282 [1024x768]

WŁAŚCIWOŚCI ROZTWORÓW
291
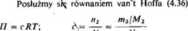
rtijRT ^ m2RT Mty ’ * " ''/IV
3,2-62.361-290 32,8 0.1
Przykład 2
Ciśnienie osmotyczne rozcieńczonego roztworu KNO., w wodzie wynosi 357 mm Hg względem wody w temp. 25CC. Obliczyć prężność pary wodnej nad roztworem oraz temp. topnienia i wrzenia roztworu. Prężność pary nad czystą wodą wynosi 23,756 mm Hg.
Z równania van't Hoffa (4.36) obliczmy stężenie KNOj:
II
~RT
357
0,082 760 - 298.2
= 0,0192 moli/dm3
Ułamek molowy substancji rozpuszczonej obliczymy ze wzoru dla roztworów rozcieńczo-
3.46- 10-
0,0192 1000/18 = 0.99965
Prężność pary nad roztworem, zgodnie z prawem Raoulta p, =/>?•*, = 0,99965 • 23.756 •» 23,748 mm Hg
Biorąc dane z tabeli 4.1 i 4.2 na stałą kriometryczną i ebuliometryczną wyznaczymy zmiany temp. wrzenia i krzepnięcia, przy czym możemy założyć, że dla roztworu rozcieńczonego
A7*w ** mKm = cKw = 0,0192 - 0,51 0,0098°
Tm = 100.0098X'
AFk - c- Kk = 0,0192- 1,86 = 0,036 Tk - — 0,036°C
Roztwory niedoskonałe. Współczynnik osmotyczny
Odstępstwo roztworów od ,.doskonałości” uwidacznia się zarówno w pręi-nościach par, jak i we wszystkich wielkościach pochodnych, tj. ATk, ATW, TI.
Jeżeli sporządzamy roztwory znanych związków chemicznych, wówczas na podstawie pomiarów kriometrycznych, ebuliometrycznych czy ciśnienia osmotycznego możemy wyciągać ważne wnioski co do oddziaływań między-cząstcczkowych w roztworach. Jako miarę odstępstw od „doskonałości” roztworów rozważa się często tzw. współczynnik osmotyczny
Wyszukiwarka
Podobne podstrony:
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
280 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 289 Obliczmy bracę maksymalną dla procesu przeniesienia I mola
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
318 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW E1ZJLTR0UTÓW 327 Elektroliza wodnego roztworu NaCi jest przykła
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
322 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW W równaniu tym liczby przenoszenia /J i /£ są wart
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
270 [1024x768] Właściwości roztworówTermodynamiczna charakterystyka roztworów Zgodnie z definicją (p
272 [1024x768] 281 WŁAŚCIWOŚCI ROZTWORÓW W roztworze określa potencjał chemiczny d
278 [1024x768] 287 WŁAŚCIWOŚCI ROZTWORÓW Tabela 4.2 Slałe kriometryczne kjekfórych
291 [1024x768] 300 ROZTWORY I RÓWNOWAGI FAZOWF.Równowagi ciecz—paradla układów dwuskładnikowych Na r
305 [1024x768] Właściwościroztworów elektrolitów Charakterystyka roztworów elektrolitów Roztwory ele
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
310 [1024x768] 31* WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓWTeoria dysocjacji elektrolitycznej Początki wsp
314 [1024x768] 323 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW po rozpuszczeniu kryształu w wodzie mogłoby do
316 [1024x768] 325 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Kation H+ po zaadsorbowaniu na powierzchni ele
508 [1024x768] Właściwości kinetyczne układów koloidalnych Do roztworów koloidalnych, mimo że różnią
519 [1024x768] 530 KOLOIDY Lepkość właściwa roztworu koloidalnego zależy oczywiście od stężenia gram
więcej podobnych podstron