320 [1024x768]

WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329
przestrzeni środkowej, a stąd do przestrzeni katodowej, zawędruje tylko 1 gramorównoważnik kationów. Ruch trzech gramorównoważników anionów w kierunku przestrzeni anodowej oraz 1 gramorównoważnika kationów w przeciwnym kierunku (do przestrzeni katodowej) jest oczywiście równoważny przeniesieniu przez roztwór 4 faradajów. Jednakże w wyniku założonej przez nas wyższej ruchliwości anionów, aniony poruszające się trzy razy szybciej od kationów, przeniosły trzy razy większy ładunek. Oczywiście proces taki musi doprowadzić do zmian stężeń w przestrzeniach elektrodowych.
W rezultacie po zakończeniu elektrolizy (stan c), roztwory we wszystkich przestrzeniach będą elektroobojętne, chociaż będą znacznie różnić się stężeniami. Stężenie w przestrzeni środkowej nie uległo zmianie — zmieniły się jedynie stężenia w przestrzeniach elektrodowych. Zmiana stężenia nastąpiła tam w wyniku równoczesnego przebiegu dwóch procesów: reakcji elektrodowej i migracji jonów w polu elektrycznym. Prześledźmy te zmiany.
Przestrzeń katodowa: zmiana ilości gramorównoważników kationu w wyniku reakcji elektrodowej i migracji wynosi
Ank(0 «= reakcja elektrodowa + migracja = —4 + 1 = —3
Zmiana ilości gramorównoważników anionów w przestrzeni katodowej wyniesie podobnie
A/ik© = reakcja elektrodowa + migracja = 0-3 = —3.
W wyniku przepływu przez naczyńko 4 faradajów z przestrzeni katodowej ubyły więc 3 gramorównoważni ki elektrolitu.
Przestrzeń anodowa:
A= reakcja elektrodowa + migracja = 0—1 = — 1 A/i,© = reakcja elektrodowa + migracja » —4+3 = —1
Przepływ 4 faradajów przez naczyńko spowodował ubytek 1 gramorównoważnika z przestrzeni anodowej.
W celu obliczenia z wyników takiego doświadczenia liczb przenoszenia, oznaczmy całkowity ładunek przeprowadzony przez roztwór symbolem q (w naszym przypadku q = 4 F). Zmiana liczby gramorównoważników elektrolitu w przestrzeni katodowej wynosi:
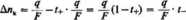
stąd:
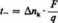
(5.17)
(5.18)
F 3
W rozpatrywanym przykładzie q = 4 F, zatem /_ = 3 • = ~ą ** ^>75.
Wyszukiwarka
Podobne podstrony:
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
322 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW W równaniu tym liczby przenoszenia /J i /£ są wart
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
310 [1024x768] 31* WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓWTeoria dysocjacji elektrolitycznej Początki wsp
314 [1024x768] 323 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW po rozpuszczeniu kryształu w wodzie mogłoby do
316 [1024x768] 325 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Kation H+ po zaadsorbowaniu na powierzchni ele
318 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW E1ZJLTR0UTÓW 327 Elektroliza wodnego roztworu NaCi jest przykła
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
280 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 289 Obliczmy bracę maksymalną dla procesu przeniesienia I mola
282 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 291 rtijRT ^ m2RT Mty ’ * " /IV 3
80525 skan0262 6. Elektrochemia Właściwości roztworów elektrolitów różnią się od właściwości roztwor
270 [1024x768] Właściwości roztworówTermodynamiczna charakterystyka roztworów Zgodnie z definicją (p
305 [1024x768] Właściwościroztworów elektrolitów Charakterystyka roztworów elektrolitów Roztwory ele
532 [1024x768] Właściwości elektrokinetyczne układów koloidalnych Trwałość typowych roztworów koloid
534 [1024x768] WŁAŚCIWOŚCI ELEKTROKINETYCZNE UKŁADÓW KOLOIDALNYCH 545 koloidu hydrofobowego — roztwó
więcej podobnych podstron