318 [1024x768]

WŁAŚCIWOŚCI ROZTWORÓW E1ZJLTR0UTÓW 327
Elektroliza wodnego roztworu NaCi jest przykładem, gdy jeden z jonów (w tym przypadku jon Nał) redukuje się bardzo trudno. W wyniku przebiegu reakcji elektrodowych powstaje chlor (anoda) i wodór (katoda), a w przestrzeni katodowej pojawia się roztwór NaOH:
anoda (Pt), (+): CT -1/2 0,+ e' katoda (Pt), (-): H,0 - H* + OH"
H+ +e- - 1/2 H,
H,0 + e" - 1/2 H, + OH-
Migracja jonu Na* do przestrzeni katodowej wraz z reakcją elektrodową produkującą OH" powoduje zagęszczenie w tej przestrzeni roztworu NaOH.
Liczby prmKtwfat
W jaki sposób odbywa się rzeczywisty proces przenoszenia jonów w roztworze elektrolitu pod wpływem pola elektrycznego? Aby odpowiedzieć na to pytanie, musimy wprowadzić pojęcie liczb przenoszenia kationu »+ i anionu r— Ucztą przenoszenia kationu t+ nazywamy ułamek ładunku przeniesiony przez kation: jonu

(5.14)
gdzie: q oznacza całkowity ładunek przeniesiony przez roztwór, a jest wielkością ładunku, przeniesionego przez kationy. Analogicznie definiujemy liczbę przenoszenia anionu:
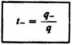
Ponieważ q =» ?++?-, zatem z równać (5.14) i (5.15) wynika, że suma liczb przenoszenia jest równa jedności:
r++«-
1
(5.16)
Jeżeli przez roztwór przepuścimy ładunek równy jednemu faradajowi (1 F), to jest rzeczą oczywistą, że dokładnie 1 gramorównoważnik kationów zostanie zredukowany na katodzie, a 1 gramorównoważnik anionów utleniony na anodzie.
Wyszukiwarka
Podobne podstrony:
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
322 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW W równaniu tym liczby przenoszenia /J i /£ są wart
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
280 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 289 Obliczmy bracę maksymalną dla procesu przeniesienia I mola
282 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 291 rtijRT ^ m2RT Mty ’ * " /IV 3
270 [1024x768] Właściwości roztworówTermodynamiczna charakterystyka roztworów Zgodnie z definicją (p
273 [1024x768] 282 ROZTWORY I RÓWNOWAGI FAZOWI; Przykład Prężności pary chlorobenzenu i bromobenzenu
225 (21) 450 16. Funkcje charakteryzujące obwody elektryczne Wzór (16.111) jest słuszny, gdy granica
305 [1024x768] Właściwościroztworów elektrolitów Charakterystyka roztworów elektrolitów Roztwory ele
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
310 [1024x768] 31* WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓWTeoria dysocjacji elektrolitycznej Początki wsp
314 [1024x768] 323 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW po rozpuszczeniu kryształu w wodzie mogłoby do
316 [1024x768] 325 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Kation H+ po zaadsorbowaniu na powierzchni ele
532 [1024x768] Właściwości elektrokinetyczne układów koloidalnych Trwałość typowych roztworów koloid
534 [1024x768] WŁAŚCIWOŚCI ELEKTROKINETYCZNE UKŁADÓW KOLOIDALNYCH 545 koloidu hydrofobowego — roztwó
347 [1024x768] Ogniwa galwaniczneSilą elektromotoryczna ogniw galwanicznych W czasie elektrolizy wod
więcej podobnych podstron