278 [1024x768]

287
WŁAŚCIWOŚCI ROZTWORÓW
Tabela 4.2
Slałe kriometryczne kjekfórych rozpuszczalników
|
Rozpuszczalnik |
r, |
tfk(dcg • kg mol) obliczone |
tfk(deg • kg/mol) doświadcz. | |
|
Woda |
\ 1436 |
273,16 |
1,862 |
1,86 |
|
Benzen |
2350 |
278,7 |
5.12 |
5.12 |
|
Cykloheksan |
637 |
279,7 |
20,5 |
20.0 |
|
Kwas octowy |
2800 |
289.8 |
3.58 |
3.90 |
pomiar mas cząsteczkowych. Podwyższenie temperatury wrzenia lub obniżenie temperatury krzepnięcia jest proporcjonalne do stężenia molarncgo a nie do masy rozpuszczonej substancji. Dlatego z wartości A7" łatwo można obliczyć masę cząsteczkową substancji rozpuszczonej.
Ciśnienie osmotyczne
Jeżeli mamy dwa roztwory o różnych stężeniach, to potencjał chemiczny rozpuszczalnika w roztworze o mniejszym stężeniu jest wyższy. Przy zetknięciu się takich roztworów będzie zachodzić samorzutny proces przechodzenia rozpuszczalnika z roztworu o mniejszym stężeniu do roztworu o większym stężeniu. To samo oczywiście zaobserwuje się w przypadku czystego rozpuszczalnika i roztworu.
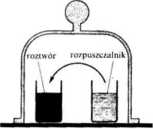
Rys. 4.5. Samorzutny proces przechodzenia rozpuszczalnika do roztworu
Tendencję do takiego samorzutnego procesu można przedstawić w sposób bardzo poglądowy za pomocą następującego doświadczenia. Zamknijmy mianowicie (rys. 4.5)dw'a naczynia zawierające roztwór i rozpuszczalnik pod kloszem. Prężność pary, zgodnie z prawem Raoulta. nad rozpuszczalnikiem jest wyższa
Wyszukiwarka
Podobne podstrony:
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
272 [1024x768] 281 WŁAŚCIWOŚCI ROZTWORÓW W roztworze określa potencjał chemiczny d
310 [1024x768] 31* WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓWTeoria dysocjacji elektrolitycznej Początki wsp
314 [1024x768] 323 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW po rozpuszczeniu kryształu w wodzie mogłoby do
316 [1024x768] 325 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Kation H+ po zaadsorbowaniu na powierzchni ele
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
280 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 289 Obliczmy bracę maksymalną dla procesu przeniesienia I mola
282 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 291 rtijRT ^ m2RT Mty ’ * " /IV 3
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
318 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW E1ZJLTR0UTÓW 327 Elektroliza wodnego roztworu NaCi jest przykła
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
322 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW W równaniu tym liczby przenoszenia /J i /£ są wart
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
519 [1024x768] 530 KOLOIDY Lepkość właściwa roztworu koloidalnego zależy oczywiście od stężenia gram
520 [1024x768] 531 WŁAŚCIWOŚCI KINETYCZNE UKŁADÓW KOLOIDALNYCHCiśnienie osmotyczne roztworów
406 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 41$ Tabela 5.8 Skład typowych roztworów
270 [1024x768] Właściwości roztworówTermodynamiczna charakterystyka roztworów Zgodnie z definicją (p
39 STRATEGIE NMR WYZNACZANIA STRUKTUR BIAŁEK W ROZTWORZE Tabela 3. Sekwencje wykorzystywane do redag
więcej podobnych podstron