5806256260
Część III: Termodynamika układów biologicznych
■ AG > O - reakcja przebiega spontanicznie, ale w odwrotnym kierunku Przebieg reakcji można też przedstawić graficznie w formie wykresu wartości entalpii swobodnej układu, G, w funkcji współrzędnej reakcji, jak na rysunku powyżej.
Na gruncie chemii fizycznej można wyprowadzić zależność zmian entalpii swobodnej od stężeń substratów i produktów:
AG = AG°+RTln^2.
CA'CB
gdzie: AG0 - standardowa zmiana entalpii swobodnej, czyli dla jednostkowych stężeń substratów i produktów.
Ponieważ w stanie równowagi AG = 0, więc:
AG0 = -RTln^-^-
cA-cB
gdzie: cf - stężenie i-tej substancji w stanie równowagi. Jeżeli wprowadzimy teraz pojęcie stałej równowagi, K, zdefiniowanej jako:
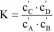
to otrzymamy znane zależności:
AG0 = -RTlnK i AG = RTlnCc'Cp -RTlnK
cA-cB
Drugie z tych równań nosi nazwę izotermy van’t Hoffa i może być zastosowane do wyznaczania wartości AG0 i K.
Należy bardzo wyraźnie zwrócić uwagę, że o kierunku przebiegu reakcji decyduje AG, a nie AG0, czyli zmiana entalpii swobodnej przy aktualnych stężeniach substratów i produktów. Jest to szczególnie ważne w układach biologicznych, w których stężenia niektórych substratów lub produktów mogą być utrzymywane na stałym poziomie zdecydowanie różnym niż innych substancji biorących udział w reakcji.
Przykład:
Procesowi przemiany glukozy w 2 cząsteczki kwasu mlekowego (reakcja glikolizy)
C6H,206=>2C,H60.,
odpowiada standardowa zmiana entalpii swobodnej równa AG0 = -138 kJ/mol. W komórce stężenia glukozy i kwasu mlekowego są dosyć ściśle regulowane i utrzymują się na poziomie 0,005 M dla glukozy i 0,001 M dla kwasu mlekowego. Po prostych przeliczeniach wynika, że zmiana entalpii swobodnej tej reakcji w warunkach wnętrza komórki wynosi AG =-159 kJ/mol. Tak więc reakcja ta przebiega w tych warunkach spontanicznie i może być źródłem energii dla komórki.
Niektóre bakterie zdolne są do wiązania gazowego azotu i utleniania go do jonów azotanowych:
10
Wyszukiwarka
Podobne podstrony:
Część III: Termodynamika układów biologicznych Materiały Pomocnicze do Wykładów z Podstaw
Część III: Termodynamika układów biologicznych 2N2 + 502 + 2H20 = 4H+ + 4N03 Standardowa zmiana ent
Część III: Termodynamika układów biologicznych Do opisu wymiany entropii z otoczeniem wygodnie jest
Część III: Termodynamika układów biologicznych Przez dłuższy czas poszukiwano wyjścia z tego problem
Część III: Termodynamika układów biologicznych W przypadku strumieni sprzężonych niektóre strumienie
Część III: Termodynamika układów biologicznych Ldv - współczynnik ultrafiltracji lub osmozy Z faktu
Część III: Termodynamika układów biologicznych dt Na uwagę zasługuje fakt, że występowanie
Część III: Termodynamika układów biologicznych ■ przyjęliśmy liniową
Część III: Termodynamika układów biologicznychPOMIARY KALORYMETRYCZNEWstęp Pomiary kalorymetryczne
Część III: Termodynamika układów biologicznych niższej niż zadana temperatura doświadczenia T°,
Część III: Termodynamika układów biologicznych układu na jednym poziomie może być traktowany jako ca
Część III: Termodynamika układów biologicznych roztworu składnika B i proces się powtarza. W miarę j
Część III: Termodynamika układów biologicznych gdzie L, M, N są pochodnymi cząstkowymi funkcji g
Część III: Termodynamika układów biologicznych Tak więc objętość jest funkcją stanu gazu
Część III: Termodynamika układów biologicznych układach biologicznych. Od tego czasu badania takie
Część III: Termodynamika układów biologicznych r - współrzędna pracy. Należy teraz dla każdego
Część III: Termodynamika układów biologicznych ■ energia swobodna (F) zwana także
Część III: Termodynamika układów biologicznych dH = TdS - Vdp + Pidiij + pjdn } Jeżeli założymy, że
Część III: Termodynamika układów biologicznych fj.i = H-RTlnrij lub m = +
więcej podobnych podstron