5806256276
Część III: Termodynamika układów biologicznych
■ energia swobodna (F) zwana także funkcja Helmholtza definiowana wzorem: F = U - TS
■ entalpia swobodna (G) zwana także funkcją Gibbsa: G = H - TS = U + pV - TS
Ich znaczenie dla opisu procesów chemicznych i biochemicznych poznamy szczegółowo w następnych etapach wykładu.
Potencjał chemiczny
Omawiając pracę w układach termodynamicznych stwierdziliśmy, że jedną z jej rodzajów jest praca chemiczna związana ze zmianą liczby moli poszczególnych substancji w układzie. Współczynnikiem pracy chemicznej jest wielkość zwana potencjałem chemicznym, p. Spróbujmy teraz powiązać tą wielkość z poznanymi dotychczas funkcjami stanu.
Rozważmy układ termodynamiczny, w którym możliwe są tylko 2 rodzaje pracy: praca objętościowa i praca chemiczna. Dla takiego układu I. zasada termodynamiki przyjmuje postać: dU = TdS - pdV + Mni + pjdn i
Jeżeli założymy, że w układzie nie zmienia się entropia, dS = 0, objętość, dV = 0, oraz liczba moli substancji innych niż i to równanie uprości się do postaci: dU = Mni
A wiec w układzie takim zmiana liczby moli i-tej substancji, dn;, związana jest bezpośrednio ze zmianą energii wewnętrznej układu. Pozwala to zdefiniować potencjał chemiczny i-tej substancji jako:
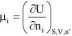
czyli jako pochodną energii wewnętrznej po zmianie liczby moli i-tej substancji przy stałej entropii, objętości i liczbie moli pozostałych substancji obecnych w układzie.
Jeżeli do opisu układu chcemy użyć entalpii zamiast energii wewnętrznej, to musimy najpierw obliczyć jej różniczkę zupełną: dH = dU + pdV + Vdp
a następnie wyznaczyć różniczkę energii wewnętrznej: dU = dH-pdV-Vdp
którą teraz można podstawić do równania I. zasady termodynamiki: dH - pdV - Vdp = TdS - pdV + Mn i + Z Pjdn j
j*i
Po uproszczeniu wyrazów podobnych otrzymujemy:
7
Wyszukiwarka
Podobne podstrony:
Część III: Termodynamika układów biologicznych Materiały Pomocnicze do Wykładów z Podstaw
Część III: Termodynamika układów biologicznych ■ AG > O - reakcja przebiega spontanicznie, ale w
Część III: Termodynamika układów biologicznych 2N2 + 502 + 2H20 = 4H+ + 4N03 Standardowa zmiana ent
Część III: Termodynamika układów biologicznych Do opisu wymiany entropii z otoczeniem wygodnie jest
Część III: Termodynamika układów biologicznych Przez dłuższy czas poszukiwano wyjścia z tego problem
Część III: Termodynamika układów biologicznych W przypadku strumieni sprzężonych niektóre strumienie
Część III: Termodynamika układów biologicznych Ldv - współczynnik ultrafiltracji lub osmozy Z faktu
Część III: Termodynamika układów biologicznych dt Na uwagę zasługuje fakt, że występowanie
Część III: Termodynamika układów biologicznych ■ przyjęliśmy liniową
Część III: Termodynamika układów biologicznychPOMIARY KALORYMETRYCZNEWstęp Pomiary kalorymetryczne
Część III: Termodynamika układów biologicznych niższej niż zadana temperatura doświadczenia T°,
Część III: Termodynamika układów biologicznych układu na jednym poziomie może być traktowany jako ca
Część III: Termodynamika układów biologicznych roztworu składnika B i proces się powtarza. W miarę j
Część III: Termodynamika układów biologicznych gdzie L, M, N są pochodnymi cząstkowymi funkcji g
Część III: Termodynamika układów biologicznych Tak więc objętość jest funkcją stanu gazu
Część III: Termodynamika układów biologicznych układach biologicznych. Od tego czasu badania takie
Część III: Termodynamika układów biologicznych r - współrzędna pracy. Należy teraz dla każdego
Część III: Termodynamika układów biologicznych dH = TdS - Vdp + Pidiij + pjdn } Jeżeli założymy, że
Część III: Termodynamika układów biologicznych fj.i = H-RTlnrij lub m = +
więcej podobnych podstron