5806256265
Część III: Termodynamika układów biologicznych
Ldv - współczynnik ultrafiltracji lub osmozy
Z faktu występowania sprzężeń pomiędzy strumieniami wynika istnienie dwóch ciekawych zjawisk: ultrafiltracji - przepływu substancji pod wpływem różnicy ciśnienia hydrostatycznego oraz osmozy -przepływu rozpuszczalnika pod wpływem różnicy stężenia substancji rozpuszczonej.
Przykład 2.
Rozważmy układ otwarty, do którego może wnikać z otoczenia substancję M. Wewnątrz układu substancja ta przekształcana jest z szybkością v w substancję N. Substancja N może dyfundować do otoczenia. Ponadto przez granicę układu może dyfundować substancja O, z która nic się w układzie nie dzieje. Strumienie poszczególnych substancji nie są ze sobą sprzężone i można je opisać zależnościami:

Z dwóch pierwszych równań wynika, że strumień substancji M wpływający do układu równy jest co do wartości strumieniowi substancji N wypływającemu z układu, a oba te strumienie równe są liczbowo szybkości powstawania substancji N. Z ostatniego równania wynika ponadto, że strumień substancji O jest zerowy. Podstawiając wyrażenia na strumienie otrzymujemy:
LMMAflM-V = 0
LnnAUn +v = 0
LooAHo — 0
Można teraz wyznaczyć różnice potencjałów chemicznych poszczególnych substancji w stanie stacjonarnym:
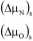
lmm V
Lnn
= 0
Tak więc różnice potencjałów chemicznych substancji M i N zależą od szybkości przemiany i od współczynników dyfuzji poszczególnych substancji. Potencjał chemiczny substancji O jest identyczny w układzie i w otoczeniu.
Przykład 3.
Rozważmy teraz jak będzie wyglądał stan stacjonarny takiego samego układu, jeżeli pomiędzy strumieniami substancji M i O występuje sprzężenie.
=LMMAł‘M+L0UAl*0 = LV.,A^V
Jo=LOMAłiM+WHio
W stanie stacjonarnym ilość poszczególnych substancji w układzie nie ulega zmianie, co możemy zapisać jako:
Wyszukiwarka
Podobne podstrony:
Część III: Termodynamika układów biologicznych Materiały Pomocnicze do Wykładów z Podstaw
Część III: Termodynamika układów biologicznych ■ AG > O - reakcja przebiega spontanicznie, ale w
Część III: Termodynamika układów biologicznych 2N2 + 502 + 2H20 = 4H+ + 4N03 Standardowa zmiana ent
Część III: Termodynamika układów biologicznych Do opisu wymiany entropii z otoczeniem wygodnie jest
Część III: Termodynamika układów biologicznych Przez dłuższy czas poszukiwano wyjścia z tego problem
Część III: Termodynamika układów biologicznych W przypadku strumieni sprzężonych niektóre strumienie
Część III: Termodynamika układów biologicznych dt Na uwagę zasługuje fakt, że występowanie
Część III: Termodynamika układów biologicznych ■ przyjęliśmy liniową
Część III: Termodynamika układów biologicznychPOMIARY KALORYMETRYCZNEWstęp Pomiary kalorymetryczne
Część III: Termodynamika układów biologicznych niższej niż zadana temperatura doświadczenia T°,
Część III: Termodynamika układów biologicznych układu na jednym poziomie może być traktowany jako ca
Część III: Termodynamika układów biologicznych roztworu składnika B i proces się powtarza. W miarę j
Część III: Termodynamika układów biologicznych gdzie L, M, N są pochodnymi cząstkowymi funkcji g
Część III: Termodynamika układów biologicznych Tak więc objętość jest funkcją stanu gazu
Część III: Termodynamika układów biologicznych układach biologicznych. Od tego czasu badania takie
Część III: Termodynamika układów biologicznych r - współrzędna pracy. Należy teraz dla każdego
Część III: Termodynamika układów biologicznych ■ energia swobodna (F) zwana także
Część III: Termodynamika układów biologicznych dH = TdS - Vdp + Pidiij + pjdn } Jeżeli założymy, że
Część III: Termodynamika układów biologicznych fj.i = H-RTlnrij lub m = +
więcej podobnych podstron