
Uniwersytet Przyrodniczy we Wrocławiu
Wydział Nauk o Żywności
Kierunek: Technologia Żywności i Żywienie Człowieka
Specjalność: Technologia Drobiu i Jaj
Justyna Linowska
WŁA
ŚCIWOŚCI PRZECIWUTLENIAJĄCE
WYBRANYCH MI
ĘŚNI KURCZĄT
ANTYOXIDATIVE PROPERTIES OF SELECTED
CHICKEN MUSCLES
Praca magisterska
wykonana pod kierunkiem
dr inż. Małgorzaty Korzeniowskiej
w Katedrze Technologii
Surowców Zwierzęcych
i Zarządzania Jakością
Wrocław 2010

2
Dziękuję Pani
dr inż. Małgorzacie Korzeniowskiej
za życzliwość,
pomoc i cenne
uwagi w czasie
pisania pracy magisterskiej.

3
Dziękuję Rodzicom
za wsparcie i pomoc
w trakcie
pięcioletniej nauki.

4
Spis treści
1. Streszczenie........................................................................................................5
2. Przegląd literatury...............................................................................................6
2.1 Wstęp.............................................................................................................6
2.2 Zagadnienie w świetle piśmiennictwa..........................................................6
2.2.1 Potencjał oksydo – redukcyjny. Wolne rodniki...................................6
2.2.2 Autooksydacja. Czynniki wywołujące reaktywne formy tlenu
............7
2.2.3 Peroksydacja składników zawartych w mięśniach.............................10
2.2.4 Przeciwutleniacze naturalne i syntetyczne oraz enzymy
przeciwutleniające..............................................................................11
2.2.5 Histologiczna budowa mięśni tuszki drobiowej.................................23
2.2.6 Skład chemiczny mięsa tuszki drobiowej...........................................28
3. Cel pracy............................................................................................................32
4. Metodyka badań.................................................................................................33
4.1 Materiał badawczy........................................................................................33
4.2 Przebieg doświadczenia................................................................................34
4.3 Metody analityczne.......................................................................................35
3.3.1 Przygotowanie prób do analiz.............................................................35
3.3.2.Oznaczenie aktywności antyoksydacyjnej metodą ABTS .................35
3.3.3 Oznaczenie aktywności antyoksydacyjnej metodą DPPH................37
3.3.4. Pomiar substancji reagujących z kwasem 2-tiobatbiturowym ..........38
3.4. Analiza statystyczna....................................................................................41
5. Omówienie wyników.........................................................................................42
6. Dyskusja wyników.............................................................................................50
7. Wnioski..............................................................................................................54
8. Literatura............................................................................................................55
Spis tabel..................................................................................................................58
Spis wykresów.........................................................................................................64

5
Streszczenie
W pracy analizowano zmiany właściwości przeciwutleniających wybranych
mięśni drobiu w czasie zamrażalniczego przechowywania.
Materiałem badawczym był „Świeży kurczak patroszony bez podrobów kl. A”
oraz „Świeże skrzydła z kurczaka kl. A” wyprodukowane w firmie DROSED S.A.
Tuszki dzielono na skrzydło, filet z piersi, udo, podudzie i część grzbietową,
a następnie
poddawano zamrażalniczemu przechowywaniu przez okres do 90 dni
w temperaturze –18ºC. W dniu zamrożenia, a także po 30, 60 i 90 dniach
przechowywania wykonano analizę zawartości dialdehydu malonowego (TBARS)
wskazującego stan zaawansowania oksydacji tłuszczu oraz oznaczenia zdolności
do zmiatania pozostałych w próbie wolnych rodników DPPH i ABTS.
Na podstawie zebranych w doświadczeniu wyników i przeprowadzonej analizy
statystycznej
wykazano,
że
podczas
przechowywania
zamrażalniczego
tj. w temperaturze -18
°
C w wybranych mięśniach drobiowych zachodzą niekorzystne
procesy oksydacyjne, których następstwem są zmiany jakościowe mięsa oraz
wyrobów z niego wytworzonych. Procesy utleniania składników zawartych
w mięśniach
drobiu
uzależnione
są
zarówno
od
czasu
przechowywania
zamrażalniczego, jak i od rodzaju analizowanego mięśnia. Najbardziej podatne
na niekorzystne procesy oksydacji składników mięśni kurcząt są mięśnie podudzia
i uda, najprawdopodobniej ze względu na między innymi większy udział tłuszczu
i barwników hemowych w porównaniu do innych analizowanych mięśni drobiu.
Natomiast najmniej narażone na działanie reaktywnych form tlenu są filety z mięśni
piersiowych, zarówno wewnętrzny, jak i zewnętrzny.

6
1. Przegląd literatury
1.1. Wstęp
Tlen jest jednym z najważniejszych pierwiastków szeroko rozpowszechnionych
na naszej planecie. Jego podstawową funkcją jest podtrzymywanie życia organizmów
tlenowych, podczas gdy w stosunku do organizmów beztlenowych przejawia działanie
toksyczne.
Cząsteczka tlenu ulega reakcji redukcji. Może to być zarówno redukcja całkowita
do cząsteczki wody, jak i stopniowa w etapach jednoelektronowych lub przy
wzbudzeniu. W wyniku tych procesów tworzą się reaktywne formy tlenu (RFT).
Reagują one ze składnikami komórek, prowadząc do ich modyfikacji oraz
uszkodzenia. Efektem tych reakcji jest zapoczątkowanie schorzeń, których ostateczną
konsekwencją mogą być stany chorobowe w organizmie (Bartosz, 2009;Bartnikowska,
2004).
1.2. Zagadnienie w świetle piśmiennictwa
1.2.1 Potencjał oksydo-redukcyjny. Wolne rodniki
Tlen, jako pierwiastek dający życie, może także wykazywać działanie toksyczne
tworząc reaktywne formy tlenu. Rozpoczynając opisywanie tego zjawiska należy
wykazać jak zachowują się elektrony w środowisku, w którym przebiegają reakcje
biochemiczne.
Nieumiejętność występowania elektronów w postaci wolnej przyczynia się do ich
ciągłej wymiany pomiędzy formą zredukowaną a formą utlenioną cząsteczki. Formy te
tworzą układy zwane układami oksydacyjno-redukcyjnymi (Kleczkowski i in., 1998).
Reakcje oksydacyjno-redukcyjne to reakcje z przeniesieniem elektronów, przy
czym jeden z substratów jest donorem natomiast drugi akceptorem elektronów.

7
Miernikiem, który określa zdolność lub siłę systemu do przyjmowania elektronów jest
potencjał oksydoredykcyjny (Bałasińska, 2004).
Podczas jednoelektronowej redukcji wieloetapowej cząsteczki tlenu, powstają
reaktywne formy tlenu zwane wolnymi rodnikami. Dzieje się to w warunkach
podwyższonego stężenia i ciśnienia tlenu (Barowicz, 2000; Kleczkowski i in., 1998).
Wolne rodniki to cząsteczki tlenu bądź ich fragmenty, które są zdolne
do samodzielnego istnienia i mające na swojej orbicie walencyjnej jeden lub kilka
niesparowanych elektronów. Wolne rodniki tlenowe tworzą się również w organizmie
podczas przemian metabolicznych i są produktami ubocznymi tych przemian.
Powstałe rodniki są zazwyczaj neutralizowane przez enzymy lub antyoksydanty
naturalnie występujące w organizmie (Kerr i in., 1996).
Ponadto wywołują one wiele różnych reakcji, między innymi reakcję
autooksydacji (Kleczkowski i in.,1998).
1.2.2 Autooksydacja. Czynniki wywołujące reaktywne formy tlenu.
Autooksydacja to proces wolnorodnikowy, w którym niezbędny jest kontakt z tlenem
atmosferycznym (Wawrzeńczyk, 2001).
W mechanizmie wolnorodnikowym autooksydacji rozróżniamy trzy etapy:
a) inicjację
b) propagację
c) terminację
a
) LH
Inicjator
L • + H •
Inicjacja to zapoczątkowanie reakcji wolnorodnikowej. Na tym etapie jest oderwany
atom wodoru znajdujący się przy wiązaniu podwójnym kwasu tłuszczowego (LH).
W wyniku czego powstają rodniki lipidowe (L•). RFT są jednymi z czynników
inicjujących autooksydację.

8
b)
L • + O2 LOO •
LOO • + LH LOOH + L •
Podczas etapu propagacji rodniki lipidowe (L • ) powstałe w procesie inicjacji reagują
z tlenem cząsteczkowym (O
2
). Prowadzi to do powstania rodników nadtlenkowych
(LOO
•
), które następnie reagując z wielonienasyconymi kwasami tłuszczowymi (LH)
tworzą wodoronadtlenki (LOOH) oraz nowe rodniki lipidowe (L
•
). Powstałe rodniki
lipidowe reagują z tlenem cząsteczkowym i reakcja powtarza się.
c)
L • + L • LL
L • + LOO • LOOL
LOO • + LOO • LOOL + O2
W ostatnim etapie autooksydacji, którym jest terminacja, następuje rekombinacja
reakcji pomiędzy nagromadzonymi formami wolnorodnikowymi (L
•
i LOO
•
) oraz
powstanie reaktywnych produktów tych reakcji
(Pisulewski i in., 2007; Oldman, 1998)
Produktami wyżej wymienionych reakcji są reaktywne formy tlenu (RTF).
Powstają one w skutek działania zewnętrznych czynników fizycznych. Do takich
czynników możemy zaliczyć między innymi światło, ultradźwięki, promieniowanie
nadfioletowe oraz jonizację (Barowicz, 2000).
Promieniowanie jonizujące, jako jeden z czynników fizycznych tworzących
reaktywne formy tlenu, powoduje rozpad cząsteczek wody. W pierwszym etapie
radiolizy następuje jonizacja oraz wzbudzenie cząsteczek wody. Następnie wzbudzone
cząsteczki rozkładają się na atomy wodoru oraz rodniki hydroksylowe.
Kolejno swobodne elektrony ulegają przekształceniu w elektrony uwodnione (e
-
aq
)
oraz zostają wytworzone cząsteczki wodoru H
2
i nadtlenku wodoru H
2
O
2
.
W przypadku, gdy w roztworze znajduje się rozpuszczony tlen, następuje jego szybka
reakcja zarówno z uwodnionymi elektronami, jak i z wodorem. W wyniku tych reakcji
powstaje anionorodnik ponadtlenkowy oraz rodnik wodoronadtlenkowy(Bartosz,
2009).
9
Promieniowanie nadfioletowe, podobnie jak radioliza również powoduje
wzbudzenie,
jonizację
bądź
rozpad
cząsteczek.
Pod
wpływem
działania
promieniowania nadfioletowego następuje rozpad cząsteczek tlenu na wolne atomy,
które kolejno reagują z innymi cząsteczkami tlenu, w wyniku czego powstaje ozon O
3
(Bartosz, 2009).
Kolejnym wyznacznikiem fizycznym przyczyniającym się do powstawania RFT
są ultradźwięki. W wyniku sonikacji powstają atomy H
•
oraz rodniki
•
OH.
Przegrupowanie rodników
•
OH powoduje powstanie H
2
O
2,
natomiast atomy wodoru
reagując z tlenem tworzą HO
•
2
. Ponadto sonikacja mieszanin zawierających tlen
przyczynia się także do rozpadu cząsteczek tlenu na atomy oraz powstania tlenu
singletowego (Bartosz, 2009).
Światło, to kolejny determinant powstawania reaktywnych form tlenu.
Cząsteczka fotosensybilizatora U po zaabsorbowaniu kwantu światła, staje się bardziej
reaktywna przechodząc w stan wzbudzony U
*
. Wzbudzona cząsteczka ulega
jednoelektronowej redukcji, gdy związek redukujący znajdzie się w pobliżu
fotosensybilizatora. Powstała zredukowana cząsteczka wchodzi kolejno w reakcje
z tlenem i ulega utlenieniu, w wyniku czego tworzy się anionorodnik ponadtlenkowy.
Zredukowana forma fotosensybilizatora może ponownie zaabsorbować kwant światła,
przez co następuje jego fotoredukcja i utlenienie (Bartosz, 2009).
U
promieniowanie
U
*
fotosensybilizator
wzbudzony
fotosensybilizator
U
*
+ SH
HU
•
+ S
•
HU
•
+ O
2
U
•
+ O
2
•
-
+ H
+
Wymienione wyżej czynniki, takie jak światło widzialne oraz promieniowanie
nadfioletowe powodują powstanie tlenu singletowego. Dzieję się to w wyniku
wzbudzenia cząsteczki tlenu będącej w stanie podstawowym, inaczej zwanym tlenem
trypletowym. Tlen trypletowy może również reagować ze związkami chemicznymi.

10
Produktem tych reakcji jest anionorodnik ponadtlenkowy, który po kolejnych
przyłączeniach tworzy rodnik wodorotlenowy
•
OH. Rodnik ten jest jednym
z najbardziej reaktywnych utleniaczy (Bartosz, 2009; Wójcik- Przybyłko, 1997).
Reaktywne
formy
tlenu
w
organizmie
powstają
także
podczas
reakcji
zapoczątkowanych przez anionorodnik ponadtlenkowy (Bartosz, 2009).
Anionorodnik ponadtlenkowy to cząsteczka, która powstaje podczas
niecałkowitej redukcji tlenu. Posiada on ładunek elektryczny oraz niesparowany
elektron na swojej orbicie walencyjnej (Bałasińska, 2004).
1.2.3 Peroksydacja składników zawartych w mięśniach.
Jednym z najbardziej znanych procesów wolnorodnikowych jest peroksydacja
lipidów. Jest to proces niszczenia błon komórkowych w wyniku działania wolnych
rodników. Polega na utlenianiu nienasyconych kwasów tłuszczowych bądź innych
lipidów, z których powstają nadtlenki. Proces peroksydacji lipidów jest nasilony
w komórkach nabłonkowych, a szczególnie w ich błonach, ponieważ zawierają wiele
nienasyconych kwasów tłuszczowych oraz mają ułatwiony dostęp do tlenu
(Kleczkowski i in.,1998; Szczypka, 1997).
Reakcjom peroksydacji ulegają także aminokwasy, białka, zasady kwasów
nukleinowych oraz kwasy nukleinowe. Wynikiem peroksydacji białek jest ich
agregacja, fragmentacja bądź modyfikacja reszt aminokwasowych lub prostetycznych
(Wójcik- Przybyłko,1997).
Wymienione modyfikacje zazwyczaj przebiegają równolegle, a ich udział
w procesie utleniania białek zależy między innymi od źródła RFT. Prekursorem
uszkodzeń białek może być rodnik hydroksylowy, anionorodnik ponadtlenkowy oraz
nadtlenek wodoru. Nadtlenki białek powstają w wyniku działania promieniowania
jonizującego. Są one jednak nietrwałe. W przypadku braku obecności innych
substancji oraz w temperaturze pokojowej zanikają.
Skutkiem działania aktywnych form tlenu na białka jest ich uszkodzenie,
co w efekcie prowadzi do utraty aktywności biologicznej białek (Wójcik-
Przybyłko,1997; Bartosz,2009).

11
Reaktywne formy tlenu mogą także oddziaływać na kwasy nukleinowe.
Związki te są jednak mniej podatne na działanie wolnych rodników niż lipidy i białka.
Nadtlenek wodoru i anionorodnik ponadtlenkowy nie wpływają destrukcyjnie
na składniki kwasów nukleinowych. Negatywne skutki działania reaktywnych form
tlenu na kwasy nukleinowe to przede wszystkim uszkodzenie struktury DNA czy RNA
przez rodnik wodorotlenowy. Uszkodzenia mogą powodować wytworzenie
przeciwciał, które są skierowane przeciwko własnemu DNA (Wójcik - Przybyłko,
1997).
Działanie aktywnych form tlenu również negatywnie wpływa na cukrowce,
bowiem powodują depolimeryzację kwasu hialuronowego, co przejawia się
obniżeniem lepkości roztworów (Wójcik - Przybyłko, 1997).
Reakcje peroksydacji przebiegają często lawinowo. Pod wpływem większej ilości
wolnych rodników w komórkach, a także przyspieszonych reakcji wolnorodnikowych
powstaje stan, który nazywamy stresem oksydacyjnym. Metaboliczne skutki stresu
oksydacyjnego to przede wszystkim obniżenie poziomu ATP, zmniejszenie stosunku
stężeń GSH/GSSG oraz całkowitego stężenia glutationu w komórkach. Następstwem
zwiększonego narażenia komórek na RFT może być także zwiększenie stężenia Ca
2+
w cytoplazmie oraz zwiększenie przepuszczalności błony plazmatycznej. Działanie
stresu oksydacyjnego prowadzi do uszkodzenia cytoszkieletu oraz zmian
morfologicznych powierzchni komórek. Ostatecznym wynikiem tego procesu,
poprzedzającym śmierć komórki, może być uszkodzenie DNA (Kleczkowski i in.,
1998; Bartosz, 2009).
1.2.4.
Przeciwutleniacze
naturalne
i
syntetyczne
oraz
enzymy
przeciwutleniające
Działanie reaktywnych form tlenu na lipidy, białka, kwasy nukleinowe oraz
cukrowce prowadzi do zaburzeń funkcjonowania organelli komórkowych,
co w ostateczności prowadzi do powstawania schorzeń. Nie ma więc wątpliwości,
że RFT przyczyniają się do powstawania wielu chorób.

12
Natomiast lekami mogą być niskocząsteczkowe antyoksydanty oraz enzymy
rozkładające RFT (Wójcik - Przybyłko,1997; Bartosz, 2009).
Do schorzeń, do których powstania mogą się przyczynić aktywne formy tlenu,
możemy między innymi zaliczyć cukrzyce, miażdżycę, astmę, grypę a także chorobę
Parkinsona oraz Alzheimera (Szczypka, 1997).
Przyczyną starzenia się organizmu oraz powstawania nowotworów u ludzi także
może być wzrost ilości wolnych rodników. U podstaw procesu starzenia się organizmu
znajduje się wiele schorzeń, takich jak arterioskleroza czy nowotwory, które również
powstają w wyniku działania reaktywnych form tlenu. Podczas starzenia dochodzi
do peroksydacji lipidów, uszkodzeń DNA oraz utlenienia kolagenu (Malinowska,
1992).
W walce o zdrowie człowieka ma tutaj ogromne znaczenie obecność
mechanizmów obronnych organizmu oraz destrukcyjne działanie reaktywnych form
tlenu. Bardzo duże znaczenie mają także przeciwutleniacze pochodzenia endogennego
oraz ochronne układy enzymatyczne. Naturalne substancje organiczne pełnią dwie
najważniejsze funkcje, wygaszają wzbudzone cząsteczki tlenu w komórkach oraz
redukują rodnik ponadtlenkowy (Malinowska, 1992).
Substancje naturalne, które redukują rodnik ponadtlenkowy do nadtlenku wodoru
zaliczane są do przeciwutleniaczy. Są otrzymywane z surowców naturalnych bądź
przez syntezę. Antyoksydanty posiadają pierścień aromatyczny z grupą hydroksylową
lub aminową. Mechanizm działania antyutleniaczy polega na hamowaniu
rozprzestrzeniania się reakcji autooksydacji poprzez łączenie wolnych rodników
z cząsteczką
przeciwutleniacza.
W
rezultacie
tworzy
się
wolny
rodnik
przeciwutleniacza, który nie posiada zdolności do wytrącenia się lub wejścia w reakcję
prolongacji.
Przeciwutleniacz – H + R
•
Przeciwutleniacz
•
+ RH
Wolny rodnik przeciwutleniacza kolejno reaguje z innym wolnych rodnikiem,
w konsekwencji czego powstaje nowy związek chemiczny nie będący wolnym

13
rodnikiem. Cząsteczka przeciwutleniacza w tym procesie traci właściwości
przeciwutleniające.
Przeciwutleniacz
•
+ R
•
Przeciwutleniacz – R
lub
Przeciwutleniacz
•
+ Przeciwutleniacz
•
Przeciwutleniacz – Przeciwutleniacz
W konsekwencji tego procesu powstają trwałe związki i następuje przerwanie
reakcji prolongacji (Wójcik-Przybyłko, Dębski, 1998).
Najważniejsze przeciwutleniacze naturalne to alfa tokoferol, kwas askorbinowy
oraz zredukowany glutation (Malinowska, 1992).
Jednymi z najistotniejszych antyoksydantów błon komórkowych są tokoferole,
a zwłaszcza alfa-tokoferol. Działanie alfa tokoferolu polega na usuwaniu
drugorzędowych wolnych rodników i terminacji reakcji utleniania lipidów. Następuje
tu także przejście wit. E w formę rodnikową (Szczypka, 1997; Bartnikowska, 1992).
Lipid - OO
•
+ T – OH
lipid – OOH + T - O
•
Rodniki tokoferylowe są mało reaktywne, przez co nie uczestniczą w etapie
prolongacji reakcji autooksydacji. Mogą natomiast reagować z innymi wolnymi
rodnikami lub ulegać redukcji wywołanej przez inne przeciwutleniacze:
TO
•
+ lipid - OO
•
H+
lipid – OOH + T = O
Ponadto, terminacja reakcji autooksydacji przez wolny rodnik tokoferylowy
może być także spowodowana przegrupowaniem rodników tokoferylowych lub
addycją do rodnika nadtlenkowego:
TO
•
+ TO
•
TO –OT
TO
•
+ lipid - OO
•
lipid – OO – OT

14
Witamina E dodatkowo jest skutecznym wygaszaczem tlenu singletowego
(Bartosz, 2009).
Ponadto, witamina E jest składnikiem błon komórkowych i lizosomalnych.
Podstawowym jej działaniem jest stabilizacja struktury tych błon oraz zwiększenie
odporności przeciw peroksydazie glutationowej. Witamina E także współdziała
z selenem, stymulując tworzenie przeciwciał, dzięki czemu zwiększa się odporność
organizmu na choroby.
Współdziałanie witaminy E z glutationem oraz ubichinonem powoduje
wzmocnienie działania alfa-tokoferolu oraz jego regenerację. Alfa-tokoferol jest więc
jednym z najskuteczniejszych antyutleniaczy hydrofobowych (Świerczewska,
Siennicka, 2005; Różański, 2004).
Do naturalnych związków przeciwutleniających o charakterze hydrofobowym
oprócz witaminy E możemy zaliczyć także karotenoidy oraz ubichinon (Bartosz,
2009)
Koenzym Q10, czyli ubichinon jest przeciwutleniaczem fazy lipidowej.
Występuje w błonach mitochondrialnych i plazmatycznych oraz w lipoproteinach
krwi. Odpowiada za metabolizm komórek. Ponadto jest aktywatorem dehydrogenaz
i cytochromu
oraz
posiada
zdolność
przerywania
łańcuchowych
reakcji
wolnorodnikowych i osłabiania tlenu singletowego. Związek ten także przyczynia się
do regeneracji rodnika
α
-tokoferylowego (Pisulewski i in.,2007).
Do naturalnych antyoksydantów możemy także zaliczyć karoteny. Są to związki
o charakterze prowitaminy A posiadające podobna aktywność biologiczną.
Największe działanie przeciwutleniające wykazuje
β
-karoten, który pełni funkcję
ochronną błon komórkowych i cytoplazmatycznych przed działaniem aktywnych form
tlenu (Świerczewska, Siennicka, 2005; Wójcik - Przybyłko,1997).
Karotenoidy maja zbliżone właściwości do tokoferoli, gdyż mogą zarówno
wygaszać tlen singletowy jak i reagować z organicznymi wolnymi rodnikami, które
powstają podczas utlenienia lipidów. W reakcji addycji rodnika nadtlenku lipidu do
β-karotenu (K) tworzy się wolny rodnik:
LOO
•
+ K LOO - K
•

15
Powstały wolny rodnik może kolejno reagować z rodnikiem nadtlenku lipidu:
LOO -
K
•
+ LOO
•
LOO – K – OOL
Następnie addukt karotenowy dwóch rodników nadtlenkowych może wchodzić
w reakcję z innymi rodnikami, w wyniku czego mogą powstawać wielokrotne
addukty:
LOO – K – OOL + LOO
•
(LOO)
2
– K - OOL
•
(LOO)
2
– K - OOL
•
+
LOO
•
(LOO)
2
– K – (OOL)
2
Ponadto, karotenoidy mogą reagować z organicznymi wolnymi rodnikami, które
tworzą się podczas peroksydacji lipidów. Podobnie jak tokoferole chronią organizm
przed działaniem tlenu singletowego, wygaszając go.
Karotenoidy przerywają łańcuchową reakcje autooksydacji na etapie propagacji
przez niszczenie rodnika peroksylowego (Pisulewski i in.,2007; Bartnikowska, 1992;
Bartosz, 2009).
Właściwości redukcyjne ma także kwas askorbinowy. Witamina ta jest silnym
antyoksydantem w stosunku do wolnych rodników, między innymi do anionorodnika
ponadtlenkowego, nadtlenku wodoru i tlenu singletowego. Kwas askorbinowy należy
do grupy antyoksydantów hydrofilowych. Głównie działa w płynach ustrojowych oraz
cytoplazmie
komórek.
Antyoksydacyjne
działanie
witaminy
C
dotyczy
jednoelektronowej redukcji wolnego rodnika. Redukcja ta prowadzi do powstania
wolnego rodnika askorbylowego. Rodnik ten jest mało reaktywny, a po dalszym
utlenieniu ulega przekształceniu do kwasu dehydroaskorbinowego (Wójcik-Przybyłko,
1997).
Kwas askorbinowy w wysokich stężeniach jest przeciwutleniaczem, natomiast
w niskich stężeniach jest prooksydantem, czyli wykazuje działanie negatywne.
Prooksydacyjna aktywność askorbinianu wykazuje, iż w obecności jonów metali
przejściowych wit. C może stymulować powstawanie rodnika hydroksylowego
•
OH
16
z nadtlenku wodoru oraz inicjować proces peroksydacji lipidów (Malinowska, 1992;
Bartosz, 2009).
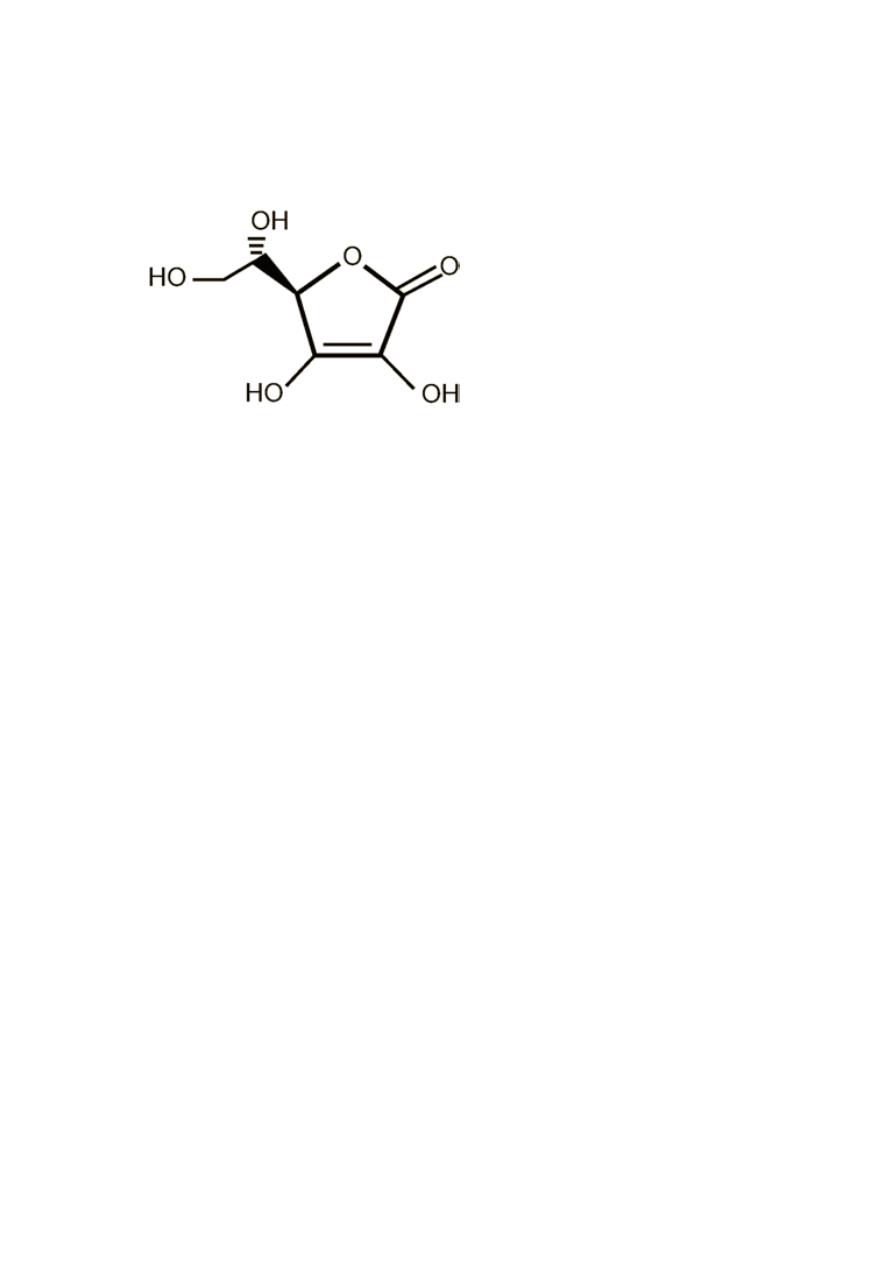
Rys. 1 Kwas askorbinowy (Witamina C) (Nawrot, Goździcka- Józefiak, 2002)
Do związków hydrofilowych wykazujących działanie przeciwutleniające oprócz
witaminy C możemy także zaliczyć glutation (GSH) oraz pochodne adeniny.
(Pisulewski i in.,2007).
Glutation to tripeptyd, który jest zbudowany z glutaminianu, cysteiny oraz
glicyny. Występuje w komórkach organizmów prokariotycznych i eukariotycznych.
Jest syntetyzowany w wątrobie, natomiast w komórkach jest głównie gromadzony
w mitochondriach, gdzie wytwarzane są reaktywne formy tlenu. Podstawową funkcją
glutationu jest unieszkodliwienie reaktywnych form tlenu oraz uczestniczenie
w procesie rozkładu nadtlenków lipidowych.
Ponadto
γ
- glutamylocysteinyloglicyna w reakcji z askorbinianem powoduje
usuwanie H
2
O
2
. Proces ten chroni przed powstawaniem rodnika hydroksylowego.
γ
- glutamylocysteinyloglicyna ma zdolność do regeneracji utlenionego rodnika
α
-tokoferylowego do wit. E oraz współdziałania w odbudowie wit. C. Glutation
w obecności wolnych rodników może ulec utlenieniu. Prowadzi to do powstania
disulfidu glutationu (GSSG), który może być regenerowany do pierwotnej formy GSH
przez reduktazę glutationową.

17
Utlenienie glutationu odbywa się na drodze nieenzymatycznej. Jednak proces ten
może być przyspieszony przez peroksydazę glutationową. Dzieje się to w przypadku
gdy czynnikiem utleniającym jest nadtlenek wodoru bądź nadtlenki organiczne
(Malinowska, 1992; Nawrot, Goździcka-Józefiak, 2002; Świerczewska, Siennicka,
2005; Łata, 1998; Pisulewski i in.,2007; Bartosz, 2009).
Podobnie jak w przypadku witaminy C również zredukowane związki tiolowe
mogą wykazywać działanie prooksydacyjne. Właściwość ta przejawia się w reakcjach
przy udziale zredukowanych jonów metali przejściowych (Pisulewski i in., 2007).
Pochodne adeniny, czyli ksantyna, hipoksantyna oraz kwas moczowy także
należą do antyoksydantów hydrofilowych. Kwas moczowy jest najbardziej poznanym
przeciwutleniaczem spośród pochodnych adeniny. Posiada zdolność przerywania
reakcji autooksydacji lipidów poprzez inaktywację rodnika hydroksylowego oraz
rodników
nadtlenkowych,
a
także
nadtlenoazotynu
(RFA).
Właściwości
antyoksydacyjne tego kwasu dotyczą zdolności wiązania prooksydacyjnych jonów
żelaza (Pisulewski i in.,2007).
Mięso kurcząt posiada także składniki antyoksydacyjne. Są one niezwykle
ważne, gdyż stanowią naturalną barierę ochronną przed reaktywnymi formami tlenu.
Należy tu wyróżnić przede wszystkim dipeptydy (karnozynę oraz anserynę), koenzym
Q10, glutation, witaminę E a także karotenoidy (Pisulewski i in.,2007).
Związki hydrofilowe oraz hydrofobowe o znaczeniu przeciwutleniającym,
również obecne w mięśniach drobiu, zostały opisane wcześniej (patrz str. 11-13),
dlatego w dalszym opisie skupiono się na związkach o charakterze dipeptydów
tj. karnozynie i anserynie.
Pierwszym z dipeptydów o działaniu przeciwutleniającym jest karnozyna, czyli
β
-alanylo-L-histydyna. Związek ten jest zbudowany z dwóch aminokwasów tj. alaniny
i histydyny. Karnozyna występuje w niektórych tkankach oraz w mięśniach, przede
wszystkim znaczne jej ilości są w mięśniach szkieletowych (Bartnikowska, 2004;
Bartosz,2009).

18
Ten endogennie występujący dipeptyd jest odpowiednikiem przeciwuteniaczy
o charakterze lipofilowym, takich jak α- tokoferol. Jego głównym zadaniem jest
redukowanie rodnika hydroksylowego i nadtlenkowego, a także tlenu singletowego,
chloraminy i rodnika peroksynitrylowego. Ponadto hamuje peroksydację lipidów oraz
zmniejsza stężenie dialdehydu malonowego. Karnozyna wykazuje także działanie
buforujące. Właściwość ta jest wynikiem obecności pierścienia imidazolowego
histydyny w cząsteczce dipeptydu (Zięba, 2007).
Drugą właściwością karnozyny jest zdolność do chelatowania jonów metali
takich jak żelazo, miedź czy cynk. Pozwala to na regulowanie stężenia jonów metali
w tkankach i płynach ustrojowych, a także zmniejszenia ich toksyczności.
Ponadto, karnozyna ma właściwości lecznicze w schorzeniach, w których
patogenezie mogą uczestniczyć stres oksydacyjny i karbonylowy (Zięba, 2007).
Karnozyna ma wiele zastosowań, stosuje się miedzy innymi jako dodatek
do mięsa w czasie przetwarzania, w celu zapobiegania zmianom oksydacyjnym
podczas przechowywania. W tych procesach można stosować karnozynę syntetyczną
bądź naturalną, otrzymaną z mięsa wieprzowego lub wołowego po uprzednim
usunięciu jonów żelaza (Bartnikowska, 2004).
Podobne właściwości do karnozyny posiada anseryna, która jest także
dipeptydem. Anseryna czyli β-alanylo-N-metylo-L-histydyna składa się z dwóch
aminokwasów: β-alaniny i L-histydyny rozbudowanej o grupę metylową (-CH3).
Anseryna występuje głównie w mięśniach szkieletowych i mózgu. W organizmie
ssaków pełni rolę antyoksydantu (Bartosz, 2009).
Oprócz
antyoksydantów
naturalnych
hamujących
proces
autooksydacji
rozróżniamy także przeciwutleniacze syntetyczne. Do przeciwutleniaczy tych
zaliczmy estry kwasu galusowego: propylowy, oktylowy i dodecylowy, a także TBHQ
(tert-butylohydrochinon),
BHA
(butylohydroksyanizol)
oraz
BHT
(butylohydroksytoluen) (Sicińska, 2008).
Przeciwutleniacze syntetyczne działają w małych stężeniach i wykazują większą
skuteczność w stosunku do tłuszczów zwierzęcych niż roślinnych (Grabowski,
Kijowski, 2004).
19
Główny cel dla którego stosuje się dodatek antyoksydantów sztucznych,
to przede wszystkim zapobieganie utlenieniu i polimeryzacji tłuszczu a także
utrwalenie smażonego produktu (Sicińska, 2008).
Charakterystyka przeciwutleniaczy syntetycznych opisana według Sicińskiej
(2008) przedstawia się następująco:
Estry kwasy galusowego wykazują małą odporność termiczna, co przede wszystkim
można
zaobserwować
w
środowisku alkalicznym. Należą do silnych
przeciwutleniaczy. Najczęściej są stosowane w połączeniu z BHA, BHT, TBHQ.
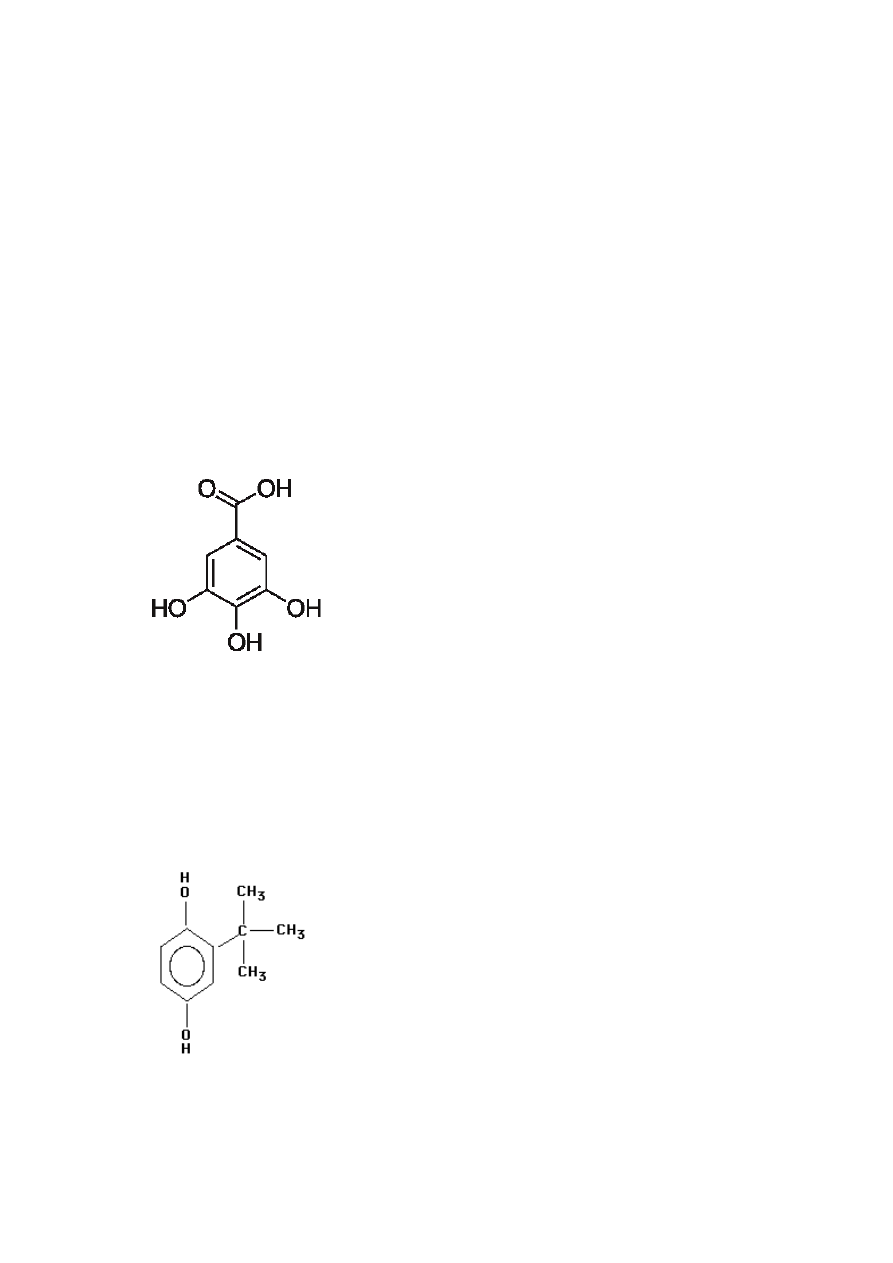
Rys. 2 Kwas galusowy (Niewiarowicz, 1993)
Tert-butylohydrochinon należy do substancji trudno rozpuszczalnych w wodzie,
natomiast w tłuszczach jest łatwo rozpuszczalny. Wykazuje wysoka skuteczność
w stosunku do wysoko nienasyconych olejów roślinnych oraz tłuszczów zwierzęcych.
Ponadto zapewnia większą stabilność olejów roślinnych podczas przechowywania.
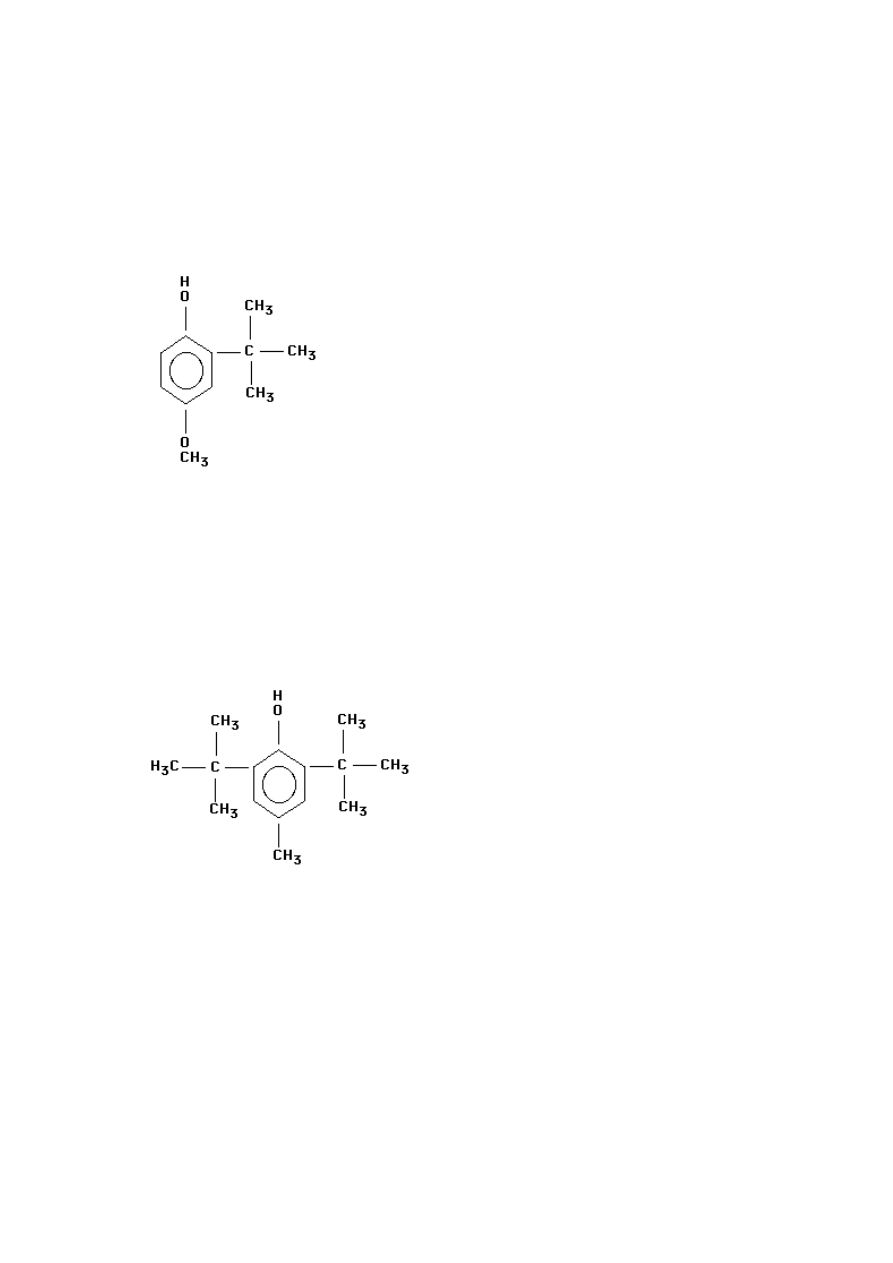
Rys. 3 Tert-butylohydrochinon (Wójcik-Przybyłko, Dębski, 1998
20
Butylohydroksyanizol jest przeciwutleniaczem bardzo skutecznym w tłuszczach
zwierzęcych, mniej natomiast w tłuszczach roślinnych. Dobrze rozpuszcza się
w etanolu oraz w tłuszczach. Wykazuje działanie synergistyczne w połączeniu
z innymi przeciwutleniaczami, między innymi BHT.
Rys. 4 Butylohydroksyanizol (Bartosz, 2009)
Butylohydroksytoluen podobnie jak BHA dobrze rozpuszcza się w tłuszczach oraz
w etanolu, natomiast w wodzie jest nierozpuszczalny. BHT najczęściej stosuje się
w połączeniu z BHA, galusanami oraz synergentami.
Rys. 5 Butylohydroksytoluen (Bartosz, 2009)
Nie wszystkie wyżej wymienione przeciwutleniacze syntetyczne wykazują
działanie zgodne z oczekiwanym, bowiem niektóre z nich są toksyczne czy
kancerogenne. Do tych antyutleniaczy należą BHA i BHT. Ich kancerogenne działanie
jest wynikiem metabolicznego przekształcenia w pochodne chinonowe.

21
Dalsze przemiany powodują, że taki przeciwutleniacz wytwarza reaktywne
formy tlenu (Bartosz, 2009).
Enzymy przeciwutleniające
Organizm
broniąc
się
przed
działaniem
wolnych
rodników
oprócz
przeciwutleniaczy hydrofobowych i hydrofilowych wyposażony jest w enzymy
niszczące wolne rodniki tlenowe. Do enzymów tych należą: katalaza, dysmutaza
ponadtlenkowa oraz peroksydaza glutationowa (Bartnikowska, 2004).
Katalazy są enzymami katalizującymi rozkład nadtlenku wodoru wytwarzanego
przez dysmutazę ponadtlenkową (SOD). Mogą wykazywać zarówno aktywność
katalazową, jak i peroksydazową (Malinowska, 1992; Gajewski i in.,2005).
Właściwości peroksydazowe katalazy wykazują utleniając między innymi etanol,
azotyny oraz chinony. Aktywność katalazowa występuje przy wysokich stężeniach
H
2
O
2
(Bartosz, 2009; Malinowska, 1992).
Mechanizm działania katalazy przedstawia się następująco:
Katalaza + H
2
O
2
Kompleks I
Kompleks I + H
2
O
2
Katalaza + 2 H
2
O + O
2
W procesie tym po przyłączeniu do centrum katalitycznego katalazy cząsteczki
H
2
O
2
powstaje kompleks I. Następnie kompleks ten ponownie reaguje z cząsteczką
nadtlenku wodoru, co w ostateczności prowadzi do powstania wody i tlenu. Katalazy
poprzez rozkład nadtlenku wodoru do tlenu i wody zapobiegają przenikaniu H
2
O
2
do komórek, który może być dla nich toksyczny (Malinowska, 1992; Łata, 1998).
Drugim czynnikiem obok katalazy, który wpływa na detoksykację reaktywnych
form tlenu jest peroksydaza glutationowa.
Rozróżniamy dwa rodzaje peroksydazy glutationowej - selenozależną oraz
selenoniezależną.
Enzym
selenozależny
zawiera
selenocysteinę.
Wpływa
na detoksykację
H
2
O
2
oraz
redukcję
wodoronadtlenków
lipidowych
i hydroksykwasów. Natomiast enzym niezależny od selenu nie powoduje rozkładu
22
H
2
O
2
, lecz jedynie jest aktywny w obecności wodoronadtlenków lipidowych.
Aktywność enzymu selenoniezależnego jest połączona z transferazą glutationową
(Malinowska, 1992). Substratem dla peroksydazy glutationowej jest zredukowany
glutation (GSH), który zostaje utleniony do disulfidu glutationu (GSSG). Proces ten
przedstawia poniższa reakcja (a) (Malinowska, 1992).
(a) 2GSH + H
2
O
2
GSSG + 2 H
2
O
Powstający disulfid glutationu jest związkiem niepożądanym, gdyż może
tworzyć dwusiarczki z białkami, które zawierają grupy tiolowe (b) lub powodować
utlenienie tych grup w wyniku czego powstają mostki disulfidowe (c). Proces ten
prowadzi do inaktywacji białek (Bartosz, 2009).
(b) białko – SH + GSSG
białko – S – SG + GSH
(c) białko + GSSG
białko + 2GSH
S S
S – S
H H
Kolejnym komponentem, który jest ściśle powiązany z peroksydazą glutationową
jest reduktaza glutationowa. Enzym ten występuje w stromie chloroplastów, a także
w cytosolu i mitochondriach. Ma ona duże znaczenia w systemie ochronnym, bowiem
redukuje utlenioną formę glutationu, powodując utlenienie NADPH. Utleniony
NADPH ponownie może ulec regeneracji w wyniku działania enzymów
katalizujących reakcję utleniania, gdzie ko-substratem jest NADP
+
. Może to być
np. deydrogenaza izocytrynianowa. Proces ten jest przebiega według poniższej reakcji
(a) (Bartosz, 2009; Malinowska, 1992; Łata, 1998).
(a) GSSG + NADPH + H
+
reduktaza glutationowa
2 GSH + NADP
+
23
Do enzymów rozkładających reaktywne formy tlenu możemy także zaliczyć
dysmutazę ponadtlenkową (SOD).
SOD jest enzymem bardzo stabilnym i niezwykle aktywnym. Zawiera w swojej
budowie metale Cu, Zn, Fe, i Mn. Powstają zatem CuZnSOD, FeSOD i MnSOD.
Poszczególne formy dysmutazy ponadtlenkowej są rozlokowane w określonych
miejscach, czyli CuZnSOD występuje w cytoplazmie i chloroplastach. MnSOD
zlokalizowana jest w mitochondriach, chloroplastach i peroksysomach. Natomiast
FeSOD występuje w stromie chloroplastów (Gajewski i in., 2005; Malinowska, 1992;
Gwóźdź, 1996).
Dysmutaza ponadtlenkowa przekształca anion ponadtlenkowy do O
2
oraz H
2
O
2
.
Proces ten przedstawia poniższa reakcja (Łata, 1998).
O
2
-
•
+ O
2
-
•
+ 2H
+
H
2
O
2
+ O
2
Główną funkcją dysmutazy ponadtlenkowej jest redukcja i utlenienie metalu,
które przebiega dwuetapowo. W początkowej fazie rodnik ponadtlenkowy redukuje
metal, który jest związany z enzymem, co powoduje uwolnienie cząsteczki tlenu.
Następnie rodnik ten utlenia metal i powstaje nadtlenek wodoru. Przebieg tych reakcji
jest następujący (Malinowska, 1992).
SOD – Me
n
+ O
2
-
•
SOD - Me
n-1
+ O
2
SOD - Me
n-1
+ O
2
-
•
SOD – Me
n
+ H
2
O
2
1.2.4 Histologiczna budowa mięśni tuszki drobiowej
Mięśnie ptaków oraz zwierząt odpowiedzialne są za prawidłowe funkcjonowanie
ich organizmów w środowisku. Umożliwiają im nie tylko utrzymywanie prawidłowej
pozycji ciała, ale także poruszanie się czy pobieranie pokarmu. Do najważniejszych
mięśni ptaka, które wykorzystano w przeprowadzonych badaniach własnych, możemy
zaliczyć mięśnie piersiowe, udowe, podudzia oraz mięsień skrzydłowy i grzbietowy.
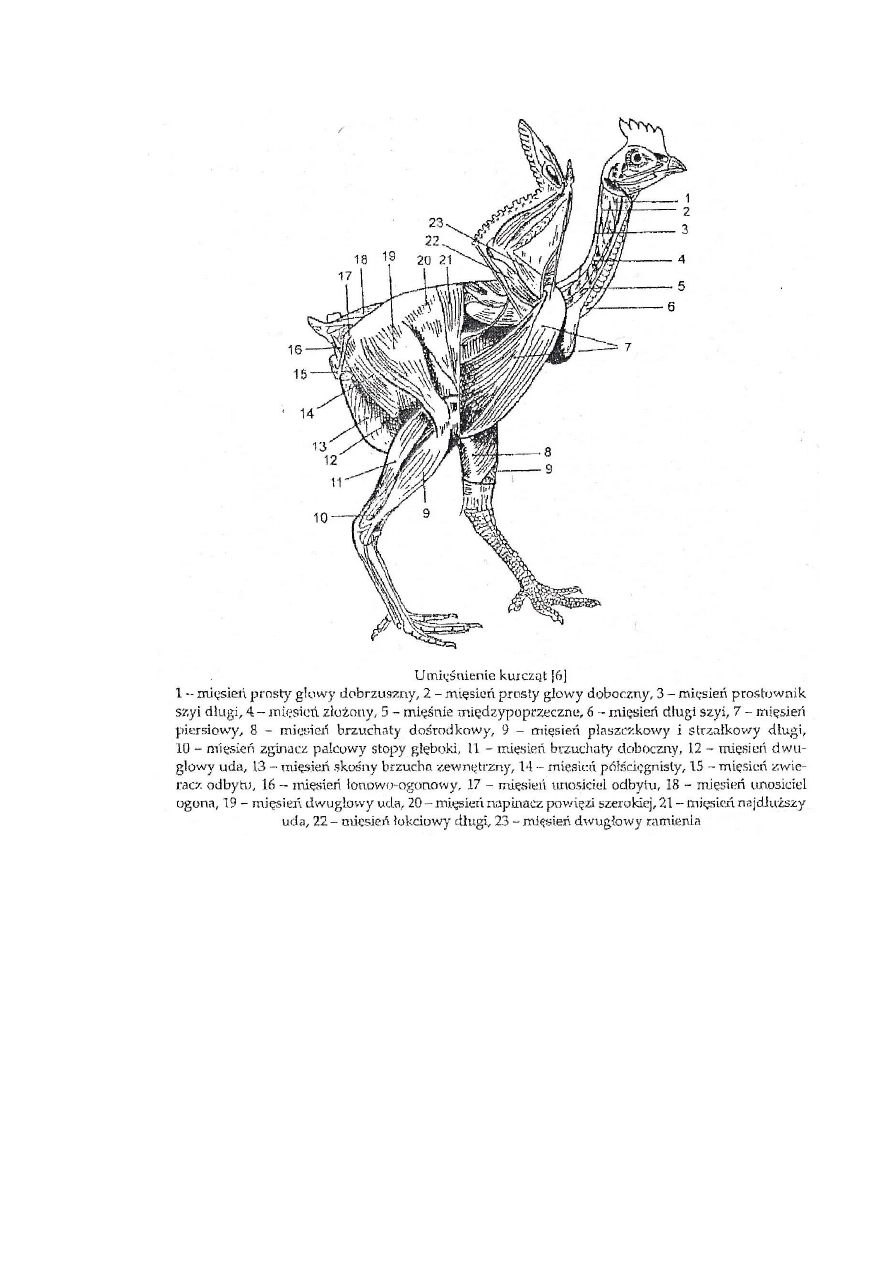
24
Rys. 6 Umięśnienie kurczęcia (Grabowski, Kijowski, 2004)

25
Histologiczna budowa mięśnia dotyczy przede wszystkim mięśni szkieletowych,
bowiem to właśnie one stanowią po uboju mięso. Oprócz mięśni szkieletowych należy
jednak wymienić także mięsień sercowy oraz mięśnie gładkie (Pawlak, 1998).
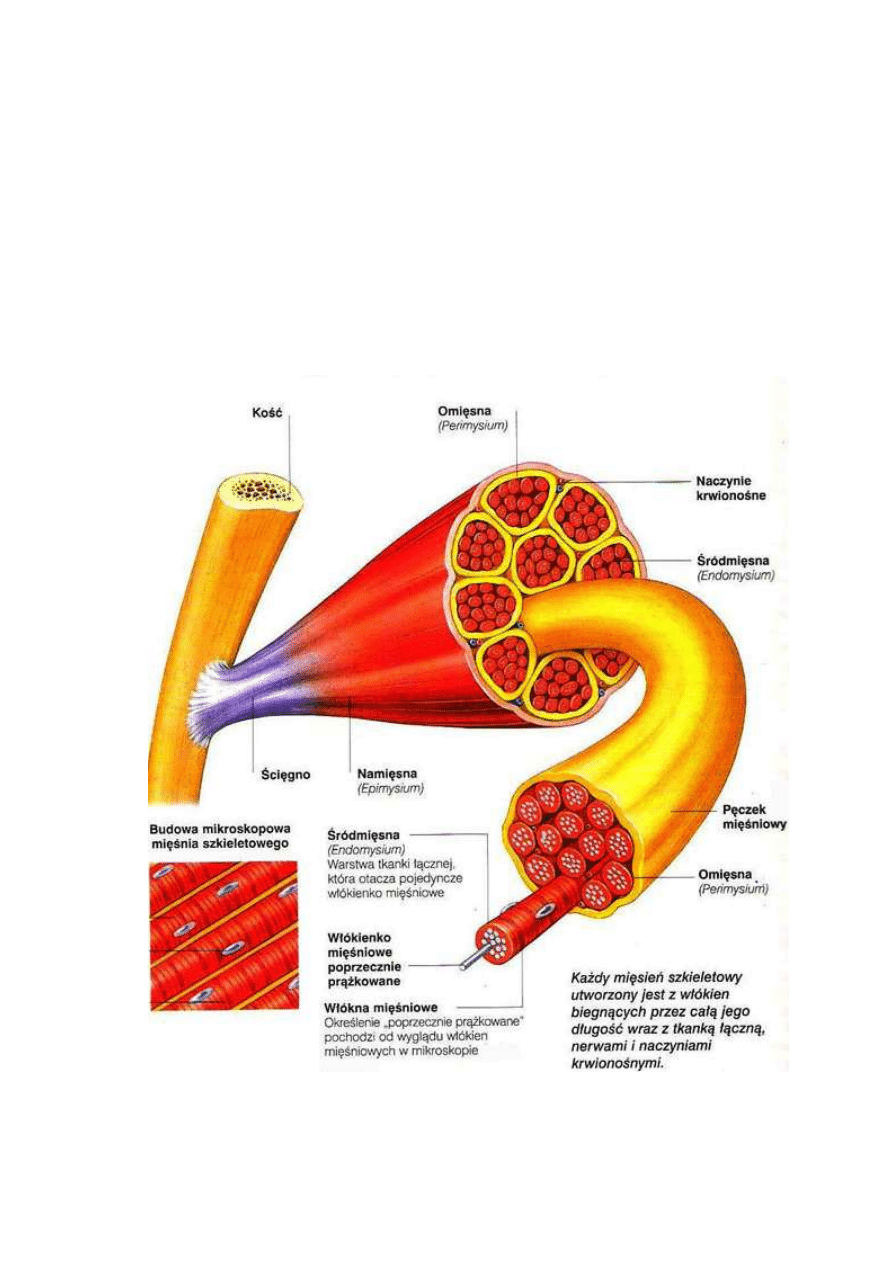
W strukturze mięśni szkieletowych rozróżniamy część ścięgnową, którą
stanowi tkanka łączna oraz część mięśniową. Część mięśniowa otoczona jest
z zewnątrz omięsną zewnętrzną (perimysium externum), czyli tkanką łączną.
Wewnątrz natomiast mieszczą się wiązki włókien, które są poprzedzielane
przegrodami zbudowanymi z omięsnej wewnętrznej (perimysium internum). Każde
pojedyncze włókno z zewnątrz otoczone jest omięsną własną, czyli błoną tkanki
łącznej, a w następnej kolejności błoną komórkową zwaną sarkolemmą. Włókno
mięśniowe jest wielojądrzastą komórka, w której podłużnym przekroju widoczny jest
obraz poprzecznego prążkowania mięśni szkieletowych. Jest to spowodowane
charakterystycznym ułożeniem miofibryli oraz Z-linii. Miofibryle są ułożone wzdłuż
włókna, natomiast Z-linia w poprzek włókna mięśniowego. Miofibryle są niezbędnymi
składnikami każdej komórki mięśniowej, bowiem odpowiadają za czynności ruchowe.
Są zbudowane z grubych i cienkich filamentów oraz z M-linii, Z-linii i N-linii.
Ponadto w komórce mięśniowej oprócz miofibryli znajduje się także system struktur
zwany cytoszkieletem. Do zadań cytoszkieletu możemy zaliczyć nadawanie
i utrzymywanie odpowiedniego kształtu komórki mięśniowej, łączenie ze sobą
organelii komórkowych, a następnie wiązanie ich z sarkolemmą (Grabowski,
Kijowski, 2004; Pawlak, 1998).
W mięśniach szkieletowych możemy rozróżnić włókna czerwone oraz białe.
Poszczególne typy włókien różnią się między innymi składem, metabolizmem,
szybkością kontrakcji mięśni oraz zawartością enzymów glikolitycznych i enzymów
fosforylacji oksydatywnej, a także ich substratów. W zależności od takich czynników
jak ilości enzymów metabolicznych i izoform miozyny, a także działania ATP-azy
miozynowej włókna mięśniowe możemy podzielić na szybko i wolno kurczące się.
Włókna białe, to włókna szybko kurczące się o charakterze glikolitycznym bądź
oksydacyjnym i glikolitycznym, natomiast włókna wolno kurczące się o
właściwościach oksydacyjnych to włókna czerwone. Większa część włókien
szkieletowych ma charakter heterogeniczny i zawiera wszystkie wymienione typy
26
włókien. Wyjątkiem są mięśnie piersiowe, które są mięśniami białymi i działają w
oparciu o przemiany glikolityczne, beztlenowe. Włókna białe kurczą się intensywniej,
a ich wydolność zależy od szybkości eliminowania metabolitów. Ponadto, zawierają
większą ilość glikogenu, a także mają wyższą aktywność fosforylaz, ATP-az oraz
enzymów glikolitycznych. Włókna czerwone w odróżnieniu do włókien białych
kurczą się wolniej, a ich wydolność uzależniona jest między innymi od szybkości
dostarczania tlenu. Ponadto zawierają znacznie więcej mitochondriów i mają wyższą
aktywność enzymów z grupy oksydaz (Grabowski, 2004).
Rys. 7 Budowa mięśnia szkieletowego (www.elemiah.pl/homo1.php)

27
Według Grabowskiego oraz Kijowskiego (2004) najlepiej wykształconymi
mięśniami u ptaków są mięśnie piersiowe, które wraz z mięśniami nóg stanowią
najcenniejsze źródło mięsa. Rozróżniamy tutaj mięsień piersiowy powierzchniowy
i mięsień piersiowy głęboki. Mięsień powierzchniowy jest znacznie większy, niż
głęboki.
Mięśnie skrzydłowe obejmują mięsień łokciowy długi oraz mięsień dwugłowy
ramienia.
W skład mięśnia udowego wchodzi mięsień pośladkowy powierzchniowy,
napinacz powięzi szerokiej oraz przednia część dwugłowego uda.
Kość piszczelowa i strzałkowa jest pokryta przez mięśnie podudzia. Do tych
mięśni zaliczamy miedzy innymi mięsień płaszczkowy i strzałkowy długi oraz mięsień
brzuchaty doboczny.
Mięśnie zwierząt, w tym drobiu, ulegają przemianom do mięsa w czasie
niezwykle złożonych procesów dojrzewania poubojowego. Dojrzewanie opiera się
o przemiany właściwości chemicznych i fizycznych mięśni, w tym ptaków. W toku
przekształcenia tkanki mięśniowej w mięso rozróżniamy trzy etapy: prerigor, rigor
mortis i post rigor. W czasie prerigor mięsień po uboju może się kurczyć i rozkurczać,
bowiem w tym okresie przebieg glikolizy jest taki sam jak w mięśniu żywym.
Wymienione procesy mogą być odwracalne, do momentu wyczerpania zasobów tlenu
związanego z mioglobiną i ATP. Skutkiem nieodwracalnych procesów glikolizy jest
brak zdolności przemiany kwasu mlekowego w glikogen, co jest spowodowane
wykrwawieniem zwierzęcia. Kolejnym etapem dojrzewania mięsa jest stężenie
pośmiertne zwane rigor mortis. Na tym etapie następuje skrócenie długości
sarkomerów oraz obniżenie wartości końcowego pH. Mięsień charakteryzuje się dużą
sztywnością i utratą elastyczności, a po ugotowaniu stanowi suche i pozbawione
pożądanego smaku oraz zapachu mięso. Ostatnią fazą procesu zmian poubojowych
jest dojrzewanie mięsa, czyli okres post rigor. Na tym etapie sztywność i łykowatość
mięsa zanika. Osiąga ono odpowiednią, pożądaną kruchość i soczystość oraz
charakterystyczny smak i zapach (Grabowski, 2004 ; Niewiarowicz i in., 1993).

28
Proces utleniania lipidów w mięśniach kurcząt zaczyna się bezpośrednio
po uboju. Nowe warunki, jakie są stworzone w wyniku zmian biochemicznych
zachodzących w tkankach zwierzęcia po uboju, a także podczas dojrzewania mięsa
powodują niezdolność do kontrolowania procesu oksydacji lipidów, jak to ma miejsce
za życia zwierzęcia. Również zostaje zachwiana równowaga pomiędzy czynnikami
pro i anty-oksydacyjnymi. Jest większe nasilenie składników pro-oksydacyjnych.
Aktywność metaboliczna bezpośrednio po uboju zwierzęcia zostaje zachowana, lecz
w wyniku wykrwawienia końcowym produktem rozkładu glikogenu jest kwas
mlekowy. Obecność kwasu mlekowego w tkankach powoduje obniżenie wartości
pH do 5,5.
W czasie zmian poubojowych przestaje funkcjonować naturalny układ
antyoksydacyjny chroniący komórki przed procesami oksydacyjnymi za życia
zwierzęcia. Jest to spowodowane wieloma zmianami metabolicznymi. Do takich
czynników możemy między innymi zaliczyć zahamowanie krążenia krwi
w organizmie, obniżenie wartości pH do około 5,5, niezdolność do funkcjonowania
ochronnych układów enzymatycznych w nowych poubojowych warunkach. Ponadto
stopień oraz szybkość oksydacji tłuszczów mięsa zależy od czynników przyżyciowych
jak np. stres bądź czynników poubojowych, którym jest np. temperatura tuszek (Pikul,
1997).
1.2.7. Skład chemiczny mięsa tuszki drobiowej
Jednym z najważniejszych wyróżników jakości mięsa drobiowego jest jego
wartość odżywcza. Mięso drobiu cechuje się wysokimi walorami odżywczymi.
Przeciętny skład chemiczny mięsa przedstawia się następująco: największą ilość,
bo aż 75% stanowi woda, następnie kolejno białko 18,5%, tłuszcz mięśniowy 3%,
związki azotowe 1,5% oraz węglowodany i składniki mineralne po 1%. Ponadto mięso
zawiera witaminy które są procentowo niewymierne (Litwińczuk i in. ,2004).
Białka
są
materiałem
budulcowym
niezbędnym
do
prawidłowego
funkcjonowania organizmu. Mięso drobiowe jest dobrym źródłem tego składnika
żywnościowego. Zawartość białka w tuszkach kur i kurcząt, w zależności od rasy,

29
wieku, płci, gatunku, systemu chowu, sposobu żywienia oraz części tuszki mieści się
w przedziale 18,0-22,5%. W samych mięśniach ilość ta jest różna i zależy od rodzaju
mięśnia. Na przykład mięśnie piersiowe kurcząt brojlerów zawierają 23,0% białka,
natomiast mięśnie udowe 19,5% białka. Mięśnie piersiowe są bogatsze w białko niż
mięśnie nóg o 1,5%-2,0% białka (Niewiarowicz i in., 1993; Zawadzka i in.,2002).
Tłuszcz to kolejny składnik mięsa drobiu. Lipidy pełnią dwie podstawowe
funkcje, stanowią główne źródło energii oraz są składnikiem membran komórkowych.
U ptaków największe ilości tłuszczu znajdują się pod skórą, mniej natomiast jest
go pomiędzy mięśniami. Jest to tzw. tłuszcz między mięśniowy. Tłuszcz tkankowy
natomiast znajduje się w układzie struktur komórkowych. W skład lipidów
zapasowych wchodzą przede wszystkim triacyloglicerole, lecz także można
wyodrębnić fosfolipidy, wolne kwasy tłuszczowe oraz mono i diacyloglicerole.
W tłuszczach zapasowych natomiast przeważającą ilość stanowią fosfolipidy.
Zawartość triacylogliceroli i fosfolipidów w lipidach jest zróżnicowana
w poszczególnych mięśniach. Mięśnie piersiowe zawierają większą ilość fosfolipidów
(56,7%) niż triacylogliceroli (36,4%). Odwrotna sytuacja jest w przypadku mięśni uda,
podudzia oraz skrzydła, tutaj jest większy udział procentowy triacylogliceroli. Udział
procentowy kwasów nasyconych, nienasyconych oraz NNKT w przypadku mięśni
piersiowych i mięśni nóg różni się nieznacznie (Niewiarowicz i in., 1993; Świderski
i in.,1999). Proporcje kwasów nasyconych i nienasyconych decydują między innymi
o konsystencji i odporności na utlenienie.
Fosfolipidy łatwo ulegają oksydacji, której skutkiem jest jełczenie w czasie
przechowywania. Ponadto w odróżnieniu od triacylogliceroli mają znacznie większe
powinowactwo do wody, w której pęcznieją. Skład kwasów tłuszczowych w dużej
mierze zależy od gatunku kurczęcia i może być zmieniany w zależności od dodatków
paszowych (Grabowski, 2004).
Poza wyżej wymienionymi składnikami występującymi w mięsie drobiowym
należy wymienić także witaminy i substancje mineralne. Ilość ich nie jest zbyt
wysoka, ale należy wyodrębnić takie składniki mineralne jak: potas, fosfor, sód,
magnez, wapń, które między innymi wpływają na równowagę elektrolityczną tkanek
i komórek. Spośród witamin mięso drobiowe zawiera znaczne ilości witamin z grupy

30
B, czyli tiaminy (B
1
), ryboflawiny (B
2
), niacyny (B
3
) oraz pirydoksyny (B
6
) a także
witaminy A, D, E, które są rozpuszczalne w tłuszczach. Z tych witamin największe
znaczenie ma witamina E, bowiem w procesach utleniania lipidów pełni rolę
ochronną. Jest jednym ze składników antyoksydacyjnych mięsa (Świderski i in.,1999;
Zawadzka i in., 2002).
Tworzenie RFT w organizmie jest niebezpieczne ze względu na szereg chorób
i stanów zapalnych, jakie powstają w wyniku działania wolnych rodników. Dlatego
tak ważne jest zapewnienie jak najwyższej jakości spożywanej żywności.
Jedną z możliwości poprawy jakości mięsa jest wzbogacenie mieszanek
paszowych dla drobiu związkami witaminowo- E- aktywnymi. W paszach zwykle
podawane są w postaci octanu alfa-tokoferolu (alfa–T). Związki te zapobiegają
utlenieniu tłuszczów mięsa, co wpływa korzystnie na przedłużenie okresu
przydatności do spożycia zarówno mięsa, jak i przetworów z mięsa drobiu. Główną
funkcją alfa-T jest przerywanie rodnikowej reakcji autooksydacji pomiędzy
cząsteczkami nienasyconych kwasów tłuszczowych. Badania wykazały, że niska
podatność tłuszczów mięsa na proces autooksydacji jest w dużej mierze uzależniony
od obecności w tkankach octanu alfa - tokoferolu. Ponadto dodatek tego składnika
wpływa na zmniejszenie tworzenia się ilości nadtlenków w tłuszczu oraz zachowanie
prawidłowego zapachu i smaku mięsa podczas wydłużonego czasu przechowywania.
Należy jednak zaznaczyć, że zarówno skład jak i jakość tłuszczów
w mieszankach paszowych ma ogromne znaczenie w zachowaniu stabilności lipidów
mięsa podczas przetwarzania i przechowywania, czy to chłodniczego czy
zamrażalniczego. Dodatek w paszy tłuszczów o zwiększonym stopniu nienasycenia
lub tłuszczów zjełczałych, a tym samym zmniejszenie ilości związków witaminowo –
E aktywnych powoduje zwiększenie zdolności lipidów mięsa na procesy oksydacyjne.
Natomiast wzbogacenie pasz w tokoferole jest konsekwencja odkładania się tych
składników w tkankach, co w ostateczności wpływa na zmniejszenie szybkości
procesu oksydacji tłuszczów mięsa. Należy zaznaczyć, iż skuteczność działania
tokoferoli jest proporcjonalna do ilości nienasyconych tłuszczów dodawanych
do paszy.

31
Kolejnym składnikiem, o który może być wzbogacona pasza dla drobiu jest olej
rybny. Składnik ten powoduje zwiększenie ilości długołańcuchowych kwasów
tłuszczowych z rodziny n-3 w mięsie, a zmniejszenie kwasów z rodziny n-6,
co wpływa na zachowanie odpowiednich proporcji kwasów z rodziny n-6 do n-3.
Jednakże zbyt duża ilość podawanego oleju rybnego do paszy jest przyczyną
powstawania w mięsie obcego smaku i zapachu (Pikul, 1997).
Selen jest kolejnym związkiem przeciwutleniającym, dla którego zostały
przeprowadzone próby wzbogacenia mięsa o ten składnik. Poziom selenu w tkance
mięśniowej, podobnie jak witaminy E jest proporcjonalny do stężenia ich w paszy.
Pierwiastek ten bierze udział w regeneracji witaminy E. Niestety duża toksyczność Se,
powoduje konieczność ograniczenia dawki tego pierwiastka jako składnika
wzbogacającego pasze dla drobiu (Pisulewski i in., 2007).
Wzbogacenie pasz dla zwierząt jest przedmiotem badań wielu autorów i mimo,
iż wyniki wskazują na korzyści jakie płyną z dodatku wyżej wymienionych
składników, to należy jednak ciągle poddawać je analizom.

32
2. Cel pracy
Celem pracy było rozpoznanie właściwości przeciwutleniających (potencjału oksydo-
redukcyjnego) wybranych mięśni kurcząt w czasie przechowywania zamrażalniczego.

33
3. Metodyka badań
3.1 Materiał badawczy
Materiałem badawczym był „Świeży kurczak patroszony bez podrobów kl. A”
oraz „Świeże skrzydła z kurczaka kl. A”
Materiał badawczy został wyprodukowany w firmie DROSED S.A.
w Siedlcach. Zakupiony w sklepie „Piotr i Paweł” we Wrocławiu.
Z tuszki drobiowej pozyskano następujące elementy:
- skrzydło – element tuszki drobiowej obejmujący kończynę przednią odciętą
od tuszki w stawie barkowym (PN-92A-86521)
- filet z piersi – element tuszki drobiowej obejmujący mięsień piersiowo
powierzchniowy i/lub głęboki bez przylegającej skóry w całości lub podzielony
na części (PN-92A-86521)
- udo – element tuszki drobiowej obejmujący kość udową wraz z przylegającymi
mięśniami i skórą (PN-92A-86521)
- podudzie – element tuszki drobiowej obejmujący kość piszczelową i kość
strzałkową wraz z przylegającymi mięśniami i skórą (PN-92A-86521)
- część grzbietowa (część tylna tuszki) – element tuszki drobiowej patroszonej
otrzymany w wyniku cięcia przebiegającego poprzecznie do osi kręgosłupa
(PN-92A-86521)
Materiał pozyskano i przekazano do dalszych analiz w stanie schłodzonym (+4
°
C).
34
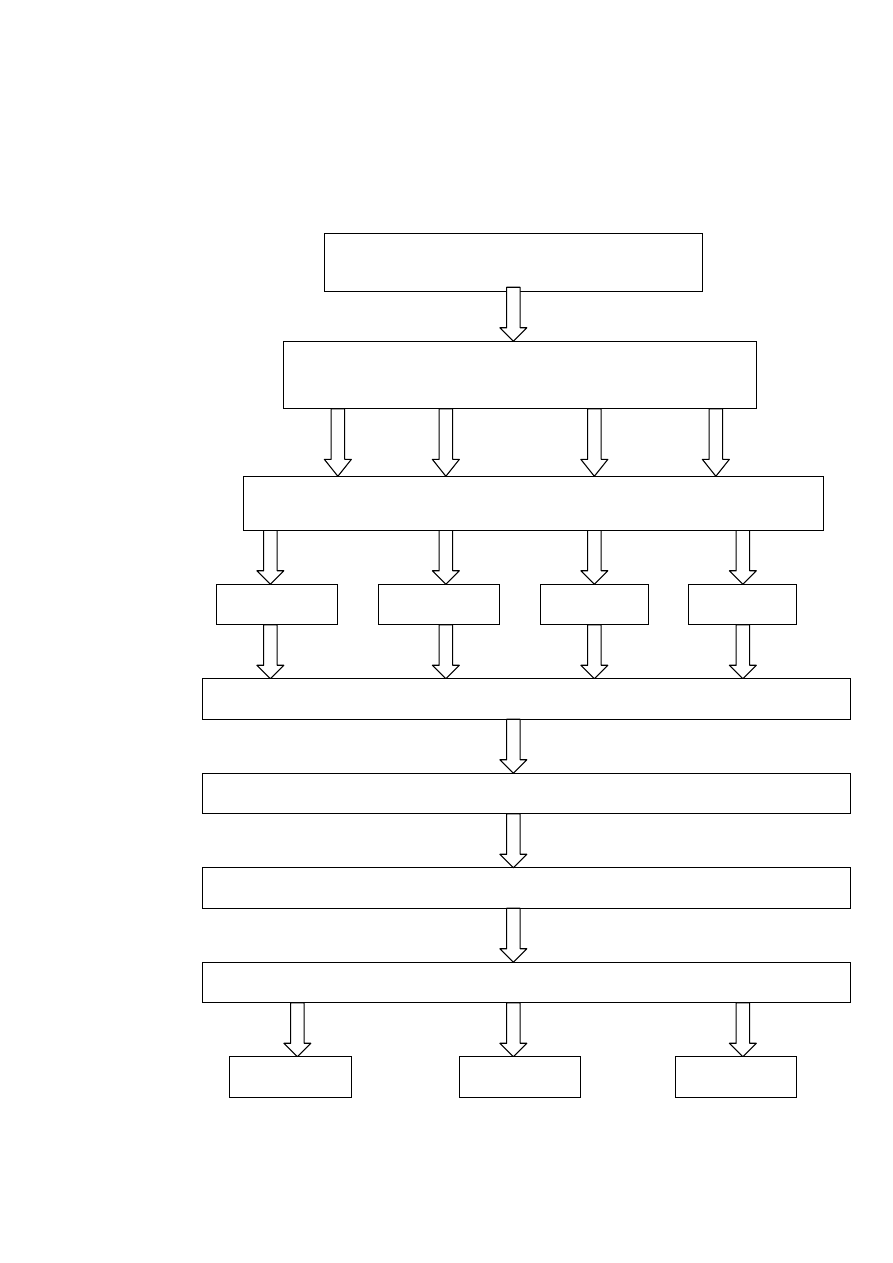
3.2 Schemat doświadczenia:
Podział tuszki drobiowej na elementy
skrzydło, filet z piersi,
udo, podudzie, część grzbietowa
0 dni
30 dni
60 dni
90 dni
uzyskanie supernatantu
przechowywanie w stanie zamrożonym -18
°
C
rozdrobnienie surowca z dodatkiem wody destylowanej (1:3)
odwirowanie roztworu na wirówce 3K30 (15 min.,15
°
C, 15 tyś. x g)
wykonanie oznaczeń
ABTS
TBARS
DPPH
35
3.3 Metody analityczne:
3.3.1. Przygotowanie prób do analiz
Tuszkę drobiową podzielono na elementy - skrzydło, udo, filet z piersi,
podudzie i część grzbietową. Następnie oddzielono mięśnie od skóry i kości.
50 gram każdego surowca tj. mięśnie ze skrzydła, uda, fileta z piersi, fileta
z piersi głębokiej, podudzia i części grzbietowej, rozdrobniono w blenderze
z dodatkiem wody destylowanej w stosunku 1:3 w czasie 3 minut. Następnie
otrzymaną zawiesinę odwirowano w wirówce 3K30 Sigma POLYGEN przez 15
minut, w temperaturze 4
°
C przy prędkości 15 tyś x g. Uzyskany supernatant
przekazano do dalszych analiz właściwości przeciwutleniających mięśni drobiu.
3.3.2 Oznaczenie aktywności antyoksydacyjnej metodą ABTS wg Re i in.
(1999)
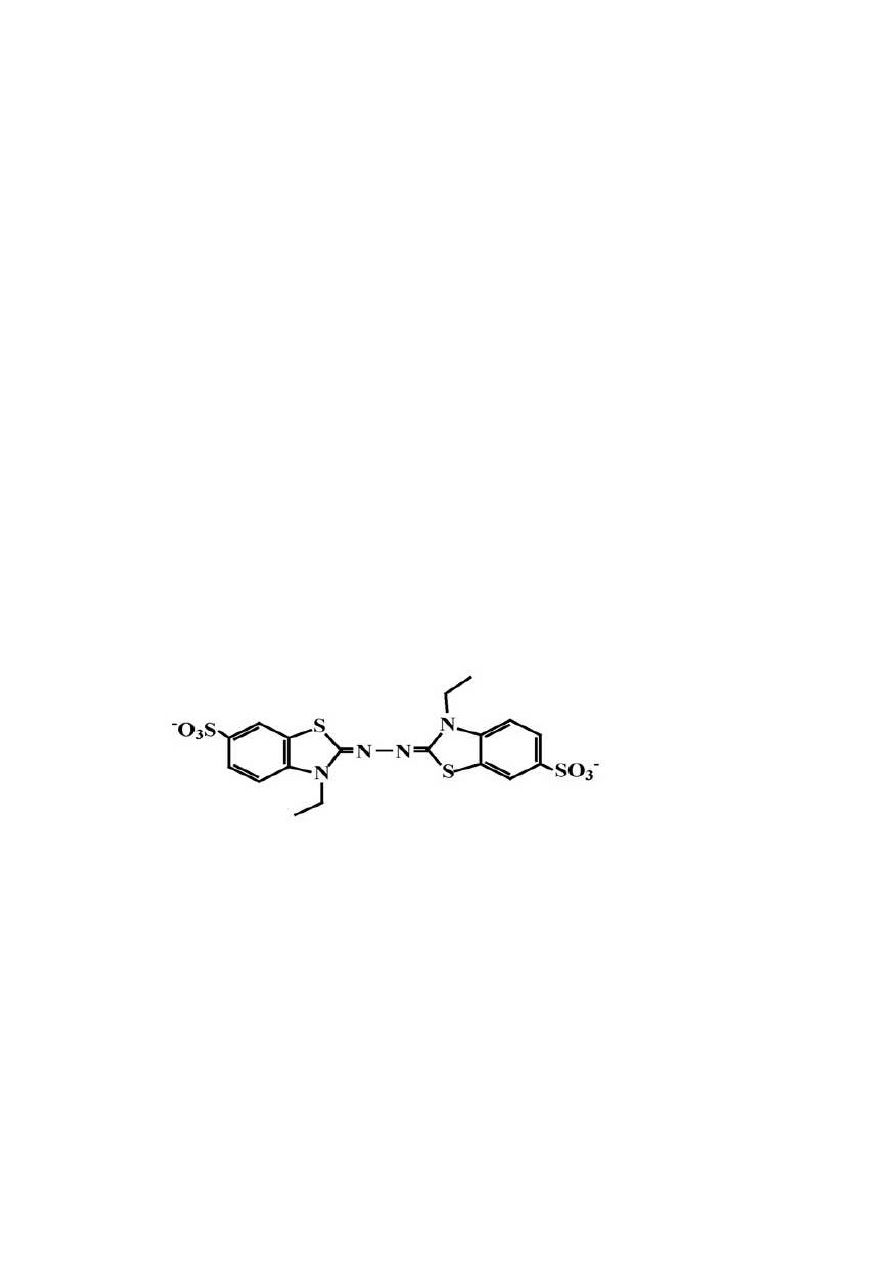
Rys. 8 ABTS [2,2 –azynobis (3-etylobenzotiazolino-6-sulfonian)] (Zhao i in., 2008)
Metoda ABTS polega na oznaczeniu całkowitej zdolności antyoksydacyjnej
na zasadzie redukcji kationorodnika ABTS
•
+
(Bartosz, 2009).
36
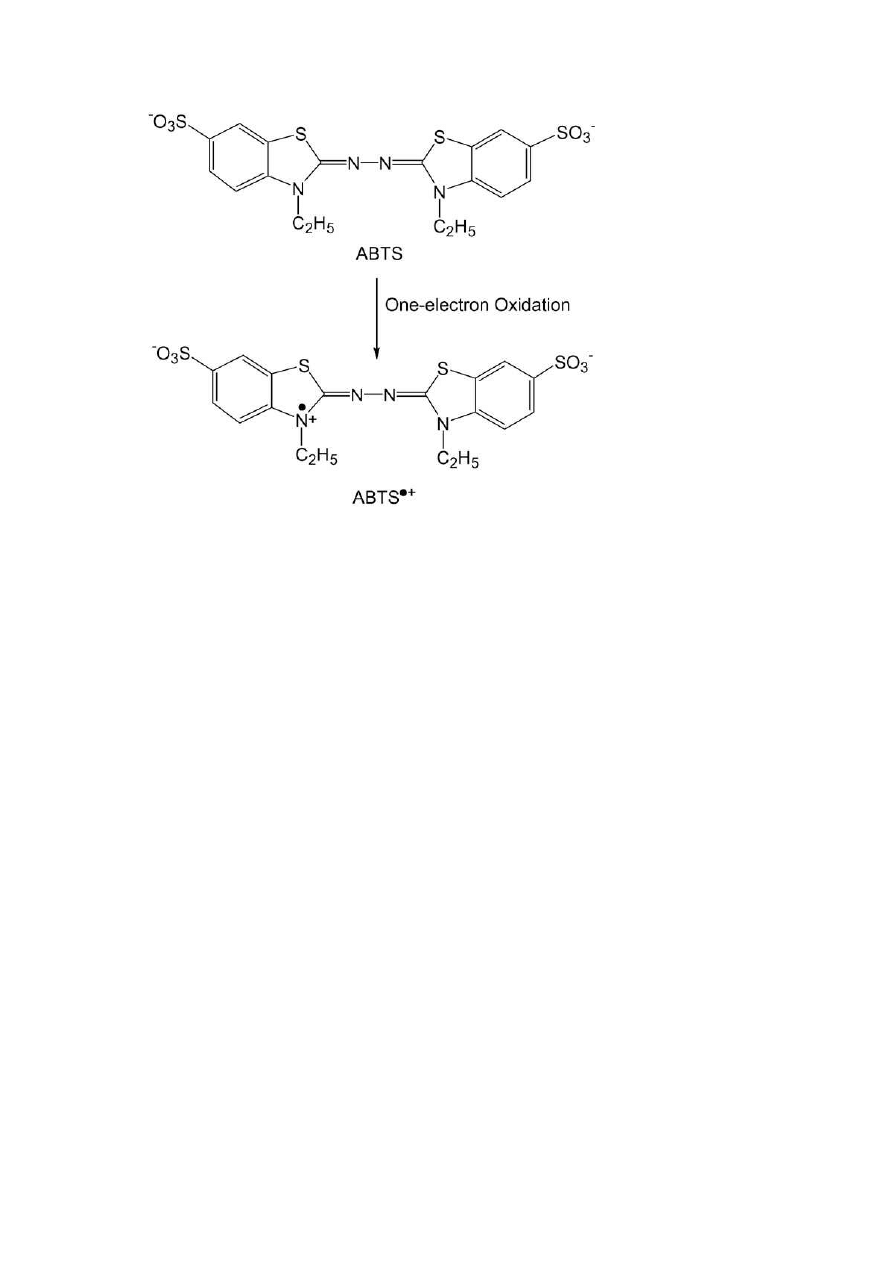
Rys. 9 Jedno-elektronowy produkt oksydacji ABTS (Lee, Yoon, 2008)
Zasada oznaczenia:
Uzyskany z mięśni drobiu supernatant, zawierający substancje o charakterze
antyoksydacyjnym, dodano do roztworu, w którym znajduje się nadmiar
kationorodnika ABTS
•
+
charakteryzujący się zielononiebieską barwą. Związki
przeciwutleniające redukują barwny kationorodnik ABTS
•
+
do bezbarwnego ABTS
[2,2 –azynobis (3-etylobenzotiazolino-6-sulfonian)]
. Zmiany absorbancji roztworu
zawierającego ABTS
•
+
są kompatybilne do liczby przeciwutleniaczy znajdujących się
w danej próbie (Bartosz, 2009)
Uzyskane wyniki przeliczono na podstawie krzywej wzorcowej otrzymanej
dla kolejnych rozcieńczeń standardowego roztworu Trolox.
Przygotowanie roztworu ABTS
ABTS (a) 76,8 mg / 20 ml
Sulfonian potasu 132,4 mg/20 ml + woda destylowana
2 ml roztworu sulfonianu + ABTS (a)
uzupełnić wodą do 20 ml
pozostawić na 16 h bez dostępu światłą
37
Oznaczenie aktywności antyoksydacyjnej metodą ABTS wg Re i in. (1999)
Do kuwetek odmierzono 2,97 ml odczynnika ABTS oraz 30
µ
l uprzednio
przygotowanej próby (supernatant mięśni drobiu) i energicznie wymieszano.
Pozostawiono na 5 minut, w celu przereagowania składników mieszaniny. Po upływie
założonego czasu zmierzono absorbancję roztworów przy długości fali
λ
=532 nm przy
użyciu spektrofotometru Thermo electron corporation Nicolet evolution 100. Próbę
ślepą stanowiła woda destylowana. Analiza została wykonana w 3 powtórzeniach.
3.3.3. Oznaczenie zdolności zmiatania wolnych rodników metodą DPPH
według Yen i Chen (1995)
Rys. 10 DPPH [ 1,1-difenylo-2-pikrylo-hydrazyl] (Zhao i in., 2008)
Metoda DPPH polega na oznaczeniu stopnia redukcji ilości wolnych rodników.
Rys. 11 Reakcja wolnego rodnika DPPH z innym wolnym rodnikiem (Milardović i in., 2006)
Zasada oznaczenia:
Alkoholowy roztwór DPPH (1,1-difenylo-2-pikrylo-hydrazyl) jest wolnym rodnikiem
o stosunkowo dużej trwałości. Ma barwę fioletową, która w czasie reakcji redukcji
zmienia się na żółtą. Zmiana barwy zostaje zarejestrowana na spekrtofotometrze przy
długości fali 517 nm.
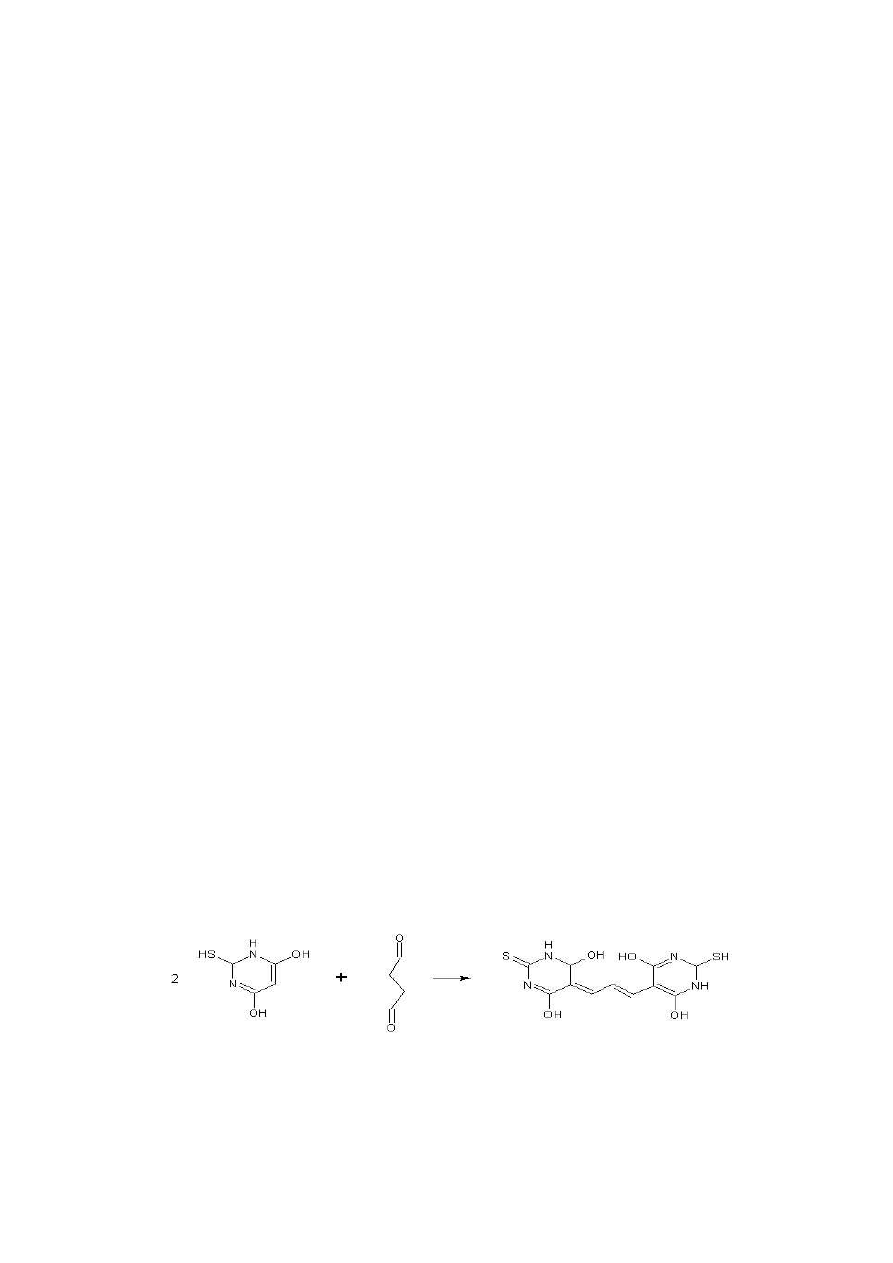
38
Wyniki otrzymane przez pomiar absorbancji są obliczone na podstawie krzywej
wzorcowej otrzymanej dla kolejnych rozcieńczeń standardowego roztworu Trolox.
Przygotowanie roztworu DPPH
Do zlewki miarowej dodano 100 ml etanolu 98% oraz 12 mg 1,1-Difenylo-2-pikrylo-
hydrazyl (DPPH). Po wymieszaniu roztwór poddano działaniu ultradźwięków w czasie
15 minut w celu całkowitego rozpuszczenia odczynnika.
Oznaczenie aktywności antyoksydacyjnej metodą DPPH według Yen i Chen
(1995)
Do probówek Eppendorfa dodano po 0,5 ml rozcieńczonej uprzednio przygotowanej
próby (supernatant z mięśni drobiu) oraz 1,5 ml 98% etanolu. Po wymieszaniu
zawartości, próby odwirowano w wirówce 3K15 przez 10 minut, w temperaturze 4
°
C
przy prędkości 15300 tyś x g. Po odwirowaniu otrzymany przesącz przeniesiono do
kuwetek plastikowych i dodano 0,5 ml odczynnika DPPH. Po wymieszaniu
składników mierzono absorbancję przy długości fali
λ
= 517 nm. Próbę ślepą stanowiła
woda destylowana. Analiza została wykonana w 3 powtórzeniach.
3.3.4. Pomiar substancji reagujących z kwasem 2-tiobatbiturowym według
zmodyfikowanej metody Mei i wsp. (1998)
Metoda TBARS jest podstawową metodą badania stopnia zaawansowania
peroksydacji lipidów. Metoda oparta jest na reakcji aldehydu malonowego (MDA)
z kwasem tiobarbiturowym.
Rys. 12 Reakcja kwasu tiobarbiturowego z aldehydem malonowym (Fernandez i in., 1997)

39
Zasada oznaczenia:
Podstawą oznaczenia metodą TBARS jest powstanie barwnego roztworu w reakcji
pomiędzy kwasem tiobarbiturowym i produktami utleniania lipidów, głównie
aldehydu malonowego. Reakcja ta przebiega w kwaśnym środowisku i podwyższonej
temperaturze, a jej produkt ma różowe zabarwienie (Bartosz,2009).
Wyniki otrzymane przez pomiar absorbancji są obliczone na podstawie krzywej
wzorcowej.
Przygotowanie roztworu TBA
W celu sporządzenia odczynnika TBA przygotowano roztwór A i B.
Roztwór A:
Do kolby miarowej o pojemności 100 ml dodano wodę destylowaną. Następnie
rozpuszczono 1 g kwasu 2-tiobarbiturowego, dodano 1,65 ml 4 M roztworu
wodorotlenku sodu i ogrzewano do rozpuszczenia się. Po ochłodzeniu dodano 0,35 ml
4 M roztworu kwasu solnego i uzupełniono wodą do kreski.
Roztwór B:
Do kolby miarowej o pojemności 500 ml dodano 300 ml wody destylowanej 73,75 g
cytrynianu sodu Na
3
C
3
H
5
O
7
x 2H
2
O. Następnie dodano 62,5 ml stężonego kwasu
solnego i uzupełniono wodą do kreski.
Po przygotowaniu roztworów A i B, właściwy odczynnik uzyskano przez zmieszanie
dwóch objętości roztworu A i jednej objętości roztworu B. Następnie ustalono
pH odczynnika na 2,5 za pomocą 1M roztworu HCL.
Pomiar
substancji
reagujących
z
kwasem
2-tiobatbiturowym
według
zmodyfikowanej metody Mei i wsp. (1998)
Do probówek szklanych o pojemności 10 ml dodano 5 ml uprzednio przygotowanej
próby (supernatant z mięśni drobiu) oraz 2 ml odczynnika TBA. Próbę odczynnikową

40
stanowiło 2 ml odczynnika TBA. Po wymieszaniu , wstawiono probówki do wrzącej
łaźni wodnej na 20 minut. Po upływie tego czasu szybko schłodzono probówki
z roztworami w wodzie wodociągowej, a następnie uzupełniono wodą destylowaną
do objętości 10 ml. Odwirowano w wirówce 3K15 Sigma POLYGEN, wirowania
przez 15 minut, w temperaturze 15
°
C stosując 5500 x g. Próbę ślepą stanowiła próba
odczynnikowa.
Analiza została wykonana w 3 powtórzeniach.

41
3.4 Analiza statystyczna
Uzyskane w doświadczeniu wyniki poddano analizie statystycznej z wykorzystaniem
jednoczynnikowej i wieloczynnikowej analizy wariancji ANOVA testem Duncana
p≤0,05.

42
4. Omówienie wyników
4.1. Oznaczenie aktywności antyoksydacyjnej metodą ABTS wg Re i in.
(1999)
Wieloczynnikowa analiza wariancji przy poziomie ufności p≤0,05 (tabela nr 2)
wyników uzyskanych w badaniach własnych wykazała statystycznie istotny wpływ
dnia przechowywania na zdolność mięśni kurcząt do wygaszania kationorodnika
ABTS. Przeprowadzona analiza statystyczna wykazała również istotny wpływ rodzaju
analizowanego mięśnia z pozyskanego z tuszki kurczęcej na zdolność do zmiatania
syntetycznego kationorodnika ABTS. Nie wykazano natomiast występowania
interakcji pomiędzy okresem przechowywania zamrażalniczego a rodzajem mięśnia
drobiu w odniesieniu do aktywności przeciwutleniającej mierzonej zdolnością
do zmiatania kationorodnika ABTS.
Jednoczynnikowa analiza wariancji wykonana testem Duncana przy poziomie
ufności p ≤ 0,05 wykazała istotne różnice w zdolności do zmiatania syntetycznego
rodnika ABTS w analizowanych próbach mięśni kurcząt w zależności od dnia
przechowywania zamrażalniczego (-18ºC) oraz od rodzaju badanego mięśnia.
Powyższą zależność przedstawiono w tabeli nr 1.
W każdym z analizowanych elementów tuszki drobiowej zdolność do zmiatania
syntetycznego rodnika ABTS przez składniki mięśni w poszczególnych dniach
przechowywania zamrażalniczego kształtowała się na zbliżonym poziomie (14,27 –
23,04 µM Trolox/g) (tabela nr 1), jedynie filet z mięśnia piersiowego
powierzchniowego charakteryzował się zdecydowanie mniejszymi wartościami
analizowanego wyróżnika (14,90 – 21,05 µM Trolox/g) (tabela nr 1).
Najwyższą wartość wskaźnika ABTS uzyskano w mięśniu skrzydłowym po w 30
dniu mrożenia (23,04 µM Trolox/g)
Najniższy wynik oznaczenia ABTS uzyskano dla mięśnia piersiowego
zewnętrznego po 90 dniach mrożenia (14,90µM Trolox/g)
Jak już wspomniano wcześniej, obecność oraz ilość w poszczególnych mięśniach
tuszki drobiowej przeciwutleniaczy naturalnych zależy od długości okresu

43
przechowywania zamrażalniczego. Do 60 dnia zamrażalniczego przechowywania
ilość
antyoksydantów w badanych mięśniach
jest na poziomie umożliwiającym
spowolnienie niekorzystnych zmian o charakterze oksydacyjnych. Jednakże w 90 dniu
przechowywania zawartość przeciwutleniaczy naturalnych obecnych w mięśniach
drobiu gwałtownie spada i osiąga wartości w przedziale (14,27 – 15,84 µM Trolox/g)
(tabela nr 1). Na tym etapie rozpoczyna się istotny wzrost tempa utleniania lipidów.
Świadczy o tym spadek intensywności zabarwienia próby będące proporcjonalne
do zawartości antyoksydantów w badanym roztworze.
Na podstawie uzyskanych w doświadczeniu wyników stwierdzono, że zdolność
do zmiatania syntetycznego kationorodnika ABTS przez składniki wybranych,
schłodzonych i nieprzechowywanych w warunkach zamrażalniczych mięśni kurcząt
kształtowała się na zbliżonym poziomie (21,0 - 21,6 µM Trolox/g) (tabela nr 1).
Najniższą aktywnością antyoksydacyjną charakteryzowały się mięśnie pozyskane
z części grzbietowej oraz mięśni piersiowych zewnętrznych (musculus pectoralis
superficialis) (21,05 µM Trolox/g), podczas gdy najwyższe wartości w analizie
zmiatania rodnika ABTS zanotowano dla mięśni piersiowych wewnętrznych
(musculus pectoralis profundus) (21,58 µM Trolox/g).
Po 60 dniach przechowywania mięśni w stanie zamrożonym tj. w temperaturze
-18
°
C, nie stwierdzono istotnych (p ≤ 0,05) różnic w zdolności składników tkanki
mięśniowej analizowanych elementów tuszki kurczęcej do zmiatania syntetycznego
rodnika ABTS w odniesieniu do mięśni w stanie świeżym schłodzonym. Jakkolwiek,
zaobserwowano tendencję obniżania się zdolności przeciwutleniających w miarę
wydłużania czasu przechowywania mięśni w temperaturze zamrażalniczej. Ponownie
najniższą zdolność do zmiatania rodników wykazano dla mięśni piersiowych
zewnętrznych (18,84 µM Trolox/g) oraz mięśni pozyskanych z części grzbietowej
(19,94 µM Trolox/g) (tabela nr 1).
Dalsze
tj.
90-dniowe,
przechowywanie
elementów
tuszki
kurczęcej
w temperaturze -18
°
C doprowadziło do istotnego (p ≤ 0,05) obniżenia zdolności
zmiatania syntetycznego kationorodnika ABTS przez składniki wszystkich
analizowanych mięśni.

44
Pod
koniec
okresu
badawczego
stwierdzono
obniżenie
aktywności
przeciwutleniającej mięśni kurcząt nawet o 30% w stosunku do wartości początkowej
tj. dla mięśni schłodzonych, nie poddanych jeszcze procesowi mrożenia
.
Najniższą
zdolnością zmiatania rodnika ABTS charakteryzowały się mięśnie piersiowe
wewnętrzne (14,27 µM Trolox/g) oraz mięśnie podudzia (14,36 µM Trolox/g),
podczas gdy wyższe wartości zaobserwowano dla mięśni części grzbietowej oraz
mięśni ud (odpowiednio, 15,67 µM Trolox/g i 15,84 µM Trolox/g) (tabela nr 1).
Jakkolwiek, analiza statystyczna uzyskanych wyników nie wykazała istotnych
(p ≤ 0,05) różnic pomiędzy analizowanymi grupami mięśni pozyskanych z tuszki
kurczęcej na zdolność do zmiatania kationorodnika ABTS. Największą dynamikę
zmian
pojemności
antyoksydacyjnej
mierzonej
zdolnością
do
wygaszania
syntetycznego rodnika ABTS wykazano dla składników części hydrofilowej mięśni
piersiowych zewnętrznych, wewnętrznych oraz mięśni podudzia (odpowiednio
21,05-
14,90 µM Trolox/g, 21,58-14,27 oraz 21,53-14,36).
Istotne (p ≤ 0,05) zmniejszenie zdolności zmiatania wolnych rodników przez
składniki zawarte w mięśniach drobiu w wyniku długotrwałego przechowywania
zamrażalniczego można wiązać z zachodzącymi w trakcie składowania procesami
oksydacyjnymi,
jak
również
ze
zmianami
komponentów
o
działaniu
antyoksydacyjnym naturalnie występującymi w tkance mięśniowej np. tokoferole,
Brak różnic statystycznych pomiędzy poszczególnymi partiami mięśniowymi tuszki
drobiowej w zdolności do wygaszania syntetycznego kationorodnika ABTS mógł być
również wynikiem analizowania tylko części hydrofilowej składników tkanki mięsnej.

45
4.2. Oznaczenie aktywności antyoksydacyjnej metodą DPPH według Yen
i Chen (1995)
Z zestawienia wyników w tabeli nr 4, które uzyskano w badaniach własnych dla
wieloczynnikowej analizy wariancji przy p ≤ 0,05 wnioskujemy, iż z dwóch
parametrów
będących
podstawą
badań,
jedynie
dzień
przechowywania
zamrażalniczego w temperaturze -18ºC ma statystycznie istotny wpływ na zdolność
poszczególnych mięśni tuszki drobiowej do zmiatania niezredukowanego rodnika
DPPH. Przeprowadzona analiza statystyczna wykazała natomiast, iż rodzaj mięśnia
nie wpływa istotnie (p≤0,05) na ilość przeciwutleniaczy zawartych w surowcu.
Ponadto, nie wykazano interakcji pomiędzy dniem przechowywania zamrażalniczego
a rodzajem mięśnia drobiu w nawiązaniu do aktywności przeciwutleniającej mierzonej
zdolnością do zmiatania pozostałego niezredukowanego rodnika DPPH.
Podobną sytuację zaobserwowano w przypadku jednoczynnikowej analizy
wariancji wykonanej za pomocą testu Duncana przy poziomie ufności p ≤ 0,05, której
wyniki zestawiono w tabeli nr 3. Zawartość pozostałego niezredukowanego rodnika
DPPH obecnego w oznaczanej próbie, była uzależniona jedynie od dnia
przechowywania zamrażalniczego. Nie zależała natomiast od rodzaju mięśnia tuszki
drobiowej.
W dniu zamrożenia wykazano niskie wartości pozostałego w próbie
niezredukowanego rodnika DPPH w każdym z poszczególnych elementów tuszki
drobiowej (0,58 - 0,66µM Trolox/g) (tabela nr 3). Oznacza to, że ilość
przeciwutleniaczy w tym okresie jest na stosunkowo wysokim poziomie i mięśnie
mogą pozostać względnie oporne na procesy oksydacji.
W trakcie wydłużania się okresu przechowywania zamrażalniczego ilości
niezredukowanego rodnika DPPH ulegały zwiększeniu i w 90 dniu mrożenia osiągnęły
wartość w przedziale od 0,82 µM Trolox/g dla mięśni udowych do 0,98 µM Trolox/g
dla mięśni piersiowych wewnętrznych (tabela nr 3).
Wzrostowa tendencja otrzymywanych wartości DPPH podczas przechowywania
zamrażalniczego jest odwrotnie proporcjonalna do stężenia antyoksydantów

46
w próbach, które mają zdolność do zmiatania pozostałego niezredukowanego rodnika
DPPH. Ilość przeciwutleniaczy wraz z wydłużającym się okresem mrożenia zmniejsza
się, co powoduje zwiększenie podatności mięśnia tuszki drobiowej na zmiany
oksydacyjne objawiające się m. in. jełczeniem surowca. Ponadto, w 90 dniu
przechowywania zamrażalniczego w temperaturze -18ºC występuje różnica istotna
statystycznie (p ≤ 0,05) w zawartości pozostałego niezredukowanego rodnika DPPH
dla mięśni części grzbietowej oraz dla mięśnia piersiowego, zarówno wewnętrznego,
jak i zewnętrznego.
Najniższe wartości pozostałego niezredukowanego rodnika DPPH uzyskano dla
mięśnia skrzydłowego w dniu zamrożenia (0,58µM Trolox/g), natomiast najwyższe
dla mięśnia piersiowego wewnętrznego w 90 dniu przechowywania zamrażalniczego
(0,98µM Trolox/g ).

47
4.3. Ilość substancji reagujących z kwasem 2-tiobatbiturowym według
zmodyfikowanej metody Mei i wsp. (1998)
Na podstawie przeprowadzonej wieloczynnikowej analizy wariancji (p ≤ 0,05)
wyników uzyskanych w oznaczeniu TBARS, czyli ilości dialdehydu malonowego
powstającego w czasie oksydacji tłuszczów, stwierdzono, iż zarówno dzień
przechowywania zamrażalniczego, jak i rodzaj mięśnia, miały statystycznie istotny
wpływ na proces utleniania lipidów w poszczególnych elementach tuszki drobiowej,
w czasie mrożenia (tabela nr 6). Zaobserwowano również występowanie interakcji
pomiędzy rodzajem mięśnia a dniem przechowywania zamrażalniczego w ilości
substancji reagujących z kwasem 2- tiobarbiturowym zawartych w wybranych
mięśniach kurcząt (tabela nr 5).
Podobnie jednoczynnikowa analizy wariancji w przedziale ufności p
≤
0,05
wykazała
, iż zarówno rodzaj mięśnia, jak i dzień przechowywania zamrażalniczego
wpływał istotnie na różnice w ilości substancji wchodzących w reakcje z kwasem 2-
tiobarbiturowym, które są końcowymi produktami oksydacji tłuszczu.
Zmienność zawartości dialdehydu malonowego w zależności od rodzaju mięśnia
oraz od dnia przechowywania zamrażalniczego zestawiono w tabeli nr 5.
Z uzyskanych w doświadczeniu rezultatów wynika, iż każdy z badanych
elementów mięśniowych tuszki drobiowej był narażony na niekorzystne zmiany
tłuszczu czyli utlenianie, o czym świadczył proporcjonalny wzrost wartości wskaźnika
TBARS do dnia przechowywania zamrażalniczego.
Mięsnie podudzia były najbardziej narażone na działanie reaktywnych form
tlenu, bowiem już w dniu zamrożenia wykazywały najwyższy poziom wskaźnika
TBARS
różniący się istotnie od wartości wskaźnika otrzymanego dla pozostałych
badanych mięśni drobiu, tj. 58,72 µg/g mięśni (tabela nr 5). W ciągu pierwszego
miesiąca
przechowywania
zaobserwowano
nasilenie
zmian
oksydacyjnych,
a w okresie od 60 do 90 dni składowania zamrażalniczego nie stwierdzono istotnych
różnic w ilości dialdehydu malonowego w analizowanych mięśniach podudzia.
Ponadto, wartość wskaźnika TBARS w mięśniach podudzia w dniu mrożenia była

48
ponad dwukrotnie wyższa (58,72 µg/g mięśni) (tabela nr 5) od wartości tego
wskaźnika dla obu filetów piersiowych, zewnętrznego (16,93 µg/g mięśni) (tabela
nr 5) i wewnętrznego (16,06 µg/g mięśni) (tabela nr 5) po trzymiesięcznym
przechowywaniu zamrażalniczym.
Podobna sytuacja wystąpiła w przypadku zespołu mięśni udowych, tutaj również
niekorzystne zmiany rozpoczynają się w dniu zamrożenia, a następnie pogłębiają się
w 30
, 60 i 90 dniu przechowywania wykazując tendencję wzrostową dla wskaźnika
TBARS. Dynamicznie przebiegająca oksydacja tłuszczu w mięśniach uda oraz
podudzia mogła być w znacznym stopniu spowodowana wysoką zawartością tłuszczu
oraz rozmieszczeniem pomiędzy poszczególnymi włóknami mięśniowymi. Mięśnie
nóg kurcząt zawierają około 10% tłuszczu, co stanowi znacznie większą ilość tłuszczu
niż np. mięśni piersiowych, które zawierają ok. 0,86% tłuszczu. Niższa zawartość
tłuszczu w mięśniach piersiowych, jak również charakterystyczne umiejscowienie
kuleczek tłuszczowych w strukturach włókienek, powoduje mniejszą podatność tego
składnika na działanie reaktywnych form tlenu. Z przeprowadzonych badań własnych
wynika, iż przechowywanie zamrażalnicze w ciągu czterech miesięcy nie stanowi
zagrożenia oksydacyjnego dla mięśnia piersiowego zewnętrznego. W mięśniu
piersiowym wewnętrznym sytuacja jest zbliżona do mięśnia zewnętrznego i zmiany
oksydacyjne zachodzą w nim na podobnym poziomie. Jednakże dynamika zmian
oksydacyjnych w mięśniu piersiowym wewnętrznym jest nieco wyższa (16,06 µg/g –
26,06 µg/g mięśnia) w porównaniu z mięśniem piersiowym zewnętrznym (16,93 µg/g
– 21,75 µg/g mięśnia) (tabela nr 5). Ponadto, w mięśniu piersiowym wewnętrznym
w 90 dniu mrożenia zachodzą istotne statystycznie zmiany w ilości substancji
reagujących z kwasem 2-tiobarbiturowym
w porównaniu z wcześniejszymi dniami
badawczymi tj. w 0, 30 i 60 dniu mrożenia.
.
Statystycznie istotne różnice (p ≤ 0,05) w zaawansowaniu zmian oksydacyjnych
w takich elementach tuszki drobiowej, jak mięśnie skrzydłowe oraz mięśnie części
grzbietowej
zaobserwowano
dopiero
po
90
dniowym
przechowywaniu
zamrażalniczym. Należy jednak podkreślić fakt, stosunkowo wysokiej zawartości
substancji reagujących z kwasem 2-tiobarbiturowym już w mięśniach schłodzonych

49
(nieprzechowywanych w stanie zamrożonym) w odniesieniu do mięśni filetów
piersiowych, w których podobną ilość di aldehydu malonowego zaobserwowano
dopiero po 3 miesiącach przechowywania w temperaturze -18
°
C.
Okres przechowywania zamrażalniczego to drugi z wyróżników mających wpływ
na status oksydo-redukcyjny mięśni drobiu.
Na podstawie uzyskanych wyników można wnioskować, iż mięśnie kurcząt już
w stanie schłodzonym są narażone na zachodzenie zmian oksydacyjnych, bowiem
we wszystkich analizowanych mięśniach wykryto obecność dialdehydu malonowego.
Najwyższy poziom substancji reagujących z kwasem 2-tiobarbiturowym w dniu
mrożenia stwierdzono w mięśniach podudzia (58,72 µg/g mięśni) i uda (32,15 µg/g
mięśni) (tabela nr 5). Podobne zależności stwierdzono również po pierwszym miesiącu
przechowywania zamrażalniczego.
Po dwumiesięcznym przechowywaniu mięśni podudzia i uda stwierdzono istotne
(p
≤
0,05)
zwiększenie ilości di aldehydu malonowego, podczas gdy stan
zaawansowania zmian oksydacyjnych tłuszczu w pozostałych analizowanych
mięśniach tuszki drobiowej nie ulegał istotnym zmianom.
Analiza
ilości
substancji
reagujących
z
kwasem
2-tiobarbiturowym
przeprowadzona w mięśniach kurcząt przechowywanych zamrażalniczo przez 90 dni
wykazała istotny (p
≤
0,05)
wzrost stopnia zaawansowania zmian oksydacyjnych
w mięśniach skrzydłowych, piersiowym wewnętrznym, udowych oraz części
grzbietowej (tabela nr 5). Nie stwierdzono natomiast w mięśniach piersiowych
zewnętrznych istotnego (p
≤
0,05)
zwiększenia ilości dialdehydu malonowego,
jakkolwiek zaobserwowano lekką tendencję wzrostową.

50
5. Dyskusja wyników
Przechowywanie zamrażalnicze jest jedną z podstawowych i jednocześnie
najważniejszych metod zabezpieczenia mięsa, jak i produktów mięsnych przed
zepsuciem, albowiem w porównaniu z innymi ta metoda utrwalania prowadzi
do minimalnych strat jakości żywności w czasie długiego okresu przechowywania
(Soyer i in., 2010).
Trwałość produktów mrożonych jest uzależniona od dwóch czynników,
a mianowicie od uzyskania niskich temperatur oraz od przemiany wody w lód.
Wielkość i rozmieszczenie kryształków powstałego lodu jest uzależnione od przebiegu
zamrażania, natomiast ilość lodu zależy od temperatury, jaka zostanie osiągnięta
podczas tego procesu. Ponadto w czasie zamrażania następuje zmiana właściwości
cieplnych mięsa tuszki drobiowej. Jest to spowodowane utworzeniem się kryształków
lodu, których ciepło właściwe jest dwukrotnie mniejsze niż wody (Barbut i in., 1990).
Jednakże, podczas mrożenia mięso tuszek drobiowych ulega niekorzystnym zmianom
chemicznym, które prowadzą do skrócenia czasu przechowywania. Do tych
czynników możemy zaliczyć między innymi niepożądane zmiany oksydatywne czy
powstawanie obcego smaku i zapachu. Przemiany te można jednak ograniczyć
poprzez obniżenie temperatury zamrażania (Grabowski, Kijowski, 2004).
Ciągłe ulepszanie procesu przechowywania zamrażalniczego jest niezwykle
ważne zarówno z technologicznego punktu widzenia, jak również z uwagi na końcową
jakość żywności i sprostanie rosnącym wymaganiom konsumentów, którzy stają się
coraz bardziej świadomi tego co kupują i spożywają. Badania statusu
oksydoredukcyjnego mięsa drobiu mogą przyczynić się do polepszenia zarówno
jakości mięsa i jego przetworów, jak również dzięki analizie przemian zachodzących
w tkance mięśniowej w czasie przechowywania może się ona przyczynić do ustalenia
optymalnego czasu i warunków składowania produktów w niskich temperaturach,
w tym zamrażalniczych. Rozpoznanie zdolności składników mięsa do zmiatania
wolnych rodników, jak również analiza zachodzących przemian oksydacyjnych może
także zapoczątkować wprowadzenie do produkcji różnorodnych, w tym nowoczesnych
rozwiązań w dziedzinie opakowalnictwa, stosowania modyfikowanej atmosfery czy

51
nawet
modyfikacji
żywieniowych mających na celu poprawę statusu
oksydoredukcyjnego mięsa oraz zachowanie stosunkowo wysokich właściwości
przeciwutleniających przy zastosowaniu optymalnych warunków przechowywania
produktów. Ponadto wzbogacenie żywności w antyoksydanty, szczególnie
pochodzenia naturalnego oraz pozyskanie informacji o procesie zmiatania wolnych
rodników jest niezwykle ważne dla zwiększenia zdrowotności żywności.
W badaniach własnych dotyczących określenia właściwości przeciwutleniających
w wybranych mięśniach drobiu podczas przechowywania zamrażalniczego
z wykorzystaniem metod ABTS, DPPH oraz TBARS wykazano, iż zarówno dzień
przechowywania zamrażalniczego, jak i rodzaj mięśnia uzyskanego z tuszki drobiowej
ma statystycznie istotny wpływ na zdolność składników tkanki mięśniowej
do zmiatania wolnych rodników, jak również na dynamikę procesów utleniania
składników mięsa, głównie lipidów. Utlenianie tłuszczy zawartych w poszczególnych
mięśniach tuszki drobiowej jest spowodowane tworzeniem się wolnych rodników,
które przyczyniają się do powstawania zjełczałego smaku i zmian koloru mięsa.
Również utlenianie białek powoduje niekorzystne zmiany w produktach mięsnych,
amianowicie utratę koloru, rozpuszczalności, a także wartości odżywczych (Fasseas
i in., 1998). Każdy z badanych mięśni tuszki drobiowej jest narażony na niekorzystne
zmiany podczas procesu mrożenia, ale szczególnie jest to nasilone w czasie
długotrwałego przechowywania w niskich temperaturach. Świadczy o tym między
innymi
wzrost
wartości
wskaźnika
TBARS
w
czasie
przechowywania
zamrażalniczego w temperaturze -18
°
C oraz wzrost wartości pozostałego w próbie
niezredukowanego DPPH, co może wiązać się ze zmniejszeniem ilości
antyoksydantów w badanej próbie w czasie przechowywania, a tym samym
zwiększoną podatność na zmiany oksydacyjne żywności. Podobne do uzyskanych
w badaniach własnych wyniki otrzymał Soyer i in. (2010) prowadząc analizy mięśni
nóg oraz mięśni piersiowych kurcząt. Wartość wskaźnika TBARS w tych mięśniach
zwiększała się podczas wydłużającego się okresu przechowywania zamrażalniczego.
Badania własne przeprowadzone metodą TBARS wykazały, iż każdy z badanych
mięśni jest narażony na działanie reaktywnych form tlenu, bowiem już w dniu
zamrożenia wykryto obecność dialdehydu malonowego (MDA).

52
Podobnie, jak w badaniach Soyer i in. (2010), badania własne wykazały,
iż zmiany te są bardziej intensywne w mięśniach nóg, tj. podudzia i uda niż
w pozostałych mięśniach. Podobne wyniki uzyskał również Pikul i in. (1984), który
w swych
badaniach
odnotował
znaczny
wzrost
ilości
MDA
podczas
sześciomiesięcznego przechowywania w stanie zamrożenia mięśni nóg i mięśni
piersiowych kurcząt. Również Abdel– Kader (1996) wykazał wzrost tempa utleniania
frakcji
lipidowej
mięsa
podczas
sześciomiesięcznego
przechowywania
zamrażalniczego. Podobnie jak w badaniach własnych, również Abdel – Kader (1996)
oraz Pikul i in. (1984) odnotowali wyższy wzrost utleniania lipidów w mięśniach nóg
w porównaniu z mięśniami piersiowymi kurcząt. Jest to między innymi spowodowane
większą ilością barwników hemowych w mięśniach nóg oraz wyższą zawartością
tłuszczów. Odmienne obserwacje wykazała w swoich badaniach Malczyk (1999),
określając znacznie większą wartość wskaźnika TBA w lipidach mięśni piersiowych
w porównaniu z mięśniami nóg. Jest to inicjowane znacznie większą obecnością
wysoko nienasyconej frakcji fosfolipidowej, będącej składnikiem budulcowym błon
komórkowych, w mięśniach piersiowych w porównaniu z mięśniami ciemnymi.
Ponadto, wyniki oznaczeń zdolności zmiatania syntetycznego kationorodnika
ABTS przeprowadzonych
w badaniach własnych wykazały tendencję obniżania się,
co wskazuje na spadek zdolności do wygaszania wolnych rodników przez składniki
zawarte w mięśniach drobiu w czasie przechowywania zamrażalniczego. Może to być
spowodowane zmniejszającą się zawartością i/lub aktywnością naturalnych
antyoksydantów obecnych w mięśniach tuszki drobiowej. Podczas wydłużającego się
okresu przechowywania aktywność przeciwutleniaczy egzogennych mięsa zmniejsza
się i w 90 dniu składowania zamrażalniczego może prowadzić do wystąpienia sporego
zaawansowania niekorzystnych zmian oksydacyjnych.
Proces utleniania składników zawartych w mięśniach tuszki drobiowej zachodzi
znacznie szybciej i na wyższym poziomie w ciemnych mięśniach w porównaniu
z mięśniami białymi. W mięśniach ciemnych, do których należą mięśnie nóg, zarówno
podudzia, jak i uda, jest znacznie większa ilość składników prooksydacyjnych,
przyczyniających się do zapoczątkowania reakcji wolnorodnikowych. Podobne wyniki

53
uzyskali Eymard i in. (2009) oraz Srinivasan i Hultin (1995), którzy wykazali,
że mięśnie ciemne są bardziej podatne na utlenianie, gdyż zawierają znacznie większą
ilość lipidów, białek hemowych oraz enzymów mikrosomalnych. Także Sacchetti
i wsp. (2008) potwierdzili w swoich badaniach nad antyoksydacyjną aktywnością
mięśni drobiu, że mięśnie piersiowe charakteryzują się większą aktywnością
w zmiataniu wolnych rodników w porównaniu z mięśniami nóg. Wiąże się
to z faktem, że mięśnie udowe zawierają w swoim składzie więcej tłuszczu i
lipofilnych przeciwutleniaczy posiadających znacznie niższe RSA (ang. radical
scavenging activity).
W hamowaniu niekorzystnych procesów oksydacji mięsa i jego wyrobów
niezwykle ważne jest dobranie odpowiednich procesów oraz ich parametrów, które
mogą skutecznie zapobiegać lub w znacznym stopniu ograniczyć powstawanie
reaktywnych form tlenu, które przyczyniają się do zapoczątkowania reakcji
autooksydacji.

54
6. Wnioski
Na podstawie wyników uzyskanych w trakcie realizacji badań oraz
przeprowadzonej analizy statystycznej można stwierdzić, że:
1. Podczas przechowywania zamrażalniczego tj. w temperaturze -18
°
C, w mięsie
drobiu zachodzą niekorzystne procesy oksydacyjne oraz zmniejsza się
aktywność naturalnych związków przeciwutleniających obecnych w tkankach
do zmiatania wolnych rodników.
2. Procesy utleniania składników zawartych w analizowanych mięśniach kurcząt
są uzależnione zarówno od dnia przechowywania zamrażalniczego, jak
i od rodzaju mięśni drobiu.
3. Oksydacja składników zawartych w mięśniach, głównie lipidów, rozpoczyna
się tuż po śmierci zwierzęcia, a operacje technologiczne tj. schładzanie
i mrożenie, a w szczególności długotrwałe przechowywanie prowadzą
do zaawansowania zmian oksydacyjnych w mięsie kurcząt.
4. W czasie przechowywania zamrażalniczego w poszczególnych mięśniach
kurcząt zmniejsza się aktywność antyoksydantów egzogennych, a zwłaszcza
ich zdolność do zmiatania wolnych rodników, co prowadzi do ograniczenia
możliwości kontrolowania procesów oksydacji składników mięsa tj. lipidów,
barwników czy białek.
5. Najbardziej podatne na procesy oksydacji są mięśnie kurcząt pozyskane
z podudzi i ud. Natomiast, najmniej narażone na procesy oksydacji wywołane
działaniem reaktywnych form tlenu są mięśnie piersiowe, zarówno
powierzchniowy, jak i głęboki.

55
7. Spis literatury
1. Abdel – Kader Z. M. 1996. Lipid oxidation in chicken as affected by cooking
and frozen storage. Nahrung: 40, 21 – 24.
2. Bałasińska B. 2004. Ocena stanu oksydo – redukcyjnego w żywych
organizmach. Medycyna Weterynaryjna: 60 (6), 579 – 583.
3. Barbut S., Mittal, G. S. 1990. Influence of the freezing rate on the rheological
and gelation properties of dark poultry meat. Poultry Science; 69, 827–832.
4. Barowicz T. 2000. Wolne rodniki tlenowe, przeciwutleniacze oraz jakość mięsa
wieprzowego. Trzoda Chlewna: 12, 53 – 55.
5. Bartnikowska E. 1992. Powstawanie wolnych rodników tlenowych i skutki ich
działania u zwierząt. Medycyna Weterynaryjna: 48 (4), 173 – 176.
6. Bartnikowska E. 2004. Przeciwdziałanie procesom utleniania w mięsie
i przetworach mięsnych. Przemysł Spożywczy: 5, 52 – 56.
7. Bartnikowska E., zawadzka K., Szymańska M. 2002. Wartość odżywcza mięsa
zwierząt rzeźnych i drobiu. Przemysł Spożywczy: 7, 17 – 20.
8. Bartosz G. 2009. Druga twarz tlenu. Wydawnictwo Naukowe PWN, Warszawa.
9. Eymard S., Baron C. P., Jakobsen C. 2009. Oxidation of lipid and protein
in horse mackered (Trachurus trachurus) mince and wasched minces during
processing and storage. Food Chemistry: 114, 57- 65.
10. Fasseas M.K.,
K.C. Mountzouris, P.A. Tarantilis, M. Polissiou, G. Zervas,
1998. Antioxidant activity in meat treated with oregano and sage essential oils.
Food Chemistry; 106 , 1188
–
1194
11. Gajewski M., Kamińska E., Wysocki Ł., Szczepanik Sz., Sygitowicz G.,
Wojciechowski M., Pachecka J., Maśliński S. 2008. Gospodarka tlenowa
w organizmie. Część I. Życie Weterynaryjne: 80 (7),380 – 386.
12. Grabowski T., Kijowski J. 2004. Mięso i przetwory drobiowe. Wydawnictwa
Naukowo- Techniczne, Warszawa

56
13. Kamińska E., Gajewski M., Wysocki Ł., Szczepanik Sz., Sygitowicz G.,
Wojciechowski M., Pachecka J., Maśliński S. 2008. Gospodarka tlenowa
w organizmie. Część II. Życie Weterynaryjne: 80 (8),473 - 480.
14. Kleczkowski M., Kluciński W., Sikora J., Kasztelan R. 2004. Rola wybranych
składników mineralnych w procesach oksydacyjnych organizmu. Medycyna
Weterynaryjna: 60 (3), 242 – 245.
15. Kleczkowski M., Kluciński W., Sitarska E., Sikora J. 1998. Stres oksydacyjny
i wybrane
wskaźniki
stanu
antyoksydacyjnego
zwierząt.
Medycyna
Weterynaryjna: 54 (3), 166 – 171.
16. Kozłowska – Wojciechowska M. 2002. Antyoksydanty – sprzymierzeńcy
zdrowia. Wiadomości Zielarskie: 5, 8-9.
17. Łata B. 1998. Mechanizmy chroniące roślinę przed stresem oksydacyjnym,
wywołanym niekorzystnymi warunkami środowiska. Postępy Nauk
Rolniczych: 6, 115 – 132.
18. Malczyk E., 1999. Wpływ systemu żywienia kurcząt na procesy oksydacyjne
zachodzące w mięsie przechowywanym chłodniczo. Żywność Nauka
Technologia Jakość; 3 (20),136-150
19. Malinowska a. 1992. Skutki toksycznego działania aktywnych form tlenu
i ochrona przed nimi. Nowości Weterynarii: 22, 3 – 16.
20. Nawrot R., Goździcka – Józefiak A. 2002. Biotechnologia w walce
z reaktywnymi formami tlenu. Biotechnologia: 2 (57), 88 – 101.
21. Niewiarowicz A., Grabowski T. 1993. Technologia mięsa drobiowego.
Wydawnictwa Naukowo- Techniczne, Warszawa.
22. Panczenko – Kresowska B. 1997. Wolne rodniki a żywienie. Wiadomości
Zielarskie: 10, 17- 18.
23. Pawlak M. 1998. Dyskretny urok mięśnia. Polskie Drobiarstwo: 12, 6 – 8.
24. Pikul J., Leszcyński D.E., Bechtel P.J., Kummerow F.A. 1984. Effects of rozen
storage and cooking on lipid oxidation in chicken meat. Journal of Food
Science: 49, 838- 843.
25. Pisulewski P., Kostogrys R., Franczyk – Żarów M. 2007. Przeciwutleniacze
w żywności. Wydawnictwo Naukowo – Techniczne, Warszawa.

57
26. Giampiero Sacchetti , Carla Di Mattia, Paola Pittia, Giuseppe Martino, 2008;
Application of a radical scavenging activity test to measure the total antioxidant
activity of poultry meat. Meat Science: 80, 1081 - 1085
27. Sicińska E. 2008. Przeciwutleniacze w żywności. Przemysł Spożywczy: 5, 36-
38, 45.
28. Soyer A., A zalp B., DalmAąs A., Bilgin V. 2010. Effects of feezing
temperature and duration of frozen storage on lipid and protein oxidation
in chicken meat. Food Chemistry: 120, 1025- 1030.
29. Srinivasan S., Hultin H. O. 1995. Hydroxyl radical odyfication of fish muscle
proteins. Journal of Food Biochemistry: 18,405 – 425.
30. Świerczewska E., Siennicka A. 2005. Antyoksydanty – skuteczna broń przeciw
wolnym rodnikom. Polskie Drobiarstwo:12, 40 – 44.
31. Szczypka M. 1997. Wolne rodniki i obrona antyoksydacyjna – udział
czynników dietetycznych. Przemysł Spożywczy: 4,16- 18.
32. Wójcik – Przybyłko E. 1997. Rola witamin w usuwaniu skutków działania
aktywnych form tlenu a organizm zwierzęcy. Nowa weterynaria:4, 32 – 37.
33. Wójcik – Przybyłko E., Dębski B. 1998. Zapobieganie skutkom działania
wolnych rodników w paszach dla zwierząt. Magazyn Weterynaryjny:1 (33),
26– 28.
34. Zięba R. 2007. Karnozyna – aktywność biologiczna i perspektywy
zastosowania w farmakoterapii. Wiadomości Zielarskie; 1- 2, 73 – 79.
35. Norma PN-92A-86521
36. www.elemiah.pl/homo1.php
58
Tab. 1 Zdolność do zmiatania syntetycznego kationorodnika ABTS przez składniki wybranych mięśni pozyskanych z tuszki
kurczęcej w czasie przechowywania zamrażalniczego
Element tuszki drobiowej
Mi
ęś
nie
skrzydła
Mi
ęś
nie piersiowe
zewn
ę
trzne
Mi
ęś
nie piersiowe
wewn
ę
trzne
Mi
ęś
nie
podudzia
Mi
ęś
nie
ud
Mi
ęś
nie cz
ęś
ci
grzbietowej
0
21,34 c d
21,05 b c d
21,58 c d
21,53 c d
21,36 c d
21,05 b c d
30 23,04 d
19,94 b c
21,20 b c d
21,80 c d
20,33 b c
22,08 c d
60
22,11 c d
18,84 b
20,22 b c
20,36 b c
21,60 c d
19,94 b c
D
z
ie
ń
p
rz
e
c
h
o
w
y
w
a
n
ia
90
15,21 a
14,90 a
14,27 a
14,36 a
15,84 a
15,67 a
a, b, c, d - wystąpienie wspólnej litery przy indeksach średnich oznacza brak statystycznie istotnej różnicy przy p ≤ 0,05
ilość powtórzeń n = 9
59
Tab.2 Wieloczynnikowa analiza wariancji wyników oznaczenia zdolności do zmiatania syntetycznego kationorodnika ABTS
przez składniki wybranych mięśni tuszki kurczęcej w czasie przechowywania zamrażalniczego
Materiał
badawczy
Zmienno
ść
Warto
ść
F
Prawdopodobie
ń
stwo (p)
Dzie
ń
przechowywania
107,16
0,000
Rodzaj mi
ęś
nia
2,52
0,041
E
le
m
e
n
t
tu
s
z
k
i
d
ro
b
io
w
e
j
Interakcja dzie
ń
przechowywania x rodzaj
mi
ęś
nia
1,21
0,298
p≤0,05 – zależność istotna statystycznie

60
Tab. 3 Zdolność do zmiatania nie zredukowanego rodnika DPPH przez składniki wybranych mięśni pozyskanych z tuszki
kurczęcej w czasie przechowywania zamrażalniczego
Element tuszki drobiowej
Mi
ęś
nie
skrzydła
Mi
ęś
nie
piersiowe zewn
ę
trzne
Mi
ęś
nie
piersiowe wewn
ę
trzne
Mi
ęś
nie
podudzia
Mi
ęś
nie
ud
Mi
ęś
nie
cz
ęś
ci grzbietowa
0
0,58 a
0,61 a
0,63 a b
0,66 a b
0,65 a b
0,65 a b
30
0,83 c d e
0,81 c d
0,81 c d
0,75 b c
0,79 c d
0,75 b c
60
0,83 c d e
0,83 c d e
0,82 c d
0,83 c d e
0,81 c d
0,81 c d
D
z
ie
ń
p
rz
e
c
h
o
w
y
w
a
n
ia
90
0,89 c d e f
0,97 f
0,98 f
0,93 d e f
0,82 c d
0,96 e f
a, b, c, d, e, f - wystąpienie wspólnej litery przy indeksach średnich oznacza brak statystycznie istotnej różnicy przy p ≤ 0,05
ilość powtórzeń n = 9
61
Tab.4 Wieloczynnikowa analiza wariancji wyników oznaczenia zdolności do zmiatania niezredukowanego rodnika DPPH
przez składniki wybranych mięśni tuszki kurczęcej w czasie przechowywania zamrażalniczego
Materiał
badawczy
Zmienno
ść
Warto
ść
F
Prawdopodobie
ń
stwo (p)
Dzie
ń
przechowywania
50,237
0,000
Rodzaj mi
ęś
nia
0,474
0,793
E
le
m
e
n
t
tu
s
z
k
i
d
ro
b
io
w
e
j
Interakcja dzie
ń
przechowywania x rodzaj
mi
ęś
nia
0,988
0,482
p≤0,05 – zależność istotna statystycznie
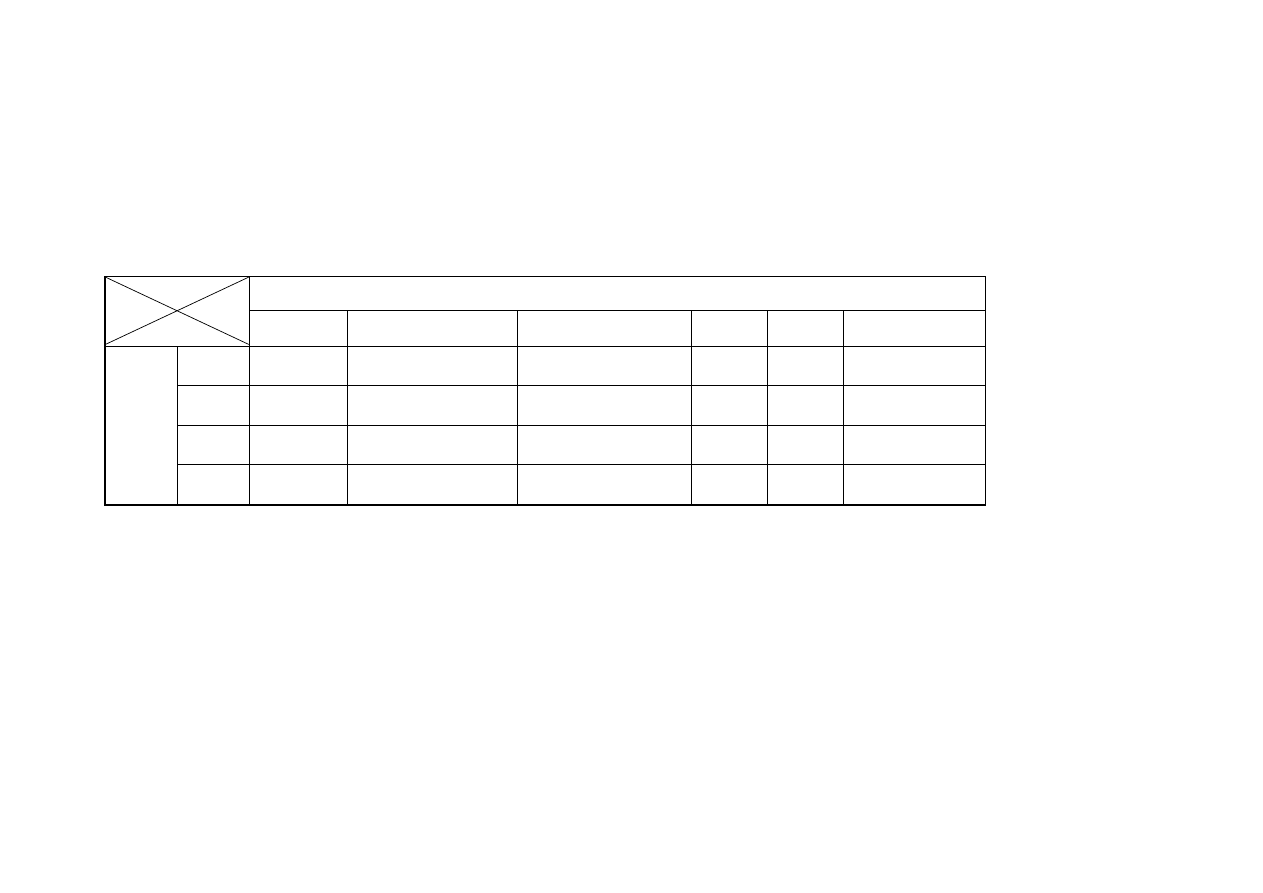
62
Tab. 5 Ilość substancji reagujących z kwasem 2-tiobatbiturowym w zależności od rodzaju mięśnia i dnia przechowywania
zamrażalniczego
Element tuszki drobiowej
Mi
ęś
nie
skrzydła
Mi
ęś
nie
piersiowe zewn
ę
trzne
Mi
ęś
nie
piersiowe wewn
ę
trzne
Mi
ęś
nie
podudzia
Mi
ęś
nie
ud
Mi
ęś
nie
cz
ęś
ci grzbietowa
0 29,42 d e f g
16,93 a
16,06 a
58,72 j 32,15 f g
25,00 c d
30 30,31 e f g
18,81 a b
16,48 a
67,96 k 41,21 h
27,66 d e f
60 33,87 g
19,12 a b
19,33 a b
75,00 ł l 50,24 i
29,45 d e f g
D
z
ie
ń
p
rz
e
c
h
o
w
y
w
a
n
ia
90 42,33 h
21,75 b c
26,06 c d e
78,75 ł 73,36 k
54,60 j
a, b, c, d, e, f, g, h, i, j, k, l, ł - wystąpienie wspólnej litery przy indeksach średnich oznacza brak statystycznie istotnej różnicy przy
p ≤ 0,05
ilość powtórzeń n = 9
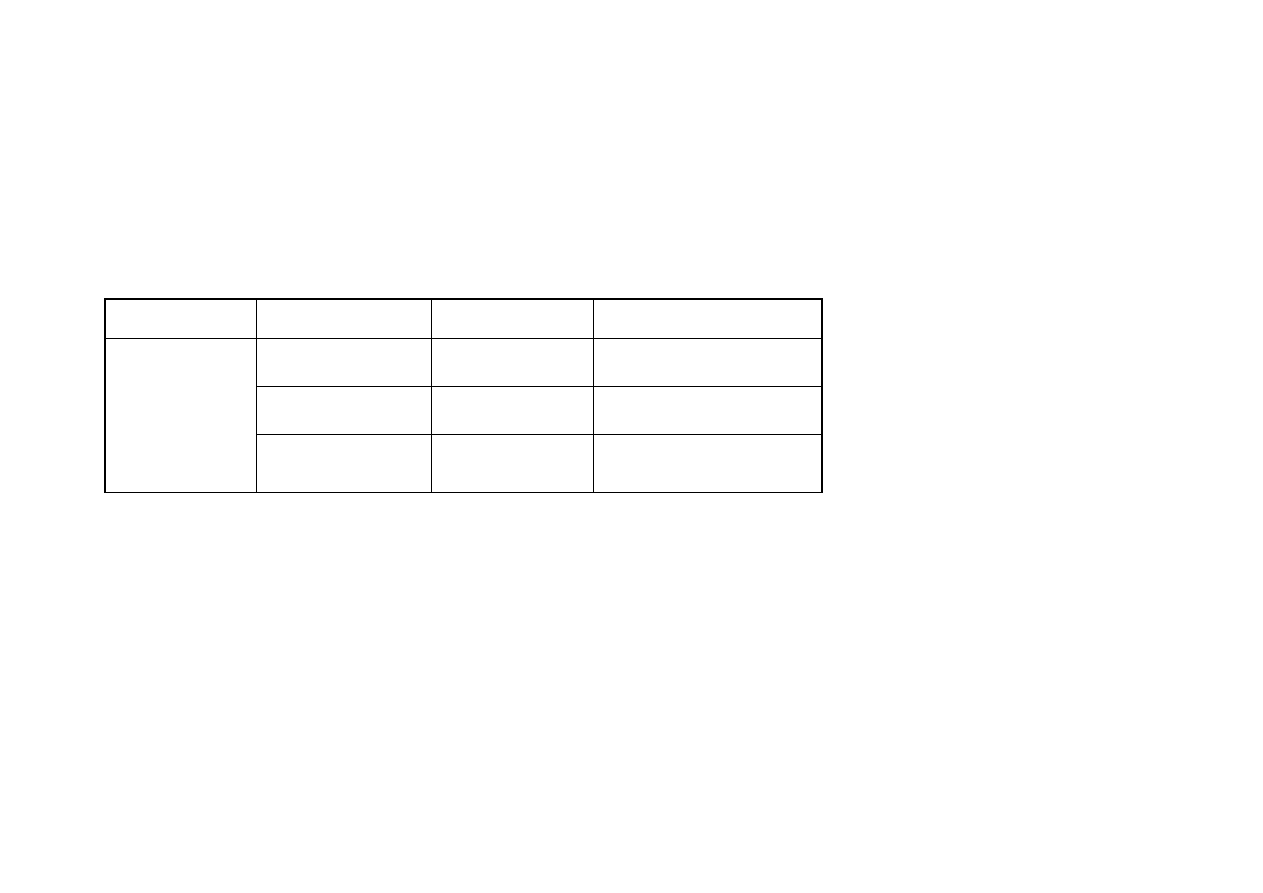
63
Tab.6 Wieloczynnikowa analiza wariancji wyników oznaczenia ilość substancji reagujących z kwasem 2-tiobatbiturowym w
czasie przechowywania zamrażalniczego
Materiał badawczy
Zmienno
ść
Warto
ść
F
Prawdopodobie
ń
stwo (p)
Dzie
ń
przechowywania
203,84
0,000
Rodzaj mi
ęś
nia
704,38
0,000
E
le
m
e
n
t
tu
s
z
k
i
d
ro
b
io
w
e
j
Interakcja dzie
ń
przechowywania x rodzaj
mi
ęś
nia
18,97
0,000
p≤0,05 – zależność istotna statystycznie
64
Wykres 1. Zdolność do zmiatania syntetycznego kationorodnika ABTS przez składniki wybranych mięśni pozyskiwaych z
tuszki kurcząt w czasie przechowywania zamrażalniczego
0
5
10
15
20
25
Il
o
ś
ć
s
y
n
te
ty
c
z
n
e
g
o
ro
d
n
ik
a
A
B
T
S
u
g
T
ro
lo
x
u
/g
0
30
60
90
Dzie
ń
przechowywania zamra
ż
alniczego
Zdolno
ść
do zmiatania syntetycznego kationorodnika ABTS przez składniki
wybranych mi
ęś
ni pozyskanych z tuszki kurcz
ą
t w czasie przechowywania
zamra
ż
alniczego
Skrzydło
Filet z piersi
Filet z piersi gł
ę
bokiej
Podudzie
Udo
Cz
ęść
grzbietowa
65
Wykres 2. Zdolność do zmiatania niezredukowanego rodnika DPPH przez składniki wybranych mięśni pozyskiwaych z tuszki
kurczęcej w czasie przechowywania zamrażalniczego
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1
Il
o
s
c
n
ie
z
re
d
u
k
o
w
a
n
e
g
o
r
o
d
n
ik
a
D
P
P
H
u
g
T
ro
lo
x
u
/g
0
30
60
90
Dzie
ń
przechowywania zamra
ż
alniczego
Zdolno
ść
do zmiatania niezredukowanego rodnika DPPH przez składniki
wybranych mi
ęś
ni pozyskanych z tuszki kurcz
ę
cej w czasie
przechowywania zamra
ż
alniczego
Skrzydło
Filet z piersi
Filet z piersi gł
ę
bokiej
Podudzie
Udo
Cz
ęść
grzbietowa
66
Wykres 3. Zależność ilości substancji zawartych w wybranych mięśniach tuszki kurczęcej reagujących z kwasem 2-
tiobarbiturowym w czasie przechowywania zamrażalniczego
0
10
20
30
40
50
60
70
80
Il
o
ś
ć
s
u
b
s
ta
n
c
ji
re
a
g
u
ja
c
y
c
h
z
T
B
A
R
S
u
g
M
D
A
/
g
m
i
ę
ś
n
ia
0
30
60
90
Dzie
ń
przechowywania zamra
ż
alniczego
Zale
ż
no
ść
ilo
ś
ci substancji zawatrych w wybranych mi
ęś
niach tuszki
kurcz
ę
cej reaguj
ą
cych z kwasem 2-tiobarbiturowym w czasie
przechowywania zamra
ż
alniczego
Skrzydło
Filet z piersi
Filet z piersi gł
ę
bokiej
Podudzie
Udo
Cz
ęść
grzbietowa
Wyszukiwarka
Podobne podstrony:
Najlepsza przyprawa o właściwościach przeciwnowotworowych, ZDROWIE-Medycyna naturalna, Poczta Zdrowi
Zakres kompetencji jednostek praca właściwa
Zakres kompetencji jednostek praca właściwaa
Praca zmianowa przeciwwskazania
WYBRANE MIĘŚNIE KOŃCZYNY GÓRNEJ
Właściwości i dawkowanie wybranych leków stosowanych u dzieci w stanie zagrożenia życia, Medycyna ra
Mięśnie kurczą się powodując ruch, Materiały naukowe z różnych dziedzin, Fizjologia człowieka
Praca własna atrofia i hipertrofia mięśniowa, fizjoterapia, FIZJOTERAPIA, III SEMESTR, Fizjologia, F
Najlepsza przyprawa o właściwościach przeciwnowotworowych, ZDROWIE-Medycyna naturalna, Poczta Zdrowi
praca właściwa
GOTOWA PRACA ochrona przeciw porazeniowa warunki szcególnego zagrożenia
Terapia zajęciowa Aneta Habowska Krzyżanowska poprawiana praca wlasciwa
Wybrane zagadnienia z fizjologii mięśni i fizyczne właściwości mięśni, Biomechanika
Wybrane zagadnienia z fizjologii mięśni i fizyczne właściwości mięśni, Biomechanika
właściwości białek mięśniowych
8 Właściwa Praca, moc, energia całość
więcej podobnych podstron