
IX
KINETYKA CHEMICZNA
Hydroliza octanu etylu w środowisku alkalicznym
1. Cel ćwiczenia
Wyznaczanie stałej szybkości reakcji przebiegającej zgodnie z równaniem :
CH
3
COOC
2
H
5
+OH
-
=CH
3
COO
-
+C
2
H
5
OH
Jest to reakcja drugiego rzędu i odpowiada jej następujące równanie kinetyczne:
gdzie: k-stała szybkości reakcji, a-początkowe stężenie NaOH, b-
początkowe stężenie estru, x-stężenie produktu po czasie t.
2. Wykonanie ćwiczenia
1) Do 6 elenmajerek wlać pipetą po 10 cm
3
0,05 M HCl i zamknąć korkiem.
2) Otrzymany w kolbce miarowej o objętości 100 cm
3
ester-przelać do kolby miarowej o
objętości 250 cm
3
. Następnie przepłukać kolbę po estrze (100 cm
3
) trzykrotnie małą
ilością wody i dołączyć wodę powstałą z płukania do kolby z estrem (250 cm
3
).
Analogicznie postąpić z 0,04 M NaOH (w kolbce miarowej o objętości 100 cm
3
).
UWAGA: nie zmieniamy kolejności.
Kolbę zawierającą reagującą mieszaninę dopełnić wodą do kreski. Za początek
reakcji (t=0) przyjąć moment przelania roztworu NaOH do kolby z estrem (przed
przepłukaniem kolbki).
3) Po 3 minutach pobrać pipetą 25 cm
3
badanej mieszaniny i wlać do kolby z kwasem,
który zahamuje dalszy przebieg reakcji. Nadmiar kwasu odmiareczkować 0,04 M
NaOH wobec fenoftaleiny.
4) Dalsze próbki pobierać po 5, 10, 15, 30 oraz po 45 minutach od chwili
zapoczątkowania reakcji postępować analogicznie jak w punkcie 3).
3. Opracowanie wyników
1) Obliczyć początkowe stężenie reagentów:
a – początkowe stężenie NaOH w mieszaninie reakcyjnej: 0,04∙100=a∙250;
b - początkowe stężenie estru w mieszaninie reakcyjnej obliczyć analogicznie.
2) Obliczyć stężenie produktu(x) po czasie t
Przykład obliczenia:
Po czasie t na zobojętnianie kwasu solnego zużyto 6,4 cm
3
0,04 M NaOH.
6,4∙0,04=0,05∙V,
stąd V=5,12 cm
3
(nadmiar kwasu), a 10 - 5,12 = 4,88 cm
3
objętość kwasu, która
przereagowała
4,88∙0,05=25∙(a-x)
a-x =0,00916 (stężenie w mieszaninie reakcyjnej), stąd x = a-0,00916 = 0,00684.

3) Zestawić wyniki pomiarów w tabeli
4) Wykreślić
(
)
jako funkcję czasu t. Z wykresu wyznaczyć współczynnik
kierunkowy otrzymanej prostej, następnie obliczyć stałą szybkości reakcji.
Zakres wymaganych wiadomości:
Szybkość reakcji chemicznej (stała szybkości, rząd reakcji).
Równania kinetyczne reakcji 1 i 2 rzędu.
Równania kinetyczne reakcji zmydlania octanu etylu i jego rozwiązanie.
Sposoby wyznaczania stałej szybkości reakcji.
Energia aktywacji i eksperymentalne sposoby jej wyznaczania.
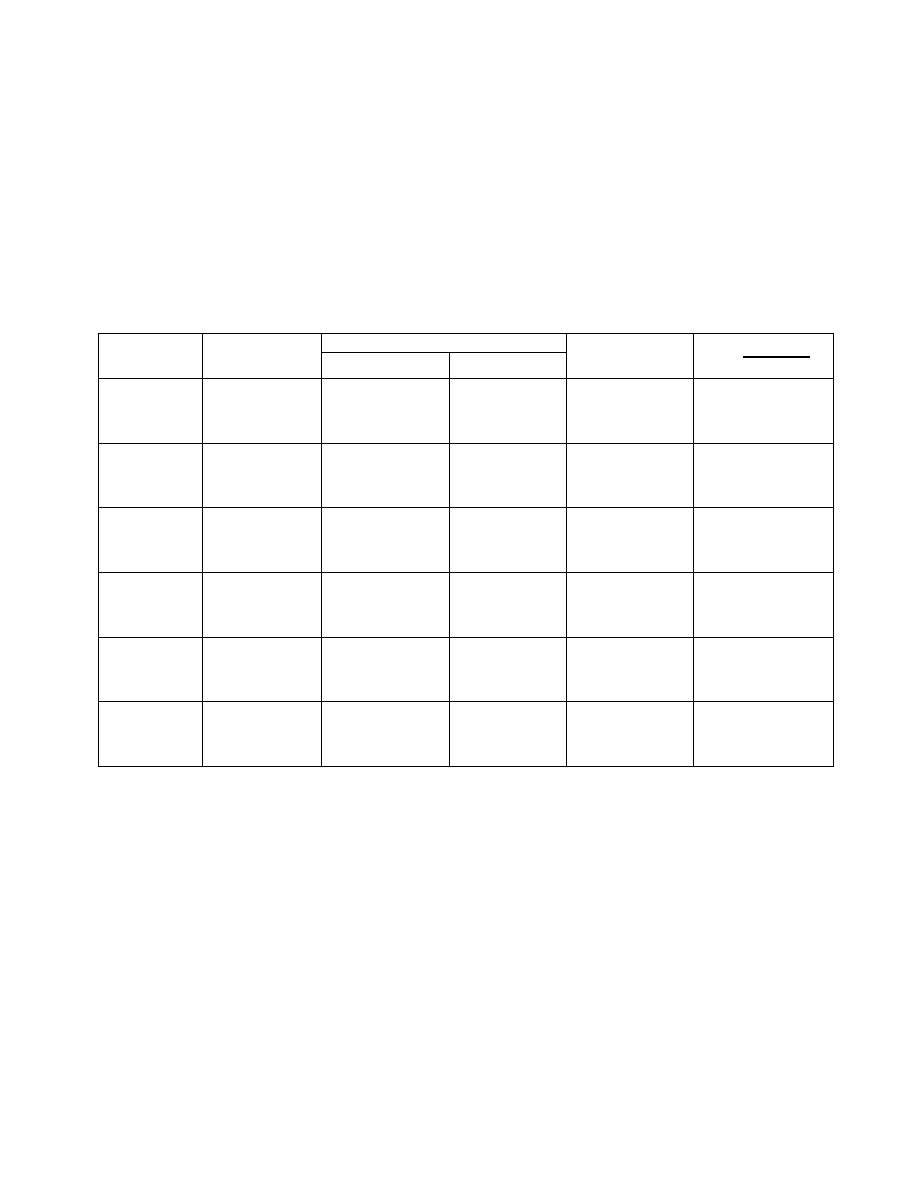
Nazwisko Imię ………………..
data ……………
Kierunek ………………………
grupa …………………………..
zespół ………………………….
ćwiczenie IX
KINEMATYKA CHEMICZNA
Hydroliza octanu etylu w środowisku alkalicznym
Zestawienie wyników pomiaru
Czas [min]
V
NaOH
[cm
3
]
Początkowe stężenia
x
(
)
NaOH
(stała a)
Ester
(stała b)
3
5
10
15
30
45
Wyszukiwarka
Podobne podstrony:
KINETYKA wykladI id 235063 Nieznany
kinetyka chemiczna id 235068 Nieznany
Kinetyka wyklad3 id 235062 Nieznany
Kinetyka 021 id 535402 Nieznany
Zestaw IX id 588412 Nieznany
Kinetyka 011 id 535401 Nieznany
kinetyka 5 11 2010 id 235066 Nieznany
4 Kinetyka id 37668 Nieznany (2)
7 Kinetyka id 44885 Nieznany (2)
kinetyka id 235057 Nieznany
kinetyka 2 id 235060 Nieznany
CHEMIA VIII Kinetyka reakcji id Nieznany
kinetyka 5 11 2010 id 235066 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
więcej podobnych podstron