
METALE i PÓŁPRZEWODNIKI
O właściwościach elektrycznych metali decydują
zdelokalizowane elektrony walencyjne s i p,
a
w
przypadku
metali przejściowych
(tj.
pierwiastków rodzin bloku d) również elektrony d.
W bardzo niskich temperaturach, zwykle rzędu
kilku
K,
niektóre
metale
osiągają
stan
nadprzewodnictwa, gdyż ich oporność elektryczna
skokowo maleje praktycznie do zera. Zachowanie się
i właściwości fizyczne metali oraz innych ciał stałych
o
strukturze
krystalicznej
można
wyjaśnić
posługując się modelem pasmowym ciała stałego.
Stan
kwantowo-mechaniczny
elektronów
walencyjnych atomów w krystalicznej fazie stałej
różni się zasadniczo w porównaniu z ich stanem
w swobodnych izolowanych atomach. W izolowanym
atomie orbitalom s, p i d odpowiadają określone
poziomy energii. Jeśli pewna liczba atomów, np.
dwa, trzy, .... , N, zbliży się do siebie na odległości
porównywalne z ich wymiarami, to w wyniku dwu-,
trzy-, ..... , N-krotnego rozszczepienia poziomów
energetycznych odpowiednich orbitali pojawiają się
pasma energetyczne o określonej szerokości (rys. 1).
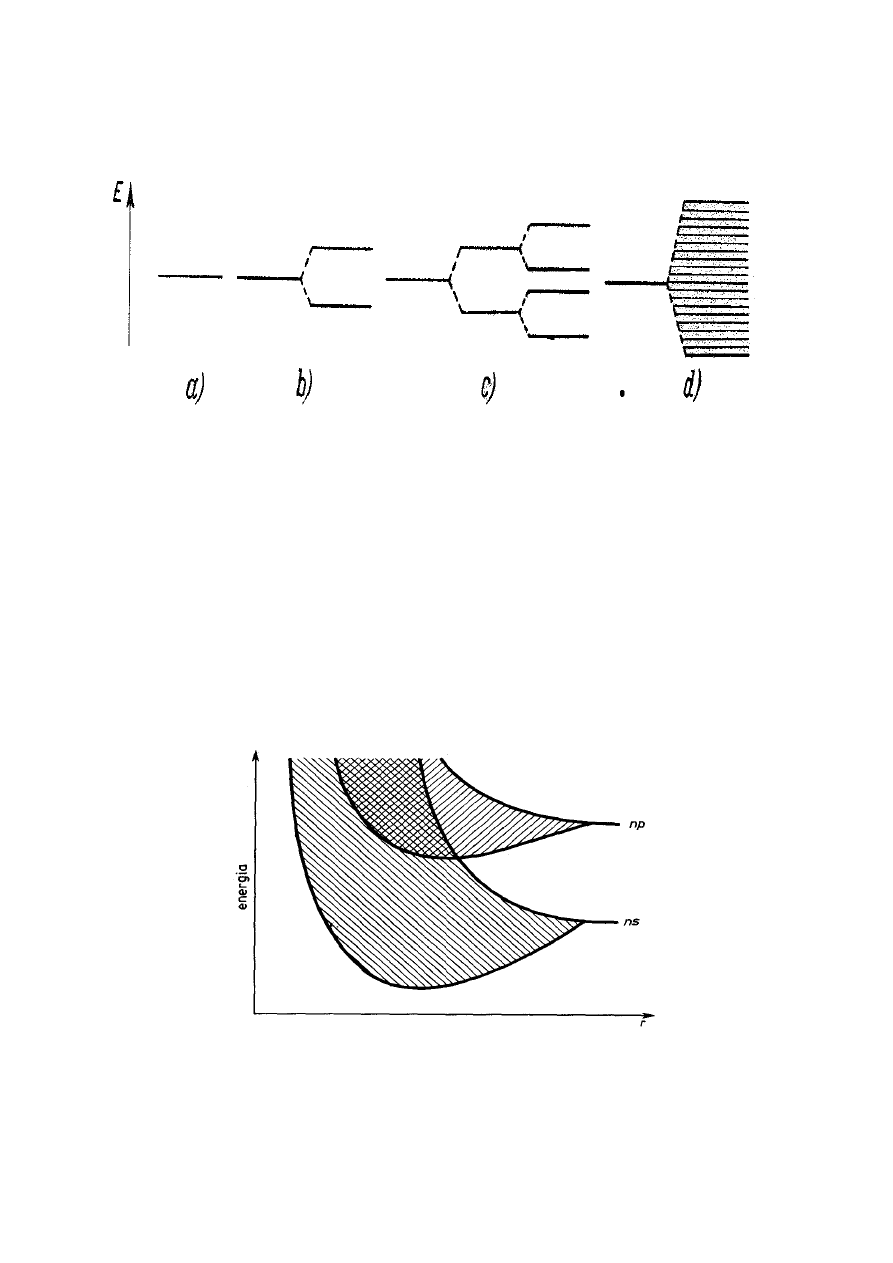
Rys. 1. Rozszczepienie poziomów energetycznych
a) poziom energetyczny nie rozszczepiony,
b) poziom rozszczepiony w przypadku dwu atomów,
c) poziom rozszczepiony w przypadku czterech atomów,
d)
to samo dla N atomów
W przypadku metali pasma energetyczne orbitali
ns i np w znacznym stopniu nakładają się na siebie
tak, jak to pokazano na rys. 2.
Rys. 2. Nakładanie się rozszczepionych poziomów energetycznych
orbitali ns i np
Poziomy o najniższej energii obsadzone przez
elektrony walencyjne N atomów metalu tworzą
pasmo podstawowe (walencyjne), natomiast łatwo
dostępne dla elektronów walencyjnych poziomy
energetyczne w obszarze nakładania się obydwu
pasm tworzą pasmo przewodnictwa.
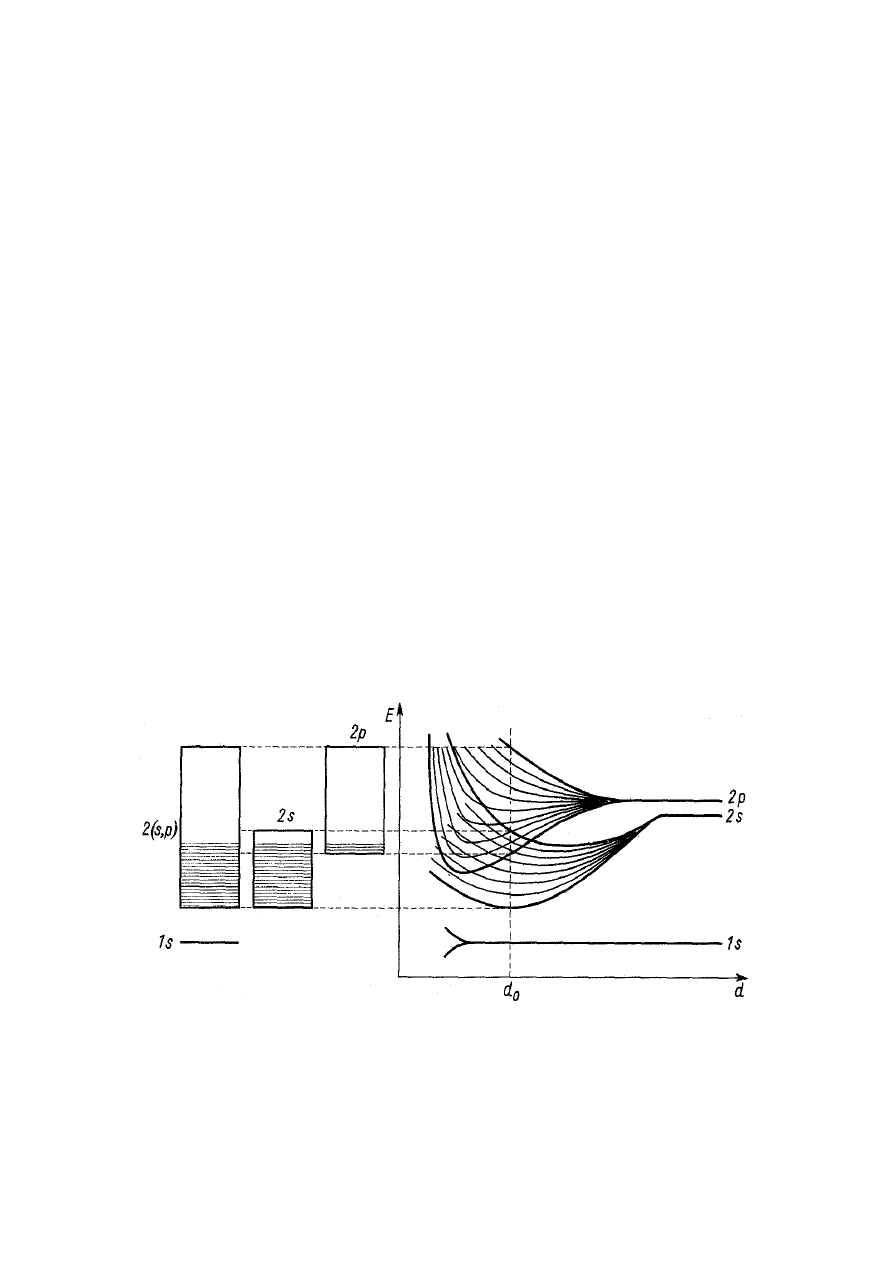
W taki właśnie sposób nakładają się na siebie
pasma energetyczne 2s i 2p berylu, którego
swobodne izolowane atomy mają wypełniony orbital
2s
2
(rys. 3). Dzięki temu elektrony walencyjne
atomów berylu mają udostępnione poziomy
energetyczne nieco wyżej położonego pasma 2p
i w ten sposób stają się swobodnymi elektronami
przewodnictwa.
Rys. 3. Nakładanie się pasm 2s i 2p berylu
W podobny sposób nakładają się na siebie poziomy
energetyczne rozszczepionych orbitali ns i (n-1)d
tworząc pasmo podstawowe (walencyjne) i pasmo
przewodnictwa u metali przejściowych.
U
innych
substancji
krystalicznych
rozszczepione poziomy energetyczne orbitali ns i np
lub ns i (n-1)d nie nakładają się na siebie, ponieważ
odpowiednie pasma oddziela odstęp energetyczny
zwany pasmem wzbronionym.
Jeśli pasmo wzbronione jest dostatecznie wąskie,
to energia termiczna elektronów wystarcza do
przeskoku z pasma podstawowego do pustego pasma
przewodnictwa.
Liczba
tak
promowanych
elektronów przewodnictwa wzrasta ze wzrostem
temperatury.
Taką
zależność
temperaturową
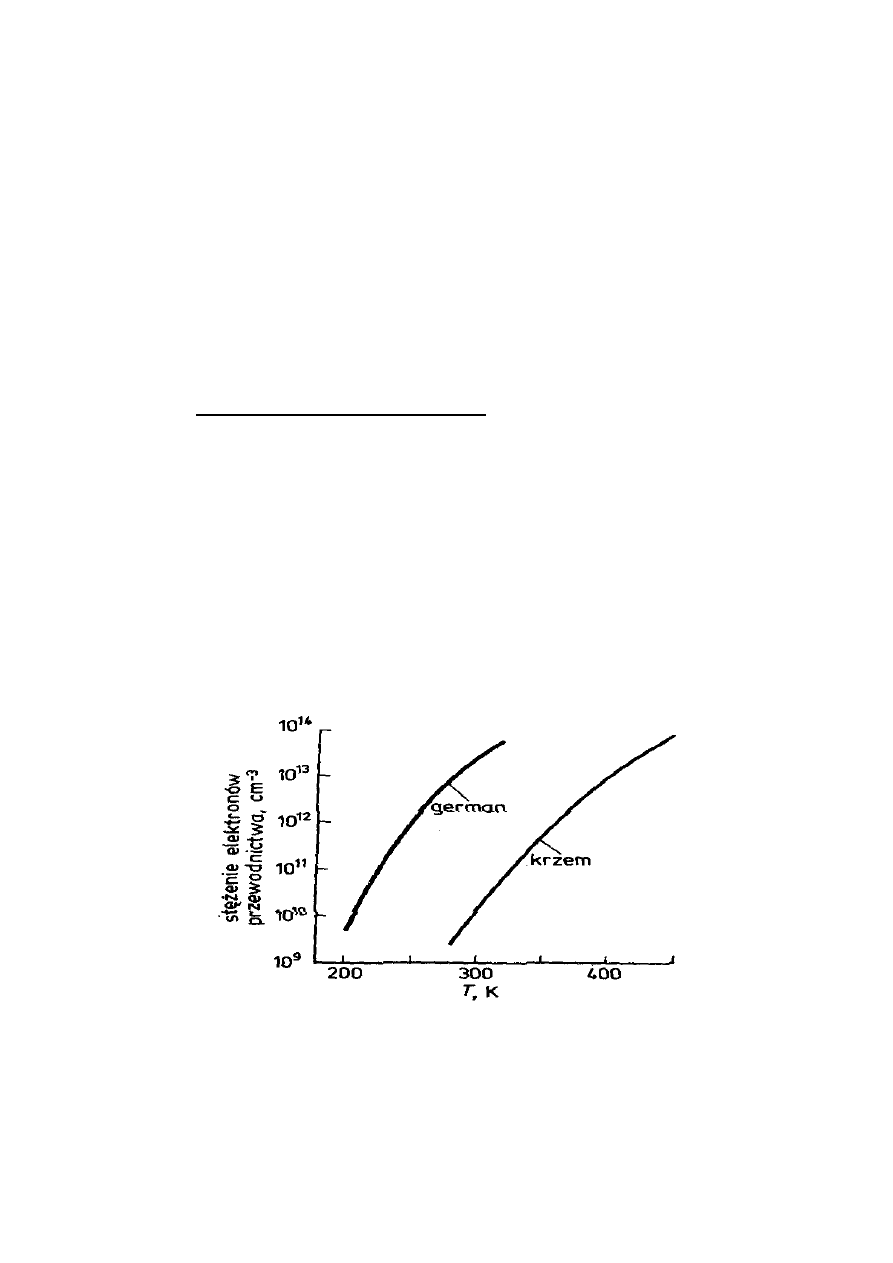
przewodnictwa wykazują półprzewodniki samoistne,
np. german i krzem.
Rys. 4. Zależność stężenia elektronów przewodnictwa od
temperatury dla krzemu i germanu
Gdy pasmo wzbronione jest bardzo szerokie,
wówczas
przeskok
elektronów
z
pasma
podstawowego
do
pasma
przewodnictwa jest
praktycznie niemożliwy, ponieważ wymagałoby to
bardzo dużego nakładu energii. Z tego powodu
substancja
krystaliczna
jako
dielektryk
nie
przewodzi prądu elektrycznego.
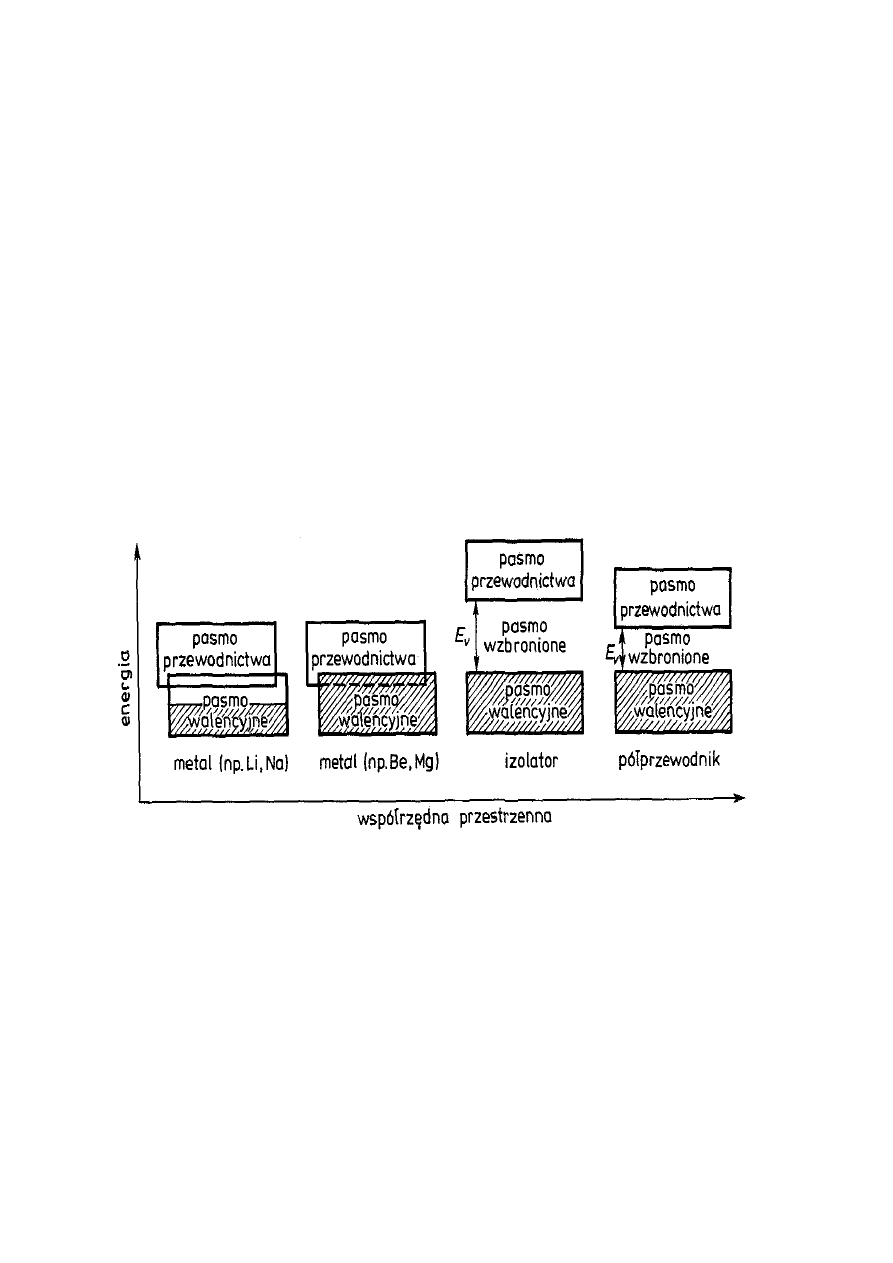
Różnice
między
metalami,
dielektrykami
(izolatorami) i półprzewodnikami można jakościowo
przedstawić w sposób pokazany na rys. 5.
Rys. 5. Układ pasm podstawowego (walencyjnego) i pasma
przewodnictwa u metali oraz rozdzielenie tych pasm pasmem
wzbronionym w dielektrykach (izolatorach) i półprzewodnikach
samoistnych

Zasadnicza
różnica
między
metalem
a
półprzewodnikiem
polega
na
tym,
że
w półprzewodniku liczba elektronów przewodnictwa
zależy od temperatury (rys. 5), natomiast w metalu
pozostaje praktycznie stała. Półprzewodniki mają
ujemny współczynnik temperaturowy oporności
elektrycznej. W temperaturze 0 K półprzewodniki
stają się izolatorami, natomiast metale wykazują
najmniejszą oporność elektryczną.
Rys. 6. Stężenie elektronów przewodnictwa u metali, metaloidów
i półprzewodników samoistnych w temperaturze pokojowej
Dodatkowa różnica polega na tym, że najlepsze
przewodnictwo mają metale w stanie czystym,
natomiast
różne
domieszki
zwiększają
przewodnictwo półprzewodników.
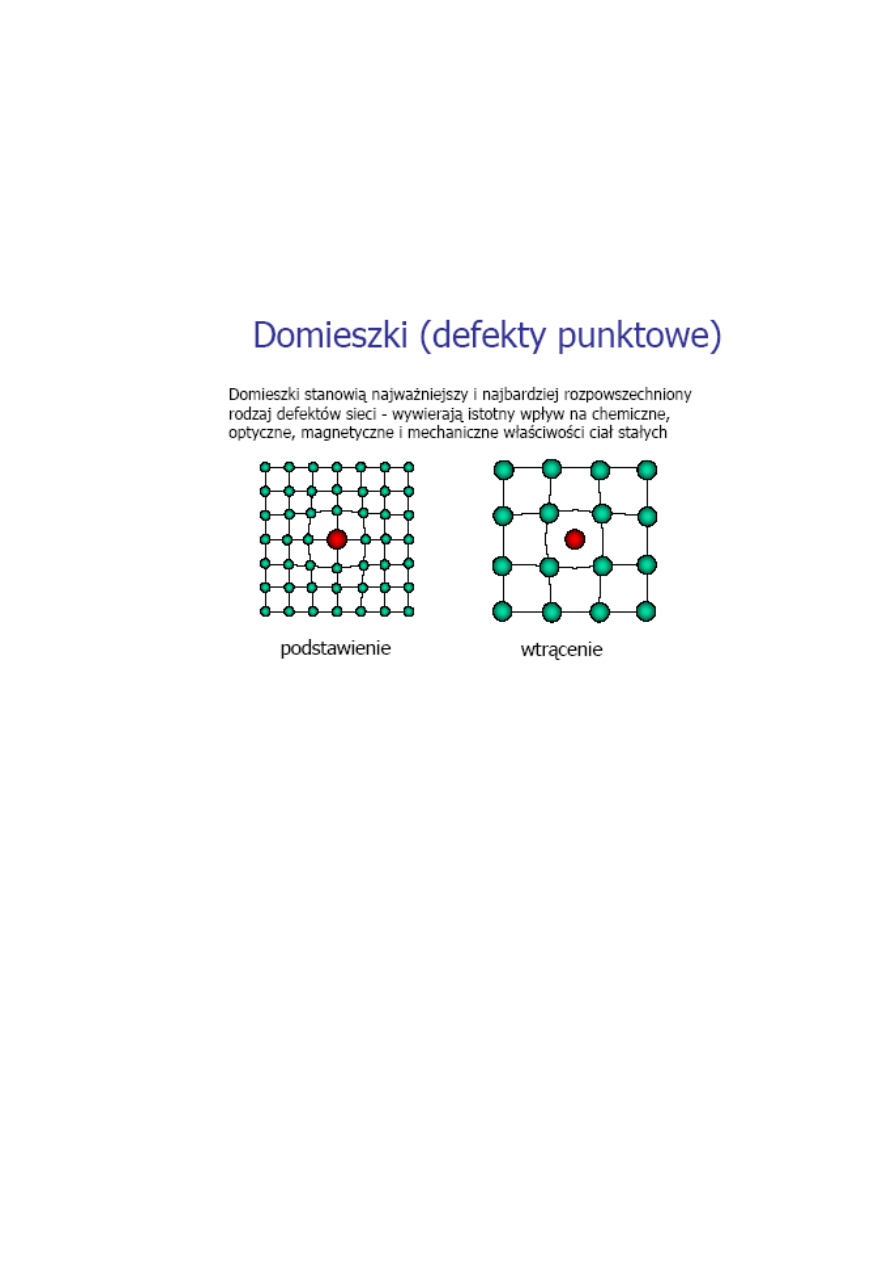
Rys. 7. Typy defektów sieci spowodowane domieszkowaniem
Jeżeli
do
macierzystego
półprzewodnika,
wprowadzi się domieszkę, której atomy mają więcej
elektronów walencyjnych od atomów macierzystych,
wówczas domieszka działa jak donor elektronów,
łatwo oddawanych do pasma przewodnictwa.
Uzyskuje się w ten sposób półprzewodnik typu n,
zwany także półprzewodnikiem nadmiarowym.
Przykładem półprzewodnika typu n jest german
domieszkowany arsenem
Jeżeli
do
półprzewodnika
wprowadzimy
domieszkę, której atomy mają mniej elektronów
walencyjnych od atomów macierzystych, to
domieszka będzie działać jako akceptor elektronów
pochodzących z pasma podstawowego, w którym
pojawią się wolne poziomy energetyczne, tzw.
dziury elektronowe, przewodzące prąd elektryczny
w przeciwnym kierunku niż elektrony. Uzyskuje się
w ten sposób półprzewodnik typu p, określany
również mianem półprzewodnika niedomiarowego.
Przykładem takiego półprzewodnika jest german
domieszkowany indem.
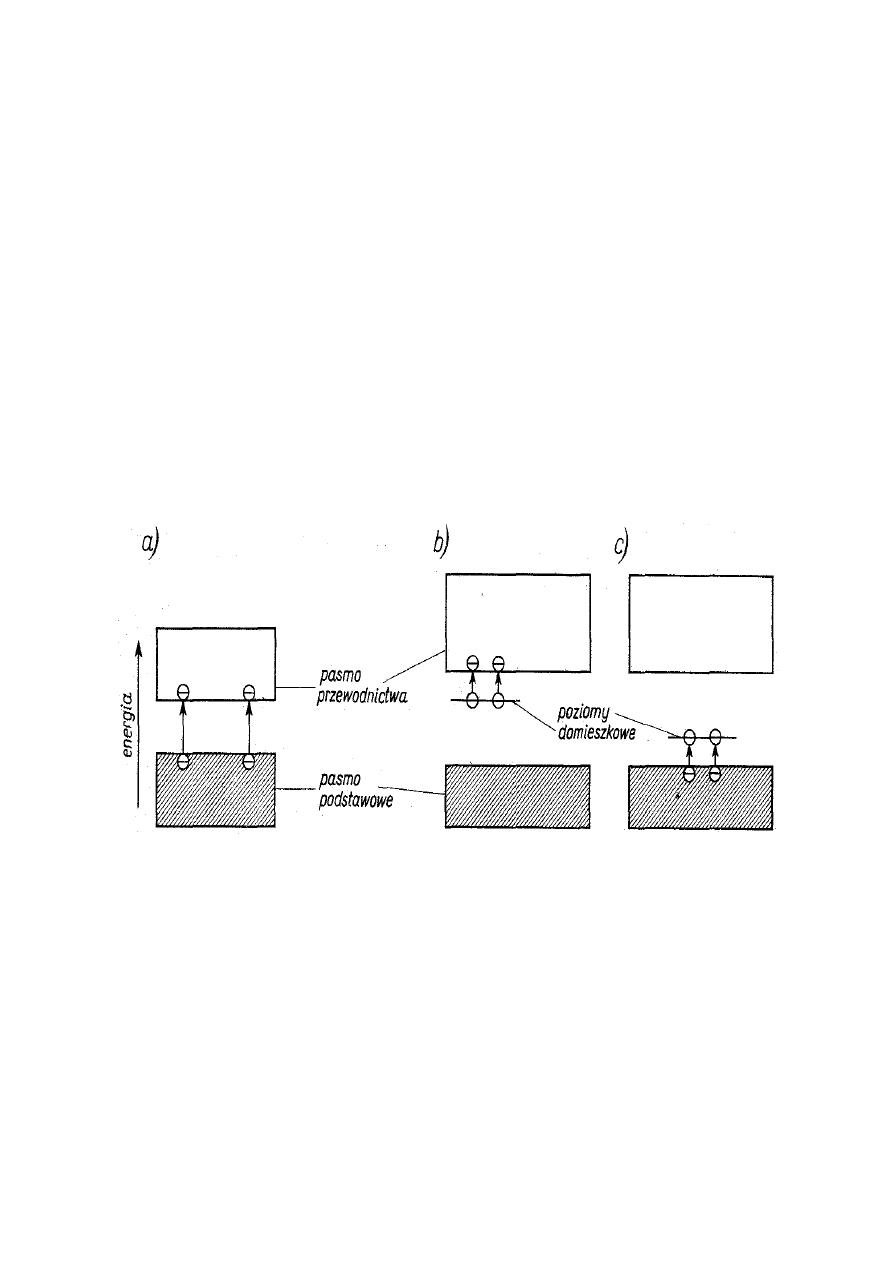
Rys. 8. Układ pasm w półprzewodnikach
a) półprzewodnik samoistny, b) półprzewodnik
domieszkowy typu n, c) półprzewodnik domieszkowy typu p
W
kryształach
omówionych
dotychczas
półprzewodników istotną rolę odgrywa wiązanie
kowalencyjne.
Właściwości
półprzewodnikowe

wykazują
również
liczne
związki
chemiczne
o charakterze jonowym, które formalnie powinny być
dielektrykami (izolatorami). Przyczyną wystąpienia
półprzewodnictwa u tych związków są bardzo
niewielkie odchylenia od idealnej stechiometrii oraz
wynikające stąd defekty struktury krystalicznej.
Substancje wykazujące nawet bardzo niewielkie
odstępstwa od stechiometrii nazywamy bertolidami.
Związki z nadmiarem jonów metalu, np. ZnO,
CdO, CdS, SnO
2
, TiO
2
, Ag
2
S, wykazują defekt Frenkla,
tzn. nadmiarowe jony metalu muszą znaleźć się w
przestrzeniach międzywęzłowych, ponieważ wszystkie
węzły sieci kryształu są już obsadzone. Nadmiarowy
dodatni ładunek kationów jest kompensowany przez
równoważną ilość mobilnych elektronów, co w
konsekwencji
powoduje, że rozważane związki
zachowują się jak półprzewodniki nadmiarowe.
Związki z niedomiarem jonów metalu, np. Cu
2
O,
SnS, FeO, CoO, NiO, wykazują defekt Schottky’ego,
tzn. niektóre węzły w sieci kryształu są puste.
Przewodnictwo tej grupy związków ma charakter
„dziurowy” i w rezultacie są one półprzewodnikami
niedomiarowymi.
Zaistnienie
takiego
rodzaju
przewodnictwa jest uwarunkowane zdolnością metalu
do tworzenia kationów na dwóch różnych stopniach
utlenienia, np. Cu
+
i Cu
2+
, Sn
2+
i Sn
4+
, Fe
2+
i Fe
3+
, Co
2+
Co
3+
, Ni
2+
i Ni
3+
, itp.
Tlenek cynku może wykazywać nieznaczny
niedobór jonów tlenkowych O
2–
, lub co jest
jednoznaczne, pewien nadmiar jonów metalu,
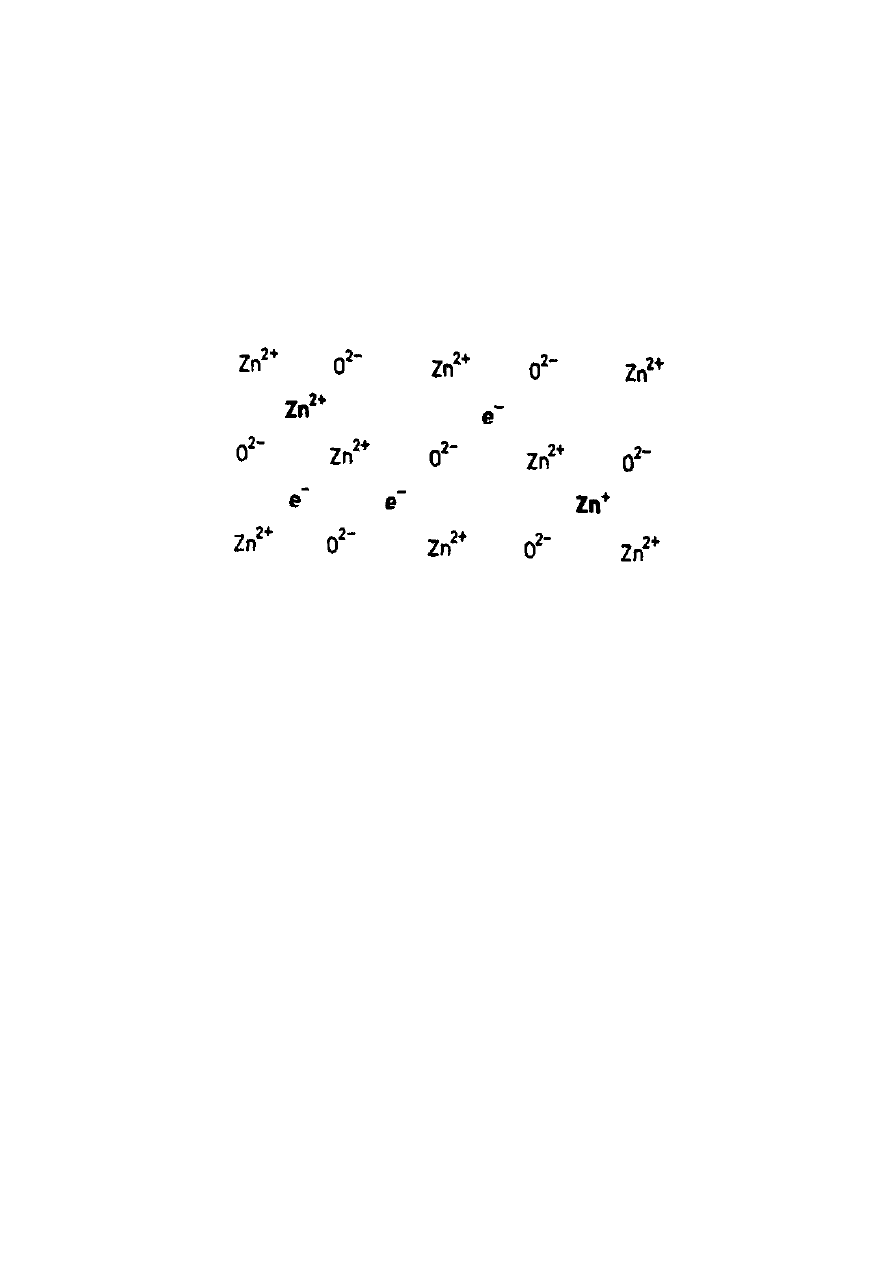
w wyniku czego jego skład nie odpowiada formule
ZnO, ale np. Zn
1,00
O
0,99
. Z tego powodu nadmiarowe
kationy cynku muszą się znaleźć w przestrzeniach
międzywęzłowych, a wraz z nimi równoważna liczba
elektronów, co wynika z warunku elektroobojętności
kryształu.
Rys. 9. Dwuwymiarowy model defektów sieciowych dla tlenku
cynku
W zewnętrznym polu elektrycznym elektrony
znajdujące się w przestrzeniach międzywęzłowych
kryształu tlenku cynku są mobilne, dlatego tlenek
ten jest półprzewodnikiem typu n.
Komórka
elementarna
stechiometrycznego
tlenku miedzi(I), Cu
2
O, krystalizującego w układzie
regularnym (rys. 10) zawiera cztery atomy miedzi
i dwa atomy tlenu.
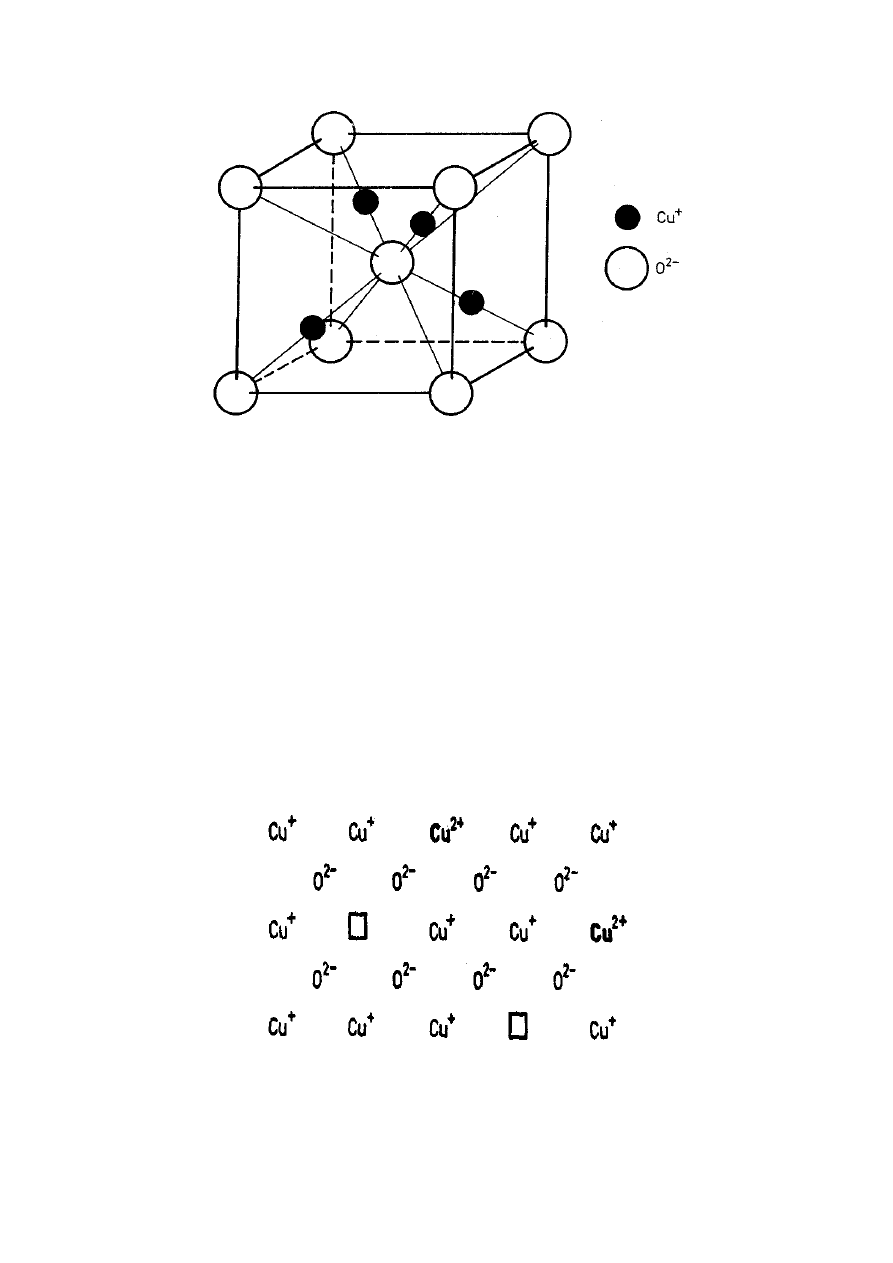
Rys. 9. Komórka elementarna Cu
2
O
Okazuje się jednak, że tlenek miedzi(I) może
wykazywać nieznaczny niedobór atomów metalu
i z tego powodu nie odpowiada idealnej stechiometrii
Cu
2
O. Gdy aktualny skład tlenku miedzi(I)
odpowiada formule Cu
1,99
O
1,00
, to na każdy tysiąc
jonów tlenkowych O
2–
przypada 1980 kationów Cu
+
oraz 10 kationów Cu
2+
, a 10 miejsc obsadzanych
w idealnej sieci krystalicznej przez kationy pozostaje
puste.
□
puste, nie obsadzone miejsce w sieci
Rys. 11. Dwuwymiarowy model defektów sieciowych u tlenku
miedzi(I)

Tlenek miedzi(I) jest półprzewodnikiem typu p,
ponieważ kationy Cu
2+
zachowują się jak dziura
elektronowa, która w wyniku przeskoku elektronu
z sąsiedniego kationu Cu
+
przenoszona jest
w przeciwnym kierunku:
Cu
+
+ Cu
2+
→ Cu
2+
+ Cu+
└─e─┘
W zewnętrznym polu elektrycznym proces ten się
powtarza i dziura elektronowa przemieszcza się
w kierunku przeciwnym do ruchu elektronów.
Wyszukiwarka
Podobne podstrony:
TEORIA PASMOWA CIAŁA STAŁEGO, Fizyka
5 Teoria pasmowa ciała stałego
Leszek wyklad9 teoria pasmowa ciala stalego
Wykład 5. Teoria pasmowa ciała stałego
WYK 5 Teoria pasmowa ciala stalego
Wykład 5 Teoria pasmowa ciała stałego
MODEL PASMOWY CIAŁA STAŁEGO
F-6 Model pasmowy ciała stałego
F 6 Model pasmowy ciała stałego
4 Budowa ciala stalego id 3714 Nieznany
04b BUDOWA CIALA STALEGOid 53 Nieznany (2)
Fizyka Ciala Stalego II id 1766 Nieznany
TEORIA fizyka rok 1, Studia, Mibm, semestr II, Fizyka Ciała Stałego, Fizyka
4 Budowa ciala stalego id 3714 Nieznany
28 Zjawiska towarzyszące bombardowaniu ciała stałego elektro
II 14 Fizyka ciala stalego
Ciżman, fizyka ciała stałego L, sprawozdanie dwójłomność spontaniczna
więcej podobnych podstron