
Nowiny Lekarskie 2011, 80, 3, 167–173
PRACE ORYGINALNE
DOROTA SIKORSKA, KRZYSZTOF SCHWERMER, KRZYSZTOF HOPPE, DARIUSZ KRUPA, AGNIESZKA
SIMACHOWICZ-OLSZOWY, PRZEMYSŁAW KWIATKOWSKI, JAROSŁAW KAŁUŻNY, STANISŁAW CZEKAL-
SKI, KRZYSZTOF PAWLACZYK, ANDRZEJ OKO
PRZEKROJOWA OCENA ZWIĄZKU
MIĘDZY STADIUM PRZEWLEKŁEJ CHOROBY NEREK
I WYSTĘPOWANIEM ZESPOŁU NIEDOŻYWIENIE-ZAPALENIE-MIAŻDŻYCA
A WYBRANYMI WSKAŹNIKAMI ZMIAN W UKŁADZIE SERCOWO-NACZYNIOWYM
THE CROSS-SECTIONAL ANALYSIS OF THE RELATIONSHIP BETWEEN THE STAGE OF CHRONIC
KIDNEY DISEASE,THE INCIDENCE OF MALNUTRITION-INFLAMMATION-ATHEROSCLEROSIS (MIA)
SYNDROME, AND SELECTED INDICATORS OF LESIONS IN THE CARDIOVASCULAR SYSTEM
Katedra i Klinika Nefrologii, Transplantologii i Chorób Wewnętrznych
Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Kierownik: prof. dr hab. med. Andrzej Oko
Streszczenie
Wstęp. Pomimo postępów w zakresie farmakoterapii oraz leczenia nerkozastępczego śmiertelność wśród chorych z przewlekłą
chorobą nerek (PChN) nadal utrzymuje się na wysokim poziomie. Najczęstszą przyczyną zgonów w tej grupie pacjentów pozostają
choroby układu sercowo-naczyniowego.
Cel. Celem pracy była ocena zależności pomiędzy stopniem uszkodzenia nerek i rozwojem zespołu niedożywienie-zapalenie-miażdżyca
(MIA, malnutrition-inflammation-atherosclerosis syndrome) a wybranymi wykładnikami uszkodzenia układu krążenia wśród pacjentów
z PChN.
Materiał i metodyka. Wtórna analiza wyników z prac doktorskich Agnieszki Simachowicz-Olszowy i Dariusza Krupy. Badaniem
objęto 96 chorych (26 kobiet, 70 mężczyzn; średni wiek 53,49 ± 14,52 lat) z udokumentowaną PChN w stadiach 1–5 o różnej etiolo-
gii. Pacjenci zostali podzieleni na 4 grupy w zależności od stadium PChN.
Wyniki. W kolejnych stadiach choroby stwierdzono zwiększenie odsetka chorych wykazujących echokardiograficzne wykładniki
uszkodzenia serca oraz zwiększenie grubości kompleksu intima-media tętnic szyjnych (IMT, intima media complex thickness).
Jednocześnie zaobserwowano istotną statystycznie ujemną korelację między wartościami filtracji kłębuszkowej (GFR, glomerular
filtration rate) a wskaźnikiem masy lewej komory (LVMI, left ventricular mass index) (r = -0,29, p < 0,001). Odnotowano również
tendencję do wzrostu wielkości kompleksu IMT tętnic szyjnych w grupach ze zmniejszającym się GFR, jednak nie była to korelacja
istotna statystycznie. Wykazano również istotną statystycznie korelację między wykładnikami stanu zapalnego: stężeniem CRP
(r = 0,19, p < 0,005) i fibrynogenu (r = 0,34, p < 0,001) oraz wartościami IMT tętnic szyjnych, a także między stężeniem fibrynogenu
i wymiarem rozkurczowym przegrody międzykomorowej (IVSd, interventricular septum diameter in diastole) (r = 0,25, p < 0,005).
Wnioski. Wyniki badania świadczą, że przewlekła choroba nerek jest ważnym czynnikiem ryzyka rozwoju chorób układu krążenia.
Potwierdzają również, iż przewlekły stan zapalny wiąże się ze wzrostem częstości występowania miażdżycowego uszkodzenia ukła-
du sercowo-naczyniowego.
SŁOWA KLUCZOWE: przewlekła choroba nerek, zespół MIA, powikłania sercowo-naczyniowe, wykładniki stanu zapalnego.
Summary
Introduction. Despite the rapid improvement in pharmacological treatment and kidney replacement therapy, the mortality rate in the
chronic kidney disease (CKD) patients remains very high, with cardiovascular diseases (CVD) being the most common cause of death.
Aim. The aim of the study was to investigate the correlation between the progress of CKD, development of malnutrition-
inflammation-atherosclerosis (MIA) syndrome and selected markers of cardiovascular system injury in CKD patients.
Material and methods. A secondary analysis of results from doctoral dissertations of Agnieszka Simachowicz-Olszowy and Dariusz
Krupa. The study was performed on 96 patients (26 females, 70 males, mean age 53.49 ± 14.52 years) with CKD diagnosed at stages
1–5, divided into 4 subgroups depending on disease advancement.
Results. The data showed that at the consecutive stages of CKD there was an increased percentage of patients with echocardio-
graphic markers of cardiac damage and increased value of the intima media complex thickness (IMT). Moreover, there was a statisti-
cally significant negative correlation between the GFR values and left ventricular mass index (LVMI) (p < 0.001, r = -0.29). A ten-
dency to higher carotid artery IMT in patients with decreased GFR was also noticed, however it did not reach statistical significance.
Moreover, there was a statistically significant correlation between inflammatory markers: C- reactive protein (CRP) (p < 0.001,
r = -0.30) and fibrinogen (p < 0.001, r = -0.42) serum concentrations and carotid artery IMT. At the same time, there was a statistically sig-
nificant correlation between fibrinogen concentration and interventricular septum diameter in diastole (IVSd) (r = 0.25, p < 0.005).
Conclusions. The study has confirmed that CKD is a risk factor of CVD and has also shown that a chronic inflammatory condition
shows a correlation with an increased frequency of atherosclerotic damage markers of cardiovascular system.
KEY WORDS: chronic kidney disease, MIA syndrome, cardiovascular disease, inflammatory markers.

Dorota Sikorska i inni
PRACE ORYGINALNE
168
Wstęp
Pomimo ogromnego postępu w dziedzinie nefroprotek-
cji, możliwości farmakoterapii oraz technik leczenia nerko-
zastępczego śmiertelność wśród chorych z przewlekłą
chorobą nerek (PChN) nadal utrzymuje się na bardzo wy-
sokim poziomie. Najczęstszą przyczyną śmiertelności w tej
grupie pacjentów są choroby układu sercowo-naczynio-
wego [1]. Choroba wieńcowa, choroba naczyń obwodo-
wych, zaburzenia rytmu serca, przeciążenie objętościowe
oraz przerost lewej komory serca występują u chorych
z PChN bardzo powszechnie [2]. Ryzyko zgonu z przyczyn
sercowo-naczyniowych u chorych z PChN jest ponad 10-
krotnie wyższe niż w populacji ogólnej. Co więcej, w gru-
pie chorych poniżej 35. roku życia jest ono prawie 1000
razy wyższe [3]. W opublikowanej ostatnio metaanalizie
obejmującej łącznie 85 badań na grupie 552 258 chorych,
wykazano silną korelację pomiędzy niewydolnością nerek
a ryzykiem rozwoju powikłań sercowo-naczyniowych [4].
Ponadto zauważono, że częstość występowania chorób
układu krążenia wzrasta już we wczesnych stadiach PChN
(przy wartościach filtracji kłębuszkowej około 75 ml/min/
1,73 m
2
) i jest zależna od stopnia niewydolności nerek [4].
Ta silna zależność związana jest ze współwystępowaniem
u chorych z PChN klasycznych czynników ryzyka (takich
jak: płeć, wiek, nadciśnienie tętnicze, czynniki genetyczne)
z innymi, mniej tradycyjnymi, czynnikami zależnymi od
istniejącego uszkodzenia funkcji nerek: przewlekły proces
zapalny, stres oksydacyjny, dysfunkcja śródbłonka naczyń,
aktywacja układu współczulnego, przeciążenie objętościo-
we lewej komory serca, wpływ toksyn mocznicowych,
zaburzenia gospodarki wapniowo-fosforanowej, niedoży-
wienie białkowo-kaloryczne oraz niedokrwistość [1]. Wy-
daje się, że u chorych z zaawansowaną PChN to właśnie
nietradycyjne czynniki ryzyka odgrywają kluczową rolę
w rozwoju chorób układu sercowo-naczyniowego i związa-
nej z nimi wysokiej śmiertelności [1].
Współwystępowanie niedożywienia białkowo-kalo-
rycznego, przewlekłego nieswoistego stanu zapalnego oraz
przyspieszonego rozwoju miażdżycy określa się mianem
zespołu niedożywienie-zapalenie-miażdżyca (MIA, malnu-
trition-inflammation-atherosclerosis syndrome) [5]. W su-
rowicy chorych ze stwierdzonymi cechami niedożywienia
często występują podwyższone stężenia mediatorów stanu
zapalnego: białka C reaktywnego (CRP, C-reactive protein),
niektórych cytokin prozapalnych, fibrynogenu i innych [6].
Wspólną osią łączącą poszczególne elementy zespołu MIA
w PChN są cytokiny prozapalne m.in. interleukina 1 (IL-1,
interleukin-1), IL-4, IL-6, czynnik martwicy nowotworów
α (TNF-α, tumor necrosis factor α). Wytwarzane dzięki
stymulacji przez różne czynniki indukujące odpowiedź
zapalną, stres oksydacyjny czy też niedobory pokarmowe,
ulegają jednoczesnej kumulacji w wyniku zmniejszonego
klirensu nerkowego [6]. Prawdopodobnie są one odpowie-
dzialne za aktywację procesów biorących udział w rozwoju
miażdżycy oraz za występowanie powikłań sercowo-
naczyniowych [1, 7]. Miażdżyca jest uznawana za chorobę
zapalną, w której dysfunkcja śródbłonka jest początkowym
objawem [1, 7].
Zespół MIA może rozwinąć się u chorych w każdym
stadium przewlekłej choroby nerek. Zwiększone stężenia
wykładników stanu zapalnego (jak CRP, IL-6, fibrynogen)
występują już we wczesnych stadiach PChN, osiągając
istotnie wyższe poziomy u chorych z wartościami GFR
poniżej 60 ml/min/1,73 m
2
[8], co stanowi uzasadnienie dla
wczesnych działań profilaktycznych oraz terapeutycznych.
W badaniu Stenvinkela i wsp. częstość występowania po-
szczególnych składowych zespołu MIA u chorych ze
schyłkową niewydolnością nerek w okresie przeddializa-
cyjnym oceniono na: zapalenie – 32%, niedożywienie –
44%, choroby sercowo-naczyniowe (głównie na podłożu
miażdżycy) – 72% [9].
Głównym celem pracy było określenie częstości wy-
stępowania wykładników uszkodzenia układu sercowo-
naczyniowego w odniesieniu do wartości GFR oraz
ocena związku między występowaniem zespołu MIA
a wybranymi wykładnikami zmian w układzie sercowo-
naczyniowym.
Materiał i metody
Wtórna analiza wyników z prac doktorskich Agnieszki
Simachowicz-Olszowy i Dariusza Krupy. Badaniem obję-
to 96 chorych (26 kobiet, 70 mężczyzn; średni wiek
53,49 ± 14,52 lat) z rozpoznaną PChN w stadiach od
1 do 5, leczonych zachowawczo w Poradni Nefrologicz-
nej oraz Klinice Nefrologii, Transplantologii i Chorób
Wewnętrznych Uniwersytetu Medycznego w Poznaniu.
Kryteria rozpoznania PChN ustalono w oparciu o wy-
tyczne amerykańskiej Narodowej Fundacji Nerkowej
(NKF K/DOQI Guidelines) z 2003 r. [10]. Stadium
PChN określono na podstawie wielkości oszacowanego
współczynnika filtracji kłębuszkowej (eGFR, estimated
glomerular filtration rate) wyliczonego ze wzoru Cock-
crofta-Goulta [11]. Ustalono również pierwotne przy-
czyny rozwoju PChN: przewlekłe kłębuszkowe zapale-
nie nerek, potwierdzone wynikiem biopsji nerki (n = 39,
40,6%), przewlekłe odmiedniczkowe zapalenie nerek
(n = 28, 29,2%), nefropatia nadciśnieniowa (n = 16,
16,7%), torbielowatość nerek (n = 4, 4,2%), nefropatia
dnawa (n = 3, 3,1%), inne przewlekłe choroby nerek,
takie jak zespół Alporta, nefropatia toczniowa, toksyczne
uszkodzenie nerek (n = 3, 3,1%). W 3 przypadkach nie
udało się określić przyczyny choroby (n = 3, 3,1%).
Dokładny czas trwania PChN u większości badanych był
trudny do ustalenia, z uwagi na niepełne dane z wywiadu
oraz dokumentacji medycznej. Wśród 50% chorych
przewlekła choroba nerek została świeżo zdiagnozowa-
na, pozostali byli już wcześniej leczeni zachowawczo.
Jako kryteria wyłączenia chorych z projektu uznano:
aktywną podstawową chorobę nerek, współistnienie
cukrzycy, ostrego aktywnego procesu zapalnego oraz
innych ciężkich chorób przewlekłych. W zależności od
stadium PChN chorzy zostali podzieleni na 4 grupy:
grupa I – chorzy w stadium 1 i 2 PChN (n = 12, 12,5%),
Przekrojowa ocena związku między stadium przewlekłej choroby nerek i występowaniem zespołu …
PRACE ORYGINALNE
169
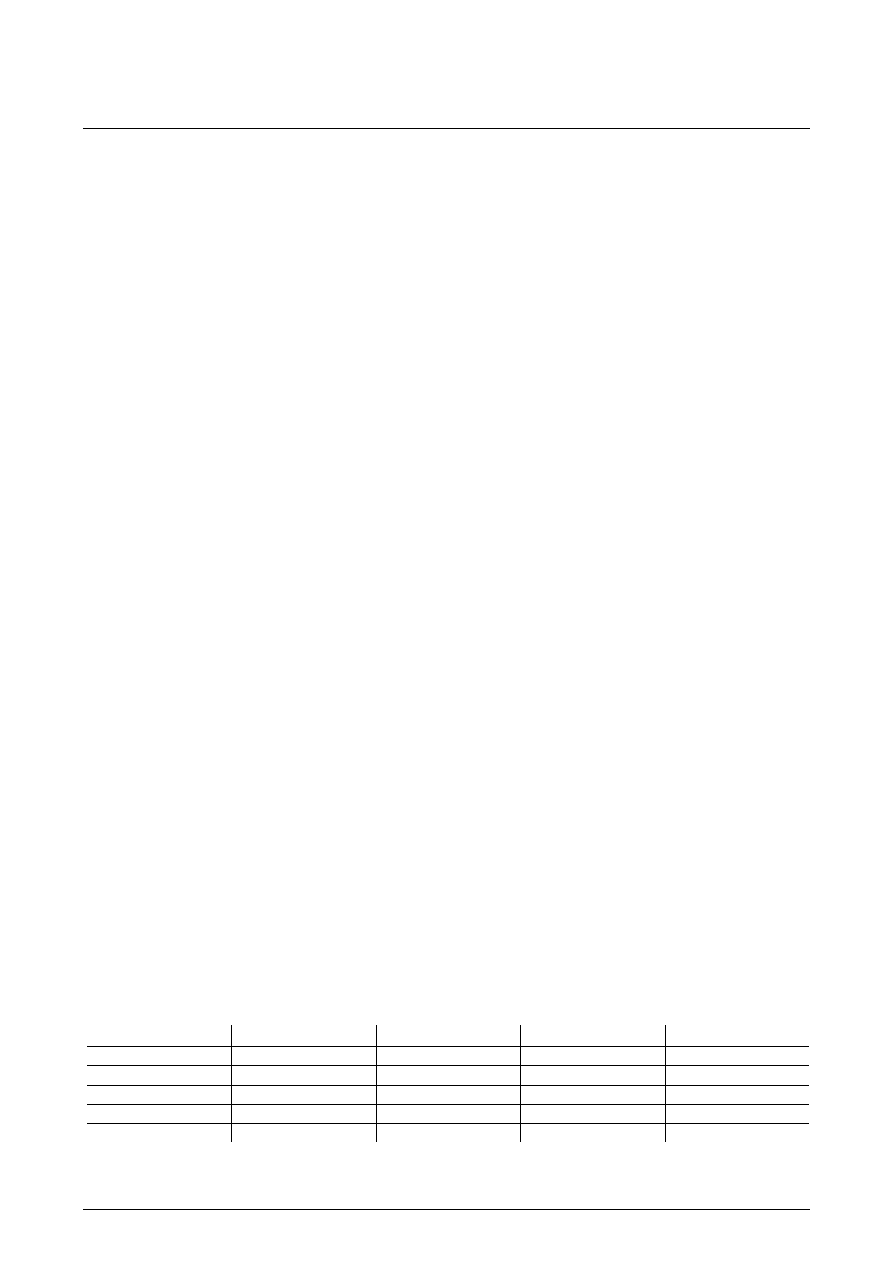
Tabela 1. Odsetek chorych z nieprawidłowymi wartościami pomiarów echokardiograficznych
Table 1. Percent of patients with abnormalities in echocardiography
Grupa I
Grupa II
Grupa III
Grupa IV
LVEDv 4,6% 15,5% 16,8% 22,4%
PWd 12,5% 22,3% 31,2% 45,3%
IVSd 12,3% 21,5% 28,1% 32,2%
LVMI 11,7% 22,9% 23,8% 43,2%
LVEF 4,6% 18,3% 13,7% 40,2%
grupa II – chorzy w stadium 3 (n = 27, 28,1%), grupa III
– chorzy w stadium 4 (n=35, 36,5%), grupa IV – chorzy
w stadium 5, ale jeszcze nie leczeni nerkozastępczo
(n = 22, 22,9%). Protokół badania uzyskał zgodę Komi-
sji Bioetycznej Uniwersytetu Medycznego w Poznaniu.
Wszyscy chorzy zostali poinformowani o przebiegu
badania, jego celu oraz wyrazili świadomą zgodę na
udział. Od każdego z pacjentów zebrano dane demogra-
ficzne oraz każdy chory został przebadany klinicznie.
Do oceny występowania czynników ryzyka powikłań
sercowo-naczyniowych oraz oceny stopnia zaawansowania
zmian miażdżycowych u poszczególnych chorych zastoso-
wano: oznaczenie stężenia w surowicy rozpuszczalnej
ludzkiej molekuły adhezyjnej (sVCAM-1, soluble vascular
cell adhesion molecule-1), rozpuszczalnej ludzkiej moleku-
ły adhezyjnej (sICAM-1, soluble intercellular adhesion
molecule-1), poszczególnych frakcji cholesterolu. Wykona-
no także badanie echokardiograficzne oraz ultrasonogra-
ficzne tętnic szyjnych. Oznaczenia stężenia sVCAM-1
i sICAM-1 przeprowadzono metodą immunoenzymatyczną
fazy stałej – ELISA. Stężenia w surowicy frakcji choleste-
rolu LDL (low density lipoproteins), HDL (high density
lipoproteins) i triglicerydów badano metodą punktu końco-
wego z wykorzystaniem aparatu Synchron Clinical System
CX7 Delta.
Badanie echokardiograficzne wykonano przy użyciu
aparatu 2D-Hewlett Packard SONS 5500 oceniając nastę-
pujące parametry: objętość końcowo-rozkurczowa lewej
komory (LVEDv, left ventricular end-diastolic volume),
grubość tylnej ściany lewej komory w rozkurczu (PWd,
posterior wall diastolic diameter), wymiar rozkurczowy
przegrody międzykomorowej (IVSd, left ventricular systo-
lic diameter), masa lewej komory (LVM, left ventricular
mass), wskaźnik masy lewej komory (LVMI, left ventricu-
lar mass index), frakcja wyrzutowa lewej komory (LVEF,
left ventricular ejection fraction). Badanie ultrasonograficz-
ne tętnic szyjnych wykonywano przy pomocy głowicy
liniowej o częstotliwości 7,5 MHz i aparatu jak wyżej.
Oceniono obecność blaszek miażdżycowych w tętnicach
szyjnych wspólnych oraz grubości kompleksu infima-
media (IMT, intima-media complex thickness).
Do oceny występowania przewlekłego stanu zapalnego
oznaczono stężenie CRP, IL-6 oraz fibrynogenu w surowicy
krwi. Stężenie CRP w surowicy określano metodą immuno-
turbidymetryczną ze wzmocnieniem cząsteczkami lateksu.
Oznaczenia wartości stężenia IL-6 wykonano metodą im-
munoenzymatyczną fazy stałej (ELISA). Stężenie fibryno-
genu badano metodą nefelometryczną.
Uzyskane wyniki poddano analizie statystycznej z wyko-
rzystaniem pakietu STATISTICA firmy StatSoft Inc. oraz
InStat firmy GraphPad Software Inc. Wartości średnie po-
równano testem Wilcoxona dla zmiennych powiązanych oraz
testem Mann-Whitneya dla zmiennych niezależnych. Analizę
korelacji przeprowadzono metodą Spearmana dla zmiennych
niezależnych. Dla porównania wyników w więcej niż w
dwóch grupach wykorzystano test ANOVA/MANOVA. Za
poziom istotności statystycznej przyjęto p < 0,05.
Wyniki
Średnia wieku zwiększała się w kolejnych grupach
chorych (w grupie I: 44,17 ± 13,89, w grupie II: 46,67 ±
13,84 lat, w grupie III: 57,51 ± 13,84 lat, w grupie IV:
60,55 ± 10,8 lat) odpowiadając bardziej zaawansowa-
nym stadiom PChN, ale w żadnej z grup nie przekroczy-
ła 65 lat. Występowanie czynników ryzyka sercowo-
naczyniowego stwierdzono we wszystkich grupach ba-
danych. Odsetek chorych z nieprawidłowymi warto-
ściami ocenianych parametrów echokardiograficznych
wzrastał progresywnie w kolejnych grupach badanych,
z jednym wyjątkiem – zauważono mniejszą częstość
występowania nieprawidłowych wartości LVEF w gru-
pie III niż w grupie II (Tabela 1.). W grupie IV ponad
40% chorych miało podwyższone wartości PWd i LVMI
oraz obniżone wartości LVEF. Wykazano istotną staty-
stycznie ujemną korelację między wartością eGFR a LVMI
(r = -0,29, p < 0,001). Zwrócono uwagę na progresywne
zwiększanie się średnich wartości IMT tętnic szyjnych
w grupach od I do IV (odsetek chorych z IMT > 0,9 mm
wynosił w grupie II 48,5%, a w grupie IV osiągnął war-
tość 75,6%), jednak nie stwierdzono istotnej statystycz-
nie zależności między eGFR a IMT. Stwierdzono nato-
miast istotną korelację między wykładnikami stanu
zapalnego: osoczowym stężeniem CRP (r = 0,19, p <
0,005) i fibrynogenu (r = 0,34, p < 0,001) oraz warto-
ściami IMT tętnic szyjnych. Zaobserwowano także istot-
ną statystycznie korelację między wartościami stężenia
fibrynogenu w surowicy i IVSd (r = 0,25, p < 0,005).
Ponadto stężenie fibrynogenu dodatnio korelowało ze
stężeniem sVCAM-1 (r = 0,28, p < 0,005). W grupach
chorych z GFR < 60 ml/min/1,73 m
2
(odpowiednio gru-
py III i IV) średnie wartości stężeń w surowicy sICAM-1
i sVCAM-1 przekraczały górne granice normy. Wyka-

Dorota Sikorska i inni
PRACE ORYGINALNE
170
zano ponadto wzrastające wartości sVCAM-1 w kolej-
nych grupach badanych oraz ujemną korelację między
GFR i sVCAM-1 (r = -0,28, p < 0,01). Stężenie IL-6
w surowicy wykazywało istotną statystycznie dodatnią
korelację ze stężeniami sICAM-1 (r = 2,7, p < 0,01)
i sVCAM (r = 2,8, p < 0,01), podobnie jak stężenia CRP
(odpowiednio sICAM r = 0,25, p < 0,005 i sVCAM
r = 0,32, p < 0,01).
W badanych grupach zaobserwowano duży odsetek
chorych z podwyższonymi wartościami stężenia chole-
sterolu całkowitego w surowicy. Nie wykazano jednak
istotnej statystycznie korelacji między stężeniem chole-
sterolu całkowitego a poszczególnymi stadiami PChN.
Stwierdzono natomiast istotną statystycznie dodatnią
korelację między wartością oszacowanego GFR i stęże-
niem cholesterolu LDL (r = 0,28, p < 0,05) oraz chole-
sterolu HDL (r = 0,28, p < 0,01). Wykazano również
korelację między stężeniem cholesterolu całkowitego
i PWd (r = 0,22, p < 0,005) oraz między poziomem LDL
a wartością kompleksu IMT (r = 0,28, p < 0,05), a także
ujemną korelację między stężeniem HDL i wartością
kompleksu IMT (r = 0,28, p < 0,01). Nie zauważono
istotnych statystycznie różnic w stężeniu triglicerydów
w surowicy w poszczególnych grupach chorych. Wyka-
zano natomiast istotną statystycznie dodatnią korelację
między stężeniem triglicerydów w surowicy a LVEDv
(r = 0,24, p < 0,001) oraz wartością IMT tętnic szyjnych
(r = 0,20, p < 0,005).
Dyskusja
Istotny związek między przewlekłą chorobą nerek
a wzrostem ryzyka sercowo-naczyniowego jest znany od
wielu lat. Wydaje się, iż kluczową rolę w rozwoju miaż-
dżycy odgrywa przewlekły stan zapalny [1]. Mechani-
zmy, w wyniku których dochodzi do rozwoju miażdżycy
u pacjentów z PChN, są niezwykle złożone, a ich do-
kładne omówienie przekracza ramy tego opracowania,
dlatego zwrócono uwagę tylko na niektóre z nich. W roz-
woju miażdżycy u chorych z PChN podkreśla się zna-
czenie wpływu stanu zapalnego. Aterogenne działanie
IL-6 wiąże się z jej wpływem na proces przylegania
i migracji leukocytów przez śródbłonek (przy udziale
ICAM), a także z hamowaniem lipazy lipoproteinowej w
komórkach tłuszczowych, co z kolei wpływa na rozwój
dyslipidemii [6]. CRP natomiast ma zdolność do akty-
wacji dopełniacza oraz wiązania i agregacji cząsteczek
LDL i VLDL [5]. Co więcej, CRP aktywuje również
makrofagi. Działanie aterogenne CRP przejawia się też
wpływem na zwiększone tworzenie wolnych rodników
tlenowych [5]. Złogi CRP w kompleksie z LDL lub
dopełniaczem zidentyfikowano w naczyniach krwiono-
śnych, blaszkach miażdżycowych oraz obszarach tkan-
kowych po zawale mięśnia sercowego [5].
Kolejnym czynnikiem aterogennym jest fibrynogen,
uznawany za białko ostrej fazy, który sprzyja tworzeniu
się skrzepliny w obrębie naczyń krwionośnych [5]. Pod-
kreśla się znaczny udział w rozwoju miażdżycy cząste-
czek adhezyjnych, m.in. ICAM i VCAM, odpowiedzial-
nych za rozpoznawanie antygenu, wiązanie dopełniacza
i komórkową adhezję [12]. Cząsteczki adhezyjne zwięk-
szają przyleganie leukocytów do ściany naczyń, co za-
początkowuje ich uszkodzenie [12]. W warunkach do-
świadczalnych in vivo gęstość VCAM na komórkach
śródbłonka zwiększa się pod wpływem hipercholestero-
lemii [12]. Wpływ na ICAM i VCAM wywierają także
cytokiny prozapalne, co jest jednym z głównych mecha-
nizmów uszkodzenia naczyń przez stan zapalny [12].
Wszystkie te złożone procesy powodują, iż stan zapalny
w przebiegu przewlekłej choroby nerek staje się istot-
nym czynnikiem ryzyka rozwoju chorób układu serco-
wo-naczyniowego.
W naszym badaniu, w kolejnych grupach chorych, cha-
rakteryzujących się coraz niższymi wartościami eGFR,
wykazano zwiększanie się średnich wartości: LVEDv,
PWd, IVSd, LVMI oraz zmniejszanie się LVEF. Przemawia
to jednoznacznie za wzrostem częstości występowania
wykładników uszkodzenia serca w kolejnych stadiach
PChN. Levin i wsp. stwierdzili [13] występowanie przero-
stu lewej komory w przypadku 26,7% chorych z GFR >
50 ml/min/1,73 m
2
i wśród aż 45,2% pacjentów z GFR <
25 ml/min/1,73 m
2
[13]. Nasze badanie pozostaje więc w
zgodzie z wynikami autorów. Podobne wnioski sformuło-
wano w nowszym badaniu Masugaty i wsp. z 2010 roku
obejmującym 300 pacjentów z PChN i dodatkowymi czyn-
nikami ryzyka sercowo-naczyniowego [14]. Autorzy za-
uważyli wówczas istotną statystycznie korelację między
wartością GFR oraz LVMI, dowodząc iż spadek wielkości
filtracji kłębuszkowej jest istotnym niezależnym czynni-
kiem ryzyka rozwoju chorób układu sercowo-naczynio-
wego [14].
Stwierdzona w naszym badaniu tendencja do progre-
sywnego zwiększania się wartości IMT w kolejnych
grupach chorych, wraz ze spadkiem wartości GFR, może
również wskazywać na udział PChN w rozwoju blaszki
miażdżycowej. Podobną, ale istotną statystycznie zależ-
ność między wartościami GFR i IMT wykazali Zhang
i wsp. w badaniu obejmującym 1046 chorych z PChN
w stadium 1–3 [15]. W innym badaniu na grupie 122
chorych z PChN leczonych zachowawczo wykazano
również, iż wzrost grubości kompleksu IMT występował
istotnie statystycznie częściej u pacjentów z obniżoną
wartością GFR < 60 ml/min/1,73 m
2
[16]. Wyniki tych
badań potwierdzają, że PChN jest istotnym czynnikiem
ryzyka przedwczesnego rozwoju miażdżycy.
Opisywany w obecnym badaniu udział przewlekłego
stanu zapalnego w rozwoju miażdżycy, wyrażony zmia-
nami w grubości kompleksu IMT tętnic szyjnych, był już
wcześniej opisywany przez innych autorów. W badaniu
Szeto i wsp., przeprowadzonym na grupie 203 chorych
z PChN w stadium 3–4, obecność blaszek miażdżyco-
wych w USG tętnic szyjnych wykazano u 59,6% bada-
nych. Stwierdzono również istotną statystycznie zależ-
ność między wartościami IMT a stężeniem CRP w
surowicy [17], co jest zgodne z naszymi wynikami. Au-
torzy opublikowanego w 2010 roku przekrojowego ba-
dania, obejmującego 122 chorych z PChN nie wymaga-

Przekrojowa ocena związku między stadium przewlekłej choroby nerek i występowaniem zespołu …
PRACE ORYGINALNE
171
jących leczenia nerkozastępczego, również zauważyli
zależność między wartościami IMT a podwyższonymi
stężeniami CRP w surowicy [16]. W badaniu Brzoski
i wsp. na rodzimej populacji 21 chorych hemodializowa-
nych wykazano istotną statystycznie zależność między
wartościami IMT a stężeniem fibrynogenu w surowicy
[18], podobnie jak w naszym badaniu. Nieco odmienne
rezultaty uzyskali Stenvinkel i wsp. oceniając obecność
blaszek miażdżycowych w tętnicach szyjnych w odnie-
sieniu do wykładników stanu zapalnego [9]. Wykazali
oni istotną statystycznie zależność między zmianami
miażdżycowymi w ocenie USG tętnic szyjnych a stęże-
niem CRP w surowicy, natomiast korelacja ta w przy-
padku fibrynogenu nie była istotna statystycznie [9].
Wieliczko i wsp. w prospektywnym badaniu oceniają-
cym związek pomiędzy markerami stanu zapalnego a ro-
zwojem miażdżycy i powikłań sercowo-naczyniowych
u 55 chorych leczonych hemodializami również wykaza-
li silną korelację pomiędzy IMT tętnic szyjnych a IL-6
oraz innymi markerami stanu zapalnego: fibrynogenem
i CRP [19].
W literaturze znaleźć można liczne doniesienia na
temat zależności między wykładnikami stanu zapalnego
a zmianami w badaniu echokardiograficznym. Zoccali
i wsp. w swoim badaniu na 192 chorych leczonych he-
modializami zwracali uwagę na występujące częściej
u pacjentów z wysokim fibrynogenem w surowicy nie-
prawidłowe wartości pomiarów echokardiograficznych:
LVMI i LVEF [20]. Podobne wyniki uzyskano w prze-
prowadzonym badaniu stwierdzając istotną statystycznie
korelację między stężeniem fibrynogenu w surowicy
a wartościami IVSd. Autorzy innego badania opubliko-
wanego w 2005 roku dowodzą istotnej statystycznie
zależności między stężeniem CRP w surowicy a pod-
wyższonymi wartościami: IVSd, LVEDv, LVMI w ba-
daniu echokardiograficznym, świadczącymi o przeroście
mięśnia serca [21]. Nie znalazło to potwierdzenia
w naszym badaniu. W opublikowanej ostatnio metaana-
lizie obejmującej łącznie 85 badań na grupie 552 258
chorych wykazano istotny związek między ryzykiem
sercowo-naczyniowym a niewydolnością nerek, zwraca-
jąc szczególną uwagę na nietradycyjne czynniki ryzyka,
takie jak przewlekły stan zapalny i niedożywienie [4].
W prezentowanym badaniu zwrócono również uwa-
gę na występujące u chorych w kolejnych stadiach PChN
wskaźniki uszkodzenia śródbłonka. Obserwowane do-
datnie korelacje między wskaźnikami stanu zapalnego
i cząsteczkami adhezyjnymi (sICAM-1 i sVCAM-1)
można zinterpretować jako potwierdzenie roli przewle-
kłego zapalenia w dysfunkcji śródbłonka. Podobne ob-
serwacje opisano w innych badaniach zarówno przekro-
jowych, jak i prospektywnych [22–24]. Stenvinkel i wsp.
w badaniu obejmującym 88 chorych w okresie prediali-
zacyjnym w stadium 5 PChN oceniali częstość wys-
tępowania podwyższonych wartości stężeń sICAM-1
i sVCAM-1 w surowicy w odniesieniu do wykładników
stanu zapalnego [23]. Autorzy wykazali istotną statys-
tycznie korelację między stężeniami CRP a sVCAM-1
i sICAM-1, co również potwierdziliśmy w naszym bada-
niu. Jednakże Stenvinkel i wsp. nie zaobserwowali istot-
nej statystycznie zależności między wartościami GFR
i sVCAM-1 [23], którą to wykazano w naszym badaniu.
Podobne wyniki otrzymał Stam i wsp., który w badaniu
przeprowadzonym na 80 chorych podzielonych na 4 grupy
w zależności od stadium PChN zaobserwował istotną staty-
stycznie zależność między wartościami klirensu kreatyniny
a stężeniami sVCAM-1 [22]. Wyniki naszych badań pozo-
stają w zgodzie z opublikowanym w 2009 roku badaniem
obejmującym grupę 73 chorych, gdzie autorzy wykazali
silną zależność między wartościami GFR i sVCAM-1 oraz
istotną statystycznie dodatnią korelację między średnimi
stężeniami w surowicy fibrynogenu i sICAM-1 oraz
sVCAM-1, a także CRP i sICAM-1 [24].
W przeprowadzonym badaniu analizowano również
udział zaburzeń gospodarki lipidowej w rozwoju miaż-
dżycy u chorych z przewlekłą chorobą nerek. W piś-
miennictwie znaleźć można doniesienia o występowaniu
odwrotnej korelacji między stężeniem cholesterolu w
surowicy a ryzykiem sercowo-naczyniowym u chorych
ze schyłkową niewydolnością nerek [25]. Wydaje się, że
odpowiedzialne za to jest współistnienie w tej grupie
chorych poszczególnych elementów zespołu MIA i szcze-
gólnej roli niedożywienia [25]. Brak zależności pomiędzy
GFR i stężeniem cholesterolu całkowitego w naszym bada-
niu można tłumaczyć przede wszystkim małą liczebnością
grup badanych. W przeprowadzonym badaniu zaskakująca
jest zależność pomiędzy wartościami GFR i LDL, jak
i HDL, co wskazywałoby, iż wraz ze spadkiem GFR wzra-
stają obie frakcje cholesterolu. Wyniki własne są tylko
częściowo zgodne z pracą Massy i wsp., którzy wykazali
u chorych z PChN podwyższone wartości cholesterolu cał-
kowitego i LDL oraz obniżone stężenia HDL [26]. Podobne
rezultaty uzyskali Sarnak i wsp., znajdując zależność mię-
dzy wartościami GFR i HDL, natomiast nie wykazali istot-
nego związku GFR z wartościami stężeń cholesterolu cał-
kowitego ani LDL [27]. Niemniej jednak, stwierdzona
dodatnia korelacja między stężeniem LDL i wartością
kompleksu IMT potwierdza, że LDL jest ważnym czynni-
kiem ryzyka rozwoju blaszki miażdżycowej. Warto zauwa-
żyć, że w naszym badaniu przy wyższych wartościach HDL
wartość IMT tętnic szyjnych była mniejsza. Znajduje to
potwierdzenie w badaniu Prestona i wsp., w którym wyka-
zano istotną zależność między wartością IMT a stężeniami
w surowicy LDL oraz HDL [28]. Natomiast odmienne
wyniki uzyskali Stenvinkel i wsp. badając 109 chorych
w stadium 5 PChN [9]. Autorzy nie stwierdzili istotnej zależ-
ności między wartościami IMT a hipercholesterolemią [9].
Wnioski
W przeprowadzonym badaniu stwierdzono, iż po-
cząwszy od najwcześniejszych stadiów przewlekłej
choroby nerek, wraz ze spadkiem wartości GFR, zwięk-
sza się częstość występowania echokardiograficznych
wykładników uszkodzenia serca, zwłaszcza przerostu
lewej komory serca. Obserwowano również tendencję do
częstszego występowania wykładników uszkodzenia na-

Dorota Sikorska i inni
PRACE ORYGINALNE
172
czyń krwionośnych (pogrubienie kompleksu intima-media)
w kolejnych stadiach zaawansowania PChN. Co ważne,
potwierdzono, iż przewlekły stan zapalny wiąże się ze
zwiększeniem częstości występowania wskaźników miaż-
dżycowego uszkodzenia naczyń krwionośnych (wzrost
wartości IMT), a także serca poprzez przyspieszenie roz-
woju miażdżycy. Należy podkreślić, że obecność zarówno
tradycyjnych, jak i nietradycyjnych czynników ryzyka
sercowo-naczyniowego stwierdzono u znacznego odsetka
badanych, a jednym z najistotniejszych jest rozwijająca się
przewlekła choroba nerek oraz nasilony proces zapalny.
Piśmiennictwo
1. Stenvinkel P., Carrero J.J., Axellson J. et al.: Emerging
biomarkers for evaluating cardiovascular risk in chronic
kidney disease patient: how do new pieces fit into the
uremic puzzle? Clin. J. Am. Soc. Nephrol., 2008, 3, 505-
521.
2. Garcia-Lopez E., Carrero J.J., Suliman M.E. et al.: Risk
factors for cardiovascular disease in patients undergoing
peritoneal dialysis. Perit. Dial. Int., 2007, 27 (S2), 205-
209.
3. Matuszkiewicz-Rowińska J.: Kontrowersje na temat zes-
połu niedożywienie, zapalenie, miażdżyca (MIA) w prze-
wlekłej niewydolności nerek. Nefrol. Dial. Pol., 2006,
10, 88-90.
4. Vanholder R., Massy Z., Argiles A. et al.: Chronic kidney
disease as cause of cardiovascular morbidity and mortality.
Nephrol. Dial. Transplant., 2005 Jun, 20(6), 1048-1056.
5. Stompór T., Sułowicz W.: Zespół Malnutrition –
Inflammation – Atherosclerosis (MIA) – istotna przy-
czyna zwiększonej chorobowości i śmiertelności pacjentów
z przewlekłą niewydolnością nerek. Nefrol. Dial. Pol.,
2002, 6, 65-73.
6. Czekalski S., Pawlaczyk K., Oko A.: Rozwój zespołu
niedożywienie – zapalenie – miażdżyca (zespół MIA)
u chorych z upośledzeniem czynności nerek leczonych
zachowawczo. Nefrol. Dial. Pol., 2004, 8, 112-115.
7. Pawlaczyk K., Oko A., Lindholm B. i wsp.: Zespół
niedożywienie – zapalenie – miażdżyca (zespół MIA)
u chorych z niewydolnością nerek. Pol. Merk. Lek., 2003,
15(88), 334-341.
8. Keller C., Katz R., Cushman M. et al.: Association of
kidney function with inflammatory and procoagulant
markers in a diverse cohort: a cross-sectional analysis
from the Multi-Ethnic Study of Atherosclerosis (MESA).
BMC Nephrol., 2008 Aug 5, 9, 9.
9. Stenvinkel P., Heimbürger O., Paultre F. et al.: Strong
association between malnutrition, inflammation, and
atherosclerosis in chronic renal failure. Kidney Int., 1999,
55(5), 1899-1911.
10. National Kidney Foundation. K/DOQI Clinical Practice
Guidelines for Chronic Kidney Disease: Evaluation,
Classification and Stratification. Am. J. Kidney Dis.,
2002, 39 (suppl 1), 1-75.
11. Myśliwiec M.: Wielka Interna. Nefrologia, Medical
Tribune Polska, Warszawa 2009, 19, 344.
12. Marciniak A., Pączek L., Żegarska J.: Udział cytokin,
białek ostrej fazy i cząsteczek adhezyjnych w pato-
genezie miażdżycy. Nefrol. Dial. Pol., 2001, 6, 27-30.
13. Levin A., Singer J., Thompson CR. et al.: Prevalent left
ventricular hypertrophy in the predialysis population:
identifying opportunities for intervention. Am. J. Kidney
Dis., 1996, 3, 347- 354.
14. Masugata H., Senda S., Goda F. et al.: Echocardiographic
assessment of the cardio-renal connection: is left ventricular
hypertrophy or diastolic function more closely correlated
with estimated glomerular filtration rate in patients with
cardiac risk factors. Clin. Exp. Hypertens., 2010, 32 (2),
113-120.
15. Zhang L., Zhao F. Yang Y. et al.: Association between
carotid artery intima-media thickness and early-stage
CKD in a Chinese population. Am. J. Kidney Dis., 2007,
49 (6), 786-792.
16. Lemos M.M., Jancikic A.D., Sanches F.M. et al.: Intima-
Media Thickness Is Associated with Inflammation and
Traditional Cardiovascular Risk Factors in Non-Dialysis-
Dependent Patients with Chronic Kidney Disease. Nephron
Clin. Pract., 2010, 23, 115(3), 189-194.
17. Szeto C.C., Chow K.M., Woo K.S. et al.: Carotid intima
media thickness predicts cardiovascular diseases in
Chinese predialysis patients with chronic kidney disease.
J. Am. Soc. Nephrol., 2007, 18(6), 1966-1972
18. Brzosko S., Łebkowska U., Małyszko J., et al.: Intima
media thickness of common carotid arteries is associated
with traditional risk factors and presence of ischaemic
heart disease in hemodialysis patients. Physiol. Res.,
2005, 54(5), 497-504
19. Wieliczko M., Matuszkiewicz-Rowińska J., Włodarczyk
D. i wsp.: Związek pomiędzy markerami stanu zapalnego
a miażdżycą tętnic szyjnych i zaburzeniami sercowo-
naczyniowymi u chorych przewlekle hemodializowa-
nych. Nephrol. Dial. Pol., 2006, 10, 21-25.
20. Zoccali C., Benedetto F.A., Mallamaci F. et al.: Fibrinogen,
inflammation and concentric left ventricular hypertrophy
in chronic renal failure. Eur. J. Clin. Invest., 2003, 33(7),
561-566.
21. Kim B.S., Jeon D.S., Shin M.J. et al.: Persistent elevation
of C-reactive protein may predict cardiac hypertrophy
and dysfunction in patients maintained on hemodialysis.
Am. J. Nephrol., 2005, 25(3), 189-195.
22. Stam F., van Guldener C., Schalkwijk C.G. et al.: Impaired
renal function is associated with markers of endothelial
dysfunction and increased inflammatory activity.
Nephrol. Dial. Transplant., 2003 May, 18(5), 892-898.
23. Stenvinkel P., Lindholm B., Heimbürger M. et al.:
Elevated serum levels of soluble adhesion molecules
predict death in pre-dialysis patients: association with
malnutrition, inflammation, and cardiovascular disease.
Nephrol. Dial. Transplant., 2000, 15(10), 1624-1630.
24. Stinghen A.E., Gonçalves S.M., Martines E.G. et al.:
Increased plasma and endothelial cell expression of
chemokines and adhesion molecules in chronic kidney
disease. Nephron Clin. Pract., 2009, 111(2), c117-26.
Epub 2009 Jan 16.
25. Liu Y., Coresh J., Eustace J.A. et al.: Association between
cholesterol level and mortality in dialysis patients: role of
inflammation and malnutrition. JAMA, 2004, 291(4),
451-459.
26. Massy Z.A., Kasiske B.L.: Hyperlipidemia and its
management in renal disease. Curr. Opin. Nephrol.
Hypertens., 1996, 5(2), 141-146.

Przekrojowa ocena związku między stadium przewlekłej choroby nerek i występowaniem zespołu …
PRACE ORYGINALNE
173
27. Sarnak M.J., Coronado B.E., Greene T. et al.: Cardio-
vascular disease risk factors in chronic renal insufficiency.
Clin. Nephrol., 2002, 57(5), 327-335.
28. Preston E., Ellis M.R., Kulinskaya E. et al.: Association
between carotid artery intima-media thickness and
cardiovascular risk factors in CKD. Am. J. Kidney Dis.,
2005, 46(5), 856-862.
Adres do korespondencji:
Katedra i Klinika Nefrologii,
Transplantologii i Chorób Wewnętrznych
Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
ul. Przybyszewskiego 49
60-355 Poznań
tel. 0618671961, fax. 06118691688
e-mail: kpawlac@amp.edu.pl
Wyszukiwarka
Podobne podstrony:
diagnostyka chorob nerek id 134 Nieznany
diagnostyka chorob nerek id 134 Nieznany
Przewlekła choroba nerek i jej wpływ na choroby serca i naczyń
Dieta w chorobach nerek
III WWL DIAGN LAB CHORÓB NEREK i DRÓG MOCZ
Choroby nerek w ciąży
1 Podstawy diagnostyki w chorobach nerek 2005
Podział chorób nerek z elementami patofizjologii
ciaza u kobiet z chorobami nerek
Wybrane choroby nerek i uk adu oddechowego
Choroby nerek i PIH
Choroba Aujeszkyego id 114534 Nieznany
Cukrzycowa choroba nerek
pbfd choroba nie tylko duzych p Nieznany
choroby genetyczne zespoly meta Nieznany (2)
Przewlekła choroba nerek profilaktyka i hamowanie progresji
więcej podobnych podstron