
DEFEKT MASY, ENERGIA WIĄZANIA:
Doświadczenia Rutherforda w 1911 r. polegające na przepuszczaniu cząstek przez cienką folię ze
złota wykazały, że atom posiada jądro, które stanowi bardzo niewielką część średnicy atomu (rzędu
10
-10
– 10
-9
m) i w którym skupiona jest prawie cała masa atomu. Przestrzeń wewnątrzatomowa
pozostaje praktycznie pusta. Fakt, że prawie cała masa atomu jest zawarta w jądrze atomowym i
skoncentrowana w bardzo małej objętości (10
-14
- 10
-15
m) tłumaczy dlaczego gęstość materii jądrowej
jest bardzo duża (rzędu 10
15
kg/m
3
).
W skład jądra wchodzą nukleony, jednakże masa jądra atomu nie jest równa sumie mas protonów i
neutronów. Różnica masy jądra atomowego i mas nukleonów wchodzących w jego skład nosi
nazwę defektu masy. Im większy atom, tym większy jest defekt masy.
Δm = Z
.
m
p
+ (A-Z)
.
m
n
- m
j
Δm - defekt masy (deficyt masy, niedobór masy)
Z - liczba atomowa (= liczba protonów)
A - liczba masowa (= liczba nukleonów, czyli protonów i neutronów)
m
p
- masa protonu, m
p
= 1,007277u
m
n
- masa neutronu, m
n
= 1,008665u
m
j
- masa jądra, m
j
= m
a
-m
c.e
m
a
- masa atomu, [u], 1u = 1,660531
.
10
-27
kg
m
c.e
- masa elektronów, wchodzących w skład atomu (czasem jest pomijana ze względu na
stosunkowo małą wartość), masa jednego elektronu
m
e
= 0,00054859u = 9,1094
.
10
-31
kg.
Defekt masy charakterystyczny dla atomu helu tzn. różnica między masą atomową, a masą 2
protonów, 2 neutronów i 2 elektronów wynosi ok. 0,031 u.
Energia i masa są powiązane równaniem Einsteina E = mc
2
, gdzie E - energia, m - masa, c - prędkość
światła w próżni.
Defekt masy można przeliczyć na energię wiązania nukleonów w jądro (E
w.n
) według wzoru
E
w.n.
= Δm
.
c
2
lub zastosować przeliczniki:
1 u = 931,4812 MeV = 8,982
.
10
10
kJ/mol
Inaczej mówiąc, "brakująca" masa zostaje "zamieniona" na energię odpowiedzialną za utrzymywanie
jądra w całości. Wartość energii wiązania jest miarą trwałości jądra. Im większa jest energia wiązania
nukleonów, tym większe nakłady energii wymagane są do rozbicia atomu na części składowe, tym
bardziej trwałym jest jądro.
Przykłady obliczeń:
1. Obliczyć energię wiązania przypadającą na jeden nukleon dla
12
6
C, przyjmując, że masa jego jądra
wynosi 12,000000u.
Δm=Z
.
m
p
+ (A-Z)
.
m
n
- m
j
=6
.
(1,007277u) + 6
.
(1,008665u) - 12,000000u
Δm= 0,095652u
E
w.n.
=
0,095652u
.
931,4812MeV/u = 89,098040MeV

Dla jednego nukleonu: E
w.1n.
= 89,098040 MeV/12 = 7,424837MeV
2. Obliczyć energię wiązania nukleonów E
w.n.
w przypadku jednego mola jąder atomowych
9
4
Be.
Masa mola protonów wynosi 1,007g/mol, neutronów – 1,009g/mol.
Δm = Z
.
m
p
+ (A-Z)
.
m
n
– m
j
= 4
.
(1,007 g/mol) + 5
.
(1,009 g/mol) – 9,012g/mol
Δm =0,061g/mol
Pamiętamy, że kg
.
m
2
/s
2
= J, wtedy:
E
w.n.
= Δm
.
c
2
= 0,061
.
10
-3
kg/mol
.
(3
.
10
8
m/s)
2
= 5,49
.
10
12
J/mol
DUALISTYCZNY CHARAKTER PROMIENIOWANIA
ELEKTROMAGNETYCZNEGO:
U podstawy współczesnych poglądów dotyczących struktury i własności mikroukładów atomowych
leży koncepcja, wysuniętą w 1900 roku przez M.Plancka, zgodnie z którą materia emituje i pochłania
energię promienistą nie w sposób ciągły, lecz w porcjach nazywanych kwantami:
,
gdzie:
E – energia jednego kwantu promieniowania, [J];
h – stała Plancka, h = 6,6260693
.
10
-34
J
.
s;
- częstość promieniowania, [s
-1
].
,
gdzie:
c – prędkość światła w próżni, c = 299792458 m/s;
- długość fali światła, [m].
Przykłady obliczeń:
1. Obliczyć częstość drgań światła czerwonego o długości fali = 650 nm oraz energię E fali
świetlnej.
,
= (2,998
.
10
8
m/s) / 650
.
10
-9
m = 4,612
.
10
14
s
-1
E = (6,626
.
10
-34
J
.
s)
.
4,612
.
10
14
s
-1
= 3,056
.
10
-19
J
2. Oblicz energię 1 mola fotonów światła zielonego o długości fali = 490 nm
- jest to energia jednego fotonu.
1 mol zawiera N
a
= 6,022
.
10
23
fotonów, więc energia 1 mola fotonów będzie wynosiła:
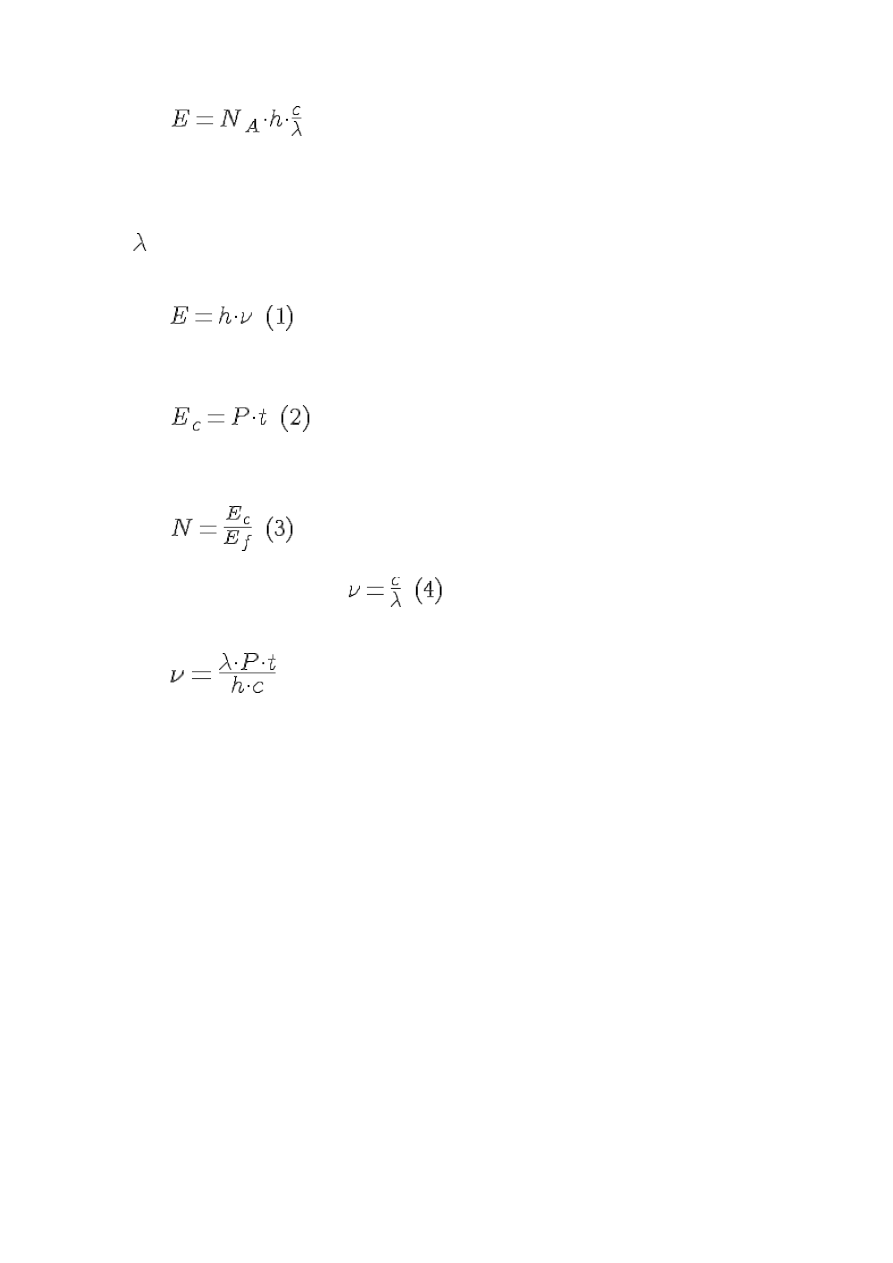
E
mol
= 6,022
.
10
23 .
(6,626
.
10
-34
J
.
s)
.
(2,998
.
10
8
m/s) / 490
.
10
-9
m
E
mol
= 244,1 kJ/mol
3. Ile fotonów N emituje w ciągu 1ms lampa o mocy 10 W, wysyłająca światło fioletowe o długości
fali = 0,40 µm, przy 100% wydajności świetlnej.
Energia jednego fotonu wynosi
Energia wszystkich fotonów jest równa całkowitej energii emitowanej przez lampę E
c
, którą
obliczamy według wzoru (2):
,
gdzie P – moc lampy, t – czas emisji światła. Znając energię wszystkich fotonów znajdzujemy ich ilość
N:
Pamiętamy, że częstotliwość drgań
, a W = J/s. Podstawiamy (1), (2) i (4) w (3), po
przekształceniach otrzymamy:
N = {(0,40
.
10
-6
m)
.
(10 J/s)
.
(1
.
10
-3
s)} / {(6,626
.
10
-34
J
.
s)
.
(2,998
.
10
8
m/s)}
N = 2,014
.
10
16
fotonów.
DUALISTYCZNY CHARAKTER CZĄSTEK MATERII:

Relacja de Broglie’a:
Dualizm korpuskularno-falowy jest cechą nie tylko cząstek światła (fotonów), lecz i wszystkich
sząstek materialnych o masie spoczynkowej różnej od zera. Tę hipotezę Lui de Broglie ogłosił w
1924 roku.
Z ruchem każdej cząstki materii związany jest pewny ruch falowy, przy czym wielkości
charakteryzujące ruch mechaniczny cząstki (pęd, energia) i towarzyszącą mu falę materii
(długość fali, częstość drgań) związane są równaniami:
,
De Broglie podał następujący wzór na długość fali materii:
,
gdzie:
- długość fali poruszającej się cząstki materii (długość fali de Brogli’a);
h – stała Plancka,
;
m – masa cząstki, [kg];
– prędkość, z którą porusza się cząstka, [m/s];
– pęd poruszającej się cząstki,
.
Zasada nieoznaczoności:
Z powodu dualistycznej natury mikrocząstek ich położenie i pęd nie mogą być ze względów
zasadniczych jednocześnie dokładnie zadane. Zwiększenie dokładności pomiaru położenia powoduje
zawsze zaburzenia zwiększające nieokreśloność pędu cząstki i na odwrót. Stwierdzenie to jest jednym
ze szczególnych przypadków zasady nieoznaczoności Heisenberga : Niemożliwe jest określenie
jednocześnie z dowolnie dużą precyzją zarówno pędu, jak i położenia cząstki.
Analiza rachunkowa wielu doświadczeń prowadzi do wniosku, że iloczyn nieokreśloności
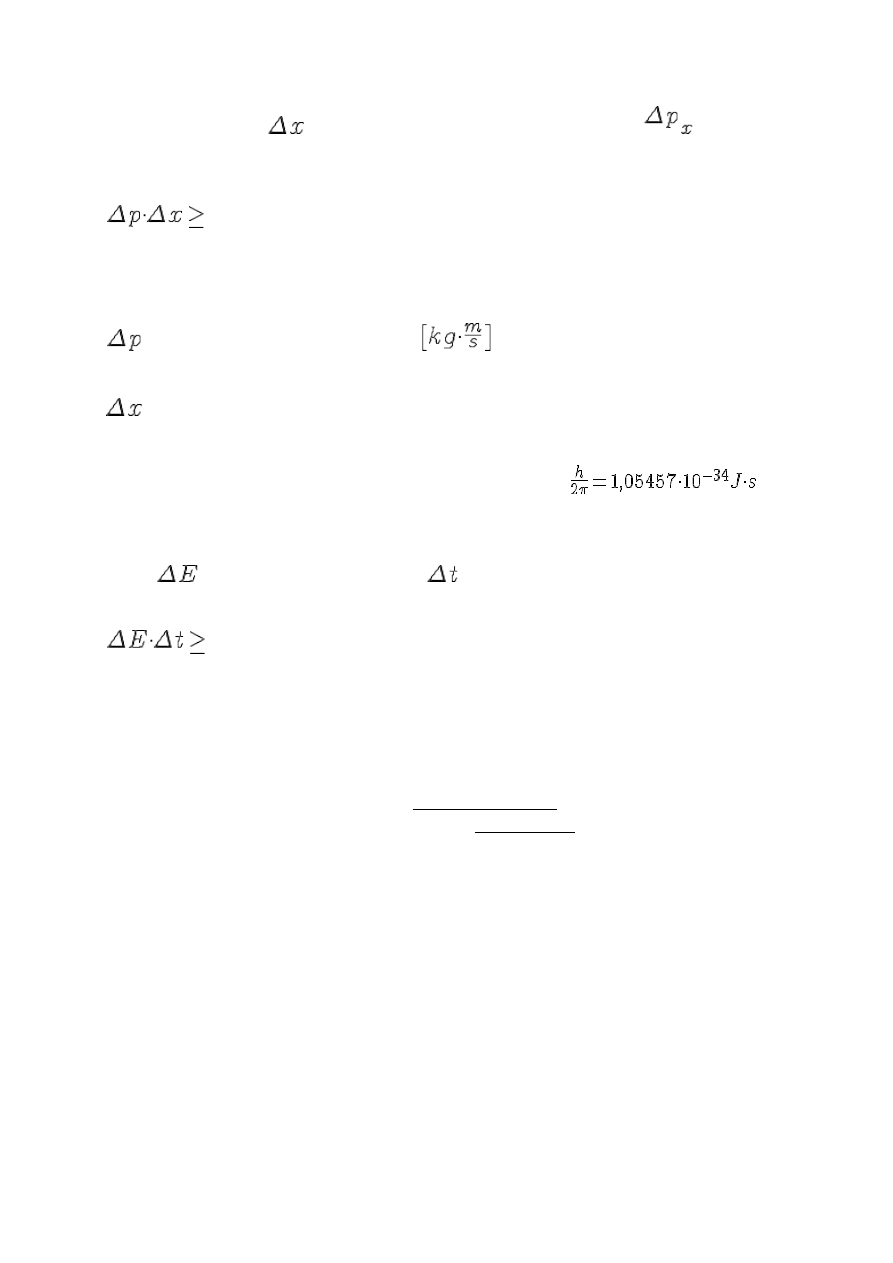
współrzędnej położenia
i odpowiadającej jej składowej pędu mikrocząstki
musi być co
najmniej rzędu elementarnego kwantu działania, czyli stałej Plancka. Wyraża to relacja:
ħ/2,
gdzie:
– nieoznaczoność pędu w kierunku osi x,
;
– nieoznaczoność położenia wzdłuż tej osi, [m];
h – modyfikacja stałej Plancka, stała Diraca (czytamy: h-kreślone), h=
.
Zasadę nieoznaczoności można też wyrazić przez iloczyn nieokreśloności wartości energii
układu
i czasu zajścia pewnego zjawiska
:
ħ/2
Sformułowana w ten sposób zasada nieoznaczoności wyznacza dolną granicę szerokości linii
widmowych.
Uwaga! Ze względu na małą wartość h zasada nieoznaczoności nie stanowi żadnego ograniczenia dla
jednoczesnego wyznaczenia położenia i pędu ciał makroskopowych z największą wymaganą
dokładnością. Jednakże w opisie stanu mechanicznego mikroukładów
(np. elektronów) rezygnujemy z
dokładnie zadanych wartości współrzędnych położenia cząstek, wprowadzając w mechanice
kwantowej zamiast tego pojęcie prawdopodobieństwa znalezienia cząstki w interesującym nas
elemencie objętości.
Przykłady obliczeń:
1. Obliczyć długość fali de Brogli’a dla protonu poruszającego się z prędkością 0,01% prędkości
światła.
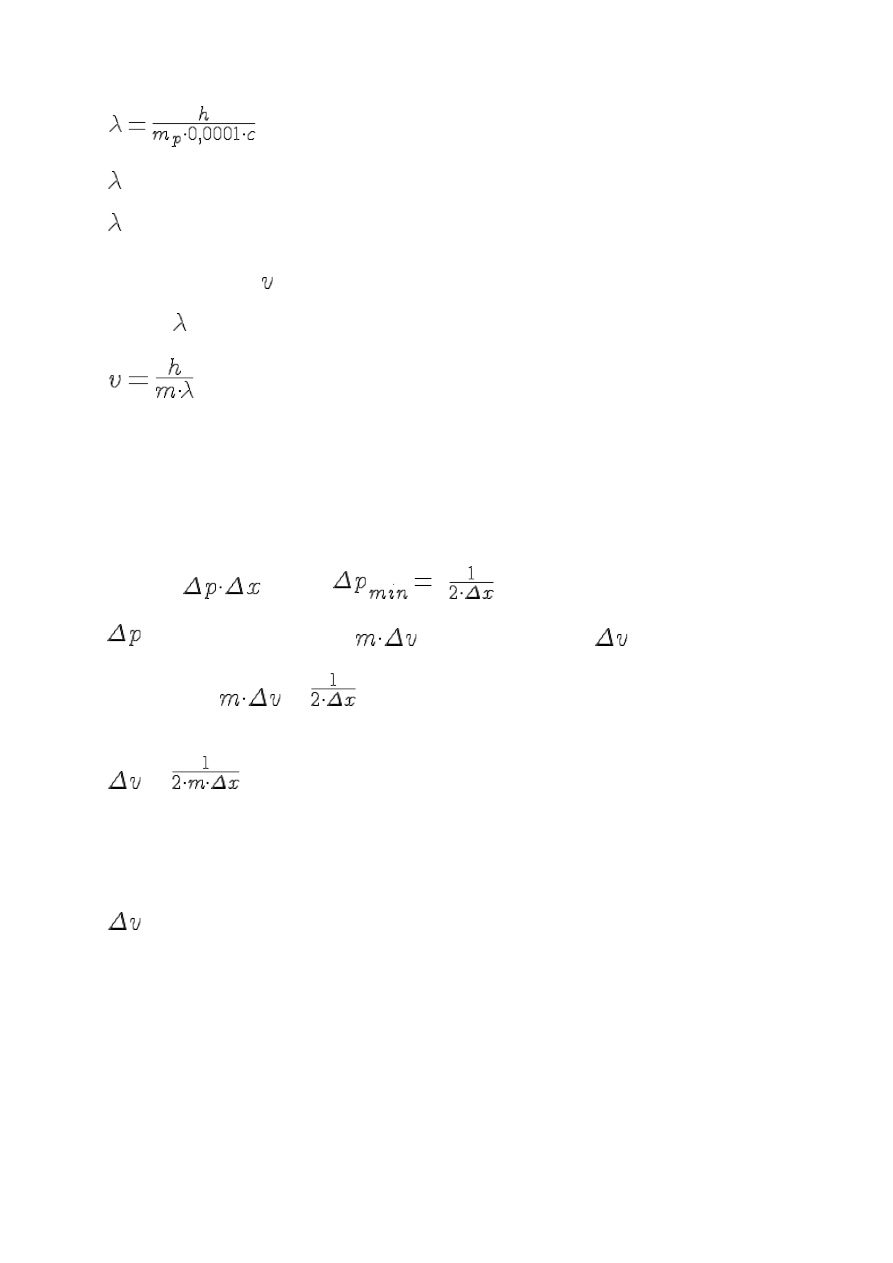
= 6,6262
.
10
-34
J
.
s/((1,6726
.
10
-27
kg)
.
(0,0001
.
2,9979
.
10
8
))
= 1,3215
.
10
-11
m
2. Jaka była prędkość cząsteczki azotu (w m/s), jeżeli wiadomo, że długość fali de Brogli’a
wynosiła = 45 µm?
v = 6,6262
.
10
-34
J
.
s/((14,0067
.
2
.
1,6605
.
10
-27
kg)
.
(45
.
10
-12
m))
v = 316,55 m/s
3. Jaka jest najmniejsza nieoznaczoność prędkości elektronu w jednowymiarowym obszarze o
długości rzędu 10 pm?
Ponieważ
≥ħ/2, to
ħ
.
możemy również zapisać jako
, gdzie m – masa cząstki,
– nieoznaczoność jej
prędkości, czyli
= ħ
. Wobec tego nieoznaczoność prędkości jest równa:
= ħ
.
Dla elektronu o masie 9,1094
.
10
-31
kg w jednowymiarowym obszarze najmniejsza nieoznaczoność
prędkości wynosi:
= 1,05457
.
10
-34
J
.
s/(2
.
9,1094
.
10
-31
kg
.
10
-11
m)
= 5,7884
.
10
6
m/s.
KONFIGURACJE ELEKTRONOWE:
Wraz ze wzrostem liczby atomowej pierwiastka wzrasta liczba elektronów. Poszczególne
powłoki elektronowe atomu wypełnia się elektronami, umieszczając je na różnych
orbitalach atomowych zgodnie z trzema regułami:

1. Zasada rozbudowy.
Konfiguracje elektronowe buduje sie od dołu, wykorzystując najpierw
orbitale o niższej energii.
Kolejność energetyczna orbitali jest następująca: 1s, 2s, 2p, 3s, 3p,
4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d
*)
2. Reguła Hunda.
W orbitalach zdegenerowanych zachowana jest maksymalna multipletowość
spinowa
, czyli sparowanie elektronów nie następuje, dopóki każdy zdegenerowany orbital
nie jest w połowie wypełniony.
3. Zakaz Pauliego.
Nie mogą istnieć dwa elektrony scharakteryzowane przez te same cztery
liczby kwantowe.
Gdy dwa elektrony zajmują ten sam orbital, muszą mieć różne spiny.
Ponieważ spinowa liczba kwantowa przybiera tylko jedną z dwóch wartości (-1/2, +1/2), na
orbitalu może znajdować się najwyżej dwa elektrony.
Jeżeli wyżej wymienione reguły są spełnione, odpowiadająca im konfiguracja elektronowa jest
konfiguracją stanu podstawowego pierwiastków. Możliwe są inne konfiguracje elektronowe, są to
jednak konfiguracje stanów wzbudzonych. Będziemy rozpatrywać konfiguracje elektronowe stanu
podstawowego pierwiastków. W przypadku cięższych pierwiastków (o większych liczbach
atomowych) mogą nastąpić odstępstwa od podanej kolejności wynikające z oddziaływania
elektronów między sobą.
Przykłady pytań:
1. Czy są możliwe następujące konfiguracje elektronowe atomów w stanie podstawowym:
a) 1s
2
2s
2
2p
6
3s
2
3p
8
4s
2
b) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
10
4p
6
c) [Kr] 4s
2
4p
6
5s
2
d) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
14
4p
6
5s
2
e) [Ne] 5s
2
4d
8
5p
6
6s
2
f) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
8
4p
6
5s
2
g) 1s
2
2s
2
2p
x
2
2p
y
1
2p
z
0
Odp.: Żadna z podanych konfiguracji elektronowych nie jest możliwa.Są naruszone zasady:
a) 1s
2
2s
2
2p
6
3s
2
3p
8
4s
2
- zakaz Pauliego;
b) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
10
4p
6
- zasada rozbudowy;
c) [Kr] 4s
2
4p
6
5s
2
- użyto nieodpowiedniego rdzenia konfiguracji elektronowej;
d) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
14
4p
6
5s
2
- zakaz Pauliego;
e) [Ne] 5s
2
4d
8
5p
6
6s
2
- użyto nieodpowiedniego rdzenia konfiguracji elektronowej;
f) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
8
4p
6
5s
2
- zasada rozbudowy;
g) 1s
2
2s
2
2p
x
2
2p
y
1
2p
z
0
- reguła Hunda.
2. Napisać konfigurację elektronową jonu jednododatniego pierwiastka o liczbie atomowej
Z=47.
Odp.: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
0
4d
10
lub [Kr] 4d
10

Uwaga 1: Należy pamiętać, że elektronami walencyjnymi są elektrony
najbardziej zewnętrznych powłok elektronowych (czyli znajdujących sie najdalej radialnie od
jądra). W rozpatrywanym przypadku odrywany jest elektron z 5sa nie z 4d.
Uwaga 2: Podczas pisania konfiguracji elektronowych jedyną informacją potrzebną (i
dostępną!) jest liczba atomowa pierwiastka. Posługiwanie się układem okresowym
pierwiastków jest zabronione.
Uwaga 3: Nie należy mylić kolejności wypełniania elektronami powłok elektronowych
a kolejności zapisu konfiguracji elektronowych. Ta ostatnia dopuszcza dwie formy: 1. zgodnie
z kolejnością wypełniania orbitali; 2. zgodnie z kolejnością radialną (pisanie powłokami). Np.
dla Z=30 zgodnie z pierwszą formą zapiszemy: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
, wg drugiego
sposobu zapisu będzie: 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
. Pierwsza forma sprzyja prawidłowemu
napisaniu konfiguracji elektronowej atomu ( o ile sie zna kolejność wypełniania!), druga
pomaga podczas pisania konfiguracji elektronowej jonu bezbłędnie określić, z której powłoki
najpierw zostaną oderwane elektrony.
OKRESOWOŚĆ WŁAŚCIWOŚCI PIERWIASTKÓW:
Układ okresowy odkryto dzięki obserwacji systematycznych zmienności właściwości pierwiastków.
Jeżeli umieścimy obok siebie pierwiastki chemiczne szeregując je według rosnących liczb atomowych,
to dostrzeżemy, że co 8-my, co 18-ty lub co 32-gi pierwiastek wykazuje podobne cechy chemiczne.
Okresowość zmian charakteru chemicznego pierwiastków wraz ze wzrostem masy atomowej była
podstawą w skonstruowanej przez D.I. Mendelejewa tablicy nazwanej układem okresowym
pierwiastków. Dzisiaj wiemy, że o własnościach chemicznych i fizycznych pierwiastka decyduje ilość
elektronów w atomie a szczególnie ilość elektronów na powłokach zewnętrznych oraz ich kształt.
Takimi właściwościami są:
rozmiary atomów i jonów,
wartości energii jonizacyji,
powinowactwo elektronowe,
elektroujemność i elektrododatność,
własności elektryczne i magnetyczne,
okresowość cech chemicznych pierwiastków.
Zobaczymy na przykładzie energii jonizacji i promieni atomowych zależność tych właściwości od
konfiguracji elektronowych.
PROMIENIE ATOMOWE I JONOWE:
Promień atomowy - odległość najdalej położonych elektronów występujących w danym atomie od
jądra tego atomu, ustalana teoretycznie dla atomów uczestniczących w hipotetycznych wiązaniach
chemicznych.
Promienie atomowe, w odróżnieniu od rzeczywistych promieni walencyjnych ustalanych
eksperymentalnie, są określane na drodze teoretycznych obliczeń kwantowo-mechanicznych
(wartości ich mogą się różnić, mimo że ich definicja jest bardzo podobna).

W okresie promienie atomów zmniejszają się wraz ze wzrostem liczby atomowej. Jest to związane z
silniejszym przyciąganiem elektronów przez jądro, ładunek którego wzrasta. Największe promienie
atomów w poszczególnych okresach mają litowce (tab.1), najmniejsze - helowce .
Tabela 1. Promienie atomowe pierwiastków II i III okresów (w pikometrach).
3
Li
167
4
Be
112
5
B
87
6
C
67
7
N
56
8
O
48
9
F
42
11
Na
190
12
Mg
145
13
Al
118
14
Si
111
15
P
98
16
S
88
17
Cl
79
W obrębie grup promienie atomów wzrastają wraz ze wzrostem liczb atomowych
.
Jest to
spowodowane większą liczbą powłok elektronowych (tab.2), co ma większy wpływ, niż wzrastający
ładunek jądra.
Tabela 2. Promienie atomowe pierwiastków I i II grup (w pikometrach).
3
Li
167
4
Be
112
11
Na
190
12
Mg
145
19
K
243
20
Ca
194
37
Rb
265
38
Sr
219
55
Cs
298
56
Ba
253
Okresowym zmianom ulegają również rozmiary jonów pierwiastków.
Promień jonowy - to odległość najbardziej oddalonych elektronów od jądra atomu w przypadku
jonów utworzonych z jednego atomu, lub też od geometrycznego centrum jonów złożonych z
większej liczby atomów.
Promienie jonowe wyznacza się na podstawie rentgenostrukturalnych pomiarów kryształów
jonowych. Przyjmuje się tu podobną zasadę, jak w przypadku wyznaczania promieni walencyjnych
atomów, uśredniając długości wiązań jonowych, jakie tworzy dany jon z innymi jonami.
W przypadku jonów prostych, tj. utworzonych z pojedynczych atomów, ich promień jonowy jest
zazwyczaj większy lub mniejszy od promieni Van der Waalsa wyjściowych atomów. Promienie
anionów są większe od promieni tworzących ich atomów, zaś w przypadku kationów jest odwrotnie.
Czym większy ładunek ujemny posiada dany anion, tym jego promień jest większy, a czym większy
ładunek dodatni ma kation, tym jego promień jest mniejszy. Jest to związane z liczbą elektronów
( pod warunkiem, że ładunek jądra jest stały) - im więcej jest elektronów, tym większe są siły
odpychania pomiędzy nimi, tym większy jest promień jonu (atomu).
Promieni jonowe zależą również od ładunku jądra. Przy identycznej liczbie elektronów (jony
izoelektronowe) wraz ze wzrostem liczby atomowej promień jonowy maleje. Jest to wynikiem
przyciągania powłok elektronowych bliżej jądra przez większy dodatni ładunek. (tab.3)
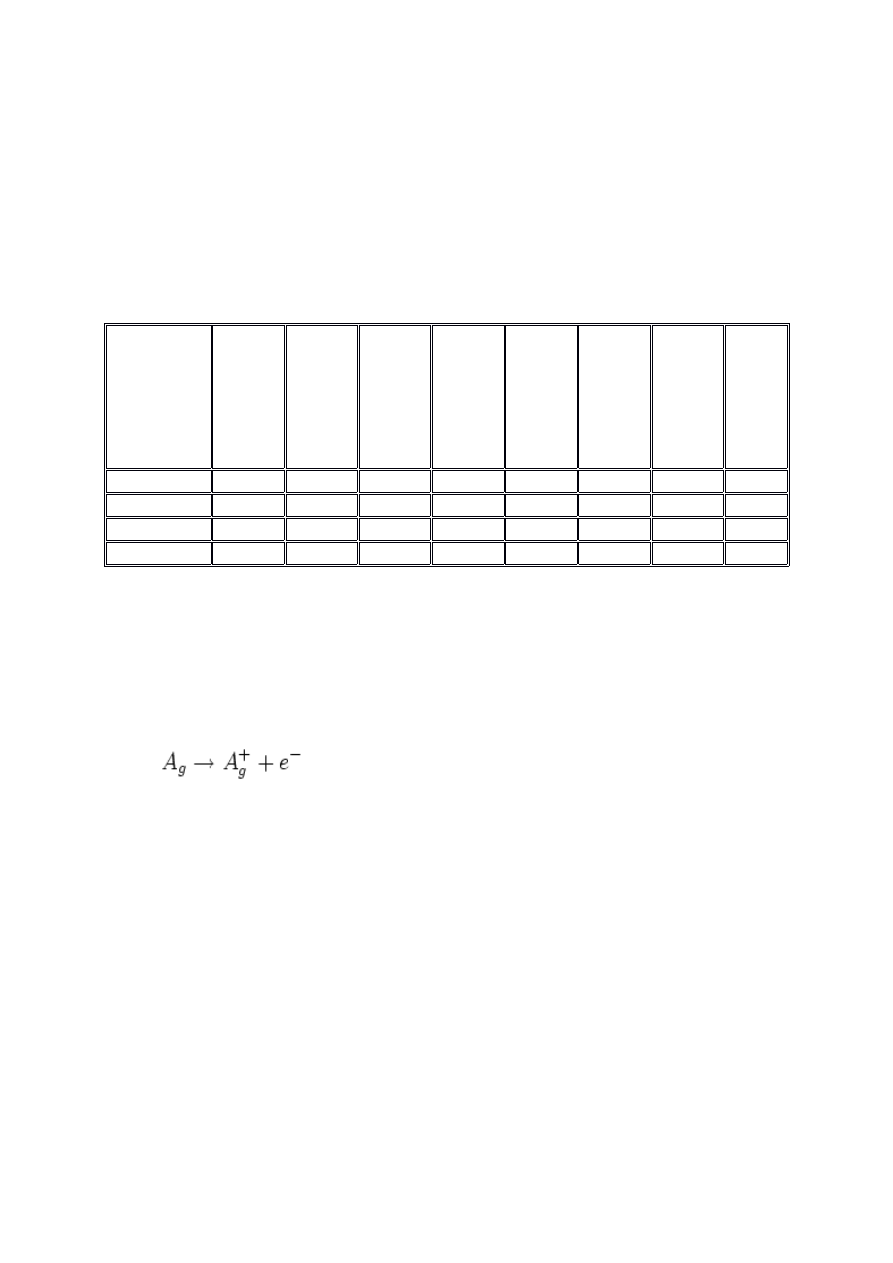
Tablica 3. Promienie niektórych jonów izoelektronowych
Gaz szlachetny,
konfigurację
elektronową
którego
posiadają jony
izoelektronow
e
Jon
Promień,
pm
Jon
Promień,
pm
Jon
Promień,
pm
Jon
Promień,
pm
Ne
O
2-
140
F
-
119
Na
+
96
Mg
2+
65
Ar
S
2-
212
Cl
-
170
K
+
133
Ca
2+
99
Kr
Se
2-
202
Br
-
187
Rb
+
148
Sr
2+
113
Xe
Te
2-
222
I
-
212
Cs
+
169
Ba
2+
135
ENERGIA JONIZACJI:
Energia jonizacji (pierwsza) pierwiastka - jest to minimum energii potrzebnej do oderwania jednego
elektronu od atomu danego pierwiastka w stanie gazowym [2].
Proces ten opisuje równanie:
W odniesieniu do oderwania się odpowiednio 2, 3 i więcej elektronów od atomu wieloelektronowego
mówi się o drugiej, trzeciej itp. energii jonizacji. W miarę usuwania kolejnych elektronów atomu
energia jonizacji powstałego kationu rośnie, przy czym największa energia jonizacji związana jest z
oderwaniem elektronu z powłoki wewnętrznej (w tabeli 4 jest zaznaczona kolorem czerwonym).

Tabela.4
Kolejne energie jonizacji I
n
(kJ/mol) atomów pierwiastków trzeciego okresu
Pierwiastek
I
1
I
2
I
3
I
4
I
5
I
6
I
7
Na
495,8
4564
—
—
—
—
—
Mg
737,7
1451
7730
—
—
—
—
Al
577,6
1817 2744
11600
—
—
—
Si
786,5
1577 3228 4350
16100
—
—
P
1011,8
1904 2910 4950
6270
21200
—
S
999,6
2253 3380 4565
6950
8490
27000
Cl
1251,2
2296 3850 5160
6560
9360
11000
Ar
1520,6
2666 3946 5770
7230
8780
12000
Energia jonizacji (E.j.) zmienia się wraz ze zmianą liczby atomowej (l.a.). Wraz ze wzrostem tej
ostatniej w grupie E.j. maleje.
Wraz ze wzrostem liczby atomowej w okresie E.j. ma tendencje do wzrostu, jednak nie jest ten
wzrost liniowy (rys. 1). Jak widać z wykresu największe wartości energii jonizacji posiadają helowce
(mają wypełnioną powłokę elektronową), najniższe - litowce (po oderwaniu 1 elektronu uzyskują
konfigurację elektronową najbliższego helowca).Jak wynika z wykresu wartość energii jonizacji
związana jest z konfiguracją elektronową. Również wysokimi wartościami E.J. charakteryzują się
azotowce (w połowie wypełniona podpowłoka) oraz berylowce i cynkowce ( w całości wypełnione
podpowłoki).
Document Outline
- DEFEKT MASY, ENERGIA WIĄZANIA:
- Przykłady obliczeń:
- 1. Obliczyć energię wiązania przypadającą na jeden nukleon dla 126C, przyjmując, że masa jego jądra wynosi 12,000000u.
- 2. Obliczyć energię wiązania nukleonów Ew.n. w przypadku jednego mola jąder atomowych 94Be. Masa mola protonów wynosi 1,007g/mol, neutronów – 1,009g/mol.
- DUALISTYCZNY CHARAKTER PROMIENIOWANIA ELEKTROMAGNETYCZNEGO:
- Przykłady obliczeń:
- DUALISTYCZNY CHARAKTER CZĄSTEK MATERII:
- Relacja de Broglie’a: Dualizm korpuskularno-falowy jest cechą nie tylko cząstek światła (fotonów), lecz i wszystkich sząstek materialnych o masie spoczynkowej różnej od zera. Tę hipotezę Lui de Broglie ogłosił w 1924 roku. Z ruchem każdej cząstki materii związany jest pewny ruch falowy, przy czym wielkości charakteryzujące ruch mechaniczny cząstki (pęd, energia) i towarzyszącą mu falę materii (długość fali, częstość drgań) związane są równaniami: , De Broglie podał następujący wzór na długość fali materii: , gdzie: - długość fali poruszającej się cząstki materii (długość fali de Brogli’a); h – stała Plancka, ; m – masa cząstki, [kg]; – prędkość, z którą porusza się cząstka, [m/s]; – pęd poruszającej się cząstki, .
- Zasada nieoznaczoności:
Wyszukiwarka
Podobne podstrony:
Wykład Chemia kwantowa 11
Notatki chemia analityczna
chemia kwantowa
Wykład Chemia kwantowa 2
Chemia kwantowa do druku (5)
Wykład Chemia kwantowa 12
Zadania kolokwium 2 chemia, UR IŚ, Notatki, chemia
Wykład Chemia kwantowa 6 6
Przegląd zadań z odpowiedziami, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
calosc chemia kwantowa, Chemia kosmetyczna
notatki chemia
Rownowaga Chemiczna Zadania, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
e notatka chemia fizyczna 1
Kolokwium nr 1 chemia kwantowa, Chemia kosmetyczna
chemia notatka, Chemia(1)
sciagaprzerobiona, matematyka i chemia kwantowa
więcej podobnych podstron