
‹#›
RJC
Substytucja Nukleofilowa
Substytucja Nukleofilowa
S
S
N
N
1
1
Substytucja Nukleofilowa
Substytucja Nukleofilowa
S
S
N
N
1
1
Slides 1 to 22
R
1
R
2
R
3
Nu

‹#›
RJC
Substytucja Nukleofilowa S
Substytucja Nukleofilowa S
N
N
2
2
Szereg reaktywności halogenków alkilowych w
Szereg reaktywności halogenków alkilowych w
reakcjach S
reakcjach S
N
N
2 (wg rzędowości halogenku): 1>2>>3
2 (wg rzędowości halogenku): 1>2>>3
CH
3
CH
3
Br
CH
3
Br
CH
3
H
H
Br
CH
3
H
CH
3
Br
CH
3
CH
3

‹#›
RJC
Substytucja Nukleofilowa S
Substytucja Nukleofilowa S
N
N
1
1
Szereg reaktywności halogenków alkilowych w
Szereg reaktywności halogenków alkilowych w
reakcjach S
reakcjach S
N
N
1 (wg rzędowości halogenku)
1 (wg rzędowości halogenku)
1
1°°<< 2
<< 2°°< 3
< 3°°..
CH
3
CH
3
Br
CH
3
Br
CH
3
H
H
Br
CH
3
H
CH
3
Br
CH
3
CH
3

‹#›
RJC
Zależy wyłącznie od stężenia
Zależy wyłącznie od stężenia substratu,
substratu, ponieważ
ponieważ
to on jest włączony w postawanie stanu
to on jest włączony w postawanie stanu
przejściowego, który zawsze limituje szybkość
przejściowego, który zawsze limituje szybkość
reakcji.
reakcji.
Reakcje S
Reakcje S
N
N
1 : Szybkość Reakcji
1 : Szybkość Reakcji
substrat
Nu
+ CH
3
Y
Nu
CH
3
+
Y

‹#›
RJC
Mechanizm S
Mechanizm S
N
N
1
1
Reakcja przebiega w dwóch etapach (stepwise).
Reakcja przebiega w dwóch etapach (stepwise).
Nu
....
CH
3
CH
3
....
Y
Energia
Postęp reakcji
Nu + CH
3
Y
NuCH
3
+ Y
CH
3
+

‹#›
RJC
Reakcje S
Reakcje S
N
N
1
1 –
–
Mechanizm & Stereochemia
Mechanizm & Stereochemia
Y
R
1
R
2
R
3
Nu
Y
R
1
R
2
Nu
R
R
2
R
3
R
1
R
2
R
3
Nu
R
1
R
2
R
3
Nu

‹#›
RJC
Nu
....
CH
3
CH
3
....
Y
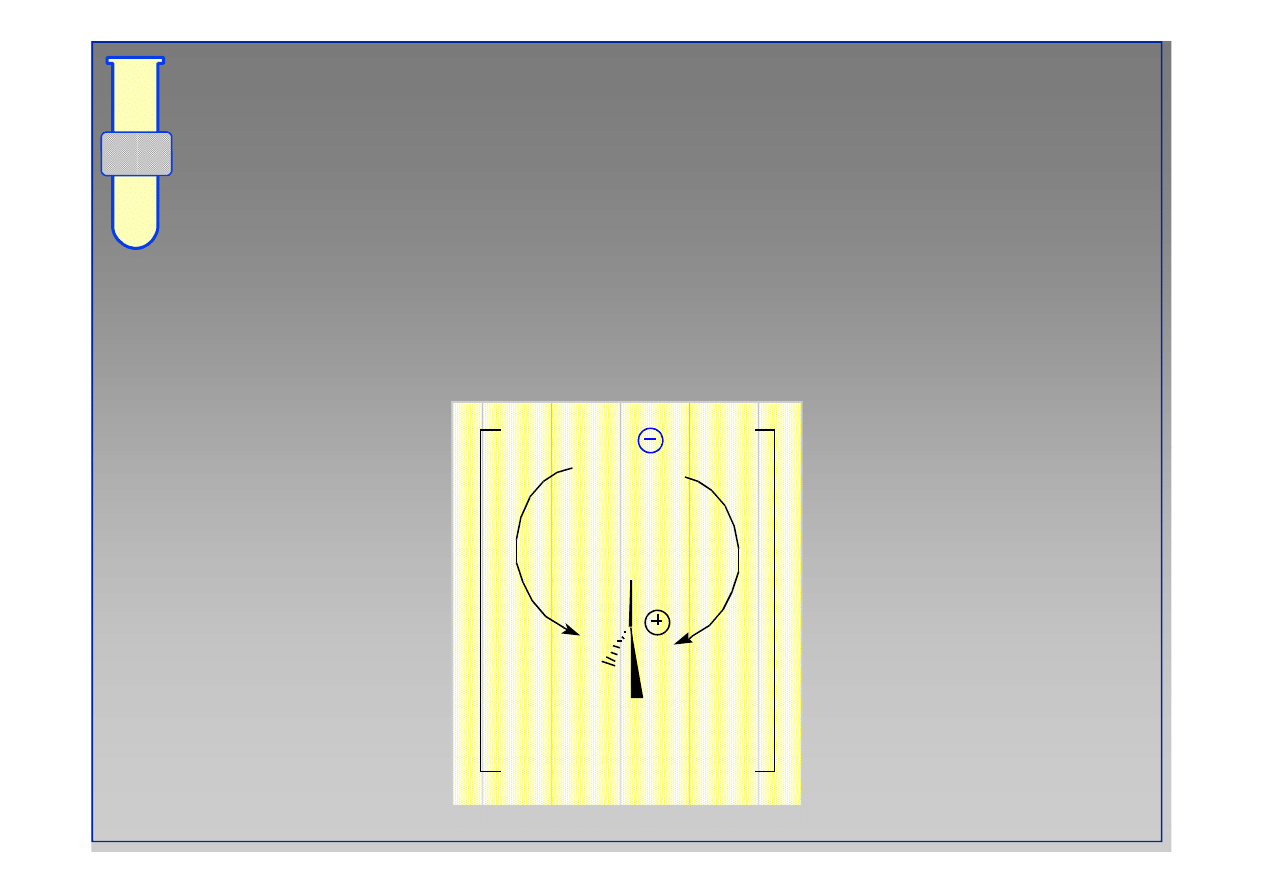
Diagram Energetyczny Reakcji S
Diagram Energetyczny Reakcji S
N
N
1
1
Szybkość reakcji jest określona przez energię
Szybkość reakcji jest określona przez energię
aktywacji najwolniejszego etapu, tj. powstawania
aktywacji najwolniejszego etapu, tj. powstawania
karbokationu (
karbokationu (
∆∆
G
G
‡
‡
))
Energia
Postęp reakcji
Nu + CH
3
Y
NuCH
3
+ Y
CH
3
+
∆
G
‡
‹#›
RJC
Zachowanie Nukleofila
Zachowanie Nukleofila
... nie wywiera wpływu na szybkość reakcji;
... nie wywiera wpływu na szybkość reakcji;
wszystkie nukleofile reagują jednakowo z
wszystkie nukleofile reagują jednakowo z
utworzonym w pierwszym etapie karbokationem.
utworzonym w pierwszym etapie karbokationem.
R
1
R
2
R
3
Nu

‹#›
RJC
Czynniki Wpływające na Wartość
Czynniki Wpływające na Wartość
∆∆∆∆∆∆∆∆
G
G
‡
‡
Substrat
Grupa opuszczająca
Rozpuszczalnik

‹#›
RJC
Substrat
Substrat
Im bardziej trwały jest stan przejściowy określający
Im bardziej trwały jest stan przejściowy określający
szybkość reakcji, tym niższa jest energia
szybkość reakcji, tym niższa jest energia
∆∆
G
G
‡
‡
(reakcja zachodzi szybciej).
(reakcja zachodzi szybciej).
∆
G
‡
Energia
Nu + CH
3
Y
NuCH
3
+ Y
∆
G
Postęp reakcji

‹#›
RJC
Trwałość Karbokationu
Trwałość Karbokationu
Im więcej podstawników w karbokationie, tym jest
Im więcej podstawników w karbokationie, tym jest
on trwalszy.
on trwalszy.
(CH
3
)
3
C
+
Malejąca reaktyw. typu S
N
1
3 3
(CH
3
)
2
CH
+
CH
3
CH
2
+
CH
3
+

‹#›
RJC
Względne Szybkości Reakcji
Względne Szybkości Reakcji
R
Br + H
2
O
R
OH + HBr
(CH
3
)
3
C
Br
1200
(CH
3
)
2
CH
Br
0.012
CH
3
CH
2
Br
0.001
CH
3
Br
0.001

‹#›
RJC
Rezonansowa Stabilizacja Karbokationu
Rezonansowa Stabilizacja Karbokationu
Karbokation jest stabilizowany w wyniku efektu
Karbokation jest stabilizowany w wyniku efektu
rezonansu.
rezonansu.
Kation allilowy

‹#›
RJC
Rezonansowa Stabilizacja Karbokationu
Rezonansowa Stabilizacja Karbokationu
Karbokation jest stabilizowany w wyniku efektu
Karbokation jest stabilizowany w wyniku efektu
rezonansu..
rezonansu..
Karbokation benzylowy

‹#›
RJC
Względne Szybkości Reakcji
Względne Szybkości Reakcji
Im bardziej trwały jest pośredni karbokation, tym
Im bardziej trwały jest pośredni karbokation, tym
szybciej zachodzi reakcja typu S
szybciej zachodzi reakcja typu S
N
N
1.
1.
3° > 2° ~ allyl ~ benzyl > 1°
N
Malejąca reaktyw. S
N
1

‹#›
RJC
Grupa Opuszczająca
Grupa Opuszczająca
Dobra grupa opuszczająca Y musi być słabym
Dobra grupa opuszczająca Y musi być słabym
nukleofilem, czyli słabą zasadą.
nukleofilem, czyli słabą zasadą.
Nu: + CH
3
Y
NuCH
3
+
Y:

‹#›
RJC
Popularne Grupy Opuszczające
Popularne Grupy Opuszczające
TsO
-
60
F
-
0.001
Względna reakt.
Względna reakt.
Y
Y
I
-
30
HO
-
0
Br
-
10
H
2
N
-
0
Cl
-
0.2
RO
-
0

‹#›
RJC
Cząsteczka H
Cząsteczka H
2
2
O może być także grupą
O może być także grupą
opuszczającą
opuszczającą
Reakcje S
Reakcje S
N
N
1 są zwykle przeprowadzane w
1 są zwykle przeprowadzane w
roztworach kwasów; w takich
roztworach kwasów; w takich przypadkach
przypadkach woda
woda
(H
(H
2
2
O) może być grupą opuszczającą.
O) może być grupą opuszczającą.
R
O
H
R
O
H
H
HCl
-H
2
O
R
RCl
+Cl

‹#›
RJC
Rozpuszczalnik
Rozpuszczalnik
Nukleofile są to cząsteczki o dużej gęstości
Nukleofile są to cząsteczki o dużej gęstości
elektronowej; są one na ogół polarne; należy użyć
elektronowej; są one na ogół polarne; należy użyć
polarnych rozpuszczalników do ich dobrego
polarnych rozpuszczalników do ich dobrego
rozpuszczenia.
rozpuszczenia.
“...Podobne rozpuszcza podobne...”
“...Polarne rozpuszcza polarne...”
“...Nie-polarne rozpuszcza nie-polarne...”

‹#›
RJC
Trwałość Karbokationu
Trwałość Karbokationu
... karbokation jest dobrze stabilizowany przez polarne
... karbokation jest dobrze stabilizowany przez polarne
rozpuszczalniki protyczne, takie jak H
rozpuszczalniki protyczne, takie jak H
2
2
O, CH
O, CH
3
3
OH...
OH...
R
+
•
•
•
•
•
•
• • •
•

‹#›
RJC
Na przykład ...
Na przykład ...
W
W H
H
2
2
O
O podana
podana reakcja
reakcja jest 100.000 razy szybsza
jest 100.000 razy szybsza
niż w
niż w EtOH
EtOH oraz nieskończenie szybsza niż w
oraz nieskończenie szybsza niż w
heksanie
heksanie
(CH
3
)
3
C
Cl
+
RO
H (CH
3
)
3
C
OR
+ H
C
l

‹#›
RJC
Podsumowanie
Podsumowanie
Substytucja nukleofilowa, S
N
1
Stereochemistry; Racemization problem
Diagram energetyczny
Karbokation jako związek przejściowy
Karbokation jako związek przejściowy
Grupa opuszczająca, H
2
O jako grupa
opuszczająca
Rozpuszczalnik
Trwałość karbokationu
Polarne rozpuszczalniki protyczne
Wyszukiwarka
Podobne podstrony:
Test SN1
chorg w 5 cykloalkany
chorg w 10 addycje elektrofilowe
chorg w 1 orbitale id 114494 Nieznany
chorg w 12 rodniki
chorg w 8 e1 e2
chorg w 16 grupy fukcyjne
chorg w 11 alkiny
chorg w 15 zasady kwasy
chorg w 6 sn2
chorg w 9 alkeny
chorg w 3 stereochemistry
chorg w 13 arenys
chorg w 4 konfiguracja absolutna
chorg w 18 c=o substytucja
SN1
Kolorowe sn1
więcej podobnych podstron