
Procesy Rozdzielania
projekt II
wariant nr 28
Michał Kuśmierczyk gr. 2
Prowadzący:
DR INŻ
.
J
AN
N
OWOSIELSKI
Warszawa, grudzień 2008
Zadanie 1.
1.1. Tre
ść
zadania
Sól (siarczan amonu) oczyszcza si
ę
z niewielkiej ilo
ś
ci nierozpuszczalnych zanieczyszcze
ń
poprzez ługowanie
rozcie
ń
czonym roztworem tej soli. Roztwór ługuj
ą
cy (ubogi) jest podgrzany do temperatury t1 = 375 K. Otrzymany
w wyniku ługowania roztwór bogaty jest chłodzony w regeneratorze ciepła, a nast
ę
pnie w dodatkowej chłodnicy do
temperatury t2 = 293 K. Po ochłodzeniu wykrystalizowana sól jest oddzielana, za
ś
roztwór ubogi zawracany
poprzez regenerator ciepła i zagrzewacz do ługowania. Temperatura soli surowej wynoci t2. Okre
ś
li
ć
ciepło
wymienione w regeneratorze, ciepło dostarczane w zagrzewaczu, ilo
ść
roztworu ubogiego oraz ilo
ść
roztworu
bogatego przypadaj
ą
ce na kilogram wydzielonej soli. W obliczeniach pomin
ąć
pojemno
ść
ciepln
ą
zanieczyszcze
ń
i przyj
ąć
wyrównanie temperatur na odpowiednim ko
ń
cu regeneratora.
1.2. Dane projektowe
t1
85
:=
[
ο
C]
t2
20
:=
[
ο
C]
1.3. Obliczenia i rozwi
ą
zanie
Wprowadzamy nast
ę
puj
ą
ce oznaczenia stanów w układzie:
1. Wylot z rozdzielacza - roztwór nasycony o temp. t
2
2. Wylot cieczy ubogiej z regeneratora - roztwór o temp. t
2
'
3. Wylot cieczy ubogiej z dogrzewacza - roztwór o temp. t
1
4. Wylot cieczy bogatej ze zbiornika gdzie nast
ę
puje rozpuszczanie - roztwór nasycony o temp. t
1
'=t
2
'
5. Wylot cieczy bogatej z regeneratora - roztwór nasycony + kryształy o temperaturze t
1
".
6. Wylot cieczy bogatej z chłodnicy - roztwór nasycony + kryształy o temperaturze t
2
.
7. Wlot solli zanieczyszczonej o temperaturze t
2
.
Dochodzi do zrównania temperatur na wylocie strumienia o mniejszej pojemno
ś
ci cieplnej (tzn. o mniejszym
strumieniu cieplnym). Jest to ciecz uboga.
Na podstawie powy
ż
szych oznacze
ń
znane jest poło
ż
enie punktów 1, 3, 7. S
ą
one nanoszone na wykres. Znaj
ą
c
poło
ż
enie punktu 1 odczytujemy skład cieczy ubogiej:
xL
0.42
:=
Na przeci
ę
ciu si
ę
odcinka 3–7 z lini
ą
roztworu nasyconego wyznaczamy poło
ż
enie punktu 4, a tym samym
temperatur
ę
oraz skład cieczy bogatej:
t2p
74
:=
[
ο
C]
xR
0.47
:=
Na linii 1–7 le
ż
y dla x=x
R
le
ż
y stan 6.
Punkt 2 znajdujemy poprzez znalezienie punktu przeci
ę
cia izotermy t
2p
oraz prostej x=x
L
.
Odcinek 2–3 okre
ś
la ciepło dostarczone w dogrzewaczu w przeliczeniu na 1 kg (Q/L) cieczy ubogiej. Odcinek 1–2
natomiast okre
ś
la ciepło wymienione w regeneratorze, równie
ż
w przeliczeniu na 1 kg cieczy ubogiej (Q
reg
/L)
Q
L
30
=
[kJ/kg]
Qreg
L
163
=
[kJ/kg]
Qreg
K
1867
=
[kJ/kg]
Ciepło dostarczone do dogrzewacza w przeliczeniu na 1 kg masy kryształów wyznaczamy
graficznie.
Q
K
259
=
[kJ/kg]

Na koniec wyznaczamy stosunki masowe cieczy ubogiej L, ubogiej R oraz kryształów.
Zakładamy 1 kg wydzielonych kryształów.
K
1
:=
L
1
:=
R
1
:=
warto
ś
ci startowe
Given
R
L
K
+
=
R xR
⋅
K
L xL
⋅
+
=
vec
Find L R
,
(
)
:=
K
1
=
[kg]
L
vec
0
10.6
=
:=
[kg]
R
vec
1
11.6
=
:=
[kg]
Zadanie 2.
2.1. Tre
ść
zadania
Krystalizacj
ę
soli (siarczan amonu) prowadzi si
ę
w warniku pod ci
ś
nieniem P = 100 kPa.
Surówka wpływaj
ą
ca do regeneratora ciepła m atemperatur
ę
t
0
= 20
ο
C i st
ęż
enie x
0
= 0,12
(uł.mas.). Okre
ś
li
ć
ciepło wymieniane w regeneratorze, ciepło doprowadzane w warniku, ilo
ść
surówki, ilo
ść
roztworu ubogiego oraz ilo
ść
roztworu bogatego, przypadaj
ą
ce na kilogram
wydzielonej soli je
ś
li w wyniku procesu powinno wykrystalizowa
ć
a = 45% całkowitej ilo
ś
ci soli
doprowadzonej pod postaci
ą
surówki. W obliczeniach przyj
ąć
wyrównanie temperatur na
odpowiednich ko
ń
cach wymiennika.
2.2. Dane projektowe
P
100
:=
[kPa]
t0
20
:=
[
ο
C]
x0
0.12
:=
a
45
:=
2.3. Obliczenia i rozwi
ą
zanie
Wprowadzamy nast
ę
puj
ą
ce oznaczenia stanów w układzie:
1. Wlot surówki do regeneratora – roztwór (t
0
,x
0
)
1'. Wylot podgrzanej surówki z regeneratora - roztwór (temp. 1')
2. Mieszanina trójfazowa w wyparce
3. Roztwór nasycony 3' i kryształy 3'' opuszczaj
ą
ce warnik (x
R
).
4. Para opuszczaj
ą
ca warnik.
5. Schłodzone kryształy i roztwór nasycony, opuszczaj
ą
ce regenerator (x
R,
temp. t
0
*)
6. Wylot kryształów soli o temperaturze t
0
.
7. Wylot roztworu nasyconego o temperaturze t
0
.
Na wykres nanosimy punkty 1, 6, 7.
Z izobary P odczytujemy temperatur
ę
wrzenia (czyli punkt znajduj
ą
cy si
ę
na linii nasycenia).
t
110
:=
[
ο
C]
Znaj
ą
c t
ą
temperatur
ę
wyznaczamy entalpi
ę
pary dla t i P. Mo
ż
emy dzi
ę
ki temu wyznaczy
ć
punkt 4.
i t
( )
2698
:=
[kJ/kg]
Zaznaczamy na wykresie obszar trójfazowy okre
ś
lany przez punkty 4–3'–3".
Znaj
ą
c izoterm
ę
t0 oraz stan 7 wyznaczamy xL.
xL
0.43
:=
W celu wyznaczenia xR rozwi
ą
zujemy poni
ż
szy równa
ń
. Wszystko b
ę
dzie liczone na 1 kg
wykrystalizowanej soli.
K
1
:=
[kg]
S
1
:=
R
1
:=
xR
0.5
:=
L
1
:=
warto
ś
ci startowe
Given
K
a
100
S
⋅
x0
⋅
=
S x0
⋅
R xR
⋅
=
R
K
L
+
=
R xR
⋅
L xL
⋅
K
+
=
vec
Find S R
,
L
,
xR
,
(
)
:=
S
vec
0
:=
R
vec
1
:=
L
vec
2
:=
xR
vec
3
:=
S
18.519
=
[kg]
L
2.842
=
[kg]
R
3.842
=
[kg]
xR 0.578
=
[kg]
Skład mieszaniny cieczy i kryształów opuszczaj
ą
cych warnik to x
R
. Jeste
ś
my w stanie dzi
ę
ki
temu wyznaczy
ć
punkt 3 na izotermie wrzenia oraz punkt 5 na izotermie t
0
. Stan 2 znajduje si
ę
na przeci
ę
ciu linii ł
ą
cz
ą
cej punkty 3 i 4 dla składu x
0
.
Odcinek 3–5 to ciepło oddane w regeneratorze liczone na 1 kg cieczy bogatej.
Qreg
R
259
=
[kJ/kg]
Odcinek 1–1' okre
ś
la ilo
ść
ciepła oddan
ą
w regeneratorze w przeliczeniu na 1 kg surówki.
Qreg
S
59
=
[kJ/kg]
Ciepło dostarczone do wyparki liczone na 1 kg kryształów zostało wyznaczone metod
ą
graficzn
ą
korzystaj
ą
c
jednak z zale
ż
no
ś
ci na podobie
ń
stwo trójk
ą
tów.
Q
K
20061
=
[kJ/kg]
Zadanie 3.
3.1. Tre
ść
zadania
Korzystaj
ą
c z wykresu entalpowego dla układu alkohol etylowy - woda dla surówki o składzie pocz
ą
tkowym
x
0
= 0.15 uł.mol. alkoholu etylowego i temperaturze pocz
ą
tkowej t
0
= 40
ο
C znajduj
ą
cej si
ę
pod ci
ś
nieniem
0,1 MPa, nale
ż
y wyznaczy
ć
:
a) Dla procesu destylacji równowagowej przy stopniu oddestylowania Z
d
= 0,5; składy produktów; temperatur
ę
destylacji; ciepło dostarczone podczas procesu przypadaj
ą
ce na 1 kg surówki, cieczy wyczerpanej i destylatu;
efekty cieplne w chłodnicach, je
ż
eli temperatura ko
ń
cowa produktów wynosi t = 25
ο
C.
b) Dla procesu destylacji ekspansyjnej (surówka zostaje spr
ęż
ona do si
ć
nienia 0.2 MPa, ogrzana do temperatury
wrzenia i po przej
ś
ciu przez zawór dławi
ą
cy rozpr
ęż
ona do ci
ś
nienia 0.1 MPa): składy otrzymanych produktów;
stopie
ń
oddestylowania; temperatur
ę
w separatorze; ciepło dostarczone do zagrzewacza przypadaj
ą
ce na 1 kg
surówki, cieczy wyczerpanej i destylatu; efekty cieplne w chłodnicach je
ś
li temperatura ko
ń
cowa produktów
wynosi t = 25
ο
C.
c) Dla destylacji rózniczkowej przy stopniu oddestylowania Z
d
= 0,35: składy produktów; ciepło dostarczone do
procesu przypadaj
ą
ce na 1 kg surówki, cieczy wyczerpanej i destylatu oraz efekt cieplny w chłodnicy, je
ś
li
temperatura ko
ń
cowa destylatu wynosi t = 25
ο
C.
d) Dla destylacji rózniczkowej półci
ą
głej: stopie
ń
oddestylowania Z
d
, je
ś
li skład cieczy wyczerpanej x
w
= 0.042
uł.mol. etanolu, a stosunek nat
ęż
enia przepłytu surówki do destylatora jest stały i wynosi S/D =
ψ
= 0,5.
3.2. Dane projektowe
x0
0.40
:=
[uł.mol. etanolu]
skład surówki
t0
30
:=
[
ο
C]
temperatura pocz
ą
tkowa
P
0.1
:=
[MPa]
ci
ś
nienie w układzie
Przeliczenie ułamka molowego na masowy:
ME
46
:=
[g/mol] masa molowa etanolu
Mw
18
:=
[g/mol] masa molowa wody
Xmas x
( )
ME x
⋅
1
x
−
(
) Mw
⋅
x ME
⋅
+
:=
ułamek masowy w funkcji ułamka molowego
x0
Xmas x0
( )
:=
x0 0.63
=
[uł.mas. etanolu]
3.3. Obliczenia
a) Destylacja równowagowa
Zd
0.25
:=
stopie
ń
oddestylowania
t
20
:=
[
ο
C]
temperatura ko
ń
cowa
Zapisujemy bilans masowy oraz składnika dla destylarki. S - ilo
ść
surówki, W - ilo
ść
cieczy wyczerpanej, D - ilo
ść
destylatu oraz x
s
=x
0
, x
w
, x
d
odpowiednio ich ułamki masowe.
S
D
W
+
=
S x0
⋅
D y0
⋅
W xw
⋅
+
=
Eliminacja W:
S x0
⋅
D yD
⋅
S xw
⋅
+
D xw
⋅
−
=
Stopie
ń
oddestylowania
Zd
D
S
=
x0 xw
−
yD xw
−
=
Dane równowagi dla układu alkohol etylowy – woda s
ą
stabelaryzowane pod ci
ś
nieniem 0,1 MPa.
Tworzymy zale
ż
no
ść
funkcyjn
ą
interpoluj
ą
c
ą
warto
ś
ci z tabeli.
Y
0
0.350
0.500
0.580
0.630
0.665
0.690
0.705
0.723
0.737
0.748
0.761
0.770
0.795
0.812
0.857
0.917
1.00
:=
X
0.00
0.05
0.10
0.15
0.20
0.25
0.30
0.35
0.40
0.45
0.50
0.55
0.60
0.65
0.70
0.80
0.90
1.00
:=
S
cspline X Y
,
(
)
:=
f x
( )
interp S X
,
Y
,
x
,
(
)
:=
Zale
ż
no
ść
t
ą
mo
ż
na przedstawi
ć
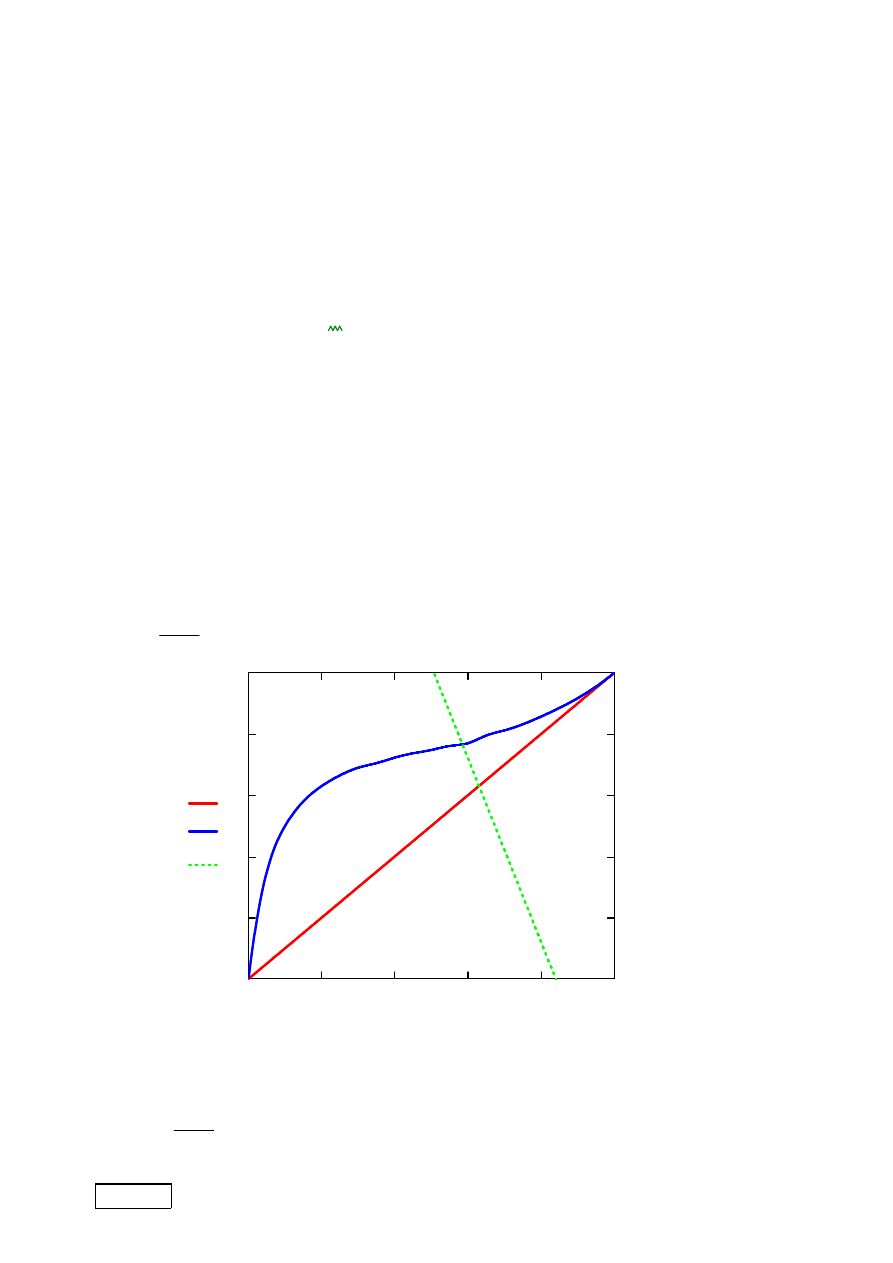
na wykresie.
y x
( )
x
:=
yZd x
( )
x0 x
−
Zd
x
+
:=
przekształcenie stopnia oddestylowania na zale
ż
no
ść
w funkcji x
0
0.2
0.4
0.6
0.8
0
0.2
0.4
0.6
0.8
y x
( )
f x
( )
yZd x
( )
x
Obliczenie składów produktów
Szukamy takiego x spełniaj
ą
cego zadane Z
d
, czyli punktu przeci
ę
cia si
ę
zale
ż
no
ś
ci na y(x) z lini
ą
równowagi.
funcja x
( )
x0 x
−
Zd
x
+
f x
( )
−
:=
xw
root funcja x
( ) x
,
0
,
1
,
(
)
:=
xw 0.585
=
skład cieczy wyczerpanej
Szukamy zatem składu destylatu.
yD
1
:=
warto
ść
startowa dla składu destylatu
Given
Zd
x0 xw
−
yD xw
−
=
yD
Find yD
( )
:=
yD 0.766
=
sklad destylatu
Obliczenie temperatury destylacji
Temperatura destylacji odczytana jest z wykresu i-x. Jest to temperatura izotermy okre
ś
laj
ą
cej równowag
ę
pomi
ę
dzy składem cieczy, a składem pary.
tdest
80.7
:=
[
ο
C]
Obliczanie ciepła dostarczanego podczas procesu
Korzystamy z konstrukcji na wykresie i okre
ś
lamy.
– Ciepło dostarczone podczas procesu na 1kg surówki
Q
S
417
=
[kJ/kg]
– Ciepło dostarczone podczas procesu na 1kg cieczy wyczerpanej
Q
W
583
=
[kJ/kg]
– Ciepło dostarczone podczas procesu na 1kg destylatu
Q
D
1917
=
[kJ/kg]
Obliczanie efektów cieplnych w chłodnicach
Korzystamy z konstrukcji na wykresie.
W chłodnicy destylatu:
QD 1366
=
[kJ/kg]
W chłodnicy cieczy wyczerpanej:
QW 233
=
[kJ/kg]
b) Destylacja ekspansyjna
t
20
:=
[st.C]
temperatura ko
ń
cowa produktów
P1
0.2
:=
[MPa]
ci
ś
nienie po spr
ęż
eniu
P
0.1
=
[MPa]
ci
ś
nienie po rozpr
ęż
eniu
x0 0.63
=
[uł.mas. etanolu]
t0 30
=
[st.C]
temperatura pocz
ą
tkowa
Konstrukcja na wykresie w celu wyznaczenia składów y
d
oraz x
w
na które nast
ą
pi rozdzielenie po zdławieniu.
Surówka zostaje najpierw zagrzana do temperatury wrzenia.
Wyznaczenie składów
Z linii równowagi otrzymano nast
ę
puj
ą
ce składy:
xw
0.616
:=
yD
0.88
:=
Wyznaczenie stopnia oddestylowania
Zd
x0 xw
−
yD xw
−
:=
Zd 0.054
=
Obliczenie ciepła dostarczonego podczas procesu
Korzystamy z konstrukcji na wykresie i okre
ś
lamy.
– Ciepło dostarczone podczas procesu na 1kg surówki
Q
S
260
=
[kJ/kg]
– Ciepło dostarczone podczas procesu na 1kg cieczy wyczerpanej
Q
W
280
=
[kJ/kg]
– Ciepło dostarczone podczas procesu na 1kg destylatu
Q
D
3700
=
[kJ/kg]
Obliczanie efektów cieplnych w chłodnicach
Korzystamy z konstrukcji na wykresie.
W chłodnicy destylatu:
QD 1360
=
[kJ/kg]
W chłodnicy cieczy wyczerpanej:
QW 220
=
[kJ/kg]
c) Destylacja ró
ż
niczkowa
Zd
0.35
:=
stopie
ń
oddestylowania
t
25
:=
[
ο
C]
temperatura ko
ń
cowa
Zapisujemy bilans masowy na deflegmatorze.
L – chwilowa zawarto
ść
moli cieczy w kotle
x – chwilowe st
ęż
enie molowe składnika bardziej lotnego
Cała ilo
ść
moli która uwywa z kotła przechodzi do destylatu, zatem:
dL
−
dD
=
Mo
ż
emy zatem zapisa
ć
:
d L x
⋅
(
)
y x
( ) dL
⋅
=
L dx
⋅
x dL
⋅
+
y x
( ) dL
⋅
=
L dx
⋅
dL y x
( )
x
−
(
)
⋅
=
dL
L
dx
y x
( )
x
−
=
Pocz
ą
tkowa ilo
ść
moli to surówka S, natomiast ko
ń
cowa to ciecz wyczerpana W:
S
W
L
1
L
⌠
⌡
d
x0
xw
x
1
y x
( )
x
−
⌠
⌡
d
=
ln
W
S
x0
xw
x
1
y x
( )
x
−
⌠
⌡
d
=
Zapisuj
ą
c to jako zale
ż
ne od stopnia oddestylowania:
W
S
S
D
−
S
=
1
D
S
−
=
1
Zd
−
=
ln 1
Zd
−
(
)
x0
xw
x
1
y x
( )
x
−
⌠
⌡
d
=
Znaj
ą
c stopie
ń
oddestylowania wyznaczamy skład cieczy wyczerpanej:
xw
0.02
:=
warto
ść
startowa dla składu cieczy wyczerpanej
Given
ln 1
Zd
−
(
)
x0
xw
x
1
f x
( )
x
−
⌠
⌡
d
=
xw
Find xw
( )
:=
xw 0.554
=
skład cieczy wyczerpanej
Z definicji stopnia oddestylowania wyznaczamy skład destylatu:
Given
Zd
x0 xw
−
yD xw
−
=
yD
Find yD
( )
:=
yD 0.771
=
skład destylatu
Obliczenie ciepła dostarczonego podczas procesu
Korzystamy z konstrukcji na wykresie i okre
ś
lamy.
– Ciepło dostarczone podczas procesu na 1kg surówki
Q
S
600
=
[kJ/kg]
– Ciepło dostarczone podczas procesu na 1kg cieczy wyczerpanej
Q
W
840
=
[kJ/kg]
– Ciepło dostarczone podczas procesu na 1kg destylatu
Q
D
1800
=
[kJ/kg]
Obliczanie efektów cieplnych w chłodnicy
Korzystamy z konstrukcji na wykresie.
W chłodnicy destylatu:
QD 1400
=
[kJ/kg]
d) Destylacja półci
ą
gła
xw
0.13
:=
[uł.mol.] etanolu w cieczy wyczerpanej
xw
Xmas xw
( )
:=
xw 0.276
=
[uł.mas.] etanolu w cieczy wyczerpanej
S
D
ψ
=
ψ
0.7
:=
stosunek nat
ęż
enia przepływu surówki do destylatora
Wyznaczenie stopnia oddestylowania
Zapisujemy bilans masowy:
L – wkład do kotła [mol]
S – strumie
ń
podawanej surówki [mol/s]
D – strumie
ń
destylatu [mol/s]
Liczba moli w kotle zmienia si
ę
w czasie:
dL
S dt
⋅
D dt
⋅
−
=
S
S
ψ
−
dt
=
ψ
1
−
ψ
S
⋅
dt
⋅
=
L0
L
L
1
⌠
⌡
d
0
t
t
ψ
1
−
ψ
S
⋅
⌠
⌡
d
=
Zatem otrzymujemy zale
ż
no
ść
na aktualn
ą
liczb
ę
moli w kotle po czasie t:
L t
( )
L0
ψ
1
−
ψ
S
⋅
t
⋅
+
=
W danej chwili składnika bardziej lotnego jest L
.
x:
d L x
⋅
(
)
S x0
⋅
dt
⋅
D y
⋅
dt
⋅
−
=
S x0
⋅
dt
⋅
S
ψ
y
⋅
dt
⋅
−
=
x0
y
ψ
−
S
⋅
dt
⋅
=
Wstawiaj
ą
c wcze
ś
niejsz
ą
zale
ż
no
ść
pod Sdt:
dL
ψ
1
−
ψ
S
⋅
dt
⋅
=
Otrzymujemy:
L dx
⋅
x dL
⋅
+
x0
y
ψ
−
ψ
ψ
1
−
⋅
dL
⋅
=
1
ψ
1
−
L0
L
L
1
L
⌠
⌡
d
⋅
x0
x
x
1
−
y
x
ψ
1
−
(
)
⋅
+
ψ x0
⋅
−
⌠
⌡
d
=
1
ψ
1
−
ln
L
L0
⋅
x0
x
x
1
−
y
x
ψ
1
−
(
)
⋅
+
ψ x0
⋅
−
⌠
⌡
d
=

Proces destylacji prowadzimy tak długo a
ż
osi
ą
gniemy st
ęż
enie cieczy wyczerpanej x
w
:
Przekształcaj
ą
c zale
ż
no
ść
:
L t
( )
L0
ψ
1
−
ψ
S
⋅
t
⋅
+
=
dziel
ą
c j
ą
przez L
0
stronami:
L
L0
L0
ψ
1
−
ψ
S
⋅
t
⋅
+
L0
=
Wiadomo,
ż
e stopie
ń
oddestylowania to ilo
ść
otrzymanego destylatu na ilo
ść
surówki:
Zd
D t
⋅
L0 St
+
=
przekształcaj
ą
c oraz bior
ą
c pod uwag
ę
zale
ż
no
ść
S
D
ψ
=
otrzymujemy:
S t
⋅
ψ L0
⋅
Zd
⋅
1
Zd
−
=
wstawiaj
ą
c t
ą
zale
ż
no
ść
do poprzedniego wzoru otrzymujemy:
L
L0
1
Zd
−
1
ψ Zd
⋅
−
=
Całka przyjmie zatem posta
ć
:
1
ψ
1
−
ln
1
Zd
−
1
ψ Zd
⋅
−
⋅
x0
x
x
1
−
y
x
ψ
1
−
(
)
⋅
+
ψ x0
⋅
−
⌠
⌡
d
=
Nale
ż
y wzi
ąć
pod uwag
ę
, i
ż
y jest opisany równowag
ą
woda-etanol f(x) i jest funkcj
ą
x:
Szukamy takiego Z
d
dla którego x=x
w
danym w zadaniu:
Zd
0.45
:=
warto
ść
startowa stopnia oddestylowania
Given
1
ψ
1
−
ln
1
Zd
−
1
ψ Zd
⋅
−
⋅
x0
xw
x
1
−
f x
( )
x
ψ
1
−
(
)
⋅
+
ψ x0
⋅
−
⌠
⌡
d
=
Zd
Find Zd
( )
:=
Szukany stopie
ń
oddestylowania wynosi zatem:
Zd 0.763
=
Zadanie 4.
4.1. Tre
ść
zadania
Mieszanina gazowa w
ę
glowodorów o składzie: y
01
= 0,4 uł.mol. propanu, y
02
= 0,3 uł.mol. n-butanu, y
03
= 0,3
n-pentanu jest kondensowana pod ci
ś
nieniem P = 1 MPa. Stopie
ń
kondensacji Z
k
= 0,5. Znale
źć
składy
otrzymanych produktów oraz pocz
ą
tkow
ą
temperatur
ę
kondensacji w przypadku:
a) kondensacji równowagowej
b) kondensacji ró
ż
niczkowej
4.2. Dane projektowe
P
1
:=
ci
ś
nienie w układzie
[MPa]
y01
0.4
:=
ułamek molowy propanu w parze
y02
0.3
:=
ułamek molowy butanu w parze
y03
0.3
:=
ułamek molowy n-pentanu w parze
Zk
0.5
:=
stopie
ń
kondensacji
4.3. Blok interpolacyjny
Współczynnik równowagi jest interpolowany wzgl
ę
dem ci
ś
nienia, a nast
ę
pnie temperatury dla wszystkich
składników.
Propan
PROPANdane
0.1
0.2
0.5
1.0
6.8
3.4
1.5
0.8
8.6
4.4
1.8
1.0
10.8
5.5
2.3
1.23
17.0
8.7
3.6
1.9
25.0
13.0
5.3
2.8
:=
cisnienie
PROPANdane
0
〈 〉
:=
Kprop.T16
PROPANdane
1
〈 〉
:=
Kprop.T66
PROPANdane
4
〈 〉
:=
Kprop.T27
PROPANdane
2
〈 〉
:=
Kprop.T38
PROPANdane
3
〈 〉
:=
Kprop.T93
PROPANdane
5
〈 〉
:=
W1
cspline cisnienie Kprop.T16
,
(
)
:=
KpropT16 p
( )
interp W1 cisnienie
,
Kprop.T16
,
p
,
(
)
:=
W2
cspline cisnienie Kprop.T27
,
(
)
:=
KpropT27 p
( )
interp W2 cisnienie
,
Kprop.T27
,
p
,
(
)
:=
W3
cspline cisnienie Kprop.T38
,
(
)
:=
KpropT38 p
( )
interp W3 cisnienie
,
Kprop.T38
,
p
,
(
)
:=
W4
cspline cisnienie Kprop.T66
,
(
)
:=
KpropT66 p
( )
interp W4 cisnienie
,
Kprop.T66
,
p
,
(
)
:=
W4
cspline cisnienie Kprop.T93
,
(
)
:=
KpropT93 p
( )
interp W4 cisnienie
,
Kprop.T93
,
p
,
(
)
:=
temp
16
27
38
66
93
:=
Kprop
KpropT16 P
( )
KpropT27 P
( )
KpropT38 P
( )
KpropT66 P
( )
KpropT93 P
( )
:=
W
cspline temp Kprop
,
(
)
:=
Współczynnik równowagi dla
propanu w funkcji temperatury
dla zało
ż
onego ci
ś
nienia P.
KPR t
( )
interp W temp
,
Kprop
,
t
,
(
)
:=
n-Butan
BUTANdane
0.1
0.2
0.5
1.0
1.8
0.91
0.41
0.24
2.5
1.35
0.55
0.32
3.4
1.7
0.75
0.43
6.4
3.3
1.4
0.8
10.4
5.3
2.3
1.24
:=
cisnienie
BUTANdane
0
〈 〉
:=
Kbut.T16
BUTANdane
1
〈 〉
:=
Kbut.T66
BUTANdane
4
〈 〉
:=
Kbut.T27
BUTANdane
2
〈 〉
:=
Kbut.T38
BUTANdane
3
〈 〉
:=
Kbut.T93
BUTANdane
5
〈 〉
:=
S1
cspline cisnienie Kbut.T16
,
(
)
:=
KbutT16 p
( )
interp S1 cisnienie
,
Kbut.T16
,
p
,
(
)
:=
S2
cspline cisnienie Kbut.T27
,
(
)
:=
KbutT27 p
( )
interp S2 cisnienie
,
Kbut.T27
,
p
,
(
)
:=
S3
cspline cisnienie Kbut.T38
,
(
)
:=
KbutT38 p
( )
interp S3 cisnienie
,
Kbut.T38
,
p
,
(
)
:=
S4
cspline cisnienie Kbut.T66
,
(
)
:=
KbutT66 p
( )
interp S4 cisnienie
,
Kbut.T66
,
p
,
(
)
:=
S4
cspline cisnienie Kbut.T93
,
(
)
:=
KbutT93 p
( )
interp S4 cisnienie
,
Kbut.T93
,
p
,
(
)
:=
temp
16
27
38
66
93
:=
Kbut
KbutT16 P
( )
KbutT27 P
( )
KbutT38 P
( )
KbutT66 P
( )
KbutT93 P
( )
:=
S
cspline temp Kbut
,
(
)
:=
Współczynnik równowagi dla
n-butanu w funkcji
temperatury dla zało
ż
onego
ci
ś
nienia P.
KB t
( )
interp S temp
,
Kbut
,
t
,
(
)
:=

n-Pentan
PENTANdane
0.1
0.2
0.5
1.0
0.48
0.25
0.11
0.062
0.71
0.36
0.16
0.094
1.0
0.53
0.23
0.14
2.3
1.2
0.53
0.31
4.4
2.2
0.97
0.55
:=
cisnienie
PENTANdane
0
〈 〉
:=
Kpent.T16
PENTANdane
1
〈 〉
:=
Kpent.T66
PENTANdane
4
〈 〉
:=
Kpent.T27
PENTANdane
2
〈 〉
:=
Kpent.T38
PENTANdane
3
〈 〉
:=
Kpent.T93
PENTANdane
5
〈 〉
:=
E1
cspline cisnienie Kbut.T16
,
(
)
:=
KpentT16 p
( )
interp E1 cisnienie
,
Kpent.T16
,
p
,
(
)
:=
E2
cspline cisnienie Kpent.T27
,
(
)
:=
KpentT27 p
( )
interp E2 cisnienie
,
Kpent.T27
,
p
,
(
)
:=
E3
cspline cisnienie Kpent.T38
,
(
)
:=
KpentT38 p
( )
interp E3 cisnienie
,
Kpent.T38
,
p
,
(
)
:=
E4
cspline cisnienie Kpent.T66
,
(
)
:=
KpentT66 p
( )
interp E4 cisnienie
,
Kpent.T66
,
p
,
(
)
:=
E4
cspline cisnienie Kpent.T93
,
(
)
:=
KpentT93 p
( )
interp E4 cisnienie
,
Kpent.T93
,
p
,
(
)
:=
Współczynnik równowagi dla
n-pentanu w funkcji
temperatury dla zało
ż
onego
ci
ś
nienia P.
temp
16
27
38
66
93
:=
Kpent
KpentT16 P
( )
KpentT27 P
( )
KpentT38 P
( )
KpentT66 P
( )
KpentT93 P
( )
:=
E
cspline temp Kpent
,
(
)
:=
KPE t
( )
interp E temp
,
Kpent
,
t
,
(
)
:=
4.4. Obliczenia
a) Kondensacja równowagowa
Obliczenie temperatury pocz
ą
tkowej
Zakładamy temperatur
ę
pocz
ą
tkow
ą
kondensacji jako t
p
. B
ę
dzie ona warto
ś
ci
ą
startow
ą
dla oblicze
ń
numerycznych.
tp
60
:=
[
ο
C]
Para musi by
ć
w równowadze z ciecz
ą
, a zatem suma ułamków x=y/K musi by
ć
równa 1. Szukamy takiej
temperatury, dla której jest to spełnione. B
ę
dzie ona temperatur
ą
pocz
ą
tkow
ą
kondensacji. Zk dla pocz
ą
tku
kondensacji jest równy zero.
funcp tp
( )
y01
KPR tp
( )
y02
KB tp
( )
+
y03
KPE tp
( )
+
1
−
:=
tp
root funcp t
( ) t
,
(
)
88.788
=
:=
[
ο
C]
wyznaczona pocz
ą
tkowa temperatura destylacji
Dla tej temperatury wyznaczamy pocz
ą
tkowe ułamki składników w fazie ciekłej.
x01
y01
KPR tp
( )
0.152
=
:=
x02
y02
KB tp
( )
0.257
=
:=
x03
y03
KPE tp
( )
0.591
=
:=
Wyznaczenie ko
ń
cowej temperatury kondensacji
Tak
ż
e na wylocie z kondensatora musi by
ć
spełniona zale
ż
no
ść
x
1
+x
2
+x
3
=1, lecz tym razem bierzemy pod
uwag
ę
zadany stopie
ń
przemiany.
x1 t
( )
y01
Zk KPR t
( ) 1
Zk
−
(
)
⋅
+
:=
x2 t
( )
y02
Zk KB t
( ) 1
Zk
−
(
)
⋅
+
:=
x1 t
( )
y01
Zk KPR t
( ) 1
⋅
+
Z
−
:=
Z
x3 t
( )
y03
Zk KPE t
( ) 1
Zk
−
(
)
⋅
+
:=
Szukamy temperatury, dla których suma ułamków b
ę
dzie równa 1. B
ę
dzie to temperatura
ko
ń
cowa kondensacji.
funck t
( )
y01
Zk KPR t
( ) 1
Zk
−
(
)
⋅
+
y02
Zk KB t
( ) 1
Zk
−
(
)
⋅
+
+
y03
Zk KPE t
( ) 1
Zk
−
(
)
⋅
+
+
1
−
:=
t
20
:=
warto
ść
startowa
tk
root funck t
( ) t
,
(
)
74.562
=
:=
[
ο
C]
Wyznaczamy st
ęż
enia kondensatu i fazy gazowej dla tej temperatury z nast
ę
puj
ą
cych zale
ż
no
ś
ci.
x1 t
( )
y01
Zk KPR t
( ) 1
Zk
−
(
)
⋅
+
:=
x1 tk
( )
0.254
=
y1
KPR tk
( )
x1 tk
( )
⋅
:=
y1 0.546
=
x2 t
( )
y02
Zk KB t
( ) 1
Zk
−
(
)
⋅
+
:=
x2 tk
( )
0.31
=
y2
KB tk
( )
x2 tk
( )
⋅
:=
y2 0.29
=
x1 t
( )
y01
Zk KPR t
( ) 1
⋅
+
Z
−
:=
Z
x3 t
( )
y03
Zk KPE t
( ) 1
Zk
−
(
)
⋅
+
:=
x3 tk
( )
0.436
=
y3
KPE tk
( )
x3 tk
( )
⋅
:=
y3 0.164
=
b) Kondensacja ró
ż
niczkowa
Wyznaczenie temperatury pocz
ą
tkowej
Jest to taka temperatura, dla której para o pocz
ą
tkowym składzie jest par
ą
nasycon
ą
, a zatem jest to ta sama
temperatura jak obliczona dla kondensacji równowagowej.
Wyznaczamy temperatur
ę
ś
redni
ą
mi
ę
dzy wlotem i wylotem, b
ę
d
ą
ca temperatur
ą
obliczeniow
ą
do lotno
ś
ci
wzgl
ę
dnych. Konieczne jest do tego zało
ż
enie temperatury ko
ń
cowej destylacji.
tk
68.2
:=
tsr
tp tk
+
2
78.494
=
:=
[
ο
C]
Lotno
ś
ci składników liczymy wzgl
ę
dem składnika odniesienia – najmniej lotnego n-pentanu
α13
KPR tsr
( )
KPE tsr
( )
5.528
=
:=
α23
KB tsr
( )
KPE tsr
( )
2.422
=
:=
Na wylocie para powinna by
ć
par
ą
nasycon
ą
, zatem suma ułamków molowych w parze powinna by
ć
równa 1.
Zapisujemy zale
ż
no
ść
na ułamki składników w funkcji ułamka składnika odniesienia.
y1 y3
( )
y01
α13
y3
⋅
y03 1 Zk
−
(
)
α13 1
−
⋅
1
α13
:=
y2 y3
( )
y02
α23
y3
⋅
y03 1 Zk
−
(
)
α23 1
−
⋅
1
α23
:=
functk y3
( )
y1 y3
( )
y2 y3
( )
+
y3
+
(
)
1
−
:=
Y3
root functk y3
( )
y3
,
(
)
:=
Y1
y1 Y3
( )
:=
Y2
y2 Y3
( )
:=
X3
Y3
KPE tp
( )
:=
X1
Y1
KPR tp
( )
:=
X2
Y2
KB tp
( )
:=
X1 0.224
=
X2 0.256
=
X3 0.219
=
Y1 0.59
=
Y2 0.299
=
Y3 0.111
=
Sprawdzenie, czy dla zadanej temperatury ko
ń
cowej suma ułamków składników w fazie gazowej równa jest 1.
Y1
KPR tk
( )
Y2
KB tk
( )
+
Y3
KPE tk
( )
+
1
=
Temperatura ko
ń
cowa kondensacji wynosi:
tk 68.2
=
[
ο
C]
Zadanie 5.
5.1. Tre
ść
zadania
Prowadzi si
ę
destylacj
ę
z par
ą
wodn
ą
odp
ę
dzaj
ą
c anilin
ę
z jej roztworu z nielotna smol
ą
. Wstad destylacyjny, w
ilo
ś
ci N = 250 kmoli zawiera x
0
= 0,6 uł.mol. aniliny. Mo
ż
na przyj
ąć
stosowalno
ść
roztworu anilina-smoła do prawa
Raoulta. Destylacj
ę
prowadzi si
ę
pod ci
ś
nieniem 0,1 MPa przy u
ż
yciu pary wodnej o entalpii wła
ś
ciwej 2788 kJ/kg.
Nale
ż
y okre
ś
li
ć
zu
ż
ycie pary wodnej niezb
ę
dnej do oddestylowania
η
= 95% anilinny. Pr
ęż
no
ść
pary wodnej oraz
jej entalpi
ę
w zale
ż
no
ś
ci od temperatury oraz pr
ęż
no
ść
pary aniliny w funkcji temperatury zamieszczono w tabeli.
Ś
rednie ciepło wła
ś
ciwe aniliny wynosi 2,35 kJ/kg
.
K, a jej
ś
rednie ciepło parowania równe jest 488 kJ/kg.
5.2. Dane projektowe
N
60
:=
[kmol]
ilo
ść
moli wsadu
x0
0.65
:=
[uł.mol.]
zawarto
ść
aniliny we wsadzie
P
100
:=
[kPa]
ci
ś
nienie w układzie
t
165
:=
[
ο
C]
temperatura pary nasyconej
η
0.79
:=
[-]
stopie
ń
oddestylowania
Lp
488
:=
[kJ/kg
.
K]
ciepło parowania aniliny
Cp
2.35
:=
[kJ/kg]
ciepło wła
ś
ciwe aniliny
Manil
93
:=
[g/mol]
masa molowa aniliny
ANILINAdane
50
60
70
80
90
100
110
120
130
140
150
160
170
184
0.32
0.76
1.41
2.40
3.89
6.09
9.22
12.88
19.26
27.2
37.3
49.3
65.3
101
:=
Tanil
ANILINAdane
0
〈 〉
:=
Panil
ANILINAdane
1
〈 〉
:=
Zale
ż
no
ść
pr
ęż
no
ś
ci pary
[kPa] aniliny od
temperatury [
ο
C].
PARAdane
0
10
20
30
40
50
60
70
80
90
100
110
120
130
140
150
160
170
185
190
200
0.613
1.23
2.33
4.24
7.37
12.3
19.9
31.2
47.3
70.1
100
143
198
270
361
476
618
792
1161
1297
1607
2500
2519
2537
2555
2573
2591
2609
2626
2643
2659
2675
2691
2706
2720
2733
2746
2757
2768
2782
2786
2793
:=
Tpara
PARAdane
0
〈 〉
:=
Ppara
PARAdane
1
〈 〉
:=
ipara
PARAdane
2
〈 〉
:=
Zale
ż
no
ś
c pr
ęż
no
ś
ci pary
wodnej [kPa] i jej entalpii
[kJ/kg] od temperatury [
ο
C].
5.3. Obliczenia
Zapisujemy zale
ż
no
ś
ci funkkcyjne na podstawie danych tabelarycznych:
Sp
cspline Tpara Ppara
,
(
)
:=
p t
( )
interp Sp Tpara
,
Ppara
,
t
,
(
)
:=
pr
ęż
no
ść
pary wodnej w funkcji t
Si
cspline Tpara ipara
,
(
)
:=
i t
( )
interp Si Tpara
,
ipara
,
t
,
(
)
:=
entalpia pary wodnej w funkcji t
Wanil
cspline Tanil Panil
,
(
)
:=
panil t
( )
interp Wanil Tanil
,
Panil
,
t
,
(
)
:=
pr
ęż
no
ść
aniliny w funkcji t
Ilo
ść
uzyskanej aniliny przy danej temperaturze oraz składzie wsadu licz
ą
c na 1 kg pary mo
ż
emy zapisa
ć
jako:
Gm x t
,
(
)
x panil t
( )
⋅
P
x panil t
( )
⋅
−
Manil
18
⋅
:=
[masa aniliny - kg - uzyskanej liczona na 1 kg pary]
Warto
ść
entalpii przypadaj
ą
ca na 1kg pary wodnej jest funkcj
ą
temperatury:
Gi x t
,
(
)
Gm x t
,
(
) Lp Cp t
⋅
+
(
)
⋅
:=
Jako,
ż
e entalpia pary zasilaj
ą
cej musi by
ć
równa entalpii oparów aniliny oraz pary wodnej w temperaturze
destylacji jeste
ś
my w stanie wyznaczy
ć
temperatur
ę
destylacji w funkcji ułamka molowego aniliny.
Entalpia pary zasilaj
ą
cej układ i
p0
:
ip0
i t
( )
2.763
10
3
×
=
:=
[kJ/kg]
func x tdest
,
(
)
Gi x tdest
,
(
)
i tdest
( )
+
ip0
−
:=
Szukamy takiego t
dest
, dla którego funkcja przyjmie warto
ść
zero z przedziału temperatur, dla których
mamy stabelaryzowane warto
ś
ci, czyli 50 - 184.
tdest x
( )
root func x t
,
(
) t
,
50
,
184
,
(
)
:=
tdest 0.65
(
)
91.52
=
[
ο
C]
Nast
ę
pnie wyznaczamy ci
ś
nienie aniliny w funkcji ułamka molowego aniliny we wsadzie.
Panil x
( )
panil tdest x
( )
(
)
x
⋅
:=
zgodnie z prawem Raoulta
Aby uzyska
ć
stopie
ń
oddestylowania obliczamy ko
ń
cowy ułamek molowy aniliny.
Nsmoły
1
x0
−
(
)
N
⋅
21
=
:=
ilo
ść
smoły
xw
1
η
−
(
) x0
⋅
N
⋅
Nsmoły
1
η
−
(
) x0
⋅
N
⋅
+
0.281
=
:=
ko
ń
cowy ułamek molowy aniliny
Nast
ę
pnie obliczamy ilo
ść
kmoli wody zu
ż
utej do przeprowadzenia procesu:
Nwody
x0
xw
x
1
1
x
−
(
)
2
⌠
⌡
d Nsmoły
⋅
Nsmoły P
⋅
x0
xw
x
1
1
x
−
(
)
2
Panil x
( )
⋅
⌠
⌡
d
⋅
−
:=
Przeliczaj
ą
c to na mas
ę
zu
ż
ytej wody otrzymujemy:
Mwody
18 Nwody
⋅
2.172
10
4
×
=
:=
[kg] wody


Wyszukiwarka
Podobne podstrony:
Mathcad Projekt metal
Mathcad projekt
Mathcad Projekt belki kablobetonowej
Mathcad Projekt wytrzymałość II cz 3
Mathcad projekt fund
Mathcad projekt 13
Mathcad Projekt 10 3 xmcd
Mathcad, projekt nr 1c
Mathcad PROJEKT drewno 2
Mathcad projekt 3
(Mathcad Projekt końcowy ppi
Mathcad Projekt 10 2 xmcd
Mathcad Projekt mostu sprężanego
Mathcad projekt 1 dwuteownik
Mathcad projekt edzia
Mathcad Projekt
Mathcad projekt 22
Mathcad, Projekt 10 3.xmcd
więcej podobnych podstron