

Źródła zakażenia
Rezerwuar: woda, ziemia, przewód
pokarmowy człowieka, zwierząt i ptaków.
Kolonizacja szczepami szpitalnymi przewodu
pokarmowego i jamy nosowo-gardłowej.
Szybkość kolonizacji wprost proporcjonalna do
długości pobytu chorego w szpitalu.
W szpitalu pałeczki Gram(-) szerzą się przez
ręce personelu z jednego na drugiego
pacjenta lub poprzez zanieczyszczony sprzęt i
bezpośrednie otoczenie chorego.

Postacie kliniczne
zakażeń
Zakażenia układu moczowego – związane
przede wszystkim z cewnikowaniem
Zapalenia płuc
Zakażenia ran chirurgicznych
Zakażenia przewodu pokarmowego – zawsze
egzogenne
Bakteriemia
Zakażenia OUN – najczęściej u pacjentów
neurochirurgicznych, noworodków oraz u
operowanych z założeniem drenażu

Zapobieganie
zakażeniom
Mycie lub dezynfekcja rąk
Rękawice ochronne
Kontrola sprzętu szpitalnego
Eliminacja rezerwuarów pałeczek w
środowisku
Restrykcyjne stosowanie antybiotyków o
szerokim spektrum
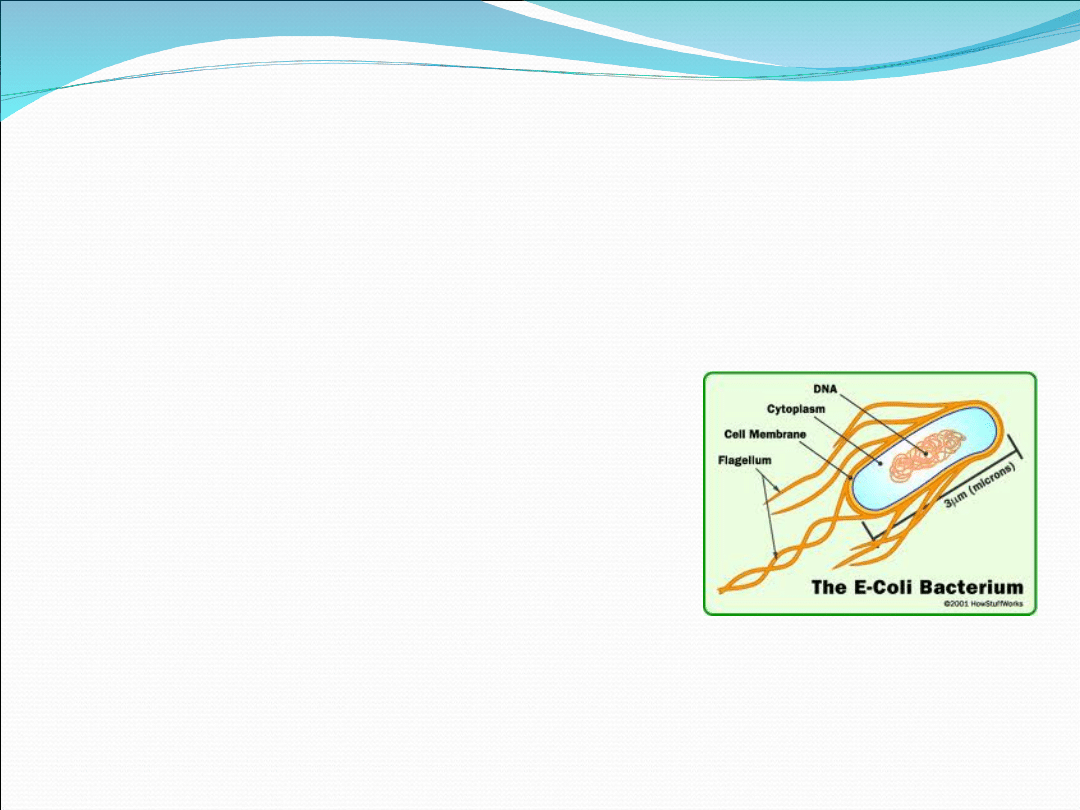
Escherichia coli - budowa
Podłużne, tlenowe pałeczki
Zawierają nukleoid i plazmidy – nośniki
genów zjadliwości lub lekooporności
Komórki otoczone 3 warstwami
osłona zewnętrzna
warstwa peptydoglikanu
błona komórkowa (zawiera PBP)
•
180 typów serologicznych
•
Rozmnażanie poprzez podział poprzeczny

Escherichia coli –
czynniki zjadliwości
Adhezyny
Fimbrie P (wiążące się z antygenem grupowym krwi P)
Adhezyny typu CFA I i CFA II
Otoczki (antygen K, Vi)
Egzotoksyny ( termowrażliwe i termostabilne
enterotoksyny)
Toksyna typu shiga
α-hemolizyny
Siderofory
Endotoksyny (LPS)

Postacie kliniczne
zakażeń
Zakażenia dróg moczowych
Sepsa
Zakażenia ran
Zakażenia dróg żółciowych
Zakażenia wyrostka robaczkowego
Szpitalne zapalenie płuc
ZOMR u noworodków
Zakażenia przewodu pokarmowego – biegunki
podróżnych, biegunki u dzieci, zespół
hemolityczno-mocznicowy

Szczepy odpowiedzialne za zakażenia przewodu
pokarmowego:
Enterotoksyczne ETEC – biegunka wodnista
Enteropatogenne EPEC – biegunki niemowlęce
do 2 r.ż.
Enteroinwazyjne EIEC – zakażenia podobne do
czerwonki
Werotoksyczne VTEC – enterokrwotoczne,
biegunka z dodatkiem krwi i zespół
hemolityczno – mocznicowy
Enteroagregacyjne – obraz mieszany

Najczęstsza pałeczka wywołująca sepsę u pacjentów
hospitalizowanych.
Ponad 80% zakażeń układu moczowego w warunkach
pozaszpitalnych i 60% zakażeń szpitalnych powodują
pałeczki E. coli
Czynnikiem sprzyjającym zakażeniom układu
moczowego jest przewlekłe cewnikowanie.
ZOMR u noworodków kolonizowanych podczas porodu.
Kolonizacja jest zwykle zjawiskiem naturalnym, jednak
zakażenie rozwija się wyjątkowo rzadko. Obarczone jest
dużą śmiertelnością.
Zapalenie płuc o etiologii E. coli zwykle powiązane jest z
współwystępowaniem zakażenia układu moczowego.
Wszystkie postacie zakażeń przewodu pokarmowego są
zakażeniami egzogennymi.

Leczenie
Wobec E. coli aktywne są następujące antybiotyki:
penicyliny szerokowachlarzowe
Cefalosporyny I, II, III i IV generacji, a także cefoperazon
z sulbaktamem
Aminoglikozydy
Tatracykliny
Fluorochinolony
Kotrimoksazol
Monobaktamy
Karbapenemy
fosfomycyna

Klebsiella pneumoniae i
Klebsiella oxytoca
Budowa
Pałeczki Gram(-)
Polisacharydowa otoczka – ochrona przed fagocytozą
oraz bakteriobójczym działaniem dopełniacza
Czynniki zjadliwości
Adhezyny fimbrialne i niefimbrialne
LPS
Elastazy
siderofory

Źródła zakażenia
Rezerwuar – skolonizowana skóra, gardło i
przewód pokarmowy
Wektor – ręce personelu szpitalnego
Kolonizacja dróg oddechowych w szpitalu jest
zjawiskiem bardzo częstym i występuje przede
wszystkim u pacjentów leczonych
antybiotykami.

Postacie kliniczne
zakażeń
Zapalenie płuc szpitalne i pozaszpitalne,
zwłaszcza u pacjentów wentylowanych
Zakażenia miejsca operowanego
Zakażenia przewodu pokarmowego
Bakteriemia i sepsa
Zakażenia dróg moczowych
Zakażenia kości i stawów
ZOMR (noworodki)

Leczenie
Lekami z wyboru są cefalosporyny II, III i IV generacji
Wśród szczepów ESBL(+) aktywne mogą być:
piperacylina/tazobaktam
Cefoperazon/sulbaktam
Karbapenemy
Tygecyklina
Aminoglikozydy
Fluorochinolony
Kotrimoksazol

Enterobacter
Największe znaczenie jako patogeny
szpitalne: E.cloacae, E.aerogenes
Budowa: przypominają pałeczki Klebsiella
( różnica: brak otoczki, obecność
rzęsek)
Czynniki zjadliwości: endotoksyna-
lipopolisacharyd aktywacja układu
dopełniacza, synteza cytokin prozapalnych,
rozwój sepsy

Źródła zakażenia
W warunkach naturalnych występuje w
przewodzie pokarmowym u 40-80% osób
zdrowych
W szpitalu pałeczki te przebywają w
wilgotnych miejscach np. jako
zanieczyszczenie nawilżaczy
W wyniku stosowania cefalosporyn w
szpitalach, chodzi do selekcji szczepów
opornych kolonizujących przewód pokarmowy
chorego

Czynniki sprzyjające
zakażeniu
Przedłużający się pobyt w szpitalu > 24 h
Inwazyjne procedury diagnostyczne w ciągu
ostatnich 72 h
Leczenie antybiotykami- cefalosporyny lub
penicyliny z inhibitorem w okresie poprzedzającym
30 dni aktualny pobyt w szpitalu
Drenaż naczyń centralnych
Pobyt w oddziale OIT
Nowotwory układu krwionośnego, guzy lite, choroby
dróg żółciowych, choroba wrzodowa, mechaniczna
wentylacja i immunosupresja

Źródłem zakażenia endogennego jest
skolonizowana skóra, przewód pokarmowy i
drogi moczowe ( cewniki)
Drobnoustroje przenoszone są z rezerwuarów
środowiskowych przez ręce personelu
Pałeczki te zasiedlają endoskopy, aparaty do
monitorowania ciśnienia wewnątrzaortalnego,
stetoskopy i inne sprzęty

Postacie kliniczne
zakażenia
Bakteriemia ( rozwija się u chorych leczonych
w OIT, największa śmiertelność)
Zakażenia dolnych dróg oddechowych-
początkowo bezobjawowa kolonizacja
tchawicy i oskrzeli a następnie zapalenie płuc i
ropniak opłucnej
Zakażenie skóry i tkanek miękkich : cellulitis,
fascitis, myositis, ropnie, zakażenia ran
Zapalenie wsierdzia- najczęściej po
wczepieniu biozastawek

Zakażenie układu moczowego. Przebiega najczęściej
jako pyelonepgritis z bakteriemią, zapalenie
prostaty, pęcherza moczowego lub pod postacią
bezobjawowej bakteriurii
Zakażenia wewnątrzbrzuszne: wtórne zapalenie
otrzewnej po perforacji, ropnie wewnątrzbrzuszne,
sepsa wywodząca się z dróg żółciowych, martwica
wątroby u dzieci po przeszczepie tego narządu,
krwotoczne zapalenie trzustki
Zakażenie OUN ( u noworodków ZOMR najczęściej
o etiol. E.sakazakii)
Zakażenie gałki ocznej ( najbardziej agresywny
przebieg- rodzina Enterobacter, Pseudomonas)
Zapalenie kości i stawów

Diagnostyka
mikrobiologiczna
Cecha charakterystyczna: wytwarzanie
chromosomalnej cefalosporynazy, enzymu
podatnego na indukcyjne działanie antybiotyków
b-laktamowych. Może dojść do selekcji szczepów
z derepresowaną b-laktamazą- oporność
konstytutywna
Induktory: ampicylina, cefoksytyna, imipenem,
cefalosporyny I gen.
Cefalosporyny prowadzą do selekcji szczepów
wytwarzających plazmidowe enzymy o
rozszerzonym profilu substratowym

Leczenie
Wrażliwe na karbapenemy, tygecyklinę i
kolistynę
Wobec szczepów dzikich: piperacylina,
cefalosporyny III i IV gen. , penicyliny z
inhibitorem, fluorochinolony, kotrimoksazol,
aztreonam, tygecyklina, karbapenemy
Konstytutywna ekspresja ampC: cefepim,
karbapenemy, fluorochinolony, tygecyklina

Proteus
Urzęsione gram (-) pałeczki, które łatwo rosną
na podłożach sztucznych tworząc
charakterystyczny wzrost pełzający
Przystosowane do bytowania w drogach
moczowych- wytwarzają ureazę, proteazę oraz
hemolizynę. Mają zdolność alkalizacji moczu
oraz sprzyjają wytrącaniu się kamieni
nerkowych
Wchodzą w skład fizjologicznej mikroflory
przewodu pokarmowego

Zakażeniu sprzyja długotrwały drenaż dróg
moczowych oraz zabiegi na drogach
moczowo-płciowych
Postacie kliniczne zakażeń
Zakażenia układu moczowego
Zakażenia ran
Bakteriemia/sepsa
Zakażenia wewnątrzbrzuszne
ZOMR u dzieci

Diagnostyka mikrobiologiczna: hodowla
drobnoustrojów z materiałów klinicznych,
identyfikacja i oznaczenie wrażliwości na
antybiotyki. W zakażeniach układu
moczowego wykonuje się także badania
ilościowe
Leczenie: antybiotyki aktywne z wyjątkiem
nitrofuranów

Serratia
Pałeczki szeroko występujące w środowisku
szpitalnym, oporne na antybiotyki cefalosporynowe
Najczęściej spotykane w szpitalu : S. mercescens,
S. liquefaciens, S. odorifera
Zakażenie poprzez produkty spożywcze (mleczne),
wodę , ziemię
U człowieka można spotkać w drogach
oddechowych, szeroko kolonizuje jelito grube
zwłaszcza u dzieci i noworodków
Szczególne upodobania do środowiska o dużej
wilgotności ( aparatura do wspomagania
oddychania, nawilżacze)

Wywołuje zakażenia szpitalne prawie
wyłącznie oportunistyczne, szczególnie w OIT
Postacie kliniczne zakażeń:
zapalenie płuc
sepsa
ZOMP
zapalenie gałki ocznej
ZUM
biegunka

.
Diagnostyka mikrobiologiczna: hodowla
materiałów klinicznych pobranych od pacjenta
Leczenie: karbapenemy, fluorochinolony,
monobaktamy, piperacylina/ tazobaktam,
aminoglikozydy, tygecyklina, tykarcylina/
klawulanian
Mogą wytwarzać chromosomalną
cefalosporynazę- enzym indukcyjny który w
wyniku mutacji przekształca się w enzym
konstytutywny- oporność na wszystkie
antybiotyki b-laktamowe z wyjątkiem
karbapenemów

Morganella morgani
Postacie kliniczne zakażeń:
ZUM
biegunka
zakażenia ran
sepsa
synteza chromosomalnej cefalosporynazy-
główny mechanizm oporności
Aktywne antybiotyki: monobaktamy,
aminoglikozydy, karbapenemy, fluorochinolony

Citrobacter diversus,
Citrobacter freundii
Typowe patogeny szpitalne, wywołujące różne
postacie zakażeń
Źródłem zakażenia są najczęściej
drobnoustroje obecne w przewodzie
pokarmowym
Leczenie: fluorochinolony, karbapenemy,
aminoglikozydy

Oznaczanie
mechanizmów oporności
pałeczek Gram(-) z
rodziny
Enterobacteriaceae
Najważniejsze znaczenie kliniczne ma
wykrywanie β-laktamaz o rozszerzonym
spektrum substratowym (ESBL) i
chromosomalnych β-laktamaz ampC.

Oznaczanie ESBL
Najczęściej spotykane u E. coli, K.
pneumoniae i K. oxytoca.
Metoda dwóch krążków, E-testy lub krążki z
dodatkiem kwasu klawulanowego jako
inhibitora β-laktamaz.

Metoda krążkowo-dyfuzyjna
(tzw. dwóch krążków)
Zasada metody:
Zawiesina hodowli szczepu w roztworze NaCl o
gęstości 0,5 McFarlanda
Podłoże MHA
Krążki bibułowe nasycone antybitykami: cefotaksym,
ceftazydym, amoksacylina z kwasem klawulanowym
Inkubacja w atmosferze tlenowej 35°C, 16-18 godz
Wynik dodatni:
Pojawienie się odkształconej strefy dla cefalosporyn

Metoda krążkowo-dyfuzyjna
(tzw. kombinowana)
Zasada metody:
Zawiesina hodowli szczepu w roztworze NaCl o gęstości
0,5 McFarlanda
Podłoże MHA
Krążki bibułowe nasycone antybitykami: cefotaksym i
cefotaksym z kwasem klawulanowym, ceftazydym i
ceftazydymz kwasem klawulanowym
Inkubacja w atmosferze tlenowej 35°C, 16-18 godz
Wynik dodatni:
Różnica między średnicą strefy wokół krążka z dodatkiem
kwasu klawulanowego jest większa lub równa 5 mm od
średnicy strefy wokół krążka z samą cefalosporyną.

Metoda z zastosowaniem
podwójnych pasków E-test
Zasada metody:
Zawiesina hodowli szczepu w roztworze NaCl o gęstości 0,5
McFarlanda
Podłoże MHA
Paski E-test: cefotaksym i cefotaksym z kwasem
klawulanowym, ceftazydym i ceftazydymz kwasem
klawulanowym oraz cefepim i cefepim z kwasem
klawulanowym
Inkubacja w atmosferze tlenowej 35°C, 16-18 godz
Wynik dodatni:
Różnica stężeń MIC cefalosporyny i cefalosporyny z
inhibitorem równa co najmniej 3 kolejnym rozcieńczeniom.

Metody automatyczne
VITEK -1, VITEK – 2, Phoenix
Wykrywanie ESBL u E.coli i K. pneumoniae
Przy stosowaniu metod automatycznych
zaleca się wykonanie testu potwierdzającego.

Chromosomalna
cefalosporynaza AMPc
•
Cefalosporynaza jest wytwarzana przez wszystkie
bakterie z rodziny Enterobacteriaceae, z wyjątkiem
Salmonella, jednak w większości przypadków ekspresja
genu jest zbyt niska aby miało to znaczenie kliniczne.
•
hydrolizują penicyliny, cefalosporyny (z wyjatkiem
leków IV generacji) i aztreonam. Z reguły nie są one
też podatne na działanie inhibitorów b-laktamowych,
zwłaszcza kwasu klawulanowego
•
Znaczenie:
Enterobacter
Citrobacter freundii
Serratia marcescens
Morganella
Providencia

wykrywanie AmpC : użycie
krążka z cefoksytyną o
stężeniu 30µg.
•
Czystą hodowlę szczepu należy zawiesić w jałowym,
fizjologicznym roztworze NaCl do gęstości 0,5 w
skali McFarlanda.
•
Używamy podłoża MHA, na którym umieszczamy
krążki z cefoksytyną i ceftazydymem (30µg) w
odległości około 25-30mm. Inkubacja w tlenowej
atmosferze w 35°C +/- 2°C przez 16-18 godz.
•
Szczepy wytwarzające AmpC wykazują oporność na
cefoksytynę, która indukuje ekspresję enzymu.
Strefa zahamowania wzrostu wokół ceftazydymu
ulega deformacji (spłaszczeniu) od strony krążka z
cefoksytyną.


Oporność na
karbapenemy
Obniżenie przepuszczalności błony +
wytwarzanie AmpC lub ESBL na wysokim
poziomie (Kl.pneumoniae, Kl. oxytoca)
Wytwarzanie enzymu hydrolizującego lek:
Wytwarzanie karbapenemaz – MBL (Kl.
pneumoniae, E.coli, Serratia marcescens)
Wytwarzanie karbapenemaz klasy A – KPC
(Serratia, Enterobacter, Klebsiella)

KPC- ang. Klebsiella
pneumoniae
carbapenemase).
•
Są to enzymy (β-laktamazy) hydrolizujące wszystkie
karbapenemy (imipenem, meropenem, ertapenem,
doripenem) a także wszystkie pozostałe antybiotyki β-
laktamowe (penicyliny, cefalosporyny i aztreonam).
•
Enzymy te są stosunkowo słabo hamowane przez
inhibitory
β-laktamaz (kwas klawulanowy, sulbaktam, tazobaktam),
przez co połączenia inhibitorów z β-laktamami nie znajdują
żadnego zastosowania.
•
Karbapenemazy KPC najczęściej obserwujemy u K.
pneumoniae, a następnie u Klebsiella oxytoca,
Enterobacter spp., rzadziej u innych pałeczek
Enterobacteriaceae (np. Escherichia coli, Citrobacter
freundii, Serratia marcescens, Salmonella enterica).
•
Ostatnio opisano pojawienie się KPC też u pałeczek
Pseudomonas (P. aeruginosa i P. putida).

Testy fenotypowe na obecność KPC wykorzystują
kwas boronowy jako inhibitor tych b-laktamaz.
Test z kwasem boronowym na obecność KPC
częściej wykonuje się w wersji „kombinowanej”, w
której na krążki z imipenemem (10 μg) i
meropenemem (10 μg), lub tylko z meropenemem
podaje się kwas boronowy i bada różnice stref
wokół krążka z karbapenemem i inhibitorem oraz
krążka z samym karbapenemem.
Wynik odczytujemy jako pozytywny, jeśli różnica
stref zahamowania wzrostu wokół krążka z
którymkolwiek z karbapenemów i inhibitorem oraz
krążka z samym karbapenemem wyniesie 5 mm
lub więcej (300 μg kwasu)


Zmodyfikowany test
Hodge’a
Jako test potwierdzający wytwarzanie karbapenemaz można też stosować tzw.
zmodyfikowany test Hodge’a („liscia koniczyny”), w zaleceniach CLSI jest to
jedyny obecnie proponowany test na obecność karbapenemaz u
Enterobacteriaceae.
Test ten nie rozróżnia miedzy MBL i KPC, wynik pozytywny oznacza wiec
wyłącznie stwierdzenie prawdopodobnej obecności „karbapenemazy” w
szczepie bakteryjnym
Wykorzystuje się w nim wrażliwy na karbapenemy, niewytwarzający
karbapenemaz szczep E. coli ATCC 25922. Zasadniczo, w teście tym wysiewa się
na powierzchnie całej płytki E.coli ATCC 25922 (rozcieńczenie 1:10 zawiesiny 0,5
McFarlanda) i układa na niej krążek z ertapenemem lub meropenemem lub
imipenemem. Nastepnie wykonuje sie tzw. „posiew promienisty” szczepów
badanych.
Wynik pozytywny polega na odkształceniu strefy zahamowania wzrostu E. coli
ATCC 25922 wokół krążka z karbapenemem wzdłuż linii posiewu szczepu
badanego (podrastanie E. coli ATCC25922 w stronę krążka).

MBL
Geny kodujące syntezę MBL mogą być
przenoszone horyzontalnie między szczepami
pałeczek Enterobacteriaceae
Hydrolizują penicyliny, cefalosporyny,
karbapenemy
Nie są hamowane przez inhibitory

MBL
Test krążkowy z zastosowaniem EDTA jako
inhibitorem: metoda referencyjna
Zasada metody: zawiesić hodowlę w jałowym
fizjologicznym roztworze NaCl do gęstości 0,5
McFarlanda, podłoże MHA, krązki bibułowe
nasycone antybiotykami: imipenem 10 μg,
ceftazydym 30 μg
Nakłada się krążek z EDTA na środek a po bokach
krążki z antybiotykami
Wynik + pojawienie się przejaśnienia i powiększenia
strefy zahamowania wzrostu wokół krążków z
imipenemem i ceftazydymem od strony inhibitora

Bibliografia
„Zakażenia szpitalne” Dzierżanowska D.
Dziękujemy za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
02 Rek2009 Paleczki z rodziny Enterobacteriaceae
Izolacja i identyfikacja pałeczek z rodziny Enterobacteriaceae, Mikrobiologia
Diagnostyka pałeczek z rodziny Enterobacteriaceae
Charakterystyka pałeczek z rodziny Enterobacteriaceae, Mikrobiologia
Bakterie z rodziny Enterobacteriaceae oraz Gram, materiały farmacja, Materiały 3 rok, mikroby, koło
Charakterystyka pałeczek z rodziny Enterobacteriaceae, studia-biologia, Licencjat, sem 3-4, mikrobio
ŚCIĄGI, bakterie ściąga z nazw i wymogów bardziej rozbudowana, Rodzina enterobacteriaceaeG(-);palecz
02 Rek2009 Paleczki z rodziny Enterobacteriaceae
02 Rek2009 Paleczki z rodziny Enterobacteriaceae
Pałeczki niefermentujące, Diagnostyka pałeczek Gram-ujemnych niefermentujących glukozy
Pałeczki Gram ujemne cz 2
opracowania, Mikro JU cw 3, Pałeczki Gram - dodatnie beztlenowe
Paleczki Gram-ujemne tlenowe lub wzglednie beztlenowe
Tlenowe pałeczki gram, mikrobiologia
Oznaczanie wraŜliwości pałeczek Gram ujemnych
Pałeczki Gram( )
7 - Pałeczki Gram(-), materiały ŚUM, III rok, Mikrobiologia
Pałeczki Gram ujemne cz 1
więcej podobnych podstron