
PODSTAWOWE TERMINY
PODSTAWOWE TERMINY
DLA OPERACJI PROCESOWYCH
DLA OPERACJI PROCESOWYCH
W instalacji i operacjach technologicznych są
rozróżniane następujące stany:
a) normalne operacje,
b) operacje wcześniej przewidziane w projekcie
procesowym,
c) zakłócenie w warunkach procesu,
d) awaria (wypadek).
Te stany są uzupełniane następującymi
nieodłącznymi pojęciami:
projektowe bezpieczeństwo procesu,
incydentalne zapobiegawcze działanie,
działanie na wypadek skutków awarii.
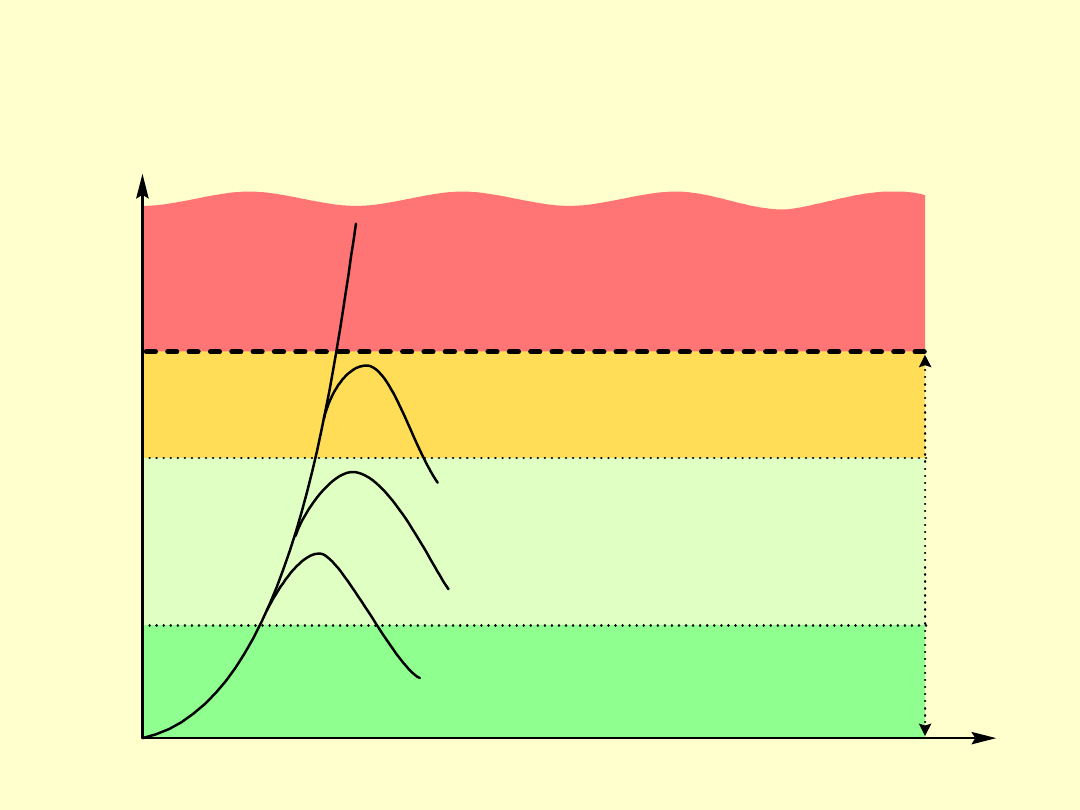
Oddziaływanie stanu procesu a koncepcja
Oddziaływanie stanu procesu a koncepcja
zasad bezpieczeństwa
zasad bezpieczeństwa
p
lub
T
Czas
o d c h y le n ia p ro c e s u
u n ie m o �liw ia j�c e
je g o k o n ty n u o w a n ie
z d a rz e n ie lu b w y p a d e k
g ra n ic z n e w a ru n k i
lu b o d c h y le n ia p ro c e s u
z a k re s to le ro w a n y c h
o d c h y le � p ro c e s u
n o rm a ln a p ra c a
in s ta la c je ro b o c z e
d z ia �a n ia k o re k c y jn e
k o n tro li n a d z o rc z e j
z a p o b ie g a n ie w y p a d k o m
s y s te m o c h ro n y
a w a ry jn e j
pr
ac
a
w
z
ak
re
si
e
ok
re
�l
on
eg
o
pr
oj
ek
tu

Postępowanie w badaniach
Postępowanie w badaniach
związanych z oceną bezpieczeństwa
związanych z oceną bezpieczeństwa
Proces musi być charakteryzowany
eksperymentalnie.
Normalne warunki operacji technologicznych muszą
być
oszacowane za pomocą kryteriów, które można
zastosować
w przechodzeniu od eksperymentalnych rezultatów
(badań
instrumentalnych) do warunków procesu
technologicznego.
Możliwe procesowe odchylenia muszą być
systematycznie
identyfikowane, charakteryzowane i oceniane z
punktu widzenia
bezpieczeństwa.
Żądane i zalecanie co do bezpieczeństwa instalacji
i/lub
modyfikacje procesu muszą być realizowane w
oparciu o wszystkie
informacje i muszą być zastosowane.
Parametry termicznego
Parametry termicznego
bezpieczeństwa reakcji
bezpieczeństwa reakcji
egzotermicznych
egzotermicznych
Termodynamic
zne
Kinetyczn
e
Szybkość reakcji
Szybkość
generowanego
ciepła
Temperatura rozkładu
Adiabatyczny czas indukcji
Szybkość wzrostu ciśnienia
Energia aktywacji
Energia reakcji
Adiabatyczny przyrost
temperatury
Objętość właściwa
wydzielanych gazów
Ciśnienie maksymalne po
reakcji

Cykl życiowy procesu chemicznego
Cykl życiowy procesu chemicznego
Badania
naukowe
Opracowanie
procesu
Instalacja
pilota�
owa
Produkcja
przemys�
owa
Zako�czenie
produkcji

Z
Z
ada
ada
nia
nia
związan
związan
e
e
z oceną
z oceną
reaktywności na różnych etapach
reaktywności na różnych etapach
rozwoju technologii
rozwoju technologii
Etap
Główna problematyka
Aspekty techniczno-
organizacyjne
dotyczące procesu
Skala laboratoryjna badań
nad procesem
Charakterystyka
substancji
Ocena potencjalnych zagrożeń
Analiza alternatywnych
procesów
Wybór procesu
Badania pilotowe procesu
Charakterystyka
zagrożeń
Wpływ instalacji na zagrożenia
Zdefiniowanie bezpiecznych
procedur
Badanie skutków
potencjalnych zmian w
procesie
Określenie krytycznych
warunków pracy
Produkcja przemysłowa
Korekta pierwotnej
charakterystyki zagrożeń
w procesie
Analiza zagrożeń związanych
ze skalą i organizacją działania
Zarządzanie zmianami w
procesie
Ocena powiązań
bezpieczeństwa procesowego z
aspektami ekonomicznymi,
produkcyjnymi, inżynieryjnymi
i handlowymi

Podstawowe pojęcia
Podstawowe pojęcia
Niesprawnością obiektu nazywamy
każde zdarzenie
uniemożliwiające fizyczne spełnienie przewidzianych
dla niego funkcji.
Niesprawność
(uszkodzenie), której usunięcie wymaga
dużych nakładów nazywamy awarią.
Pojawienia się zdarzenia niepożądanego w postaci
niesprawności wywołuje stan zagrożenia.
W każdym procesie niesprawność wywołuje stan
zagrożenia, któremu można przypisać określony
„potencjał zagrożenia”.
Uwolnienie się potencjału niebezpieczeństwa w postaci
sekwencji wtórnych zdarzeń niepożądanych może
prowadzić do powstawania strat.
Przejście ze stanu zagrożenia do strat nazywamy
wypadkiem.
Wypadek w którym straty są duże nazywamy
katastrofą.

Zjawisko wybuchu w reaktywnych
Zjawisko wybuchu w reaktywnych
układach
układach
Reakcje główne
to takie, które prowadzą do
otrzymania założonego produktu. Te reakcje są
głównym celem procesu technologicznego (desired
reaction or primary reaktion)
Reakcje poboczne
są reakcjami następczymi lub
pobocznymi w stosunku do reakcji głównej.
Najczęściej jest to kilka reakcji. Z punktu widzenia
bezpieczeństwa procesów chemicznych ważne są
reakcje egzotermiczne.
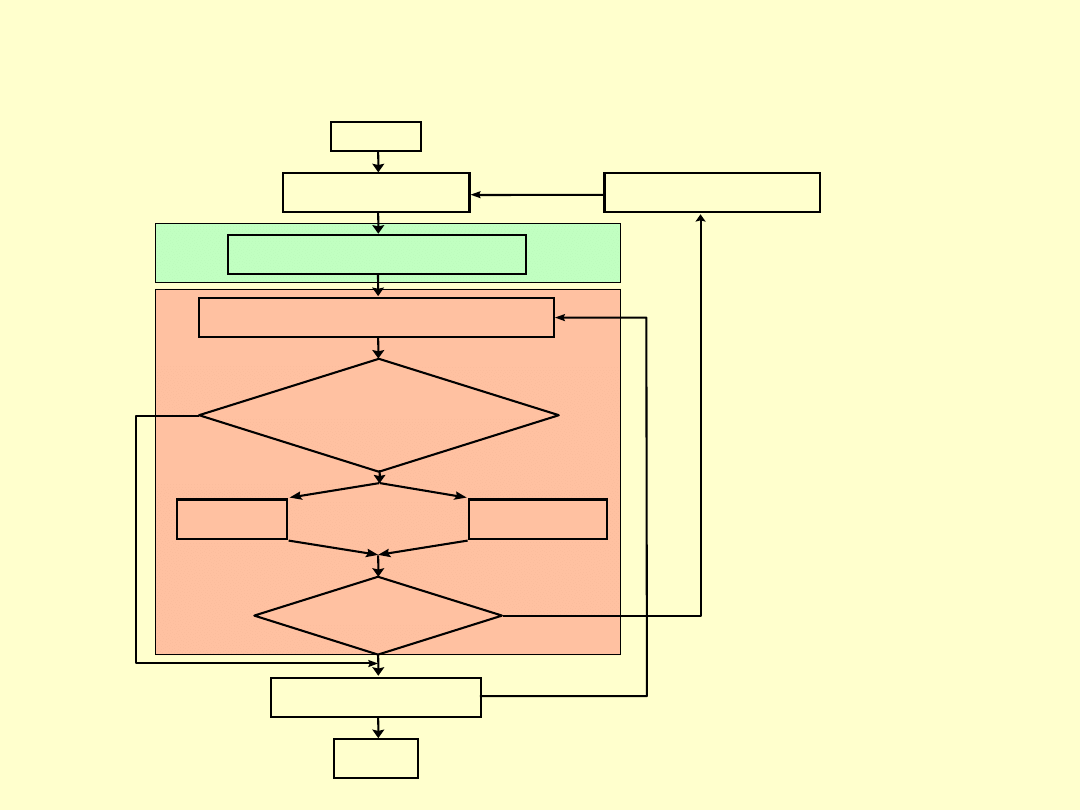
Procedura postępowania w badaniach
Procedura postępowania w badaniach
z bezpieczeństwem procesu
z bezpieczeństwem procesu
Konieczna modyfikacja
procesu lub instalacji
START
Określenie procesu
oraz opis instalacji
Ocena bezpieczeństwa procesu
w normalnych warunkach pracy
Systematyczna identyfikacja możliwych
odchyleń od normalnej pracy
Działania
techniczne
Działania
organizacyjne
Tak
Tak
Tak
Nie
Nie
Nie
i/lub
Ocena następnego
możliwego odchylenia
Raport
STOP
Process
Hazard
Assessment &
Safety
Evaluation
Proces
Oceny
Zagrożeń
i Określania
Bezpieczeństwa
Czy teraz
proces może być
kontrolowany?
Czy proces może być wciąż
kontrolowany przy granicznych
warunkach pracy?

Adiabatyczny wzrost temperatury
Adiabatyczny wzrost temperatury
(T
(T
ad
ad
)
)
T
ad
= -U/C
p
gdzie: U – ciepło reakcji,
C
p
– ciepło właściwe.
Dla związków organicznych C
p
zmienia się w
granicach od 1.5 do 2.0 J/g w temperaturze
pokojowej. W pierwszym przybliżeniu można
przyjąć, że adiabatyczny wzrost temperatury
związany z egzotermicznym efektem reakcji jest
proporcjonalny do ciepła reakcji.

Adiabatyczny wzrost temperatury
Adiabatyczny wzrost temperatury
(T
(T
ad
ad
)
)
c.d.
c.d.
Maksymalna możliwa temperatura reakcji (T
max
)
T
max
= T
R
+ T
ad
gdzie T
R
– temperatura reakcji.
Termiczna liczba reakcji (B)
gdzie: E – energia aktywacji,
T
ad
– adiabatyczny wzrost temperatury,
T
0
– temperatura początkowa,
R – stała gazowa.
2
0
ad
RT
T
E
B
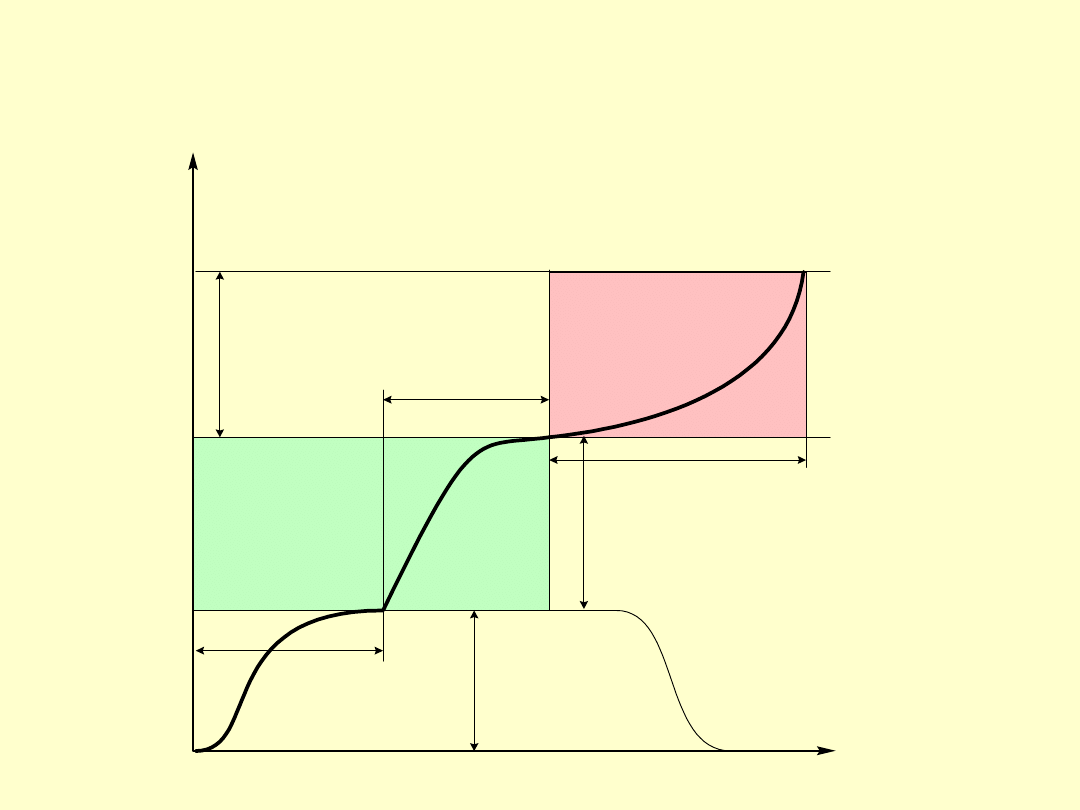
Schemat zmiany temperatury
Schemat zmiany temperatury
procesów chemicznych w przypadku
procesów chemicznych w przypadku
awarii układu chłodzenia
awarii układu chłodzenia
Temperatura
Czas
T
end
MTSR
T
p
reakcja
po�
�
dana
reakcje
wt�rne
czas do
awarii
ch�
odzenia
wzrost temp.
w warunkach
normalnego
procesu
wzrost temp.
na skutek braku
ch�
odzenia
czas indukcji reakcji wt�rnych
w warunkach adiabatycznych
czas do
osi�gni�cia
MTSR
wzrost temp.
na skutek
reakcji
wt�rnych

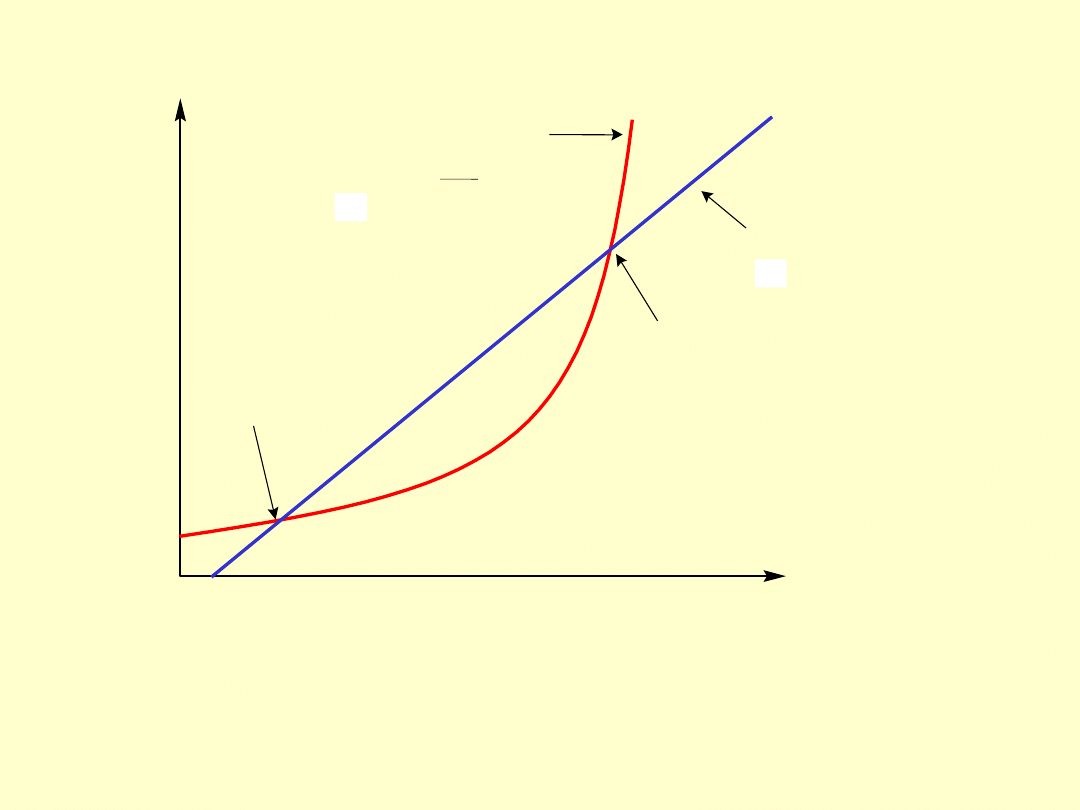
Warunki powstawania wybuchu
Warunki powstawania wybuchu
cieplnego
cieplnego
M
o
c
c
ie
p
ln
a
Temperatura
R
RT
E
RA
H
e
k
Q
A
0
T
T
K
Q
RA
Warunki
stabilne
Bilans
podkrytyczny
Warunki
niestabilne
Bilans
nadkrytyczny
Odbiór ciepła
Wydzielanie ciepła
R
K
k – współczynnik kinetyczny,
E – energia
aktywacji,
R – stała gazowa,
A – powierzchnia
wymiany ciepła,
K – współczynnik przenikania ciepła,
T – temperatura
procesu,
T
0
– temperatura czynnika chłodzącego
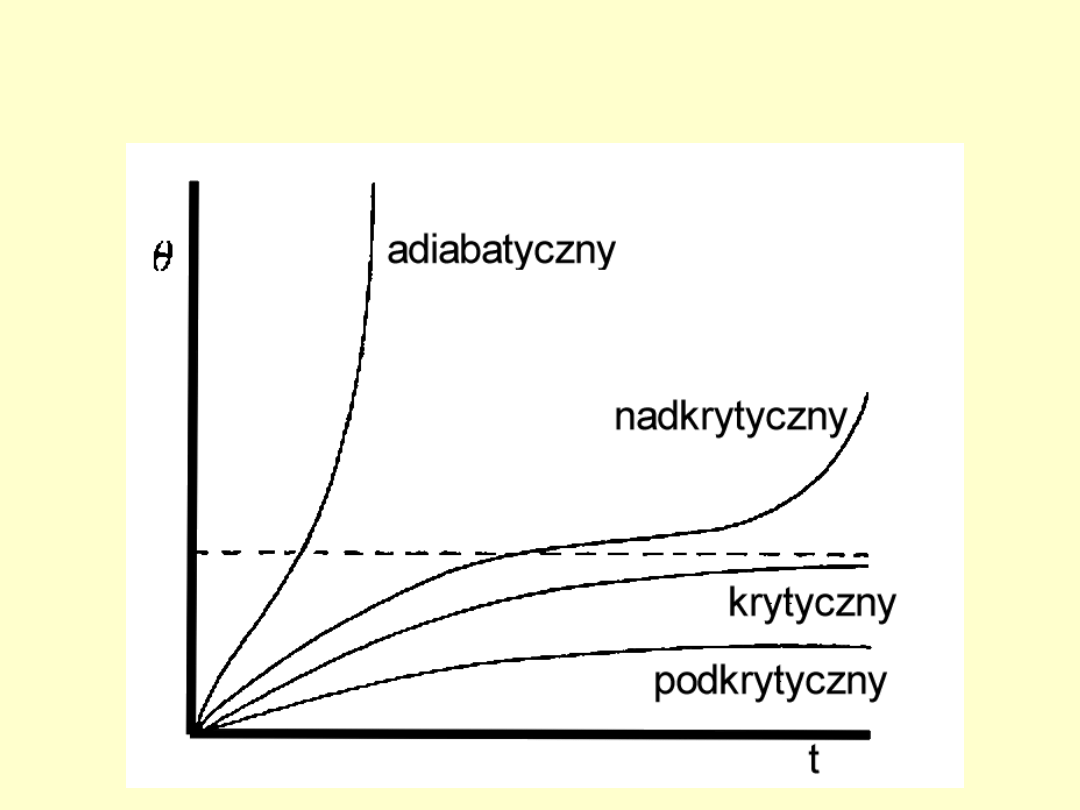
Krzywe procesu samoogrzewania w
Krzywe procesu samoogrzewania w
warunkach adiabatycznych i dla układów
warunkach adiabatycznych i dla układów
przekazujących ciepło otoczeniu przy
przekazujących ciepło otoczeniu przy
różnych warunkach chłodzenia
różnych warunkach chłodzenia
Oddziaływanie na strumień
Oddziaływanie na strumień
wydzielanego ciepła
wydzielanego ciepła
q
1
= � H
r
�
r�
V
Zmniejszenie wydzielanego ciep�
a
Zmniejszenie r
�
niska temperatura
�
rozcie�czenie
�
mniejsza szybko��
dozowania
Zmniejszenie V
�
zmniejszenie masy
reakcyjnej
Zmniejszenie � H
r
�
zmiana reagent�w
Oddziaływanie na strumień
Oddziaływanie na strumień
odbieranego ciepła
odbieranego ciepła
q
2
= K�
(T
c
�T)�
A
Zwi�kszenie zdolno�ci ch�
odzenia
Wzrost K
�
efektywniejszy typ
mieszad�
a
�
zwi�kszenie ilo�ci
obrot�w mieszad�
a
�
wi�kszy strumie�
cieczy ch�
odz�cej
Wzrost T
c
�T
�
ch�
odniejszy
czynnik
�
wi�kszy strumie�
cieczy ch�
odz�cej
�
ni�sza temperatura
pocz�tkowa reakcji
Wzrost A
�
maksymalne upako-
wanie powierzchni
� p�aszcz i w�ownica
zastosowane
jednocze�nie

Kryterium Semenov’a
Kryterium Semenov’a
Dla fazy gazowej i ciekłej można przyjąć, że
Dla fazy gazowej i ciekłej można przyjąć, że
temperatura wewnątrz zbiornika użytego do reakcji
temperatura wewnątrz zbiornika użytego do reakcji
periodycznej lub transportu jest stała ze względu na
periodycznej lub transportu jest stała ze względu na
ruchy konwekcyjne. Cały gradient temperatury między
ruchy konwekcyjne. Cały gradient temperatury między
medium, a otoczeniem jest we wnętrzu ścianek
medium, a otoczeniem jest we wnętrzu ścianek
zbiornika.
Biorąc
pod
uwagę
ciepło
reakcji
zbiornika.
Biorąc
pod
uwagę
ciepło
reakcji
egzotermicznej i ciepło wymienione z otoczeniem,
egzotermicznej i ciepło wymienione z otoczeniem,
zmiany temperatury medium w wyniku przebiegu
zmiany temperatury medium w wyniku przebiegu
reakcji egzotermicznej można wyrazić równaniem:
reakcji egzotermicznej można wyrazić równaniem:
0
ad
T
T
RT
E
exp
A
T
dt
dT

Zmiany temperatury w układzie
Zmiany temperatury w układzie
Powyższe równania są słuszne dla reakcji zerowego
Powyższe równania są słuszne dla reakcji zerowego
lub pierwszego rzędu. Równania różniczkowe dla
lub pierwszego rzędu. Równania różniczkowe dla
reakcji autokatalitycznych są złożone i nie posiadają
reakcji autokatalitycznych są złożone i nie posiadają
rozwiązania analitycznego
rozwiązania analitycznego
.
.
gdzie
gdzie
u
u
jest stopniem przereagowania, a
jest stopniem przereagowania, a
= (T-T
= (T-T
0
0
)/
)/
T
T
ad
ad
.
.
u
u
1
k
dt
d
Wybuch cieplny w warunkach
Wybuch cieplny w warunkach
adiabatycznych
adiabatycznych
c.d.
c.d.
Dla
Dla
reakcji zerowego lub pierwszego rzędu czas do
reakcji zerowego lub pierwszego rzędu czas do
wybuchu można obliczyć zgodnie z relacją:
wybuchu można obliczyć zgodnie z relacją:
.
.
0
2
0
exp
RT
E
T
AE
RT
ad
ad
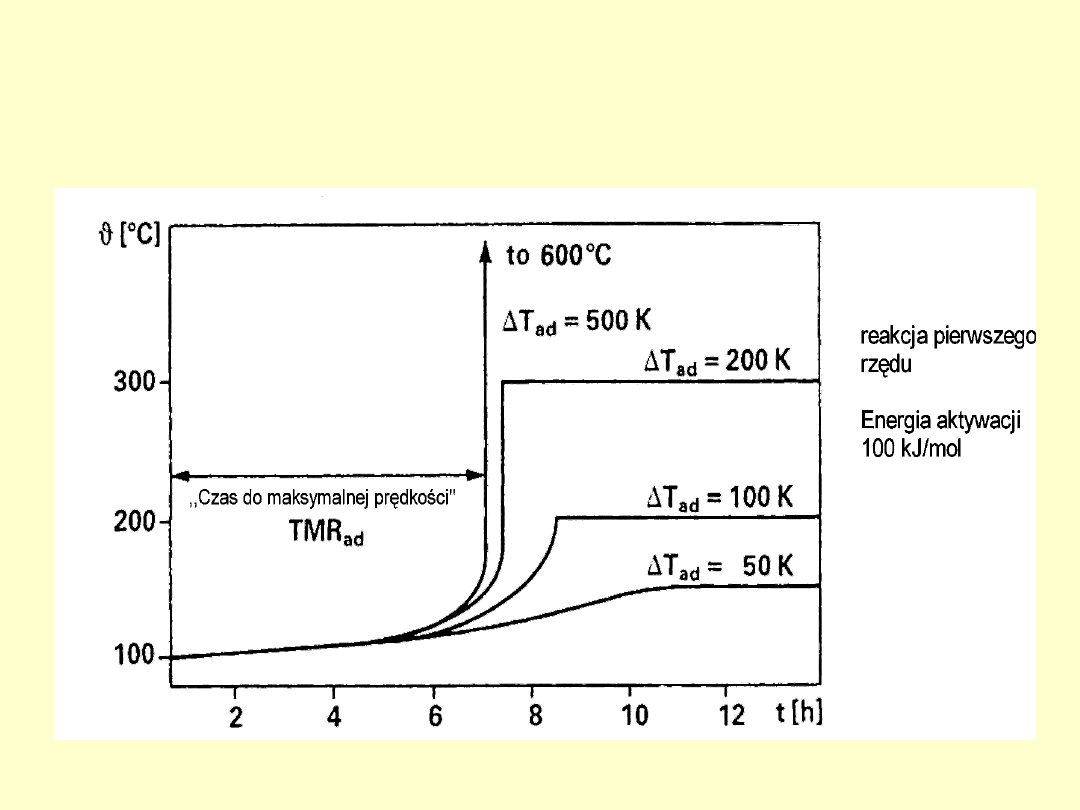
Zależność temperatury układu
Zależność temperatury układu
reakcyjnego od czasu dla adiabatycznego
reakcyjnego od czasu dla adiabatycznego
cieplnego układu dla różnych wartości
cieplnego układu dla różnych wartości
T
T
ad
ad

Rekomendowane procedury badań
Rekomendowane procedury badań
do szacowania bezpieczeństwa
do szacowania bezpieczeństwa
Skala
procesu
Zakres badań
Metody badań
Proces
laboratoryjny
Wielkolaborator
yjny (kg-skala)
Skala ułamkowa
Skala
produkcyjna
Badania literaturowe
Analiza teoretyczna
Charakterystyka
substancji i mieszanin
w aspekcie
bezpieczeństwa
1) Ostateczne
ustalenie
warunków
normalnych
operacji
technologicznych
2) Identyfikacja
możliwych
odchyleń
Ostateczne
oszacowanie
wszystkich etapów i
odchyleń
Struktura
chemiczna
Bilans tlenowy
Testy klasyfikacji
Reakcje
Kalorymetria do
badań reakcji
Fizyczne
jednostkowe
operacje:
adiabatyczne i
inne
skomplikowane
metody
Kalorymetria
adiabatyczna i
inne złożone
metody
Informacje termodynamiczne i kinetyczne
Informacje termodynamiczne i kinetyczne
niezbędne do szacowania bezpieczeństwa
niezbędne do szacowania bezpieczeństwa
procesów chemicznych
procesów chemicznych
Informacje
termodynamiczn
e
Informacje
kinetyczne
Reakcja główna
(cel procesu)
Reakcja poboczna
(reakcja
niepożądana)
ciepło reakcji,
pojemność cieplna,
MTSR*,
p
max
ciepło reakcji
T
k
p
max
stopień
akumulacji ciepła
temperatura =
f(czas),
ciśnienie = f(czas)
warunki
niezbędne do
uwolnienia reakcji
pobocznych,
proces,
temperatura =
f(czas),
ciśnienie = f(czas)
* maksymalna dostępna temperatura reakcji syntezy.
* maksymalna dostępna temperatura reakcji syntezy.

Ocena niebezpiecznej reaktywności
Ocena niebezpiecznej reaktywności
substancji
substancji
Różnice dotyczące prowadzenia reakcji
nieorganicznych i organicznych:
- reakcje organiczne muszą, być prowadzone
w ograniczonym zakresie temperatur,
wynikającym
z niestabilności substancji,
- przy prowadzeniu reakcji organicznych
muszą być,
każdorazowo brane pod uwagę zagrożenia
pożarowe.

Ocena niebezpiecznej reaktywności
Ocena niebezpiecznej reaktywności
substancji
substancji
c.d.
c.d.
Ocena niebezpiecznej reaktywności substancji
obejmuje:
identyfikację niestabilnych grup molekularnych,
ocenę struktury cząsteczki związku chemicznego ze
względu na
jej reaktywność z substancjami, które powszechnie
występują w
procesach przemysłowych (woda, powietrze,
utleniacze, paliwa,
kwasy, ślady związków metali, inne środki natury
chemicznej),
określenie energii, która potencjalnie może
towarzyszyć reakcji
substancji na podstawie:
a) entalpii rozkładu i (lub) reakcji substancji,
b) bilansu tlenowego związku chemicznego.

Bilans tlenowy
Bilans tlenowy
Bilans tlenowy MW o składzie sumarycznym
C
C
a
a
H
H
b
b
O
O
c
c
N
N
d
d
oblicza się według wzoru:
gdzie
M
-
masa
cząsteczkowa
materiału
wybuchowego.
Bilans tlenowy może przyjmować wartości dodatnie
lub ujemne.
2
b
a
2
c
M
1600
B
t

Ocena niebezpiecznej reaktywności
Ocena niebezpiecznej reaktywności
substancji
substancji
c.d.
c.d.
W przypadku zagrożeń związanych z rozwojem
niepożądanych reakcji, szczególnie ważne jest
zainteresowanie się:
- grupami funkcyjnymi, podatnymi na egzotermiczną
polimeryzację
,
- grupami funkcyjnymi, podatnymi do tworzenia
wiązań
nadtlenkowych w obecności tlenu atmosferycznego,
- kombinacjami substancji stwarzających zagrożenia
we wzajemnym
kontakcie, który może być przypadkowy, na tle
prowadzonych
w sąsiedztwie operacji technologicznych.

Analizując reaktor o działaniu okresowym można
stosować dwie równoległe drogi kształtowania
bezpiecznego rozwiązania w fazie projektowania:
1) przez dobór warunków wpływających na
minimalizację
strumienia generowanego ciepła,
2) przez dobór warunków wpływających na
maksymalizację
strumienia chłodzącego.
Ocena niebezpiecznej reaktywności
Ocena niebezpiecznej reaktywności
substancji
substancji
c.d.
c.d.
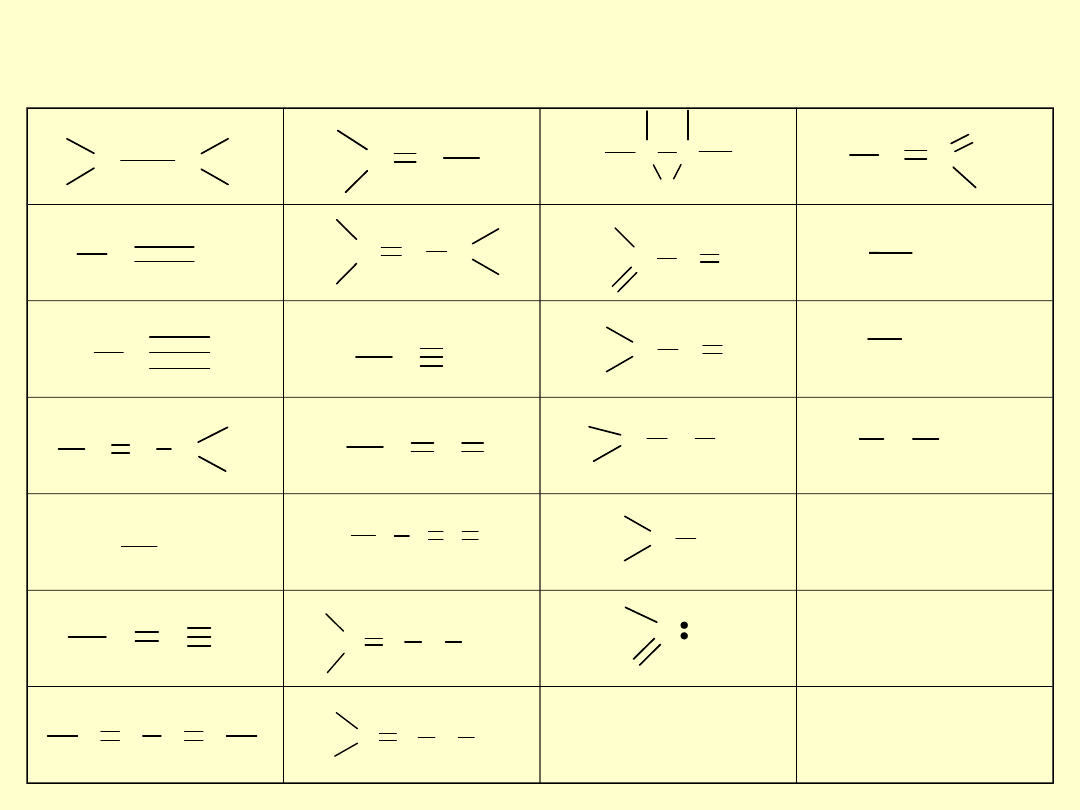
Funkcyjne grupy zawierające azot
Funkcyjne grupy zawierające azot
które dają wzrost egzotermicznego
które dają wzrost egzotermicznego
efektu reakcji rozkładu
efektu reakcji rozkładu
N
N
N
N
+
N
N
N N N
N
3
C N N
N N N N
C N
C N N
C N
N O
N C O
N C S
C
C N O H
C N O R
C
NH
C
C N O
N N O
N O H
N Cl
N N
O
ONO
NO
2
O NO
2
NH
2
.
HNO
3
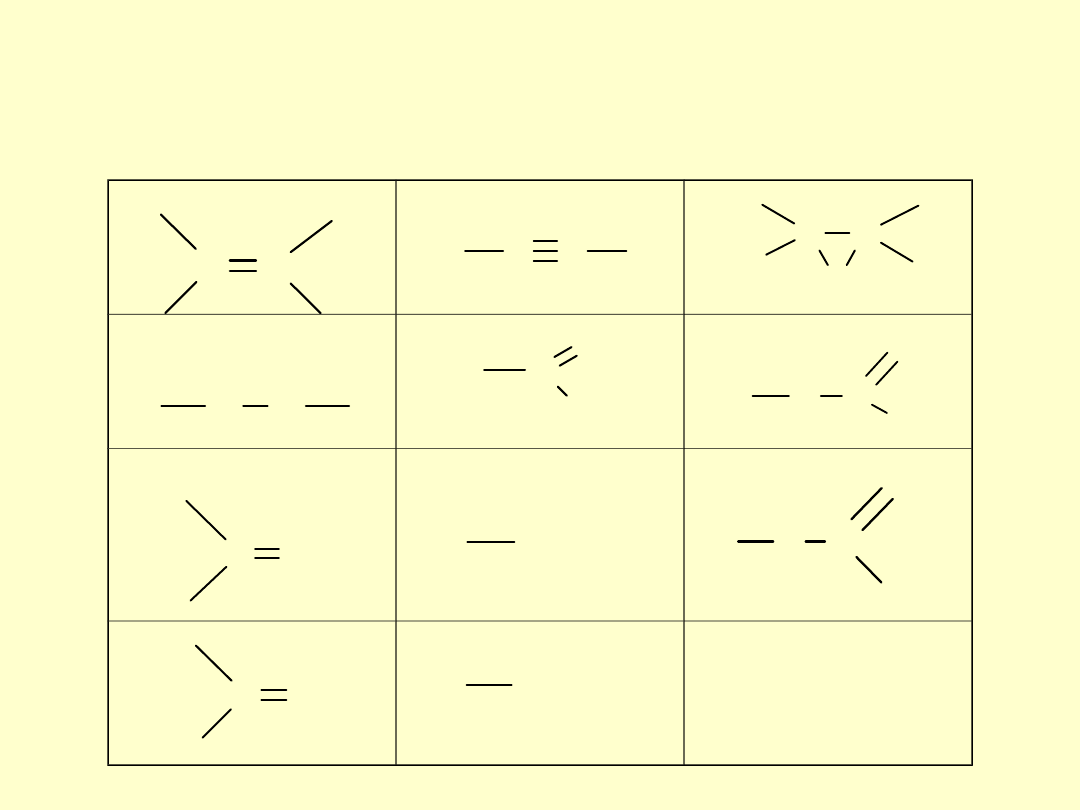
Typowe funkcyjne grupy nie zawierające
Typowe funkcyjne grupy nie zawierające
azotu, które dają wzrost egzotermicznego
azotu, które dają wzrost egzotermicznego
efektu reakcji rozkładu
efektu reakcji rozkładu
i polimeryzacji
i polimeryzacji
C C
O O
S O
P O
C C
O
C
Cl
SO
2
Cl
P(OR)
2
C C
O
O C
O
Cl
O C
S
SK
P(OR)
3

Wykorzystanie adiabatycznych
Wykorzystanie adiabatycznych
pomiarów
pomiarów
Z
adiabatycznych
krzywych
doświadczalnych
temperatura - czas procesu samoogrzewania można
wyznaczyć
następujące
parametry:
- szybkość wzrostu temperatury,
- szybkość wydzielanego ciepła,
- całkowity adiabatyczny przyrost ciepła,
- szybkość wzrostu ciśnienia,
- adiabatyczny czas indukcji w funkcji ciśnienia,
-
- temperaturę w której wyspecyfikowany czas
indukcji zostanie
osiągnięty,
- parametry kinetyczne,
- ciepło reakcji.

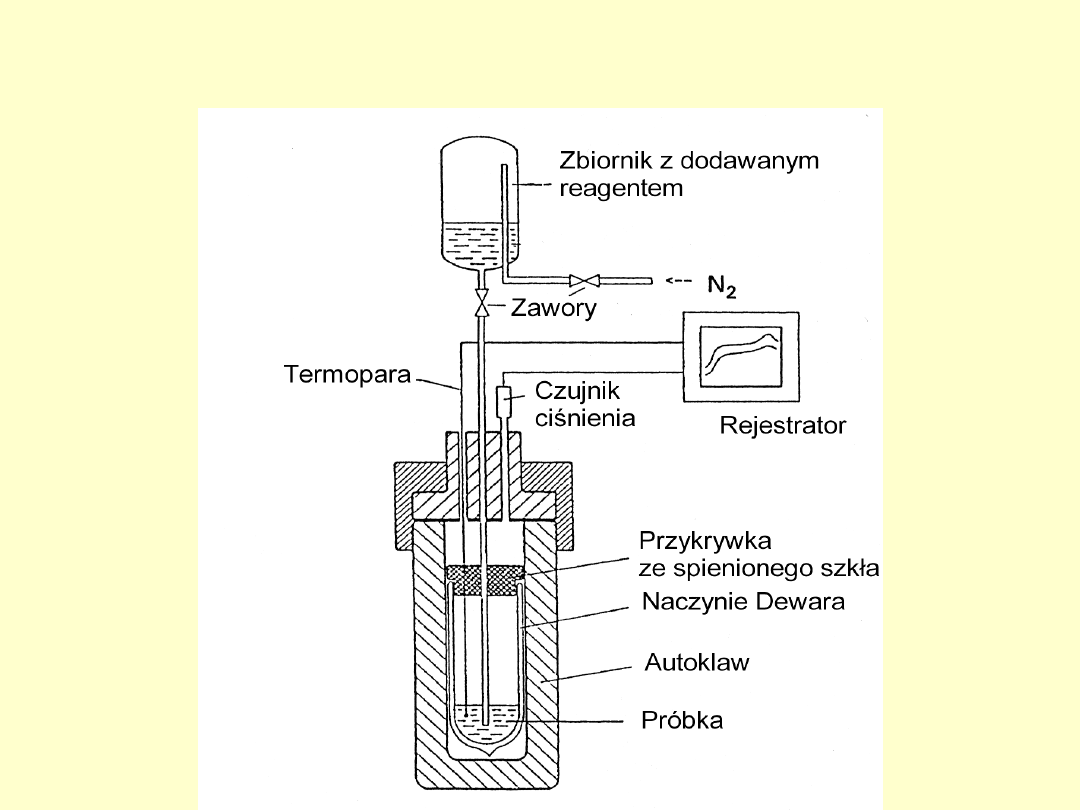
Mały autoklaw do badań w naczyniu Dewara
Mały autoklaw do badań w naczyniu Dewara
pod ciśnieniem gazu obojętnego
pod ciśnieniem gazu obojętnego

Badanie wydzielanych gazów
Badanie wydzielanych gazów
Do
gazowych
produktów
rozkładu
można
Do
gazowych
produktów
rozkładu
można
zastosować trzy rodzaje badań:
zastosować trzy rodzaje badań:
1) pomiar objętości całkowitej wydzielonego
gazu
charakteryzowaną poprzez objętość
właściwą,
2) pomiar szybkości wydzielanych gazów (to
można realizować
w różnych warunkach pomiaru na przykład
adiabatycznych
lub izotermicznych,
3) badanie składu i ilości wydzielanych
produktów gazowych
tworzonych podczas rozkładu.
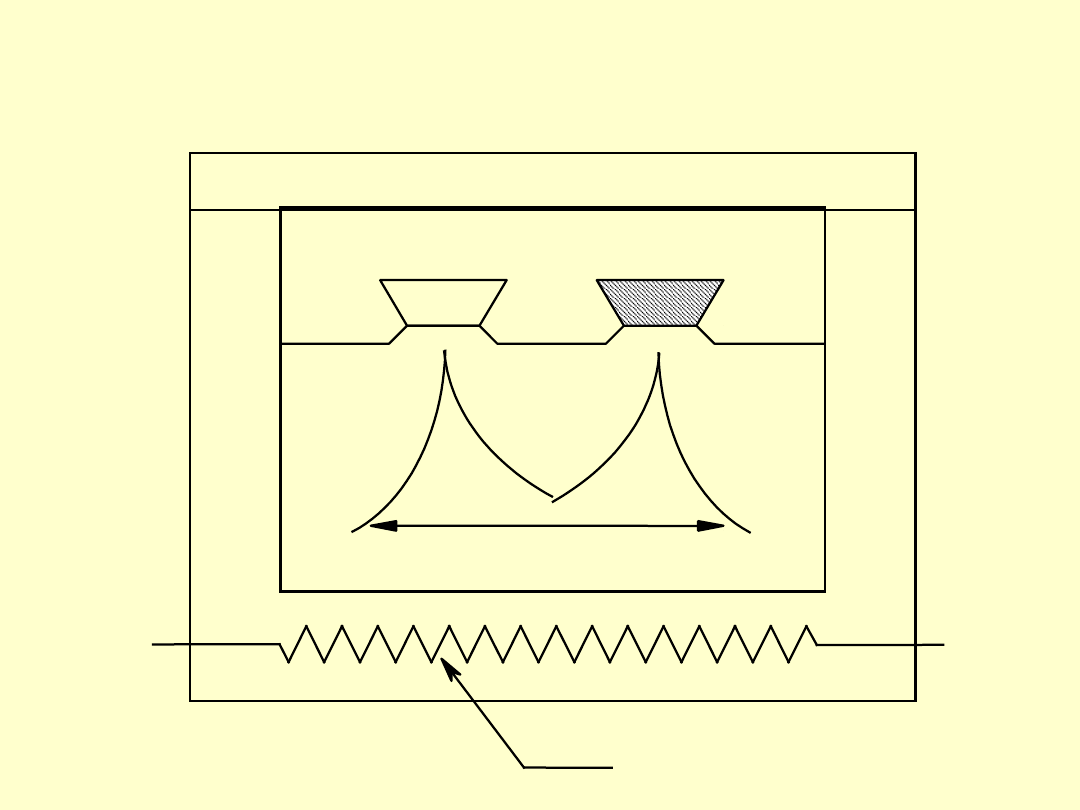
Schemat układu przepływowego DSC
Schemat układu przepływowego DSC
S
R
T
grzałka
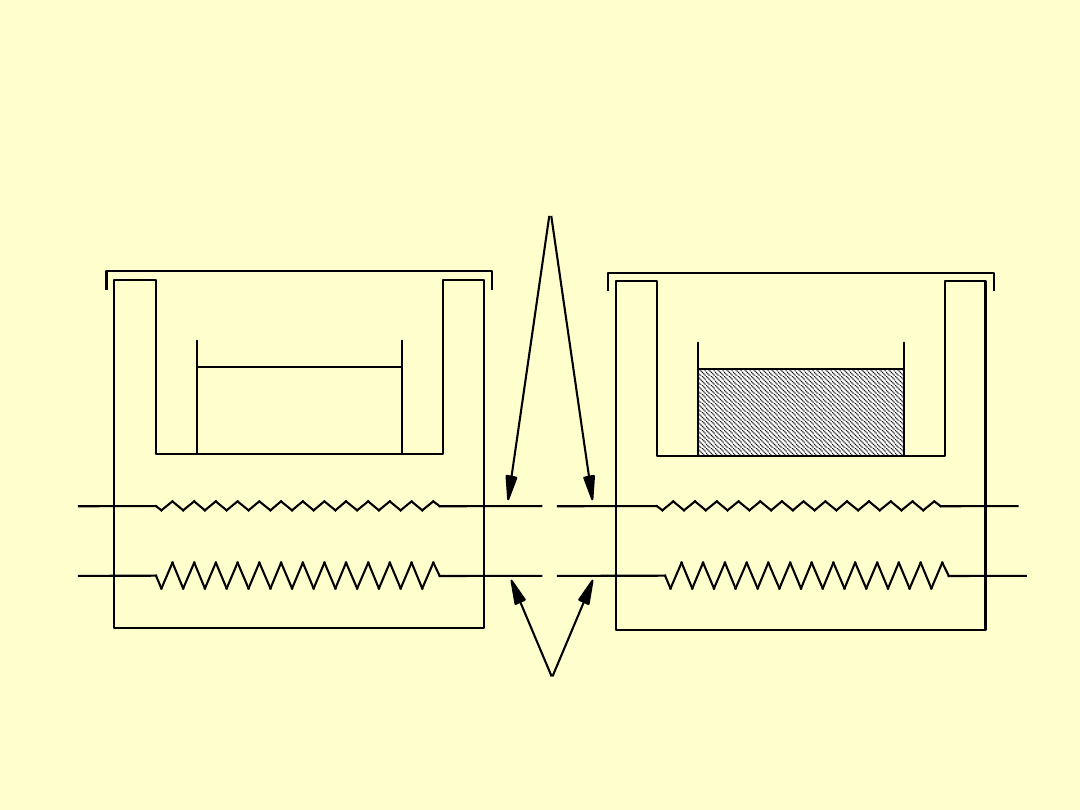
Schemat układu kompensacyjnego
Schemat układu kompensacyjnego
DSC
DSC
R
S
grzałki niezależnie sterowane
czujniki platynowe
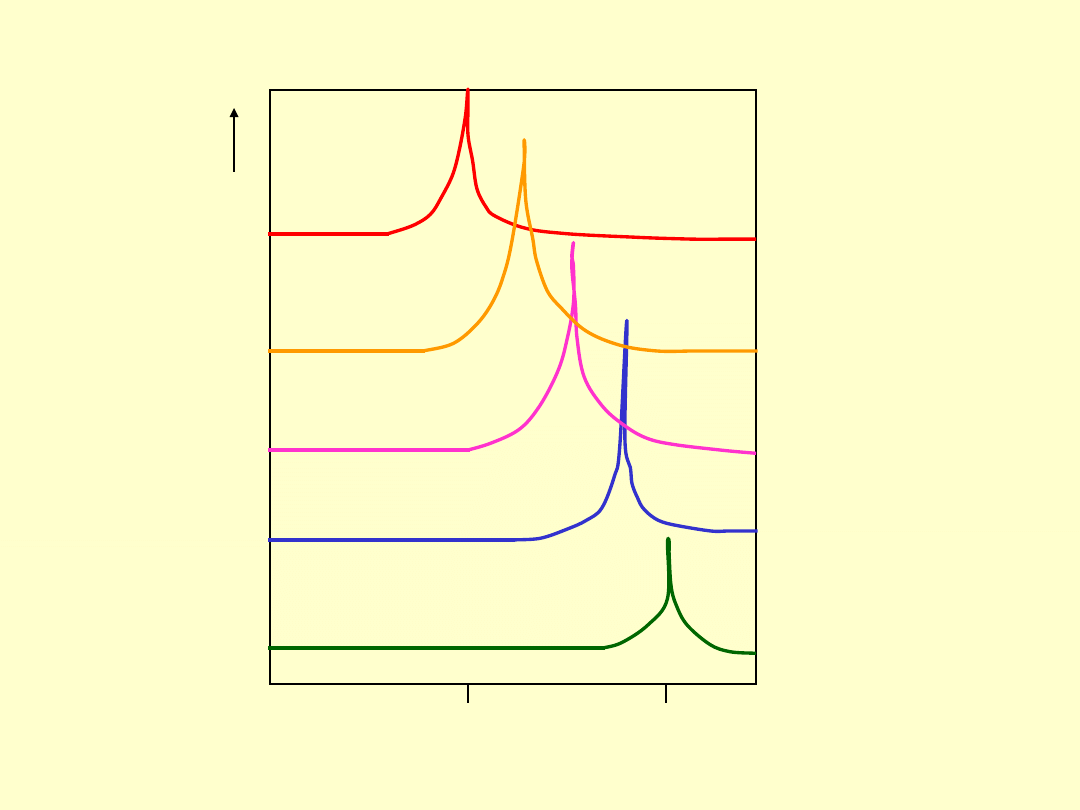
Przykład zastosowania DSC
Przykład zastosowania DSC
Temperatura [
Temperatura [
o
o
C]
C]
200
200
300
300
400
400
450
450
Czysty kwas 3-nitrobenzoesowy
Czysty kwas 3-nitrobenzoesowy
1,5% VCL
1,5% VCL
3
3
1,6% MoCL
1,6% MoCL
5
5
1,3% FeCL
1,3% FeCL
3
3
1,6% NaCl
1,6% NaCl
e
g
zo
e
g
zo
T
T

Jakościowa interpretacja krzywych
Jakościowa interpretacja krzywych
DTA i DSC
DTA i DSC
Dla normalnych reakcji wzrost szybkości
Dla normalnych reakcji wzrost szybkości
pomiaru temperatury dwu lub trzykrotnie
pomiaru temperatury dwu lub trzykrotnie
przesuwa egzotermiczny pik
przesuwa egzotermiczny pik około 10 K
około 10 K
w
w
kierunku wyższych temperatur.
kierunku wyższych temperatur.
Dla termicznego egzotermicznego rozkładu
Dla termicznego egzotermicznego rozkładu
substancji, można przyjąć regułę
substancji, można przyjąć regułę
,,100 K”, tzn. operacje technologiczne są
,,100 K”, tzn. operacje technologiczne są
bezpieczne w temperaturach
bezpieczne w temperaturach
100 K
100 K
poniżej
poniżej
temperatury maksimum piku egzotermicznej
temperatury maksimum piku egzotermicznej
reakcji oznaczonej metodą DTA lub DSC dla
reakcji oznaczonej metodą DTA lub DSC dla
szybkości wzrostu temperatury 10 K/min.
szybkości wzrostu temperatury 10 K/min.
Dla mniejszych szybkości wartość ta powinna
Dla mniejszych szybkości wartość ta powinna
być zmniejszona, np. dla szybkości wzrostu
być zmniejszona, np. dla szybkości wzrostu
temperatury
1
K/min
wynosi
około
temperatury
1
K/min
wynosi
około
70 K
70 K
.
.

Adiabatyczna temperatura rozkładu dla 24
Adiabatyczna temperatura rozkładu dla 24
godz. (ADT
godz. (ADT
24
24
)
)
Wykonując
badania
czasu
do
Wykonując
badania
czasu
do
wybuchu
od
temperatury
w
wybuchu
od
temperatury
w
warunkach adiabatycznych można
warunkach adiabatycznych można
obliczyć temperaturę, w której do
obliczyć temperaturę, w której do
wybuchu dochodzi po 24 godzinach.
wybuchu dochodzi po 24 godzinach.
Przyjmuje
się,
że
temperatura
Przyjmuje
się,
że
temperatura
bezpieczna jest niższa o 20 K od
bezpieczna jest niższa o 20 K od
temperatury
oznaczonej
metodą
temperatury
oznaczonej
metodą
ADT
ADT
24
24
.
.

Temperatura samoprzyśpieszającego się
Temperatura samoprzyśpieszającego się
rozkładu SADT
rozkładu SADT
(Self accelerating
(Self accelerating
decomposition temperature)
decomposition temperature)
Próbka około 400 ml w naczyniu Dewar’a o objętości
500 cm
3
wykazuje podobne straty cieplne, jak
naczynie transportowe pozwalające na przewóz
materiału o masie około 100 kg.
Test
SADT
jest
stosowany
do
określania
bezpieczeństwa
w
transporcie.
Badania
przeprowadza się w temperaturze
20 K
powyżej
maksymalnej
temperatury
mogącej
wystąpić
podczas transportu. Zapis temperatury w funkcji
czasu prowadzi się około
2 K
poniżej temperatury
termostatowania
przez
siedem
dni.
Jeśli
temperatura badanego materiału w wymienionym
czasie nie przewyższy
6 K
, to badana substancja
może być dopuszczona do transportu.

Jeśli
reakcja
główna
jest
tylko
niskoenergetyczna, tzn.
T
ad
< 50K
, to w
następnym etapie bada się mieszaniny
reakcyjne na istnienie egzotermicznych
reakcji pobocznych.
Jeśli ciepło reakcji egzotermicznej pobocznej
(-U) jest mniejsze niż
100 J/g lub T
ad
jest <
50 K
, to bardzo rzadko wymagane są
dodatkowe badania.
Temperatura samoprzyśpieszającego się
Temperatura samoprzyśpieszającego się
rozkładu SADT
rozkładu SADT
(Self accelerating
(Self accelerating
decomposition temperature)
decomposition temperature)

Do gazowych produktów rozkładu można zastosować trzy
Do gazowych produktów rozkładu można zastosować trzy
rodzaje badań:
rodzaje badań:
1) pomiar objętości całkowitej wydzielonego gazu
charakteryzowaną poprzez objętość właściwą,
2) pomiar szybkości wydzielanych gazów (to można
realizować
w różnych warunkach pomiaru na przykład
adiabatycznych
lub izotermicznych,
3) badanie składu i ilości wydzielanych produktów
gazowych
tworzonych podczas rozkładu.
Badanie wydzielanych gazów
Badanie wydzielanych gazów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
PEDOFILIA word, Bezpieczeństwo 2, Bezp II rok, sem I, Przestępczość kryminalna M.Kotowska, do wydruk
Prawo karne wykład I, WSPiA bezpieczeństwo wewnętrzne, II ROK, III semestr
moc rozdrobnienia, WNoZ, Inżynieria procesowa II, egzamin
2012 - Pytania do kol wyk, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 2, d
Aborcja word, Bezpieczeństwo 2, Bezp II rok, sem I, Przestępczość kryminalna M.Kotowska, do wydruku
tajemnica gospodarcza, Bezpieczeństwo 2, Bezp II rok, sem I, ochona danych osobowych i informacji ni
Prostytucja word, Bezpieczeństwo 2, Bezp II rok, sem I, Przestępczość kryminalna M.Kotowska, do wydr
Tezy na II kol. dla osób co zaliczyły, Bezpieczeństwo 2, Bezp II rok, sem II, ochrona mienia
Finanse publ.wykład z dn.20.03.2011, WSPiA bezpieczeństwo wewnętrzne, II ROK, IV semestr, finanse pi
bezrobocie -Rysiu I ja, WSPiA bezpieczeństwo wewnętrzne, II ROK, IV semestr, prawo administracyjne c
PORWANIA DLA OKUPU word, Bezpieczeństwo 2, Bezp II rok, sem I, Przestępczość kryminalna M.Kotowska,
Zawartość i redakcja zadania do samodzielnego wykonania z SZSK, Bezpieczeństwo 2, Bezp II rok, sem I
kontrol identyfik potencj źródeł zagrożeń i oceny bezpiecz procesow instalacji, BHP nowe, BHP
reguła newmana na przykładzie, WNoZ, Inżynieria procesowa II, egzamin
XI, Bezpieczeństwo 2, Bezp II rok, sem I, ochona danych osobowych i informacji niejawnych, wykłady w
PRZEMOC DOMOWA word, Bezpieczeństwo 2, Bezp II rok, sem I, Przestępczość kryminalna M.Kotowska, do w
Pr. Finansowe moje wykłady, WSPiA bezpieczeństwo wewnętrzne, II ROK, IV semestr, finanse piubliczne
filozofia z logiką- praca zaliczeniowa, WSPiA bezpieczeństwo wewnętrzne, II ROK, III semestr, Filozo
więcej podobnych podstron