1
RJC
Addycje Elektrofilowe
Addycje Elektrofilowe
Addycje Elektrofilowe
Addycje Elektrofilowe
Slides 1 to 19
E
E
R
R
R
R
R
R
R
R
X
E
R
R
R
R
X
2
RJC
R
2
C=CR
2
+
E
X
R
2
C
E
CR
2
X
Addycje Elektrofilowe
Addycje Elektrofilowe
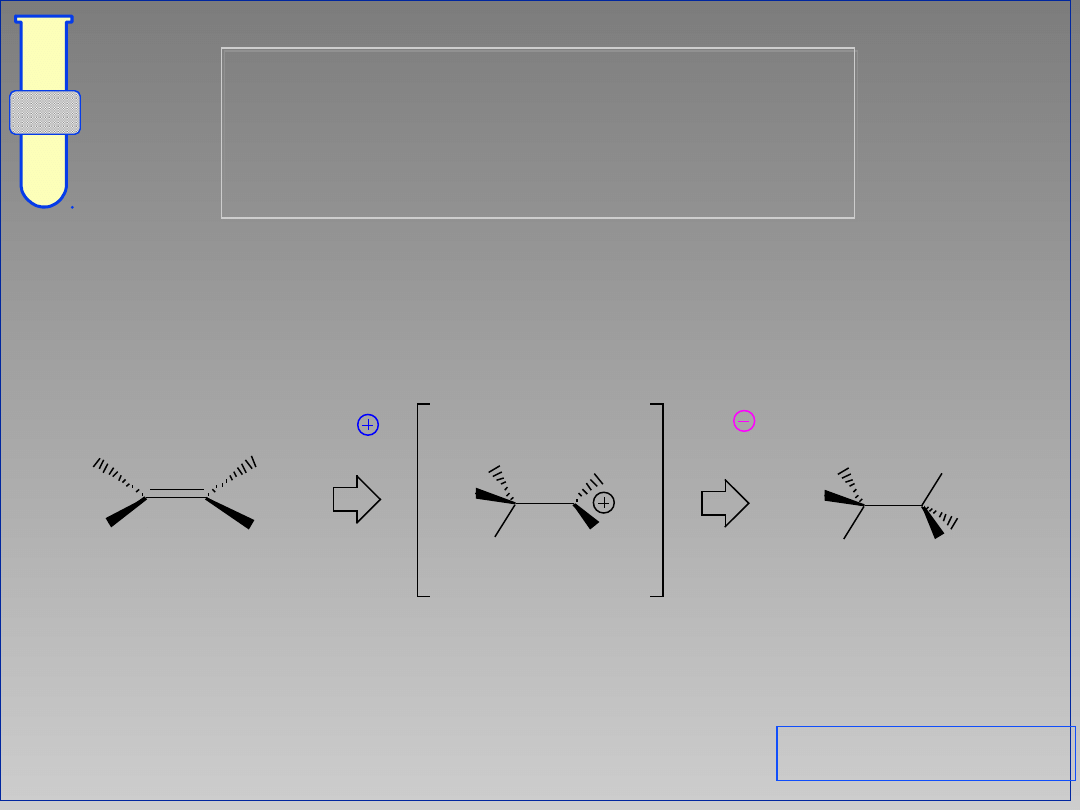
Mogą być rozpatrywane jako reakcje
Mogą być rozpatrywane jako reakcje
odwrotne do eliminacji E1.
odwrotne do eliminacji E1.
3
RJC
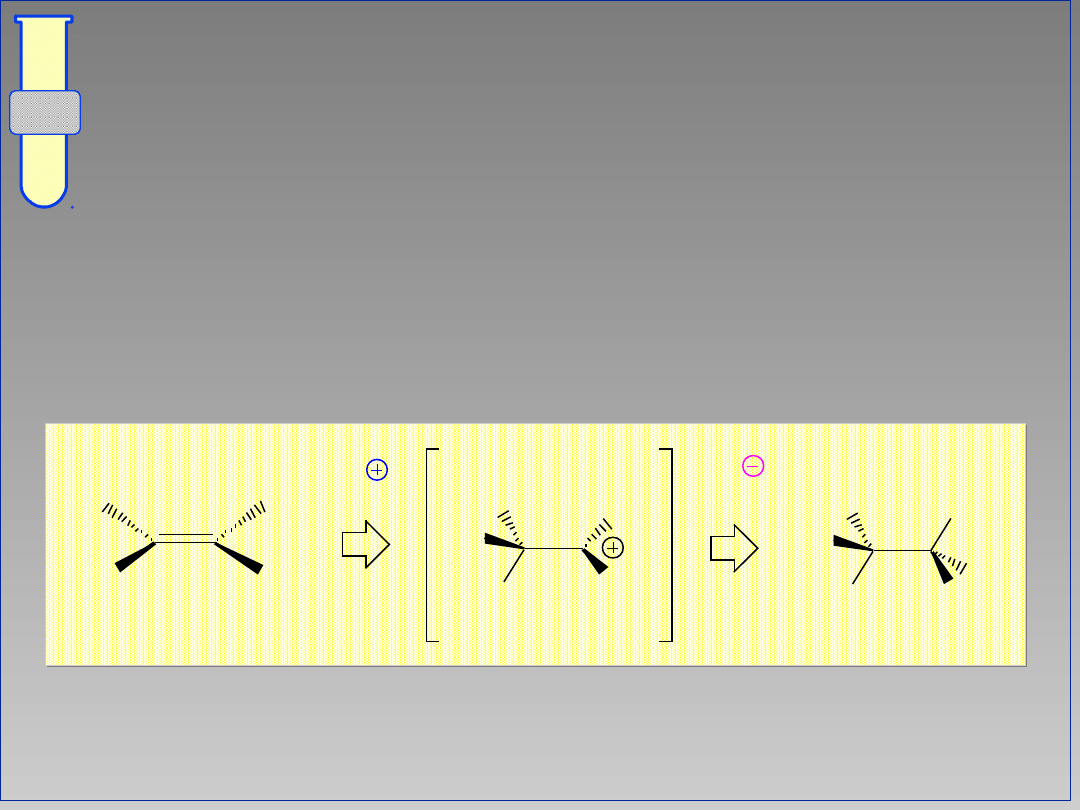
Mechanizm
Mechanizm
Elektrofil (E
Elektrofil (E
+
+
) przyłącza się do wiązania
) przyłącza się do wiązania
podwójnego, a nukleofil (X
podwójnego, a nukleofil (X
-
-
) neutralizuje
) neutralizuje
utworzony pośrednio karbokation.
utworzony pośrednio karbokation.
E
E
R
R
R
R
R
R
R
R
X
E
R
R
R
R
X
4
RJC
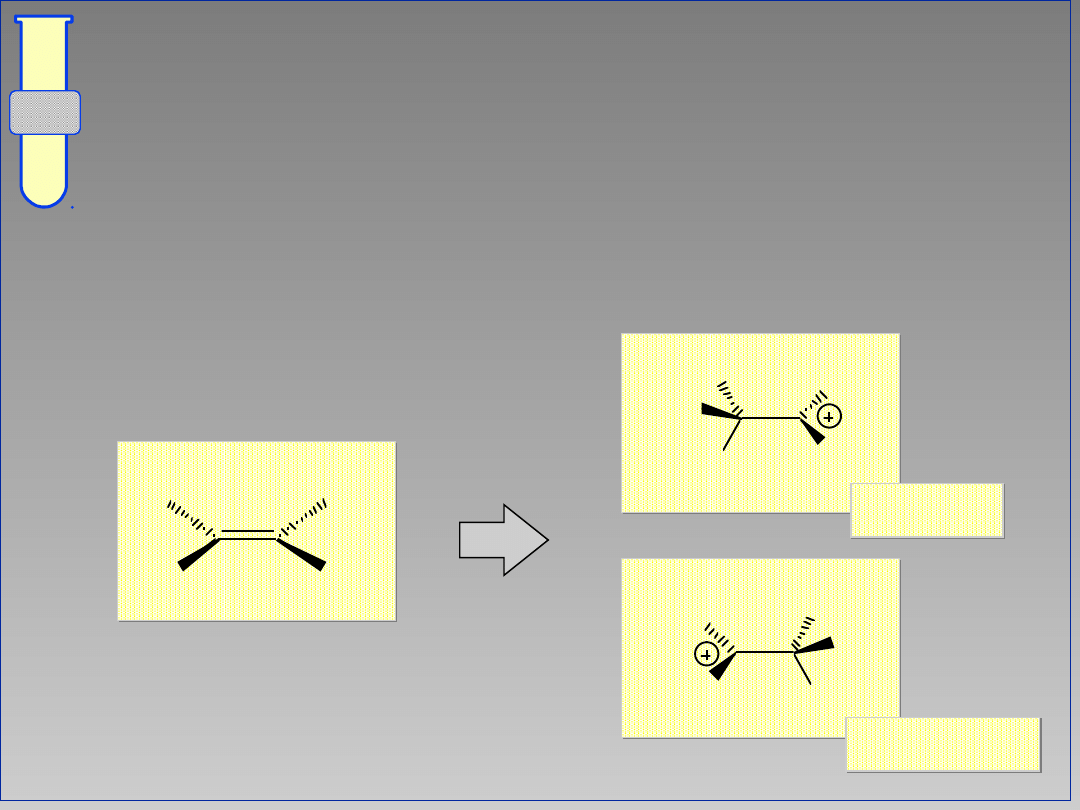
Regioselektywność
Regioselektywność
Jeżeli istnieje możliwość utworzenia
Jeżeli istnieje możliwość utworzenia
dwóch karbokationów, to preferowany
dwóch karbokationów, to preferowany
jest ten, który posiada więcej
jest ten, który posiada więcej
podstawników wokół centrum
podstawników wokół centrum
kationowego (bardziej podstawiony).
kationowego (bardziej podstawiony).
R
R
H
R
E
R
R
H
R
E
R
R
R
H
E
+
główny
główny
poboczny
poboczny

5
RJC
Reguła Markownikowa
Reguła Markownikowa
Obserwacja eksperymentalna...
Obserwacja eksperymentalna...
„.. w addycji odczynnika HX do alkenu,
H
+
przyłącza się do mniej
podstawionego atomu węgla (z
większą liczbą atomów H), a fragment
X
–
do bardziej podstawionego..."
6
RJC
Inaczej wyrażona regułą
Inaczej wyrażona regułą
Markownikowa...
Markownikowa...
Interpretacja oparta o teorię
Interpretacja oparta o teorię
mechanizmów ...
mechanizmów ...
"...Addycja HX do niesymetrycznego
wiązania C=C przebiega poprzez
karbokation o wyższej rzędowości..."
7
RJC
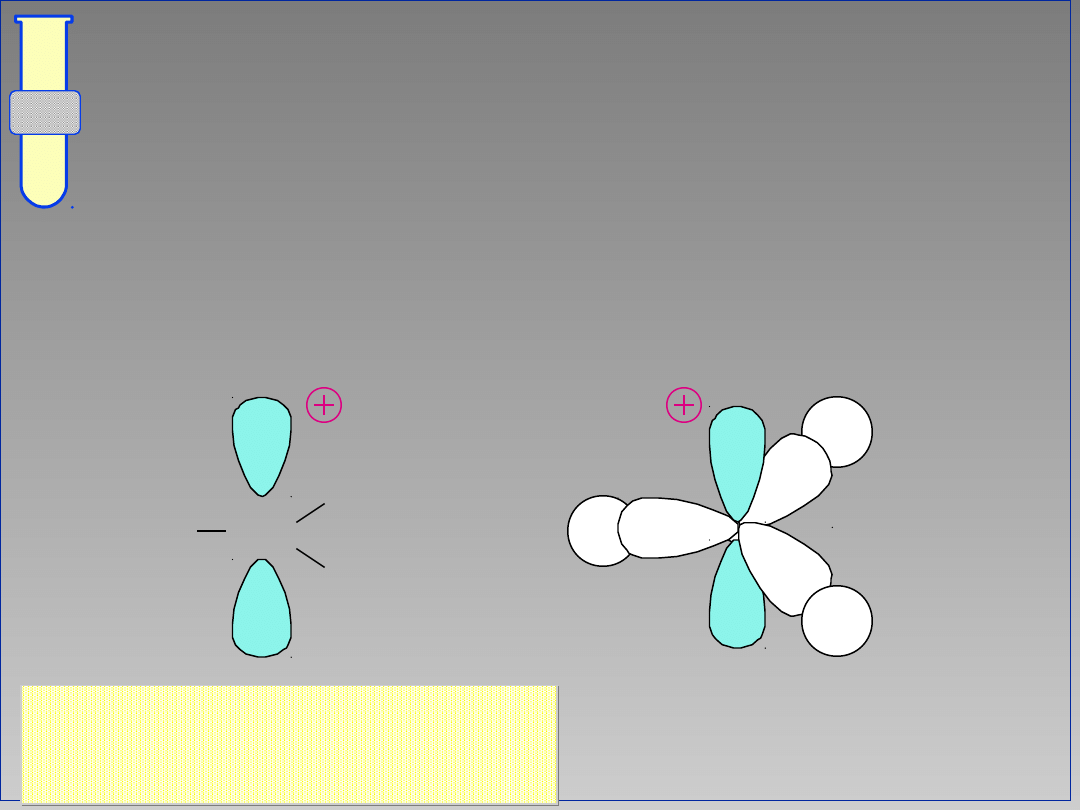
Karbokationy
Karbokationy
Tworzą płaską strukturę (planarną) z
Tworzą płaską strukturę (planarną) z
atomem węgla zhybrydyzowanym sp
atomem węgla zhybrydyzowanym sp
2
2
;
;
są stabilizowane poprzez efekt
są stabilizowane poprzez efekt
hiperkoniugacji oraz efekty indukcyjne.
hiperkoniugacji oraz efekty indukcyjne.
s
s
sp
sp
2
2
sp
sp
2
2
sp
sp
2
2
s
s
s
s
C
H
H
H
Struktura płaska,
trygonalna
Struktura płaska,
trygonalna
8
RJC
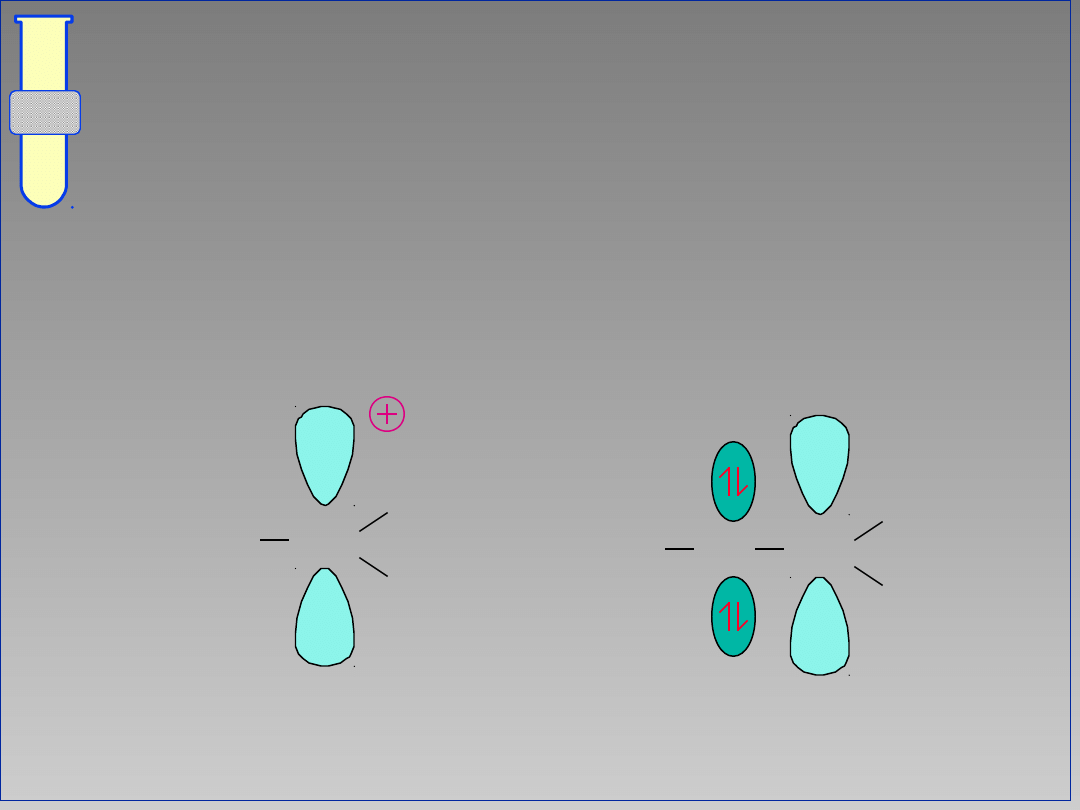
Hyperkoniugacja
Hyperkoniugacja
Elektrony wiążące ulokowane w pobliskich
Elektrony wiążące ulokowane w pobliskich
wiązaniach C-H, pomagają w stabilizacji
wiązaniach C-H, pomagają w stabilizacji
karbokationu.
karbokationu.
C
C
H
H
H
H
H
H
C
C
C
C
H
H
H
H
H
H
H
H
H
H
+
+
9
RJC
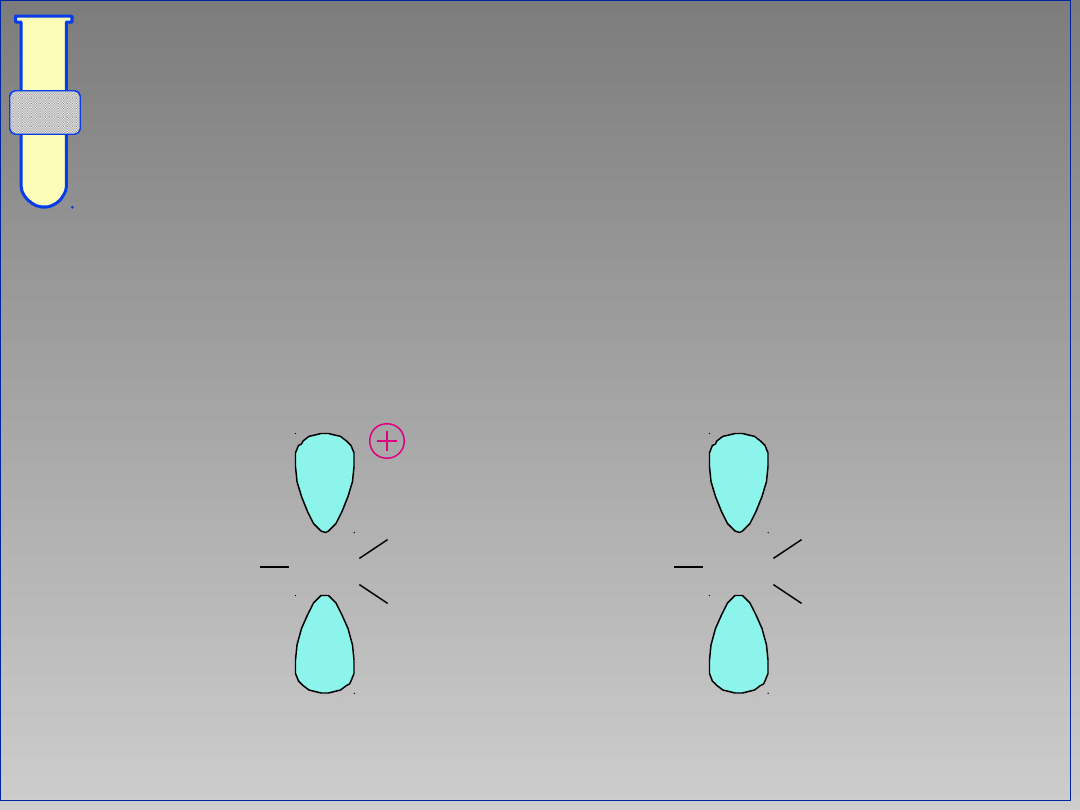
Efekty Indukcyjne
Efekty Indukcyjne
Grupy alkilowe R są bardziej
Grupy alkilowe R są bardziej
elektronodonorowe niż atomy H i
elektronodonorowe niż atomy H i
dlatego lepiejstabilizują karbokation .
dlatego lepiejstabilizują karbokation .
C
H
H
H
C
H
R
H
+
+
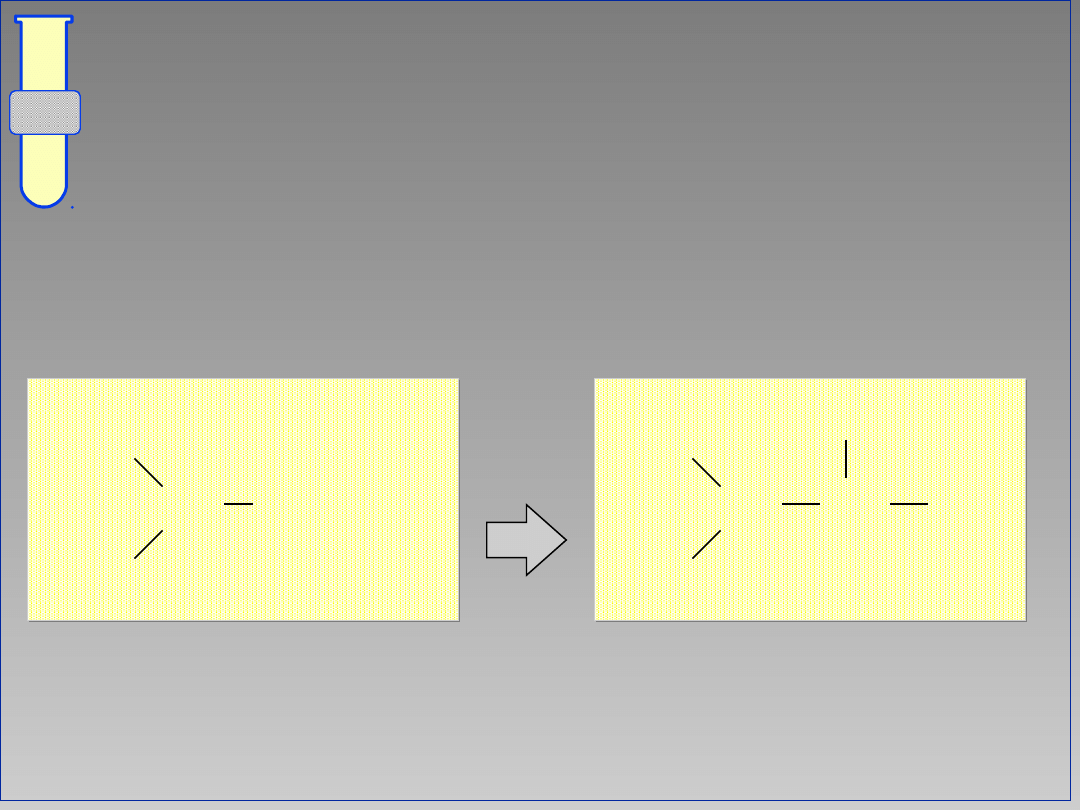
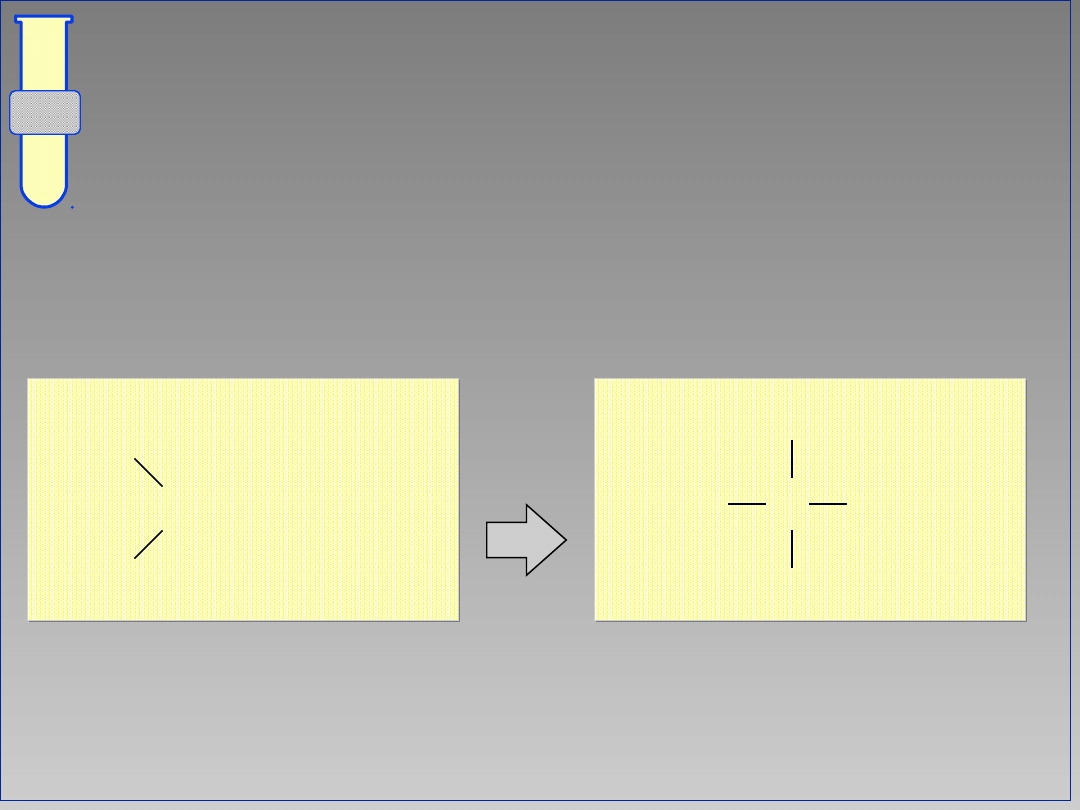
10
RJC
Na przykład ...
Na przykład ...
Ta reakcja przebiega poprzez pośredni
Ta reakcja przebiega poprzez pośredni
karbokation II-rzędowy.
karbokation II-rzędowy.
CH
CH
3
CH = C
H
2
CH
3
CH
CH
3
CH C
H
3
CH
3
Br
H
Br
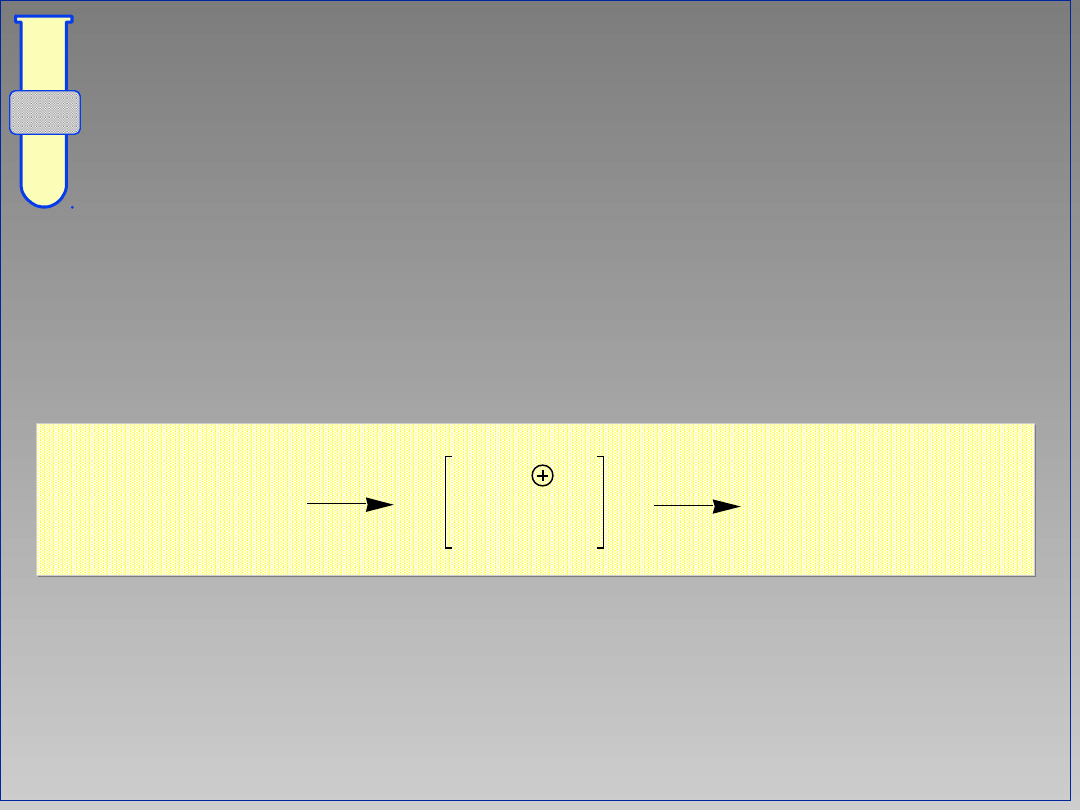
11
RJC
Na przykład ...
Na przykład ...
Ta reakcja przebiega poprzez
Ta reakcja przebiega poprzez
karbokation
karbokation
III-rzędowy.
III-rzędowy.
C = CHCH
3
CH
3
CH
3
C
C
H
2
CH
3
CH
3
CH
3
Br
H
Br
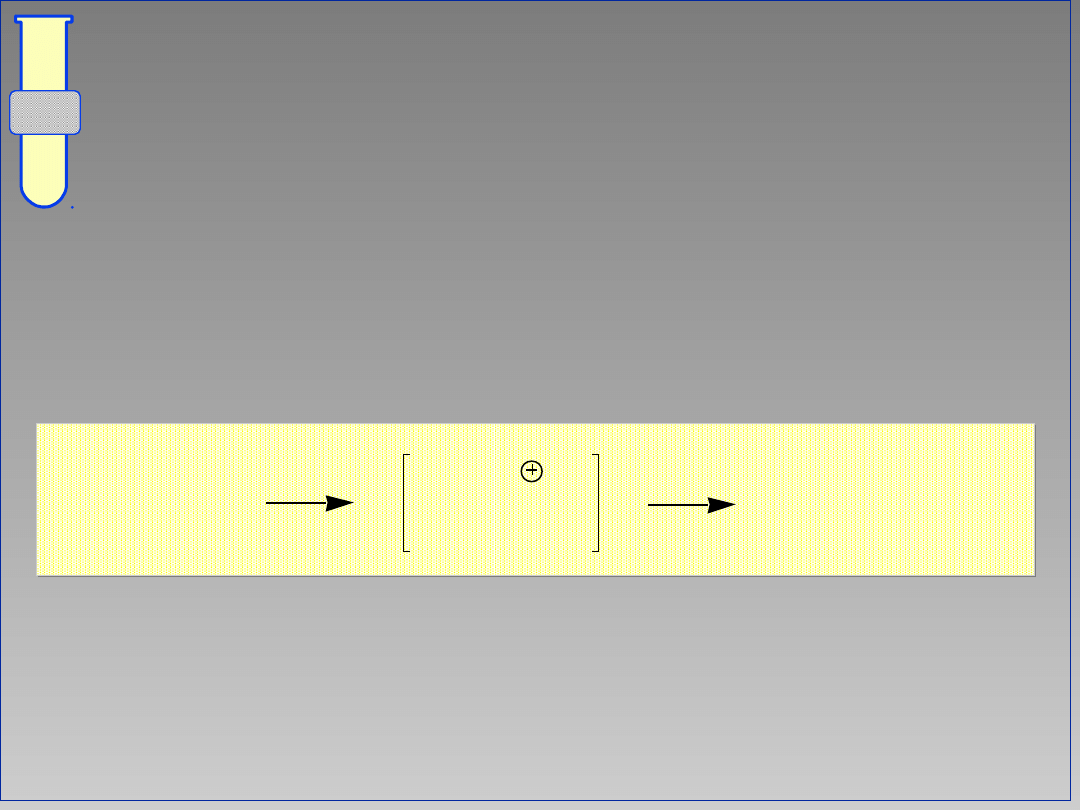
12
RJC
Elektrofilowa hydratacja
Elektrofilowa hydratacja
...
...
H
H
2
2
SO
SO
4
4
/H
/H
2
2
O
O
Odczynniki elektrofilowe nie są
Odczynniki elektrofilowe nie są
ograniczone do halogenowodorów HX.
ograniczone do halogenowodorów HX.
CH
2
=CH
2
C
H
3
CH
2
C
H
3
CH
2
OH
H
2
SO
4
/H
2
O
H
2
SO
4
/H
2
O
13
RJC
Elektrofil ...
Elektrofil ...
Cl
Cl
2
2
Heterolityczny rozpad cząsteczki Cl
Heterolityczny rozpad cząsteczki Cl
2
2
(ale
(ale
także innych halogenów) umożliwia tym
także innych halogenów) umożliwia tym
pierwiastkom wchodzenie w reakcję
pierwiastkom wchodzenie w reakcję
zarówno w roli elektrofila jak
zarówno w roli elektrofila jak
neutralizującego karbokation nukleofila.
neutralizującego karbokation nukleofila.
CH
2
=CH
2
Cl
CH
2
CH
2
Cl
CH
2
CH
2
Cl
Cl
2
14
RJC
Elektrofil...
Elektrofil...
Br
Br
2
2
Heterolityczny rozpad cząsteczki Cl
Heterolityczny rozpad cząsteczki Cl
2
2
(ale także innych halogenów) umożliwia
(ale także innych halogenów) umożliwia
tym pierwiastkom wchodzenie w
tym pierwiastkom wchodzenie w
reakcję zarówno w roli elektrofila jak
reakcję zarówno w roli elektrofila jak
neutralizującego karbokation nukleofila.
neutralizującego karbokation nukleofila.
CH
2
=CH
2
Br
CH
2
CH
2
Br
CH
2
CH
2
Br
Br
2
15
RJC
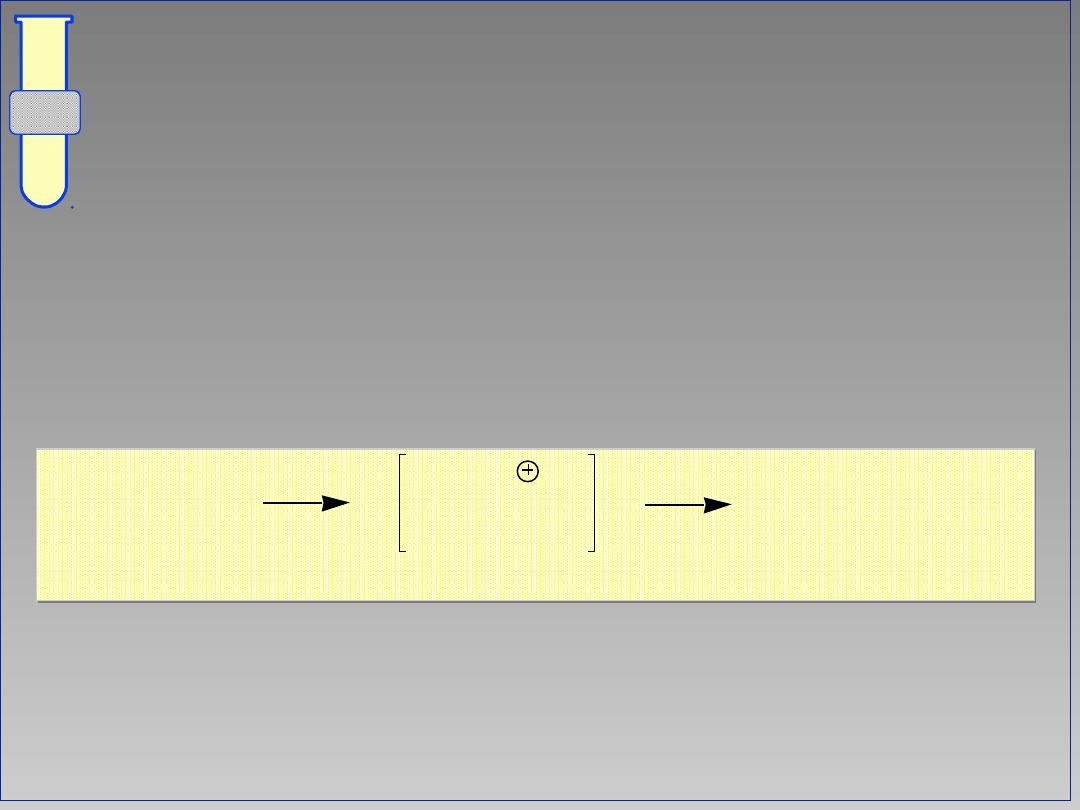
Cykloalkeny
Cykloalkeny
Addycja Br
Addycja Br
2
2
do cyclopentenu prowadzi
do cyclopentenu prowadzi
do powstawania
do powstawania
trans
trans
-1,2-
-1,2-
dibromocyclopentanu jao jedynego
dibromocyclopentanu jao jedynego
produktu.
produktu.
Br
2
trans-1,2-dibromocyklopentan
trans-1,2-dibromocyklopentan
cyklopenten
cyklopenten
Br
Br
16
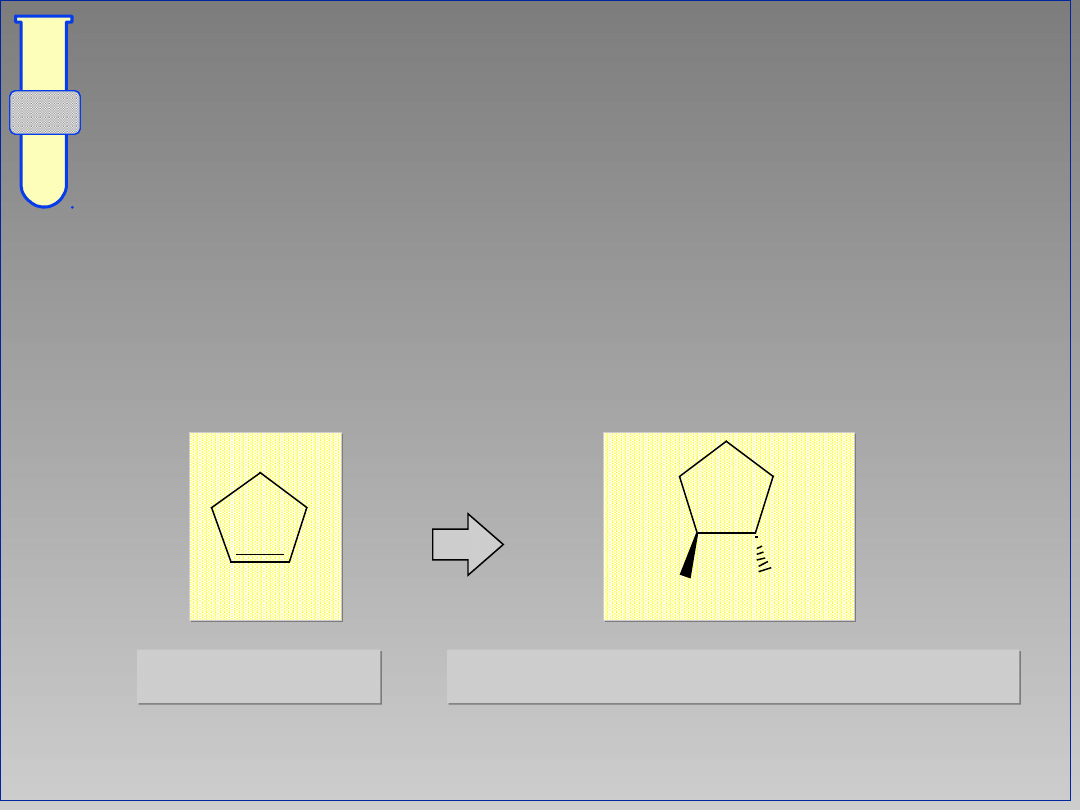
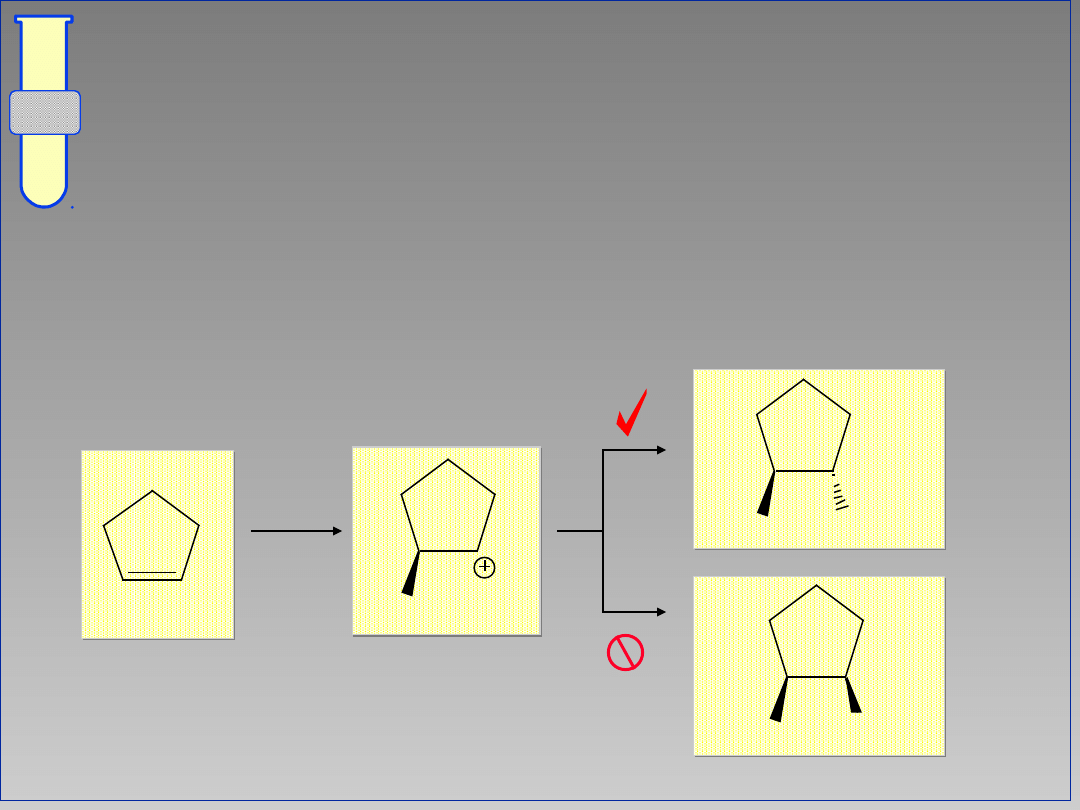
RJC
Możliwy Mechanizm
Możliwy Mechanizm
Jedna strona karbokationu jest bardziej
Jedna strona karbokationu jest bardziej
osłonięta, co wymusza stereoselektywną
osłonięta, co wymusza stereoselektywną
addycję nukleofila.
addycję nukleofila.
Br
2
Br
Br
Br
Br
Br
17
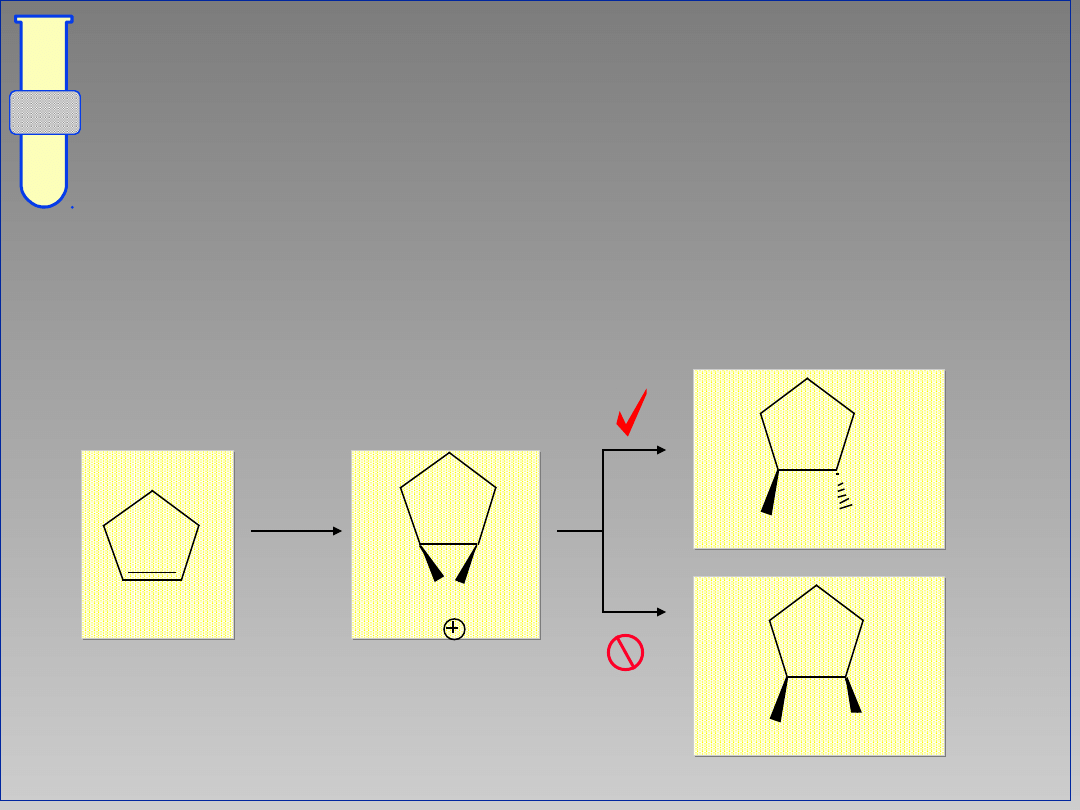
RJC
Lepszy, Alternatywny Mechanizm
Lepszy, Alternatywny Mechanizm
W cyklicznym kationie bromoniowym,
W cyklicznym kationie bromoniowym,
atom Br całkowicie osłania jedną stronę
atom Br całkowicie osłania jedną stronę
cząsteczki (związku przejściowego).
cząsteczki (związku przejściowego).
Br
2
Br
Br
Br
Br
Br
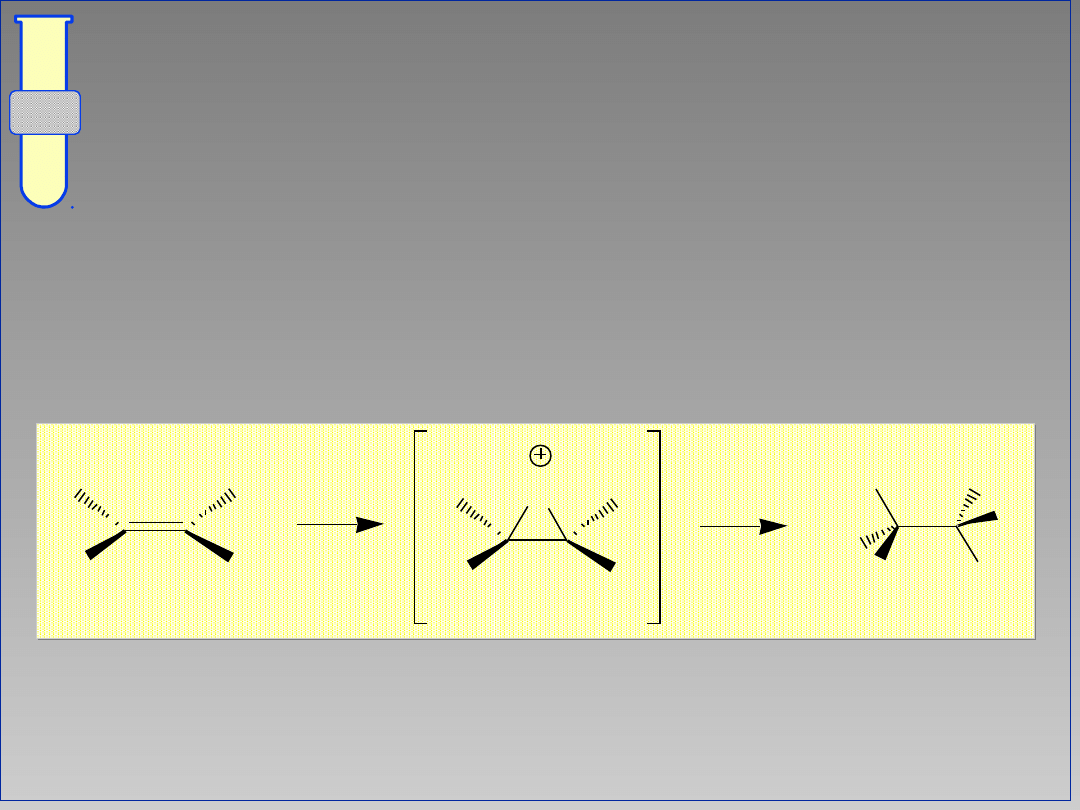
18
RJC
Halohydryny
Halohydryny
Neutralizacja pośredniego kationu
Neutralizacja pośredniego kationu
haloniowego cząsteczką wody prowadzi
haloniowego cząsteczką wody prowadzi
do powstania halohydryny.
do powstania halohydryny.
Br
OH
R
R
R
H
R
R
H
R
Br
2
R
R
H
R
Br
H
2
O

19
RJC
Podsumowania
Podsumowania
Elektrofilowa addycja do
alkenów
Regioselektywność
Reguła Markownikowa
Karbokationy
Hyperkoniugacja
Efekt indukcyjny
Cykloalkeny
Halohydryny
Elektrofilowa addycja do
alkenów
Regioselektywność
Reguła Markownikowa
Karbokationy
Hyperkoniugacja
Efekt indukcyjny
Cykloalkeny
Halohydryny
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
chorg w 10 addycje elektrofilowe
mechanizm reakcji addycji elektrofilowej ppt
Napęd Elektryczny wykład
Podstawy elektroniki i miernictwa2
elektryczna implementacja systemu binarnego
urządzenia elektrotermiczn
Podstawy elektroniki i energoelektroniki prezentacja ppt
Elektryczne pojazdy trakcyjne
elektrofizjologia serca
Ćwiczenia1 Elektroforeza
elektrolity 3
Urządzenia i instalacje elektryczne w przestrzeniach zagrożonych wybuchem
Elektroforeza DNA komórkowego BioAut1, BioAut2 i Ch1
Instalacje elektroenergetObl1
08 Elektrownie jądrowe obiegi
U 8 Zestyki w aparatach elektrycznych
więcej podobnych podstron