
Kataliza i katalizatory
podstawowe zagadnienia
Lucjan Chmielarz

Kataliza
„Chemistry without catalysis
would be like a sword without a
handle, a light without brilliance,
a bell without sound”
Alwin Mittasch

Kataliza
Jöns Jacob Berzelius
(1779-1843)
Jako pierwszy wprowadził pojęcie „kataliza”
(1836) - z języka greckiego κατάλυσις,
które oznacza rozłożenie lub rozprężenie.
Zjawisko to zostało wprowadzone w celu
określenia zjawisk zaobserwowanych przez
różnych badaczy w XIX wieku np.
przyspieszenie przemiany skrobi w glukozę
w obecności kwasów.

Kataliza
Wilhelm Friedrich Ostwald
(1853 – 1932)
„A catalyst is a substance that alters
the velocity of a chemical reaction
without appearing in the end
products of the reaction.”
„A catalyst is a substance that
changes the velocity of a reaction
without itself being changed by the
process.”

Kataliza to zjawisko polegające na zwiększeniu
szybkości reakcji chemicznej lub też skierowaniu jej
do wybranego produktu w obecności niewielkich
ilości substancji zwanej katalizatorem.

Właściwości katalizatorów
Aktywność – jak szybko będzie przebiegać reakcja
katalityczna;
Selektywność – jakie będą produkty reakcji katalitycznej;
Stabilność - czas efektywnej pracy, odporność na działanie
trucizn;
Wytrzymałość mechaniczna.

Właściwości katalizatorów
Aktywność – jak szybko będzie przebiegać reakcja
katalityczna;
Selektywność – jakie będą produkty reakcji katalitycznej;
Stabilność - czas efektywnej pracy, odporność na działanie
trucizn;
Wytrzymałość mechaniczna.
Kataliza przemysłowa
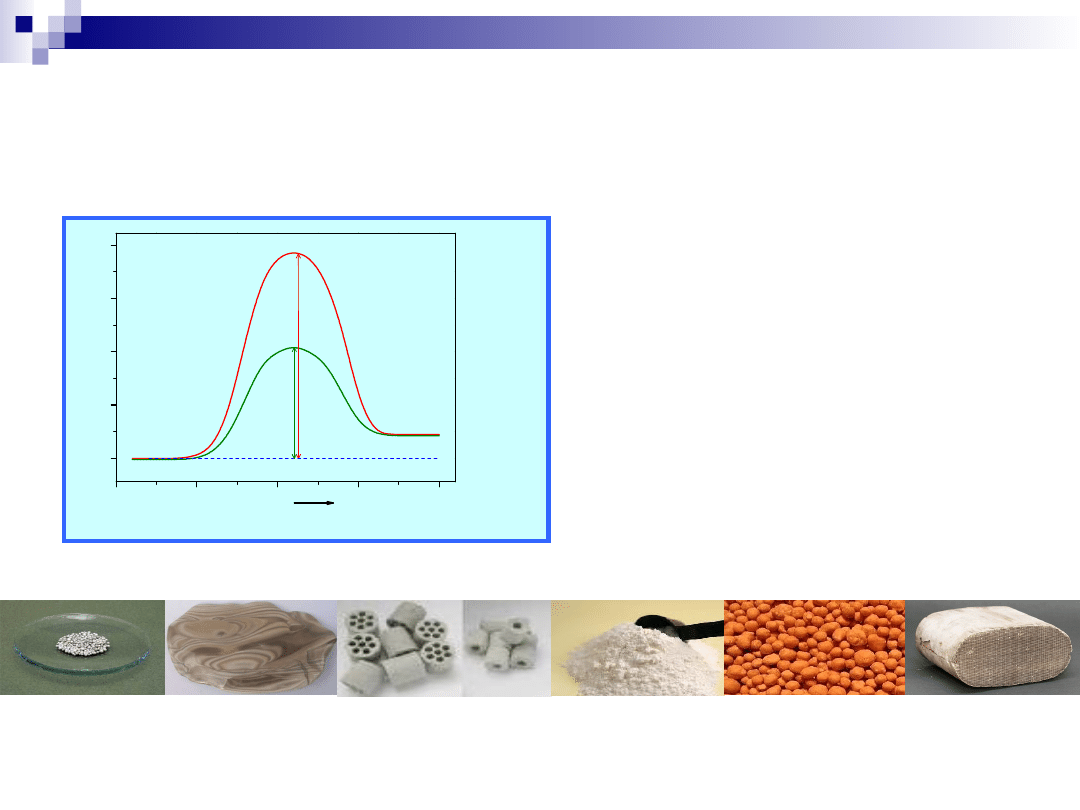
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
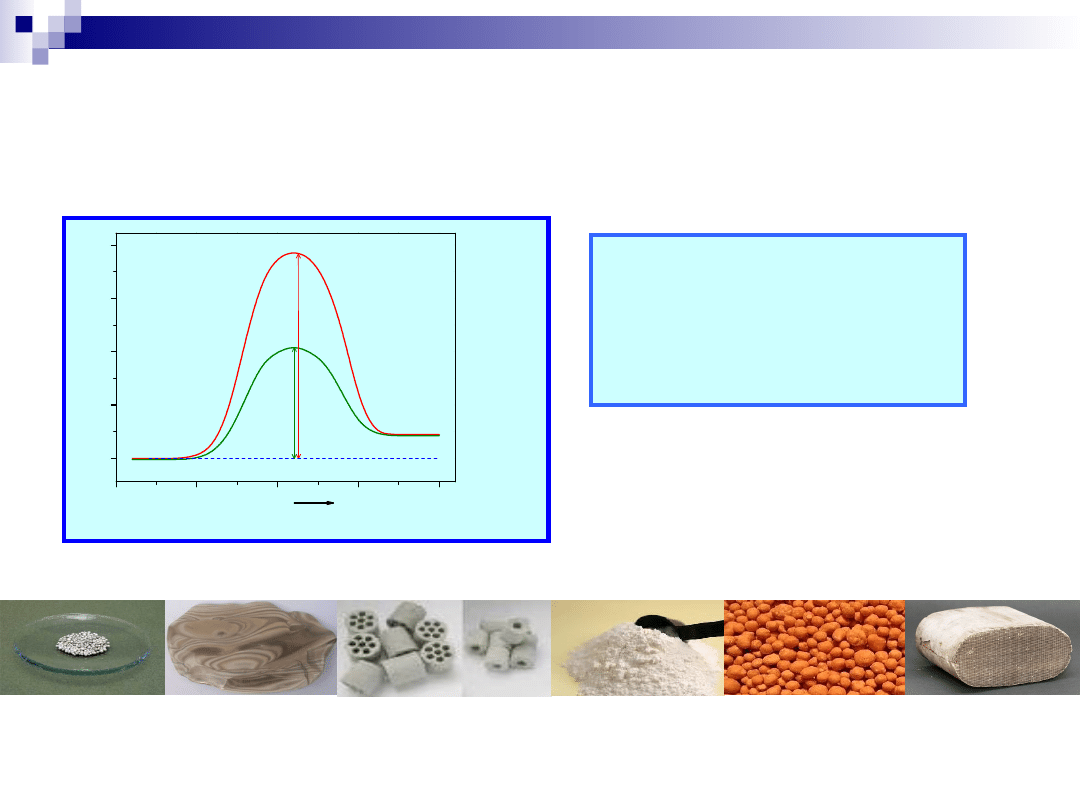
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
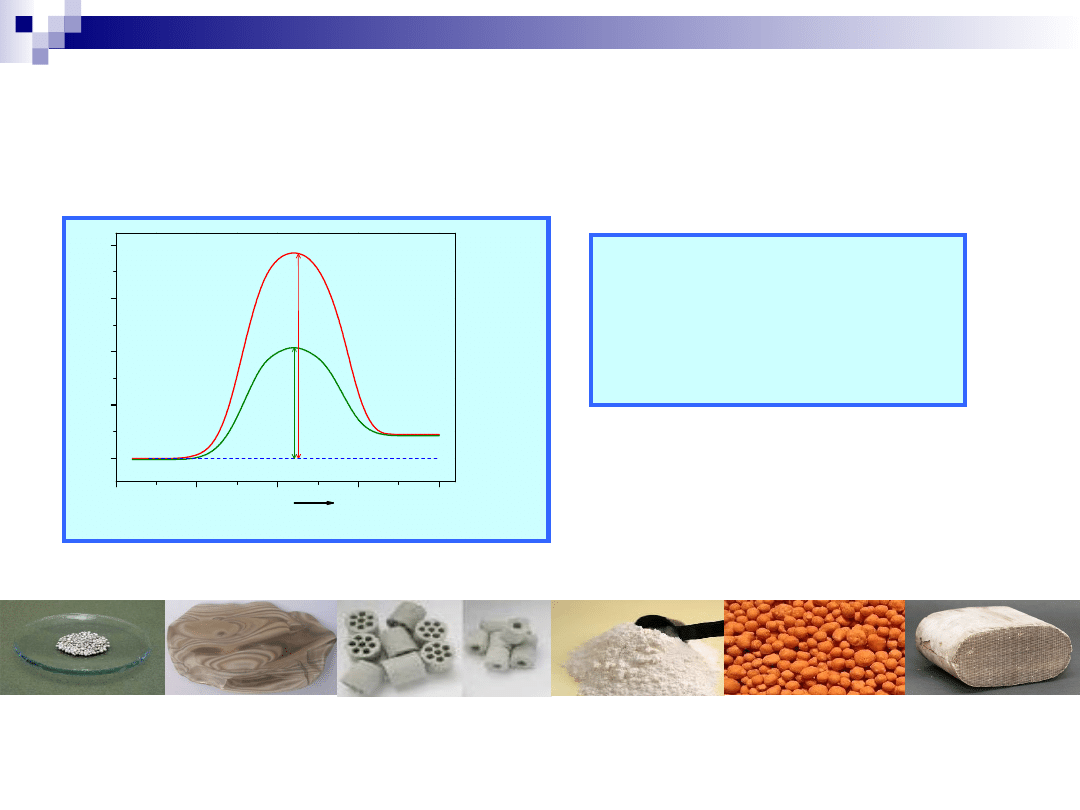
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
R
k
/R = 5.13* 10
12
(!!!)
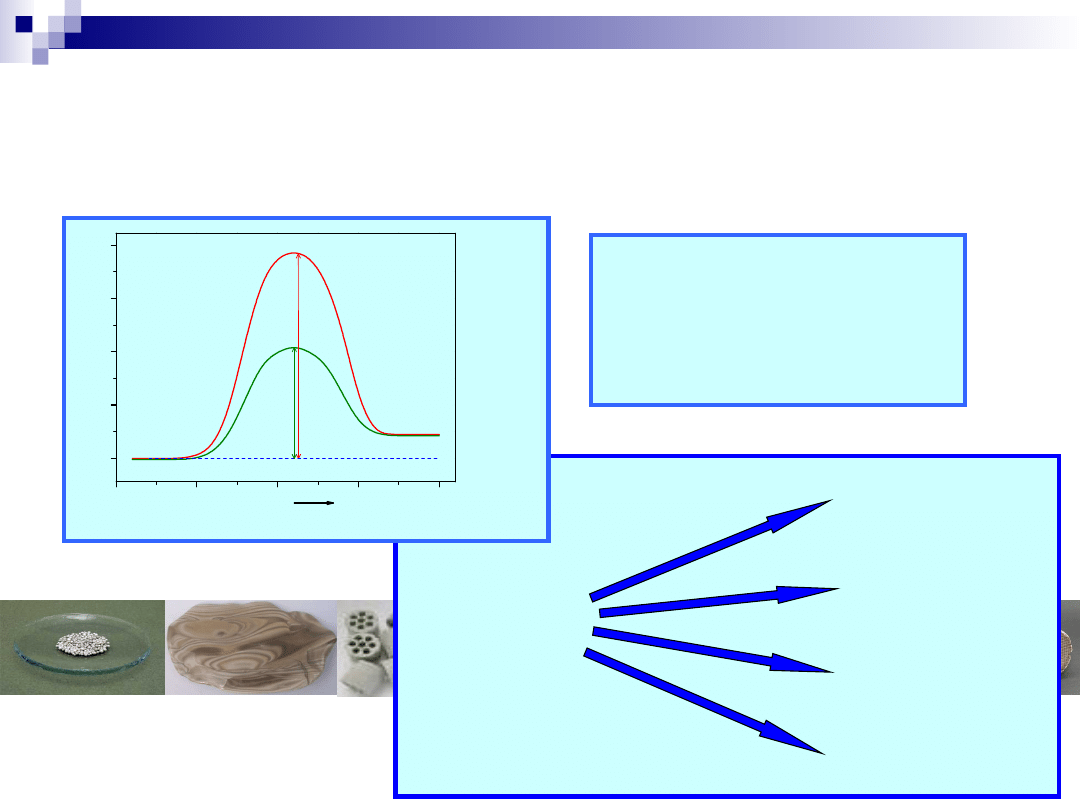
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
R
k
/R = 5.13* 10
12
(!!!)
N
2
NO
2
N
2
O
NO
+ H
2
O
N
2
NO
2
N
2
O
NO
+ H
2
O
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
R
k
/R = 5.13* 10
12
(!!!)
Katalizator: Pt-Rh
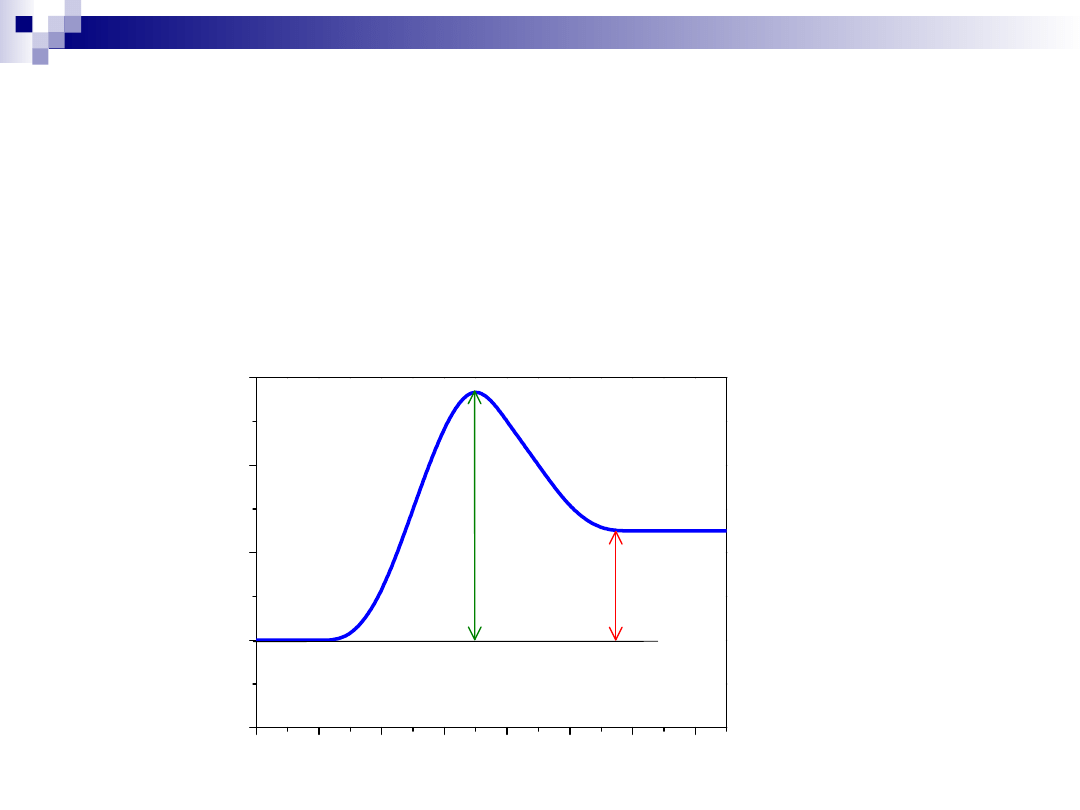
Uwaga !!!
Katalizator nie zmienia stanu równowagi termodynamicznej, ale
wpływa na szybkość z jaką układ osiąga stan równowagi
80
100
120
140
160
reakcji
prod
E
ne
rg
ia
[k
J/
m
o
l]
sub
E
a
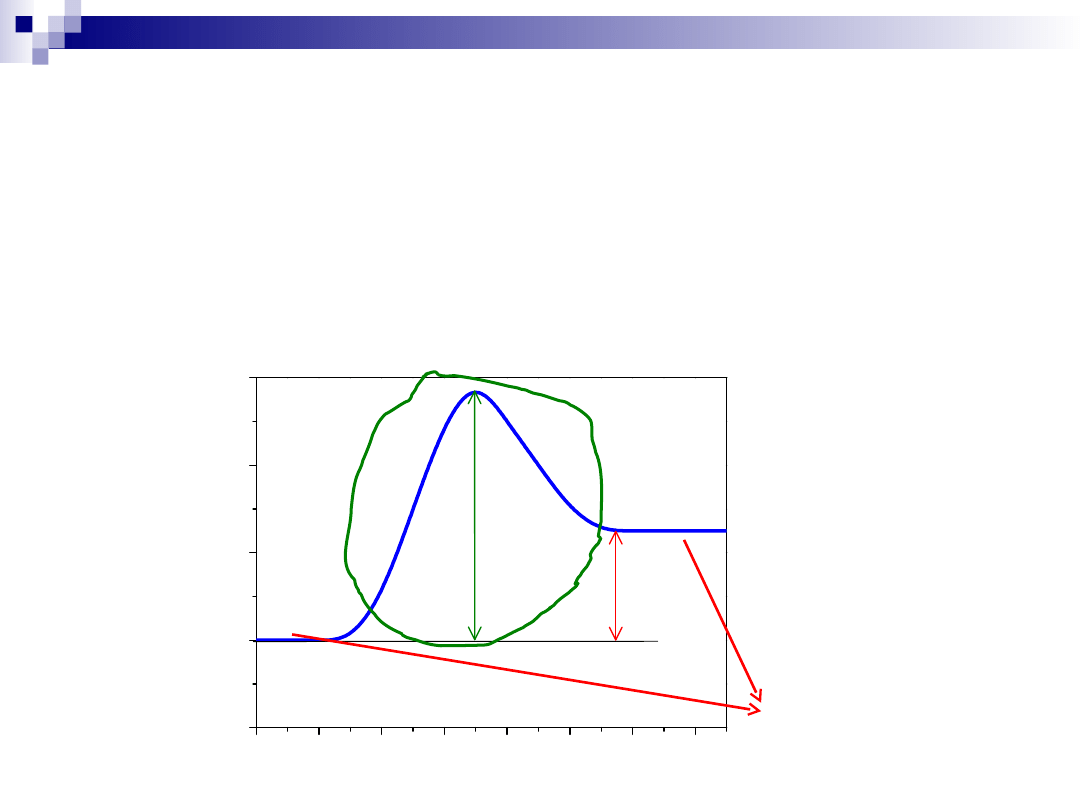
Uwaga !!!
Katalizator nie zmienia stanu równowagi termodynamicznej, ale
wpływa na szybkość z jaką układ osiąga stan równowagi
80
100
120
140
160
reakcji
prod
E
ne
rg
ia
[k
J/
m
o
l]
sub
E
a
Kinetyka (tu objawia się działanie katalizatora)
Termodynamika
(na to katalizator nie ma wpływu)

Aktywność katalizatora:
a
kat
= r
kat
– r
Miarą aktywności jest zwykle konwersja (stopień
przereagowania):
- konwersja ułamkowa (0÷1):
- konwersja procentowa (0-100%):
Selektywność:
%
100
c
c
S
n
1
i
i
j
j
0
0
c
c
c
%
100
c
c
c
0
0

Kataliza homogeniczna
Katalizator i reagenty znajdują się w tej samej
fazie
:
- gaz-gaz,
- ciecz-ciecz,
- ciało stałe-ciało stałe.
Przykład:
2SO
2
+ O
2
2SO
3
katalizator:
NO
(gaz-gaz)
Problem: musimy rozdzielić po reakcji katalizator i
produkty (nieprzereagowane substraty) – to jest
dodatkowy koszt.

Kataliza heterogeniczna
Katalizator
i
reagenty
znajdują się w odrębnych fazach:
-
gaz
-
ciecz
,
-
gaz
-
ciało stałe
,
-
ciecz
-
gaz
,
-
ciecz
-
ciało stałe
,
-
ciało stałe
-
gaz,
(kataliza kontaktowa)
-
ciało stałe
-
ciecz,
Przykład:
4NH
3
+ 5O
2
4NO + 6H
2
O
katalizator:
Pt-Rh
(kataliza
kontaktowa)
Zaleta nie ma problemu z oddzieleniem katalizatora i produktów reakcji
(nieprzereagowanych substratów).

Katalizatory nośnikowe
Faza aktywna:
Metale; tlenki, siarczki metali
Nośnik:
SiO
2
(np. mezoporowata krzemionka)
Al
2
O
3
(-, -)
TiO
2
ZrO
2
MgO
ZnO
Zeolity
etc.
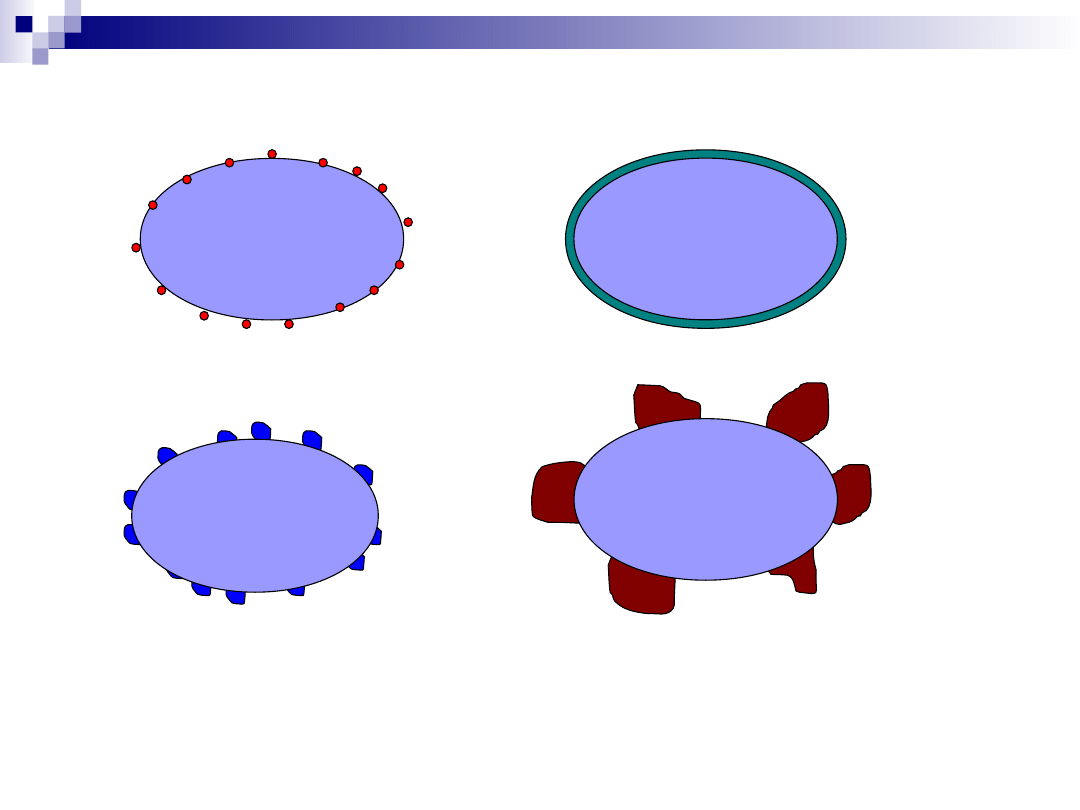
Katalizatory nośnikowe - faza aktywna
izolowane jony lub atomy
warstwa (monowarstwa)
klastery metalu, tlenku metalu
dwie fazy w kontakcie

Formy katalizatorów kontaktowych
Granulki
Kształtki
Monolity
Siatki

Proces katalityczny – kataliza
kontaktowa
Dyfuzja substratów z głębi fazy gazowej do powierzchni
katalizatora;
Dyfuzja substratów przez system kanałów w katalizatorze;
Chemisorpcja substratu (substratów) na centrum
aktywnym;
Reakcja powierzchniowa;
Desorpcja produktu reakcji powierzchniowej;
Dyfuzja produktów przez system kanałów w katalizatorze;
Dyfuzja produktów z powierzchni katalizatora do głębi fazy
gazowej.
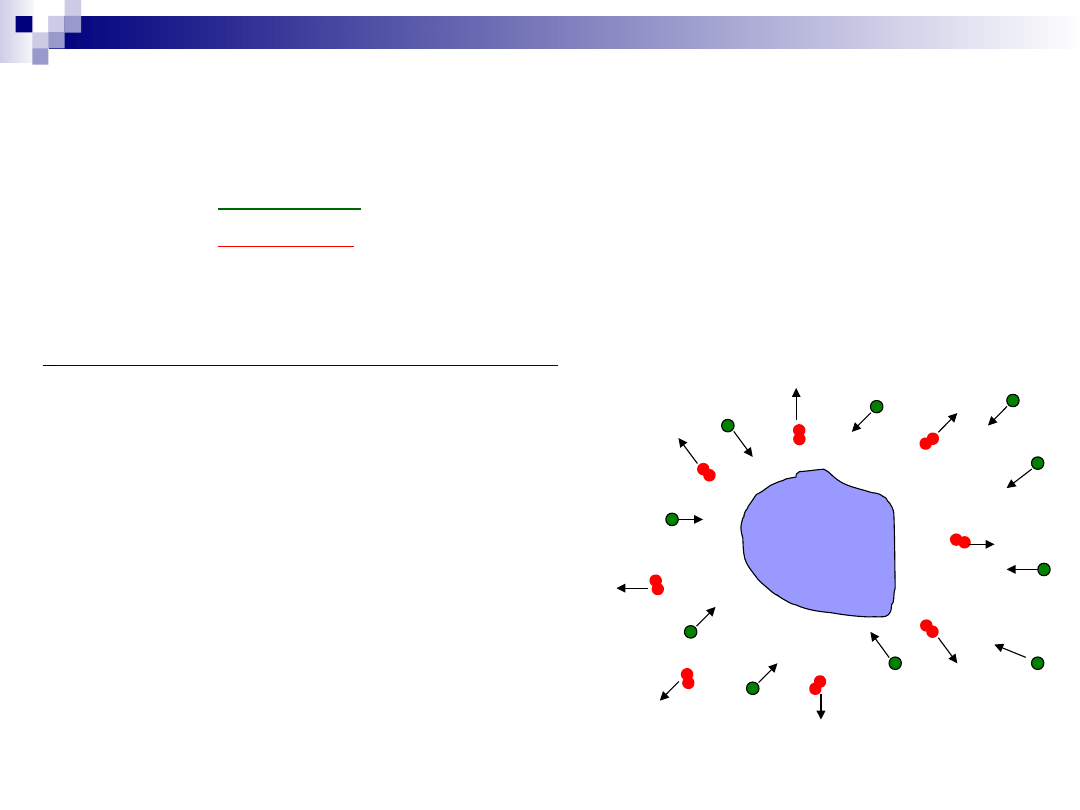
Proces katalityczny – dyfuzja
zewnętrzna
Dyfuzja
substratów
z głębi fazy gazowej do powierzchni katalizatora;
Dyfuzja
produktów
od powierzchni katalizatora do głębi fazy gazowej.
I
prawo Ficka (dla przestrzeni jednowymiarowej):
J = -D δφ/δx
gdzie:
J - strumieniem składnika (masa molowa
składnika przepływająca przez jednostkowy przekrój w
jednostce czasu)
D – współczynnik dyfuzji
φ – stężenie substancji dyfundującej
x - odległość od źródła dyfundującej substancji
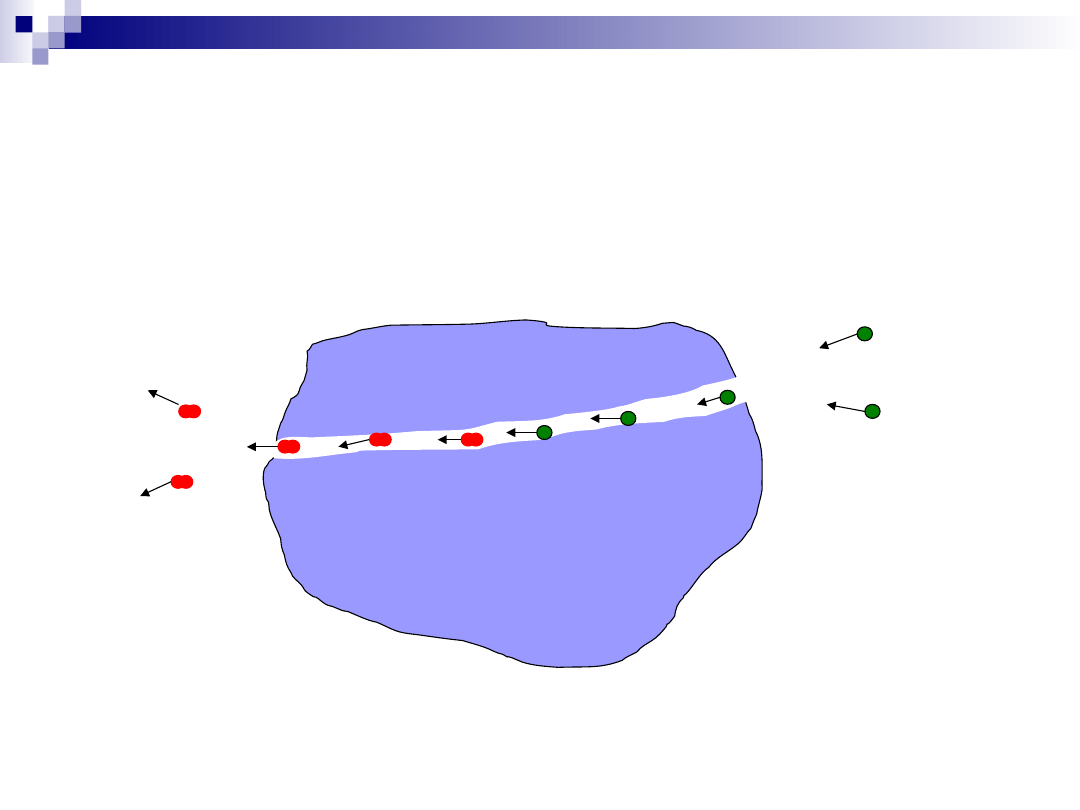
Proces katalityczny – dyfuzja
wewnętrzna
Dyfuzja substratów przez system kanałów w katalizatorze;
Dyfuzja produktów przez system kanałów w katalizatorze;
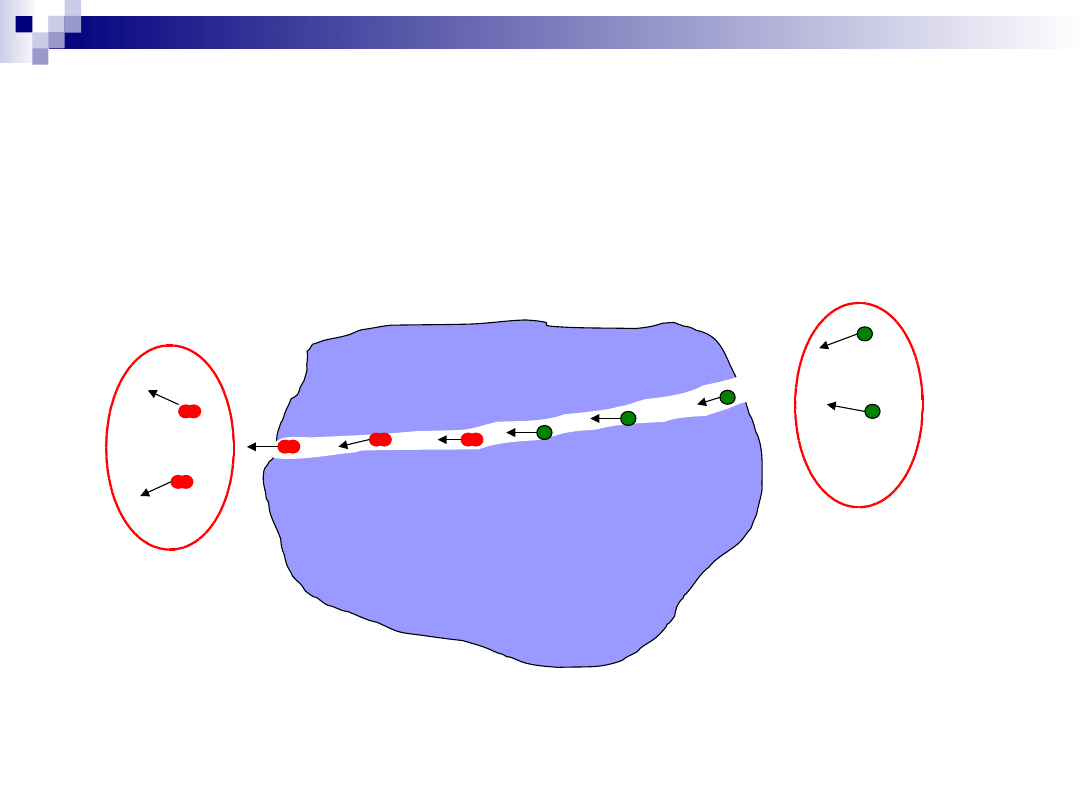
Proces katalityczny – dyfuzja
wewnętrzna
Dyfuzja substratów przez system kanałów w katalizatorze;
Dyfuzja produktów przez system kanałów w katalizatorze;
Dyfuzja zewnętrzna
Dyfuzja zewnętrzna
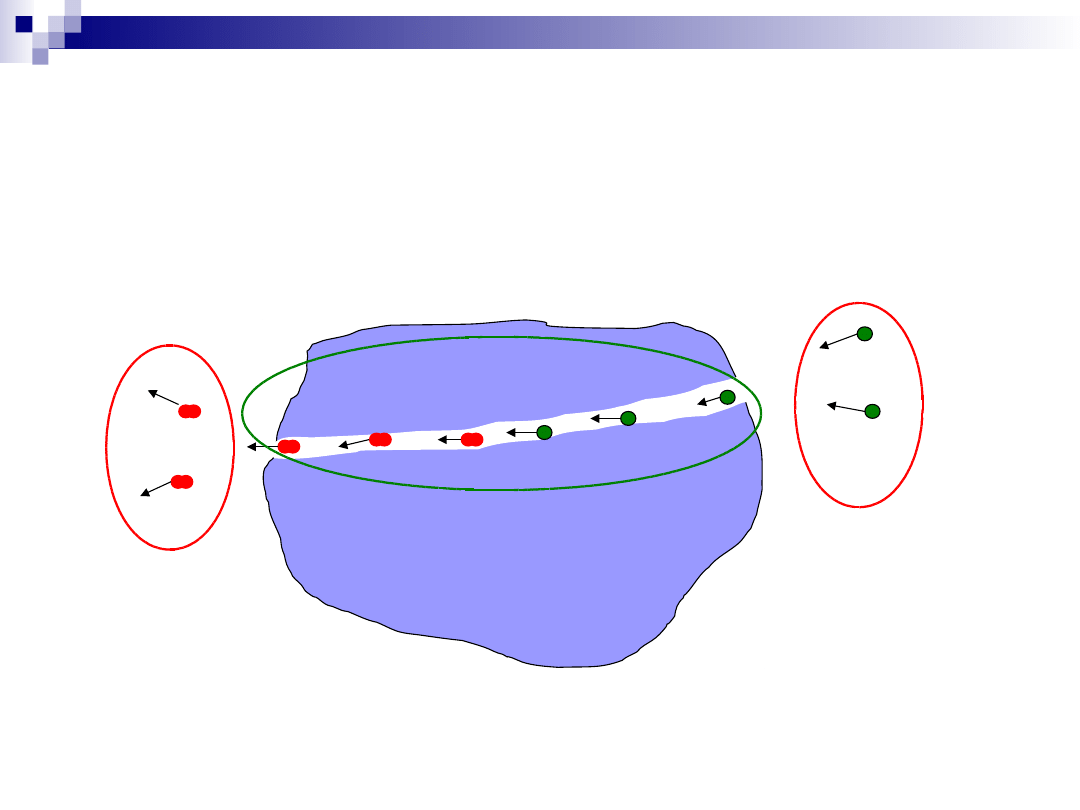
Proces katalityczny – dyfuzja
wewnętrzna
Dyfuzja substratów przez system kanałów w katalizatorze;
Dyfuzja produktów przez system kanałów w katalizatorze;
Dyfuzja zewnętrzna
Dyfuzja zewnętrzna
Dyfuzja wewnętrzna
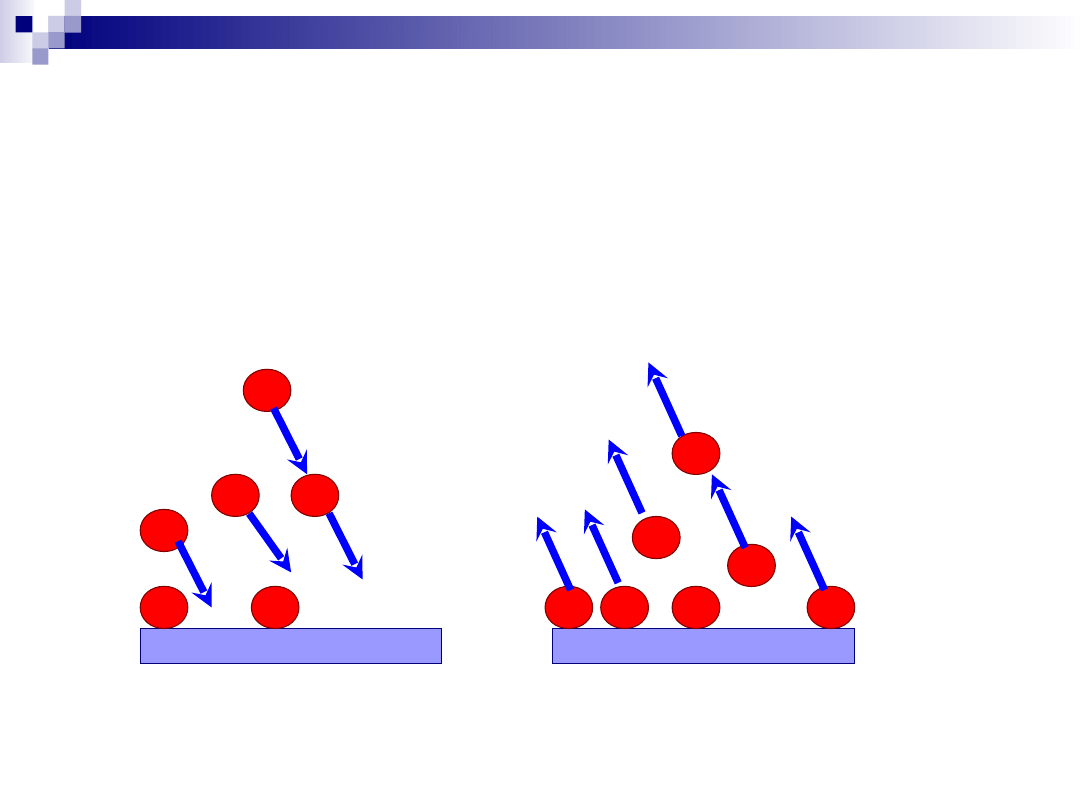
Proces katalityczny – adsorpcja i desorpcja
Adsorpcja
Desorpcja
Chemisorpcja substratu (substratów) na centrum aktywnym;
Desorpcja produktu reakcji powierzchniowej.
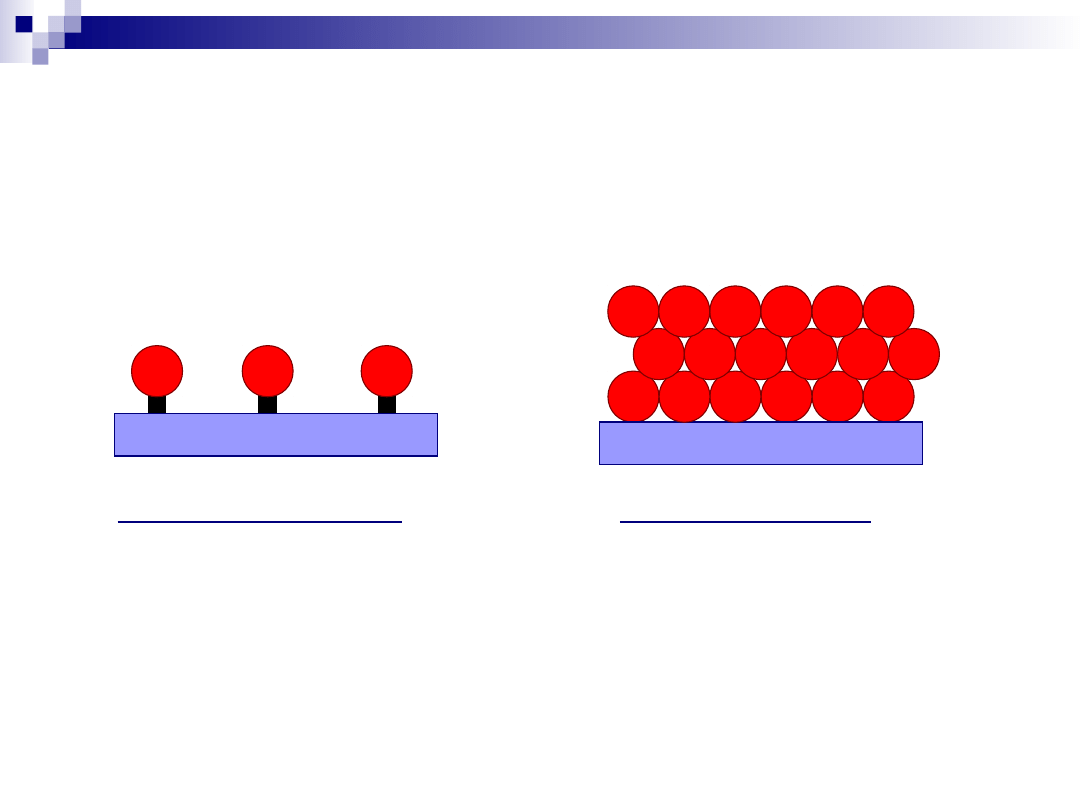
Adsorpcja fizyczna – adsorpcja chemiczna
Adsorpcja chemiczna –
wiązanie chemiczne pomiędzy
reagentem a katalizatorem
Adsorpcja fizyczna –
cząsteczki reagentów wiążą się
z katalizatorem
za pomocą sił Van der Wallsa
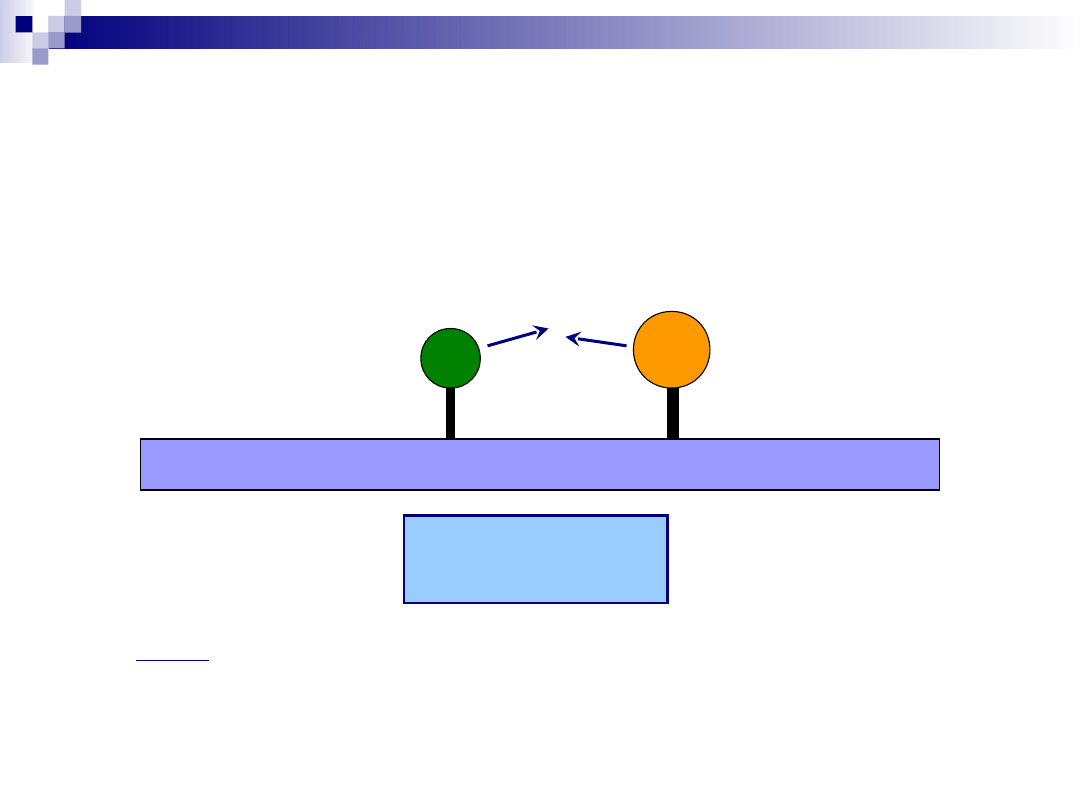
Proces katalityczny – reakcja
powierzchniowa
Mechanizm Langmuira-Hinshelwooda
r = kθ
A
θ
B
gdzie:
r – szybkość reakcji powierzchniowej
k – stała szybkości reakcji powierzchniowej
θ
A
i θ
B
– stopnie pokrycia centów aktywnych substratami A i B
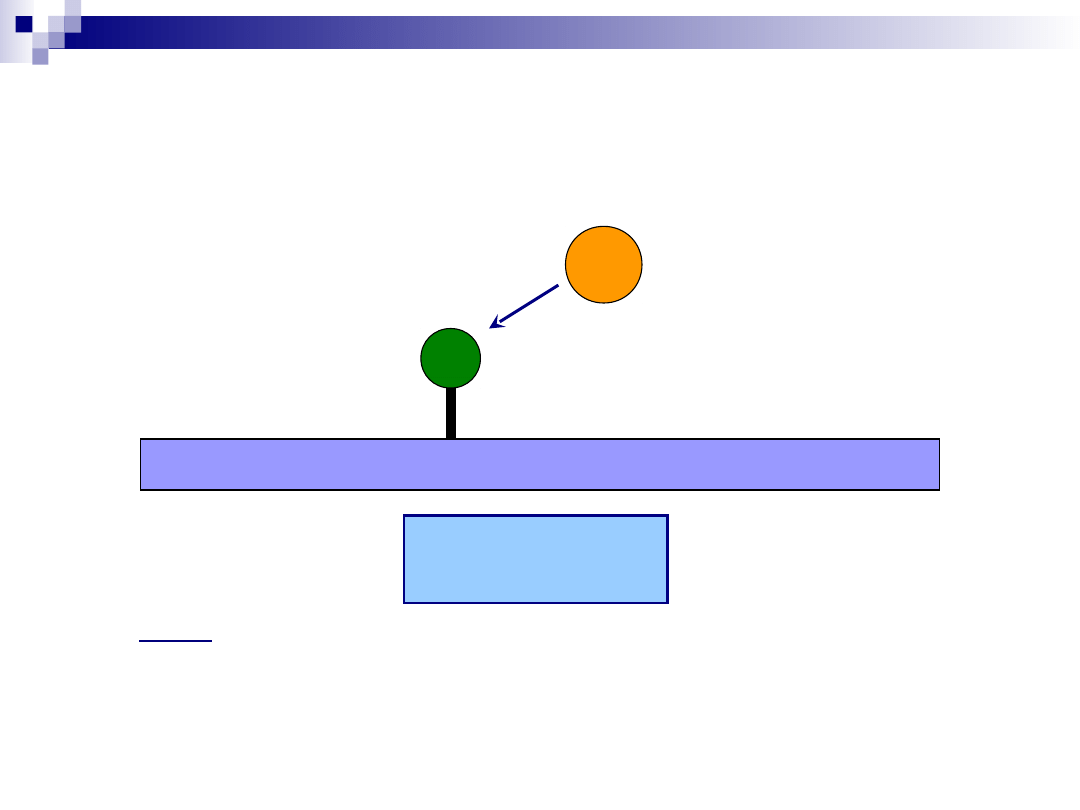
Proces katalityczny – reakcja
powierzchniowa
Mechanizm Eleya- Riedela
r = kθ
A
p
B
gdzie:
r – szybkość reakcji powierzchniowej
k – stała szybkości reakcji powierzchniowej
θ
A
– stopień pokrycia centów aktywnych substratem A
p
A
– ciśnienie parcjalne reagenta B w fazie gazowej

Ponad 90% linii technologicznych
wykorzystuje w co najmniej jednym
węźle
produkcyjnym
procesy
katalityczne
.
Wśród nich dominują procesy katalizy
heterogenicznej.

Jakie własności powinien posiadać katalizator
przemysłowy
?
1.
Wysoka aktywność;
2.
Jak najwyższa selektywność do oczekiwanego produktu
reakcji;
3.
Duża stabilność i możliwość regeneracji katalizatora;
4.
Odporność na działanie trucizn;
5.
Powtarzalna i jak najtańsza preparatyka;
6.
Możliwość utylizacji zużytego katalizatora.

Ponad 90% linii technologicznych
wykorzystuje w co najmniej jednym
węźle
produkcyjnym
procesy
katalityczne.
Wśród nich dominują procesy katalizy heterogenicznej.

Stabilność katalizatora:
Jak szybko następuje dezaktywacja katalizatora?
-
kilka minut ÷ kilka lat
Dlaczego następuje dezaktywacja katalizatora?
- zatruwanie;
- spiekanie;
- reakcje pomiędzy składnikami katalizatora;
- sublimacja jednego lub kilku składników katalizatora;
- mechaniczne zniszczenie katalizatora;
- etc.
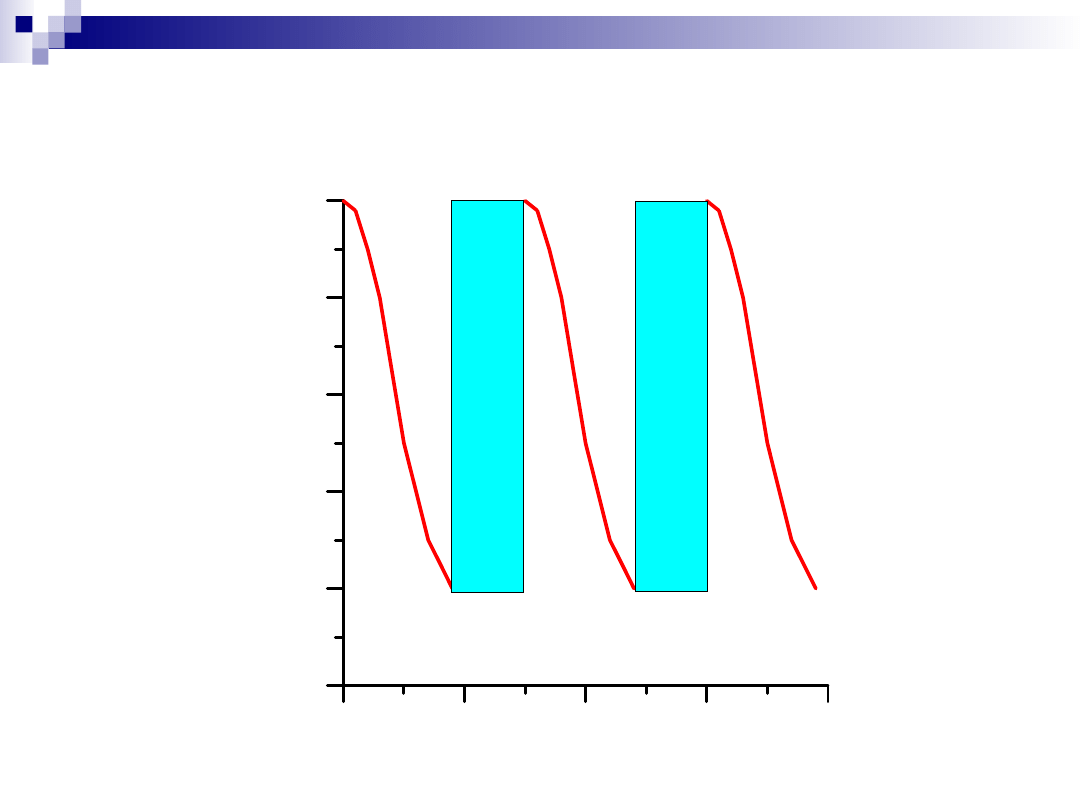
Regeneracja katalizatora
C z a s
0
2 0
4 0
6 0
8 0
1 0 0
Ko
nw
er
sj
a
[%
]
R
eg
an
er
ac
ja
Re
ge
ne
ra
cj
a
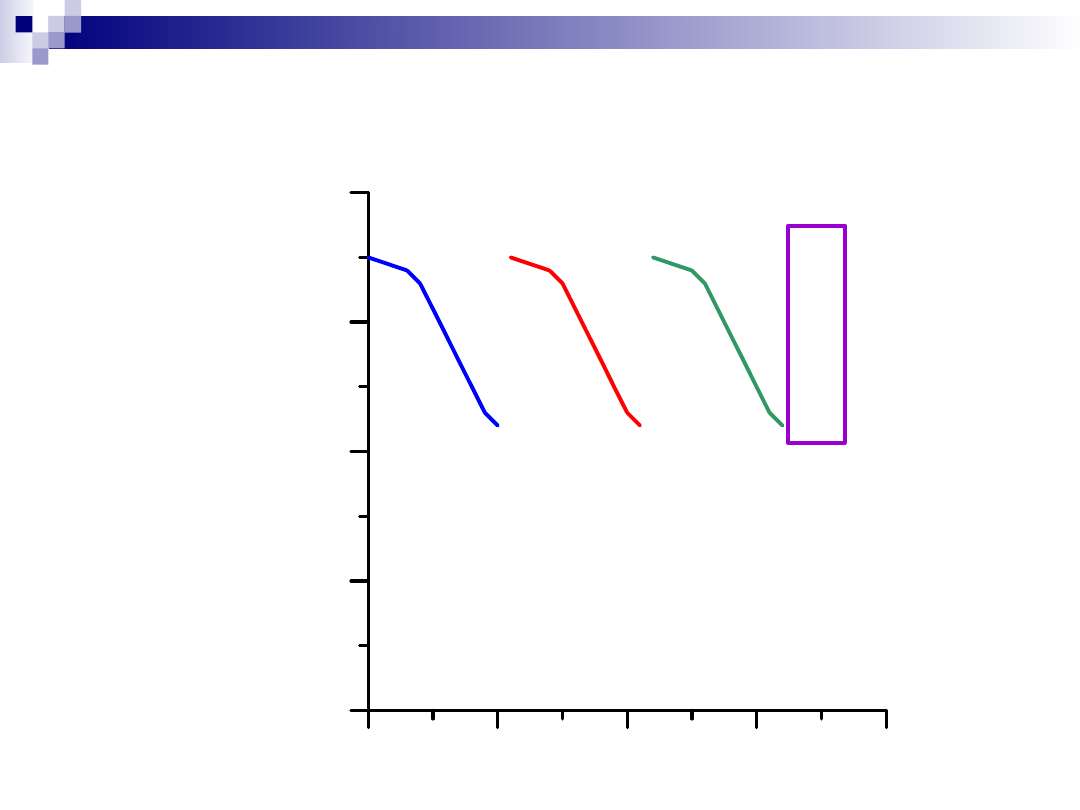
Wzrost temperatury procesu
C z a s
6 0
7 0
8 0
9 0
1 0 0
Ko
nw
er
sj
a
[%
]
4 4 0 ° C
4 6 0 ° C
4 8 5 ° C
w
ym
ia
na
k
at
al
iz
at
or
a
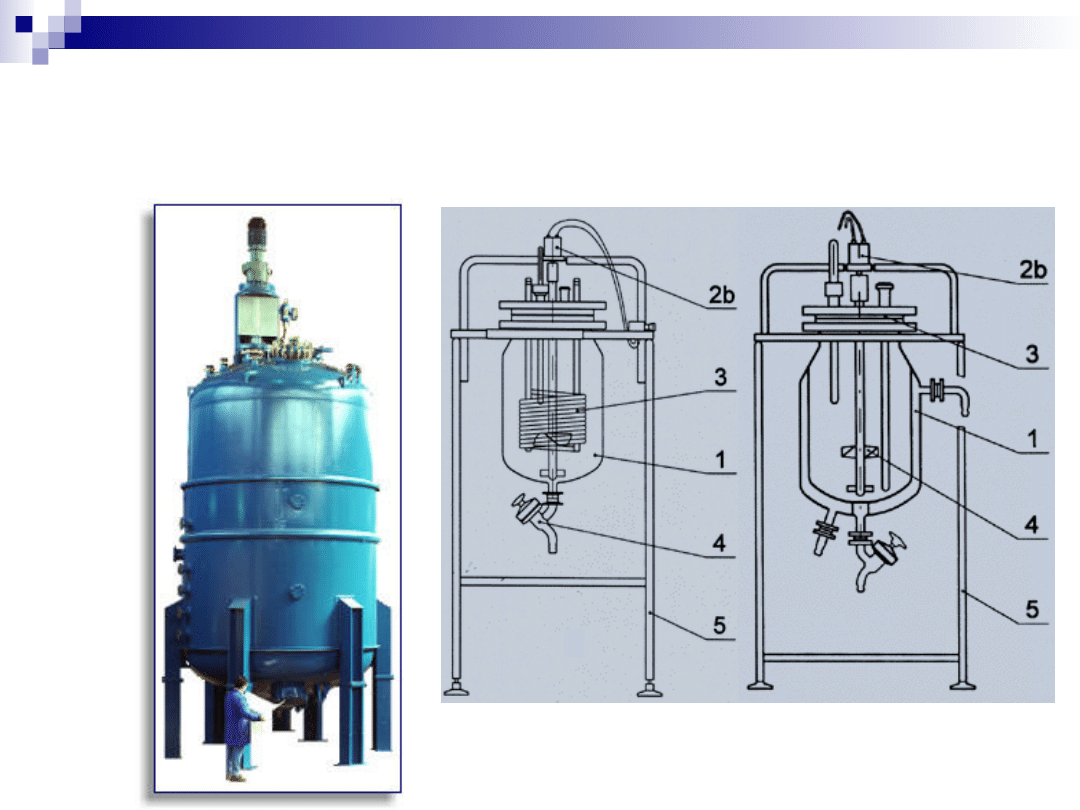
Katalityczne reaktory przemysłowe
Reaktory okresowe
(periodyczne):

Reaktory przepływowe (praca ciągła):
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
Wyszukiwarka
Podobne podstrony:
Synteza katalizatorów podstawy
Podstawy Chemii Fizycznej KATALIZA
Seminarium IIIR do kopiowania
Podstawowe zasady udzielania pomocy przedlekarskiej rany i krwotoki
Farmakologia pokazy, Podstawy Farmakologii Ogólnej (W1)
Podstawy fizyczne
CZLOWIEK I CHOROBA – PODSTAWOWE REAKCJE NA
Podstawy elektroniki i miernictwa2
podstawy konkurencyjnosci
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
PODSTAWOWE ZABIEGI RESUSCYTACYJNE (BLS) U DZIECI
01 E CELE PODSTAWYid 3061 ppt
Epidemiologia jako nauka podstawowe założenia
PODSTAWY STEROWANIA SILNIKIEM INDUKCYJNYM
06 Podstawy syntezy polimerówid 6357 ppt
4 socjalizacja jako podstawowy proces spoeczny
Podstawy MN 2007
więcej podobnych podstron