
Metody izolacji leukocytów
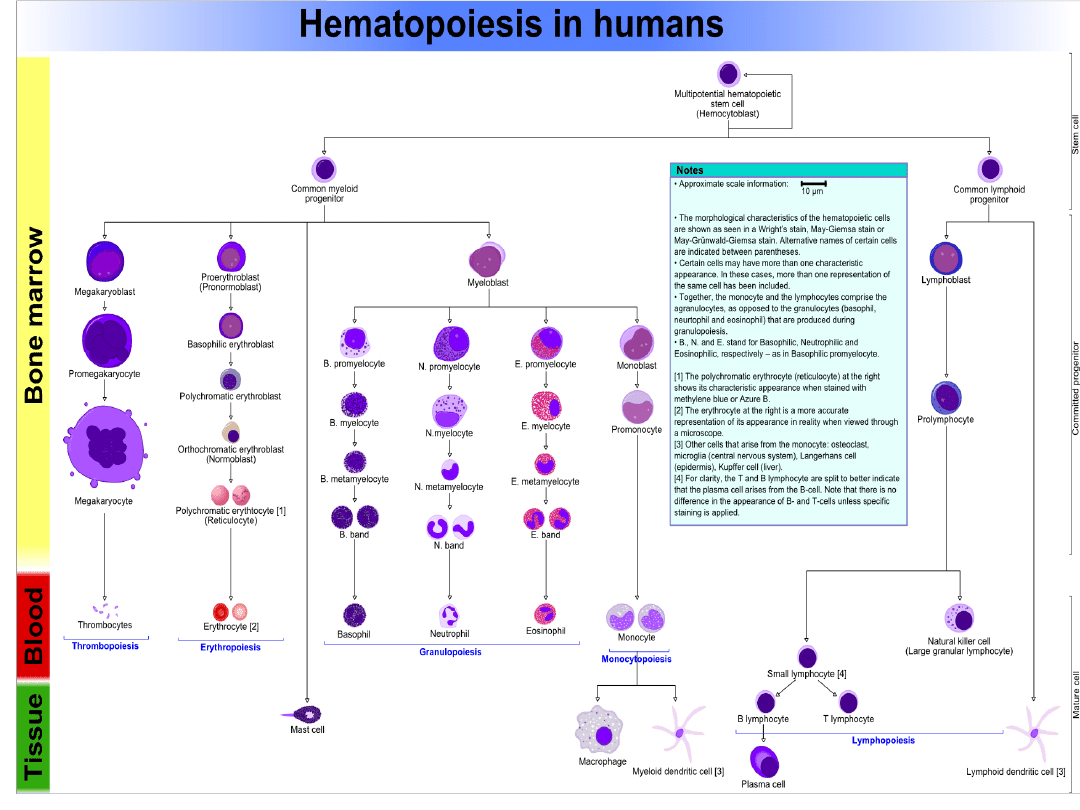

Źródłem komórek immunologicznie kompetentnych do badań w tym oceny
ich aktywności może być krew obwodowa, centralne (grasica, szpik) i
obwodowe (śledziona, węzły chłonne) narządy limfatyczne lub popłuczyny z
dróg oddechowych.
• W przypadku krwi by zahamować procesy krzepnięcia stosuje się między
innymi: heparynę (20 IU/ml krwi), cytrynian sodu (3,8-5%), wersenian sodu
(4 mM) lub kulki szklane (przy mieszaniu włóknik osadza się na kulkach).
Krew z antykoagulantem lub odwłóknioną, można następnie poddać dalszej
analizie.
• Narządy limfatyczne pobrane od zwierząt odpłukuję się w PBS od resztek
krwi, rozdrabnia i przeciska przez sito nylonowe (25-50 m) lub wyczesuje
się igłami preparacyjnymi, uwalniając komórki immunokompetentne.
• Komórki szpiku kostnego można uzyskać poprzez wymywanie roztworem soli
fizjologicznej wnętrza, odciętej z obu stron, kości udowej za pomocą
strzykawki z igłą. Uzyskuje się w ten sposób zawiesinę komórek o różnym
stopniu dojrzałości i kompetencji immunologicznej.
• Materiał z dróg oddechowych można uzyskać na drodze płukania
oskrzelowo-pęcherzykowego (bronchoalveolar lavage - BAL) roztworem soli
fizjologicznej, przeprowadzanym podczas standardowej bronchoskopii.
Uzyskane komórki zawiesza się w pełnym, standardowym płynie
hodowlanym.
Sedymentacja
• Sedymentacja spontaniczna - najprostsza metoda (1-2
godzin w 37
0
C).
• Sedymentacja indukowana - poprzez dodatek substancji o
dużej lepkości (roztwory dekstranu wielkocząsteczkowego,
0,1-1,5% metylceluloza, 3% żelatyna, 1,2% alkohol
poliwinylowy). Opłaszczone erytrocyty szybciej
sedymentują, a lżejsze leukocyty można wykryć w
supernatancie. W celu uzyskania określonych populacji
leukocytów przeprowadza się kolejne etapy izolacji.
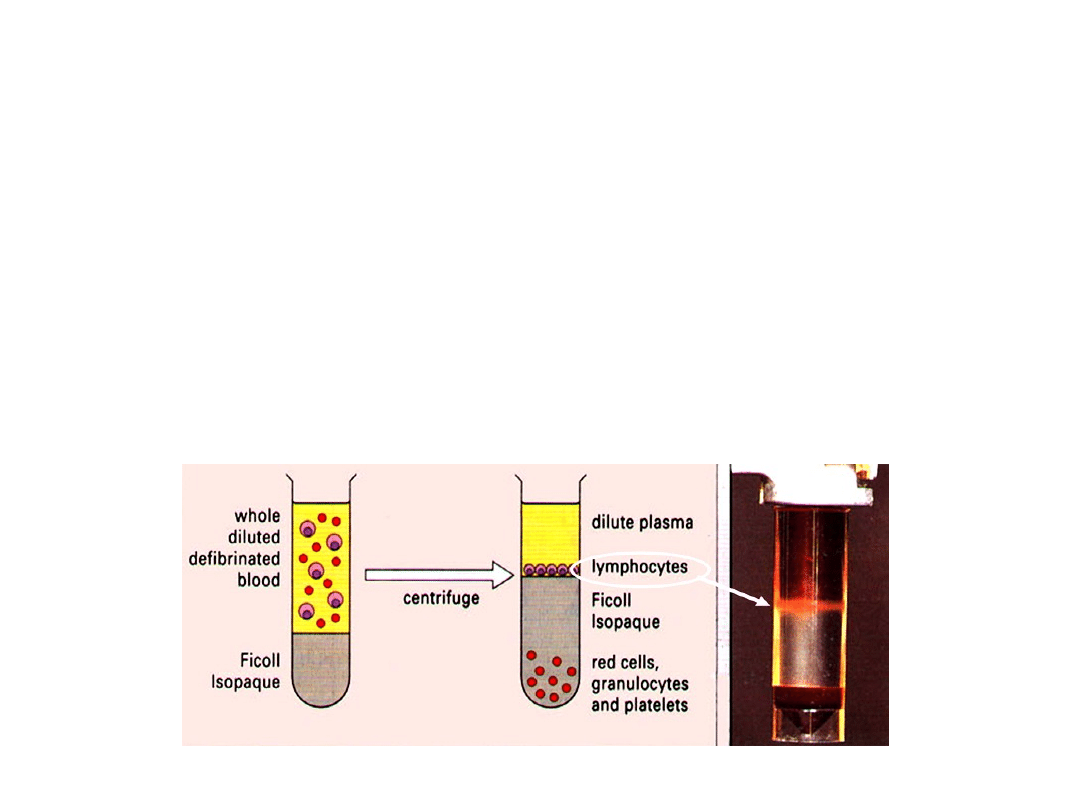
Wirowanie w gradiencie
gęstości
Najczęściej stosowanym gradientem gęstości jest mieszanina Ficoll-Isopaque lub
Histopaque. Służy do izolacji limfocytów z krwi i płynów ustrojowych. Na
określoną objętość gradientu gęstości nawarstwia się delikatnie zawiesinę
komórek (np: pełną krew). Po odwirowaniu, zbiera się interfazę (warstwa
komórek na granicy gradientu i płynu nawarstwionego) bogatą w limfocyty i
monocyty. Przez warstwę przechodzą erytrocyty i granulocyty, które zbierają się
na dnie probówki. Warunkiem uzyskania odpowiedniego rozdziału elementów
morfotycznych krwi jest zastosowanie preparatów o odpowiedniej gęstości.
Granulocyty z osadu można odzyskać poprzez lizę erytrocytów na drodze szoku
osmotycznego przy pomocy 0,83% roztworu chlorku amonu (0,14 M NH
4
Cl z
buforem TRIS, pH 7,4) w 37
0
C przez 5 minut lub przy użyciu wody destylowanej
(1 część płynu hodowlanego i 2 części wody).
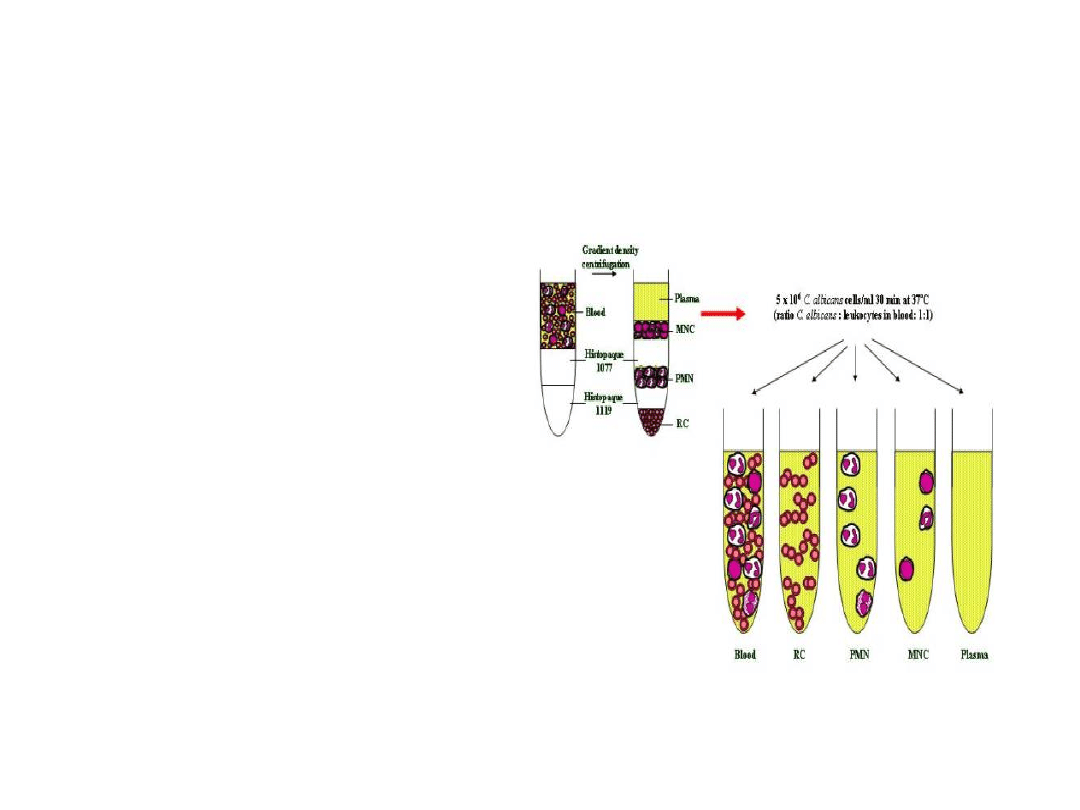
Gradient dwustopniowy
Do izolacji granulocytów z
pełnej krwi wykorzystuje się
wirowanie w dwustopniowym
gradiencie gęstości,
składającym się z Histopaque
1077 i Histopaque 1119. Krew
nawarstwiona na gradient
sporządzony z dwóch równych
objętości tych związków wiruje
się w temperaturze pokojowej
przez około 30 min. przy
700xg. Uzyskuje się 2
interfazy: górną, zawierającą
limfocyty i dolną, zawierającą
granulocyty. Erytrocyty
sedymentują na dno
probówki.
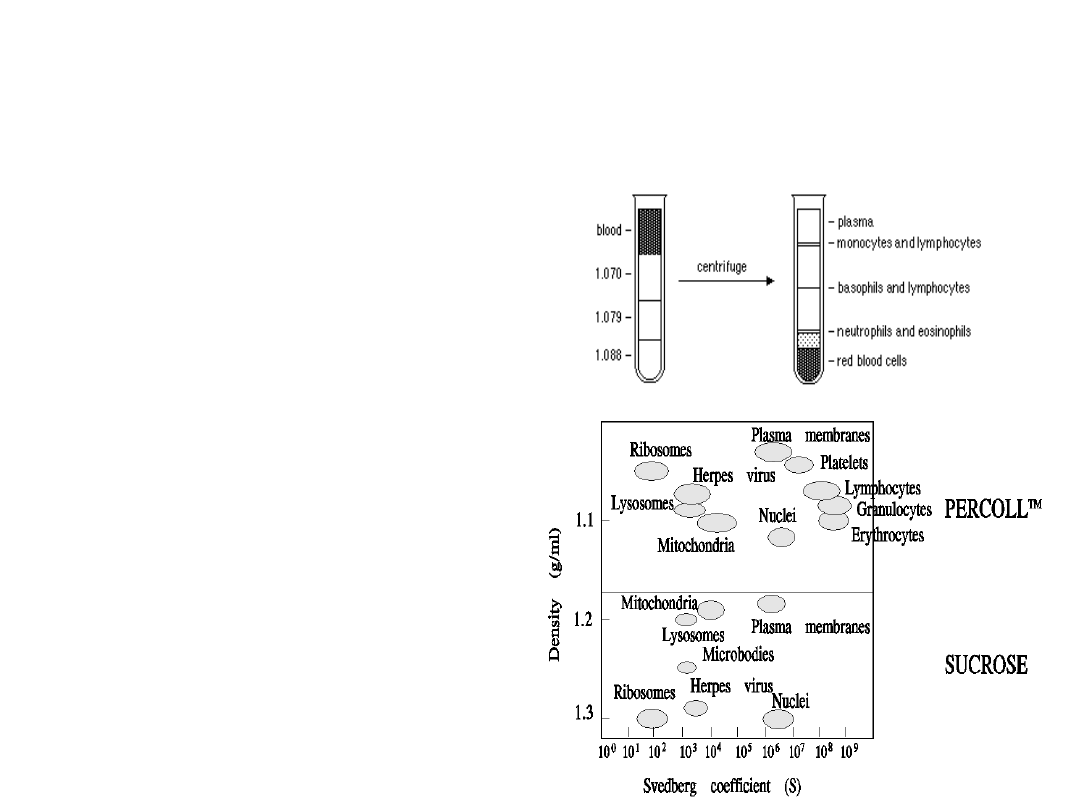
Wielowarstwowy gradient
percoll’u
Percoll jest to zawiesina kuleczek
(15-30 nm) krzemionki pokrytych
poliwinylopyrolidonem (PVP).
Poszczególne warstwy
przygotowuje się rozpuszczając
Percoll (1,130 g/ml) w płynie
fizjologicznym.
Gradient wielowarstwowy służy
do rozdziału subpopulacji
leukocytów np: limfocytów B i T,
komórek NK, monocytów oraz
granulocytów. Izolowane komórki
zatrzymują się na odpowiednich
warstwach o określonej gęstości
w zależności od swojej masy

Metody adherencyjne
Adherencją nazywamy zdolność przylegania do szkła bądź plastiku części komórek
krwi, zwłaszcza monocytów, makrofagów, granulocytów i limfocytów B.
Komórki mogą ulegać adhezji na:
- kulkach szklanych
- płytkach Petriego (polistyrenowe)
- kolumnach z waty nylonowej lub szklanej, z cząsteczkami wielocukru (Sephadex G-
10) lub poliakrylamidu
Zawiesinę komórek inkubuje się na nośniku około 30-45 min. w temp. 37
o
C a
następnie wypłukuje się medium hodowlanym komórki nie przylegające (limfocyty
T). Poprzez inkubację zawartości kolumny (szczególnie szklanej lub nylonowej) w 50
% FBS następuje uwalnianie zaadsorbowanych komórek.
Immunoabsorpcja
Immunoadsorbenty (nośniki),
są to kulki (szklane,
plastikowe) cząsteczki agarozy,
sepharozy, poliakrylamidu
opłaszczone przeciwciałami
skierowanymi przeciw
antygenom powierzchniowym
danej populacji komórek.
Immunoadsorbenty można
umieszczać w szklanych
kolumnach lub innych
nośnikach. Podczas inkubacji
następuje wysokoselektywne
łączenie komórek z
immunoadsorbentem. Aby
uwolnić komórki ze złoża
przepłukuje się je dużą ilością
odpowiedniego eluentu: EDTA,
trypsyna, FBS
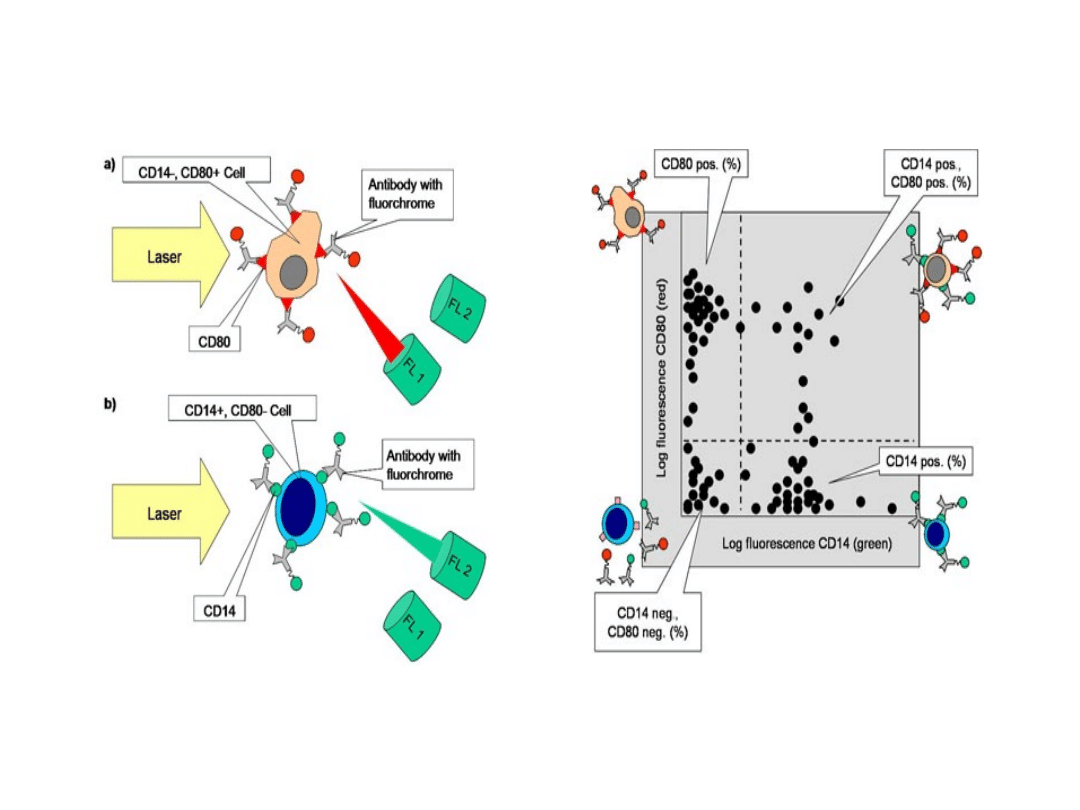
Immunofenotypowanie
Wykorzystując immunoabsorpcję
można otrzymać określone subbopulację
komórek. Przeciwciała skierowane
przeciw markerom CD (cluster of
differentiation) określonej populacji,
powodują związanie komórek z
nośnikiem. Proces ten można powtarzać
wielokrotnie, otrzymując komórki o ściśle
określonym składzie CD.
Technika negatywnej selekcji
Związanie Ig z antygenem w
obecności białek układu dopełniacza
doprowadza do lizy komórek. W wyniku
tego po przejściu przez kolumnę w
zawiesinie pozostaje populacja komórek
nienaruszonych , oraz resztki komórek
martwych w wyniku działania białek
układu dopełniacza.
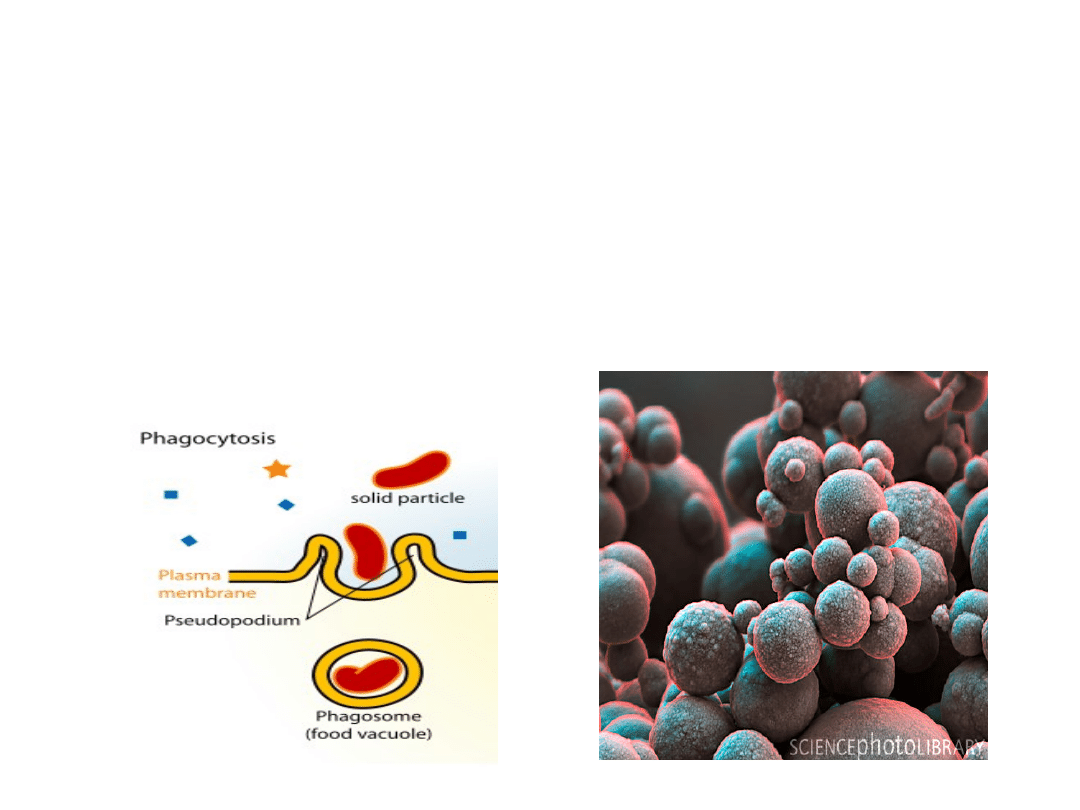
Wykorzystanie fagocytozy
Wykorzystanie właściwości fagocytarnych monocytów,
makrofagów, granulocytów i komórek dendrytycznych pozwala
na ich wyodrębnienie z badanego materiału. W procesie
fagocytozy obce cząsteczki (karbonylek żelaza lub lateks) zostają
otoczone wypustkami błony komórkowej i wchłonięte do wnętrza
pod postacią fagosomu. Następnie komórki te oddziela się od
przy pomocy magnesu (żelazo) lub po przez wirowanie (lateks).

Izolacja magnetyczna z
wykorzystaniem Ig
Nieco inną metodą oczyszczania danej
populacji komórek jest metoda izolacji
magnetycznej z zastosowaniem
paramagnetycznych cząstek polistyrenowych.
Cząstki te o średnicy kilku mikrometrów opłaszcza
się przeciwciałami i inkubuje z komórkami.
Następuje wówczas wiązanie miedzy Ig na
nośniku a komórkami mającymi na powierzchni
odpowiednie antygeny. Komórki związane z
cząsteczkami nośnika izoluje się z zawiesiny za
pomocą magnesu.
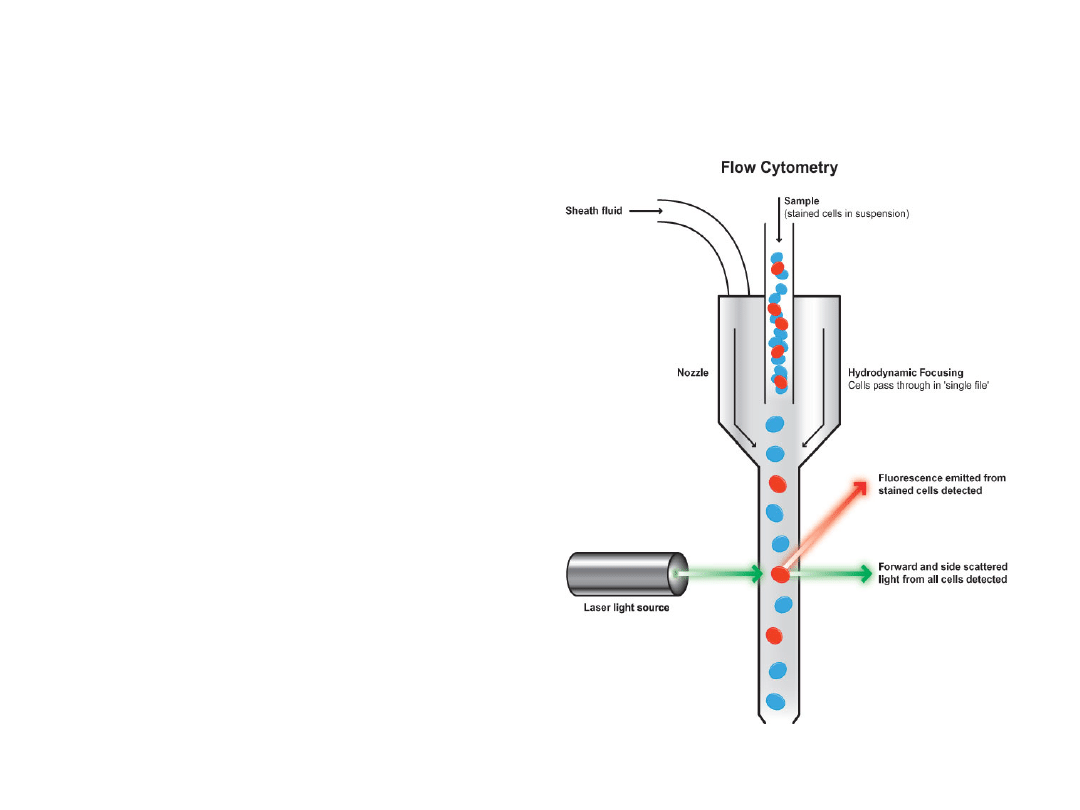
Cytometria przepływowa
Cytometria przepływowa (Flow
cytometry – FCM) to wysoce
specjalistyczna metoda analityczna,
umożliwiająca jednoczesny pomiar
wielu biochemicznych i biofizycznych
właściwości zawieszonych w cieczy
komórek i ich składowych. Technika
ta opiera się na zastosowaniu
przeciwciał monoklonalnych
sprzężonych z barwnikami
fluorescencyjnymi lub bezpośrednim
barwieniu komórek.
Nowoczesne
cytometry wyposażone są w
przynajmniej jeden laser, emitujący
światło o określonej długości fali
(488nm). Pomiar polega na detekcji i
analizie światła rozproszonego przez
komórki oraz fluorescencji
emitowanej na skutek wzbudzenia
barwników. Dostarcza to Informacji
na temat wielkości, wewnętrznej
złożoności (ziarnistości) oraz składzie
antygenowym badanych komórek.
Wykorzystując FCM, możemy
określić ilościowo populacje i
subpopulacje komórek, ich cechy
morfologiczne oraz stan
czynnościowy.
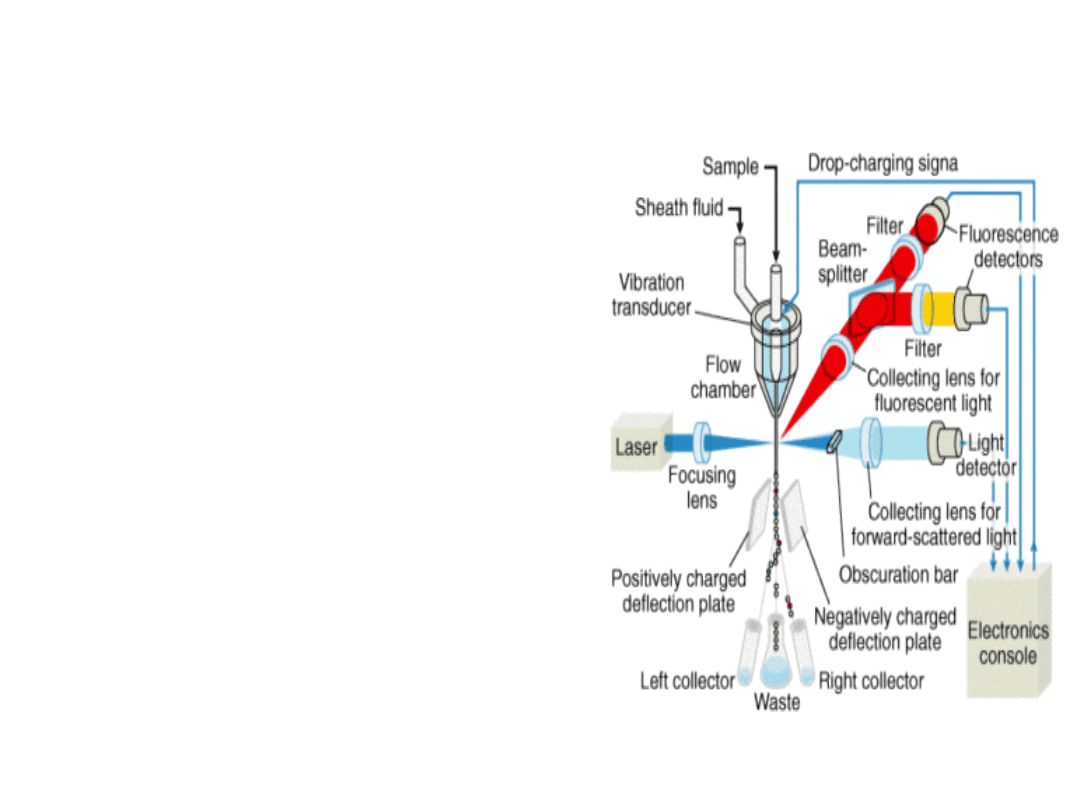
Zasada działania i budowa cytometru
przepływowego
Cytometr przepływowy składa się z
układów: optycznego, elektronicznego,
powietrznego oraz układu transportu
cieczy. Znakowane komórki formowane
są w cienki strumień, naświetlany
wiązką lasera. Światło ulega
rozproszeniu na komórkach a w
przypadku zastosowania
fluorochromów dochodzi również do
jego emisji. Zmiany w natężeniu
światła mierzone są za pomocą
odpowiednich detektorów. Główny
(FSC) rejestruje rozproszenie zgodnie z
kierunkiem padania wiązki laserowej,
pozostałe (SSC) rejestrują rozproszenie
pod kątem 90° lub innym.
Promieniowanie rozproszone zgodnie z
kierunkiem wiązki rośnie ze wzrostem
rozmiaru cząsteczki i nie zależy od jej
kształtu i współczynnika załamania
światła, tak więc określa wielkość
komórki. Natomiast promieniowanie
rozpraszane pod kątem 90° zależy od
wielkości i kształtu cząsteczki i
różnicuje komórki ze względu na ich
kształt i wewnętrzną ziarnistość.
Powstałe sygnały elektryczne
wzmacnia się, formuje i przesyła do
komputera celem dalszej obróbki,
przechowywania i analizy.
Testy rozetkowe limfocytów
Limfocyty T posiadają na swej powierzchni
receptory (antygen CD2), dla krwinek
czerwonych barana co umożliwia
spontaniczne tworzenie rozet z tymi
krwinkami (rozetki spontaniczne E-
bezpośrednie). Rozetki można oddzielić od
pozostałych komórek poprzez wirowanie w
gradiencie stężenia a następnie poprzez
usunięcie erytrocytów na drodze szoku
osmotycznego. Około 70% limfocytów krwi
obwodowej tworzy rozetki spontaniczne.
Rozetki pośrednie (EA) powstają poprzez
łączenie się fragmentu Fc
immunoglobulin opłaszczających
erytrocyty, ze swoistymi receptorami
występującymi na powierzchni limfocytów B
(oraz na makrofagach i neutrofilach).
Rozetki EA tworzy około 30% leukocytów
krwi.
Rozetki EAC powstają przez połączenie
kompleksu erytrocyt-przeciwciało-
dopełniacz z obecnym na limfocycie B
receptorem dla składnika C3
dopełniacza. Receptory dla składników C3
dopełniacza posiadają także monocyty i
neutrofile. Rozetki EAC tworzy 10-20 %
leukocytów.
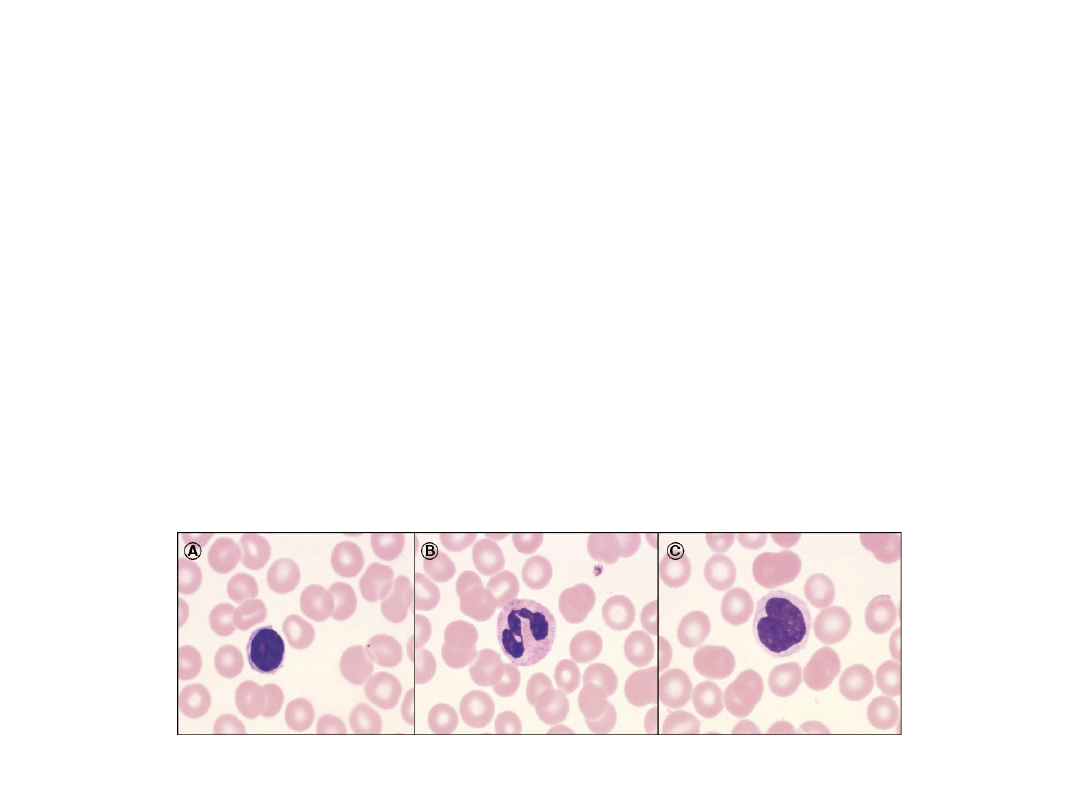
Badania izolowanych leukocytów opierają się głownie na określaniu aktywności
cytotoksycznej komórek, badaniu transformacji balstycznej, wykrywaniu
obecności cytokin i określaniu zdolności fagocytarnych i chemotaktycznych.
W celu sprawdzenia żywotności wyizolowanych komórek przeprowadza się
barwienie przyżyciowe: błękitem trypanu, eozyną, nigrozyną. Natomiast dla
ustalenia jednorodności uzyskanych populacji komórkowej, sprawdza się rozmaz
barwiony metodą May-Grunwalda Giemzy lub przeprowadza się test
immunofluorescencji powierzchniowej (IMF) przy użyciu przeciwciał
monoklonalnych.
A- limfocyt
B- granulocyt
C- monocyt
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
ćw1- metody izolacji IgM-sączenie molekularne, immunologia, ćwiczenia
metody izolacji
Cw 1 Metody izolacji analityka farmacja
Ćwiczenie 2 Metody izolacji komórek
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
Metody izolacji RNA
(),mikrobiologia L, izolacja czystych kultur, metody liczenia drobnoustrojów
dachy Metodyka obliczeń izolacyjności cieplnej dachów, określanie ryzyka kondensacji pary wodnej
System dyscyplinarno - izolacyjny, metodyka wychowania resoc
(),mikrobiologia L, izolacja czystych kultur, metody liczenia drobnoustrojów
Metody wydajnej izolacji i hodowli mezenchymalnych komórek macierzystych
T 3[1] METODY DIAGNOZOWANIA I ROZWIAZYWANIA PROBLEMOW
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
metodyka 3
organizacja i metodyka pracy sluzby bhp
więcej podobnych podstron