
Metody izolowania
komórek z
narządów
limfatycznych
myszy
Katarzyna
Bartosik
Agata Krzywicka

Komórki immunologicznie czynne z płynów i
tkanek litych – podstawowy „substrat”
biologiczny dla szeroko stosowanych
technik immunologii komórkowej, służących
ocenie jakościowej i funkcjonalnej układu
immunologicznego

Udział limfocytów T i B w
narządach limfatycznych
%
limfocytów T
%
limfocytów B
grasica
97
1
węzły
chłonne
77
18
śledziona
35
38
przewód
piersiowy
80
19
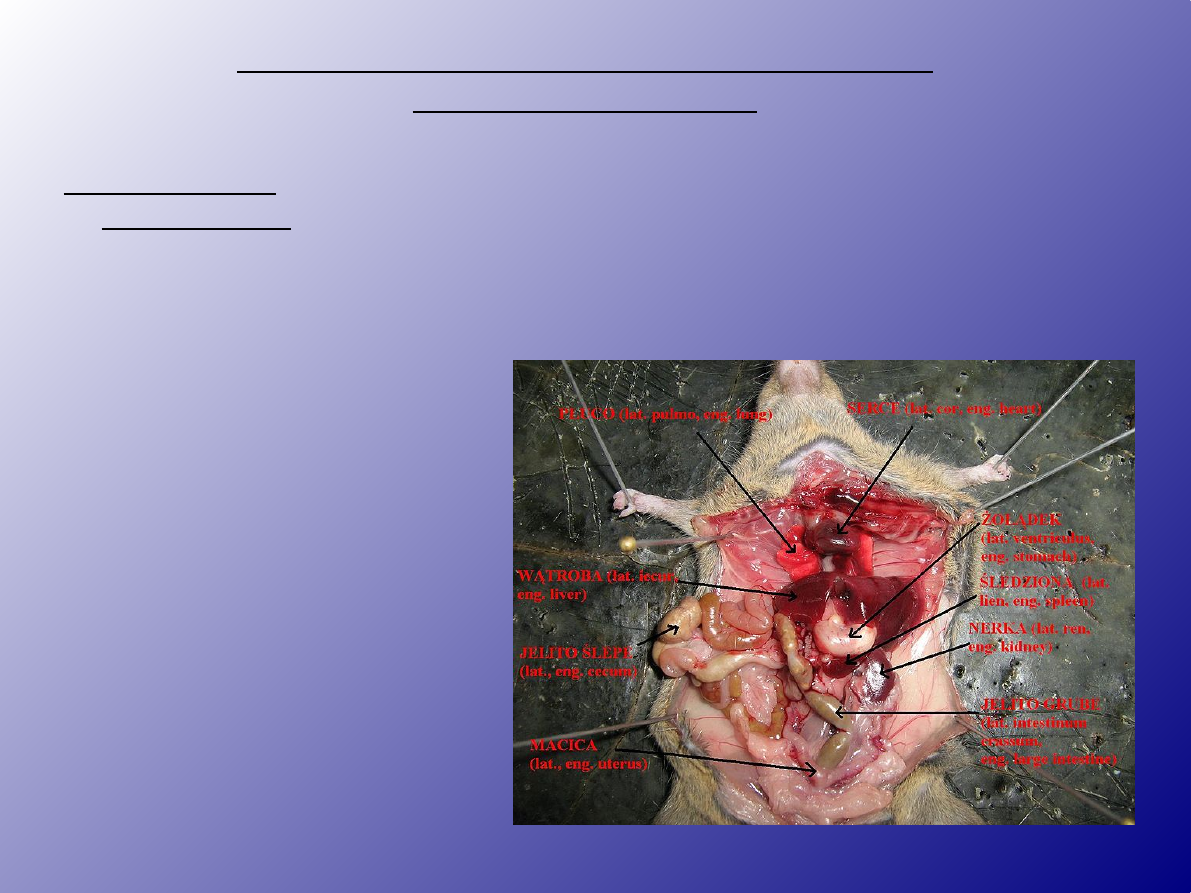
1.Pobranie
narządów
śledziona –
przecięcie skóry i
otrzewnej na
lewym boku
zwierzęcia
pachowe i
pachwinowe
węzły chłonne–
przecięcie skóry
wzdłuż ciała,
odchylenie jej na
boki, węzły
widoczne pod skórą
węzeł
mezenteryczny
Węzeł
podkolanowy
grasica – dodatkowe cięcie
żeber wzdłuż mostka
szpik kostny – kość udowa
IZOLACJA KOMÓREK Z NARZĄDÓW
LIMFATYCZNYCH:

2. Uwolnienie komórek immunologicznie
czynnych z otaczającego zrębu
łącznotkankowego
- rozdrobnienie mechaniczne
(np. w homogenizatorze) na kawałki o
objętości 2-3 mm
3
;
w przypadku kości
udowej wymywanie komórek za pomocą
strzykawki z igłą
- przetarcie fragmentów tkankowych i zlepów
komórek przez siatkę nylonową o wielkości
porów 25 – 50 μm
- zawieszenie komórek w standardowym
płynie hodowlanym

Inne metody izolacji komórek układu
odpornościowego:
- izolacja makrofagów z jamy
otrzewnowej lub płuc
- drenaż przewodu piersiowego – cewnik
umieszczony operacyjnie w przewodzie –
kilkanaście godzin, zawiesina komórek
(większość to limfocyty)

Izolacja makrofagów z jamy
otrzewnowej:
• -dootrzewnowe wstrzyknięcie środków
drażniących -tioglikolat, skrobia lub glikogen
• -po kilku dniach przepłukanie jamy
otrzewnowej PBS z EDTA – wysięk zawierający
makrofagi aktywowane
Izolacja
makrofagów płuc:
•perfuzja płuc przez
tchawicę płynem
zawierającym czynnik
antykoagulacyjny

Metody rozdziału wyizolowanych
komórek
- wykorzystujące właściwości:
• fizyczne
- gradienty gęstości
-metody adherencyjne
-eliminacja komórek na drodze szoku
osmotycznego
• biologiczne
- tworzenie rozet
- immunoadsorbenty
- kulki magnetyczne
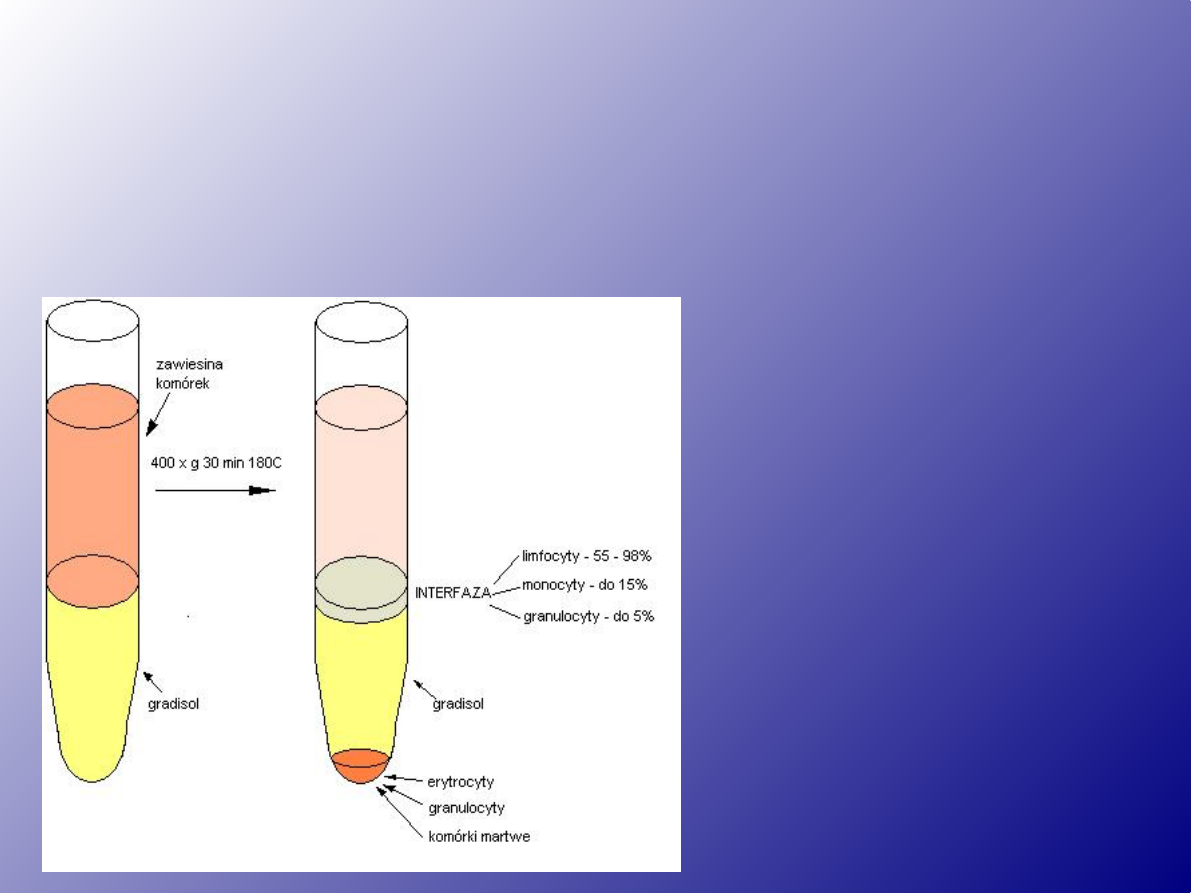
Wirowanie w gradiencie gęstości
Gradient – najczęściej mieszanina syntetycznych
wysokocząsteczkowych polimerów (lecz może to być także
surowica) o określonej gęstości względnej (g/ml) i lepkości.
Gradient powinien być:
-o niskiej lepkości
-izoosmotyczny z krwią danego
gatunku
- nietoksyczny
-niezdolny do penetracji
przez błony biologiczne
izolowanych komórek
-łatwy do usunięcia
(wypłukania) z
oczyszczanego materiału
ZASADA
ROZDZIAŁU
–
RÓŻNICE
POMIĘDZY
GĘSTOŚCIĄ
WZGLĘDNĄ
GRADIENTU A WIELKOŚCIĄ I MASĄ
IZOLOWANYCH KOMÓREK

Żywotność komórek z interfazy powinna
wynosić około 80 -100%
W
celu
sprawdzenia
żywotności
komórek
przeprowadza się barwienie przyżyciowe: błękitem
trypanu, eozyną, nigrozyną.
Jednorodność uzyskanej populacji komórkowej
sprawdza się w rozmazie barwionym metodą May-
Grunwalda Giemzy lub metodą immunofluorescencji
powierzchniowej (IMF) przy użyciu przeciwciał
monoklonalnych.
Określanie gęstości komórek
– liczenie w komorze Bürkera

Metody adherencyjne
Adherencja – zdolność przylegania do szkła bądź plastiku
części komórek, zwłaszcza szeregu monocyta; zależy od
właściwości błony komórkowej i nie ma cech swoistości.
Dotyczy nie tylko monocytów i makrofagów, ale
także granulocytów i częściowo limfocytów B
Metody:
- rozdział komórek przy użyciu kulek szklanych
- przyleganie komórek adherentnych do powierzchni płytki
Petri'ego (polistyren) w czasie inkubacji (1 godz. w 37ºC,
5%CO
2
)
- kolumny z waty nylonowej lub szklanej
- kolumny z cząsteczek wielocukru lub poliakrylamidu
(Inkubacja zawiesiny komórek w kolumnach, po 30-45 min. w
37º C wypłukanie medium hodowlanym nie przylegających
komórek –
limfocytów T
; następnie inkubacja zawartości
kolumny w 50% FCS – uwolnienie zaadsorbowanych komórek)

Eliminacja komórek na drodze
szoku
osmotycznego
(uszkodzenie błon
komórkowych)
a) woda destylowana (1 część płynu hodowlanego i 2
części wody, pH 4,65)
b) chlorek amonu (0,83%=o,14 M NH
4
Cl z buforem
TRIS, pH 7,4)
- zawieszenie komórek w jednym z ww. roztworów
- inkubacja 15 – 30 sekund
- odwirowanie
- zawieszenie w płynie hodowlanym
Zawiesina komórek zostaje pozbawiona
erytrocytów
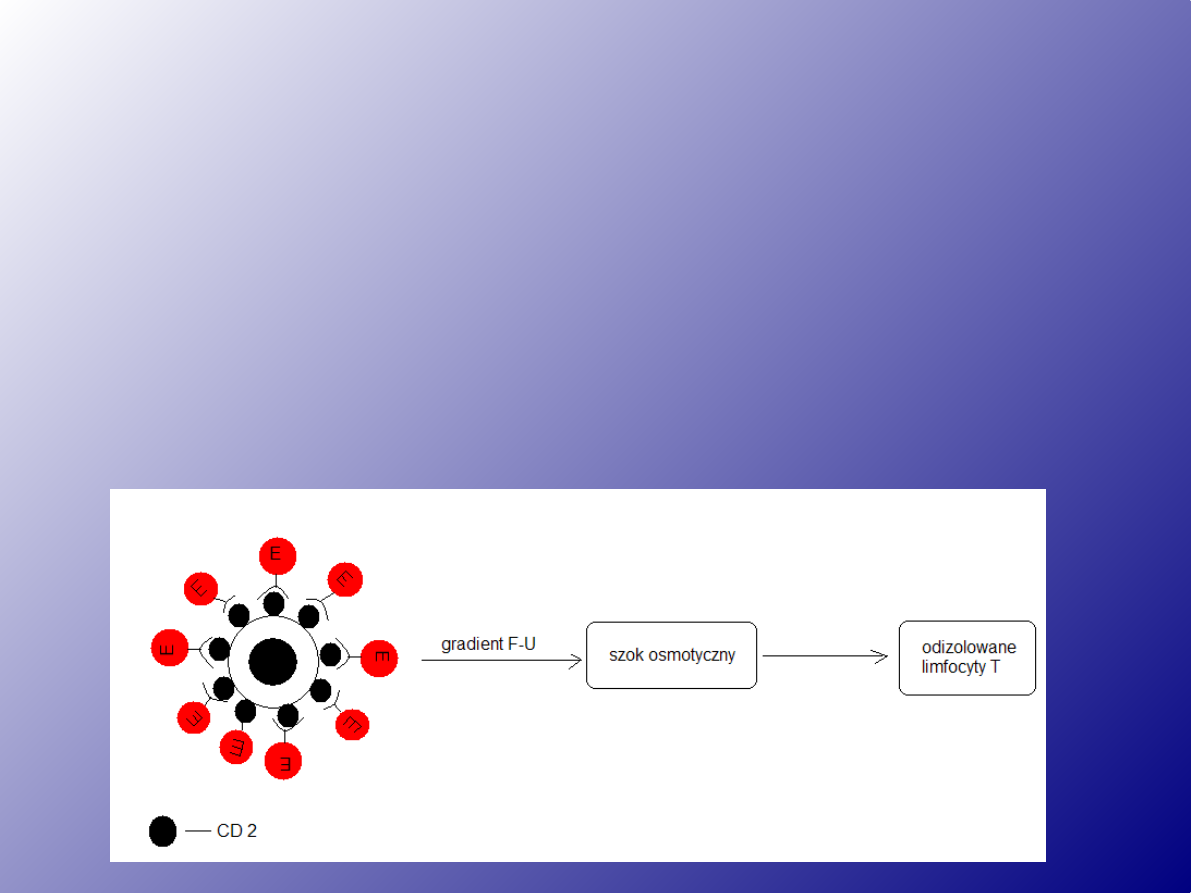
Tworzenie rozet
Limfocyty T
posiadają na swej powierzchni
receptory
dla krwinek czerwonych barana (
antygen CD2
) co
umożliwia spontaniczne tworzenie rozet z tymi
krwinkami (rozetki spontaniczne E - bezpośrednie).
Rozetki można oddzielić od pozostałych komórek
poprzez wirowanie w gradiencie Ficoll - Uropolina,
a następnie poprzez usunięcie erytrocytów na
drodze szoku osmotycznego.

Metody wykorzystujące
immunoadsorbenty
- kolumny – przez kolumnę wypełnioną nośnikiem
opłaszczonym
odpowiednim
przeciwciałem
monoklonalnym przepuszcza się zawiesinę komórek,
subpopulacja swoiście reagująca wiąże się z
nośnikiem
; komórki można odzyskać, płukając
immunoadsorbent płynem hodowlanym
- panning – immunoadsorpcja komórek w
fazie stałej
(stosowana np. do frakcjonowania CD4+ od CD8+
ludzkich limfocytów)
- paramagnetyczne cząstki polistyrenu (kulki)
opłaszczone przeciwciałami
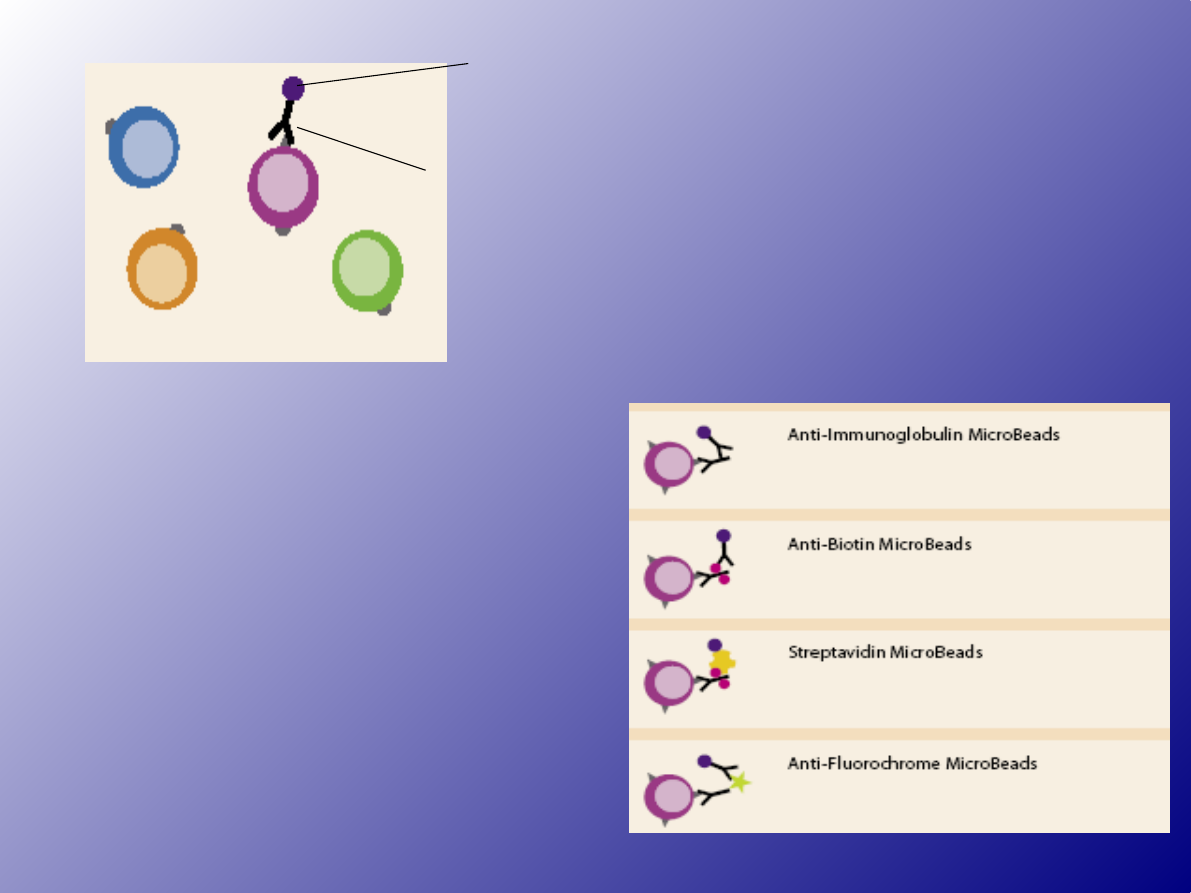
kulk
a
przeciwciało
Kulki
paramagnetyczne
Metoda uzyskiwania względnie
czystych
populacji
komórek
z
zawiesiny
zawierającej
wiele
populacji
•inkubacja zawiesiny komórek z
kulkami
magnetycznymi
opłaszczonymi
przeciwciałem
skierowanym
przeciw
powierzchniowym
antygenom
komórek,
których chcemy pozbyć
się z zawiesiny (zubożenie populacji),
np. przeciwciała antyneutrofilowe
dla
populacji
zawierającej
eozynofile
i
neutrofile,
lub
przeciwciała
anty-CD3
dla
mieszaniny limfocytów T i B
•2
możliwości:
naniesienie
mieszaniny
do
kolumny
lub
pozostawienie ich w probówce
•działanie
magnesem
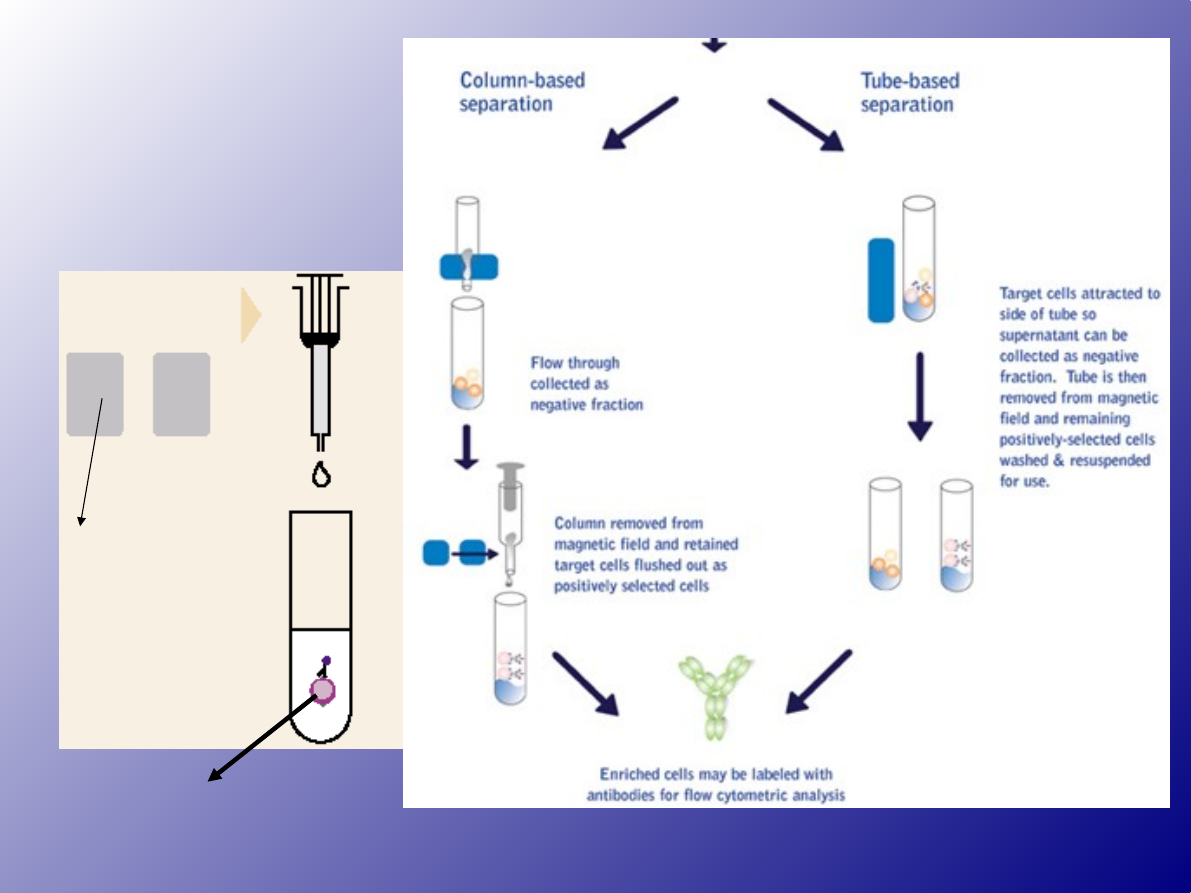
Frakcja komórek,
która została
zatrzymana w
kolumnie
magne
s
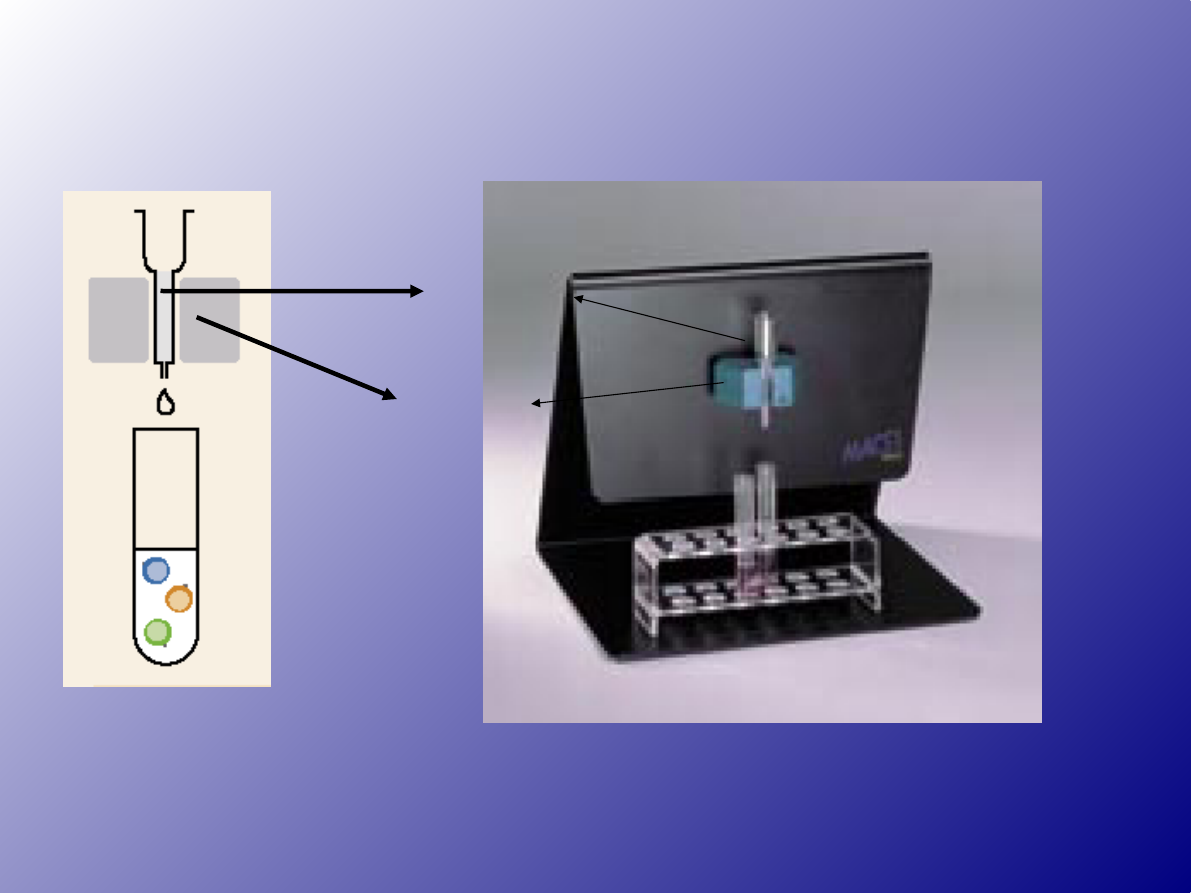
Kulki paramagnetyczne
kolumna
magnes
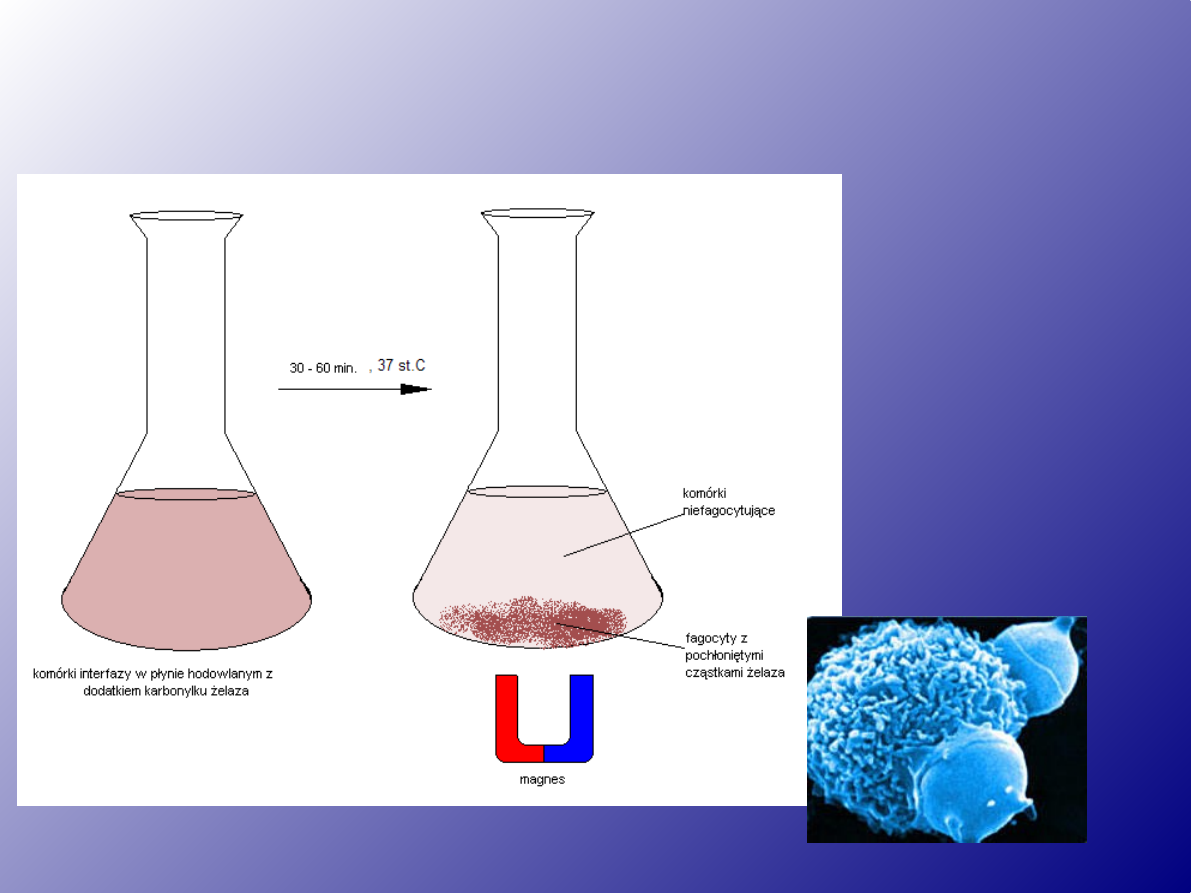
Fagocytoza
• Metody:
• a) karbonylek żelaza
(Fe
2
CO)
9
) lub opiłki
żelaza
• b) lateks (kulki plastiku
łatwo fagocytowane
)
Dziękujemy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
ćw1- metody izolacji IgM-sączenie molekularne, immunologia, ćwiczenia
Metody izolacji leukocytów
Cw 1 Metody izolacji analityka farmacja
Ćwiczenie 2 Metody izolacji komórek
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
Metody izolacji RNA
(),mikrobiologia L, izolacja czystych kultur, metody liczenia drobnoustrojów
dachy Metodyka obliczeń izolacyjności cieplnej dachów, określanie ryzyka kondensacji pary wodnej
System dyscyplinarno - izolacyjny, metodyka wychowania resoc
(),mikrobiologia L, izolacja czystych kultur, metody liczenia drobnoustrojów
Metody wydajnej izolacji i hodowli mezenchymalnych komórek macierzystych
T 3[1] METODY DIAGNOZOWANIA I ROZWIAZYWANIA PROBLEMOW
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
metodyka 3
organizacja i metodyka pracy sluzby bhp
więcej podobnych podstron