Limfocyty T
•
TCR
•
CD2
•
CD3
•
CD4
•
CD5
•
CD7
•
CD8
•
CD28
•
CD40L
Charakteryzują się obecnością na ich
powierzchni następujących markerów:

Wyróżniamy dwa główne rodzaje
receptorów TCR:
- składające się z łańcuchów α i β (90%
limfocytów krwi człowieka)
- składające się z łańcuchów γ i δ
Średnio na limfocycie znajduje się ok.
5x10
4
receptorów TC
Receptor TCR bierze udział w
rozpoznawaniu antygenu
TCR
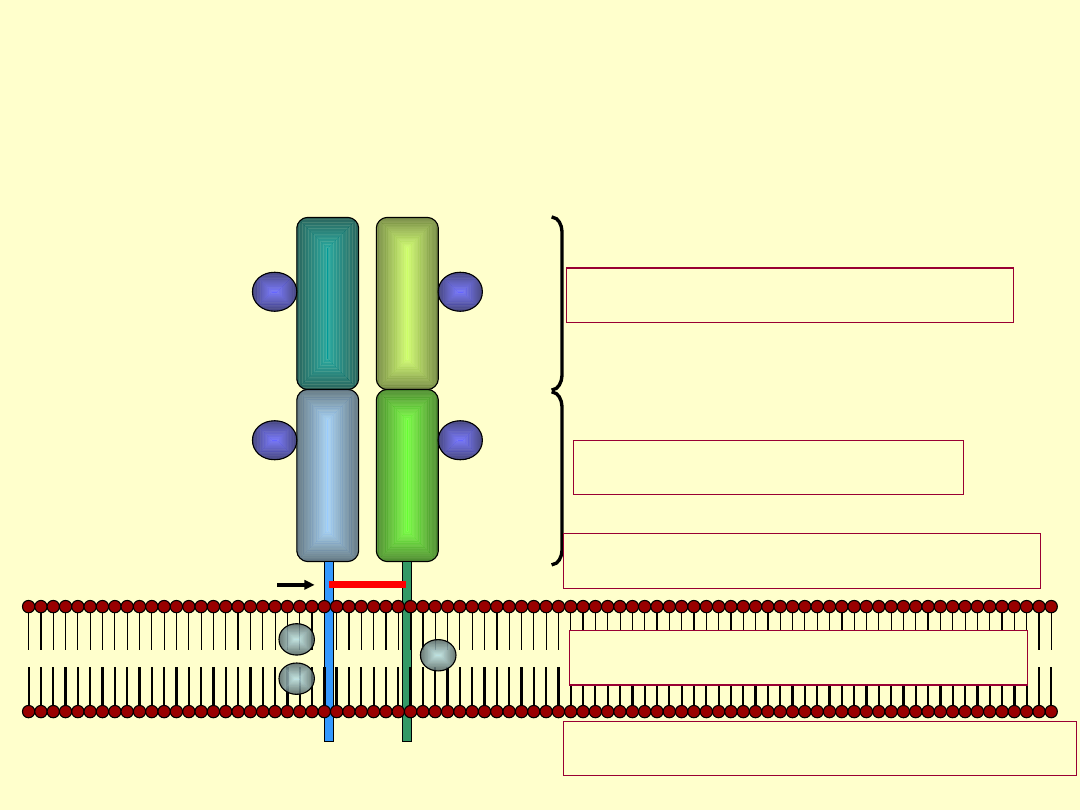
Struktura TCR
CHO
CHO
CHO
CHO
Region “V”- zmienny
Region “C” - stały
Region zawiasowy “H”
Łańcuch
Alpha
Łańcuch
Beta
Mostek dwusiarczkowy
Odcinek śródbłonowy
Cześć cytoplazmatyczna
+
+
+
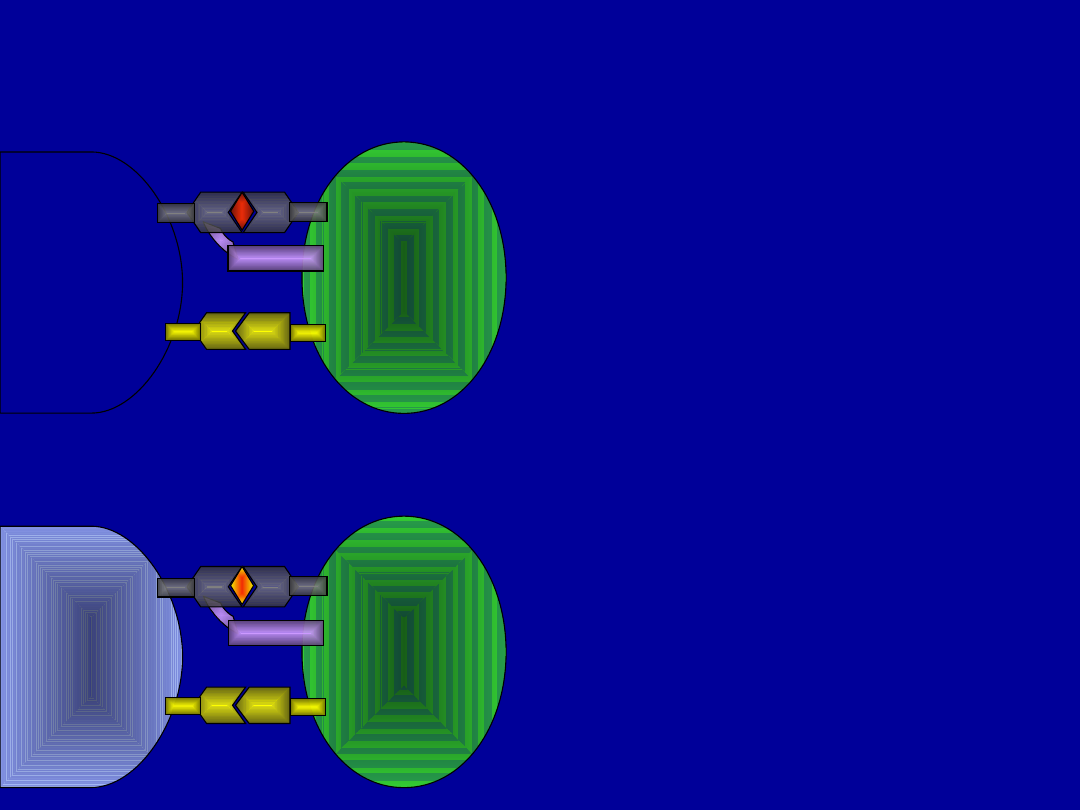
APC
limfocy
t
CD28
TCR
MHC
B7.1/B7
.2
APC
limfocy
t
CD28
TCR
MHC
B7.1/B7
.2
TCR rozpoznaje właściwy
sobie antygen –
pobudzenie receptora i
rozwój odpowiedzi
immunologicznej
TCR wiąże antygen
podobny – brak odpowiedzi
immunologicznej/hamowan
ie odpowiedzi na właściwy
antygen. Zmienione
ligandy peptydowe (APL)
można wykorzystywać w
terapii.

Geny kodujące TCR znajdują się w chromosomie 7
i 14.
Części zmienne są kodowane przez geny V i J
(łańcuchy α i γ) oraz przez geny V, D i J (łańcuchy
β i δ).
Różnorodność receptorów TCR zapewnia
rekombinacja genów.
Zasada wyłączenia allelicznego nie jest
przestrzegane bezwzględnie – limfocyt T może
mieć dwa różne łańcuchy α, γ, δ (pochodzące z 2
różnych chromosomów). Jednak do
rozpoznawaniu antygenu używany jest tylko
jeden rodzaj TCR na limfocycie.
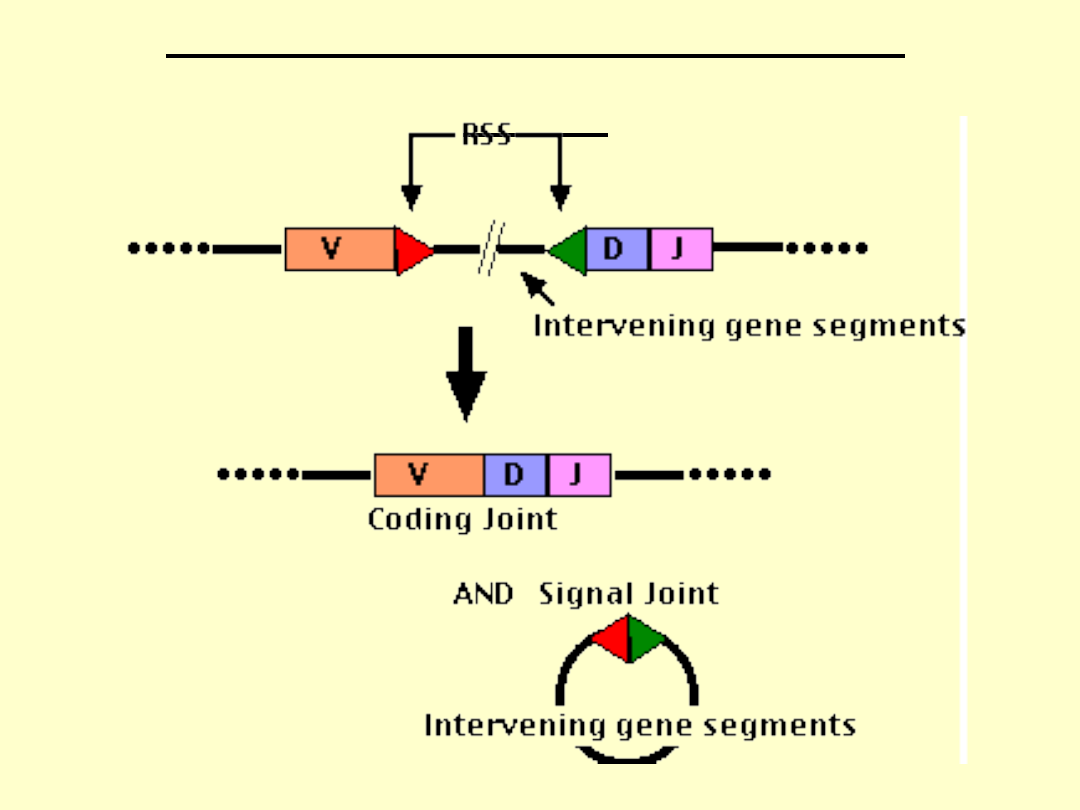
GENES CODING FOR
TCR
Recombinas
e
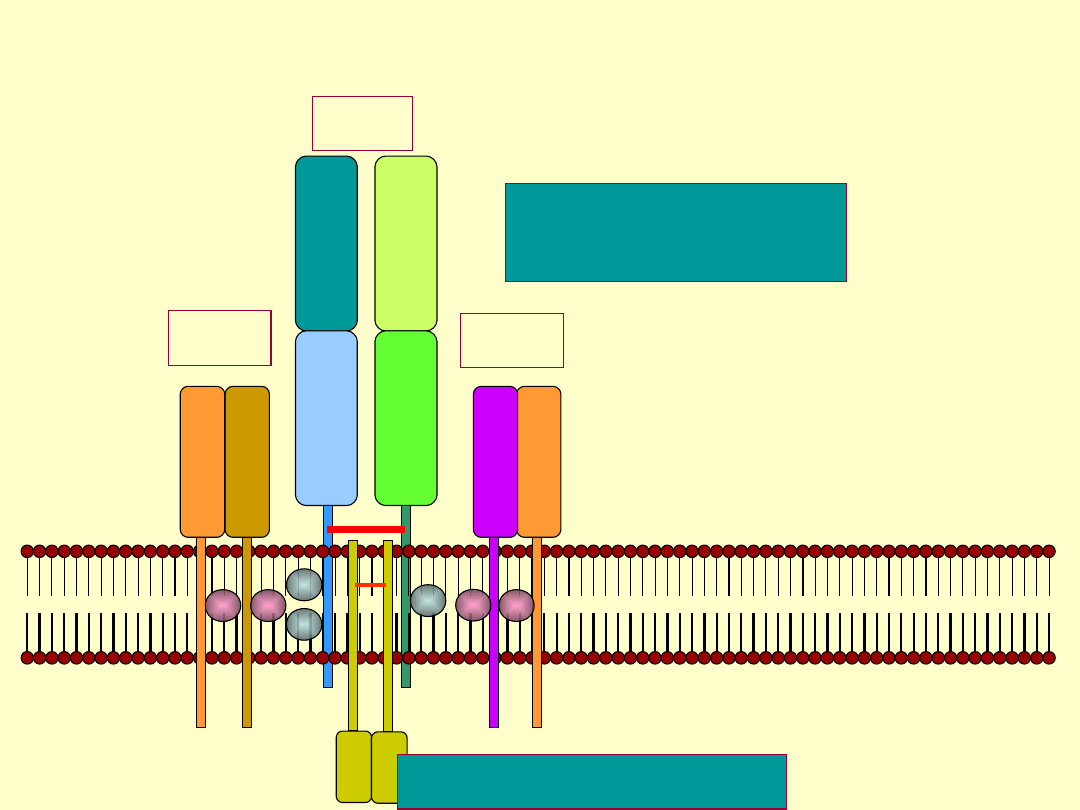
Kompleks CD3 i TCR
α
β
+
+
+
δ
ε
ε
γ
ζ ζ
-
-
- -
TCR
CD3
CD3
Rozpoznanie
antygenu
Przekazanie sygnału
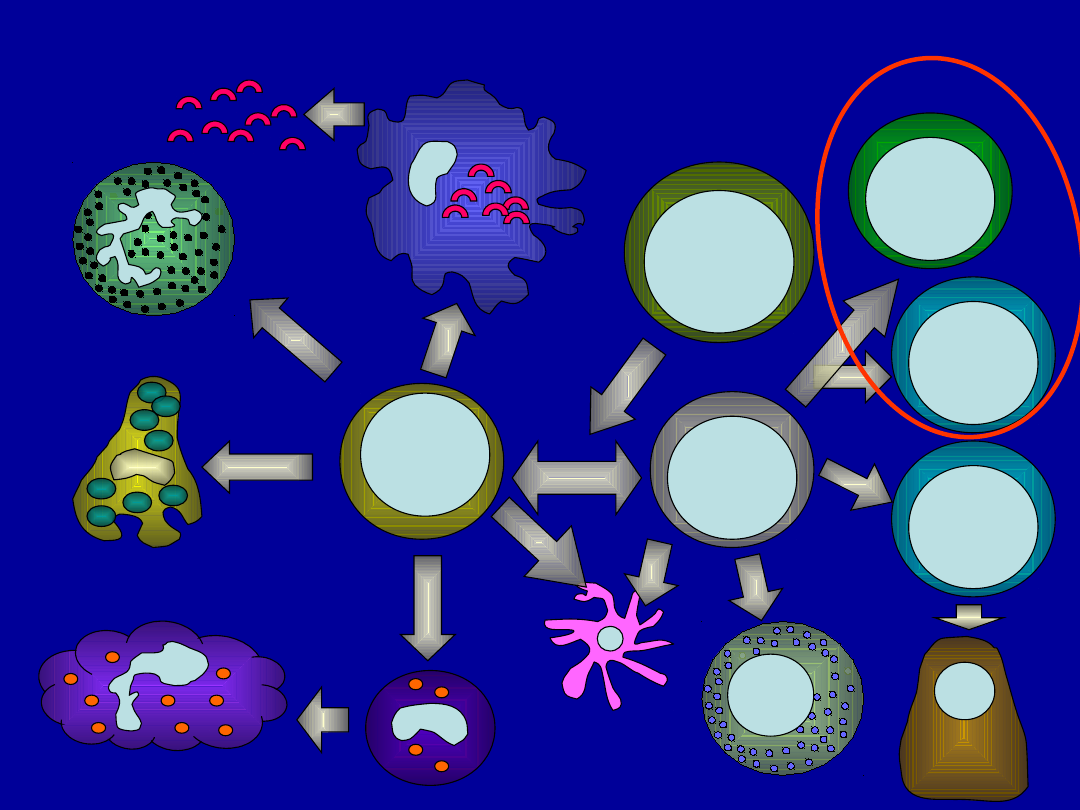
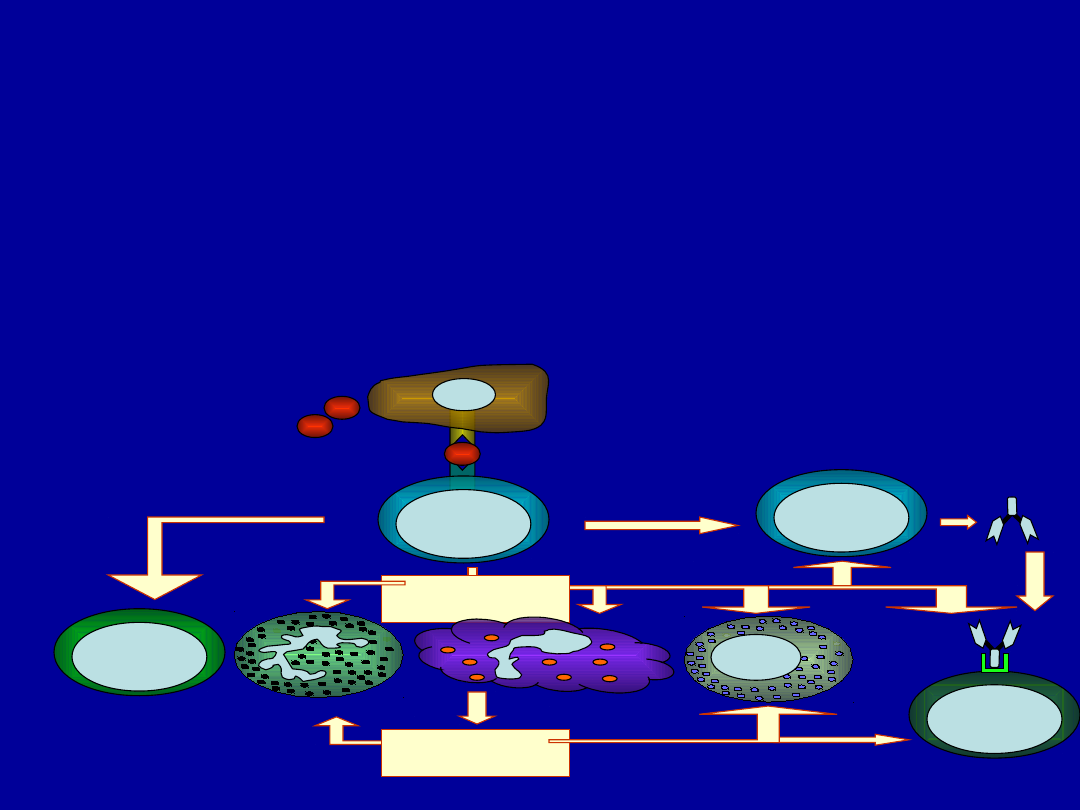
Hematopoeza
NK
Limfoidalna
komórka
progenitorowa
Limfocyty Tc
Limfocyty Th
Komórka macierzysta
Limfocyty B
Granuloc
yty
Trombocyty
Megakariocyty
Makrofagi
Monocyty
Komórki
dendrytyczne
Komórki
plazamatyc
zne
Komórki tuczne
Mieloidalna
Komórka
progenitorowa

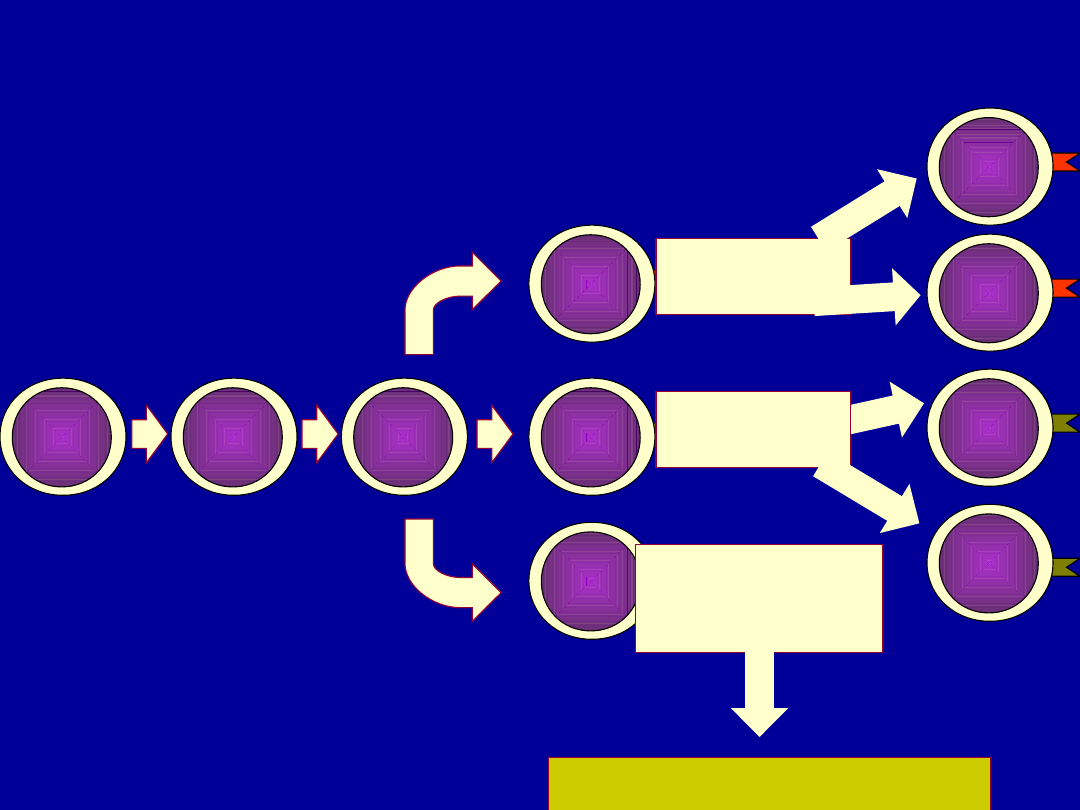
Dojrzewanie limfocytów T
• Limfocyty T dojrzewają w grasicy – limfocyty przebywające i
dojrzewające w grasicy nazywamy tymocytami.
• W czasie dojrzewania w procesach selekcji ginie ok. 90%
tymocytów.
• W grasicy możemy wyróżnić cztery populacje limfocytów T
w zależności od stopnia dojrzałości
– Tymocyty potrójnie ujemne CD4-/CD8-/TCR-
– Tymocyty podwójnie dodatnie CD4+/CD8+
– Tymocyty CD4+ lub CD8+
– Dojrzałe limfocyty T
• W procesie dojrzewania limfocytów T możemy wyróżnić
dwie fazy
– fazę wczesną
– fazę późną

Faza wczesna dojrzewania
limfocytów T
• Zasiedlenie grasicy przez powstałe w szpiku
komórki progenitorowe
• Ekspansja komórek zasiedlających
• Ukierunkowanie w stronę wczesnych tymocytów
– Komórki pro-T Kit(CD117)+/CD44+/CD25-
– Komorki pro-T Kit(CD117)+/CD44+/CD25+
– Wczesne komórki pre-T Kit(CD117)-/CD44-/CD25+
• Rearanżacja genów dla TCR
• Selekcja β
• Wyłączenie alleliczne i izotypowe
• Ukierunkowanie w kierunku linii αβ lub γδ

Późna faza dojrzewania limfocytów T
• Ma na celu wyłonienie limfocytów T mogących
rozpoznawać
antygeny
prezentowane
w
kontekście MHC i usunięcie limfocytów
mogących
niszczyć
własne
antygeny
organizmu.
• Uczestniczą w niej limfocyty mające na swej
powierzchni w pełni wytworzony kompleks TCR
oraz cząsteczki CD4 i CD8.
• Wyróżniamy dwa główne etapy
– Selekcję pozytywną
– Selekcje negatywną
Selekcja pozytywna i restrykcja MHC
4-
8-
4+/-
8+
4+ 8+
TCR low
4+ 8+
TCR low
4+ 8+
TCR low
4+ 8+
TCR low
Rozpoznaje
MHC I
Rozpoznaje
MHC II
Nie rozpozanje
MHC
Apoptoza – „smierć z
zaniedbania”
8+
TCR high
8+
TCR high
4+
TCR high
4+
TCR high
Selekcja negatywna
Brak reakcji z
autoantygenami
Brak interakcji
z autoantygenami
8+
TCR high
4+
TCR high
Apoptoza indukowana TCR
Dojrzałe limfocyty T
Rozpoznaje
MHC I
Rozpoznaje
MHC II
8+
TCR high
4+
TCR high
Duże
powinnowactw
o
do
autoantygenó
w
Dojrzałe limfocyty T
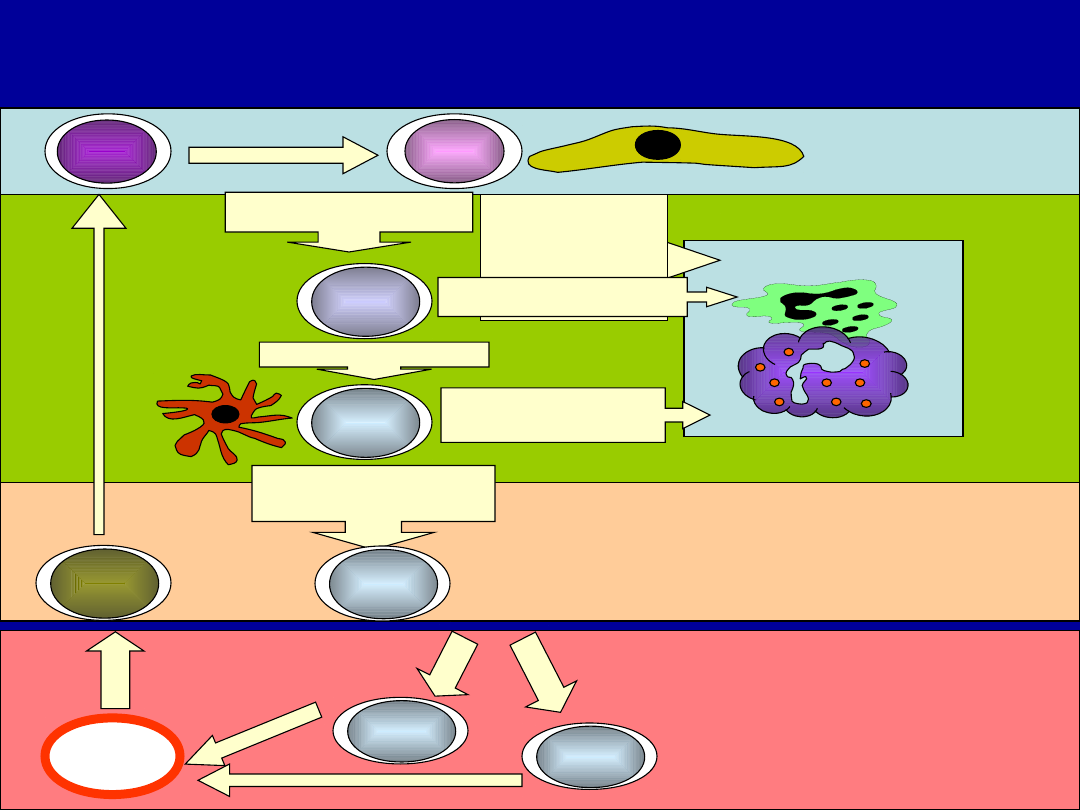
Dojrzewanie limfocytów T i ich migracja w
grasicy
4 -
8 low
4 low
8 low
4 + 8 +
TCR
4 + 8 +
TCR
makrofag
makrofag
Prawidłowa rearanżacja
TCR
Nieprawidło
wa
rearanżacja
TCR
Rozpoznanie auto MHC
Brak interakcji z auto MHC
TCR nie rozpoznaje
własnych antygenów
TCR rozpoznaje własne
antygeny
APOPTOZA
4 + 8 +
TCR
4 - 8 -
Region
podtorebkow
y
Kora
Granica kory i rdzenia
4 + 8 -
TCR
4 - 8 +
TCR
Krwiobieg
Rdzeń

Limfocyty T
Limfocyty możemy podzielić:
• ze względu na budowę TCR
– Tαβ
– Tγδ
• ze względu na ekspresję cząsteczek CD4 i CD8
– limfocyty T CD4+
– limocyty T CD8+
• ze względu na funkcję
– limfocyty T pomocnicze Th
– limfocyty T cytotoksyczne Tc
– limocyty T regulatorowe Treg

Limfocyty T pomocnicze
• Charakteryzują
się
ekspresją
antygenu CD4 i rozpoznają antygen
prezentowany w kontekście MHC I
• Wspomagają zarówno odpowiedź typu
komórkowego, jak i humoralnego.
• Ich działanie odbywa się poprzez
bezpośredni
kontakt
między
komórkami,
a
także
poprzez
wydzielanie odpowiednich cytokin.
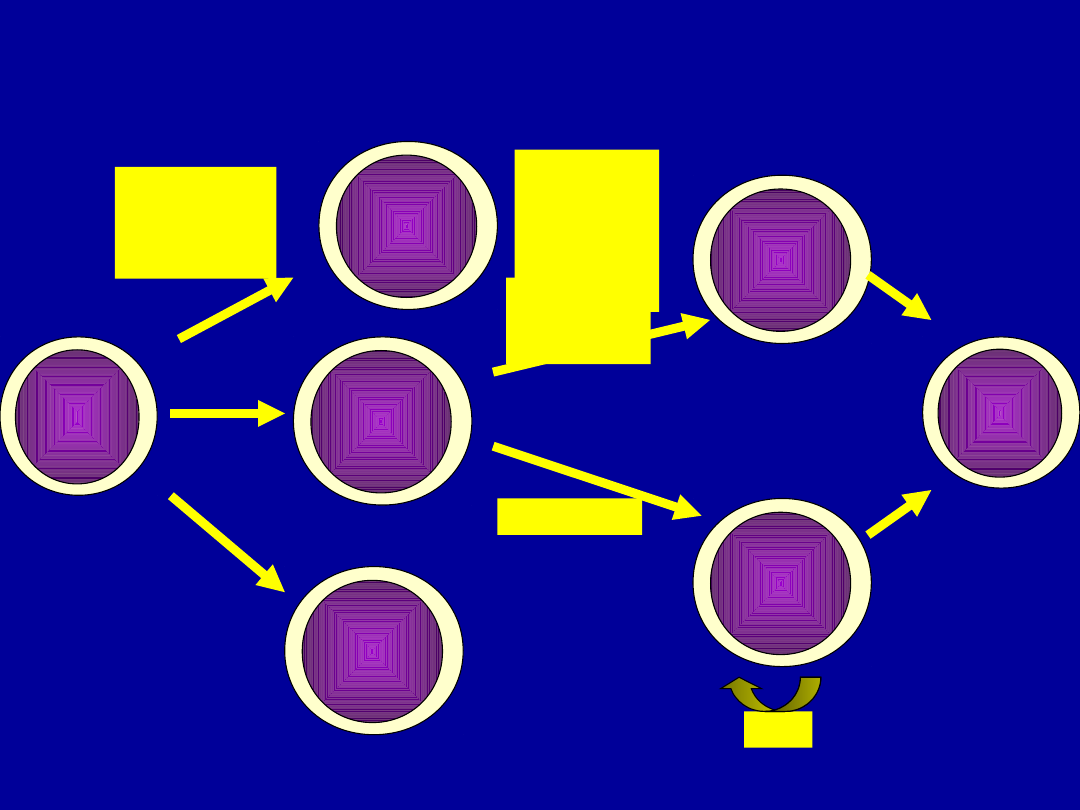
Limfocyty T pomocnicze
Th
Prekursor
IL_2
Th0
IL-2, IL-3,
IL-4, IL-5, IL-10,
IFN-γ, GM-CSF
Th
IL-2, IL-4, IFN-γ
Th
IL-2, IL-4, IL-5
Th2
IL-3, IL-4, IL-5,
IL-6, IL-10,
IL-13, GM-CSF
Th1
IL-2, IL-3,
IFN-γ, GM-CSF
LT-α
IL-12, IL-
18, IFN-γ,
IFN-α
IL-4
IL-4
Krótkotrwa
ła
stymulacja
antygenem
Dlugotrwa
ła
stymulacj
a
antygene
m
ThM
IL-2
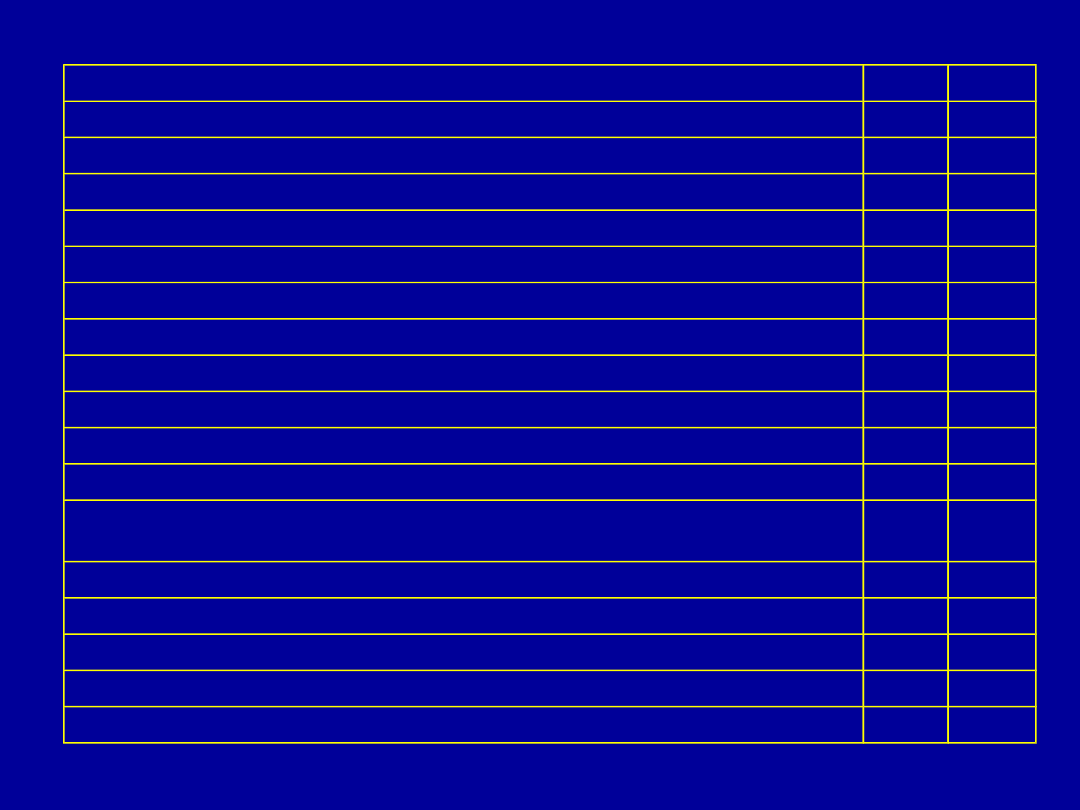
Limfocyty pomocnicze Th1 i Th2
Th1
Th2
IL-2
+
-
INF-γ
+
-
LT-α
+
-
IL-3
+
+
GM-CSF
+
+
IL-4
-
+
IL-5
-
+
IL-6
-
+
IL-9
-
+
Il-10
-
+
IL-13
-
+
Udział w odpowiedzi typu komórkowego/Nadwrażliwość typu
późnego
++
-
Aktywacja makrofagów
++
-
Pomoc limfocytom B
+/-
++
Wpływ na produkcję IgM, IgG, IgA
+/-
++
Wpływ na produkcję IgE
-
++
Wpływ na powstawanie eozynofilów i komorek tucznych
-
++
Antagonizm Th1 i Th2
Th2
IL-3, IL-4, IL-5,
IL-6, IL-10,
IL-13, GM-CSF
Th1
IL-2, IL-3,
IFN-γ, GM-CSF
LT-α
IL-4
IFN-
γ
(-
)
IL-4,IL-10,
IL-13

Limfocyty T regulatorowe
(supresorowe)
• Limfocyty Treg biorą udział:
– hamowanie aktywności autoreaktywnych
limfocytów T
– tolerancja na antygeny podane doustnie,
„tolerancja pokarmowa”
– tolerancja na ALP, tolerancja na antygeny mogące
być antagonistami TCR
– tolerancja na przeszczepy allogeniczne,
„tolerancja transplantacyjna”
• Limfocyty Treg mogą indukować powstawanie
kolejnych limfocytów Treg, co umożliwia
przenoszenie stanu tolerancji pomiędzy
osobnikami, „tolerancja infekcyjna”

• Najważniejszymi subpopulacjami limfocytów
Treg są:
– Limfocyty Th1 i Th2 biorące udział w zjawisku
antagonizmu Th1 i Th2, „dewiacji immunologicznej”
– Limfocyty Th3 wydzielające głównie TGF-β
– Limfocyty Tr1 wydzielające głównie TGF-β i IL-10
– Limfocyty T CD4+/CD25+/CD62L+
– Limfocyty T CD8+/CD28+
– Wpływ regulatorowy mogą także wywierać niektóre
limfocyty Tc, NKT, Tγδ
Limfocyty T regulatorowe
(supresorowe)

Limfocyty T cytotoksyczne
• Należą do nich głównie limfocyty T CD8+ (Tc1-
wydzielające IFN-γ i Tc2 – wydzielające IL-4 i IL-5), ale
także:
– niektóre limfocyty Th1
– limfocyty Tγδ
– limfocyty NKT
• Limfocyty cytotoksyczne rozpoznają obce cząsteczki MHC
I lub antygeny prezentowane w kontekście MHC I
• Ich głównym zadaniem jest eliminacja komórek
zakażonych przez wirusy i inne patogeny
wewnątrzkomórkowe oraz niszczenia komórek
nowotworowych.
• Limfocyty cytotoksyczne mogą także hamować replikację
wirusów w zakażonych komórkach bez ich niszczenia.

Limfocyty Tγδ
• U człowieka stanowią ok. 5% obwodowych limfocytów
• Powstają w grasicy, jednak mogą się różnicować i podlegać
selekcji także poza nią
• Biorą udział w odporności przeciwzakaźnej i
przeciwnowotworowej.
• Wydzielają cytokiny stymulujące odpowiedź immunologiczną.
• Większość z nich ma zdolność rozpoznawania antygenów nie
przetworznych przez komórki prezentujące antygen i nie
połączonych z MHC.
• Mogą rozpoznawać antygeny związane z CD1.
• Rozpoznają antygeny takie jak:
– Białka szoku cieplnego (HSP)
– Cząsteczki MICA i MICB (występujące na komórkach podanych
szokowi cieplnemu i komórkach nowotworowych)
– Tzw. fosfoantygeny (np.: pirofosforan izopentynylu,
geranylopirofosforan, farnezylopirofosforan)

Limfocyty NKT
• Są to komórki mające cechy zarówno
limfocytów T, jak i komórek NK.
• Maja TCR zbudowany z łańcuchów αβ, a
część z nich także CD4
• Rozpoznają głównie antygeny
glikolipidowe prezentowane poprzez
CD1
• Biorą udział w odpowiedzi
przeciwnowotworowej i immunoregulacji

Komórki „veto”
• Enigmatyczna subpopulacja komórek, nie
poznano charakterystycznego fenotypu.
• Maja zdolność inaktywowania i zabijania
limfocytów T na drodze bezpośredniego
kontaktu
• Ich działanie odbywa się poprzez
oddziaływania Fas – FasL
• Podobne właściwości mogą przejawiać
keratynocyty, komórki dendrytyczne,
komórki nerwowe i mikrogleju, komórki
nabłonka tarczycy.

Aktywacja limfocytów T
• Limfocyty powstałe w grasicy są limfocytami
dziewiczymi – nie miały kontaktu z antygenem.
• Aby limfocyt T mógł wziąć udział w odpowiedzi
immunologicznej musi rozpoznać swoisty antygen
prezentowany przez komórki prezentujące antygen
w kontekście MHC i zostać w pełni aktywowany.
• Aktywacja limfocytu wiąże się z przejściem z fazy
G0 cyklu komórkowego do fazy G1. Morfologicznie
towarzyszy temu zwiększenie objętości całej
komórki i jądra komórkowego, zmiany jego
chromatyny i pojawienie się jąderek. Zmian te
określamy mianem „transformacji blastycznej”.

Aktywacja limfocytów Th
• Aktywacja limfocytów jest procesem złożonym i
obejmuje:
– wytworzenie synapsy immunologicznej – polaryzacja
limfocytu i adhezja limfocytu i APC
– przekazanie dwóch sygnałów aktywacji limfocytowi
dziewiczemu - poprzez receptor TCR rozpoznający
prezentowany antygen i poprzez CD28 pobudzaną przez
cząstki kostymulujące
– dojrzewanie synapsy immunologicznej
– przekazanie sygnału do wnętrza komórki i jądra komórkowego
– transkrypcję genów związanych z procesem aktywacji i
produkcje białek niezbędnych do aktywacji limfocytu
– wydzielanie cytokin i proliferacje aktywowanego limfocytu –
wytworzenie klony limfocytów rozpoznających i zwalczających
antygen
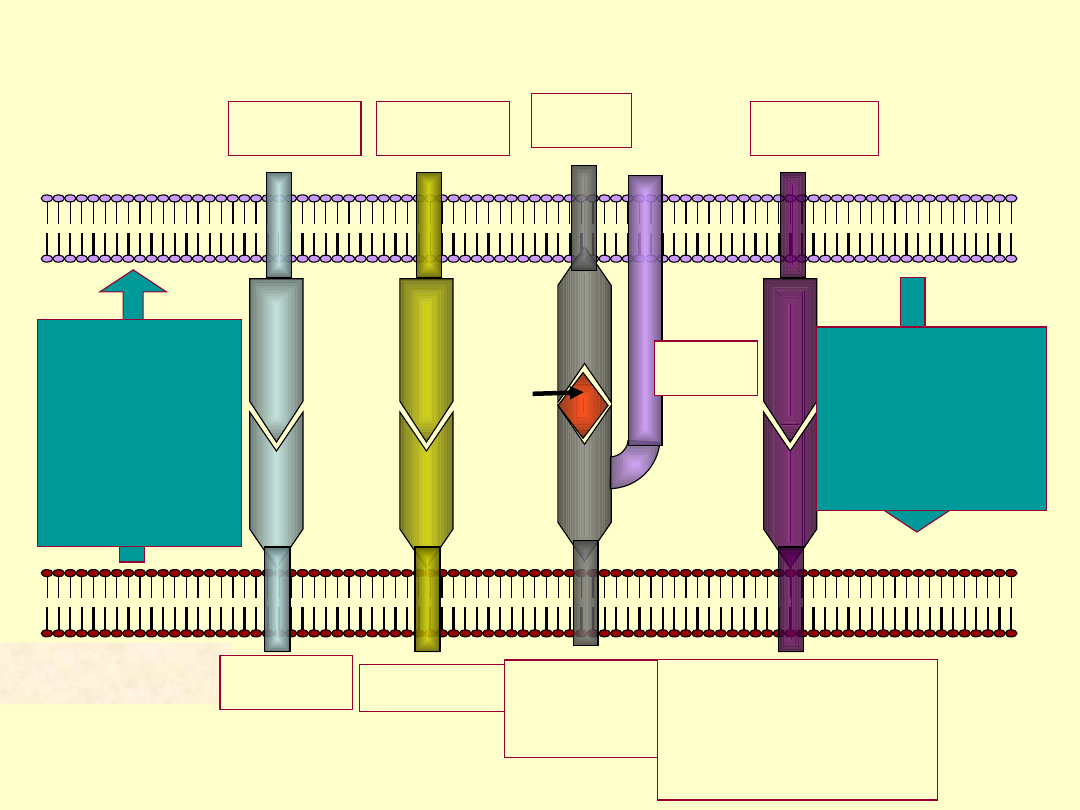
Interakcje pomiędzy limfocytem Th a komórka
prezentującą antygen
APC
LFA-3
LFA-2 LFA-1
TCR
CD4
ICAM-1/2
Class II
MHC
B7-1/B7-2
(CD80/CD86)
B7-3??
CD28
IL-1
IL-6
TNF-alpha
IL-12
IL-15
TNF-beta
IFN-gamma
GM-CSF
IL-4
Limfocy
t T
antygen
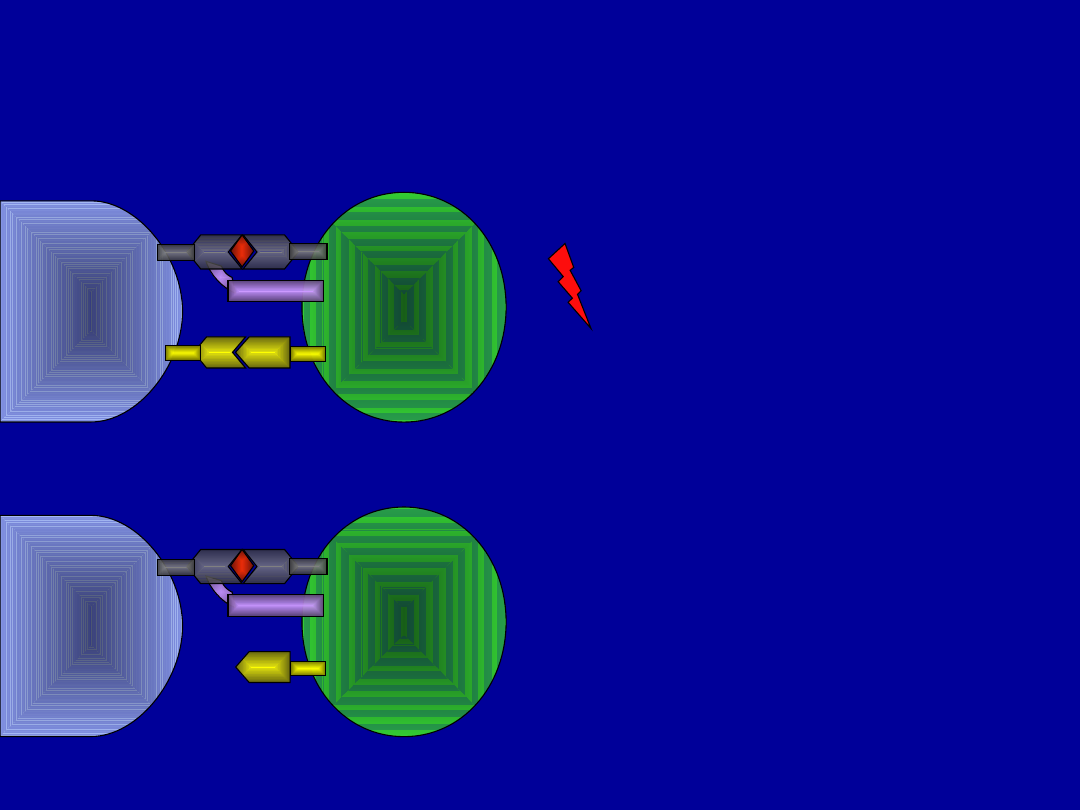
APC
limfocy
t
CD28
TCR
MHC
B7.1/B7
.2
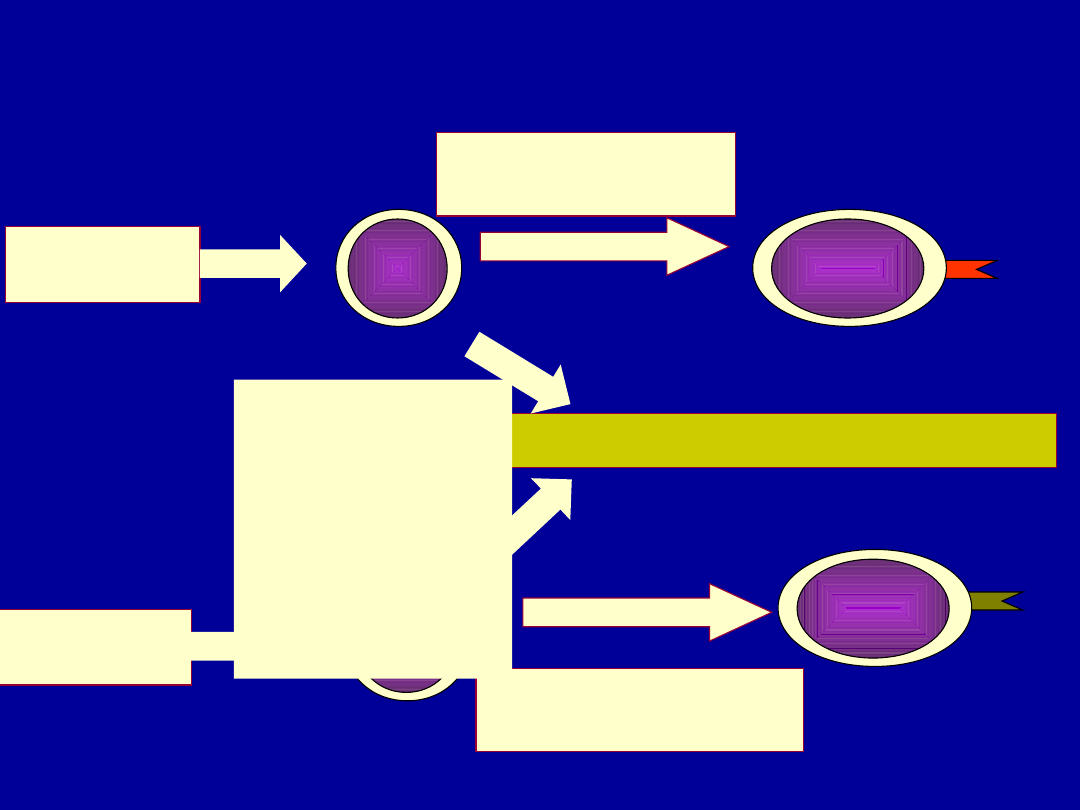
Dwa sygnały – pełna
aktywacja i
odpowiedź
immunologiczna
APC
limfocy
t
CD28
TCR
MHC
Brak drugiego
sygnału – anergia
Teoria „dwóch sygnałów”

Dojrzewanie synapsy immunologicznej
• Aktywacja limfocytu prowadzi do przegrupowań w białkowo-
lipidowych w błonie komórkowej i skupiania się mikrodomen.
• Mikrodomeny są to rejony błony komórkowej wzbogacone w
sfingolipidy i cholesterol, zawierają także białka błonowe ,
odpowiedzialne za przekazanie sygnału aktywującego do wnętrza
komórki np.: kinazy z rodziny Src, podjednostki α białek G, białka
powierzchniowe związane z glikozylofosfatydyloinozytolem.
• Po rozpoznaniu antygenu mikrodomeny skupiają się wokół
kompleksu TCR/CD3.
• W
czasie
dojrzewania
synapsy
immunologicznej
rejony
mikrodomen nie tylko są wzbogacane w białka uczestniczące w
przekazywaniu sygnału do wnętrza komórki, ale także są usuwane
białka zbędne.

Przekazanie sygnału do wnętrza
komórki i jądra komórkowego
• Przekazanie sygnału do wnętrza komórki odbywa się
głownie na drodze fosforylacji białek
– aktywacja niereceptorowych kinaz tyrozynowych
– aktywacja białek adaptorowych i kaskada kinaz MAP
– aktywacja czynników transkrypcyjnych
• Transkrypcja genów związanych z procesem
aktywacji (pierwsze produkty tych genów można
wykryć już po 15 min. od kontaktu z antygenem, a
produkcja kolejnych białek wywołana aktywacją trwa
ok. 20 godzin.
• W aktywowanym limfocycie mamy do czynienia
także z ekspresją cząsteczek, które hamują proces
aktywacji np.: CTLA-4 (CD154). Prowadzi to do
ograniczenia odpowiedzi immunologicznej a potem
jej wygaśnięcia.
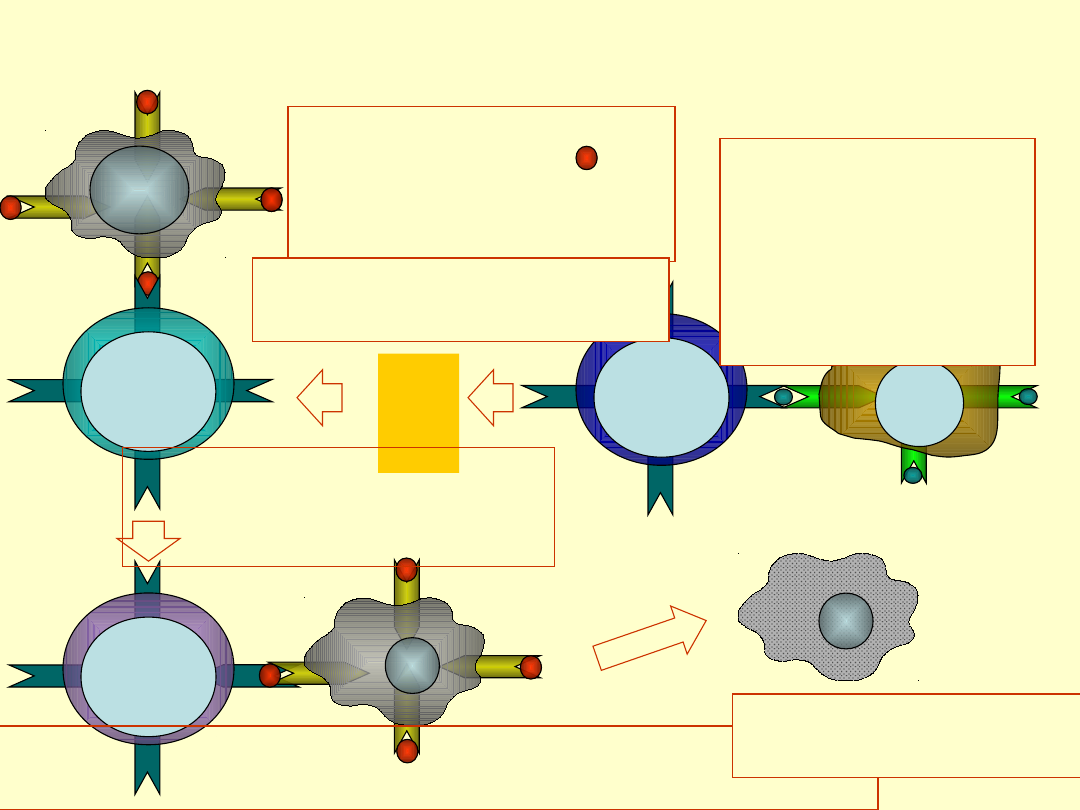
Aktywacja limfocytów Tc
pre-Tc
Tc cell
Th
MHC II
APC
1. Prezentacja
antygenu komórkom
pre-Tc w kontekście
MHC I
IFN
IL-
2
2. APC
prezentuje
antygen
limfocytowi Th w
kontekście MHC
II
3. Th wydziela cytokiny
stymulujące Tc
4. Limfocyt pre-Tc
różnicuje się w pełni
funkcjonalny limfocyt Tc
5. Limfocyt Tc rozpoznaje
antygen w kontekście MHC I na komórkach docelowych
6. Komórka docelowa
jest zabijana

Cytotoksyczność
komórkowa
• Jest to mechanizm obrony głównie przed
patogenami wewnątrzkomórkowymi, bierz
udział także w eliminacji komórek
nowotworowych, niektórych wolno żyjących
bakterii oraz w odrzucaniu przeszczepu
allogenicznego.
• Właściwości cytotoksyczne przejawiają
– limfocyty T (Tc i NKT)
– komórki NK
– komórki K
– makrofagi
– granulocyty

Mechanizmy cytotoksyczności
komórkowej
•
Komórki cytotoksyczne mogą rozpoznawać komórki
docelowe za pomocą:
–
receptora TCR – limfocyty T
–
receptorów wiążących MHC – komórki NK
–
receptora dla fragmentu Fc IgG (FcγRIII, CD16)
•
Istnieją dwa podstawowe mechanizmy cytotoksyczności
wykorzystywane przez limfocyty
–
uwalnianie zawartości ziaren cytolitycznych
–
ekspresja ligandów dla receptorów z nadrodziny TNF
(Apo-1/Fas – CD95, DR4, DR5) znajdujących na
komórkach
docelowych
i
aktywacja
tychże
receptorów
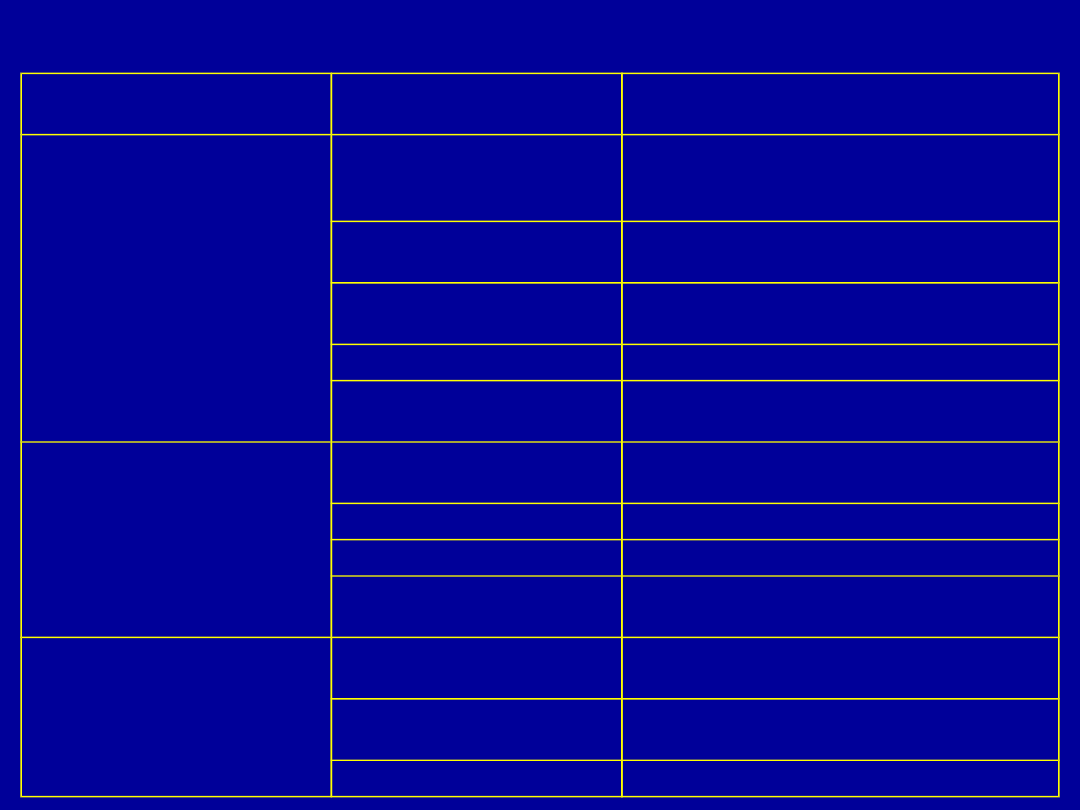
Mechanizmy cytotoksyczności
komórkowej
Mechanizm
cytotoksyczności
Czynnik
Działanie
Związany z ziarnami
cytolitycznymi
perforyna
Tworzenie porów błonie
komórkowej, pośrednio indukuje
apoptozę
granzymy
Liza białek cytoplazamy i jądra
komórkowego, indukcja apoptozy
enzymy lizosomalne
Liza białek cytoplazamy i jądra
komórkowego, indukcja apoptozy
P40-TIA-1
stymulacja degradacji DNA
granulizyna
Uszkadza błony komórkowe,
indukcja apoptozy
Związany z receptorami
z nadrodziny T NF
Apo-1L/FasL (CD95L)
Indukcja apoptozy poprzez Apo-
1/Fas (CD95)
TNF
Indukcja apoptozy przez TNFR1
LT-α
Indukcja apoptozy przez TNFR1
TRAIL
Indukcja apoptozy przez receptory
DR4 i DR5
Inne
Leukoregulina
Uwrażliwianie na działanie innych
czynników cytotoksycznych
ATP
Wzrost przepuszczalności błon
komórkowych, indukcja apoptozy
Wolne rodniki
Uszkodzenie struktur komórki

Etapy reakcji cytotoksycznej
zależnej od ziaren
cytolitycznych
• Rozpoznanie i wiązanie komórki
docelowej przez komórkę
cytotoksyczną Tc
• Aktywacja i polaryzacja komórki
cytotoksycznej
• Uwolnienie zawartości ziaren
cytolitycznych
• Recyrkulacja komórek cytotoksycznych
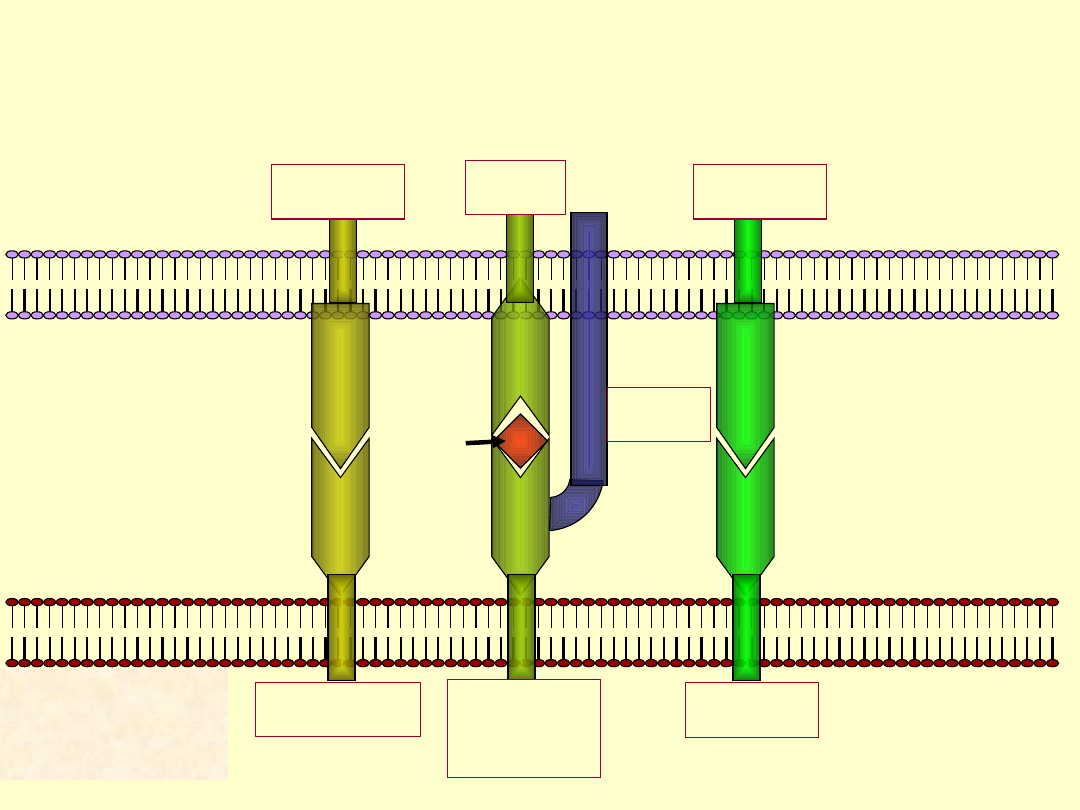
Interakcje pomiędzy limfocytem Tc a komórką
zabijaną
LFA-1
TCR
CD8
ICAM-1
Class I
MHC
LFA-3
LFA-2
Limfocy
t Tc
Komórka
zabijana
pept
ide
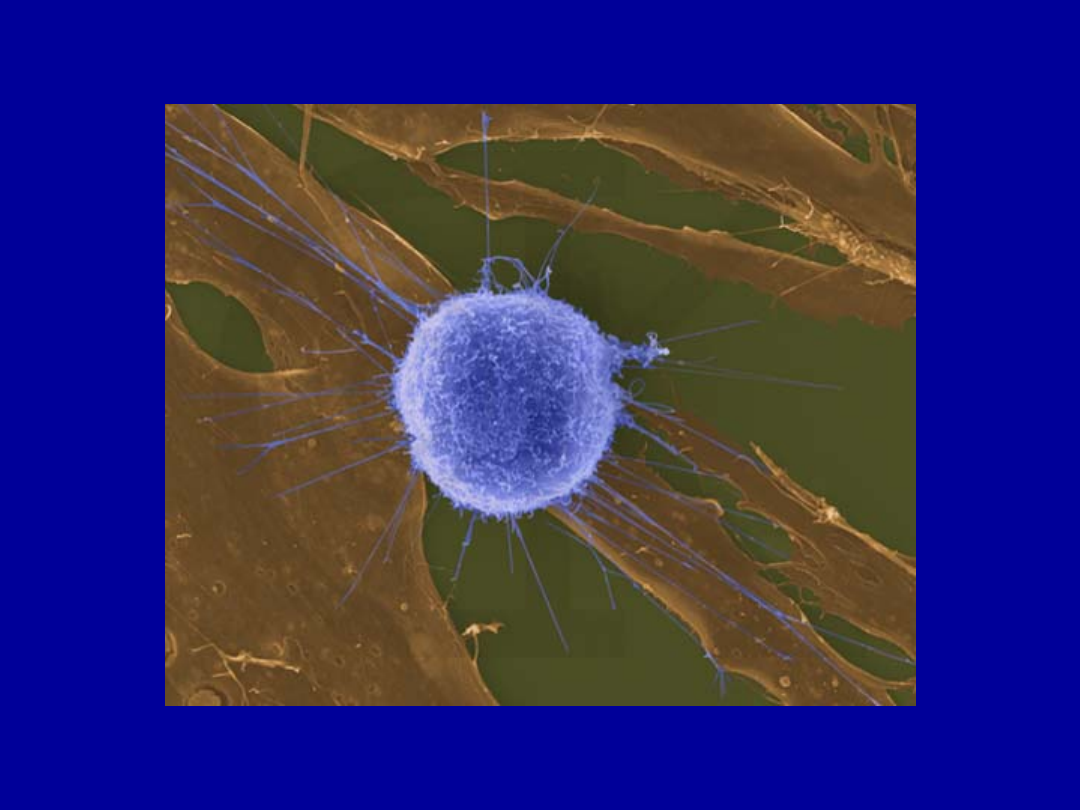
Reakcja cytotoksyczna limfocytu Tc
Tc
cel
l
Ca++
Monom
ery
perfory
ny
Perforyn
a tworzy
polimer
y
Kanały
perforynowe
Tc
ce
ll
Granzymy
Komórka
docelowa
Komórka
docelowa
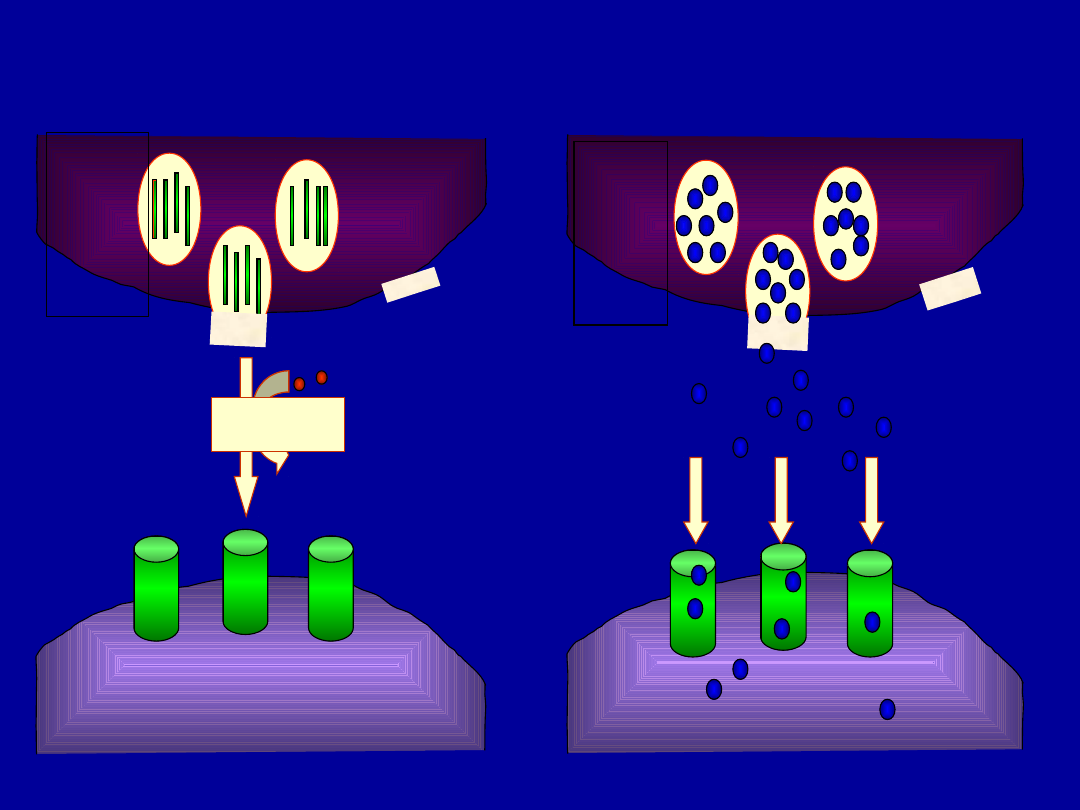
Etapy reakcji cytotoksycznej
Tc
1. Rozpoznanie komórki
docelowej
2. Aktywacja i polaryzacja
komórki cytotksycznej
Tc
3. Uwolnienie zawartości
ziaren cytotoksycznych
Tc
4.
Recyrkulacja
limfocytów
Śmierć komórki
docelowej na drodze
apoptozy

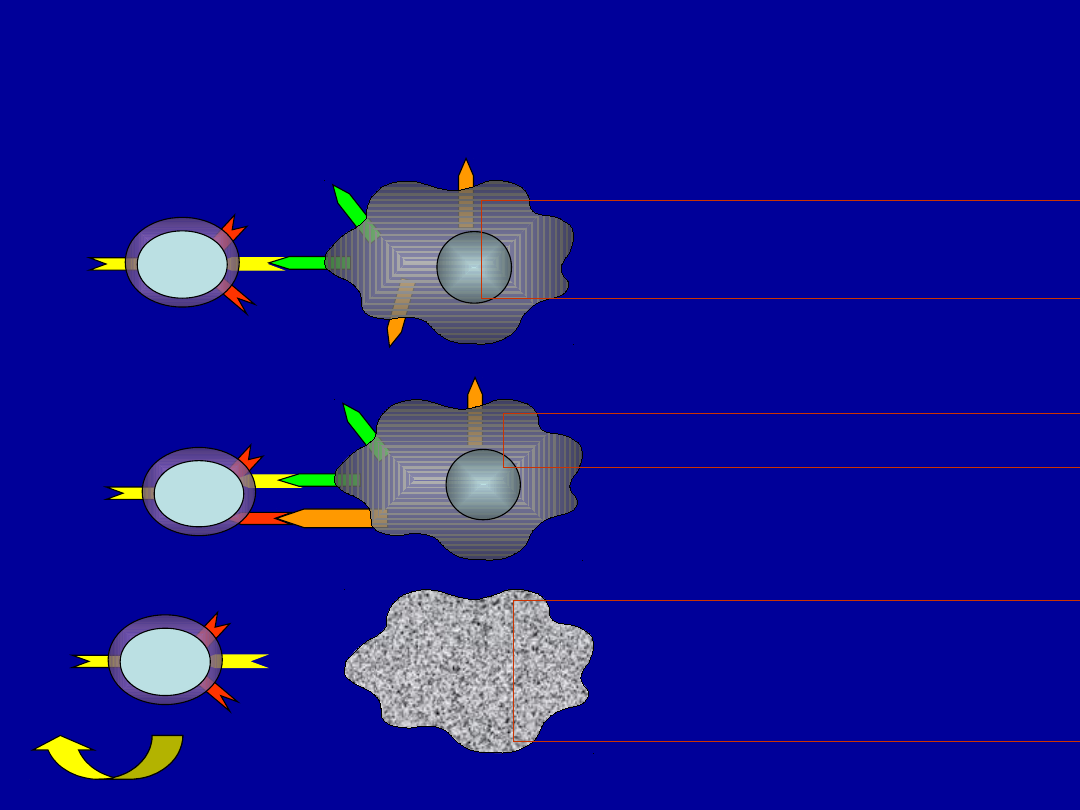
Etapy reakcji cytotoksycznej zależnej
od receptorów z nadrodziny TNF
• Rozpoznanie i wiązanie komórki docelowej
przez komórkę cytotoksyczną Tc
• Interakcje ligandów na komórce cytotoksycznej
z receptorami na komórce docelowej
• Recyrkulacja limfocytów cytotoksycznych
• Komórki cytotoksyczne mogą złuszczać ze swej
powierzchni ligandy dla receptorów. Wolne
ligandy także stymulują apoptozę jednak jest to
zjawisko niespecyficzne – brak etapu
rozpoznanie komorki docelowej.
Tc
Tc
Tc
Etapy reakcji cytotoksycznej zależnej
od receptorów z nadrodziny TNF
1. Rozpoznanie komórki
docelowej
2. Interakcja CD95L z CD95
3. Recyrkulacja limfocytów
cytotoksycznych i śmierć
komórki docelowej

Komórki NK
• Są to duże ziarniste limfocyty (LGL) mające
zdolność spontanicznego (bez wcześniejszego
kontaktu z antygenem) i zabijania komórek
nowotworowych i zakażonych wirusami.
• Proces ten nie podlega restrykcji MHC
• Prawdopodobnie uczestniczą także w procesie
immunoregulacji.
• Stanowią ok. 10% limfocytów krwi obwodowej
człowieka i są pochodzenia szpikowego.
• Główną cytokiną stymulującą ich aktywność jest
IL-2, ale także IL-12, IL-15, IL-21. Hamująco na
komorki NK działają PGE2, TGF-β, kortyzol, PDGF

Komórki NK
• Morfologia komórek NK
– liczne azurofilne ziarnistości cytoplazmatyczne
– niska wartość stosunku powierzchni jadra do
powierzchni cytoplazmy (ok. 0,6)
– nerkowate jądro z heterogenną cytoplazmą i
jąderkiem
– liczne mikrokosmki i pofałdowania błony
komórkowej
• Immunofenotypowo komórki NK możemy
scharakteryzować jako CD3-/CD16+/CD56+
(+/-)

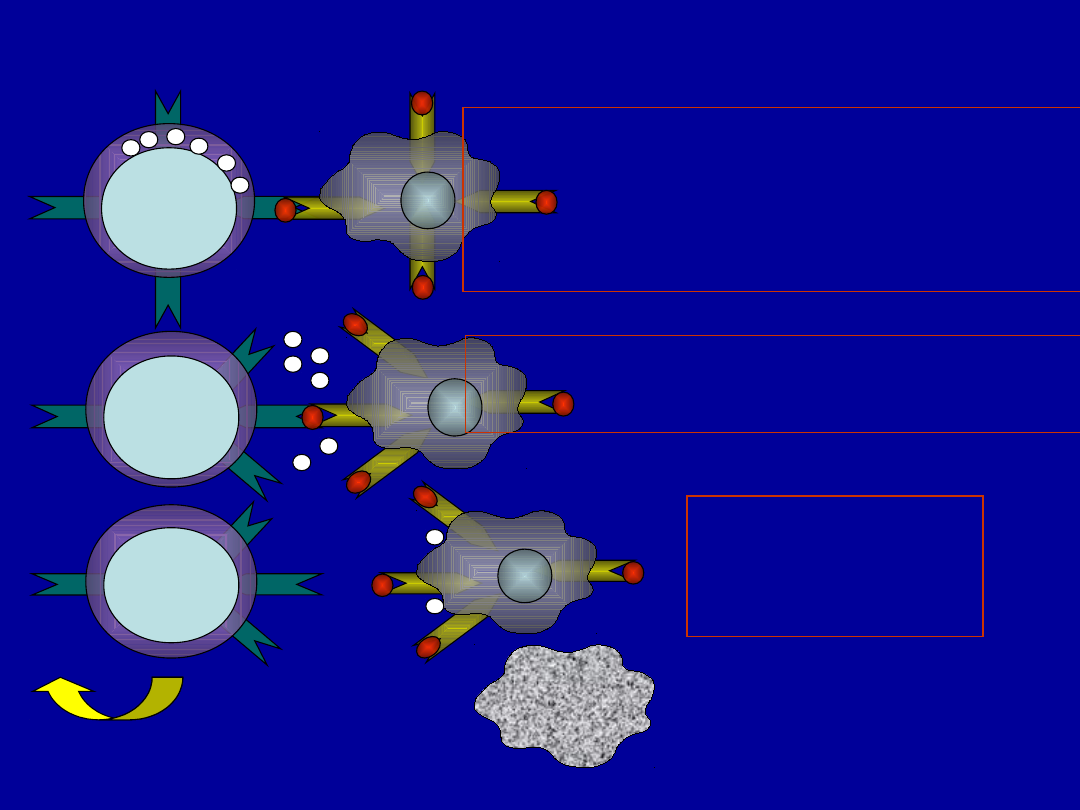
Zjawisko cytotoksyczności zależnej od
przeciwciał (ADCC)
• biorą w niej udział komórki posiadające na
swej powierzchni receptory dla fragmentu Fc
immunoglobulin (głównie IgG, ale także IgE w
przypadku odpowiedzi przeciwko pasożytom)
• mogą w niej brac udział komorki NK,
limfocyty T, monocyty, makrofagi, neutrofile
eozynofile, trombocyty
• dawny termin „komórki K” obecnie stosuję
się dla określenie komórek limfoidalnych
biorących udział w ADCC – komórki NK i
limfocyty CD3+/CD16+
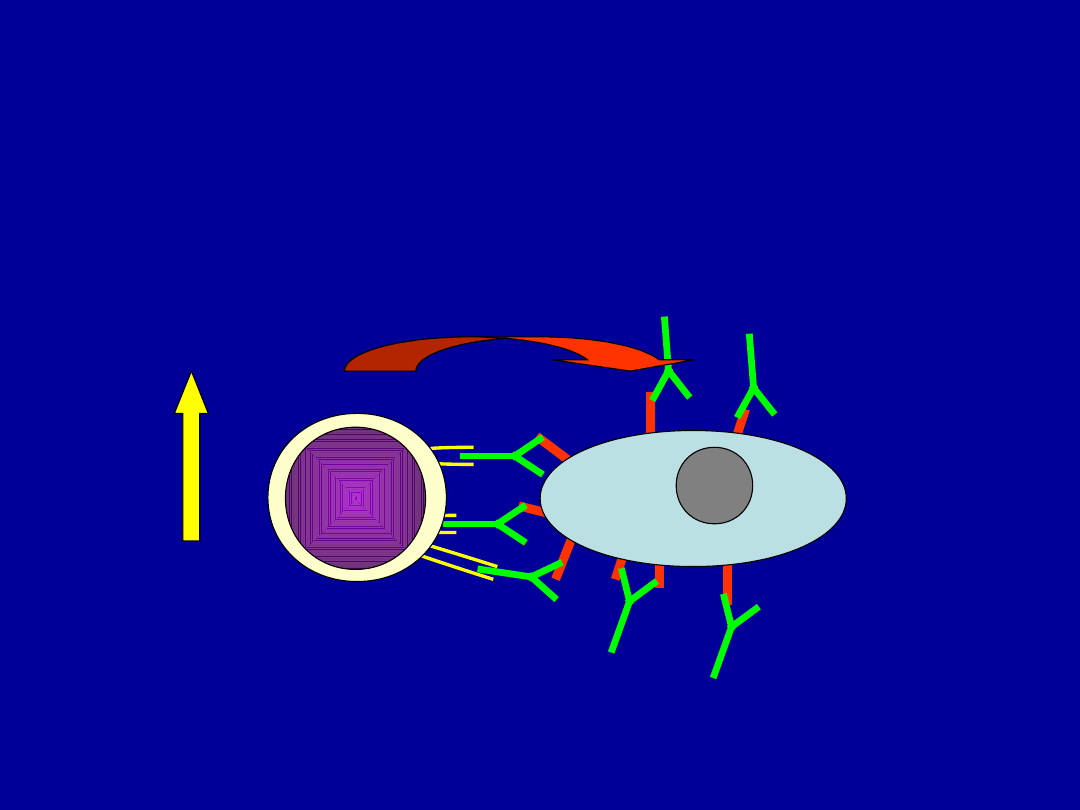
Komórka K
Komórka K zabija
komórkę
spłaszczoną
przeciwciałami
Zjawisko cytotoksyczności zależnej od
przeciwciał (ADCC)
IL-2
GM-CSF
IFN-γ

Komórki LAK
• Jest
heterogenna
grupa
limfocytów
aktywowanych in vitro cytokinami (IL-2),
wykazująca duża aktywnośc cytotoksyczna
wobec autologicznych komórek nowtoworowych
• Można
wśród
nich
wyróżnić
frakcję
charakteryzującą się zdolnością przylegania do
plastikowych powierzchni
Komórki TIL
• Jest
heterogenna
grupa
limfocytów
wyizolowanych z guza nowotworowego, zdolna
do zabijana autologicznych i allologicznych
komórek nowotworowych.


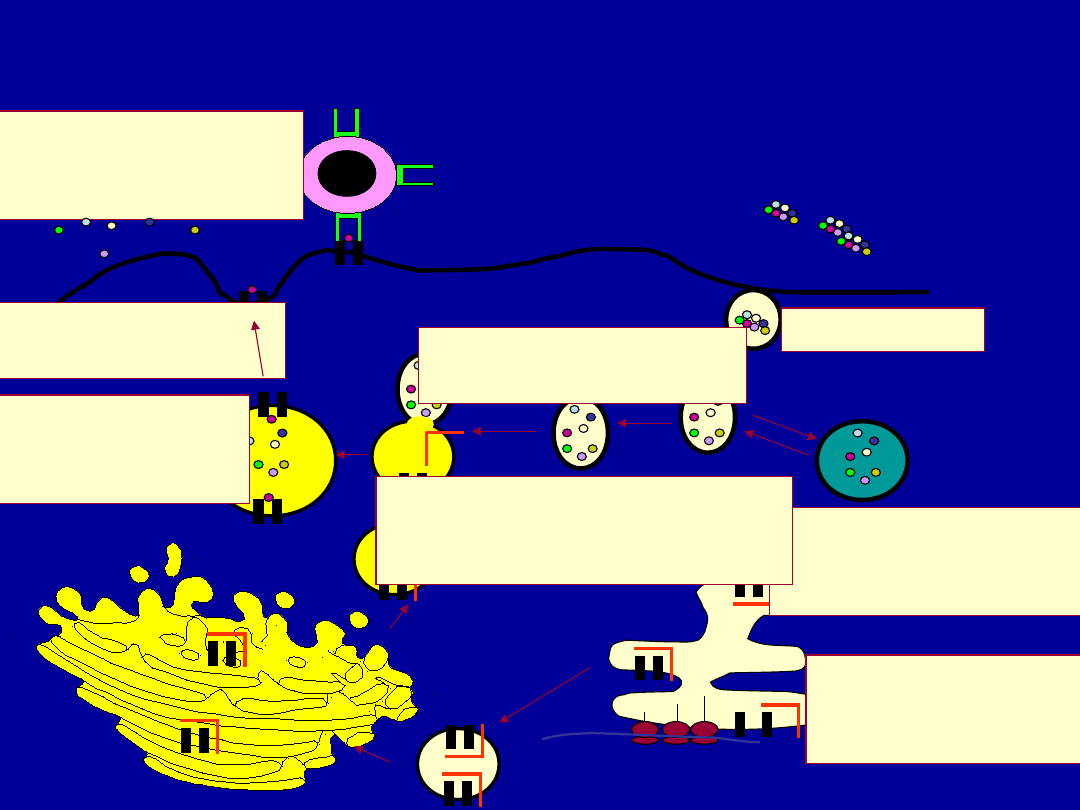
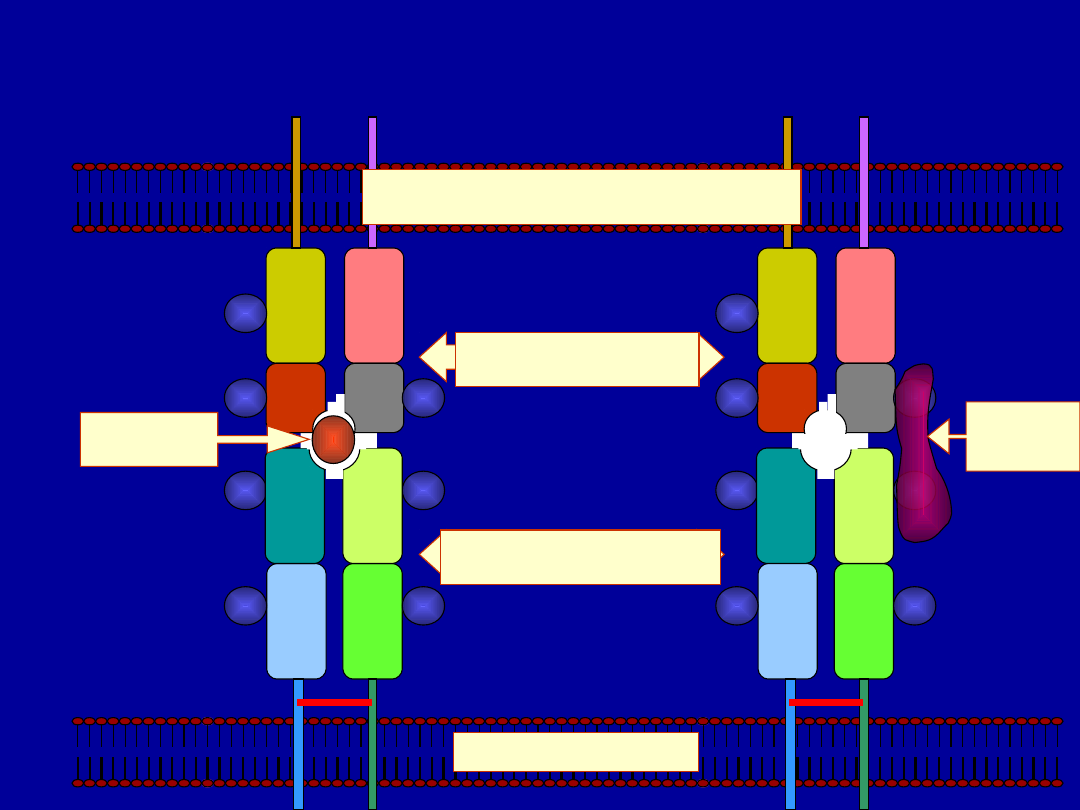
Class II MHC Pathway
Globu
lar
protei
n
Endocytosis
Protein is processed to
peptides in endosome
or lysosome
Endosome
Lysosome
Fusion of endosome
and exocytic vesicle
Endoplasmic reticulum
Class II MHC
Synthesis
3 chains: α,β and Ii
Golgi
Body
Exocytic vesicle fuses
with endosome
releasing Ii from αβ dimer
α
β
Ii
Immunodominant
peptide binds
to class II MHC
Endosome fuses with
plasma membrane
Peptide MHC-II
complex is presented
to CD4 helper T cell
CD4 helper T cell
Conventional Antigen
αC βC
CHO
CHO
CHO
CHO
βV
αV
α2 β2
β1
α1
CHO
CHO
CHO
αC βC
CHO
CHO
CHO
CHO
βV
αV
α2 β2
β1
α1
CHO
CHO
CHO
MHC Class II
T cell receptor
Antigen
Super
antigen
T lymphocyte
Antigen presenting cell
Superantigen
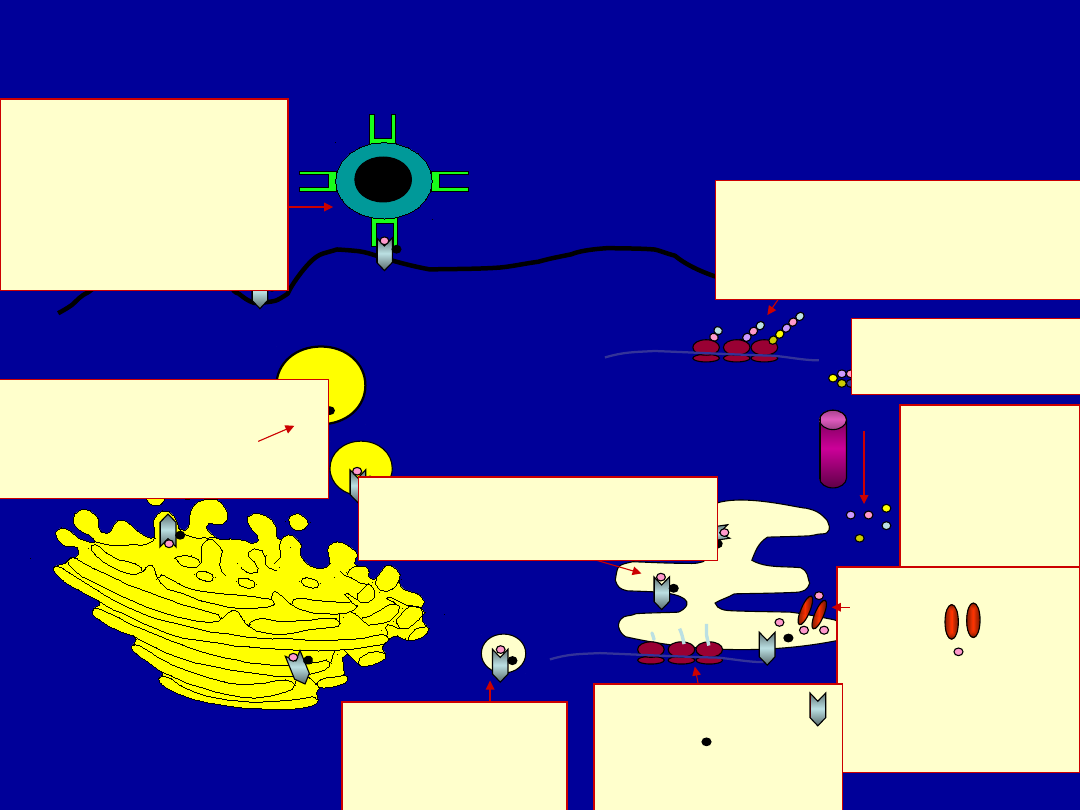
Class I MHC Pathway
Viral protein is made
on
cytoplasmic
ribosomes
Plasma membrane
Proteaso
me
degrades
protein
to
peptides
Peptide
transporter
protein
moves
peptide into
ER
MHC class I
alpha
and beta
proteins
are made on
the rER
Peptide associates
with MHC-I complex
Peptide with
MHC
goes to Golgi
body
Peptide passes
with MHC from Golgi
body to surface
Peptide is
presented
by MHC-I to
CD8
cytotoxic T cell
Golgi body
rER
Globular viral
protein - intact
Critical Role of Th Cells in
Specific Immunity
• Select effector mechanisms
• Induce proliferation in appropriate
effectors
• Enhance functional activities of
effectors
APC
T
h
cell
B cell
Tc
cell
NK
Ag
Ag
Ag
NK cell
Cytokines
Granulocyte
Granulocyte
Macrophage
Macrophage
Cytokines
Antigen-presenting cell
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
Wyszukiwarka
Podobne podstrony:
limfocyty T2003
limfocyty id 268478 Nieznany
Ćw 03c Izolacja limfocytów ze śledziony oraz określanie żywotności komórek
10 dojrzewanie limfoc
Limfocyty T
antygeny trichopyton wplyw na transformacje blastyczna limfocytow
3a Limfocyty
notatki gołąb, 12. Krążenie limfocytów, Immunologia rozrodu
Limfocyty regulatorowe w chorobach autoimmunologicznych, Limfocyty regulatorowe w chorobach autoimmu
immunology & microbiology, LIMFOCYTY Th1 I Th2, LIMFOCYTY Th1 I Th2
Białaczki limfocytowe
Ćw 06b Prezentacja antygenu limfocytom T Połączenie asocjatywne
notatki gołąb, 11. Populacje i subpopulacje limfocytów, Immunologia rozrodu
PREZENTACJA BUDOWA I FUNKCJE LIMFOCYTÓW B i T
Defekt limfocytów B
niedobory limfocytów B
Rola grasicy w powstawaniu limfocytów T, nowotwory grasicy
Limfocyty T
więcej podobnych podstron