
1
Analiza
chemioterapeutyków
Analiza antybiotyków

2
Podział antybiotyków
I. Antybiotyki β-laktamowe
1. pochodne penamu – penicyliny
a. penicyliny naturalne
b. penicyliny półsyntetyczne
- izoksazolowe
- karboksypenicyliny
- aminopenicyliny
- penicyliny amidynowe
2. pochodne cefalosporyny (I, II, III, IV generacja)
3. pochodne karbapenemu
4. monobaktamy
II. Antybiotyki hamujące biosyntezę białka
1. antybiotyki aminoglikozydowe
2. tetracykliny
3. chloramfenikol i jego pochodne
4. antybiotyki makrolidowe
5. linkozamidy
III. Antybiotyki peptydowe
1. cykliczne antybiotyki peptydowe
2. glikopeptydy
3
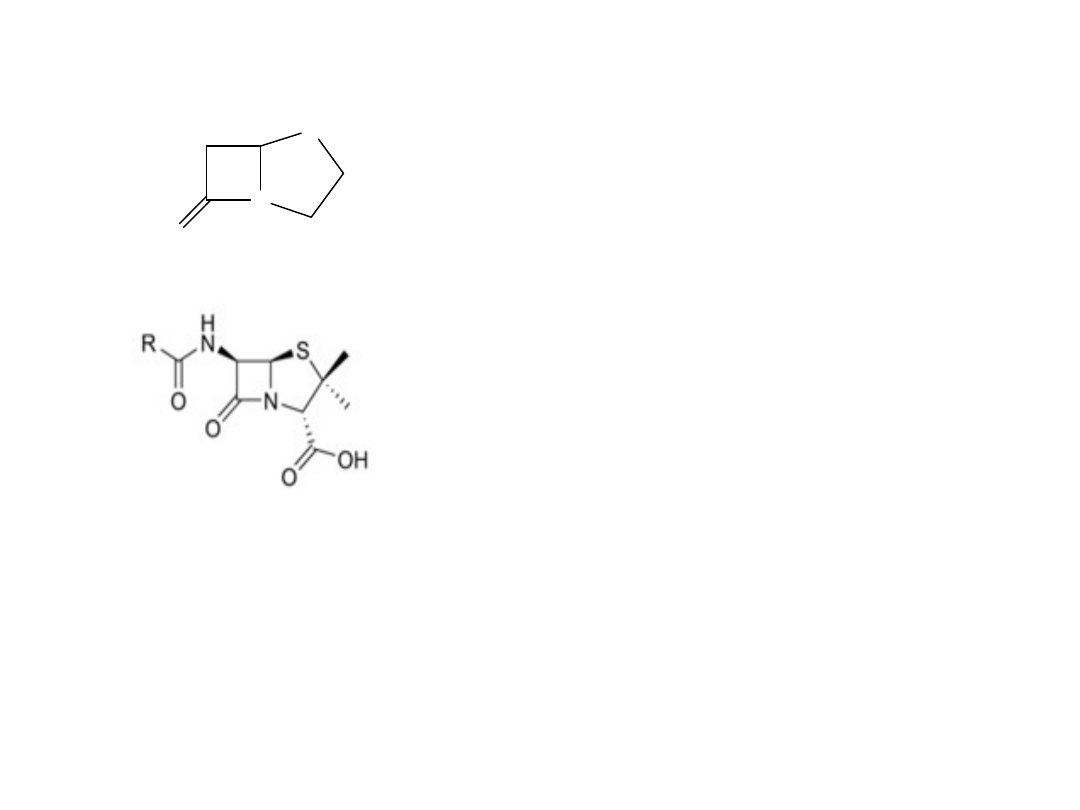
Antybiotyki β-laktamowe – pochodne penamu (penicyliny)
penam
4-Tia-1-azabicyklo[3.2.0]heptan-7-on
N
S
O
1
2
3
4
5
6
7
Acylowe i amidynowe pochodne
kwasu 6-aminopenicylanowego
(6-AC)
4
N
S
HOOC
CH
3
H
3
C
O
NHCOR
3
NH
S
HOOC
CH
3
H
3
C
O
NHCOR
3
NHOH
3 (NH
2
OH)Cl, 6 NaOH
3 NaCl, 6 H
2
O
+ FeCl
3
- NaCl
NH
S
HOOC
CH
3
H
3
C
O
NHCOR
NHO
3
Fe
3+
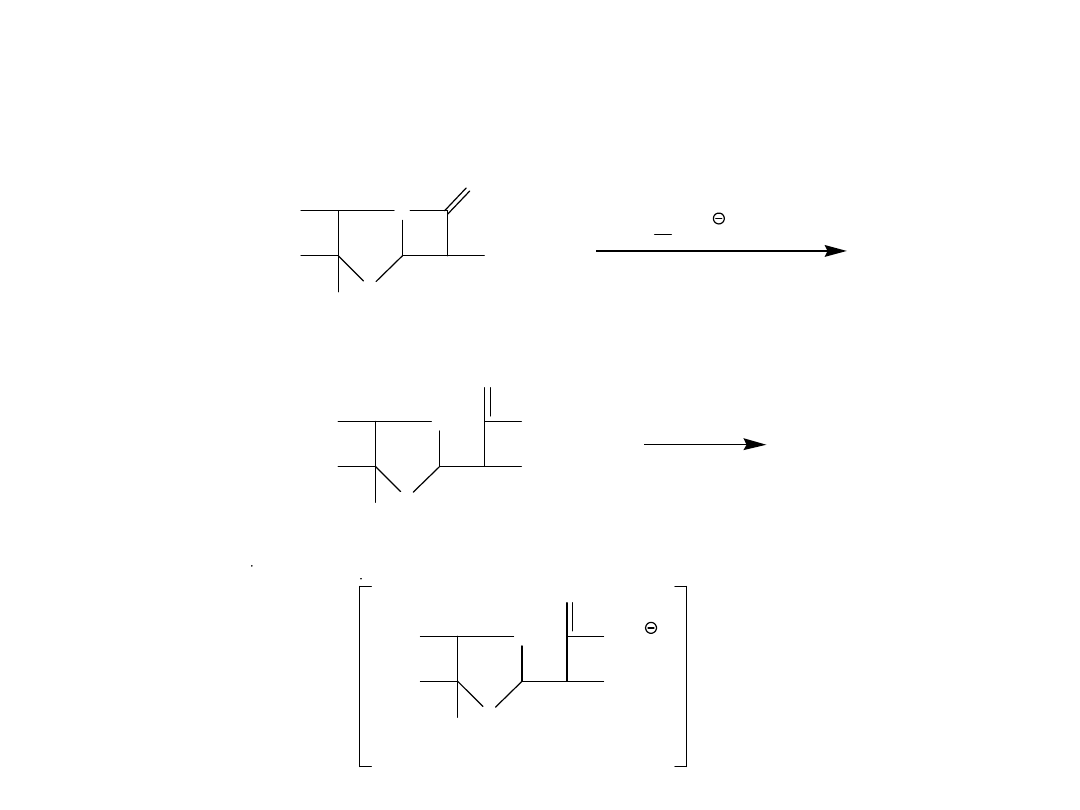
1. Reakcja penicylin z chlorowodorkiem hydroksyloaminy
Kwas hydroksyamowy
Reakcje tożsamościowe dla penicylin
5
N
S
COOH
CH
3
CH
3
O
ROCHN
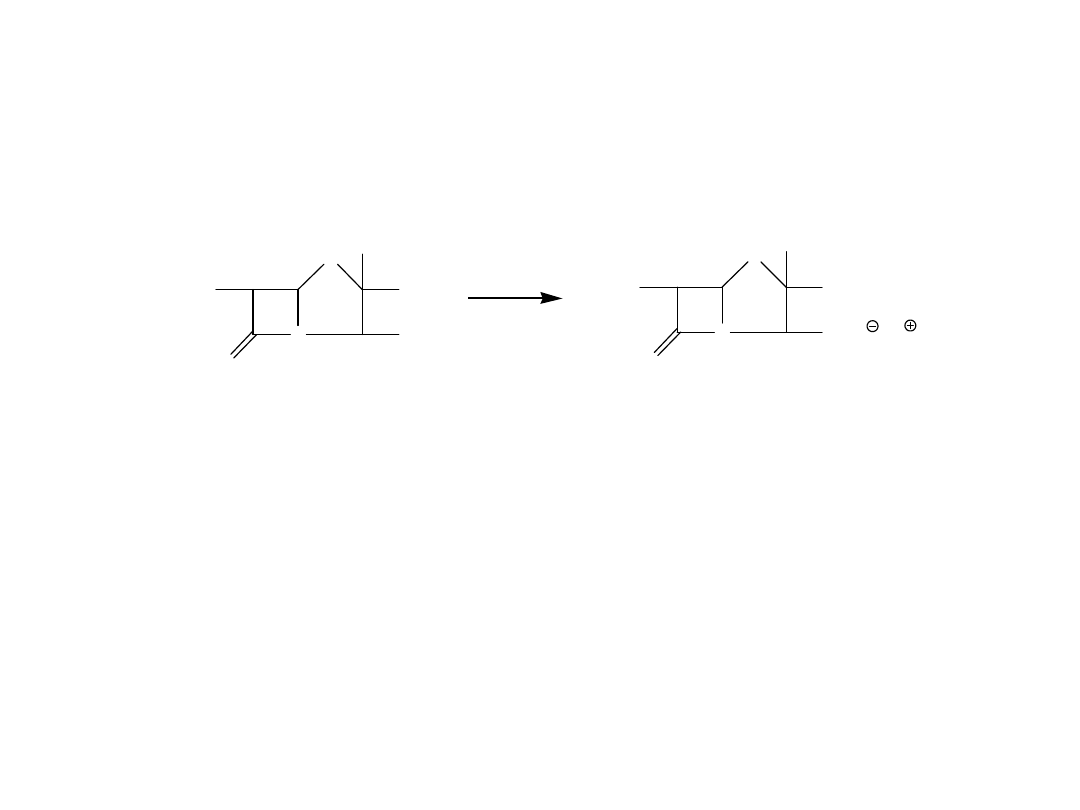
NaOH
N
S
COO
CH
3
CH
3
O
ROCHN
Na
Reakcja penicylin z zasadami
6
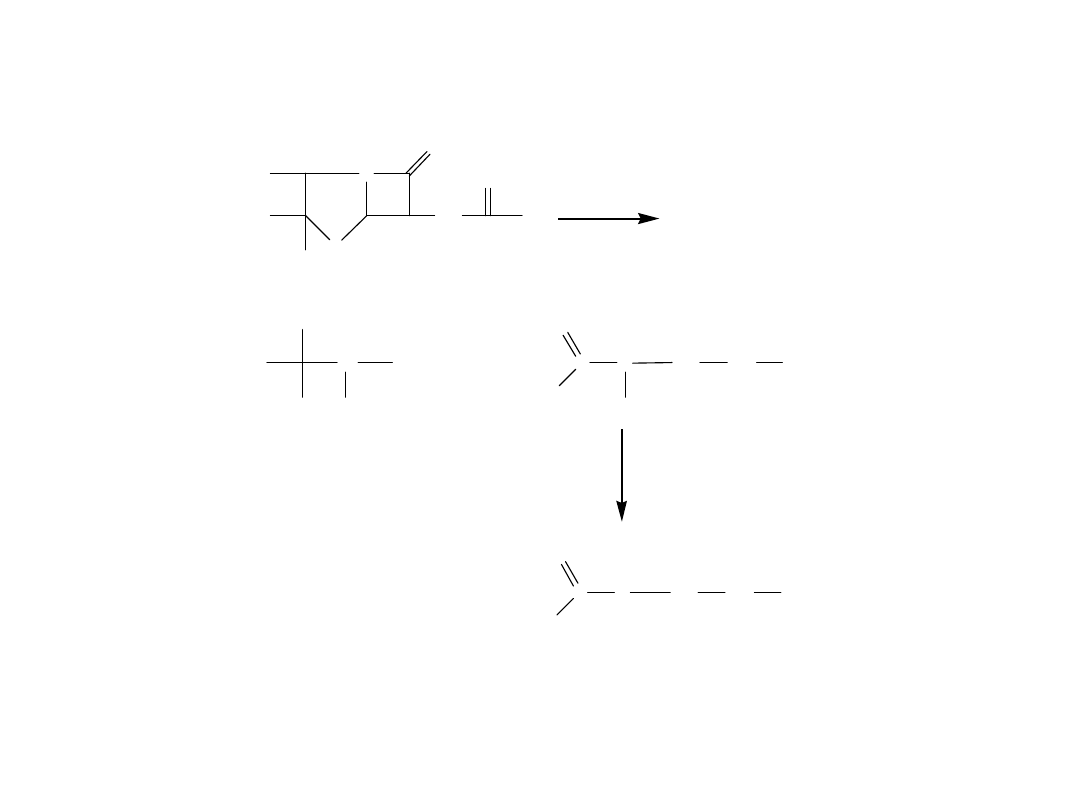
Hydroliza penicylin pod wpływem kwasów mineralnych
Roztwór po hydrolizie daje reakcje charakterystyczne dla aldehydów i aminokwasów
N
S
HOOC
CH
3
H
3
C
O
NH
O
R
+ H
2
O/H
+
H
3
C
CH
3
SH
CH
2
COOH
NH
2
+
C
O
H
H
C
NH
CO
- CO
2
R
COOH
C
O
H
H
2
C
NH
CO
R
penicylamina
kwas penaldowy
aldehyd penilowy
7
Kondensacja penicylin z fenolami
W wyniku rozkładu penicylin powstaje aldehyd penilowy, który ulega reakcji
kondensacji z fenolami
2-naftol w reakcji z penicylinami daje zielone zabarwienie
OH
HO
+
O
H
CH
2
NH
O
R
CH
3
NH
O
R
2
H
+
/ [O]
- 3 H
2
O
O
HO
O

8
Próba na siarkę organicznie związaną
50 g substancji rozpuścić w 2 ml 15% roztworu NaOH, dodać 0,5 ml
10% roztworu
octanu ołowiu (II) i ogrzać; powstaje brunatne zabarwienie, a po
ochłodzeniu
brunatny osad.
S
2-
+ Pb(CH
3
COOH)
2
= PbS + 2 CH
3
COO
-
9
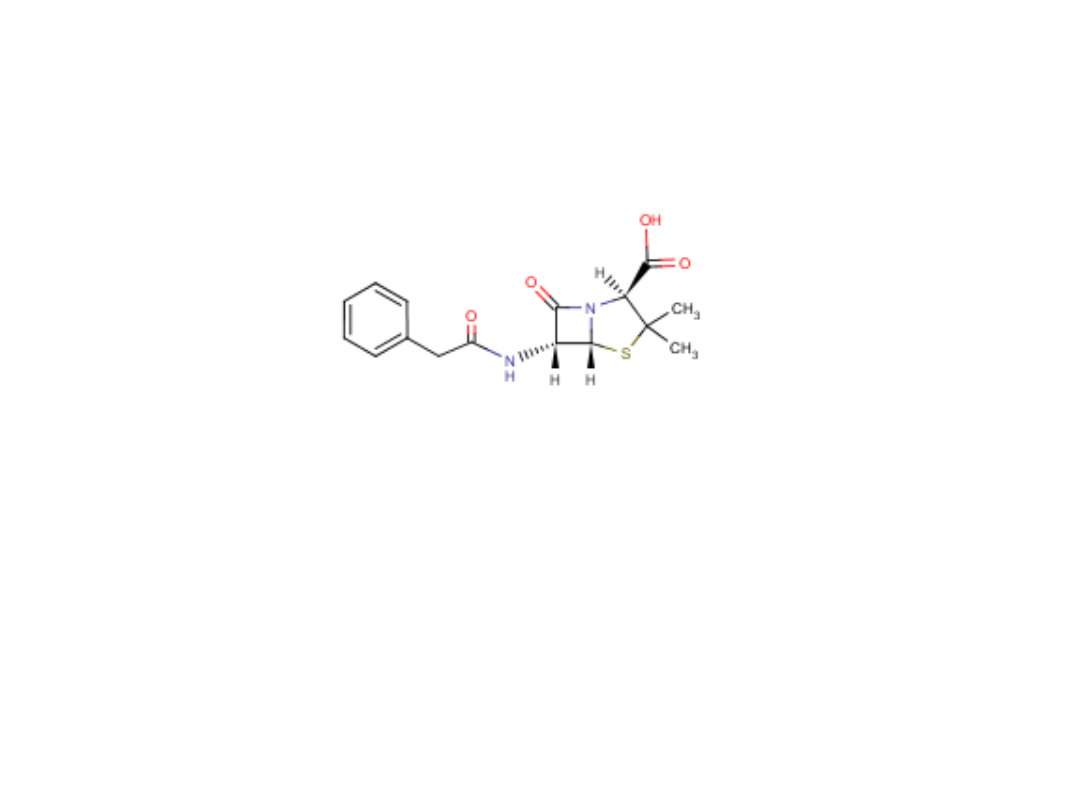
Penicylina G
Benzylopenicylina potasowa, sodowa
Benzylpenicillinum kalium, natrium
Zastosowanie: zapalenie opon mózgowych, choroby dróg oddechowych, ropne choroby jamy
ustnej, zapalenie wsierdzia, posocznica, choroba reumatyczna, różyca, kiła, rzeżączka
Działanie: przeciwbakteryjne (Gram-dodatnie, ziarenkowce Gram-ujemne, krętki)
Mechanizm działania: penicyliny blokują ostatni etap syntezy ściany komórkowej bakterii
(reakcja transpeptydowania)

10
Analiza jakościowa:
1. Reakcje charakterystyczne dla penicylin
2. Penicyliny dają charakterystyczne zabarwienie płomienia; żółty dla soli sodowej
i fiołkowy dla soli potasowej
3. Penicylina benzylowa tworzy sól z N-etylopiperydyną o temp. top. 152-154
0
C,
trudno rozpuszczalna w mieszaninie bezwodnego acetonu i bezwodnego
octanu amylu
11
Analiza ilościowa:
1. Metoda jodometryczna
N
S
C
CH
3
H
3
C
O
NH
O
CH
2
O
HO
C
6
H
5
KOH
HOH
NH
H
C
S
C
CH
3
H
3
C
NH
O
CH
2
O
HO
C
6
H
5
C
O
OH
HCl
2 HOH
HO
O
CH
NH
2
C
CH
3
SH
H
3
C
+
C
6
H
5
H
2
C
C
NH
O
CH
C
C
O
OH
O
H
+
2 KCl
kwas penicylonowy
penicylamina
kwas penaldowy
12
HO
O
CH
NH
2
C
CH
3
SH
H
3
C
+
C
6
H
5
H
2
C
C
NH
O
CH
C
C
O
OH
O
H
3 I
2
I
2
HO
O
CH
NH
2
C
CH
3
SO
3
H
H
3
C
C
6
H
5
H
2
C
C
NH
O
CH
C
C
O
OH
O
OH
+
kwas penicyloaminosulfonowy
kwas fenyloacetyloaminomalonowy
Gramorównoważnik = 1/8 gramocząsteczki
Przebieg reakcji zależy od pH środowiska, dlatego konieczny jest bufor
penicylamina
kwas penaldowy

13
Penicyliny nie utleniają się pod wpływem jodu.
W oznaczeniu wykonuje się równoległe oznaczenie jodometryczne próby hydro-
lizowanej i niehydrolizowanej (tzw. ślepa próba).
Umożliwia ona ustalenie, czy i jaka ilość penicyliny uległa hydrolizie w czasie
przechowywania.
Nadmiar jodu, który nie brał udziału w reakcji utleniania, oznacza się mianowanym
roztworem tiosiarczanu sodu
W obliczeniach uwzględnia się różnicę objętości Na
2
S
2
O
3
zużytą w analizie próbki
niehydrolizowanej i hydrolizowanej
I
2
+ 2 S
2
O
3
2-
= 2 I
-
+ S
4
O
6
2-

14
2. Metoda grawimetryczna
Penicylina benzylowa tworzy z N-etylopiperydyną sól trudno
rozpuszczalną
w mieszaninie bezwodnego acetonu i bezwodnego octanu
amylu.
1 g osadu odpowiada 0,8322 g benzylopenicyliny potasowej
1 g osadu odpowiada 0,7692 g benzylopenicyliny sodowej
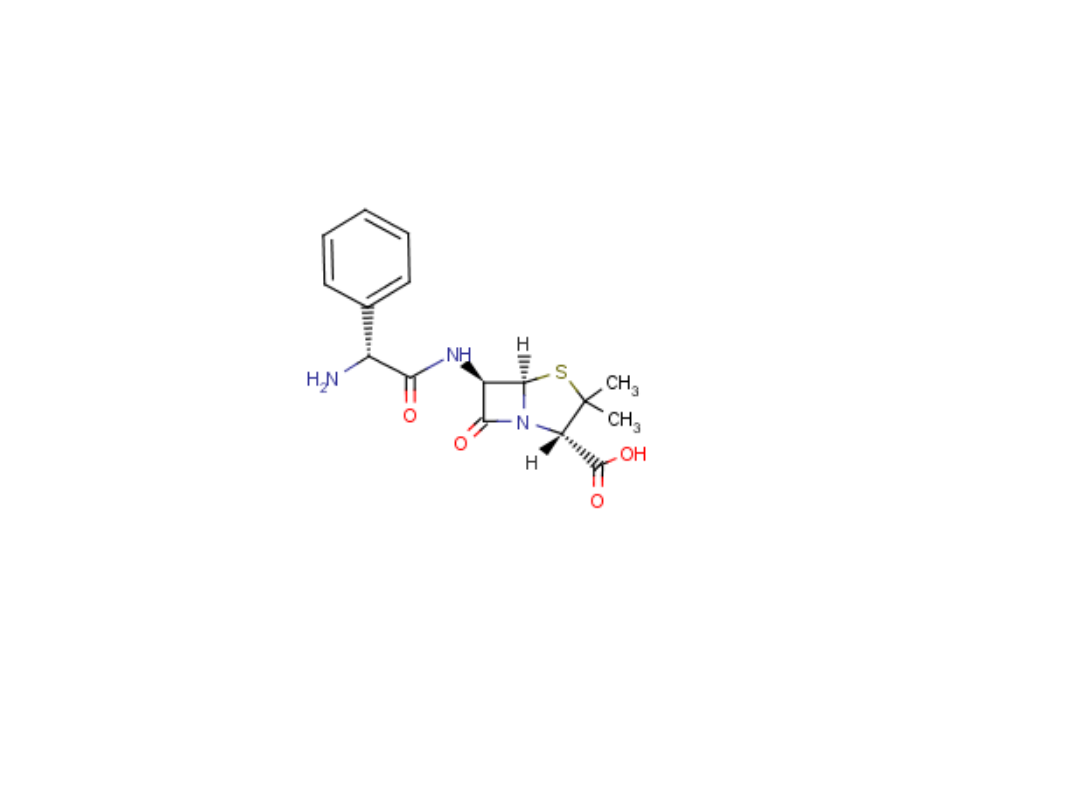
15
Benzylopenicylina prokainowa
Benzylpenicillinum procainum
Sól prokainowa penicyliny G
Zastosowanie: paciorkowcowe zapalenie płuc
N
S
O
HN
O
CH
3
CH
3
COOH
H
2
N
O
O
(CH
2
)
2
N
C
2
H
5
C
2
H
5
*

16
Analiza jakościowa:
1. Reakcja z chlorowodorkiem hydroksyloaminy
2. Reakcja diazowania i sprzęgania prokainy z β-naftolem
ok. 0,2 g substancji rozpuścić w 25 ml wody, przesączyć. Do
przesączu
dodać 0,2 ml 10% HCl, następnie 1 ml 1% roztworu NaNO
2
, po
czym dodać
5 ml 15% NaOH i 5 ml alkalicznego roztworu β-naftolu; powstaje
szkarłatnoczerwony osad.
Analiza ilościowa:
1. Metoda jodometryczna
gramorównoważnik = 1/8 gramocząsteczki
benzylopenicylina prokainowa trudno rozpuszcza się w wodzie,
dlatego w metodzie jodometrycznej jako rozpuszczalnik stosujemy
wodę i metanol
2. Metoda grawimetryczna
1 g osadu odpowiada 1,315 g benzylopenicyliny
prokainowej
17
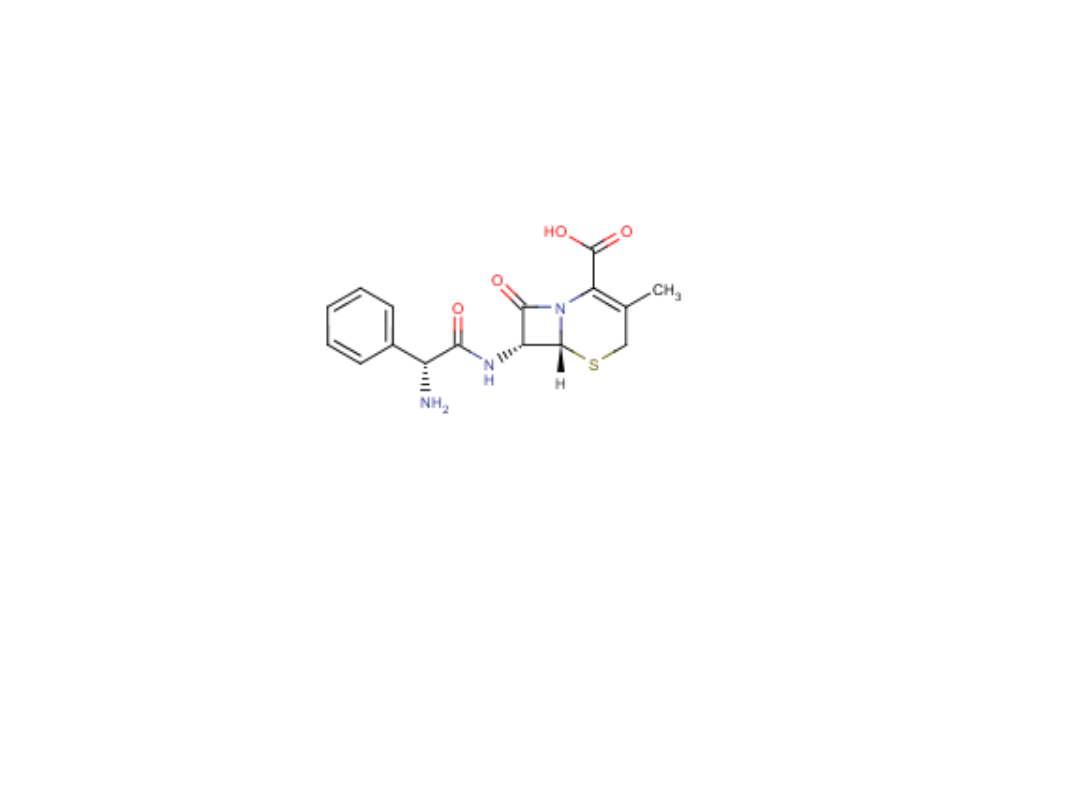
Ampicylina
Ampicillinum
D(-)-α-aminobenzylopenicylina
Syn. Binotal
Zastosowanie: w zakażeniach przewodu pokarmowego (pęcherzyka żółciowego i dróg
żółciowych), dróg moczowych i oddechowych, zakażenia skóry
18
Analiza jakościowa:
1. Ampicilina daje pozytywne reakcje opisane dla penicylin
2. Reakcja z ninhydryną – powstaje fioletowe zabarwienie
C
H
R
NH
2
[O]
ninhydryna
C
O
H
+
NH
3
O
OH
OH
O
+
NH
3
O
HO
H
O
+
- 3 H
2
O
OH
O
N
O
O
produkt o fioletowym zabarwieniu
forma zredukowana ninhydryny
ninhydryna
19
Antybiotyki β-laktamowe – pochodne cefemu
(cefalosporyny)
N
S
O
1
2
3
4
5
6
7
8
N
S
O
O
O
R
4
R
2
R
3
N
H
O
R
1
Δ2-cefem
4-tia-1-azabicyklo-[4.2.0]-oktan-8-on
Ogólny wzór pochodnych cefemu
S = C karbacefemy
S = O oksacefemy
R
1
= warunkuje aktywność przeciwbakteryjną
R
2
= wpływa na aktywność, farmakokinetykę
i trwałość metaboliczną
R
3
= chroni ugrupowanie β-laktamowe przed
działaniem β-laktamaz
R
4
= zwiększa lipofilność pochodnych, co
wpływa korzystnie na ich biodostępność
20
Cefaleksyna
Cefalexinum
Syn. Keflex
Cefalosporyna I generacji
Zastosowanie: w zakażeniach wywołanych pałeczką zapalenia płuc, w
zakażeniach
dróg moczowych, w przypadku uczuleń na penicyliny i w zakażeniach
opornych na penicyliny
Mechanizm działania: hamują biosyntezę ściany komórkowej

21
Analiza jakościowa:
1. Zmieszać 20 mg substancji z 0,25 ml kwasu octowego (10 g/l), dodać 0,1 ml
roztworu siarczanu miedzi (II) (10 g/l) i 0,05 ml roztworu NaOH (80 g/l);
powstaje jasnozielone zabarwienie.
2. Próba na siarkę organicznie związaną:
50 mg substancji rozpuścić w 2 ml 15% roztworu NaOH, dodać 0,5 ml 10%
roztworu octanu ołowiu (II); powstaje brunatne zabarwienie, a po upływie
1 min powstaje brunatny osad.
Analiza ilościowa:
1. Metoda jodometryczna

22
Antybiotyki hamujące biosyntezę białka
I. Antybiotyki aminoglikozydowe
II. Tetracykliny
III. Chloramfenikol i jego pochodne
IV. Antybiotyki makrolidowe
V. Linkozamidy
VI. Pochodne oksazolidynonu
VII. Inne antybiotyki
23
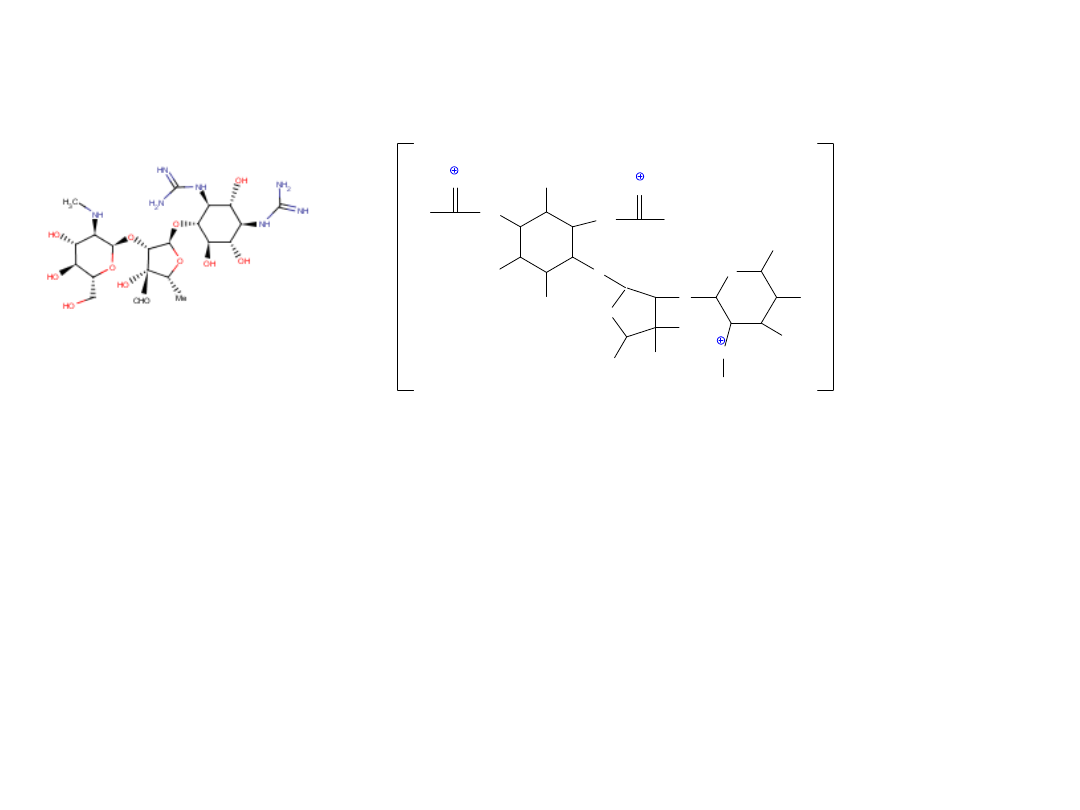
Streptomycyny siarczan
Streptomycinum sulfuricum
H
2
N
NH
2
NH
HO
OH
NH
O
OH
NH
2
NH
2
O
H
3
C
O
OH
CHO
O
CH
2
OH
OH
OH
H
2
N
CH
3
3 SO
4
2_
2
Antybiotyk aminoglikozydowy
Zastosowanie: jako lek tuberkulostatyczny, w zapaleniu płuc i opon mózgowych,
w zakażeniach dróg moczowych wywołanych bakteriami Gram-ujemnymi,
w enterokokowym zapaleniu wsierdzia
Działanie: bakteriobójcze (Gram-dodatnie, Gram-ujemne)
Mechanizm działania: zaburza prawidłową syntezę białek drobnoustrojów.
Streptomycyna łączy się z podjednostką 30S rybosomu, co powoduje zaburzenia
procesu translacji a w rezultacie niszczy kod genetyczny.
24
Analiza jakościowa:
1. Streptomycyna w wyniku hydrolizy alkalicznej rozpada się do streptozy,
która po zakwaszeniu przechodzi się w maltol (α-metylo-β-hydroksy-δ-piron).
Maltol w reakcji z 2% roztworem ałunu żelazowo-amonowego w 0,5 M kwasie
siarkowym daje ciemnofioletowe zabarwienie.
Maltol z chlorkiem żelaza (III) tworzy sól kompleksową o zabarwieniu czerwonym
maltol
3 cz. streptomycyny
6 cz.
O
O
OH
CH
3
Fe
3+
FeCl
3
- 3 HCl
O
O
OH
CH
3

25
2. Rozpuścić 3 mg substancji w 5 ml wody, dodać 1 ml roztworu NaOH (110 g/l)
i 1 ml etanolowego roztworu 1-naftolu i 0,15 ml roztworu podbrominu sodu OD;
powstaje czerwone zabarwienie.
3. Substancja daje reakcje na jony siarczanowe.
Analiza ilościowa:
1. Metoda kolorymetryczna – wykorzystuje się reakcję tworzenia maltolu, który z solami
Fe
3+
daje związek kompleksowy o barwie czerwonej
26
Tetracykliny
R = R
1
= H Tetracyclinum hydrochloricum
R = H; R
1
= OH Oxytetracyclinum hydrochloricum
R = Cl; R
1
= H Chlortetracyclinum hydrochloricum
Tetracykliny – grupa antybiotyków naturalnych i półsyntetycznych,
posiadających układ tetracenu (4 skondensowane pierścienie
benzenowe o różnym stopniu nasycenia)
Zastosowanie: zapalenie oskrzeli i płuc wywołane przez mykoplazmy,
dur plamisty, zakażenia chlamydiami przenoszone drogą płciową,
trądzik młodzieńczy
Działanie: bakteriostatyczne (bakterie Gram dodatnie, Gram-ujemne,
mykoplazmy, bedsonie i riketsje)
Mechanizm działania: ingerują w syntezę białka w układzie
chromosomalnym bakterii, co powoduje zahamowanie syntezy białka
bakteryjnego
R
OH
OH
R
1
O
OH
OH
O
CONH
2
OH
N
H
3
C
CH
3
H
3
C

27
Analiza jakościowa:
1. Tetracykliny rozpuszczone w stężonym kwasie siarkowym dają
zabarwienie od
fioletowego do czerwonego; po dodaniu wody przechodzące w
żółte
chlorowodorek tetracykliny - fioletowe (żółte)
chlorowodorek oksytetracykliny - czerwone (żółte)
chlorowodorek chlorotetracykliny - niebieskie lub ciemnooliwkowe
(złocisto-
brunatne)
2. W parowniczce porcelanowej, na łaźni wodnej, odparować 2 ml 50%
roztworu chlorku cynku. Następnie dodać szczyptę badanej
tetracykliny i ogrzewać dalej przez 1 min; powstają barwne
kompleksy:
chlorowodorek tetracykliny - żółte
chlorowodorek oksytetracykliny - fioletowe
chlorowodorek chlorotetracykliny - czerwone
3. tetracykliny dają reakcję na jon chlorkowy
4. tetracykliny po rozpuszczeniu w 2 ml 0,1 M HCl i zadaniu 1%
roztworem chlorku żelaza (III) dają czerwonobrunatne zabarwienie
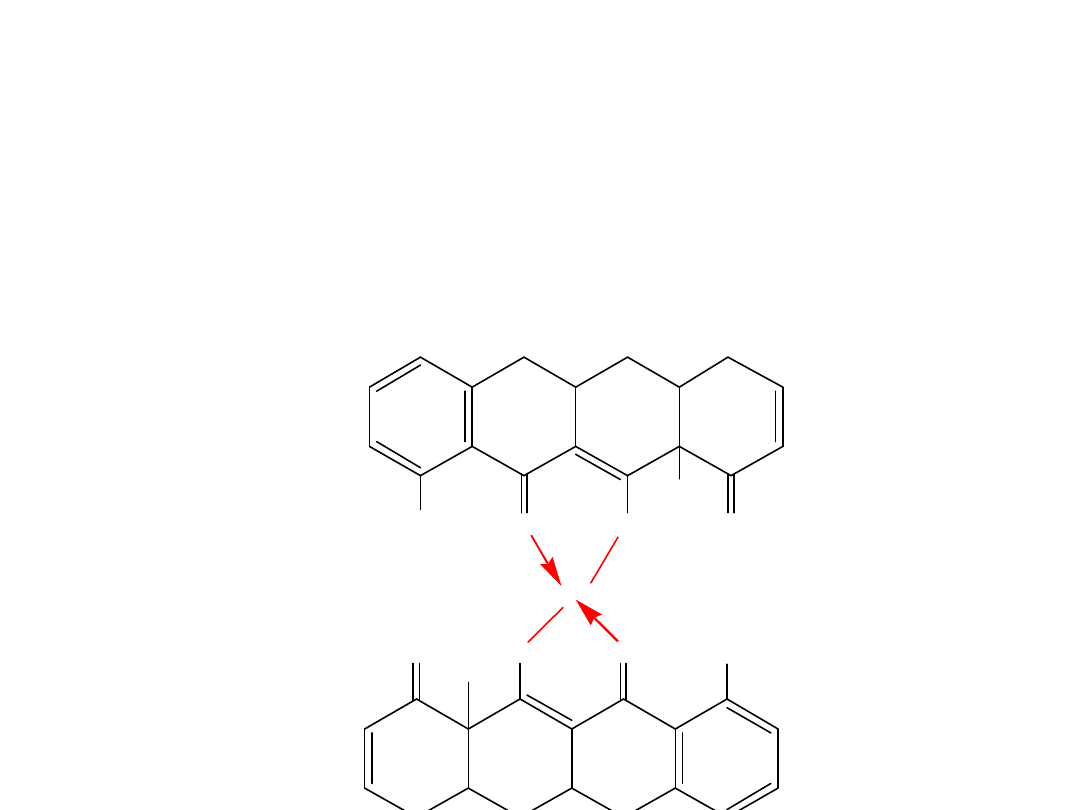
28
Analiza ilościowa:
1. Metoda fluorymetryczna
zdolność do fluorescencji wykazują produkty degradacji (najczęściej
w środowisku alkalicznym) lub kompleksy tetracyklin z Zn
2+
, Fe
3+
2. Metoda kolorymetryczna
wykorzystuje zdolność tworzenia barwnych kompleksów tetracyklin
z metalami, np. Fe
3+
OH
O
OH
O
OH
O
OH
O
O
OH
Me
29
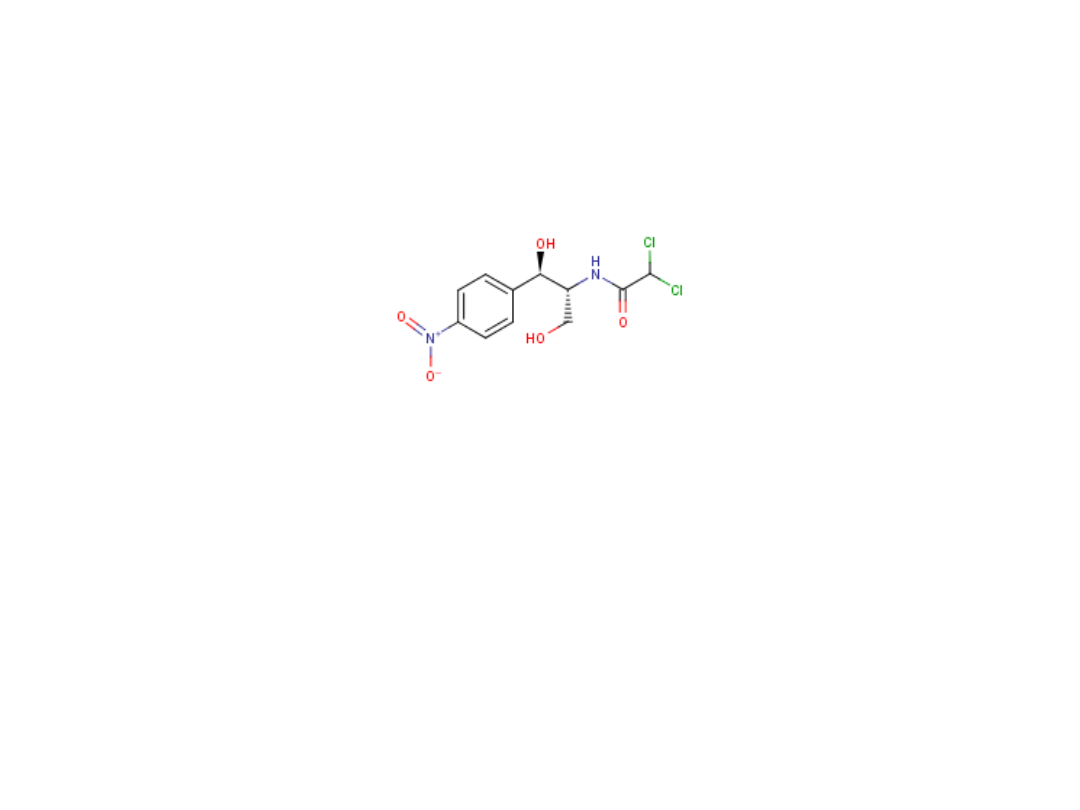
Chloramfenikol
Chloramphenicolum
D-(-)treo-1-(4-nitrofenylo)-2-(dichloroacetamido)propan-1,3-
diol
Syn. Detreomycyna, Chlorocid
Zastosowanie: w zakażeniach krętkami i riketsjami, w durze brzusznym i
osutkowym,
w biegunkach, w ropniach mózgu, w zakażeniach wewnątrz gałkowych,
krztuścu o ciężkim przebiegu
Działanie: bakteriostatyczne i bakteriobójcze
Mechanizm działania: hamuje syntezę białka bakteryjnego przez inhibicję
peptydylotransferazy, co uniemożliwia przenoszenie w cytoplazmie
aktywowanych aminokwasów z kwasu rybonukleinowego do rybosomów
30
Analiza jakościowa:
1. 10 mg substancji ogrzać z 2 ml 10 % roztworu NaOH; powstaje żółte zabarwienie.
sól disodowa kwasu
4,4’ -azobenzenokarboksylowego
NO
2
H
C
HO
CH
HN
CH
2
OH
COCHCl
2
2
+ 12 NaOH
- 2 H
2
NCH
2
OH
4 NaCl, 2 Na
2
CO
3
2 HCOONa
CHO
NO
2
CH
2
OH
NO
2
+
N
N
COONa
COONa

31
2
. 50 mg substancji rozpuścić w 3 ml etanolu, dodać 7 ml wody,
0,2 g pyłu cynkowego, ogrzać 10 min na łaźni wodnej i
przesączyć; przesącz daje reakcję na jony chlorkowe
Analiza ilościowa:
1. Oznaczenie acydymetryczne w środowisku niewodnym:
odważyć dokładnie ok. 0,3 g substancji, dodać 10 ml 25 % kwasu
solnego
i odparować do sucha.
Pozostałość rozpuścić lekko ogrzewając w 10 ml 100 % kwasu
octowego, dodać 10 ml roztworu octanu rtęci i miareczkować 0,1
M kwasem nadchlorowym wobec fioletu krystalicznego do zmiany
zabarwienia z fioletowego na niebieskie.
32
O
2
N
CH
2
OH
C
H
CH
2
OH
NH
CO
CHCl
2
+ 2 H
2
O, 2 HCl
- 2 Cl
2
CHCOOH
O
2
N
CH
OH
C
H
CH
2
OH
NH
3
2
Cl
-
+ (CH
3
COOH)
2
Hg
- HgCl
2
O
2
N
CH
OH
C
H
CH
2
OH
NH
3
2
CH
3
COO
2 (CH
3
COOH)ClO
4
4 CH
3
COOH
O
2
N
CH
OH
C
H
CH
2
OH
NH
3
2
ClO
4
chlorowodorek
1-(4-nitrofenylo)-amino-
1,3-propandiolu

33
2 . Metoda argentometryczna
W wyniku hydrolizy alkalicznej (ogrzewanie z 20 % NaOH) chlor organicznie
związany przechodzi w jony chlorkowe. Po ochłodzeniu roztwór zakwasza się
kwasem siarkowym lub azotowym i miareczkuje się roztworem azotanu srebra.
Koniec miareczkowania ustala się potencjometrycznie.
3. Metoda azotynowa
W reakcji z pyłem cynkowym w kwasie solnym grupa nitrowa w chloramfenikolu
ulega redukcji do pierwszorzędowej aromatycznej grupy aminowej, którą oznacza
się metodą azotynową.
Koniec miareczkowania oznacza się potencjometrycznie lub przy pomocy
papierka jodoskrobiowego.
34
O
2
N
CH
OH
C
H
CH
2
OH
NH CO CHCl
2
3 H
2
H
2
N
CH
OH
C
H
CH
2
OH
NH CO
CHCl
2
+
2 H
2
O
H
2
N
CH
OH
C
H
CH
2
OH
NH CO
CHCl
2
+
NaNO
2
+ 2 HCl
N
CH
OH
C
H
CH
2
OH
NH CO
CHCl
2
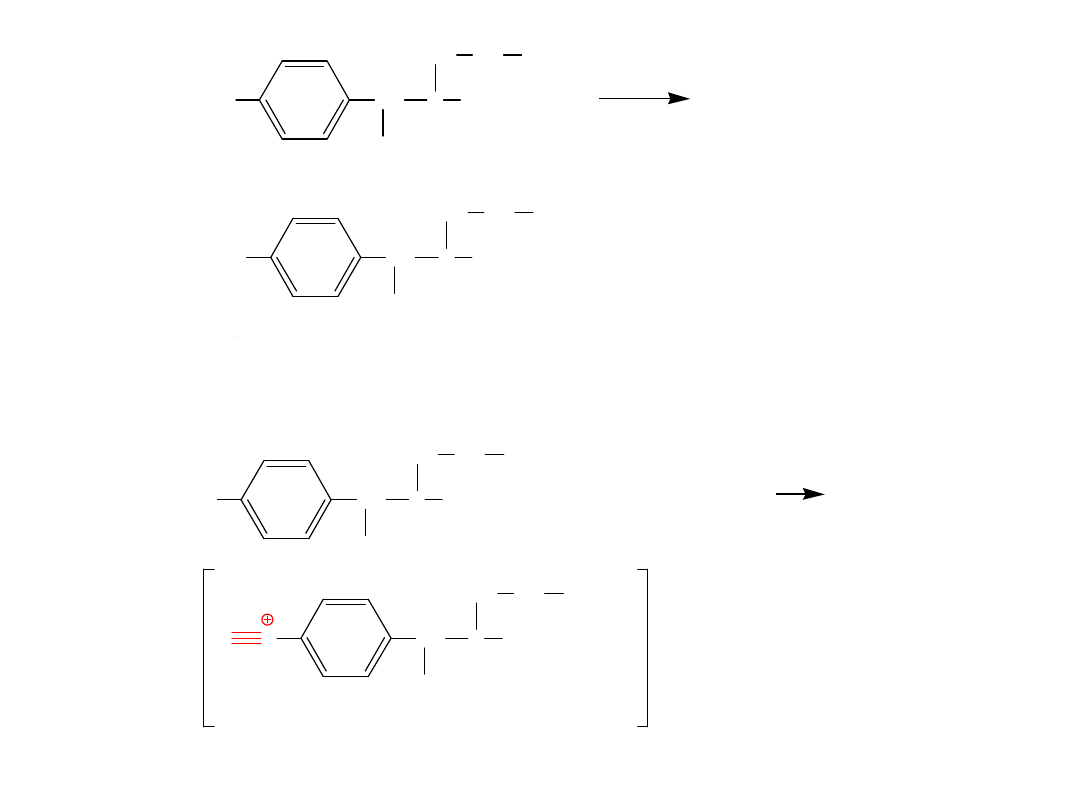
N
Cl
-
+
NaCl + 2 H
2
O
35
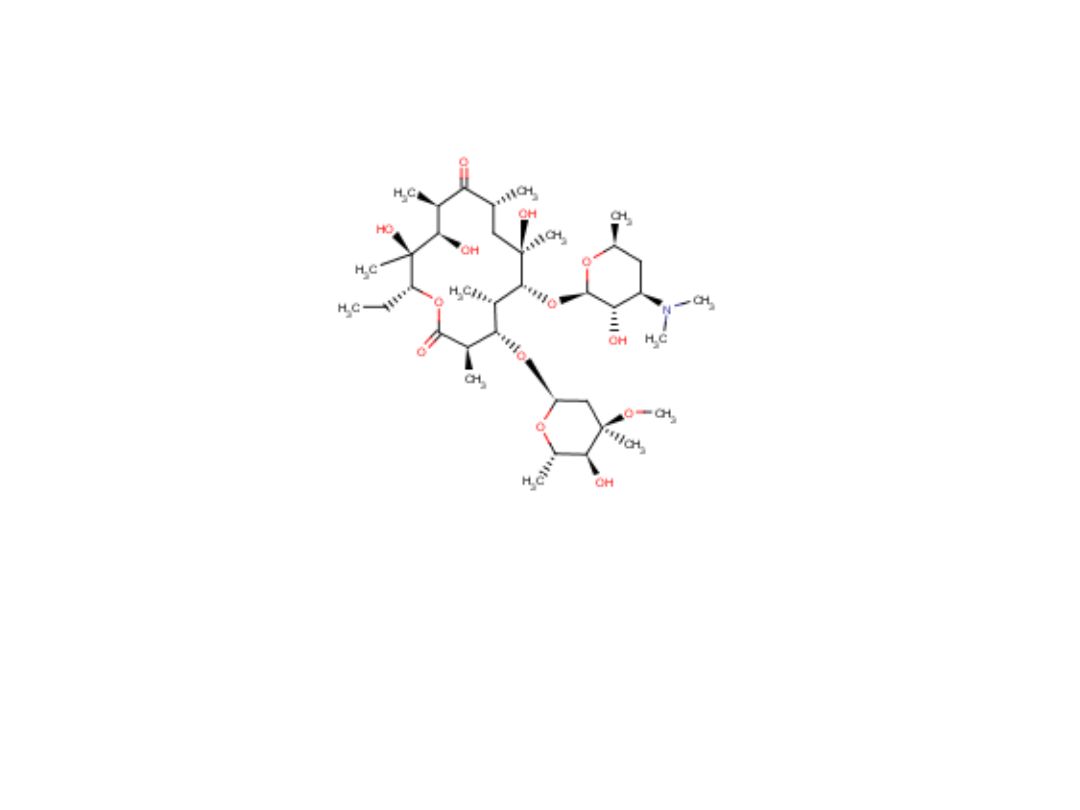
Erytromycyna
Erythromycin
Antybiotyk makrolidowy (niepolienowy)
Zastosowanie: zakażenia paciorkowcami (górny i dolny odcinek dróg
oddechowych)
Mechanizm działania: blokuje syntezę białka bakteryjnego

36
Analiza jakościowa wg FP VI:
1. Rozpuścić 5 mg substancji w ml acetonu, dodać 2 ml HCl (425
g/l);
powstaje pomarańczowe zabarwienie, zmieniające się na
czerwone.
Dodać 2 ml chloroformu i wytrząsnąć; warstwa chloroformowa
zabarwia się
na fioletowo.
2. Analiza widm absorpcyjnych w podczerwieni.
3. Badanie metodą chromatografii cienkowarstwowej.
Analiza ilościowa wg FP VI;
1. Miareczkowanie acydymetryczne kwasem nadchlorowym
wobec fioletu
krystalicznego.
2. Oznaczenie metodą cylinderkowo-płytkową wg monografii
„Oznaczenie aktywności antybiotyków metodami
mikrobiologicznymi.”
37
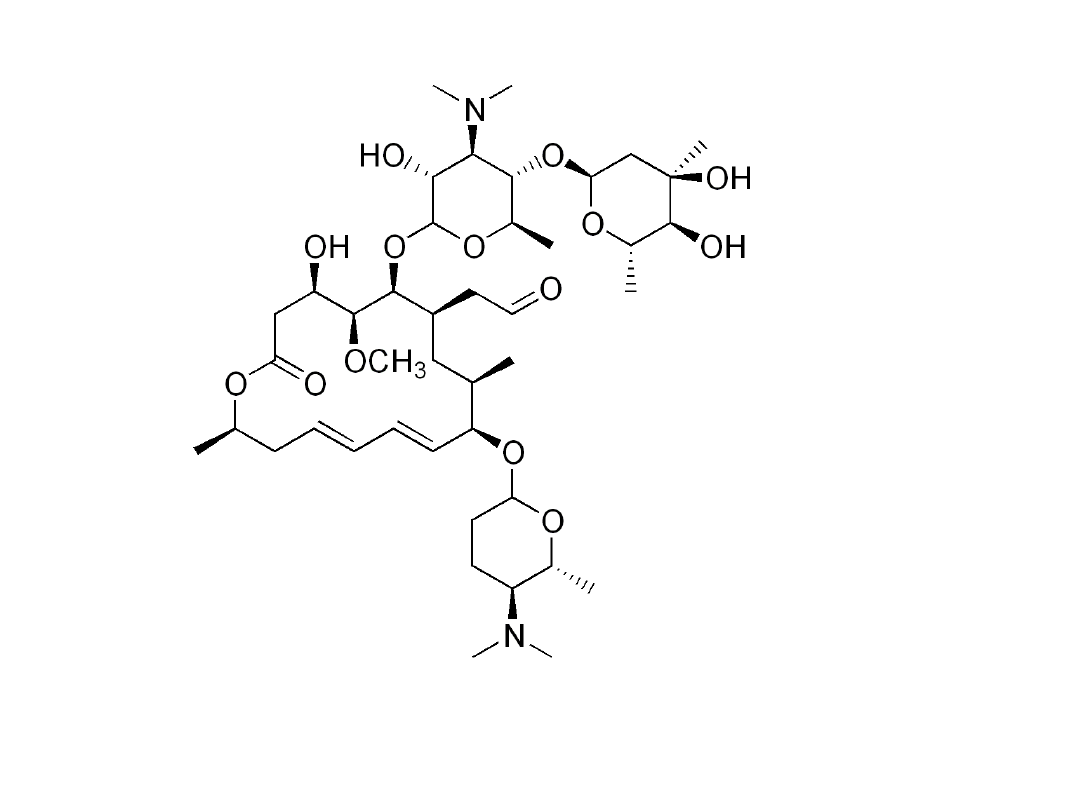
Spiromycyna - antybiotyk makrolidowy polienowy
38
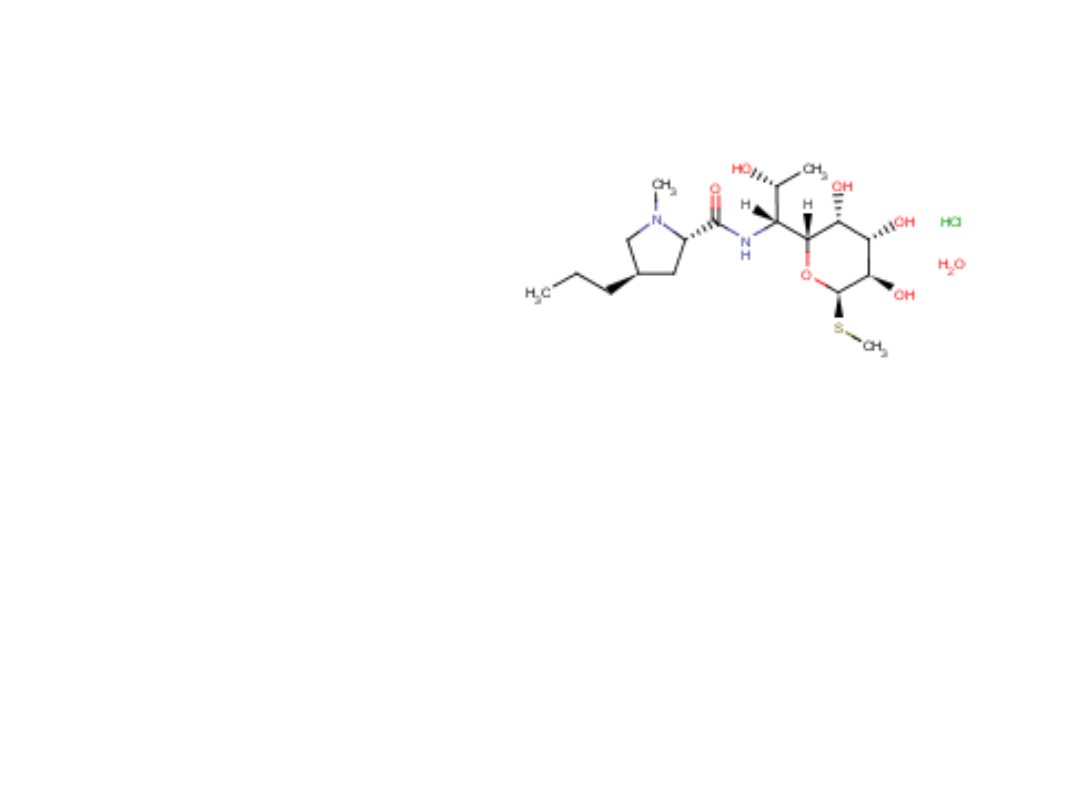
Linkomycyny chlorowodorek
Lincomycini hydrochloride
Linkozamid, hamuje syntezę białka bakteryjnego.
Kwas trans-1-propylohygrynowy połączony jest wiązaniem amidowym
z aminosacharydem zawierającym grupę tiometylową
Zastosowanie: błonnica, posocznica gronkowcowa, zapalenie płuc i ucha
środkowego,
zakażenia oporne na działanie penicylin

39
Analiza jakościowa wg FP VI:
1. Substancja wykazuje reakcje na chlorki.
2. Rozpuścić 20 mg substancji w 2 ml wody, dodać 3 ml kwasu
siarkowego
(1,762 kg/l);
na granicy faz powstaje czerwonopomarańczowe zabarwienie.
3. Badanie metodą chromatografii cienkowarstwowej.
Analiza ilościowa wg FP VI:
1. Oznaczenie metodą cylinderkowo-płytkową wg monografii
„Oznaczenie aktywności antybiotyków metodami
mikrobiologicznymi.”
2. Badanie metodą chromatografii gazowej.
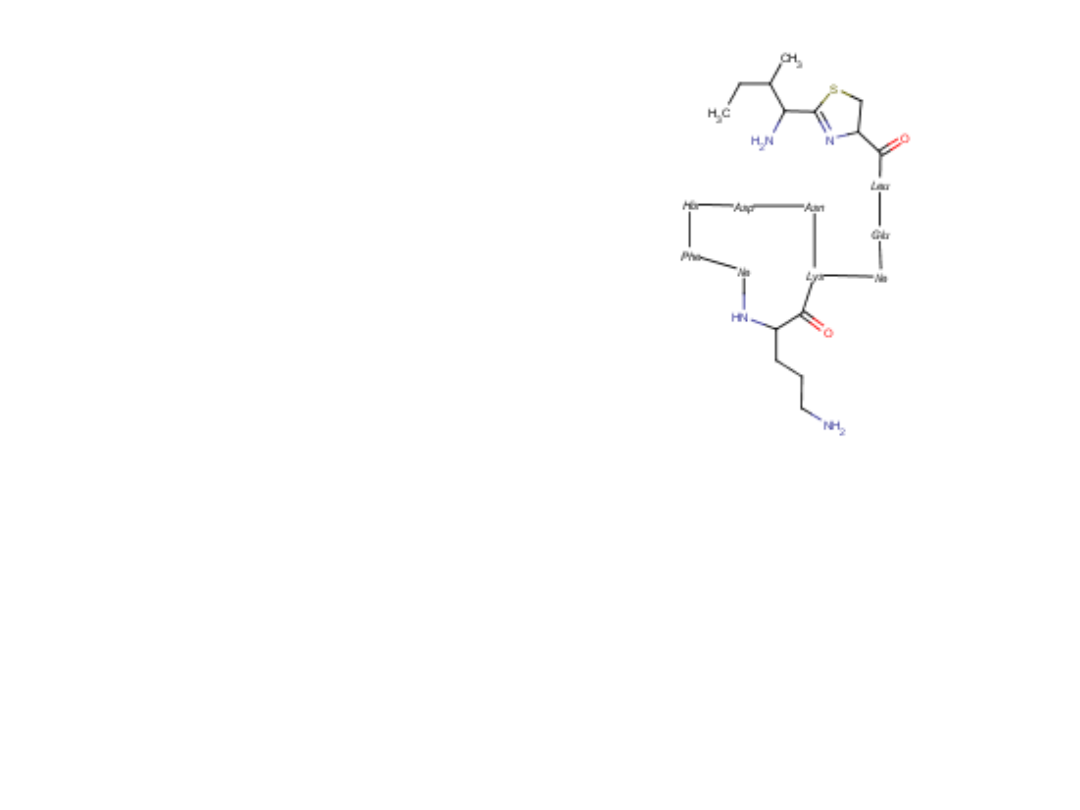
40
Bacytracyna
Bacitracinum
Zastosowanie: w zakażeniach skóry i błon śluzowych
Mechanizm działania: zakłóca biosyntezę ściany komórkowej
bakterii; uniemożliwia reakcję defosforylacji
Cykliczny antybiotyk peptydowy.
Mieszanina polipeptydów, której głównym składnikiem jest bacytracyna A
Bacytracyna A składa się z pierścieniowego heptapeptydu
I łańcucha bocznego, w którym w wyniku cyklizacji izoleucyny z cysteiną powstał pierścień
dihydrotiazolu

41
Analiza jakościowa wg FP VI:
1. Rozpuścić 5 mg substancji w 5 ml wody, dodać 5 ml roztworu NaOH (80 g/l).
Dodać 0,5 ml roztworu siarczanu miedzi (II), (10 g/l); powstaje fioletowe
zabarwienie.
2. Rozpuścić 20 mg substancji w 2 ml buforu fosforanowego o pH = 7, dodać
0,2 ml roztworu ninhydryny i ogrzewać na łaźni wodnej; powstaje fioletowo-
niebieskie zabarwienie.
3. Badanie metodą chromatografii cienkowarstwowej.
Analiza ilościowa wg FP VI:
1. Oznaczenie metodą cylinderkowo-płytkową wg monografii
„Oznaczenie aktywności antybiotyków metodami mikrobiologicznymi.”
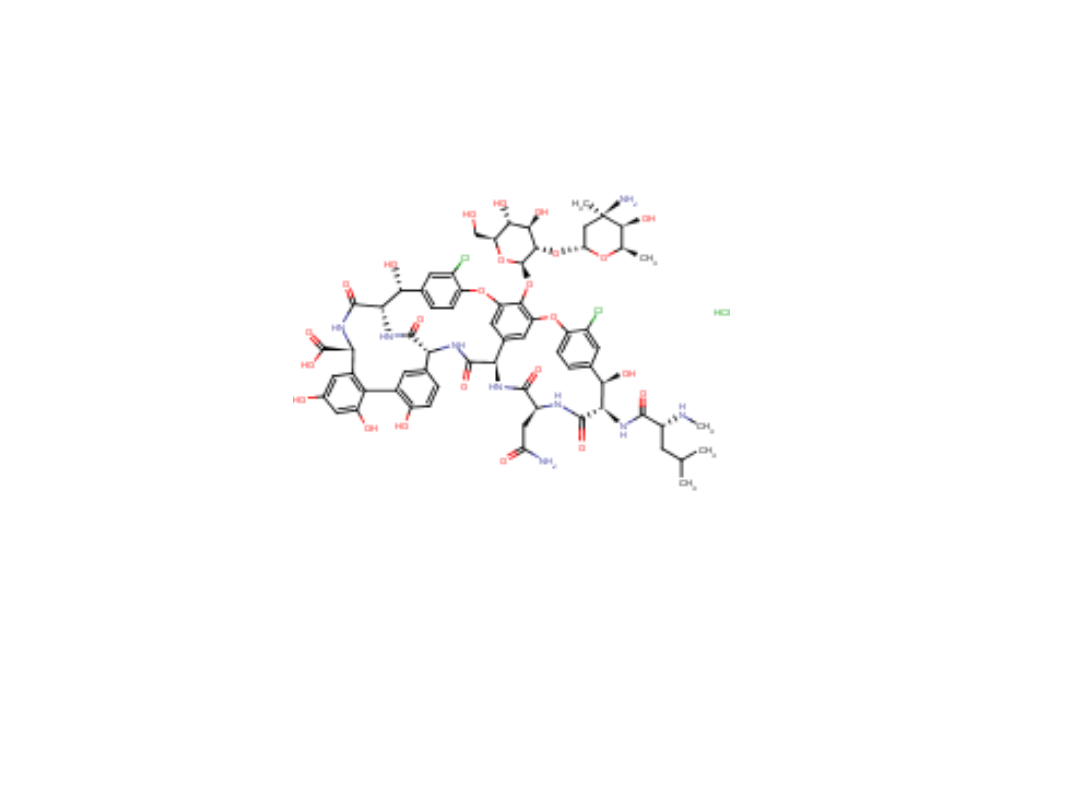
42
Vankomycyny chlorowodorek
Vancomycini hydrochloride
Antybiotyk peptydowy - glikopeptyd wytwarzany przez Nocardia orientalis
Trójpeptydowy heptapeptyd
Zastosowanie: skutecznie zwalcza infekcje wywołane przez gronkowce
Mechanizm działania: zakłóca biosyntezę ściany komórkowej

43
Analiza jakościowa wg FP VI:
1. Substancja wykazuje reakcje na chlorki.
2. Rozpuścić 10 mg substancji w 3 ml wody, zmieszać z 7 ml
roztworu
β-naftolu w kwasie siarkowym i ogrzewać 25 min na łaźni
wodnej;
powstaje różowofioletowe zabarwienie.
3. Badanie metodą chromatografii cienkowarstwowej.
Analiza ilościowa wg FP VI:
1. Oznaczenie metodą cylinderkowo-płytkową wg monografii
„Oznaczenie aktywności antybiotyków metodami
mikrobiologicznymi.”
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
Prelekcja2 ppt
prelekcja Choroby jelita grubego
Ogólne zasady chemioterapi, 2013i
prelekcja ZUM z pytaniami
Kopia Chemioterapia2
chemioterapia zakazeń bakteryjnychskrócona
Leczenie uzupełniające nowotworów narządu rodnego chemioterapia, radioterapia
CHEMIOTERAPEUTYKI W CHOROBACH BAKTERYJNYCH
Chemioterapia przeciwbakteryjna ogólna
prelekcja gardło 2013
1 - Podwzgórze i przysadka, MEDYCYNA, patofizjologia, Prelekcje
Konspekt prelekcja 4
chemioterapeutyki
prelekcje genetyka medyczna
więcej podobnych podstron