
Architektura
białek:
Białka
Struktury I-IV-rzędowa
Białka jako struktury giętkie
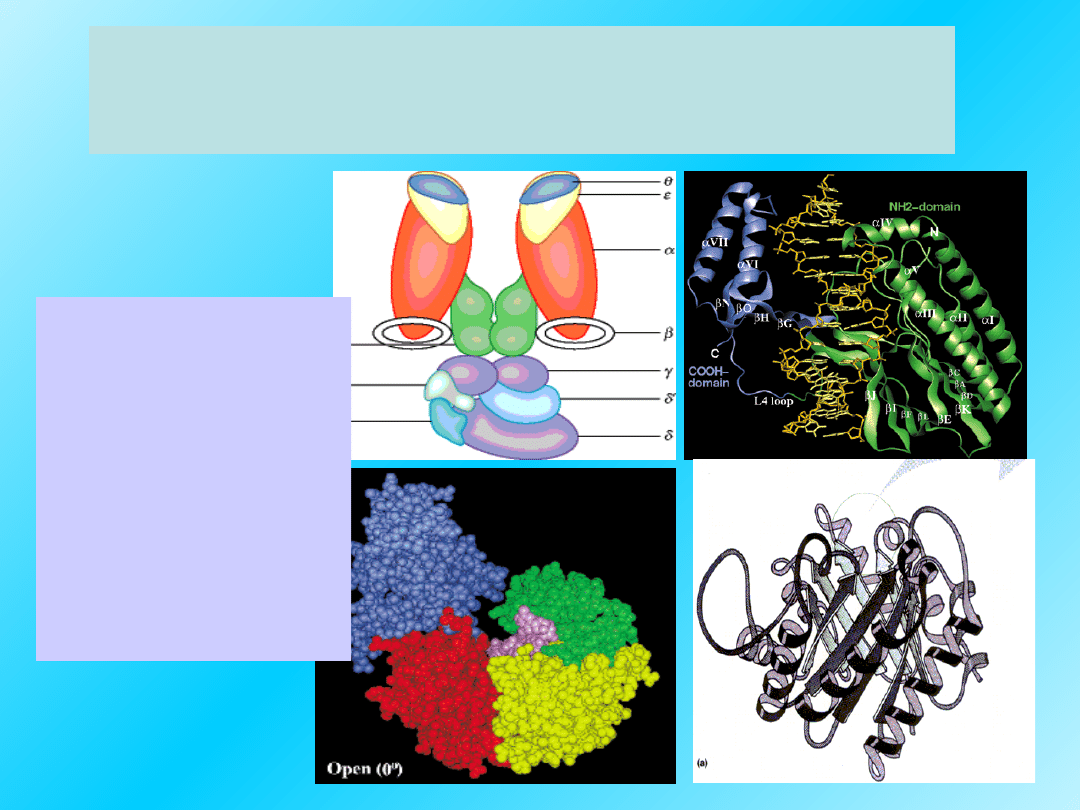
Opisanie struktury białek
Opisanie struktury białek
nie jest proste:
nie jest proste:
Możliwości
powstania
różnych
struktur
białkowych
są
olbrzymie
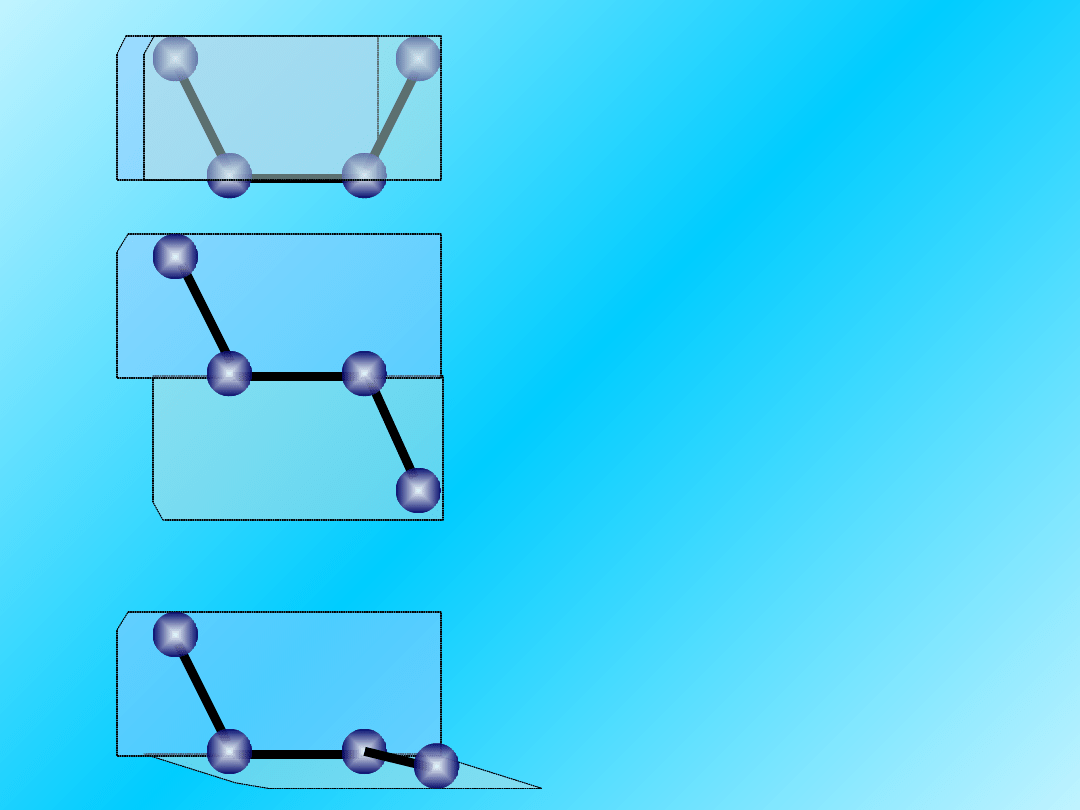
180
o
0
o
90
o

Znaczenie białek i ich rola:
Znaczenie białek i ich rola:
• Białka strukturalne (funkcje budulcowe)
• Białka regulatorowe (regulują przebieg
procesów biochemicznych)
• Białka transportujące (uczestniczą w
transporcie tlenu, np. hemoglobina;
albuminy transportujące rożne
drobnocząsteczkowe związki z tkanek do
tkanek
• Białka odpornościowe (biorą udział w
reakcjach obronnych (tworzą przeciwciała)
• Białka warunkujące ruch w komórkach (np.
aktyna i miozyna tworzące kurczliwe
struktury w komórkach mięśniowych)
4
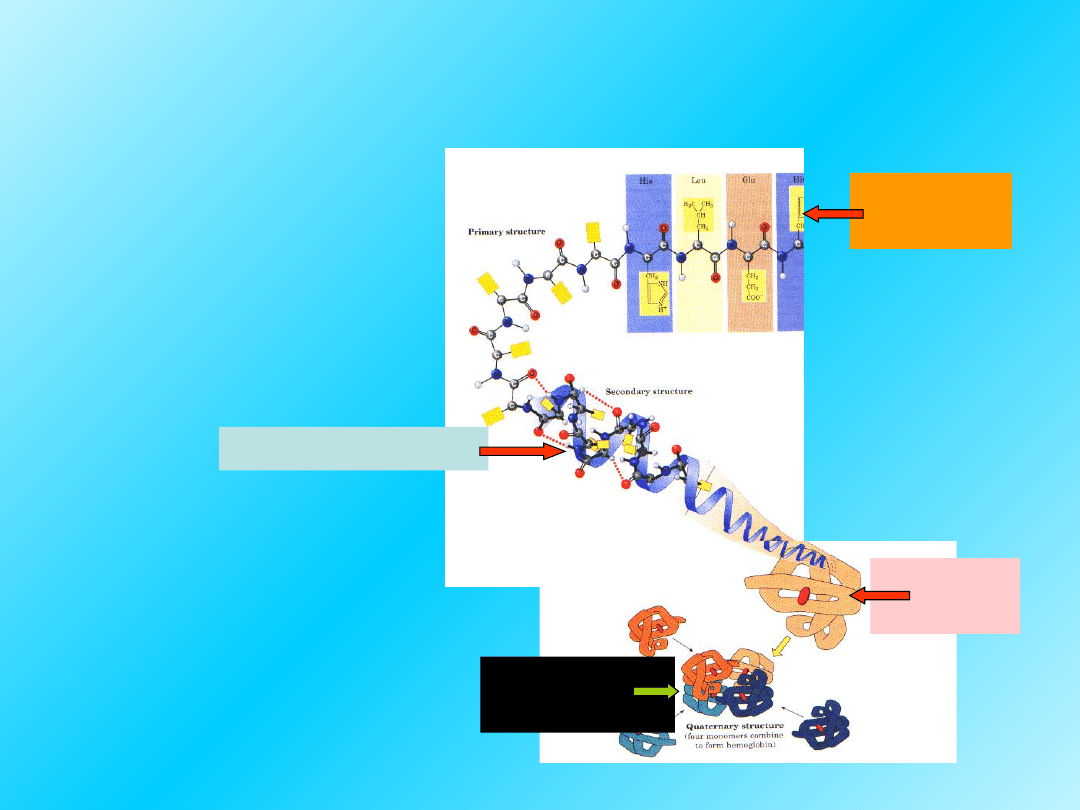
Strukturę białek
opisuje się
na czterech
poziomach:
Pierwszo
rzędowa
Drugorzędowa
Trzecio-
rzędowa
Czwarto-
rzędowa
Białka są polimerami, których
monomery stanowią aminokwasy.

Struktura I-rzędowa:
Opisuje sekwencję aminokwasów, które
budują łańcuch polipeptydowy.
Określone
białko ma ściśle zdefiniowany skład i
sekwencję (kolejność) aminokwasów.
Mówiąc o strukturze pierwszorzędowej,
podajemy kolejność aminokwasów w białku,
np.:
Gly Gly Ala His Ala Asp Asp Gly Ala Gly
Arg
Sekwencja
aminokwasów
determinuje strukturę
przestrzenną białka
Prekursor
mRNA
mRNA
(1)
mRNA (2)
Sekwencja aminokwasowa
(1)
Sekwencja aminokwasowa
(2)
7
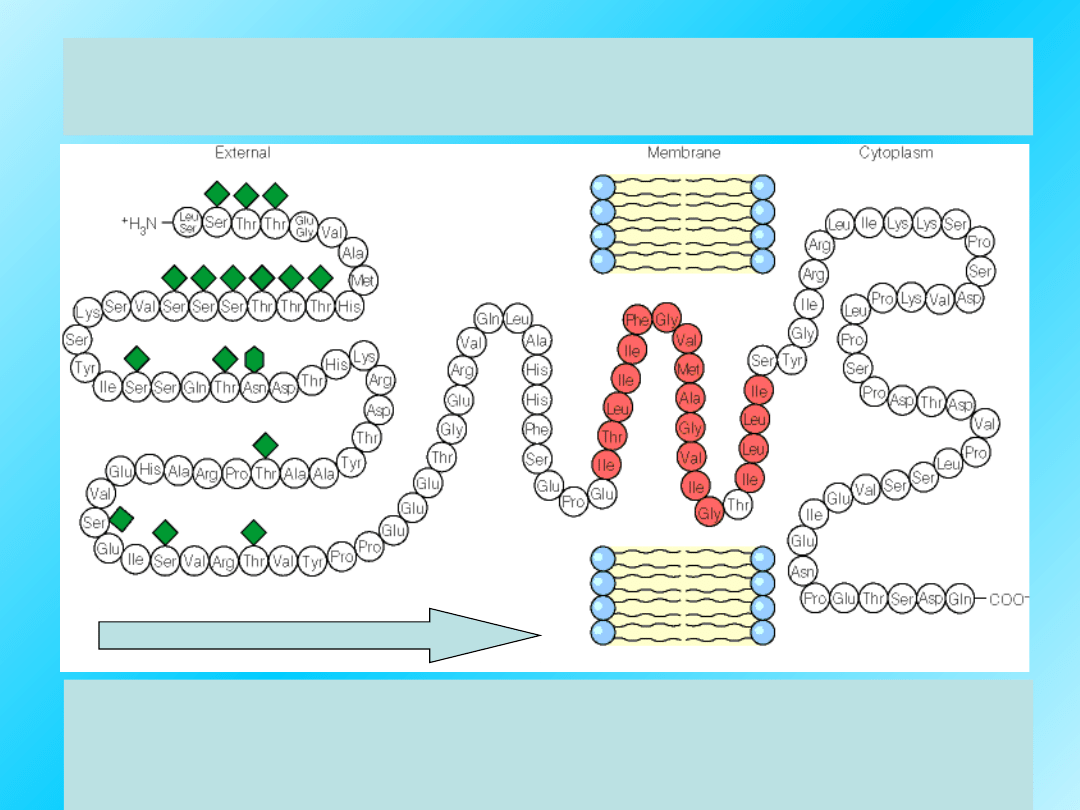
Pierwszorzędowa struktura:
integralnego białka błonowego glikoforyny A:
Każdy polipeptyd ma swój N-koniec, z wolną
grupą aminową i C-koniec, z wolną grupą
karboksylową.
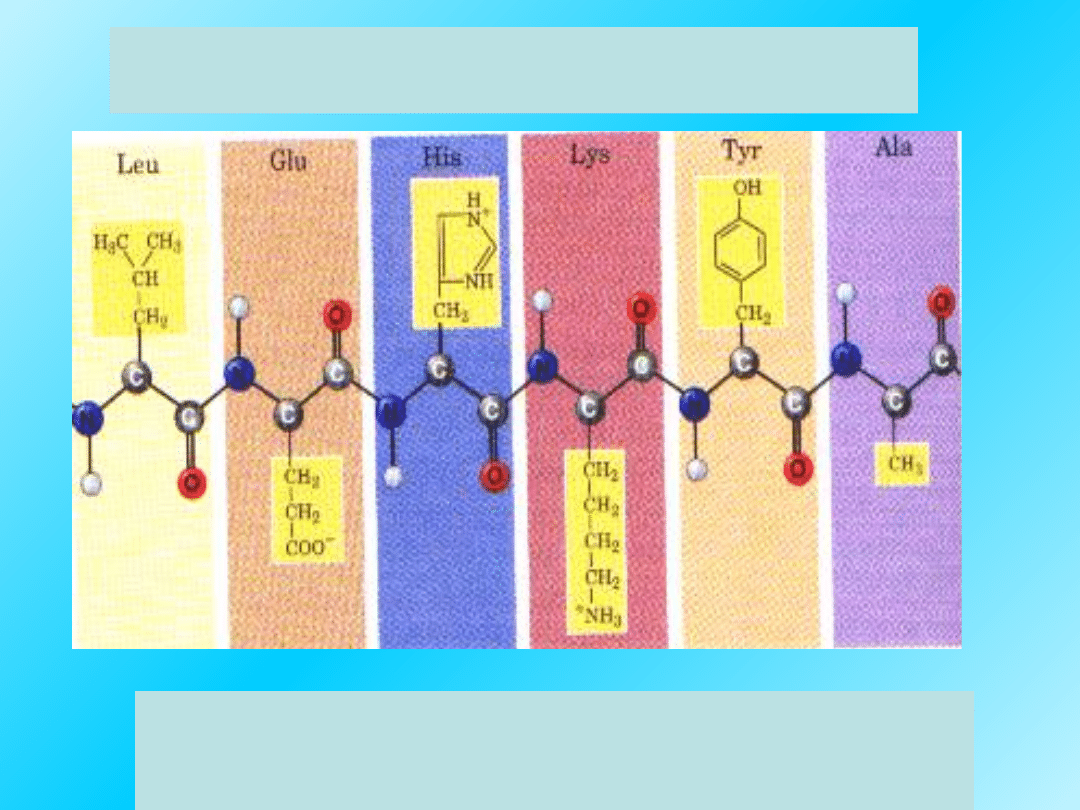
Pierwszorzędowa struktura białek:
Struktura pierwszorzędowa polipeptydu
zapisana jest w
naszych genach
9
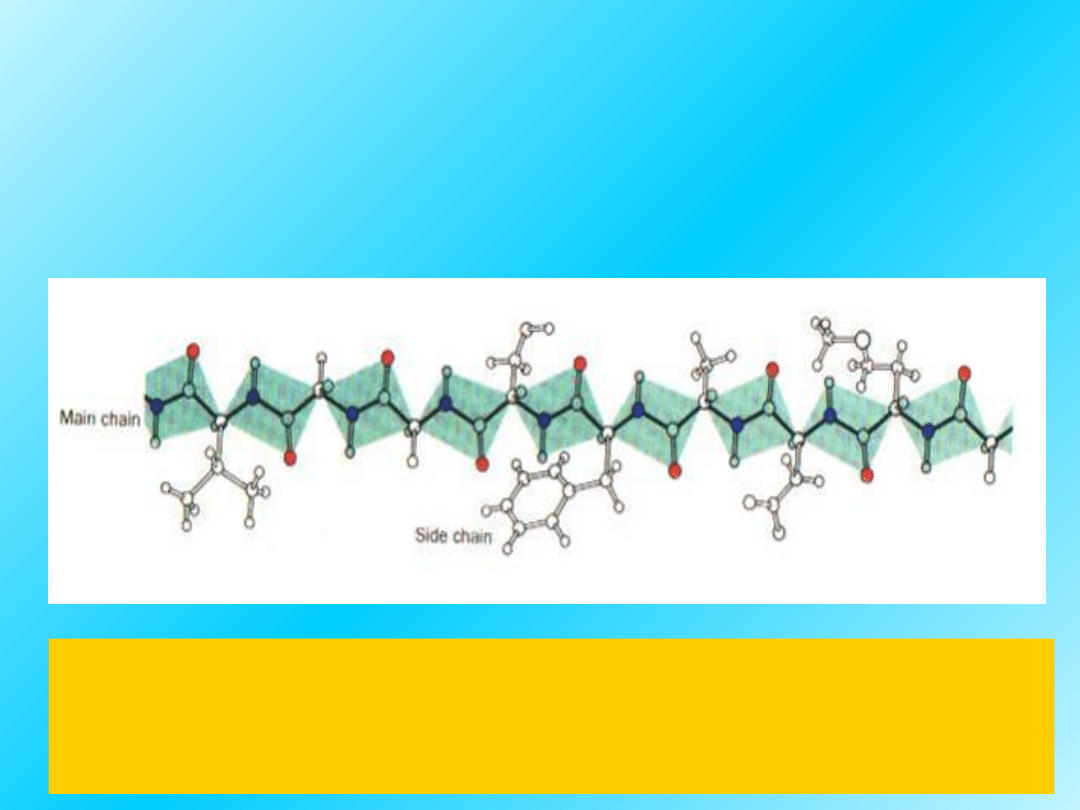
Schemat rozciągniętego łańcucha polipeptydowego
z widocznymi grupami peptydowymi.
Reszty aminokwasów w łańcuchu bocznym mogą
zmieniać konformację.
Szkielet sekwencji aminokwasów w
łańcuchu polipeptydowym utrzymuje
się dzięki
sztywnym wiązaniom peptydowym:
10
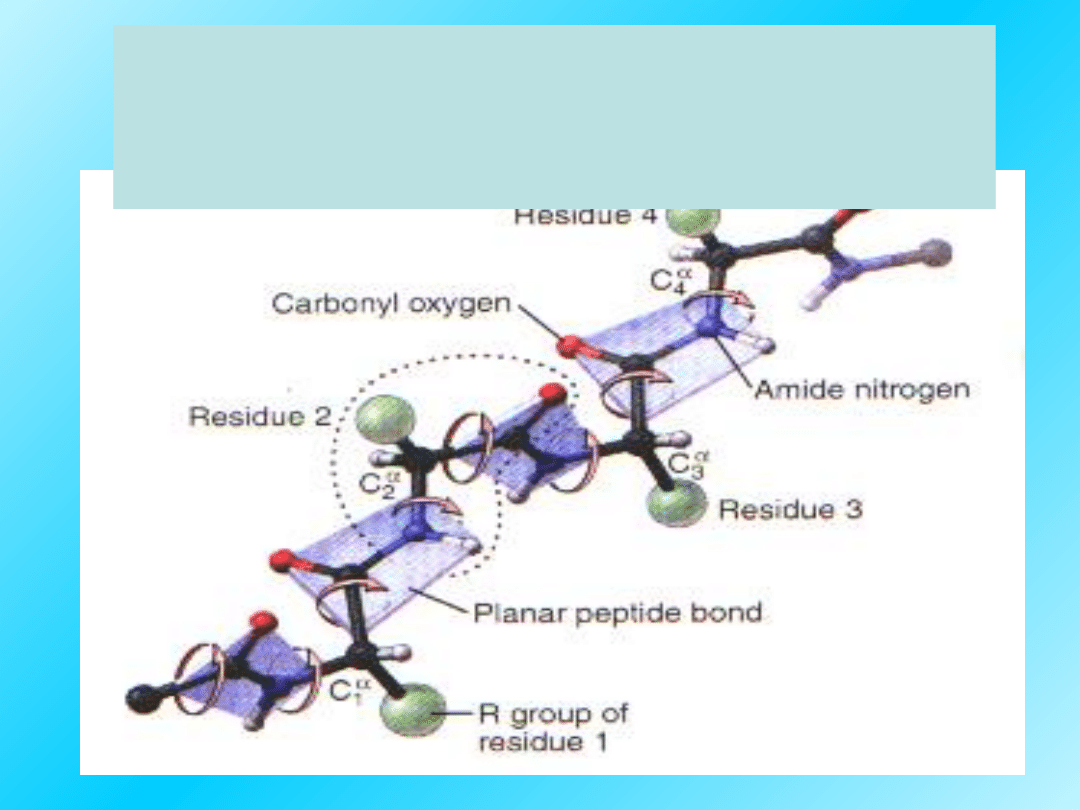
Fragment sekwencji
aminokwasów
w łańcuchu polipeptydowym:
11

Każdy peptyd albo białko
wykazuje swoją
charakterystyczną sekwencję
aminokwasową.
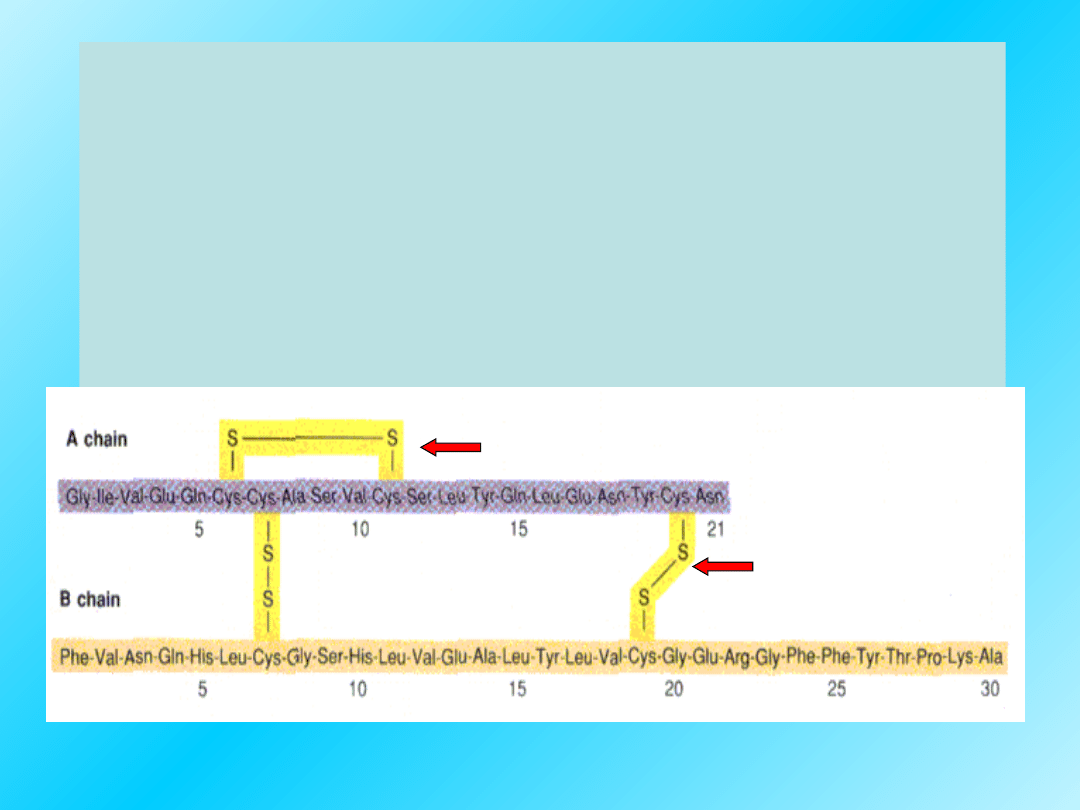
Na przykład insulina ludzka, bydlęca, psa,
owcza wykazują podobieństwo, ale nie są
identyczne.
Różnice dotyczą pozycji w sekwencji łańcucha
A: 8,9 i 10 i przy C-końcu łańcucha B w pozycji
30.

Przykład:
Hormony peptydowe: wazopresyna,
oksytocyna
wykazują niewielkie różnice w
sekwencji, a funkcja ich jest odmienna.
Wpływ podstawienia jednego
aminokwasu przez inny może mieć
znaczący wpływ na funkcję białka:
13

Pierwszorzędowa struktura
białek determinuje
drugo- i trzecio-rzędowe
struktury białek natywnych
Struktura, którą białka posiadają w organizmie i dzięki której zdolne
są pełnić
swe funkcje biologiczne, nazywana jest natywną konformacją białka
14
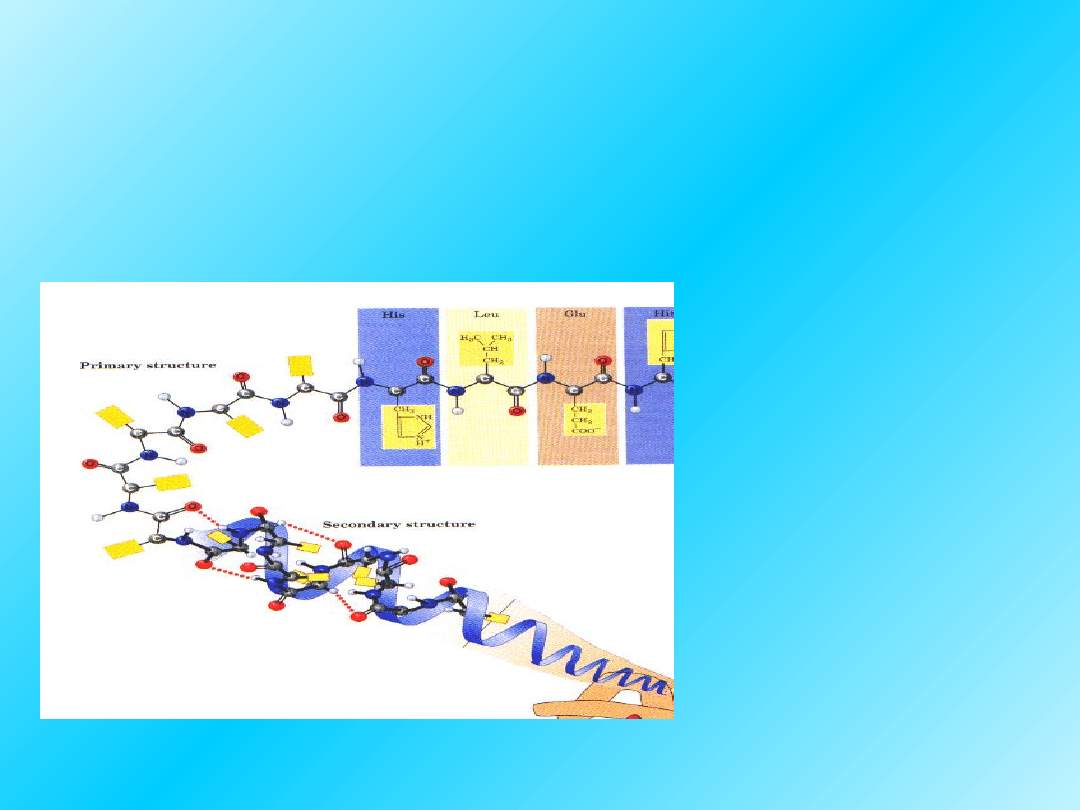
Struktura II-rzędowa:
Łańcuch peptydowy może zwijać się, układać,
w sposób regularny.
Powtarzający się
wzór zwinięcia
łańcucha związany z
wzajemnym
przestrzennym
ułożeniem reszt
aminokwasowych
sąsiadujących ze
sobą w sekwencji
liniowej, określany
jest jako
struktura
drugorzędowa
15
Dwie podstawowe
regularne
struktury II-rzędowe:
α helisa:
Struktura β, pofałdowanej
kartki:
16

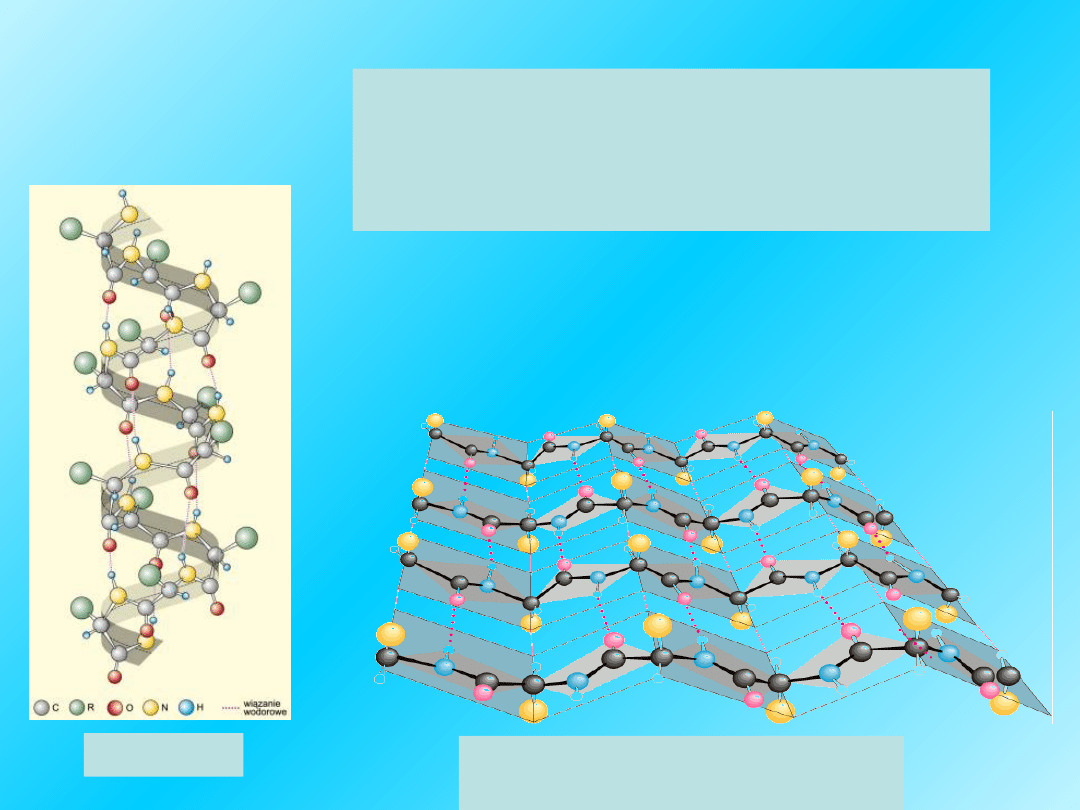
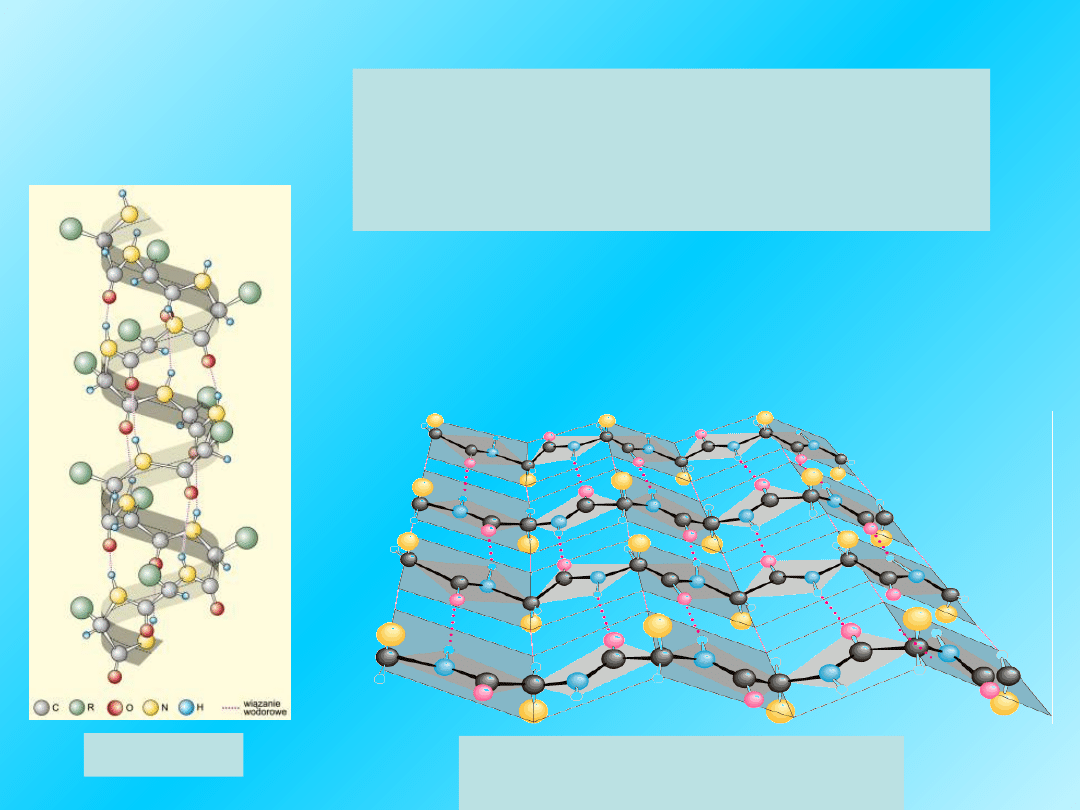
Prawoskrętna α-helisa
Wewnątrzłańcuchowe
wiązania wodorowe –
linia kropkowana -
utrzymują kształt
helisy
Helisa jest ważnym
elementem
struktury II-
rzędowej białek.
Polipeptydowy
łańcuch jest
skręcony w sposób
regularny.
17
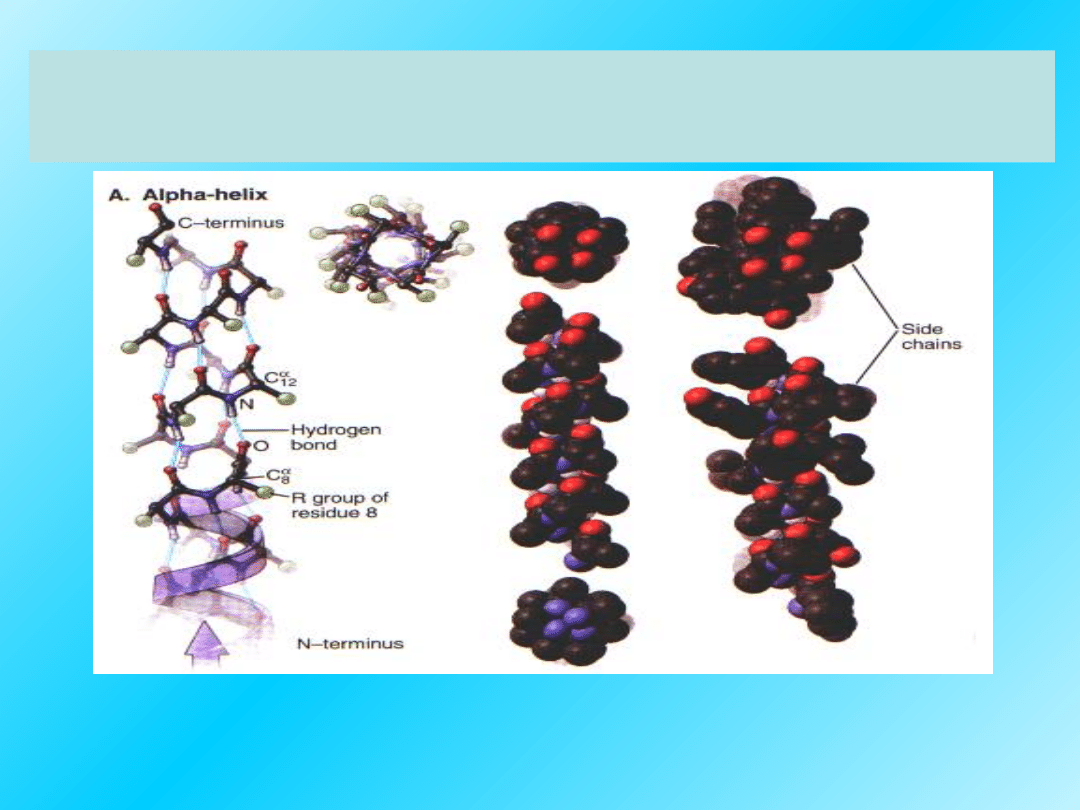
Prawoskrętna α-helisa z widocznymi
grupami R :
Wszystkie łańcuchy boczne (R-) aminokwasów odstają na
zewnątrz helisy
W strukturze
α helisy
pojedynczy łańcuch peptydowy
zwija się w taki sposób, że
przypomina prawoskrętną
spiralę.
Met, Glu
sprzyjają powstawaniu spirali.
19

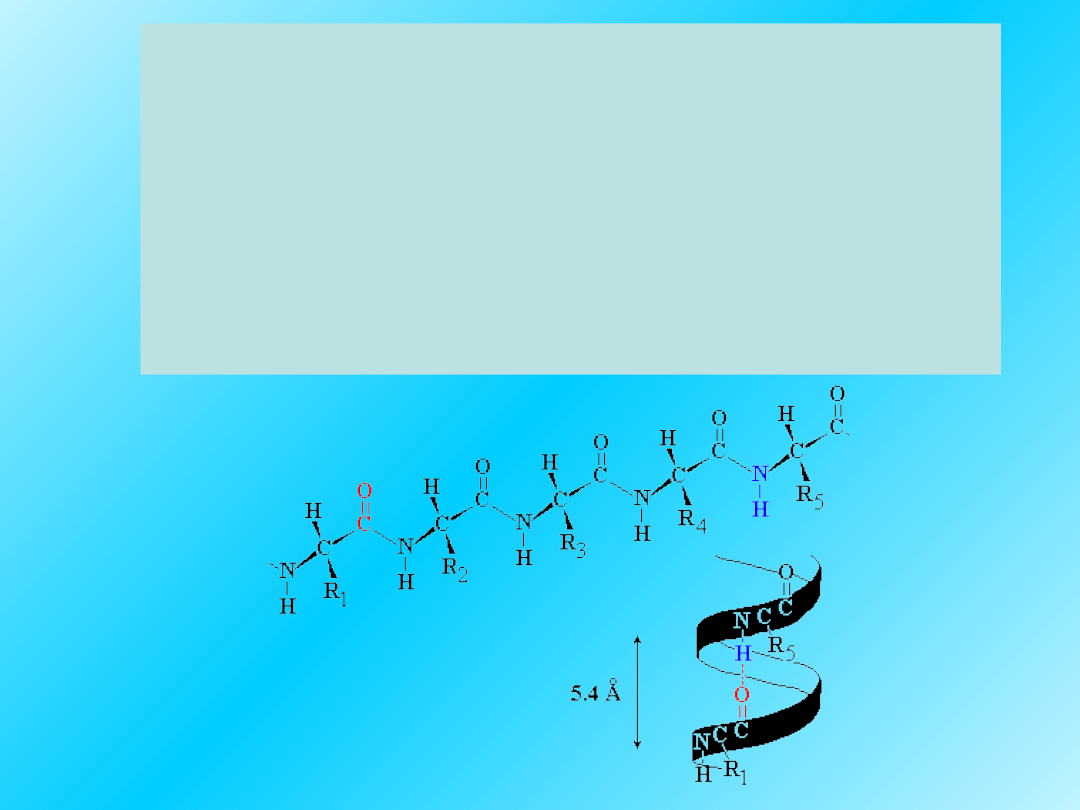
Podstawowe cechy
alfa helisy:
Złożona jest z
L
-
-aminokwasowych reszt;
Jest prawoskrętna
Utworzona jest przez 3.6 reszt aminokwasów na
1 skręt;
Wiązania wodorowe utworzone są między
N-H i C=O grupami.
21
Dwie podstawowe
regularne
struktury II-rzędowe:
α helisa:
Struktura β, pofałdowanej
kartki:
22
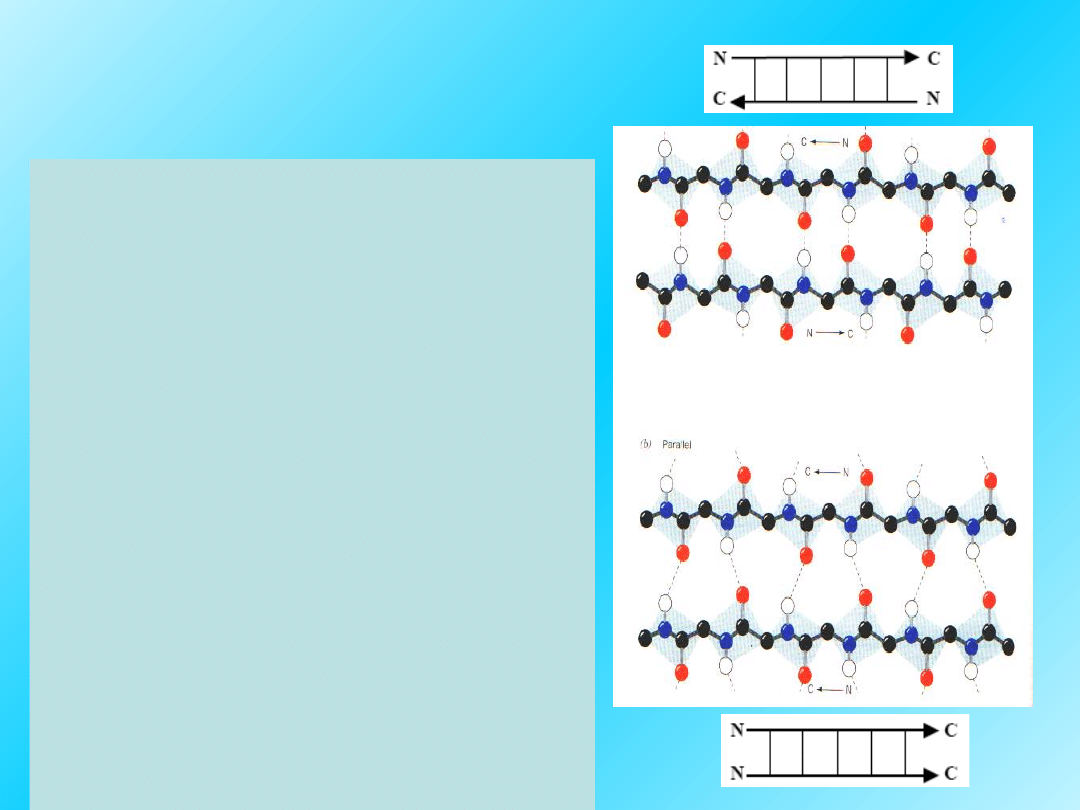
Struktura pofałdowanej
kartki, β–struktura
występuje między
łańcuchami
polipeptydowymi
przebiegającymi
równolegle
(N-końce są po tej samej
stronie)
albo
antyrównolegle
(N-
końce po przeciwnych
stronach).
23
β–struktura:
Rozciągnięty kształt
łańcucha peptydowego
utrzymywany jest przez
oddziaływania wodorowe
między sąsiadującymi
łańcuchami
peptydowymi.
Aminokwasy o
„obszernych” grupach
bocznych
np.
Val, Leu, Ile,
Val, Leu, Ile,
wykazują tendencję do
tworzenia β–struktury
.
22
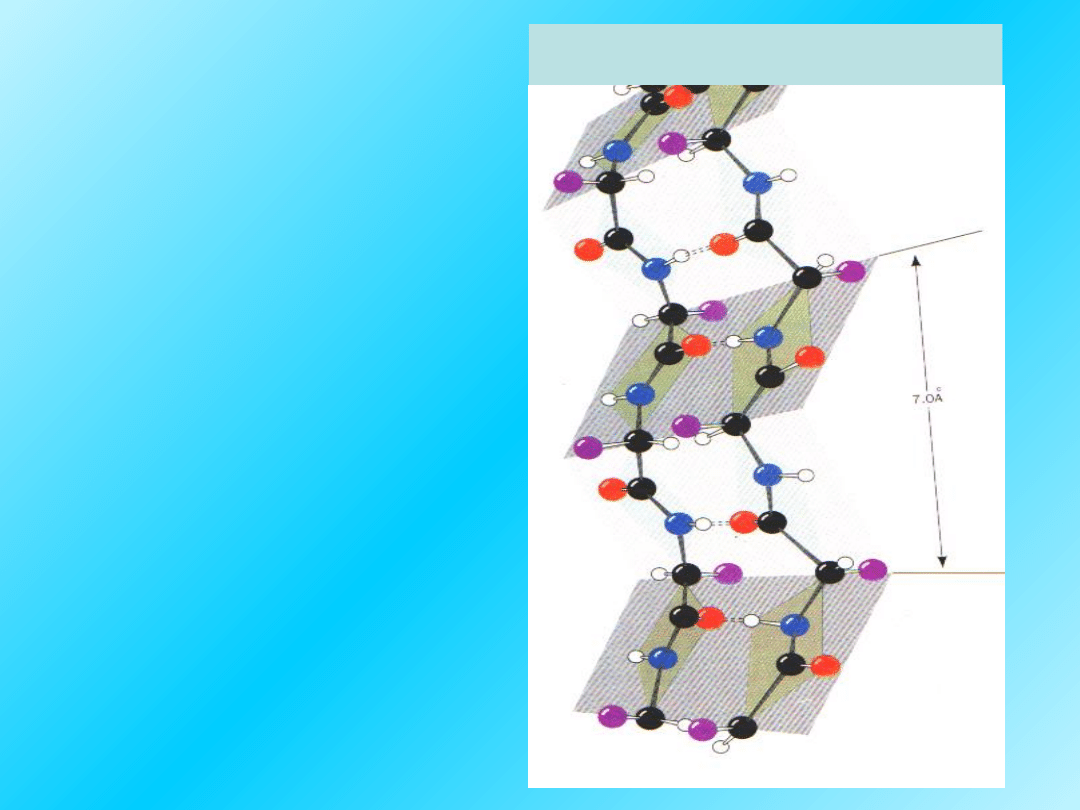
Gdy łańcuch
polipeptydowy
o strukturze β
zawraca tworząc
strukturę
„
„
spinki do włosów”.
spinki do włosów”.
powstają wewnątrz-
cząsteczkowe
β
β
zgięcia
zgięcia
.
.
β
Skręty umożliwiają
nagłą zmianę kierunku
nici polipeptydowej o
regularnej strukturze II-
rzędowej w białkach
globularnych
.
Struktura
Struktura
β
β
25

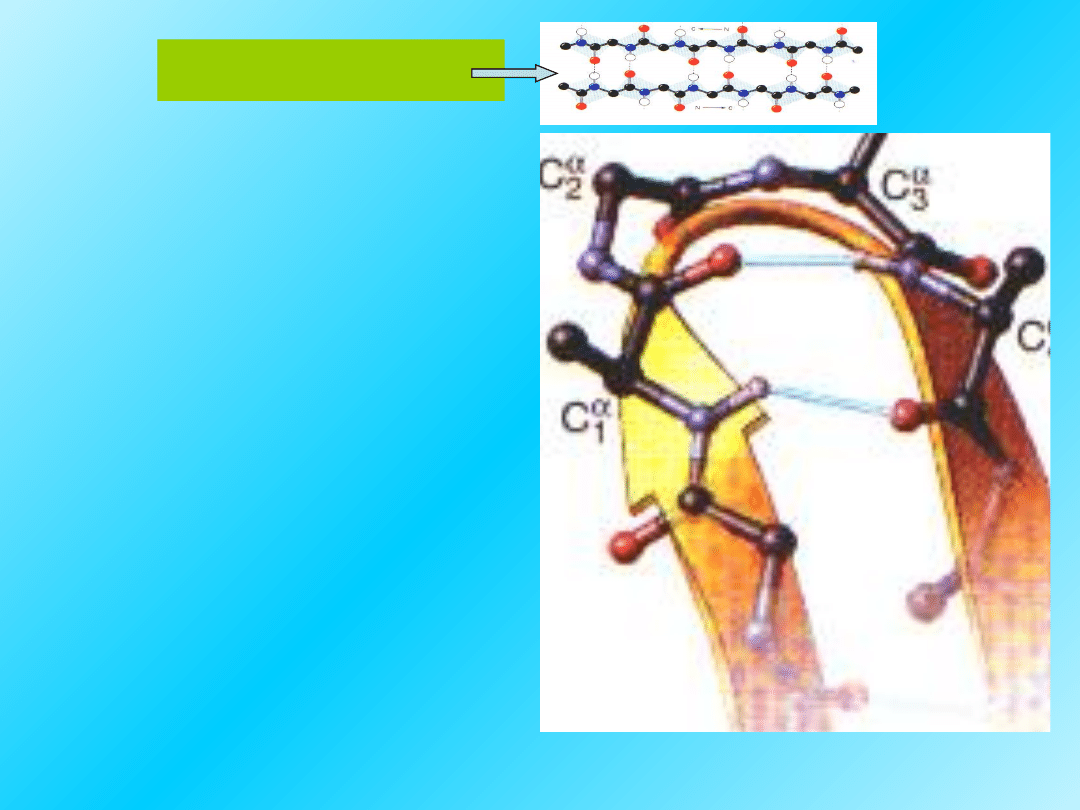
Struktura III-rzędowa:
Struktura trzeciorzędowa to
przestrzenne ułożenie całego
polipeptydu, czyli jego kształt.
Odnosi
się do przestrzennego, wzajemnego
ułożenia reszt aminokwasowych
oddalonych od siebie w sekwencji
liniowej.
27
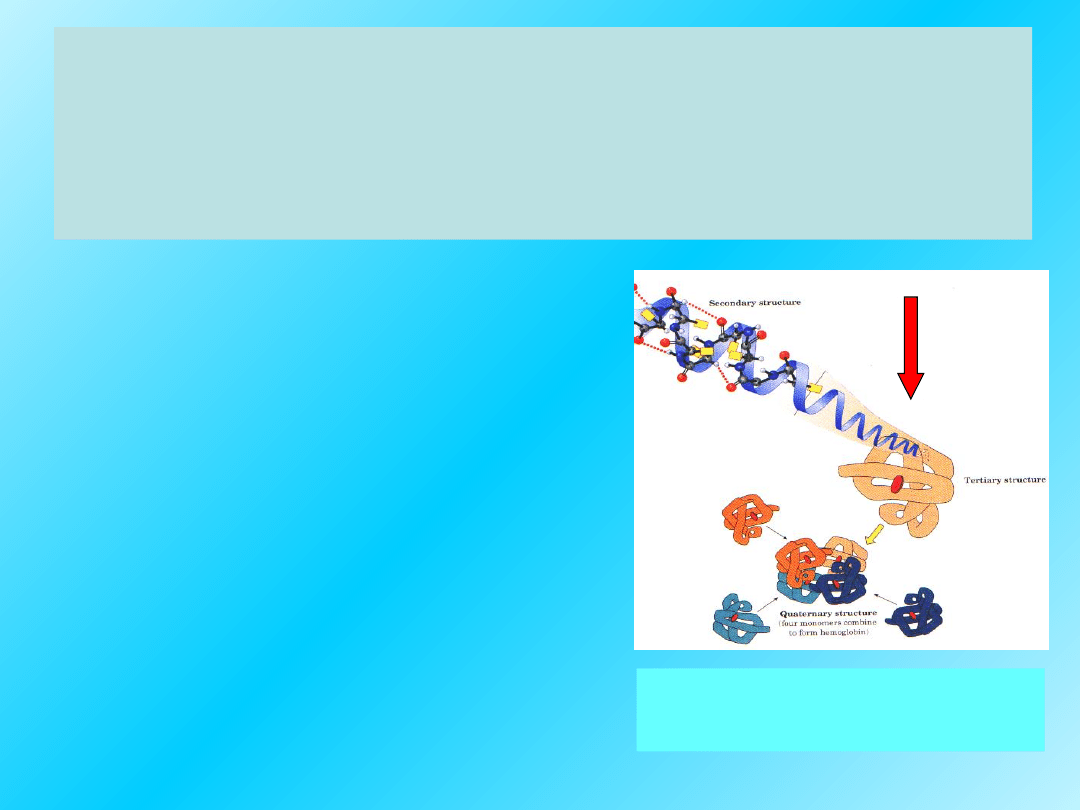
Trzeciorzędową strukturę białek
tworzą pofałdowane elementy struktury
II-rzędowej łącznie z przestrzennym
rozmieszczeniem łańcuchów bocznych:
Białka są pofałdowane
w zwarte struktury
Przestrzenna konformacja
polipeptydu utrzymuje się
dzięki różnym
oddziaływaniom i
wiązaniom
28

Zwinięcie polipeptydu
nadaje cząsteczce
trójwymiarowy kształt.
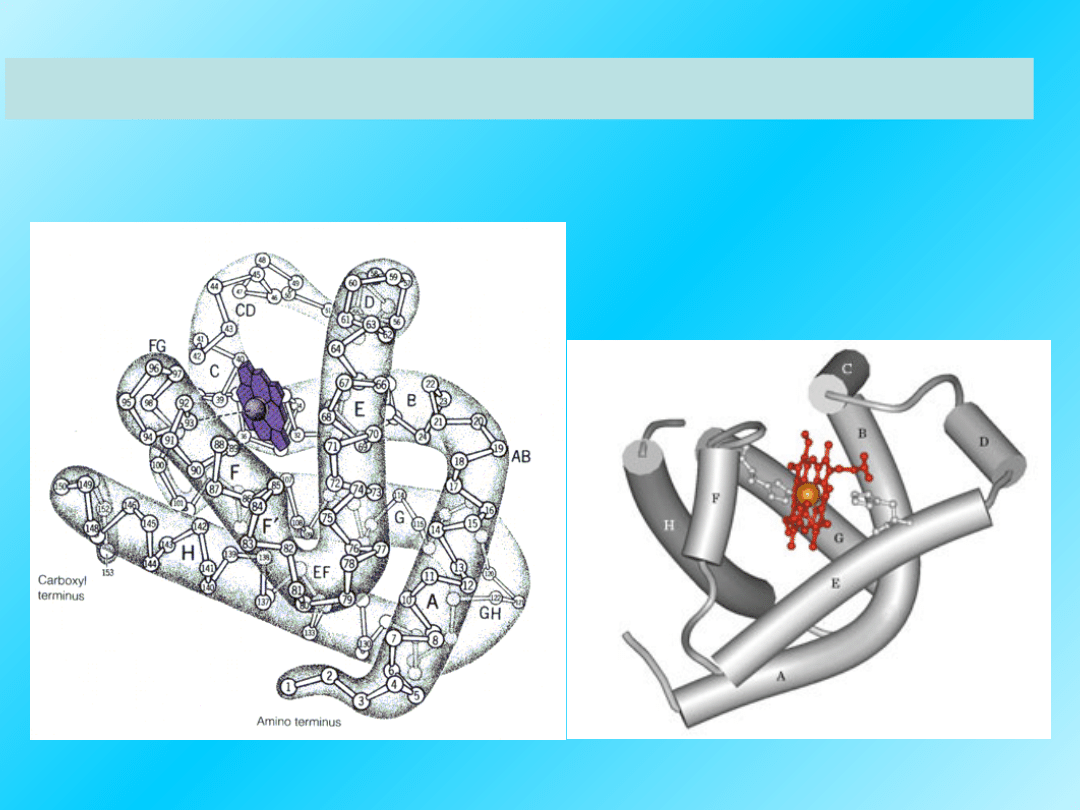
Przykład struktury trzeciorzędowej białka:
Mioglobina
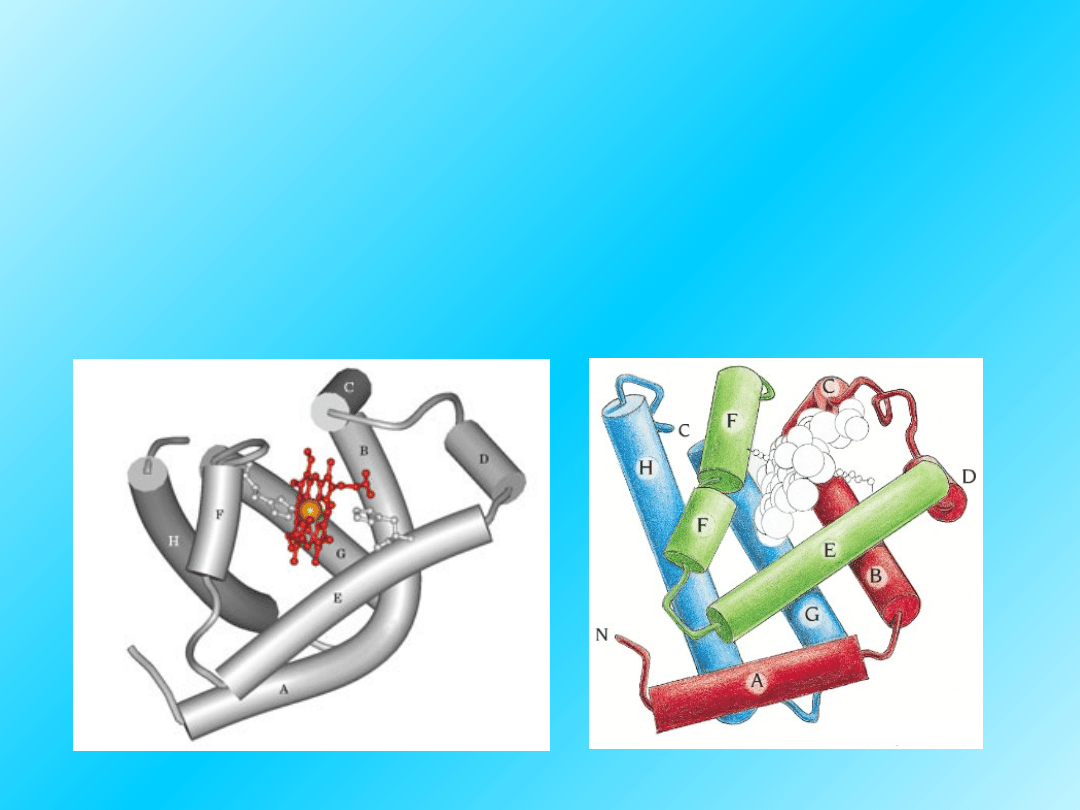
Mioglobina
Białko mięśni szkieletowych wiążące tlen cząsteczkowy. Składa
się z 153 reszt aminokwasowych i hemu. Około 75% reszt
aminokwasowych ma strukturę alfa-helisy.
31
Mioglobina ma strukturę trzeciorzędową zbliżoną do
hemoglobiny (do łańcuchów alfa i beta) a z
podobieństwo ich budowy wynika zdolność do
odwracalnego wiązania tlenu.

III-rzędowa struktura jest stabilizowana przez
niekowalencyjne interakcje
pomiędzy pofałdowanym
łańcuchem polipeptydowym takie jak:
• oddziaływania wodorowe,
• oddziaływania Van der Waalsa,
• oddziaływania hydrofobowe,
• w niektórych białkach przez wiązania z jonami
metali,
• oraz wiązania
wiązania
disiarczkowe
disiarczkowe
.
Trójwymiarowa struktura
białka zdeterminowana jest przez kilka
czynników, w tym przez sekwencję
aminokwasów w polipeptydzie i możliwości
oddziaływań między fragmentami
polipeptydu.
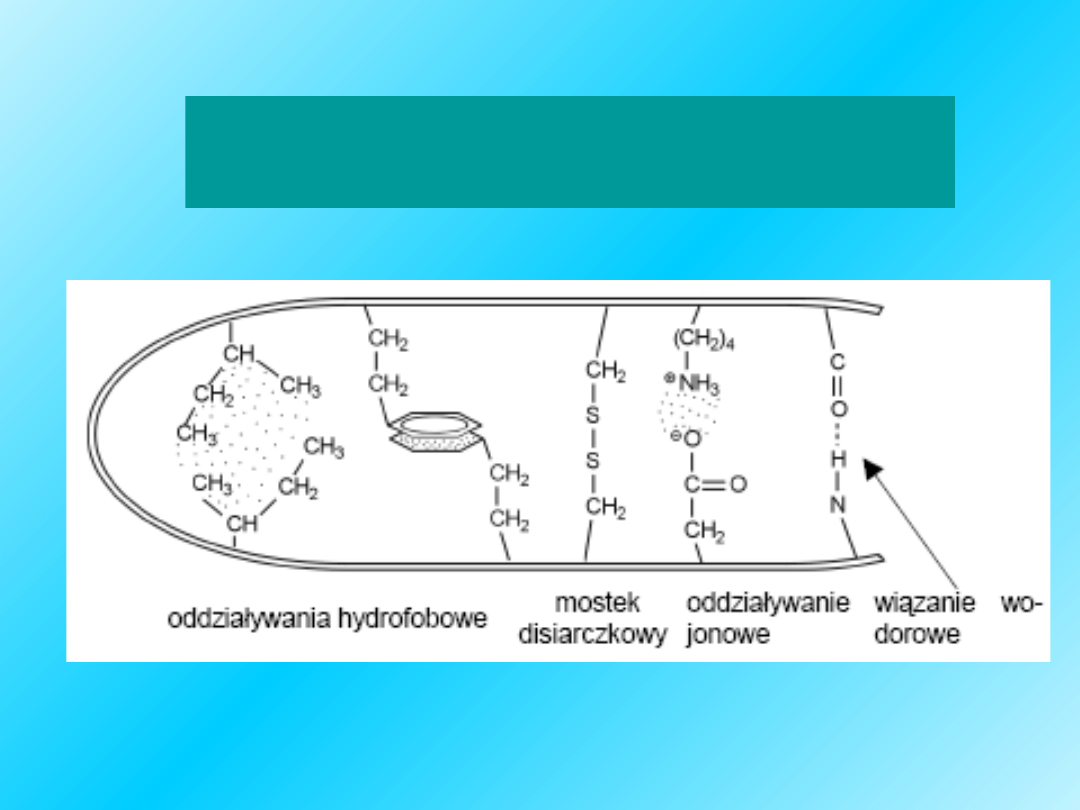
Czynniki stabilizujące
strukturę: przestrzenną
34
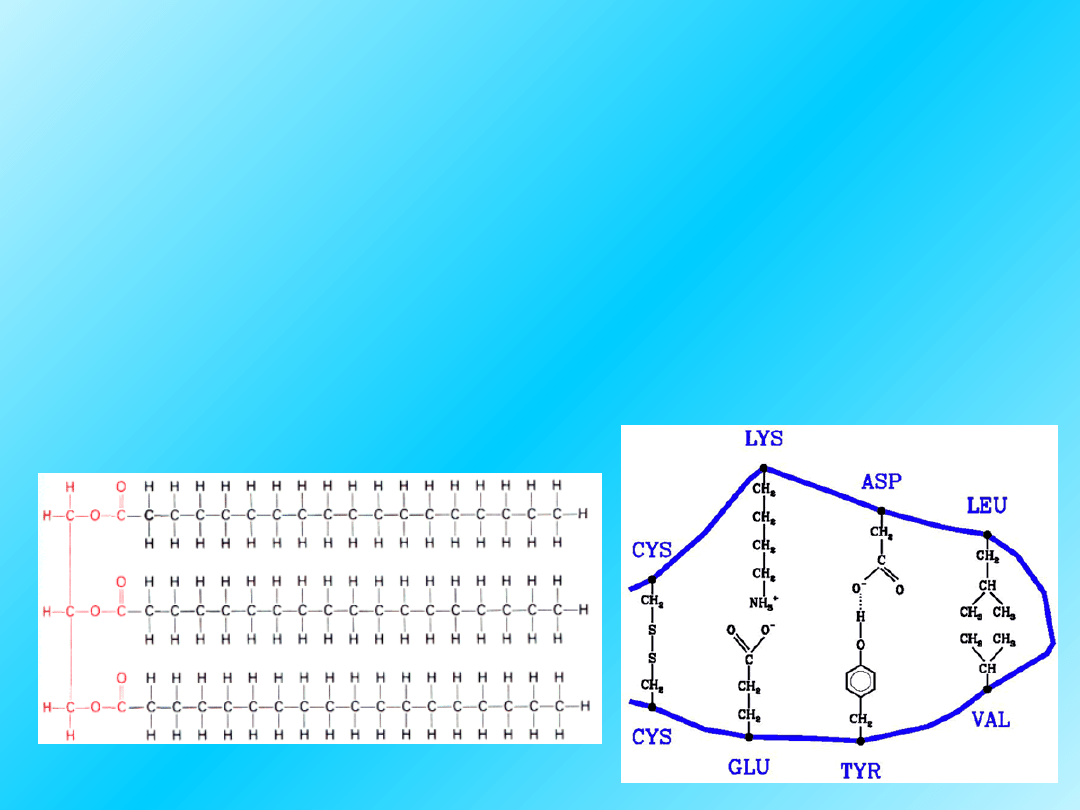
oddziaływania hydrofobowe
(wiązania hydrofobowe)
• w środowisku wodnym aminokwasy z
niepolarnymi łańcuchami bocznymi mają
tendencje do lokalizacji w głębi cząsteczki
białkowej i asocjacji z łańcuchami bocznymi
innych aminokwasów - wiązania hydrofobowe
cząsteczka tristearynianu
35
Wiązania disiarczkowe mogą łączyć
kilka polipeptydowych łańcuchów
razem
albo
mogą łączyć segmenty tego samego
polipeptydoweo łańcucha:
Intra-S-S-bridge
Inter-S-S-

We wszystkich drugorzędowych
strukturach, oddziaływania wodorowe
powstają
pomiędzy –C=O oraz H-N-
należącymi do szkieletu łańcucha
peptydowego
.
W strukturze III-rzędowej oddziaływania
wodorowe tworzą się między
grupami
bocznymi aminokwasów w sąsiadujących
łańcuchach
.
Różnica między oddziaływaniami
wodorowymi stabilizującymi
struktury II i III-rzędowe:

Struktura IV-
rzędowa:
jest najwyższym poziomem organizacji
białek, zbudowanych z dwóch lub
więcej polipeptydów, dotyczy zatem
jedynie białek oligomerycznych
.
.
Skład i wzajemny układ przestrzenny
polipeptydowych podjednostek w
obrębie jednej cząsteczki białkowej
nazwany jest strukturą
czwartorzędową białka
38
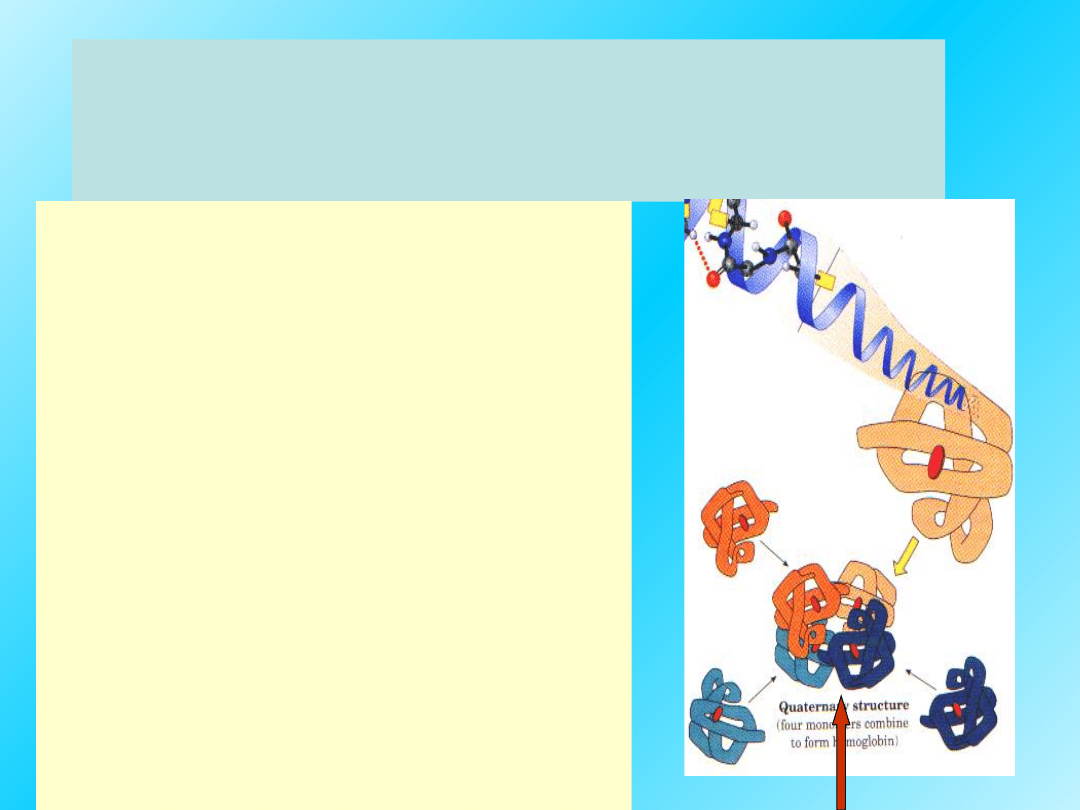
Białka o IV-rzędowej strukturze są
cząsteczkami złożonymi z
podjednostek:
Termin
„czwartorzędowa
struktura” odnosi się
do niekowalencyjnego
oddziaływania kilku
podjednostek
polipeptydowego
łańcucha.
IV-rzędowa struktura
zwykle jest
symetryczna
39
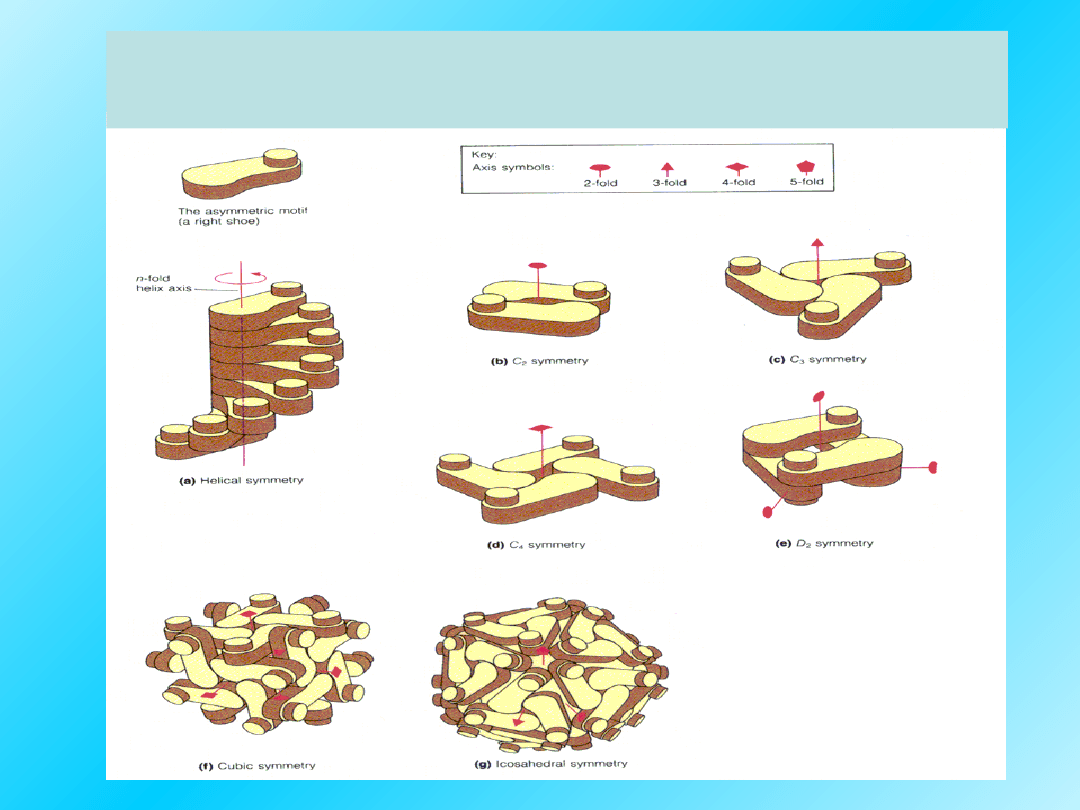
Przylegające podjednostki mogą układać
się w różny sposób:

Przykłady:
białek z IV-rzędową
strukturą:
Hemoglobina
Enzymy allosteryczne
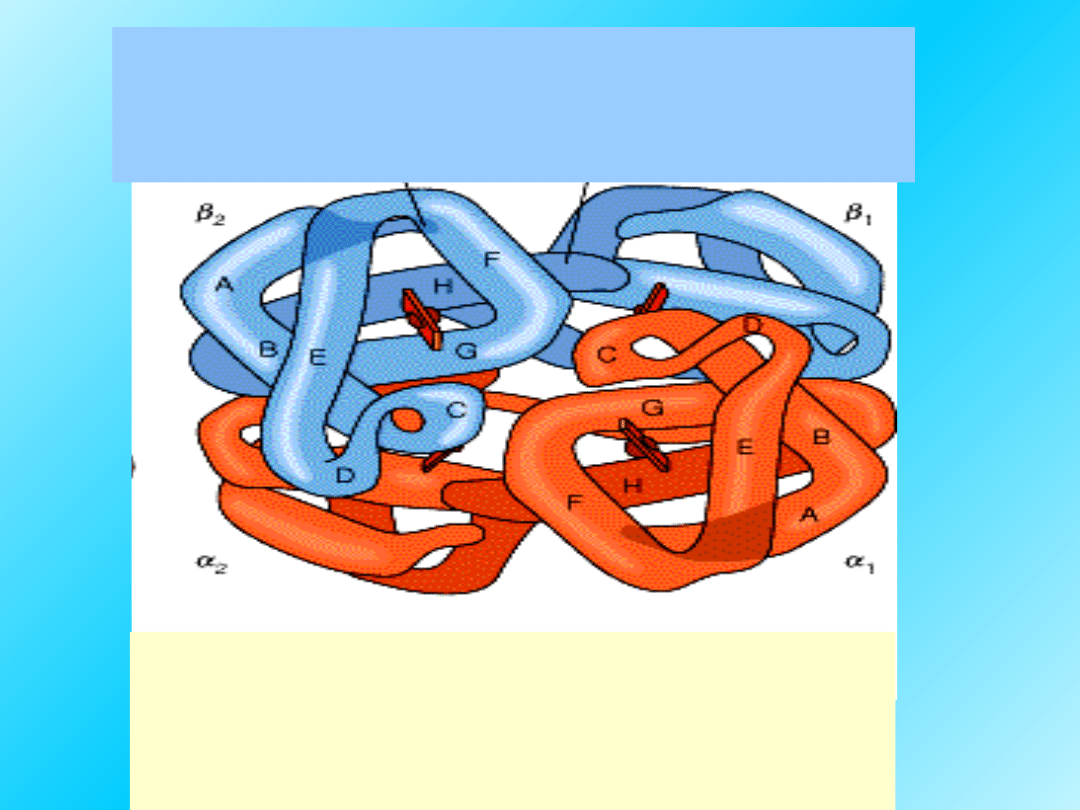
Hemoglobina
składa się z
identycznych
dwóch α-łańcuchów i dwóch β :
α i β łańcuchy mają podobną
strukturę,
ale różnią się sekwencją i
pofałdowaniem.
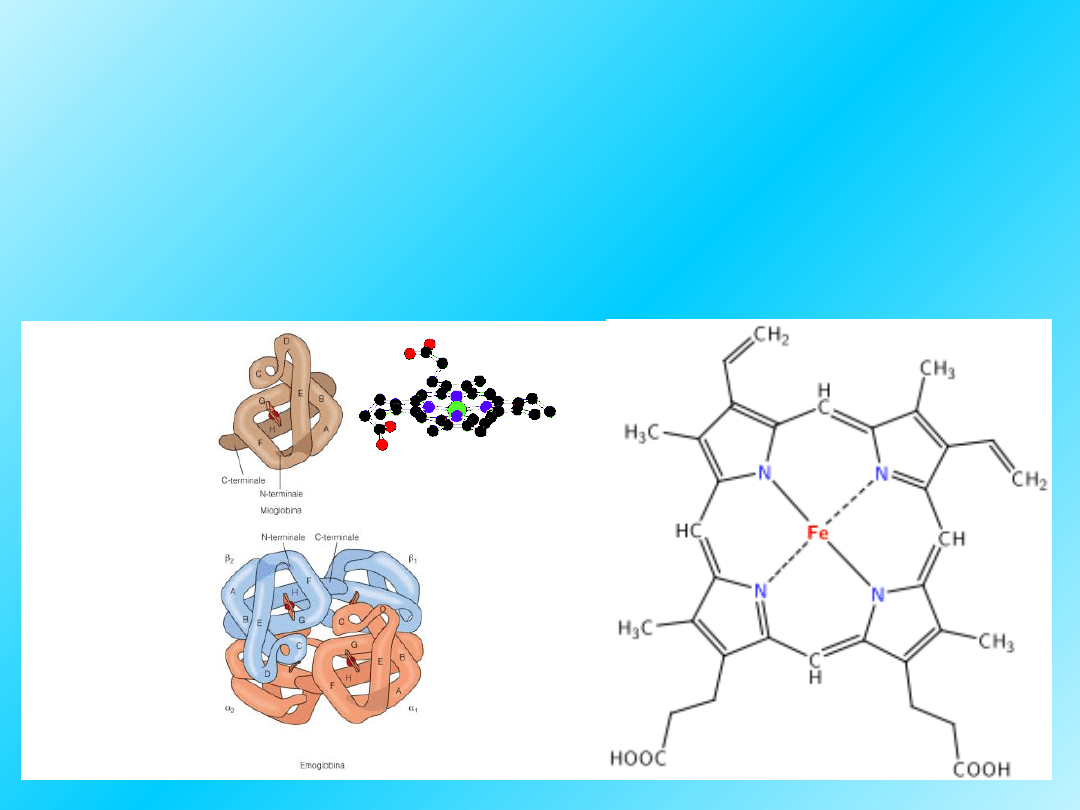
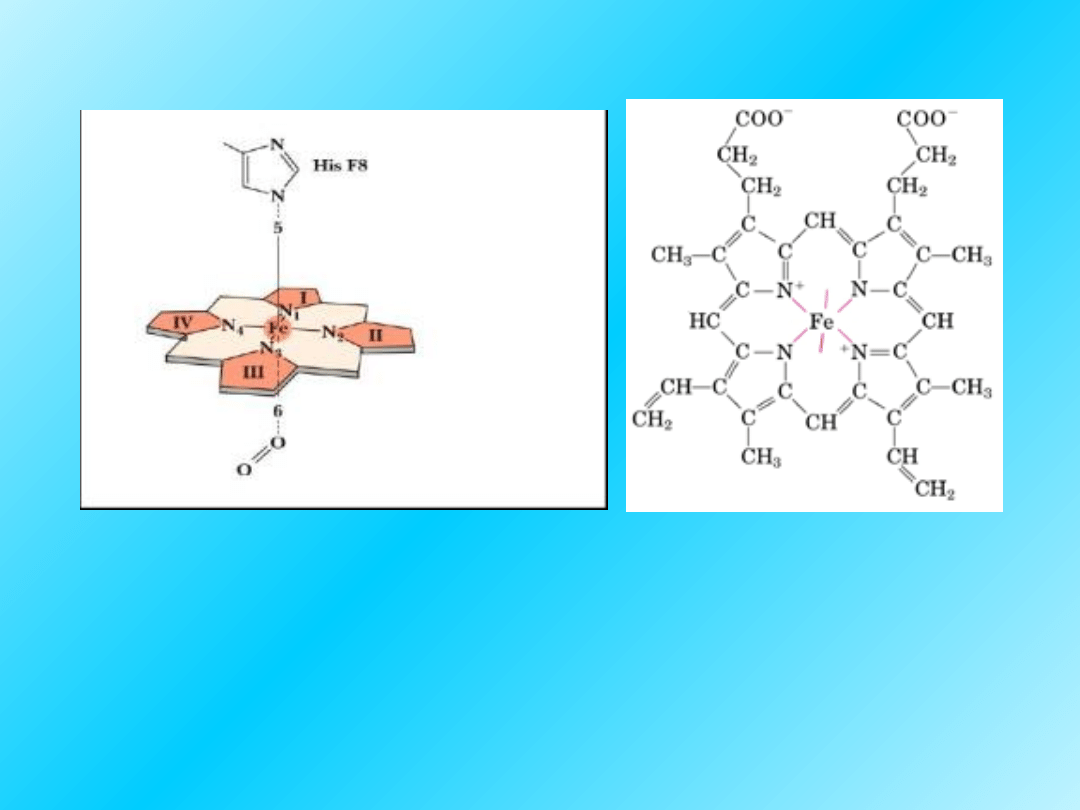
Cząsteczka tlenu jest wiązana przez jon żelaza (II),
który znajduje się w otoczeniu hemowym. Hem jest
tetrapirolowym układem makrocyklicznym, którego
cztery atomy azotu trwale wiążą jony metali
przejściowych; w hemie jest nim żelazo (II/III):

Białko
hemoglobinowe u
osobników chorych na
anemię sierpowatą
jest genetycznie
zmienione; miejsce
kwasu
glutaminowego
zastępuje walina.
45

Architektura oligomerów
utrzymywana
jest przez takie same oddziaływania
niekowalencyjne jak stabilizowana jest
struktura III-rzędowa:
Oddziaływania wodorowe,
Van der Waals’a,
Hydrofobowe interakcje,
ale wyjątkowo przez
mostki disiarczkowe.
Czynniki stabilizujące strukturę
podjednostkową, IV-rzędową:
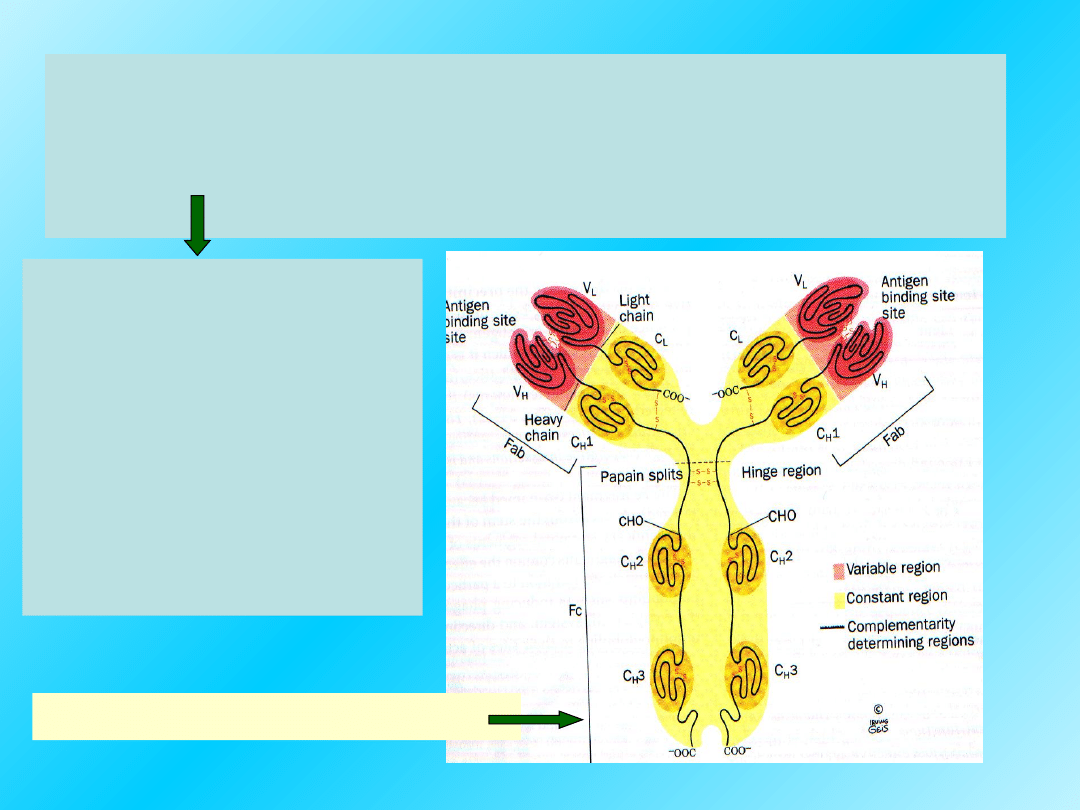
Niektóre białka, takie jak np.:
immunoglobulina, i insulina są
wielopodjednostkowymi cząsteczkami, ale
białka te nie mają struktury IV-rzędowej.
Indywidualne
łańcuchy
polipeptydowe w
tych białkach
połączone są
razem przez
mostki
disiarczkowe.
Struktura immunoglobuliny

Białka nie są cząsteczkami
statycznymi, podlegają ciągłym
zmianom, wewnętrznym ruchom,
ale ciągle są cząsteczkami
pofałdowanymi.
Energia białek może się zmieniać
w wyniku interakcji z
otoczeniem.
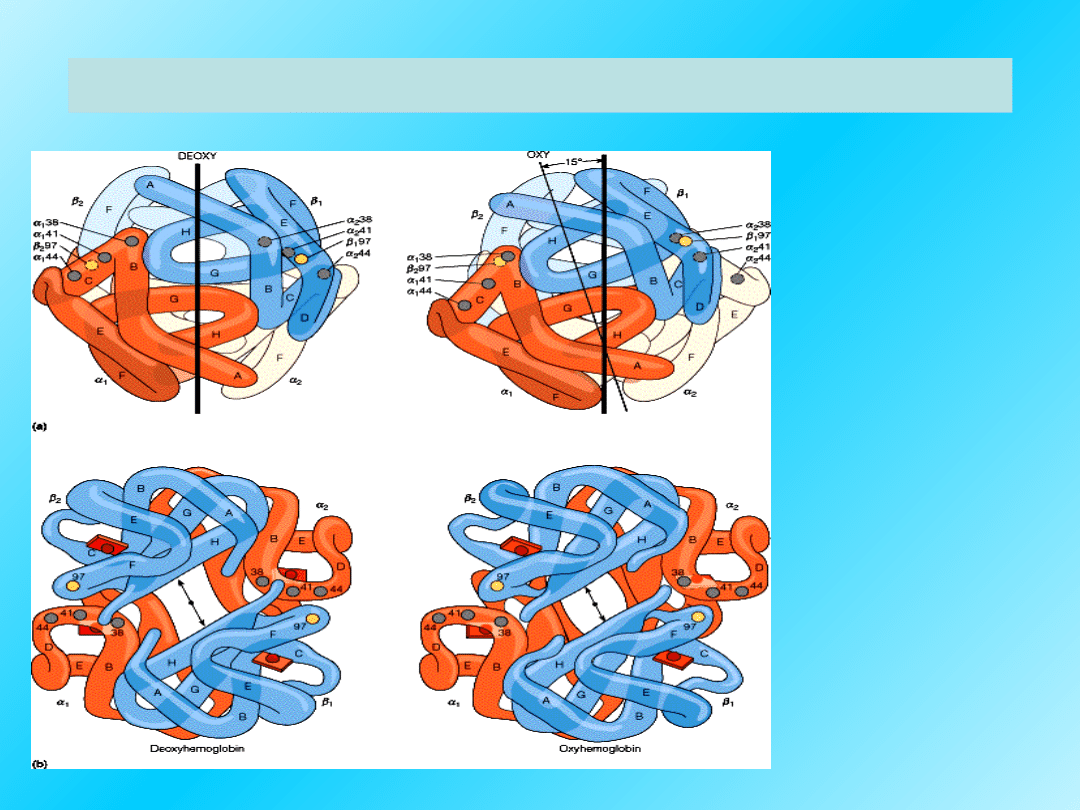
Białka są strukturami dynamicznymi:
DeoxyHb
OxyHb
Np.:
Podczas
utlenowani
a Hb
dochodzi
do zmian w
strukturze
IV-
rzędowej:
obrót i
przesunięc
ie

WŁASNOŚCI FIZYKOCHEMICZNE
WŁASNOŚCI FIZYKOCHEMICZNE
BIAŁEK
BIAŁEK
• Wielkość białek waha się w granicach 5–100 nm, ich
roztwory mają charakter koloidowy.
• Cechą białek jest powolna dyfuzja i niezdolność do
dializy, czyli do przenikania przez błony
półprzepuszczalne
• Większość białek dobrze rozpuszcza się w wodzie lub
rozcieńczonych roztworach soli, kwasów lub zasad.
O rozpuszczalności decyduje :
- zdolność do hydratacji,
- budowa chemiczna,
- obecność soli w środowisku
- pH roztworu
• Ładunek elektryczny cząsteczki
• Denaturacja białek
51
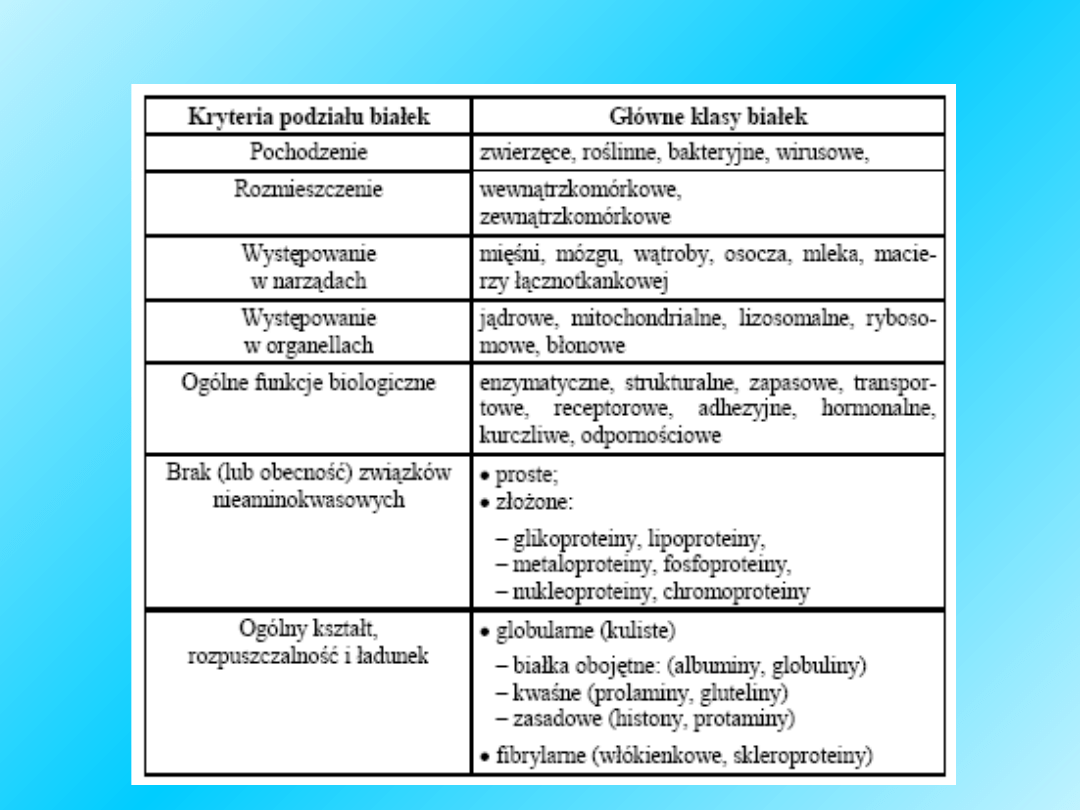
Kryteria podziału białek i ich główne
Kryteria podziału białek i ich główne
klasy
klasy

W organizmie człowieka białka tworzą
W organizmie człowieka białka tworzą
połączenia z innymi związkami
połączenia z innymi związkami
chemicznymi:
chemicznymi:
Fosfoproteiny
Fosfoproteiny
zawierają kwas fosforowy estrowo
związany z grupami -OH seryny i treoniny. Przykładem
jest kazeina mleka (0,71% fosforu).
Glikoproteiny
Glikoproteiny
to białka połączone z cukrowcami. Należą
do nich, lektyny, kolagen, ceruloplazmina, fibrynogen,
haptoglobuliny, mucyna, transferyna. W skład istoty
podstawowej tkanki łącznej wchodzą laminina i
fibronektyna.
Lipoproteiny
Lipoproteiny
są połączeniami tłuszczowców z białkami,
np. lecytyna związana z albuminą żółtka w komórce
jajowej. Wyróżnia się 4 frakcje lipoprotein krwi: HDL -
high density lipoproteins (o dużej gęstości; 18-30%), beta
- LDL (o małej gęstości; 50-70%), beta2 VLDL - very low
density lipoprotein (o bardzo małej gęstości),
chylomikrony (produkowane przez komórki adsorpcyjne
nabłonka jelita, a rozkładane przez hepatocyty). Duże
stężenie LDL (low density lipoprotein) sprzyja rozwojowi
miażdżycy.
53

Chromoproteiny
Chromoproteiny
są to białka połączone z różnymi
barwnikami: hemoglobina, hemocyjanina,
cytochromy, rodopsyna, melanoproteidy,
flawoproteidy, ceruloplazmina (transportuje
miedź), transferryna (transportuje żelazo).
Nukleoproteiny
Nukleoproteiny
to białka wielkocząsteczkowe
połączone z kwasami nukleinowymi: histony,
białka niehistonowe (m.cz. 30000-225000).
Mukoproteiny
Mukoproteiny
- grupa białkowców zawierająca w
składzie więcej niż 4% cukrowca. Obecnie jest
włączona do glikoproteidów. Dawniej zaliczano tu
mucynę, obecną w śluzie (ślina). Mucyna jest
glikoproteiną kwaśną, zawierającą kwas sialowy.
54

Na podstawie różnic w strukturze
białka dzieli się na:
Fibrylarne
Globularne
i
55

Białka globularne
stanowią istotną klasę białek.
Białka globularne
nazwano tak, ponieważ
ich łańcuchy polipeptydowe,
w przeciwieństwie do białek
włókienkowych, zwinięte są w zwarte
struktury, przypominających globulę.
Białka globularne charakteryzują się
indywidualną strukturą trójwymiarową.
56

Białka globularne:
liczna i ważna grupa makrocząsteczek
ze względu na różnorodną funkcję
w procesach życiowych.
Przykłady:
Mioglobina, hemoglobina,
Immunoglobuliny,
Albuminy,
Transportowe,
Cytokiny,
Enzymy,
Uczestniczące w kontroli biologicznej,
Białka receptorowe…
57
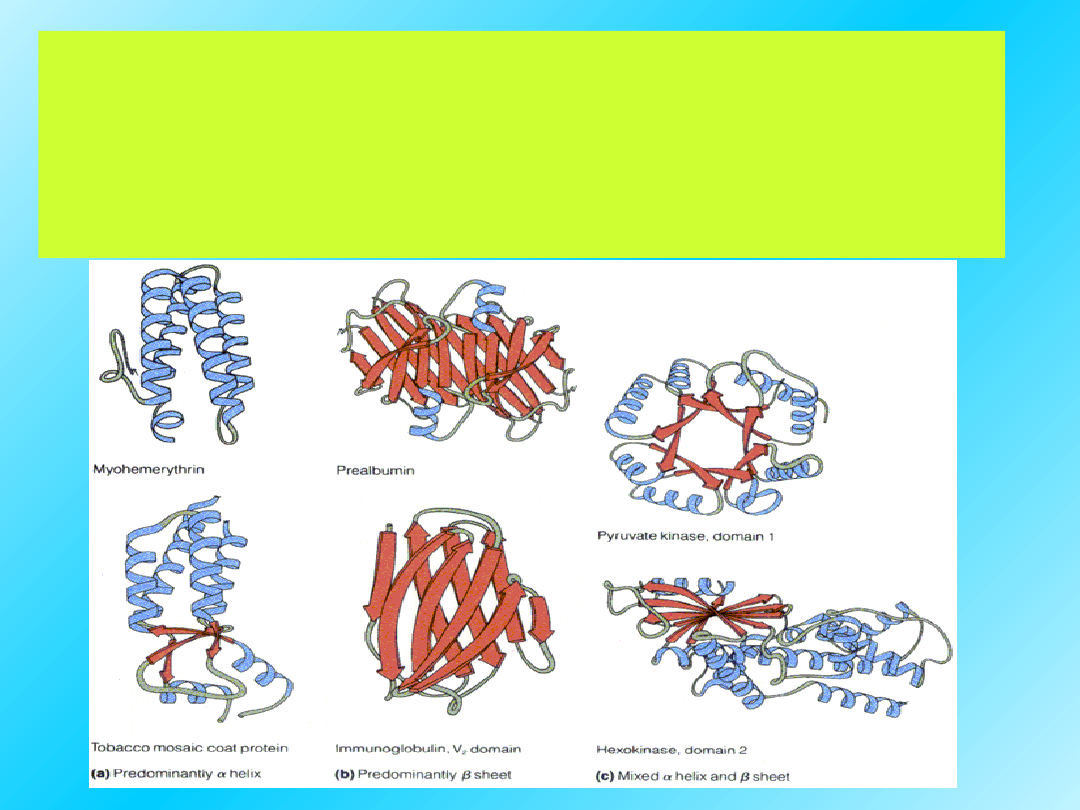
Globularne białka
mogą zawierać kombinacje
struktur helikalnych, β
kartki i nieregulrnej.
Proporcje tych struktur są charakterystyczne
dla danego białka.

Białka globularne,
nie są cząsteczkami statycznymi,
podlegają ciągłym i różnorodnym
wewnętrznych ruchom.
Właściwość ta jest związana z
przepływem energii i jest
konsekwencją interakcji białka
z otoczeniem.

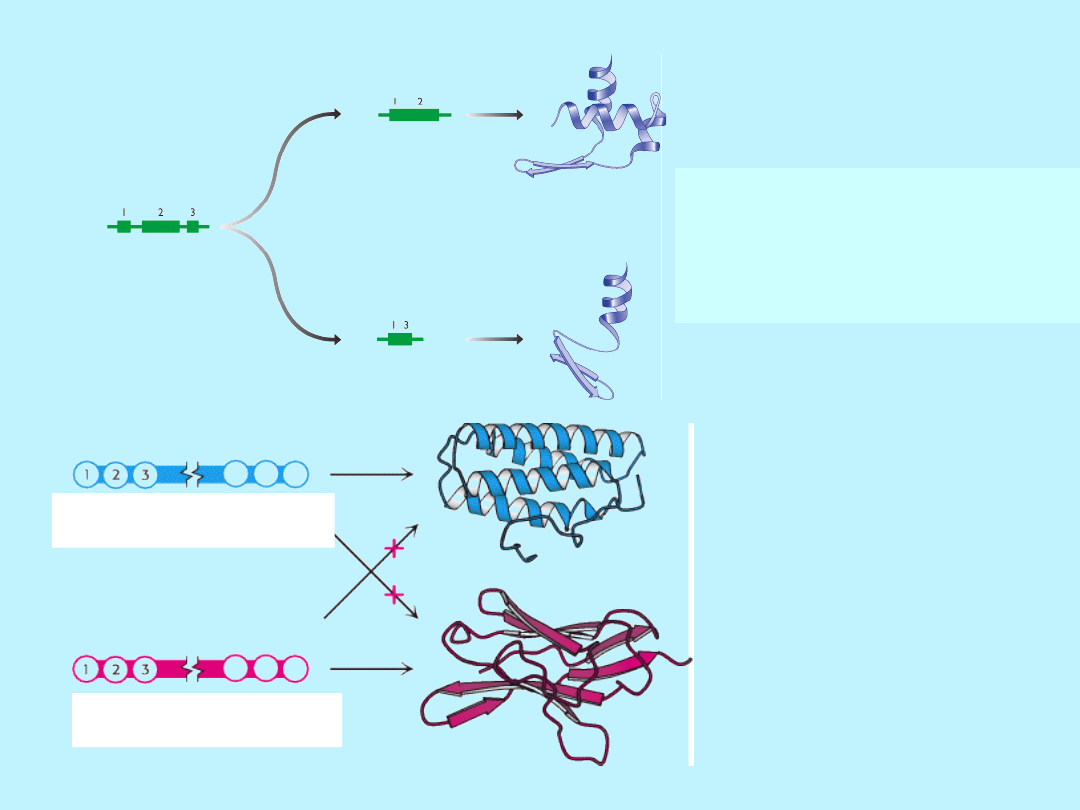
W strukturze dużych białek
globularnych można wyróżnić
domeny:
Łańcuchy polipeptydowe,
które składają się z więcej niż ~200
aminokwasów pofałdowane są zwykle
w 2 lub więcej zgrupowanych struktur
nazywanych
domenami,
nadają one białku charakterystyczny
wygląd.
60

Na podstawie różnic w strukturze
białka dzieli się na:
Fibrylarne
Globularne
i

Białka fibrylarne
(włókienkowe):
Odróżnia je od białek globularnych
włókienkowy, wydłużony kształt:
stosunek długości do średnicy > 10
Większość z nich stanowi strukturalny
materiał komórek i tkanek zwierzęcych;
Np. : białka skóry, tkanki łącznej, włosów,
jedwabiu, włókien zwierzęcych.
Fibrylarne białka składają się głównie
z niepolarnych aminokwasów
62

Wewnątrzkomórkowymi białkami
fibrylarnymi są keratyny-α i keratyny-β
Zewnątrzkomórkowymi białkami
fibrylarnymi są kolageny i elastyna.
63

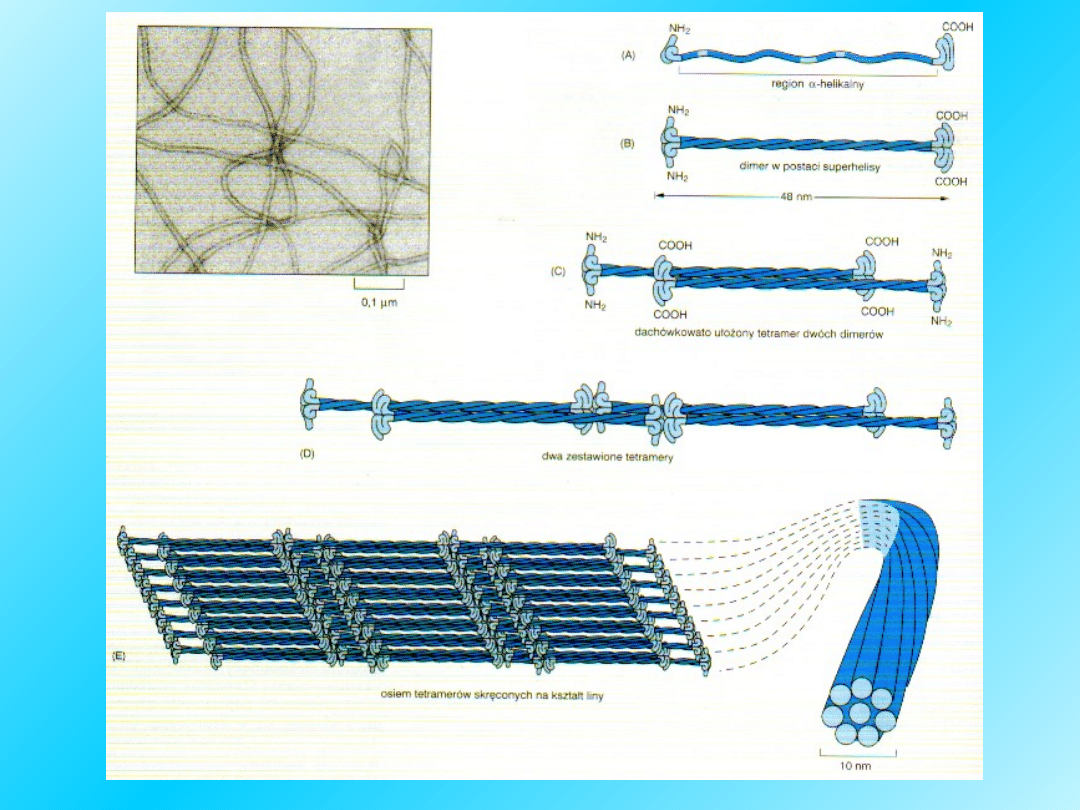
Kolagen
Dł. 300 nm
średnica: 1,4 nm
Występuje w tkance łącznej,
kościach, zębach, ścięgnach,
skórze,
macierzy zewnątrzkomórkowej
39

Najczęściej występujące aminokwasy w
kolagenie to:
Gly 33%,
Pro
-
Hyp 22%,
Ala
11%.
Kolagen zawiera hydroksylizynę,
która rzadko występuje w innych białkach.

Kolagen
Struktura I-rzędowa: ok. 1000 aminokwasów,
Powtarzająca się sekwencja Gly-Pro-Hyp (gdzie
Hyp – hydroksyprolina)
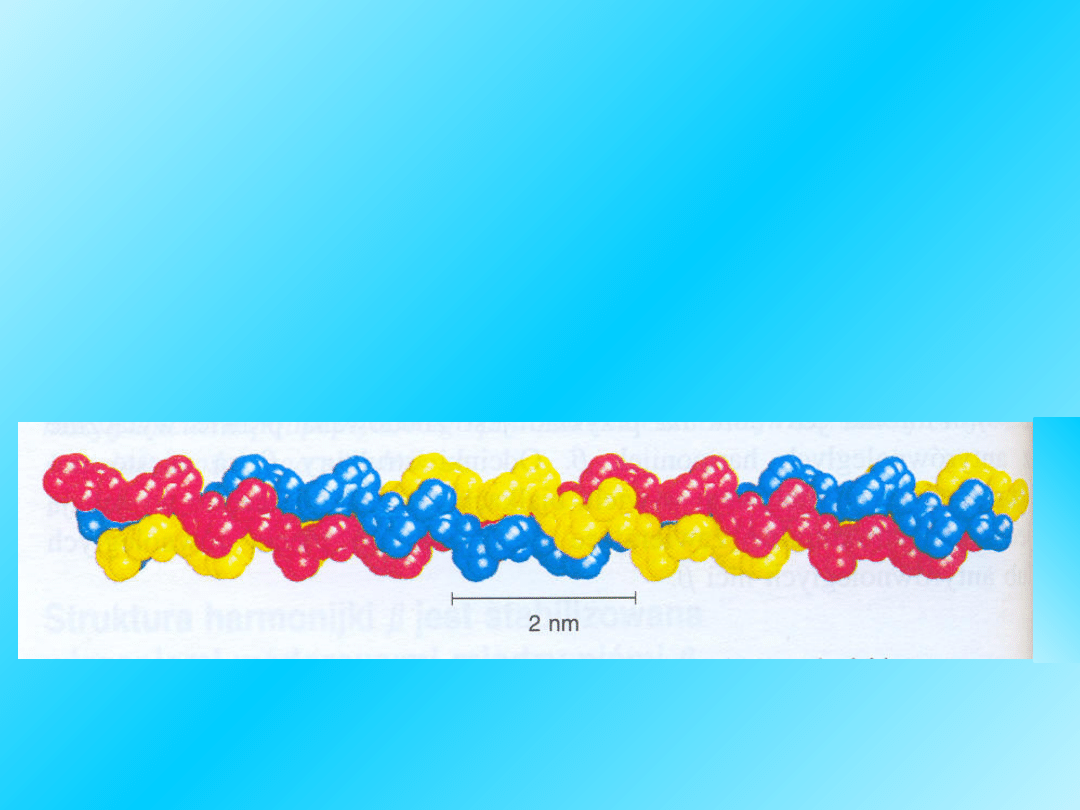
Struktura II-rzędowa: trzy nawinięte
na siebie helisy alfa, cząsteczka ma
kształt cylindryczny
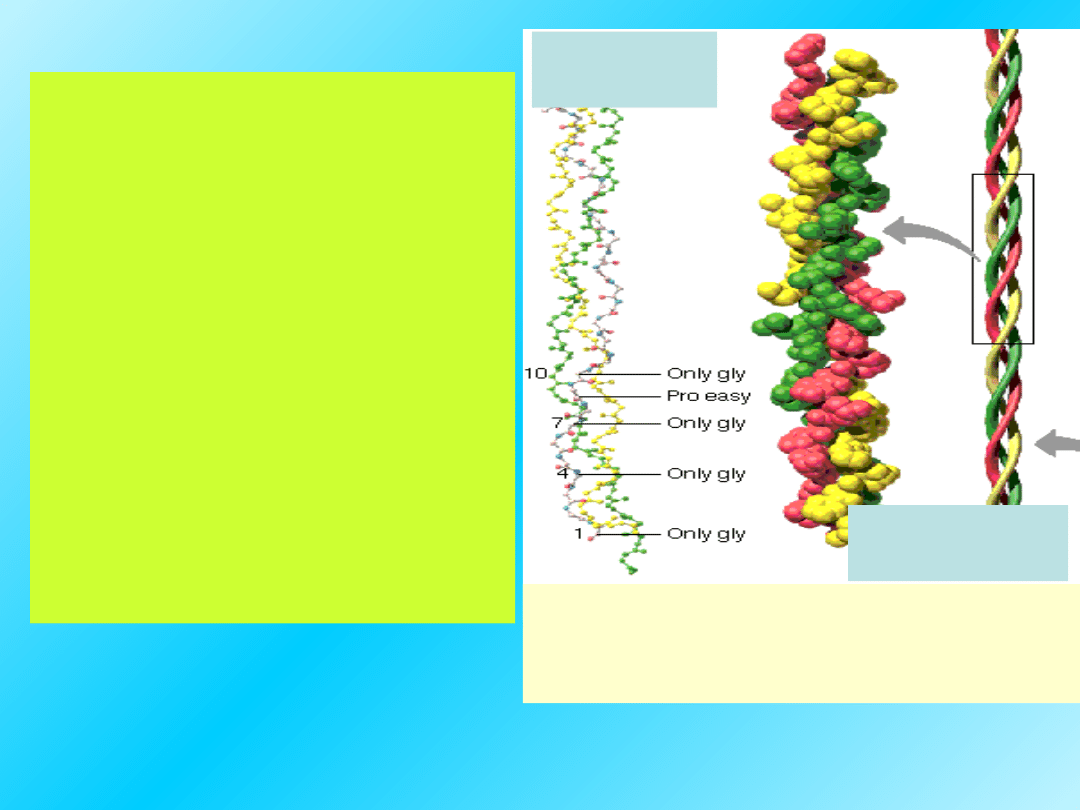
Łańcuch
lewoskrętny
Drugorzędową strukturę
helikalną należy rozpatrywać
na 2 poziomach:
Każdy polipeptyd jest
lewoskrętną rozciągniętą
helisą
Te 3 helikalne razem zwinięte
polipeptydy zebrane są w
kable tropokolagenu
następnie 3 takie jednostki
zwinięte są w prawoskrętną
superhelisę.
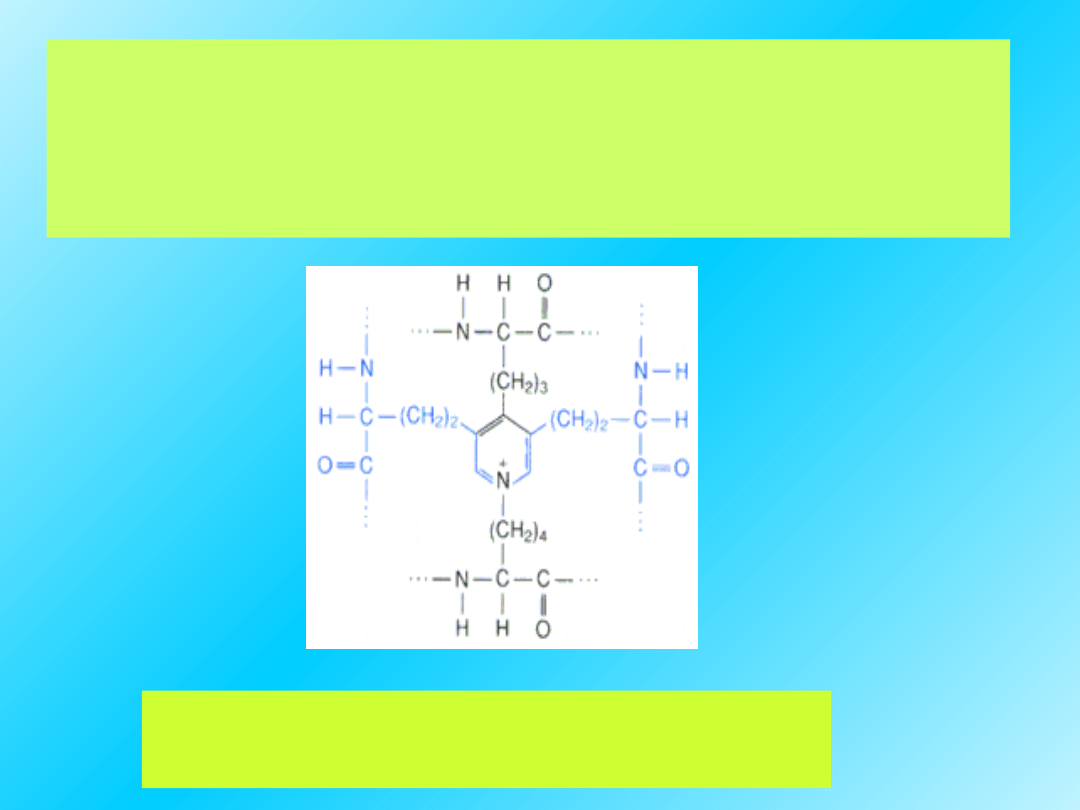
Międzyłańcuchowe wiązania
wodorowe między resztami lizyny
stabilizują strukturę tropokolagenu.
Potrójna helisa
prawoskrętna

Pomiędzy końcami jednostek kolagenu
znajduje się wolna przestrzeń, która odgrywa
istotną rolę
w tworzeniu kości i zębów.
W tych miejscach
odkładają się kryształy
hydroksyapatytu
Ca
3
(PO
4
)
3
OH.
Połączenie hydroksyapatytu z kolagenem
tworzy twardy i sprężysty materiał.

Wolne grupy karbonylowe allizyny przy N-
końcu jednego łańcucha kondensują z grupami
lizynowymi C-końca drugiego polipeptydu
(kondensacja aldolowa).
W kolejnych etapach przy udziale reszt
histydyny i i hydroksylizyny tworzą się
złożone
krzyżowe wiązania międzycząsteczkowe.
Struktura tropokolagenu podlega
usztywnieniu.

Nadmierna ilość krzyżowych-wiązań
w kolagenie zasocjowana jest z
procesem starzenia.
Proces wiązań krzyżowych zachodzi ciągle w
życiu, i akumulacja tych wiązań powoduje, że
struktura kolagenu
jest sztywna, mniej elastyczna,
bardziej krucha.
W rezultacie, kości i ścięgna u starszych ludzi są
poddatne na złamania
a skóra traci elastyczność.

Wiązania krzyżowe nie tworzą się
w wystarczającej ilości u zwierząt
karmionych słodkim grochem.
Groch Lathyrus odoratus zawiera
aminopropionitril
, który jest inhibitorem
enzymu odpowiedzialnego za modyfikację
lizyn.
Konsekwencją są nie w pełni ukształtowane
kości.
Zwierzęta cierpią wtedy na latyryzm.

W awitaminozie C zahamowany jest proces
hydroksylacji proliny. Enzym uczestniczący w
reakcji wymaga obecności Vit.C.
Grupy –OH hydroksyproliny uczestniczą w
tworzeniu wiązań wodorowych utrzymujących
strukturę tropokolagenu.
W konsekwencji braku hydroksyproliny
i zmniejszonej ilości oddziaływań wodorowych
włókna kolagenu są słabsze.
Dochodzi do nieprawidłowego tworzenie kości,
zębów, dziąseł, naczyń krwionośnych.
Szkorbut:

Hydroksyprolina (Hyp) jest wytwarzana przez
organizmy ssaków z proliny. Enzym
uczestniczący w reakcji wymaga obecności Vit.C.
Grupy –OH hydroksyproliny uczestniczą w
tworzeniu wiązań wodorowych utrzymujących
strukturę tropokolagenu.
Brak witaminy C w diecie powoduje, że w
kolagenie zamiast Hyp występuje Pro.
W
konsekwencji braku hydroksyproliny i
zmniejszonej ilości oddziaływań wodorowych
włókna kolagenu są słabsze.
Dochodzi do nieprawidłowego tworzenie kości,
zębów, dziąseł, naczyń krwionośnych.
Szkorbut:

Kolageny obecne w różnych organach różnią się
typami łańcuchów polipeptydowych.
Różnice polegają na odmiennym składzie aa,
zawartości cukrów, ilości wiązań krzyżowych.
Jakkolwiek każdy typ łańcucha zawiera
charakterystyczny zestaw sekwencji
Gly-Pro-Hyp
Opisanych jest ponad 10 typów kolagenów I-
XIV
Kolagen typu I występuje najczęściej w ludzkim
organizmie i stanowi ~ 90% wszystkich typów
kolagenów.
Elastyna
obecna jest w ścianach naczyń krwionośnych, w
płucach, skórze, w więzadłach
i tworzy wysoce elastyczne włókna.
Zawiera wysoką ilość aminokwasów
hydrofobowych.

działa podobnie jak guma,
jest rozciągliwa i nierozpuszczalna.
Nadaje sprężystość płucom,
naczyniom krwionośnym
i więzadłom.
Elastyna

Keratyny
Wykazują głównie strukturę α helikalną.
Znane są dwie klasy keratyn:
α
i
β
.
α -Keratyna
jest podstawowym białkiem
włosów i paznokci
oraz jest składnikiem skóry zwierzęcej.

Skręcone kable
α keratyn
są rozciągliwe i giętkie.
α keratyny pochodzące z odmiennych tkanek różnią
się stopniem twardości i ilością mostków
disiarczkowych obecnych na różnych poziomach
włókien.
α keratyny paznokci mają wiele krzyżowych wiążań –
S-S- , natomiast α keratyny włosów mniej.
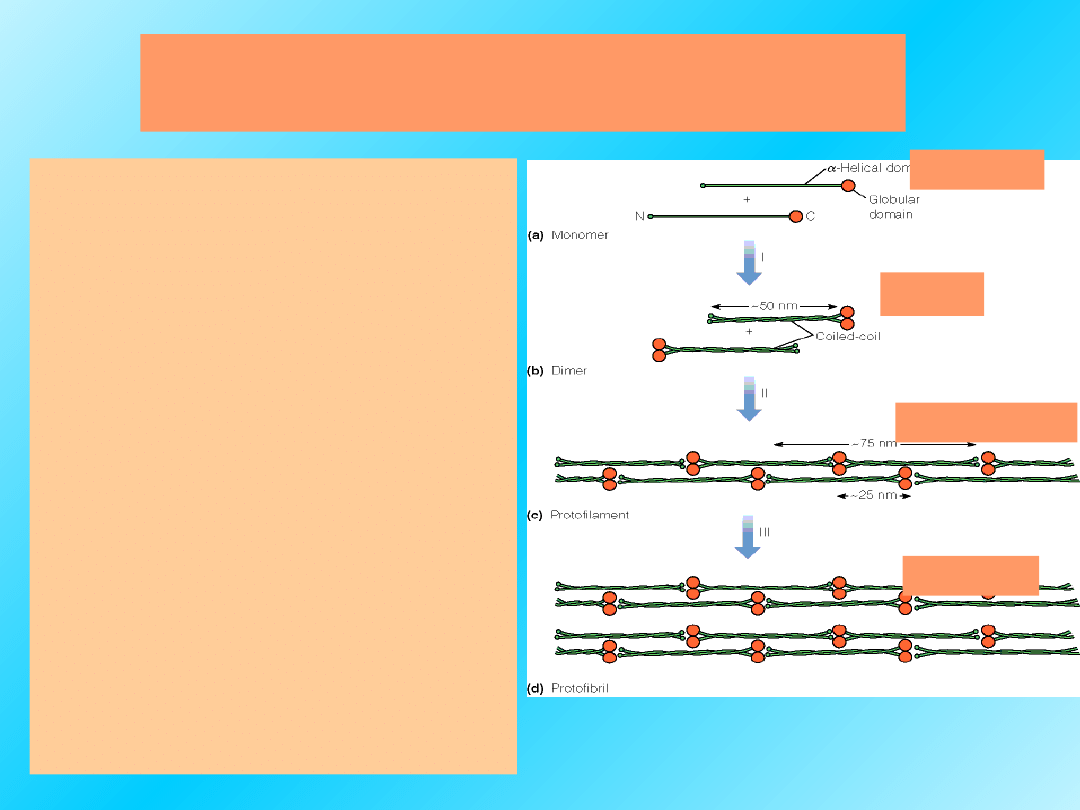
Proponowana struktura
filamentów typu
keratynowego:
W pośredniej
strukturze
filamentów, pary
zwiniętych zwojów
wykazują tendencję do
asocjacji 4 łańcuchów
w
protofilamenty,
a następnie dwa te
zwoje upakowują się
razem tworząc
protofibryle,
które
dalej mogą asocjować.
Dimer
Monomer
Protofilament
Protofibril

Inne przykłady białek fibrylarnych
:
Matriks tkanki łącznej zawiera obok
proteoglikanów, kolagenu i elastyny:
fibronektynę i lamininę
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
Wyszukiwarka
Podobne podstrony:
Białka wiążące wapń
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
BM1 Białka
04) Kod genetyczny i białka (wykład 4)
Wyklad 03 Białka3
BIOSYNTEZA BIAŁKA
Białka 08 06 05
Białka
Białka
bialkaII
Białka1
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Regulacja białka supresorowego nowotworów p53. Biologia molekularna. Seminarium 1, biologia- studia
Oczyszczanie ludzkiego białka P2 na drodze chromatografii powinowactwa
mater białka instrukcja wykonania doświadczenia
Referat białka
Sprawozdanie białka
więcej podobnych podstron