
Cele i zadania
Cele i zadania
farmakologii klinicznej
farmakologii klinicznej
Dr n.med. Monika Żurawska-
Dr n.med. Monika Żurawska-
Kliś
Kliś

FARMAKOLOGIA KLINICZNA
FARMAKOLOGIA KLINICZNA
nauka o klinicznych aspektach
nauka o klinicznych aspektach
farmakoterapii
farmakoterapii

Działy farmakologii
Działy farmakologii
klinicznej
klinicznej
•
Farmakokinetyka
•
Terapia monitorowana
•
Interakcje leków
•
Farmakogenetyka
•
Farmakologia społeczna
(problemy nadużywania, ekonomia)

Cele farmakologii klinicznej
Cele farmakologii klinicznej
•
Poprawa opieki
(maksymalizacja skuteczności i bezpieczeństwa)
•
Badania kliniczne
•
Dydaktyka (studenci i lekarze)
•
Usługi w oddziale klinicznym
- informacje o lekach
- planowanie badań
- poradnictwo
- analizy farmakokinetyki i farmakodynamiki

Głównym celem farmakologii
Głównym celem farmakologii
klinicznej jest poprawa
klinicznej jest poprawa
skuteczności i bezpieczeństwa
skuteczności i bezpieczeństwa
terapii
terapii
•

Podstawy
Podstawy
farmakokinetyki
farmakokinetyki
klinicznej
klinicznej
dr n.med. Monika Żurawska-
dr n.med. Monika Żurawska-
Kliś
Kliś

FARMAKOLOGIA
FARMAKOLOGIA
nauka o leku
nauka o leku
•
FARMAKOKINETYKA
– wpływ organizmu na lek
•
FARMAKODYNAMIKA
– wpływ leku na organizm
Procesy farmakokinetyczne
Procesy farmakokinetyczne
UWALNIANIE (liberation)
L
WCHŁANIANIE (absorption)
A
DYSTRYBUCJA (distribution)
D
METABOLIZM (metabolism)
M
WYDALANIE (excretion)
E
ELIMINACJA

Procesy farmakokinetyczne
Procesy farmakokinetyczne
L – UWALNIANIE (liberation)
A – WCHŁANIANIE (absorption)
D – DYSTRYBUCJA (distribution)
M – METABOLIZM (metabolism)
E – WYDALANIE (excretion)

UWALNIANIE
UWALNIANIE
Rozpad postaci, w której lek został
wprowadzony (np. tabletki lub kapsułki),
uwolnienie jego cząsteczek i ich
rozpuszczenie w płynach ustrojowych
Przebieg tych procesów zależy głównie od
czynników technologicznych

Procesy farmakokinetyczne
Procesy farmakokinetyczne
L – UWALNIANIE (liberation)
A – WCHŁANIANIE (absorption)
D – DYSTRYBUCJA (distribution)
M – METABOLIZM (metabolism)
E – WYDALANIE (excretion)

WCHŁANIANIE
WCHŁANIANIE
Procesy związane z przejściem leku z
miejsca podania do krążenia
ogólnego

WCHŁANIANIE
WCHŁANIANIE
TKANKI I NARZĄDY
Najczęściej przez przewód pokarmowy po podaniu
doustnym
żyła wrotna
żyły
wątrobowe
EFEKT PIERWSZEGO
PRZEJŚCIA

Efekt pierwszego przejścia
Efekt pierwszego przejścia
Intensywność metabolizowania leku w czasie
pierwszego przepływu przez wątrobę
Może wykluczyć doustną drogę podawania leku
lub sprawić, że dawka podawana doustnie jest
dużo większa niż równoważna jej dawka
podawana dożylnie
drogi podania:
– doustna
– do tętnicy wątrobowej lub żyły wrotnej
– doodbytnicza (częściowo)

Efekt pierwszego przejścia
Efekt pierwszego przejścia
Przykłady leków o dużym efekcie
pierwszego przejścia:
propranolol, metoprolol, acebutolol
nifedypina, werapamil
nitrogliceryna
ASA, paracetamol
petydyna, morfina
lidokaina

WCHŁANIANIE
WCHŁANIANIE
Pozostałe drogi podania leku:
dożylna
podskórna
domięśniowa
doodbytnicza
(stopień wchłaniania ograniczony, duże różnice międzyosobnicze
wchłaniania, częściowe ominięcie efektu pierwszego
przejścia)
donosowa
(uwaga na działanie ogólne)
podjęzykowa
(łatwość wchłaniania przy dobrym ukrwieniu, niewielka
powierzchnia)
wziewna
na skórę
(uwaga na większy stopień wchłaniania u niemowląt i osób starszych)
do worka spojówkowego
(uwaga na działanie ogólne)

WCHŁANIANIE
WCHŁANIANIE
Czynniki warunkujące wybór drogi
podania leku:
- właściwości fizykochemiczne leku
- oczekiwany początek działania leku
- docelowe miejsce działania leku
- stan ogólny pacjenta
- wiek pacjenta

Przechodzenie leków przez
Przechodzenie leków przez
błony biologiczne
błony biologiczne
Dyfuzja bierna, ułatwiona, przez pory
– rozpuszczalność w tłuszczach
– pH
– wielkość cząsteczki
Transport aktywny za pośrednictwem nośników
Pinocytoza

Dostępność biologiczna (F)
Dostępność biologiczna (F)
(biodostępność)
(biodostępność)
Ułamek dawki substancji leczniczej,
który dostaje się w formie aktywnej
farmakologicznie do krążenia
ogólnego
po podaniu pozanaczyniowym oraz
szybkość, z jaką ten proces zachodzi

Czynniki warunkujące
Czynniki warunkujące
dostępność biologiczną:
dostępność biologiczną:
droga podania
(po podaniu dożylnym = 1 (100%)
właściwości fizykochemiczne preparatu – warunkują szybkość i
ilość substancji czynnej uwolnionej z postaci leku
(rozpuszczalność, lipofilność, stopień zjonizowania, masa cząsteczkowa, substancje
pomocnicze)
stan fizjopatologiczny organizmu
(zmiany pH lub motoryki przewodu pokarmowego, choroby przewodu pokarmowego lub
wątroby)
efekt pierwszego przejścia
interakcje pomiędzy lekami lub lekiem i treścią pokarmową w
miejscu wchłaniania
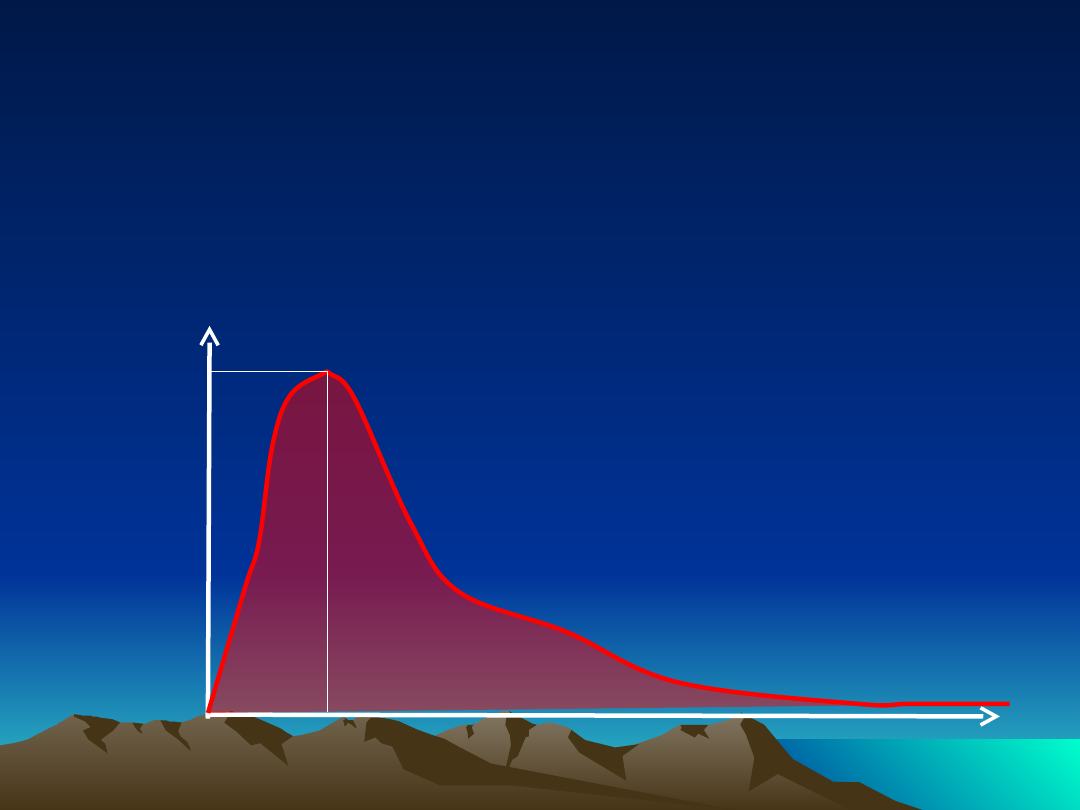
Oceniane parametry
farmakokinetyczne
Oceniane parametry
farmakokinetyczne
Cmax
- stężenie
maksymalne
T- Cmax -
czas do
osiągnięcia
stężenia maksymalnego
Cmax
- stężenie
maksymalne
T- Cmax -
czas do
osiągnięcia
stężenia maksymalnego
Stężenie
leku w
osoczu
Czas ~
AUC (Area under the Curve) - pole pod krzywą stężenia
leku we krwi
zależne od
czasu
AUC (Area under the Curve) - pole pod krzywą stężenia
leku we krwi
zależne od
czasu
T- C
max
C
max
AUC
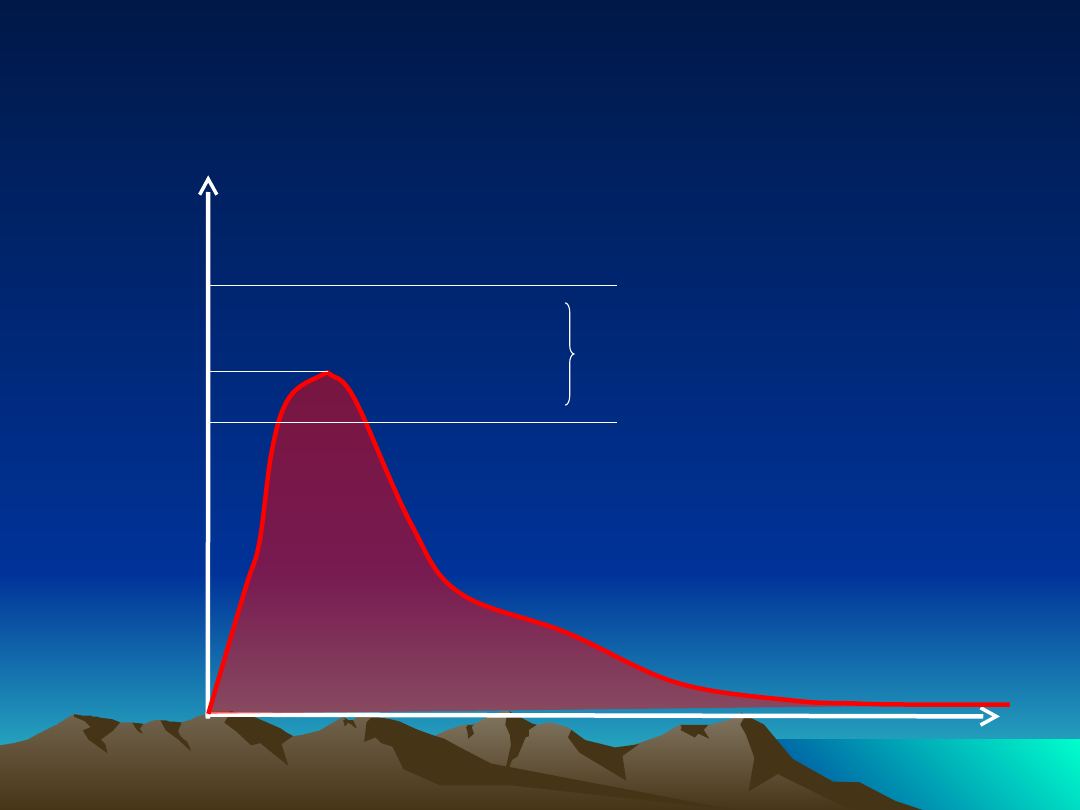
Oceniane parametry
farmakokinetyczne
Oceniane parametry
farmakokinetyczne
Stężenie
leku w
osoczu
Czas ~
C
max
MTC
–
Minimal Toxic Concentration
(minimalne stężenie toksyczne)
MEC
–
Minimal Effective
Concentration
(minimalne stężenie terapeutyczne)
MTC
MEC
zakres stężeń terapeutycznych

Dostępność biologiczna
Dostępność biologiczna
Bezwzględna
porównanie badanego leku podanego pozanaczyniowo z
tym samym lekiem podanym donaczyniowo
EBA =
Względna
porównanie preparatu badanego z preparatem
standardowym o znanej dostępności biologicznej
EBA =
EBA
-
Extend of Bioavailability
D
iv.
x AUC
po.
D
po.
x AUC
iv.
D
s
x AUC
b
D
b
x AUC
s
s
–
preparat standardowy
b
–
preparat
badany
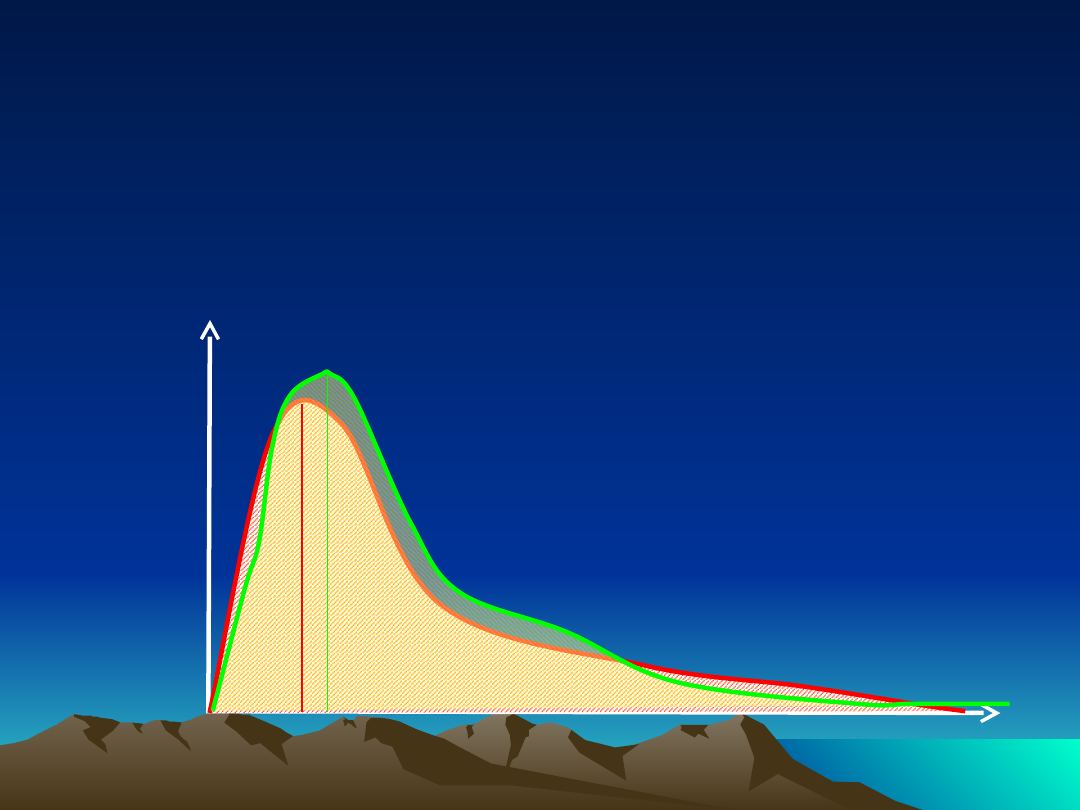
Ocena biorównoważności
Ocena biorównoważności
Stężenie
leku w
osoczu
Czas ~
AUC
preparatu badanego
/ AUC
preparatu
referencyjnego
zakres wartości
prawidłowych →
80-120%
AUC
preparatu badanego
/ AUC
preparatu
referencyjnego
zakres wartości
prawidłowych →
80-120%
T - C
max
C
max
C
max
T - C
max

Procesy farmakokinetyczne
Procesy farmakokinetyczne
L – UWALNIANIE (liberation)
A – WCHŁANIANIE (absorption)
D – DYSTRYBUCJA (distribution)
M – METABOLIZM (metabolism)
E – WYDALANIE (excretion)

DYSTRYBUCJA
DYSTRYBUCJA
Proces rozmieszczania leku w
płynach i tkankach organizmu
Czynniki warunkujące dystrybucję:
•
szybkość przepływu krwi przez poszczególne tkanki
(pojęcie kompartmentu)
•
szybkość transportu przez błony biologiczne
•
wiązanie z białkami

Kompartment
Kompartment
Zespół tkanek, płynów ustrojowych
lub narządów, w których lek i jego
metabolity rozmieszczone są
równomiernie

Modele farmakokinetyczne
Modele farmakokinetyczne
Model jednokompartmentowy
lek niezwłocznie po podaniu zostaje równomiernie
rozmieszczony w dostępnej przestrzeni
dystrybucji
Model dwukompartmentowy
rozmieszczanie leku do przestrzeni dystrucyjnych
zachodzi z różną prędkością

Kompartment
Kompartment
Kompartment centralny
osocze oraz tkanki i narządy dobrze ukrwione
(wątroba, płuca, nerki, mózg, serce, gruczoły wydzielania
wewnętrznego)
Kompartment obwodowy
(tkankowy)
tkanki i narządy gorzej lub słabo ukrwione
(tkanka tłuszczowa, skóra, mięśnie, tkanka kostna)

Objętość dystrybucji (Vd)
Objętość dystrybucji (Vd)
Hipotetyczna objętość płynów
ustrojowych, w której lek w stanie
stacjonarnym miałby podobne stężenie
jak we krwi
Vd
bezwzględna
- wyrażana w litrach
Vd
względna
– wyrażana w litrach/kilogram

Objętość dystrybucji (Vd)
Objętość dystrybucji (Vd)
Vd =
A –
ilość leku w organizmie (mg)
C –
stężenie leku we krwi (mg/l)
A
C

Objętość dystrybucji (Vd)
Objętość dystrybucji (Vd)
znaczenie praktyczne
znaczenie praktyczne
Vd = 5l -
dystrybucja ograniczona jest do krwi
Vd = 10-20l -
przenikanie leku do ECF
Vd = 25-35l -
przenikanie leku do ICF
Vd = 40l -
rozmieszczanie we wszystkich
płynach organizmu
Vd > 100l -
lek silnie kumuluje się w tkankach

Objętość dystrybucji (Vd)
Objętość dystrybucji (Vd)
wykorzystanie praktyczne
wykorzystanie praktyczne
Obliczanie dawki nasycającej
Ld =
Ld – Loading dose
Ct – stężenie terapeutyczne
BW – masa ciała w kg
F – dostępność biologiczna
Vd x Ct x
BW
F

Wiązanie leku z białkami
Wiązanie leku z białkami
Odwracalny proces powstawania
kompleksu lek-białko
Znaczenie kliniczne ma wówczas, gdy
stopień wiązania leku
z białkami jest większy niż 80%

Wiązanie leku z białkami
Wiązanie leku z białkami
Lek związany z białkami:
- jest nieaktywny farmakologicznie
- nie może przechodzić przez błony biologiczne
- nie ulega metabolizmowi
- nie może się wydalać
Zmniejszenie stopnia wiązania leku skutkuje:
wzrostem siły działania leku
skróceniem czasu działania leku

Wiązanie leku z białkami
Wiązanie leku z białkami
Czynniki warunkujące stopień wiązania z
białkami:
stężenie leku
(wysycenie miejsc wiążących już w zakresie stężeń terapeutycznych dla
salicylanów, fenylbutazonu, kwasu walproinowego, prednizolonu)
powinowactwo leku do miejsc wiążących
stężenie białek
(wydolność nerek, wątroby, wiek, stan odżywienia
itp...)
obecność substancji egzogennych
(leki, trucizny
środowiskowe)
i endogennych
(kwasy tłuszczowe, bilirubina,
mocznik, hormony)
pH osocza
(spadek wiązania np. barbituranów z białkami w kwasicy)

Wiązanie leku z białkami
Wiązanie leku z białkami
Przykłady leków o dużym stopniu wiązania
z białkami:
Pochodne kumaryny
Fenylobutazon
Salicylany
Sulfonamidy
Penicyliny

Procesy farmakokinetyczne
Procesy farmakokinetyczne
L – UWALNIANIE (liberation)
A – WCHŁANIANIE (absorption)
D – DYSTRYBUCJA (distribution)
M – METABOLIZM (metabolism)
E – WYDALANIE (excretion)

METABOLIZM
METABOLIZM
Szereg procesów biochemicznych,
których głównym celem jest
unieczynnienie leku oraz ułatwienie
jego eliminacjI z organizmu

METABOLIZM
METABOLIZM
Podstawowe miejsce
Pozostałe:
- jelita
- nerki
- śledziona
- skóra
- płuca
- osocze
- mięśnie
WĄTROBA

Metabolizm
Metabolizm
Procesy I fazy:
- Utlenianie
(przy udziale cytochromu P-450)
- Redukcja
- Hydroliza
Procesy II fazy:
- Sprzęganie z kwasem glukuronowym, siarkowym i
glicyną
- Acetylacja
- Metylacja

Metabolizm
Metabolizm
Procesy I fazy prowadzą do:
- inaktywacji leku macierzystego
- aktywacji proleku do czynnej farmakologicznie postaci
(enalapril)
- powstania metabolitu aktywnego farmakologicznie
(imipramina)
- powstania metabolitu toksycznego
(paracetamol)
Procesy II fazy prowadzą zwykle do
powstania związków nieczynnych
farmakologicznie

Czynniki wpływające na
Czynniki wpływające na
metabolizm
metabolizm
Wiek pacjenta:
- Noworodki – niedojrzały układ mikrosomalny
- Małe dzieci – przyspieszony metabolizm
- Chorzy w wieku podeszłym – zmniejszenie aktywności
enzymów mikrosomalnych
Płeć
(mężczyźni metabolizują szybciej)
Stany chorobowe
(niewydolność krążenia, marskość
wątroby)
Interakcje lekowe
Czynniki genetyczne

Izoenzymy cytochromu P-
Izoenzymy cytochromu P-
450
450
Najważniejsze:
CYP 1A2
CYP 2C9
CYP 2C19
CYP 2D6
CYP 2E1
CYP 3A4
Czynniki warunkujące aktywność izoenzymów:
- polimorfizm genetyczny
- indukcja i inhibicja

Wpływ leków na izoenzymy
Wpływ leków na izoenzymy
cytochromu P-450
cytochromu P-450
Znaczenie kliniczne indukcji i inhibicji
zmiana siły działania stosowanego induktora / inhibitora
i innych stosowanych jednocześnie leków
Indukcja:
→ osłabienie siły działania i skrócenie czasu działania w
przypadku metabolitów nieaktywnych lub mniej aktywnych
→ wzrost siły działania w przypadku metabolitów bardziej
aktywnych
→ możliwość działania toksycznego innych stosowanych
jednocześnie leków w przypadku odstawienia induktora po
uprzedniej korekcji ich dawki

Wpływ leków na izoenzymy
Wpływ leków na izoenzymy
cytochromu P-450
cytochromu P-450
Inhibitory
Cymetydyna
Propranolol
Erytromycyna
Doustne leki antykoncepcyjne
Ciprofloksacyna
Sok z grapefruita
Induktory
Alkohol etylowy
Barbiturany
Nikotyna
Rifampicyna

Procesy farmakokinetyczne
Procesy farmakokinetyczne
L – UWALNIANIE (liberation)
A – WCHŁANIANIE (absorption)
D – DYSTRYBUCJA (distribution)
M – METABOLIZM (metabolism)
E – WYDALANIE (excretion)

WYDALANIE
WYDALANIE
Procesy związane z usuwaniem leku z
organizmu

Wydalanie
Wydalanie
Przez nerki
(większość leków)
Z żółcią
(makrolidy, glikozydy)
Ze śliną
(fenytoina)
Z powietrzem wydychanym
(alkohol, środki znieczulenia ogólnego)
Z potem
(witamina B1)

Wydalanie przez nerki
Wydalanie przez nerki
Wydalanie przez nerki obejmuje:
przesączanie kłębuszkowe
(brak wpływu rozpuszczalności leków)
wydzielanie kanalikowe
(proces czynny)
wchłanianie zwrotne
(silne wchłanianie leków lipofilnych)

Wydalanie przez nerki
Wydalanie przez nerki
Poprzez zmianę pH moczu można wpłynąć na
proces wydalania leków przez nerki
Alkalizacja moczu w celu przyspieszenia
wydalania leków o charakterze słabych
kwasów
(ASA, barbiturany, sulfonamidy)
Zakwaszanie moczu w celu przyspieszenia
wydalania leków o charakterze słabych zasad
(kodeina, morfina, chinina)

Klirens leku
Klirens leku
Objętość osocza całkowicie
oczyszczonego z leku w jednostce czasu
przez narząd eliminujący ten lek z
organizmu
Pozwala dostosować dawkę leku
do określonej sytuacji klinicznej
Cl = K x Vd
Cl =
D
AUC
Cl
– klirens leku
K
– stała eliminacji

Stała eliminacji
Stała eliminacji
Określa szybkość usuwania określonej
porcji leku z kompartmentu centralnego
jako konsekwencji metabolizmu i
wydalania
Pozwala ustalić wielkość dawki podtrzymującej
K =
K – stała eliminacji
Cl – klirens leku
Vd – objętość dystrybucji
Cl
Vd

Stężenie stacjonarne
Stężenie stacjonarne
Stan równowagi pomiędzy ilością leku
wprowadzanego do organizmu i przez
niego wydalanego.
Uwarunkowane głównie przez podawanie
kolejnych dawek leku oraz klirens leku.
Spadek klirensu może stwarzać ryzyko
przedawkowania!!!
Jest ono osiągane po 4-5 okresach t
½
od
podania pierwszej dawki

Biologiczny okres półtrwania
Biologiczny okres półtrwania
(t
(t
½
½
)
)
Czas, po upływie którego stężenie leku
we krwi zmniejsza się o połowę
Pozwala określić odstępy dawkowania leków
t
½
=
t
½
=
0,693
K
0,693 x
Vd
Cl

Biologiczny okres półtrwania
Biologiczny okres półtrwania
Czynniki warunkujące biologiczny okres
półtrwania:
czynniki genetyczne
płeć
wiek
wydolności układu krążenia, wątroby i nerek
stan enzymów mikrosomalnych wątroby

Farmakokinetyka
Farmakokinetyka
Liniowa
- szybkość procesów
farmakokinetycznych jest
proporcjonalna do stężenia leku
Nieliniowa
- szybkość procesów
farmakokinetycznych zmienia się wraz
ze zmianą stężenia leku w sposób
nieliniowy
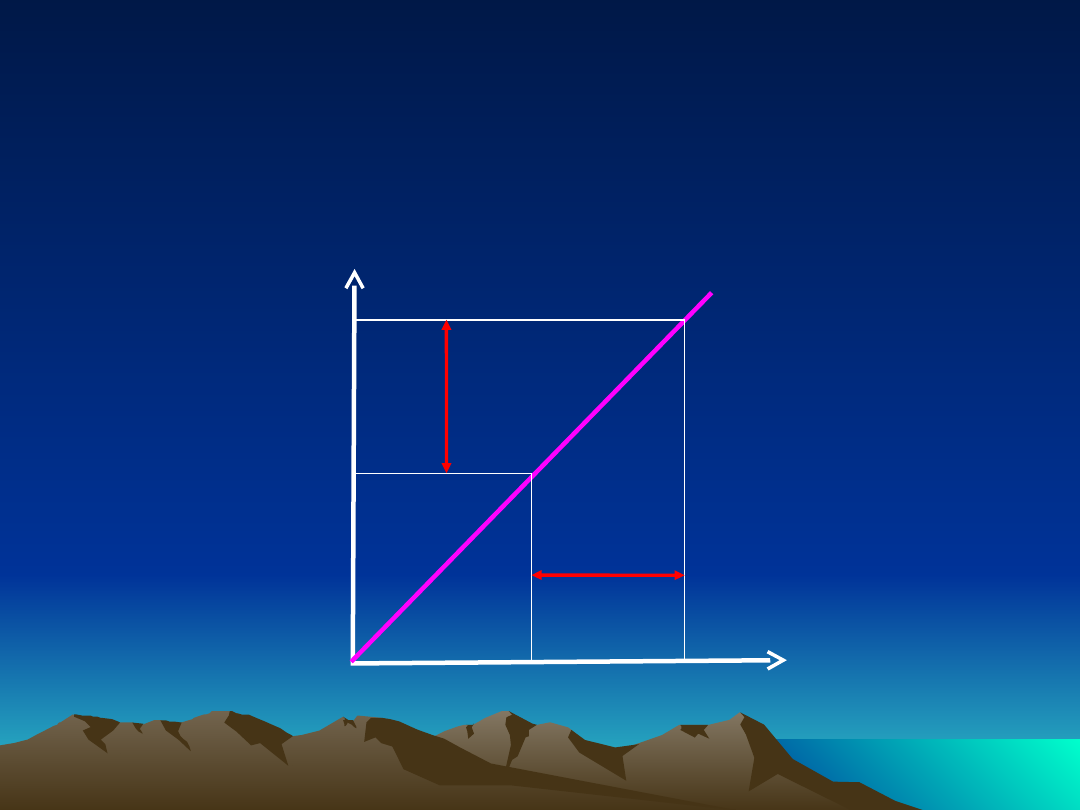
Farmakokinetyka liniowa
Farmakokinetyka liniowa
Stężenie
leku w
osoczu
Podana
dawka leku
zależność stężenia leku w osoczu od podanej
dawki
zależność stężenia leku w osoczu od podanej
dawki
D
1
D
2
C
1
C
2
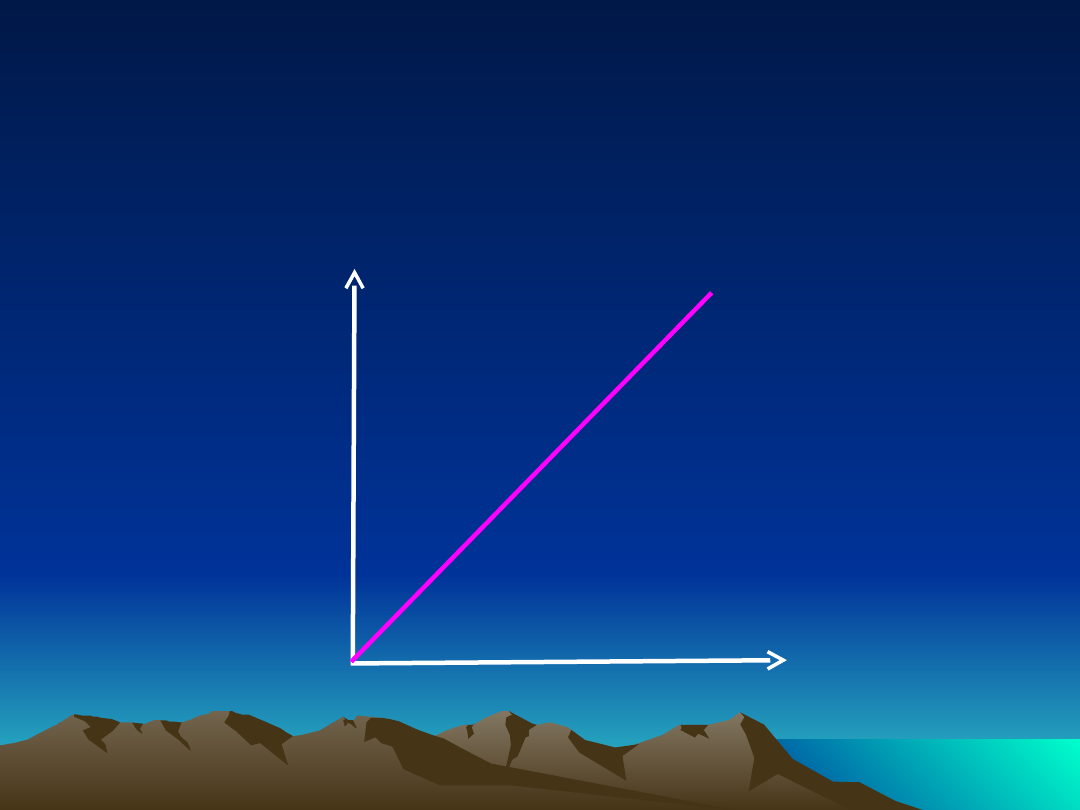
Farmakokinetyka liniowa
Farmakokinetyka liniowa
Szybkość procesów
farmakokinetycznyc
h
Stężenie
leku w
osoczu
zależność szybkości procesów
farmakokinetycznych
od stężenia leku w osoczu
zależność szybkości procesów
farmakokinetycznych
od stężenia leku w osoczu

Charakterystyka procesów
Charakterystyka procesów
przebiegających według
przebiegających według
kinetyki liniowej
kinetyki liniowej
t
½
, Vd, Cl jest stały, niezależny od dawki
AUC jest proporcjonalne do dawki
stężenie w stanie stacjonarnym jest
proporcjonalne do dawki
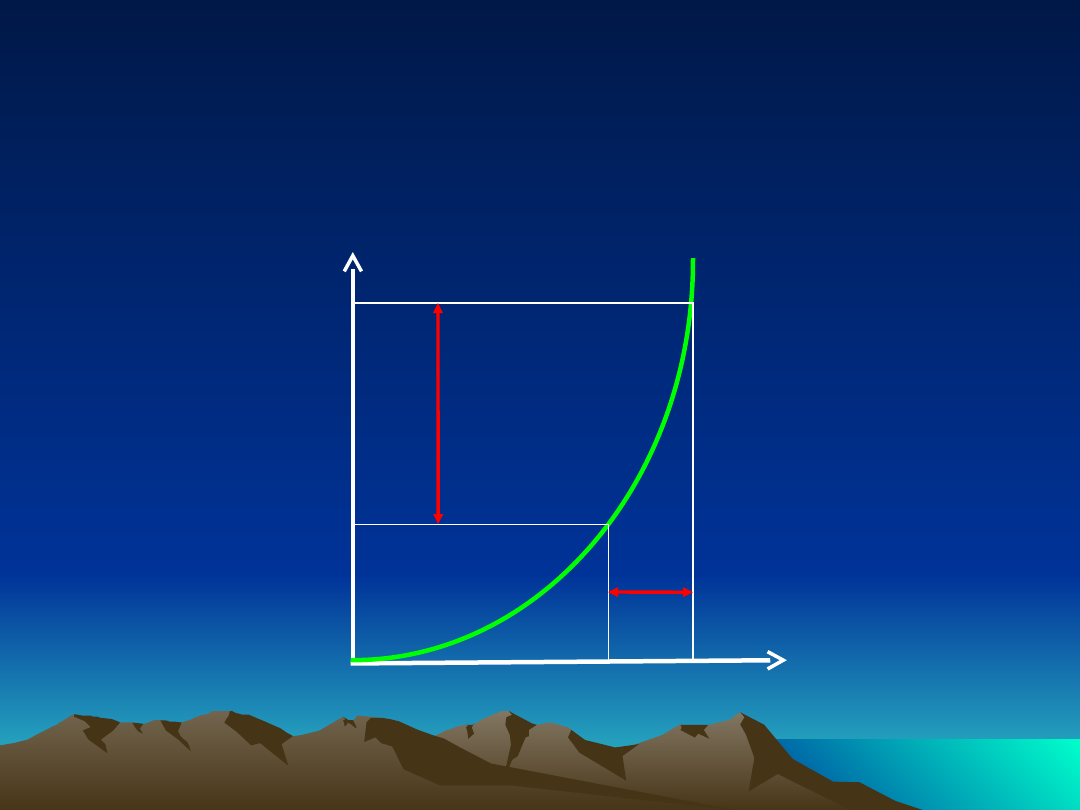
Farmakokinetyka nieliniowa
Farmakokinetyka nieliniowa
Stężenie
leku w
osoczu
Podana
dawka leku
zależność stężenia leku w osoczu od podanej
dawki
zależność stężenia leku w osoczu od podanej
dawki
D
1
D
2
C
1
C
2
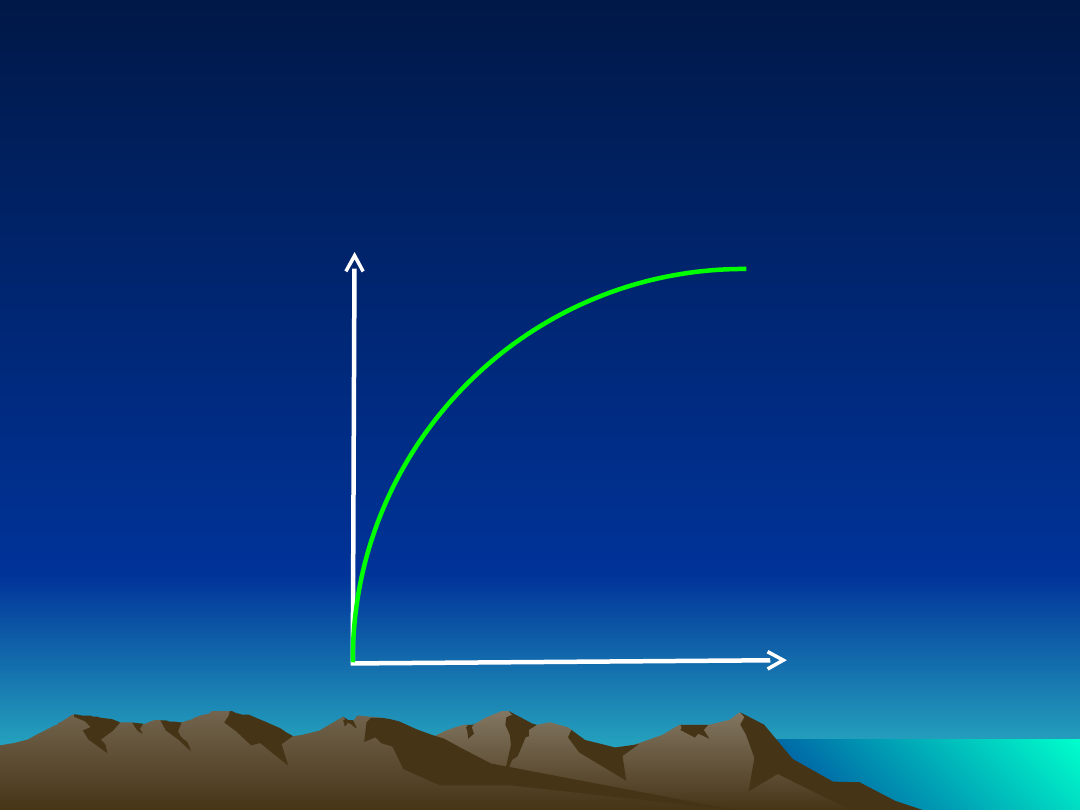
Farmakokinetyka nieliniowa
Farmakokinetyka nieliniowa
Szybkość procesów
farmakokinetycznyc
h
Stężenie
leku w
osoczu
zależność szybkości procesów
farmakokinetycznych
od stężenia leku w osoczu
zależność szybkości procesów
farmakokinetycznych
od stężenia leku w osoczu
wysycenie enzymów i
białek
transportujących!!!

Charakterystyka procesów
Charakterystyka procesów
przebiegających według
przebiegających według
kinetyki nieliniowej
kinetyki nieliniowej
szybkość procesów eliminacji
nie
jest
proporcjonalna do stężenia leku
t
½
ulega wydłużeniu
wraz ze wzrostem dawki
AUC i stężenie w stanie stacjonarnym
nie
jest
proporcjonalne do ilości leku

Zagrożenia wynikające z
Zagrożenia wynikające z
kinetyki nieliniowej
kinetyki nieliniowej
!
niewielkie zmiany dawkowania mogą
prowadzić do ujawnienia działania
toksycznego
!
eliminacja i osiągnięcie stanu
stacjonarnego mogą wydłużać się w
sposób nieoczekiwany

Leki podlegające prawom
Leki podlegające prawom
kinetyki nieliniowej
kinetyki nieliniowej
Salicylany
Fenytoina
Prednizolon
Dikumarol
Teofilina
Winkrystyna
TLPD (po przedawkowaniu)

Metody monitorowania
Metody monitorowania
farmakoterapii
farmakoterapii

Monitorowanie farmakoterapii
Monitorowanie farmakoterapii
ma na celu optymalizację
ma na celu optymalizację
skuteczności i bezpieczeństwa
skuteczności i bezpieczeństwa
leczenia
leczenia

Metody monitorowania
Metody monitorowania
farmakoterapii
farmakoterapii
Ocena objawów klinicznych
Badania dodatkowe
- laboratoryjne
- obrazowe
Terapeutyczne monitorowanie leków

Metody monitorowania
Metody monitorowania
farmakoterapii
farmakoterapii
Ocena objawów klinicznych
Badania dodatkowe
- laboratoryjne
- obrazowe
Terapeutyczne monitorowanie leków

Objawy kliniczne
Objawy kliniczne
•
Ciśnienie tętnicze
•
Tętno
•
Temperatura
•
Ból
•
Duszność
•
Kaszel

Metody monitorowania
Metody monitorowania
farmakoterapii
farmakoterapii
Ocena objawów klinicznych
Badania dodatkowe
- laboratoryjne
- obrazowe
Terapeutyczne monitorowanie leków

Badania laboratoryjne
Badania laboratoryjne
•
Stężenie glukozy
•
INR
•
APTT
•
Morfologia krwi

Metody monitorowania
Metody monitorowania
farmakoterapii
farmakoterapii
Ocena objawów klinicznych
Badania dodatkowe
- laboratoryjne
- obrazowe
Terapeutyczne monitorowanie leków

Badania obrazowe
Badania obrazowe
•
Endoskopia
•
RTG
•
Tomografia komputerowa
•
USG

Metody monitorowania
Metody monitorowania
farmakoterapii
farmakoterapii
Ocena objawów klinicznych
Badania dodatkowe
- laboratoryjne
- obrazowe
Terapeutyczne monitorowanie leków

Terapeutyczne
Terapeutyczne
monitorowanie leków -
monitorowanie leków -
założenia
założenia
istnienie korelacji pomiędzy siłą działania
farmakologicznego i stężeniem leku w
surowicy krwi – a niekoniecznie dawką leku
prowadzenie monitorowania na podstawie
zasad farmakokinetyki w połączeniu z
obserwacją kliniczną chorego i kontrolą
działania leku innymi dostępnymi metodami

Terapeutyczne
Terapeutyczne
monitorowanie leków -
monitorowanie leków -
wskazania (1)
wskazania (1)
brak prostszej metody oceny
wąski indeks terapeutyczny
kinetyka nieliniowa
liczne interakcje
brak oczekiwanego efektu lub szybko
pojawiające się działania niepożądane

Terapeutyczne
Terapeutyczne
monitorowanie leków -
monitorowanie leków -
wskazania (2)
wskazania (2)
zjawisko non compliance
podobieństwo objawów przedawkowania i
niewystarczającej skuteczności leku
niewydolność wątroby lub nerek
polipragmazja
zatrucia
profilaktyka i leczenie uzależnień

Terapeutyczne
Terapeutyczne
monitorowanie leków -
monitorowanie leków -
zasady
zasady
Nie rutynowo!!!
ocena w stanie stacjonarnym
niezbędne uwzględnienie:
- interakcji pomiędzy lekami
- stanu zdrowia chorego
- wyników innych badań
oznaczanie stężenia przed następna dawką (rano)
WYJĄTEK: - zatrucia
- ciężki stan chorego

Przykłady leków
Przykłady leków
glikozydy
aminoglikozydy
(amikacyna, gentamycyna)
wankomycyna
leki przeciwpadaczkowe
(fenytoina, karbamazepina, kwas walproinowy)
teofilina

Przykłady leków
Przykłady leków
leki przeciwdepresyjne
(sole litu)
leki antyarytmiczne
(chinidyna, lidokaina, propafenon)
leki przeciwbólowe i NLPZ
(paracetamol, ASA)
leki immunosupresyjne
(cyklosporyna)
leki przeciwnowotworowe
(metotreksat)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
Wyszukiwarka
Podobne podstrony:
wyklad 5-9, stomatologia
BIOLOGIA - wykład I - stomatologia, I rok, biologia
Embriologia - wykłady, Stomatologia, Embriologia
Radiologia - wyklady, Stomatologia UMED, Radiologia
wykład stomat 1konspekt 2007
W19-SL-W05 - Leki psychotropowe (neuroleptyki) (Fivo), Naika, stomatologia, Farmakologia, WYKŁADY
W12-SZ-W12 - Chemioterapia zakażeń grzybiczych i wirusowych (Bonns), Naika, stomatologia, Farmakolog
wykład3 - Eutanazja, Stomatologia UMED, prawo medyczne, prawo i etyka w stomatologii 2010-2011
W22-SL-W08 - Leki przeciwhistaminowe (Krzysiek), Naika, stomatologia, Farmakologia, WYKŁADY
wyklad 3-4 prota, stomatologia
Mięśnie k.dolnej (z wykładów)(1), Studia, Stomatologia Łódź, Rok I, Anatomia
Ćwiczenie 2 - glasjonomery, STOMATOLOGIA, Stomatologia materiały (ćwiczenia-wykłady)
W27-SL-W13 - Działania nieporządane leków (Basia), Naika, stomatologia, Farmakologia, WYKŁADY
W20-SL-W06 - Leki psychotropowe (przeciwdepresyjne i nootropowe) (Krzysiek), Naika, stomatologia, Fa
W05-SZ-W05 - Leki działające na układ równowagi krzepnięcia krwi (Krall), Naika, stomatologia, Farma
więcej podobnych podstron