
ZWIĄZKI
ZWIĄZKI
HETEROCYKLICZNE
HETEROCYKLICZNE

RODZAJE GRUP FUNKCYJNYCH
RODZAJE GRUP FUNKCYJNYCH
MOGĄCYCH WYSTĘPOWAĆ W FORMIE
MOGĄCYCH WYSTĘPOWAĆ W FORMIE
CYKLICZNEJ (HETEROCYKLICZNEJ)
CYKLICZNEJ (HETEROCYKLICZNEJ)
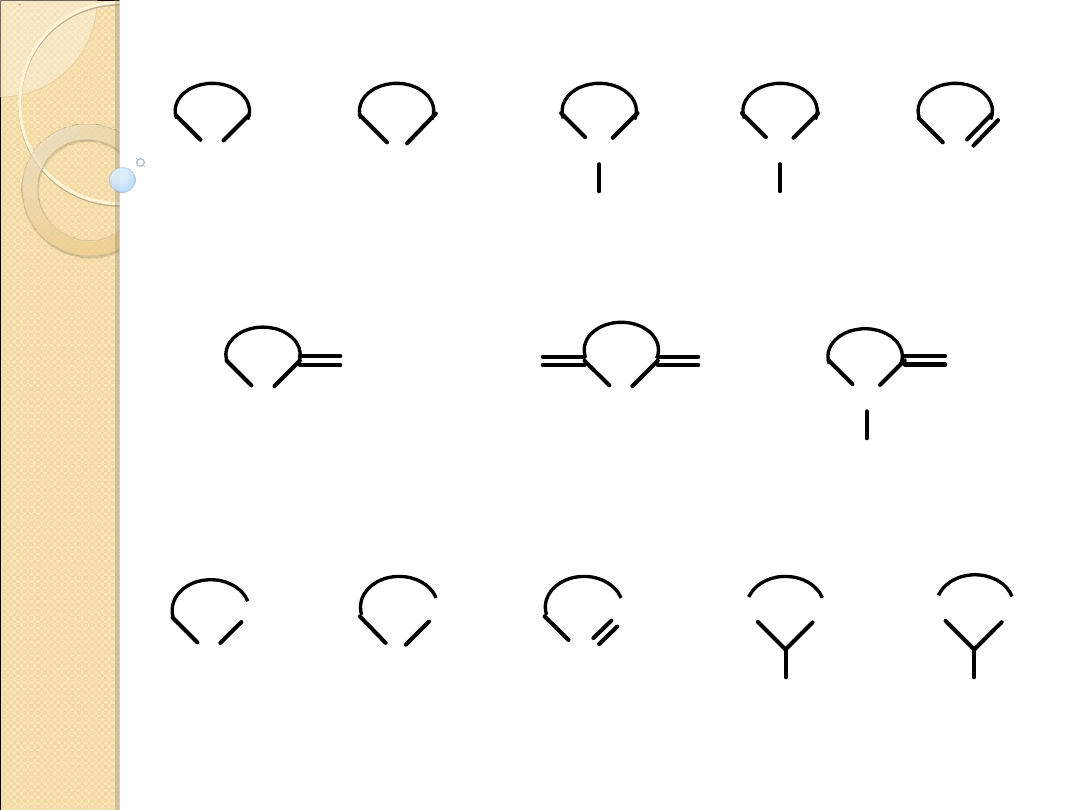
O
N
N
R
N
H
S
etery
sulfidy
aminy II
o
aminy III
o
iminy
laktony
bezwodniki
laktamy
O
O
O
O
O
N
H(R)
O
O
O
S
S
N
N
O
O
R
S
S
R
nadtlenki
disulfidy
zwiazki
azowe
acetale
tioacetale
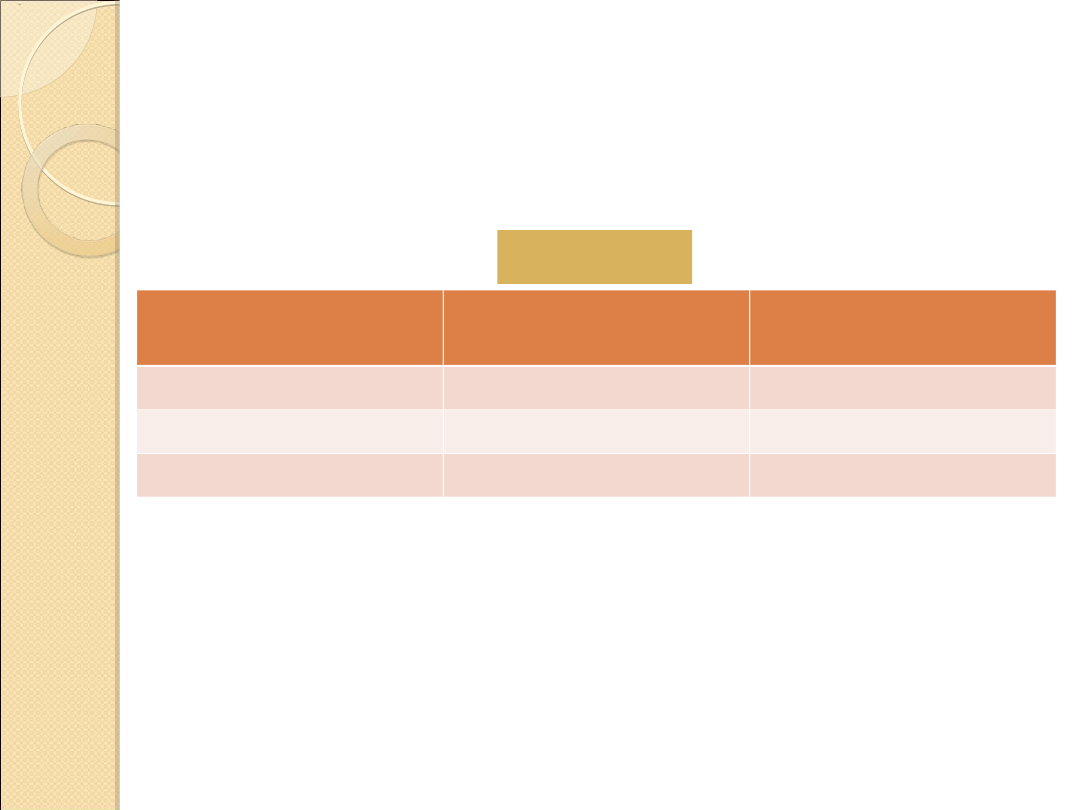
PODSTAWY NAZEWNICTWA UKŁADÓW
HETEROCYKLICZNYCH
Pierwiastek
(heteroatom)
Wartościowość
Przedrostek
Tlen
2
Oksa–
Siarka
2
Tia–
Azot
3
Aza–
TABELA 1

Liczba
atomów w
pierścieniu
Przyrostki
Pierścienie zawierające
azot
Pierścienie
niezawierające azotu
nienasycone
nasycone
nienasycone
nasycone
3
–iryna
–irydyna
–iren
–iran
4
–et
–etydyna
–et
–etan
5
–ol
–olidyna
–ol
–olan
6
–yna
*
–yn
–an
7
–epina
*
–epin
–epan
*
umieszcza się przedrostek perhydro– przed nazwą związku
nienasyconego
TABELA 2

NUMERACJA ATOMÓW W PIERŚCIENIU
1. W związkach monocyklicznych numerację zaczynamy
od heteroatomu
2. W przypadku większej ilości heteroatomów numerujemy
tak, aby lokanty określające ich położenie były jak
najniższe
3. W przypadku różnych heteroatomów numerujemy tak,
aby heteroatom znajdujący się wyżej w tabeli 1 miał
najniższy lokant
4. W przypadku, gdy występują dwa lub więcej takich
samych heteroatomów dodajemy przedrostki di–, tri–,
np. diazyna
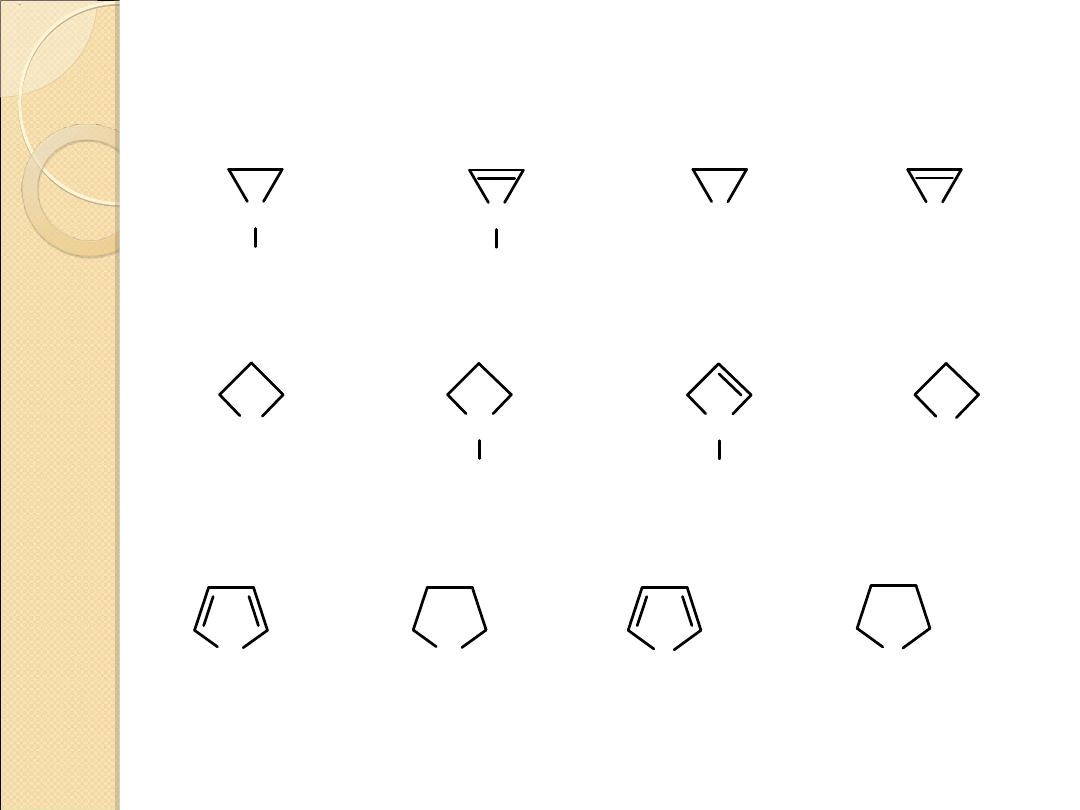
NAZEWNICTWO NIEKTÓRYCH UKŁADÓW
HETEROCYKLICZNYCH
N
H
N
H
O
O
azirydyna
2–aziryna
oksiran
oksiren
O
N
H
N
H
S
oksetan
azetydyna
2–azetyna
tietan
O
O
S
S
oksol
(furan)
oksolan
(tetrahydrofuran)
tiol
(tiofen)
tiolan
(tetrahydrotiofen
)
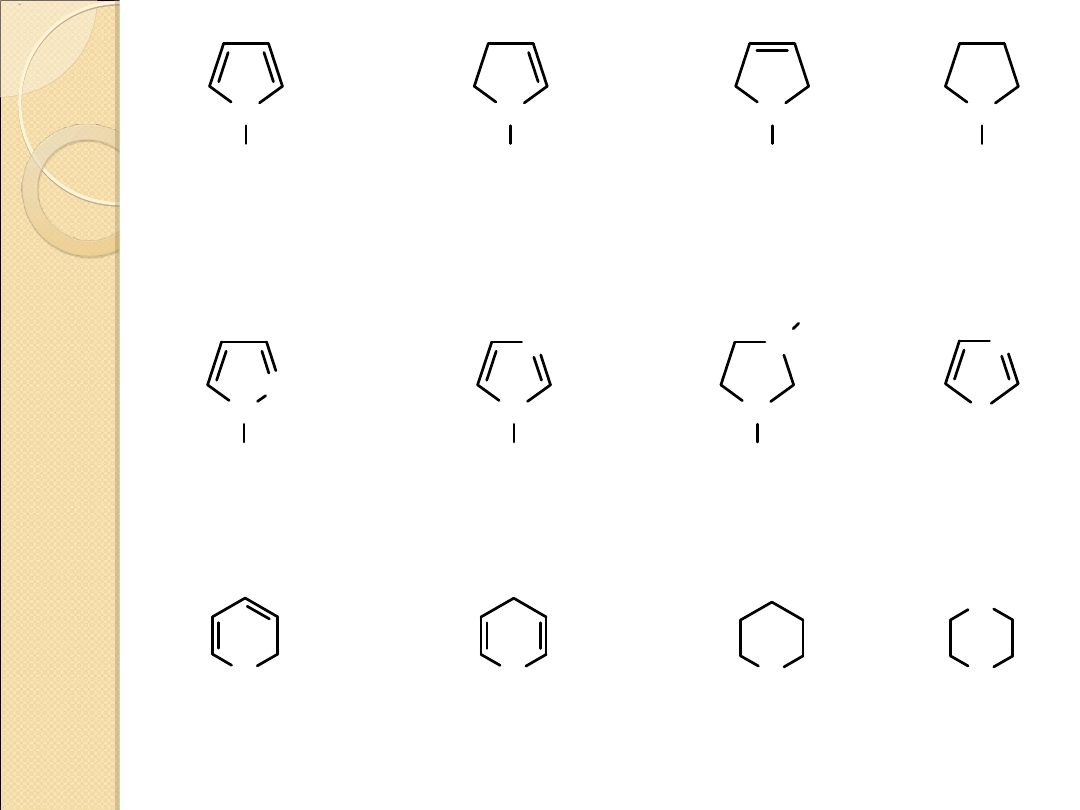
N
H
N
H
N
H
N
H
azol
(pirol)
2–azolina
(2–pirolina)
3–azolina
(3–pirolina)
azolidyna
(pirolidyna)
1,2–diazol
(pirazol)
N
N
H
N
N
H
N
N
H
H
N
S
1,3–diazol
(imidazol)
1,3–diazolidyna
(imidazolidyna)
1,3–tiazol
(tiazol)
O
O
O
O
O
2H–oksyn
(2H–piran, α–
piran)
4H–oksyn
(4H–piran, γ–piran)
oksan
(tetrahydropiran)
1,4–dioksyn
(dioksan)
N
N
H
N
H
N
N
azyna
(pirydyna)
1,4–dihydroazyna
(1,4–dihydropirydyna)
perhydroazyna
(piperydyna)
1,2–diazyna
(pirydazyna)
N
N
N
N
H
H
N
N
N
O
H
1,4–diazyna
(pirazyna)
perhydro–1,4–diazyna
(piperazyna)
perhydro–
1,4–oksazyna
(morfolina)
1,3–diazyna
(pirymidyna
)
N
N
2H–azepina
azocyna
N
N
N
H
O
N
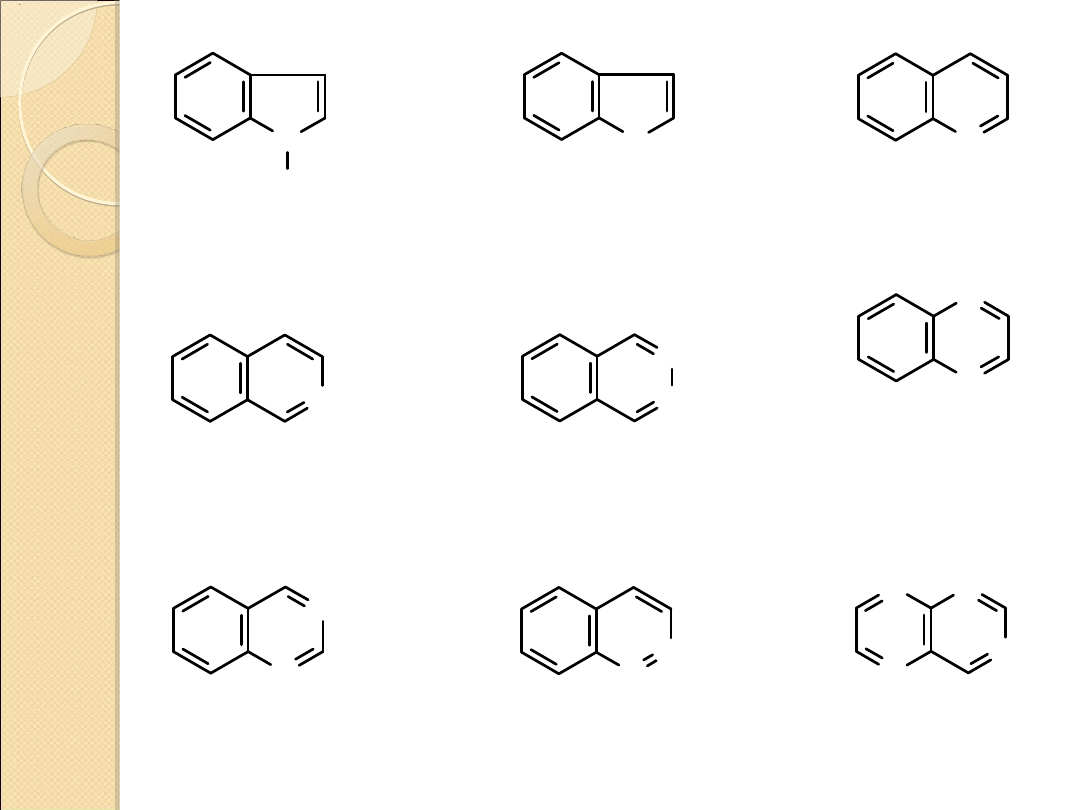
indol
kumaron
chinolina
N
N
N
izochinolina
ftalazyna
chinoksalina
N
N
N
N
N
N
N
N
chinazolina
cynolina
pterydyna

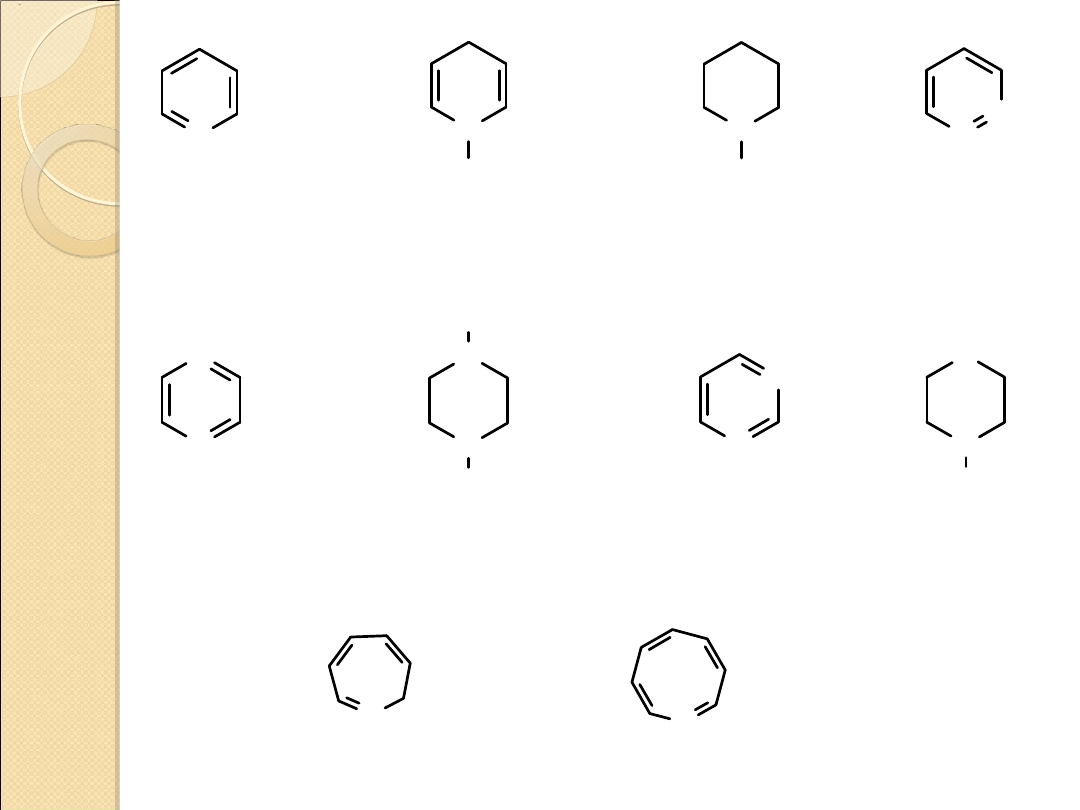
PIERŚCIENIE
PIERŚCIENIE
TRÓJCZŁONOWE
TRÓJCZŁONOWE
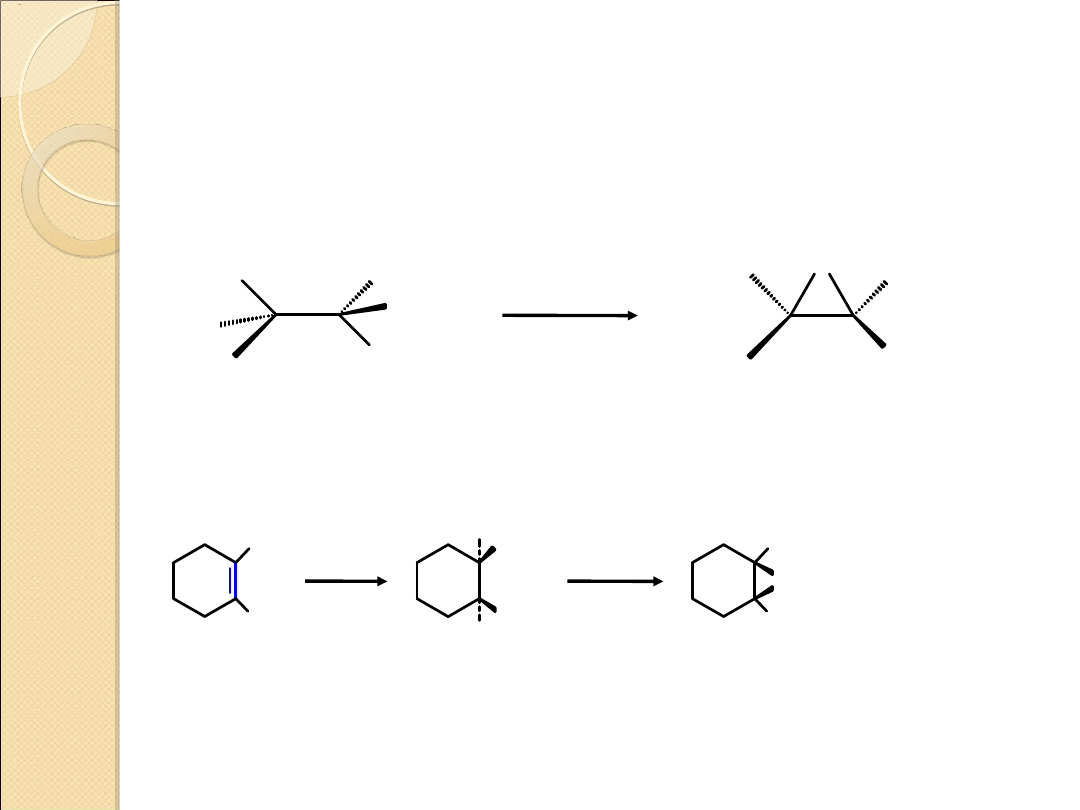
TWORZENIE TRÓJCZŁONOWYCH PIERŚCIENI
HETEROCYKLICZNYCH METODĄ SUBSTYTUCJI
NUKLEOFILOWEJ WEWNĄTRZCZĄSTECZKOWEJ
1. Otrzymywanie oksiranów (epoksydów)
HO
X
R
4
R
3
R
2
R
1
O
R
2
R
4
R
3
R
1
zasada
– HX
Synteza epoksydów z halogenohydryn
H
H
H
Cl
OH
H
O
H
H
H
2
O
Na
Cl
Cl
2
H
2
O
NaOH
H
2
O
+
+
cykloheksen
trans–2–chloro–
cykloheksanol
1,2–epoksycykloheksan
(73%)
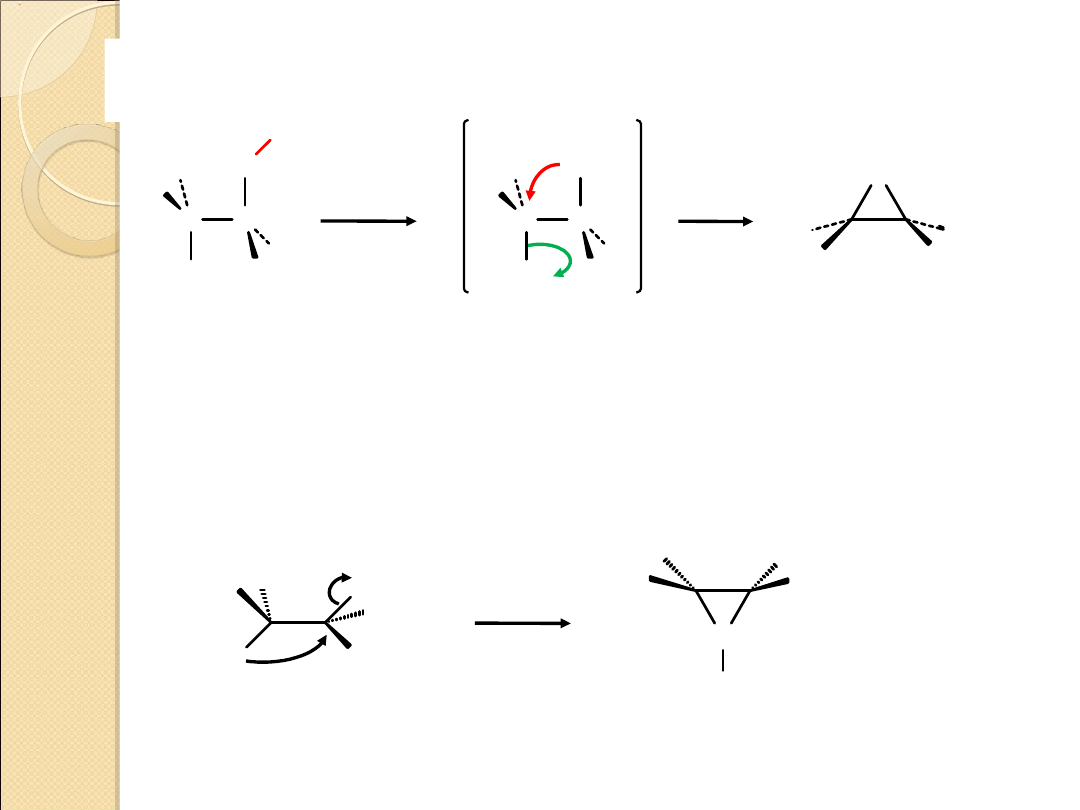
Mechanizm wewnątrzcząsteczkowej substytucji
nukleofilowej
Br
NaOH
H
2
O
C C
O
H
Br
R
R
R
R
..
..
O
R
R
R
R
..
..
C C
O
Br
R
R
R
R
.. ...
.
–
+
bromohydryna
substytucja
wewnątrzcząsteczkowa
(zachodzi w ramach tej samej
cząsteczki)
epoksyd
2. Otrzymywanie pochodnych azirydyny
RHN
X
R
2
R
1
R
4
R
3
N
R
R
2
R
1
R
3
R
4
– HX
X = Cl, Br, OSO
3
H
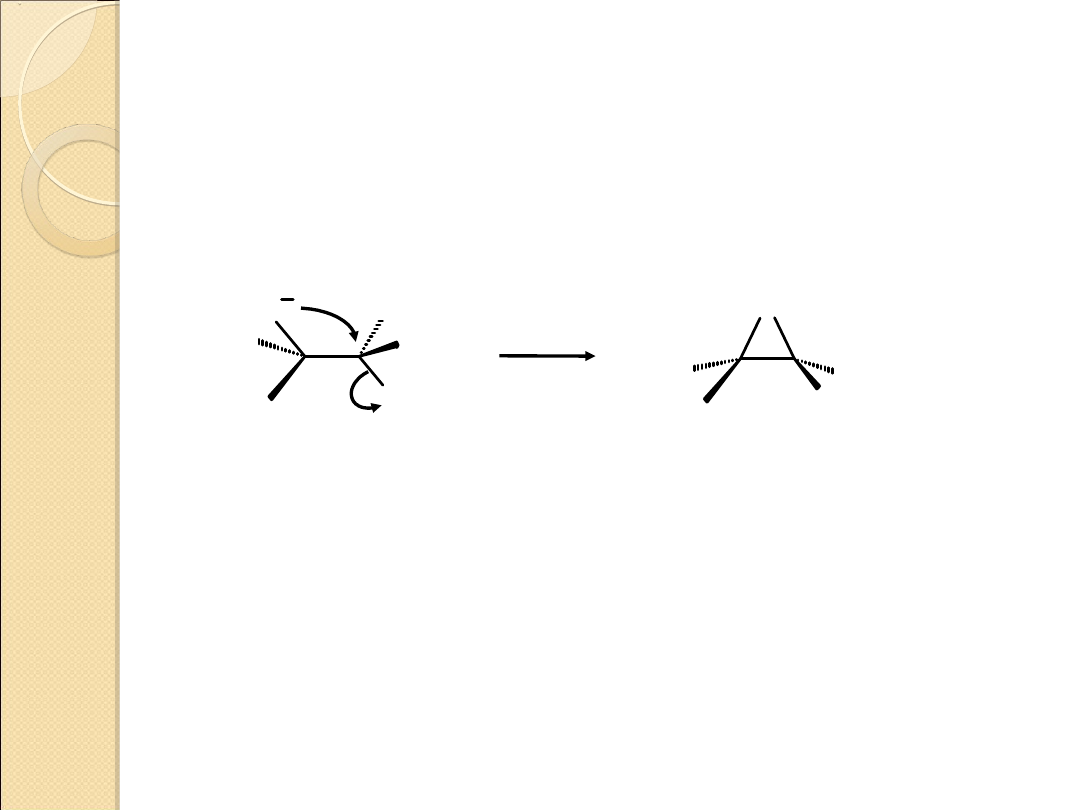
3. Otrzymywanie pochodnych tiiranu
– X
–
S
X
R
1
R
2
R
3
R
4
S
R
2
R
1
R
4
R
3
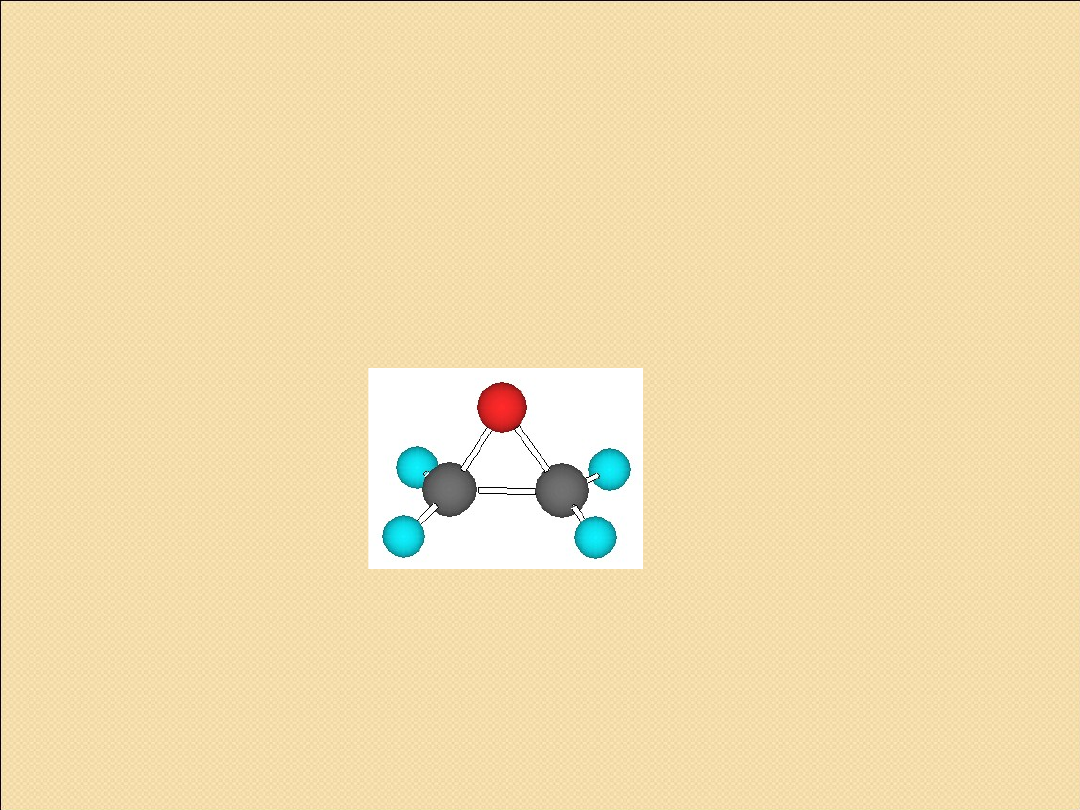
OKSIRANY
OKSIRANY
(EPOKSYDY)
(EPOKSYDY)
OTRZYMYWANIE
1. Reakcja alkenów z O
2
(Ag
2
O)
2. Reakcja alkenów z nadtlenokwasami
H
2
C CH
2
H
2
C CH
2
O
O
2
Ag
2
O,
300
o
C
etylen
tlenek etylenu
C C
C C
O
RCOH
O
RCO
O
H
O
(nadtlenokwas
)
+
Cl
C
O
O
O
H
O
H
H
Cl
C
O
OH
CH
2
Cl
2
, 25
o
C
+
cyklohepten
1,2-epoksycykloheptan
(78%)
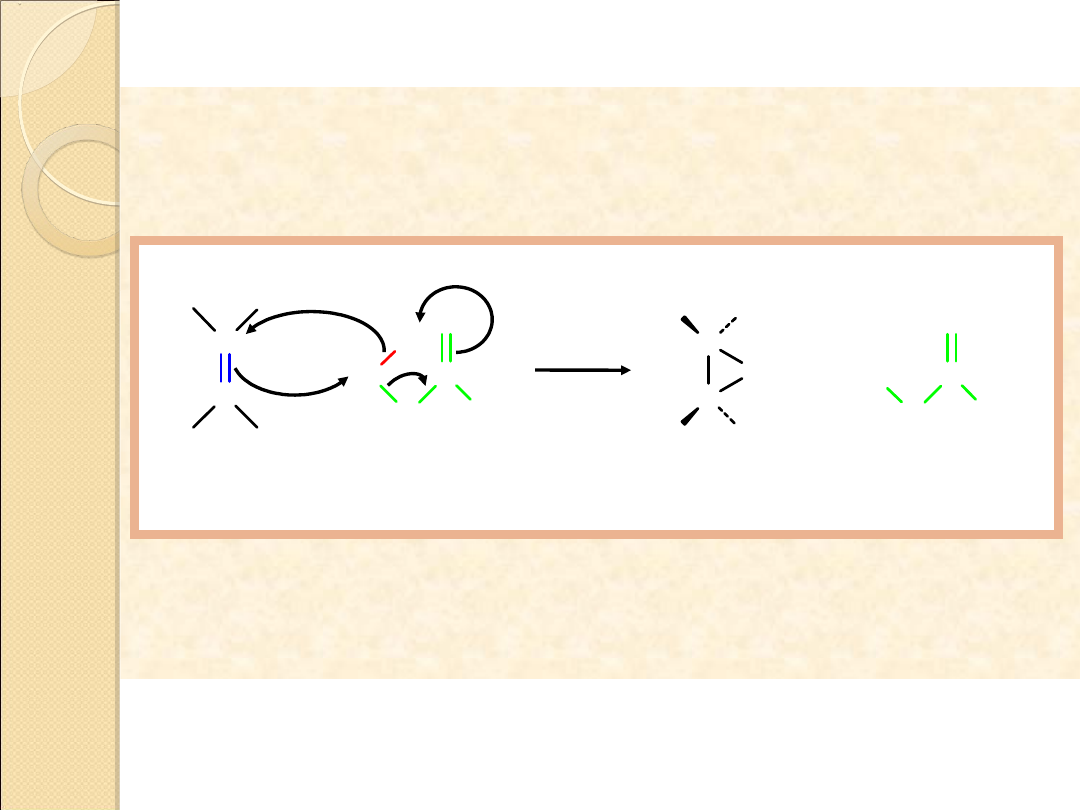
C
C
C
O
R
O
H
+
+
C
C
O
C
O
R
O
O
H
.
.
.
.
alken
nadtlenokwa
s
epoksyd
kwas
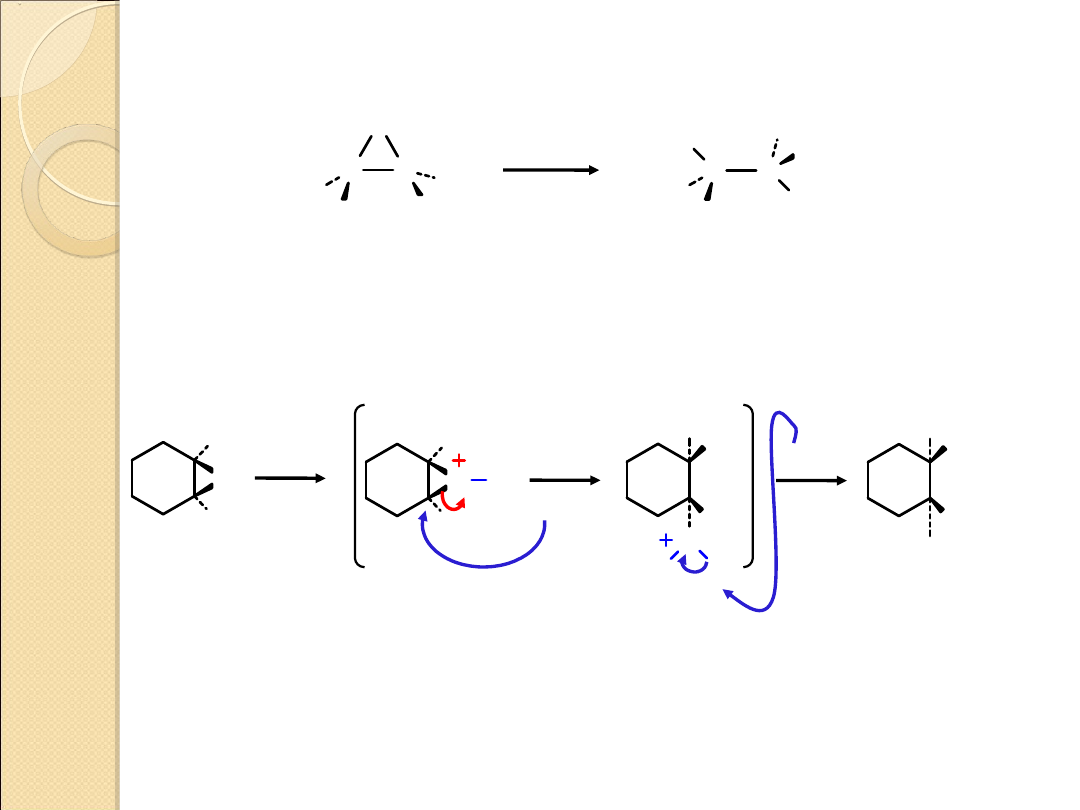
REAKCJE OTWIERANIA PIERŚCIENI EPOKSYDOWYCH
C C
O
H
H
H
H
C C
H
O
OH
H
H
H
H
H
3
O
+
tlenek etylenu
glikol etylenowy
(1,2–etanodiol)
H
O
H
O
H
H
H
H
OH
H
O
H
H
3
O
+
H
3
O
+
+
O
H
H
.
..
.
O
H
H
H
.
.
OH
2
..
..
OH
2
..
..
1,2–epoksycyklo–
heksan
trans–1,2–cyklo–
heksanodiol
(86%)
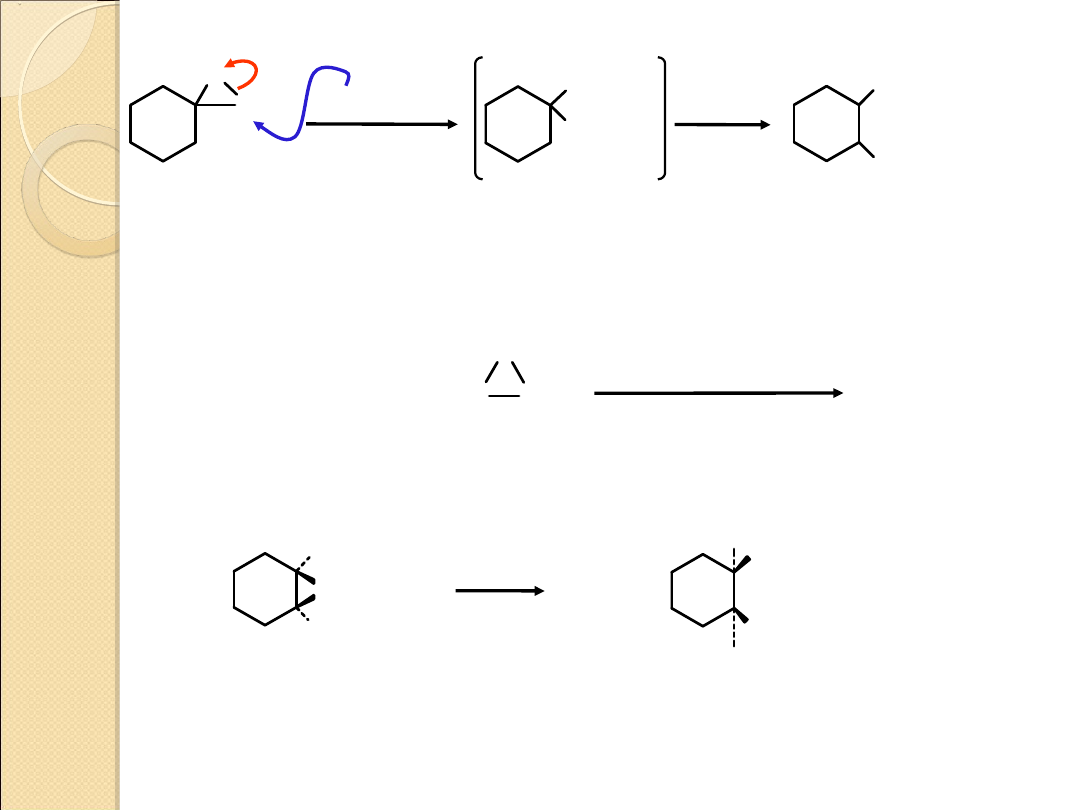
CH
2
O
O
CH
2
OH
O
H
CH
2
OH
OH
+
–
OH
H
2
O, 100
o
C
.. .. ..
H
2
O
tlenek
metyleno–
cykloheksanu
1–
hydroksymetylo–
cykloheksanol
(70%)
H
2
C CH
2
O
CH
3
(CH
2
)
3
MgBr
CH
3
(CH
2
)
5
O
H
+
1. roztwór
eterowy
2. H
3
O
+
bromek
butylomagnezow
y
1–heksanol
(62%)
O
H
H
HX
eter
H
X
H
O
H
trans–2–
halogenocykloheksanol
gdzie
X = F, Br, Cl lub I
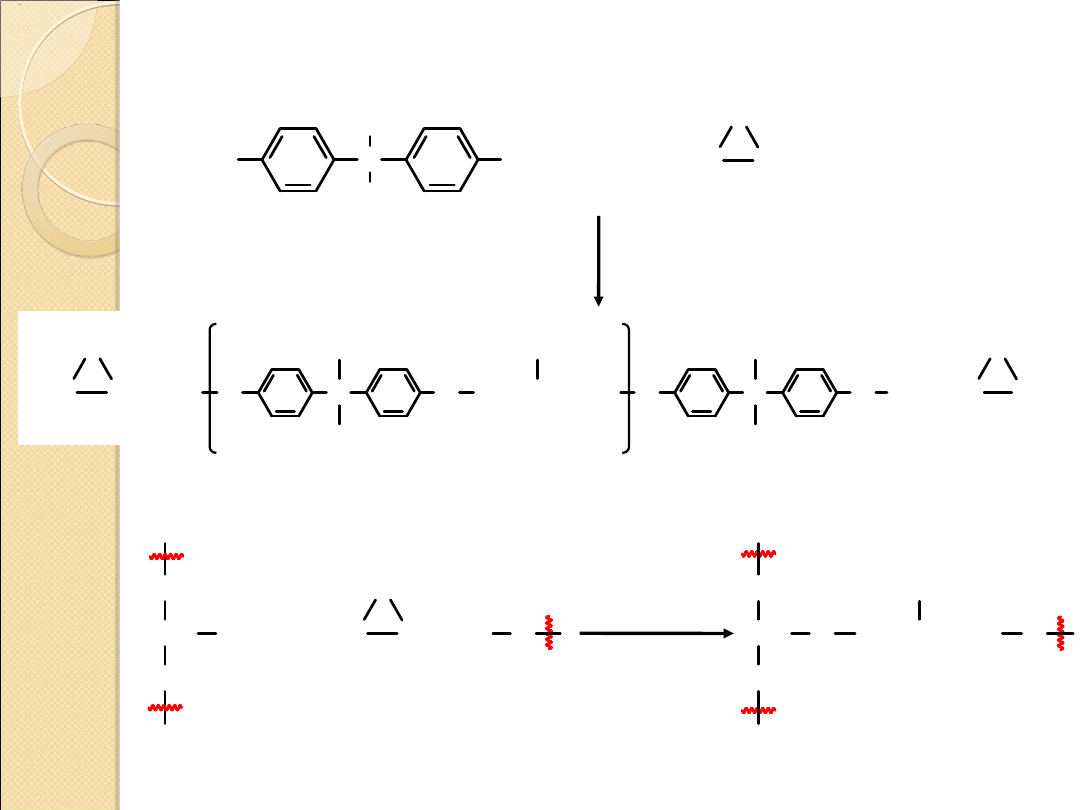
ŻYWICE EPOKSYDOWE I ŚRODKI KLEJĄCE
HO
C
CH
3
CH
3
OH
H
2
C CHCH
2
Cl
O
+
bisfenol A
epichlorohydryna
H
2
C CHCH
2
O
O
C
O
CH
2
CHCH
2
O
C
O
CH
2
CH
CH
3
CH
3
CH
3
CH
3
OH
CH
2
O
n
„prepolimer”
CH
CH
2
CH
2
OH
H
2
C CHCH
2
O
O
CH
CH
2
CH
2
O
CH
2
CHCH
2
O
OH
utwardzacz
+
środek
łańcucha 1
koniec
łańcucha 2
„łańcuchy
usieciowane”
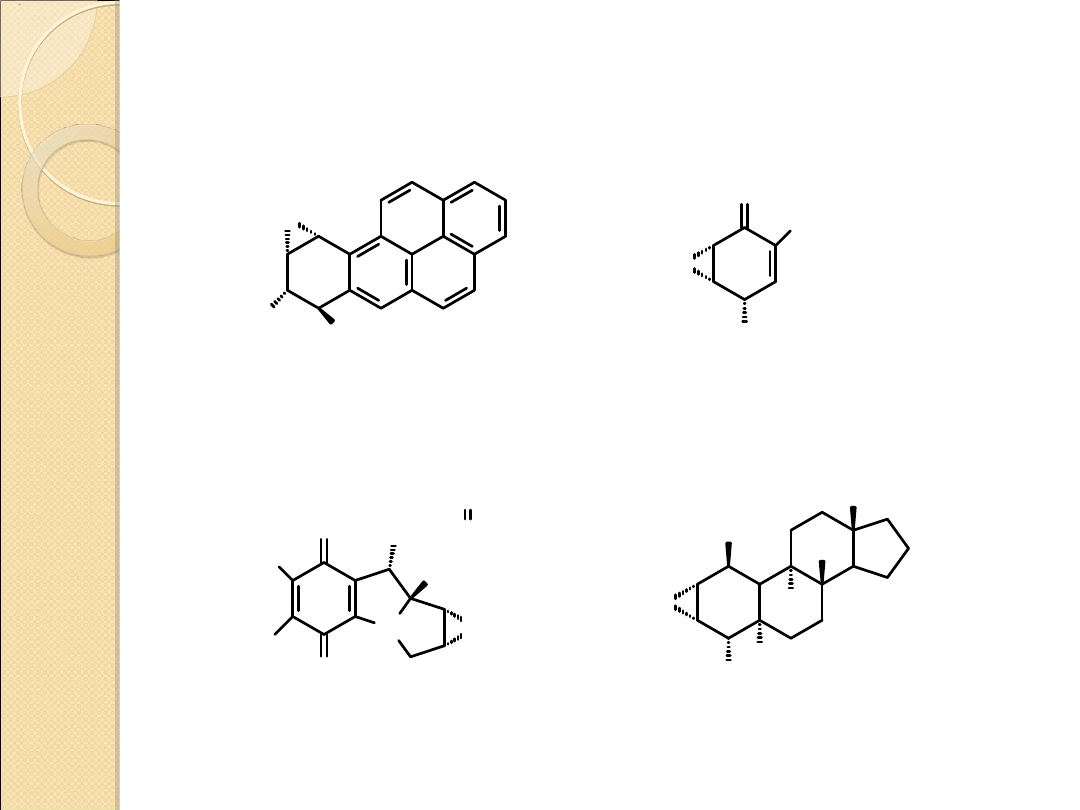
DZIAŁANIA BIOLOGICZNE NIEKTÓRYCH ZWIĄZKÓW
ZAWIERAJĄCYCH TRÓJCZŁONOWE PIERŚCIENIE
HETEROCYKLICZNE
O
HO
OH
CH
2
OH
O
O
OH
pochodna benzo[a]pirenu
silne działanie rakotwórcze
epoksydon – antybiotyk
N
O
O
H
2
N
Me
CH
2
OCNH
2
OMe
NH
O
S
Me
H
H
H
H
Me
mitomycyna C
*
Mepitiostane
*
* - działanie
antynowotworowe
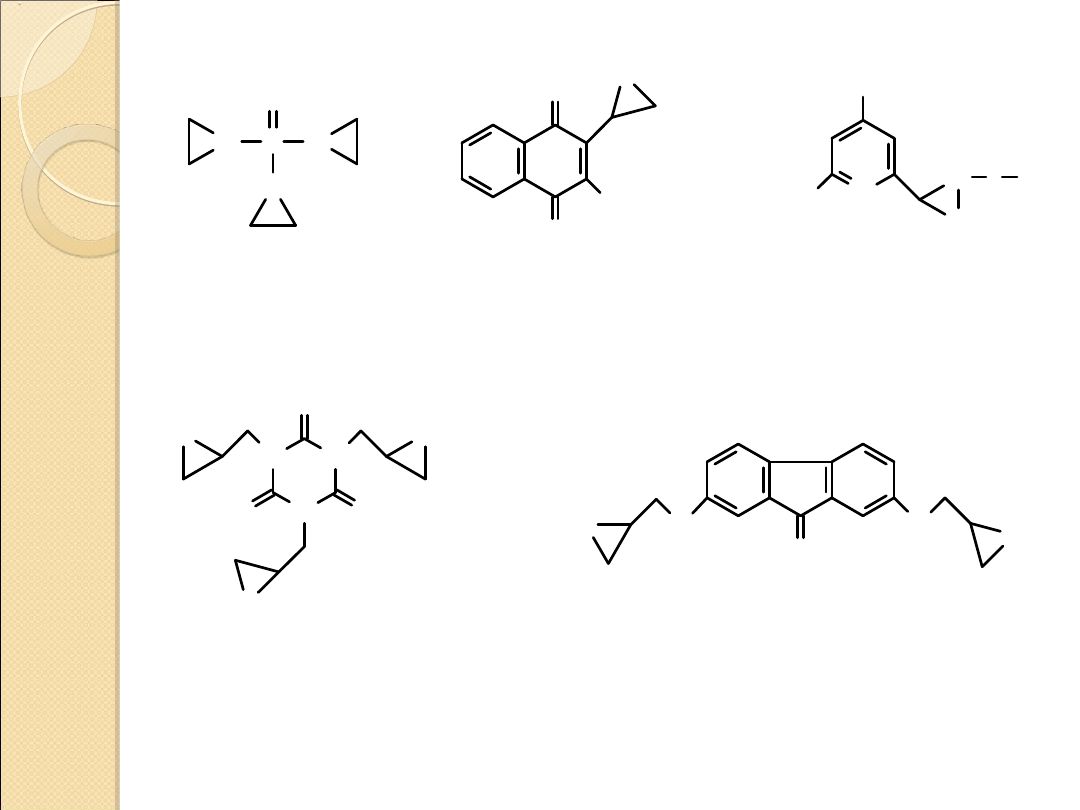
* - działanie
antynowotworowe
P
X
N
N
N
O
O
OCH
3
O
N
OHC
OCH
3
O
N t Bu
X = O, Trenimon
*
*
*
N
N
N
O
O
O
O
O
O
O
O
O
O
O
*
*

PIERŚCIENIE
PIERŚCIENIE
CZTEROCZŁONOWE
CZTEROCZŁONOWE
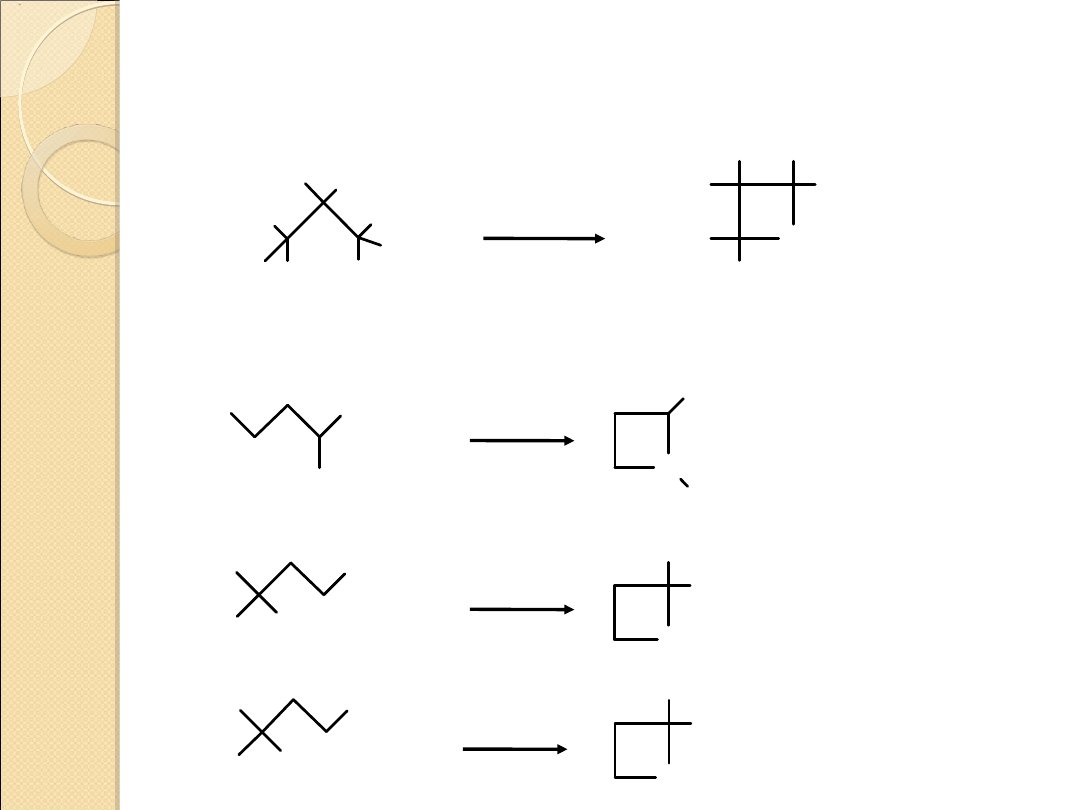
TWORZENIE CZTEROCZŁONOWYCH
PIERŚCIENI HETEROCYKLICZNYCH
R
1
R
2
X
R
3
R
4
YZ
R
5
R
6
YZ
R
1
R
2
R
3
R
4
R
5
R
6
zasada
X = Br, OTs, OSO
3
–
;
Y = O, S, N;
Z = H, Ts, Bz
NHTs
COOEt
Br
HS
R
R
Cl
HO
R
R
OTs
N
COOEt
Ts
S
R
R
O
R
R
OH
–
– HBr
OH
–
– HCl
1. BuLi
2. Δ
pochodna
azetydyny
pochodna
tietanu
pochodna
oksetanu
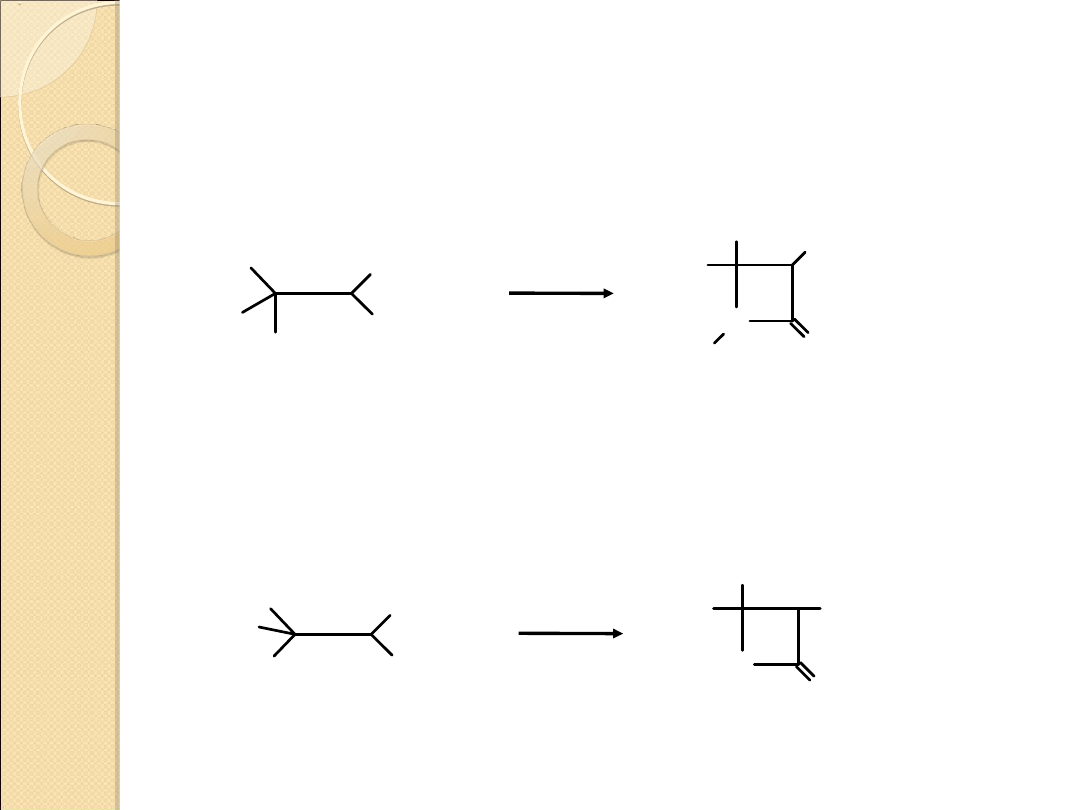
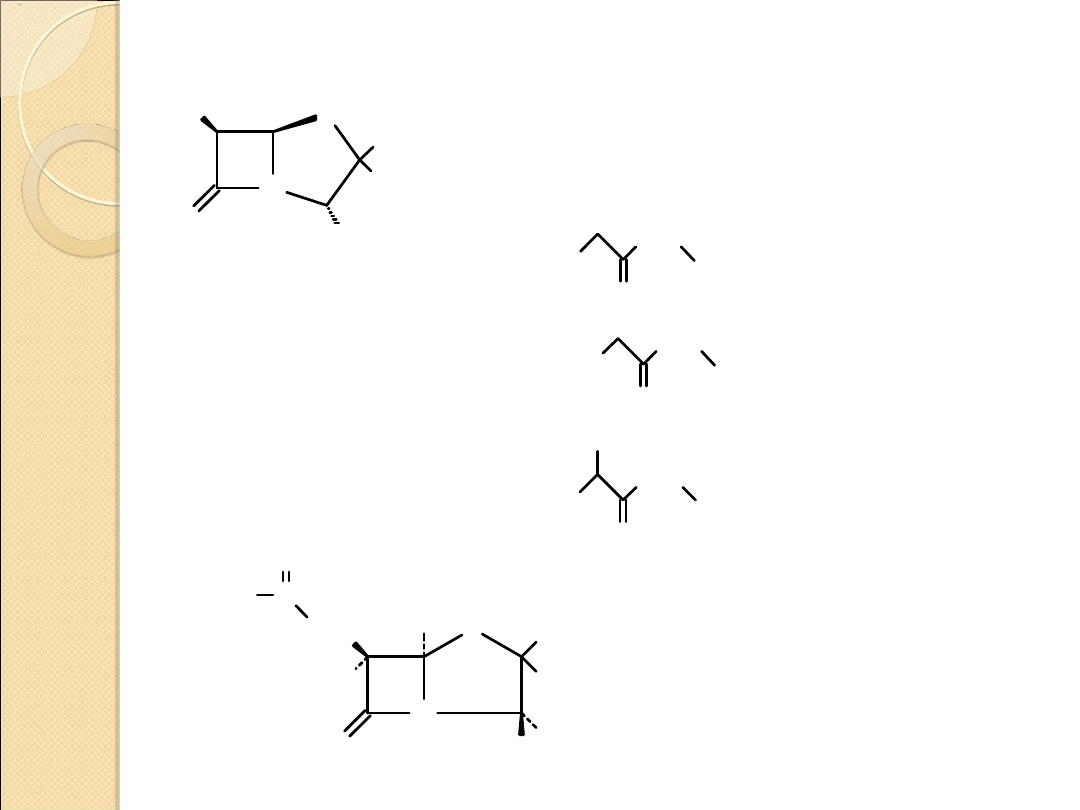
β–LAKTAMY (2–AZETYDONY)
I β–LAKTONY (2–OKSETANONY)
2–azetydony – otrzymywanie przez cyklizację β–
aminokwasów
2–oksetanony – otrzymywanie przez cyklizację
β–hydroksykwasów
R
4
NH
R
2
R
3
R
1
COOH
N
R
1
R
2
R
3
R
4
O
Δ
– H
2
O
R
2
R
1
COOH
HO
R
3
O
O
R
1
R
2
R
3
Δ
– H
2
O
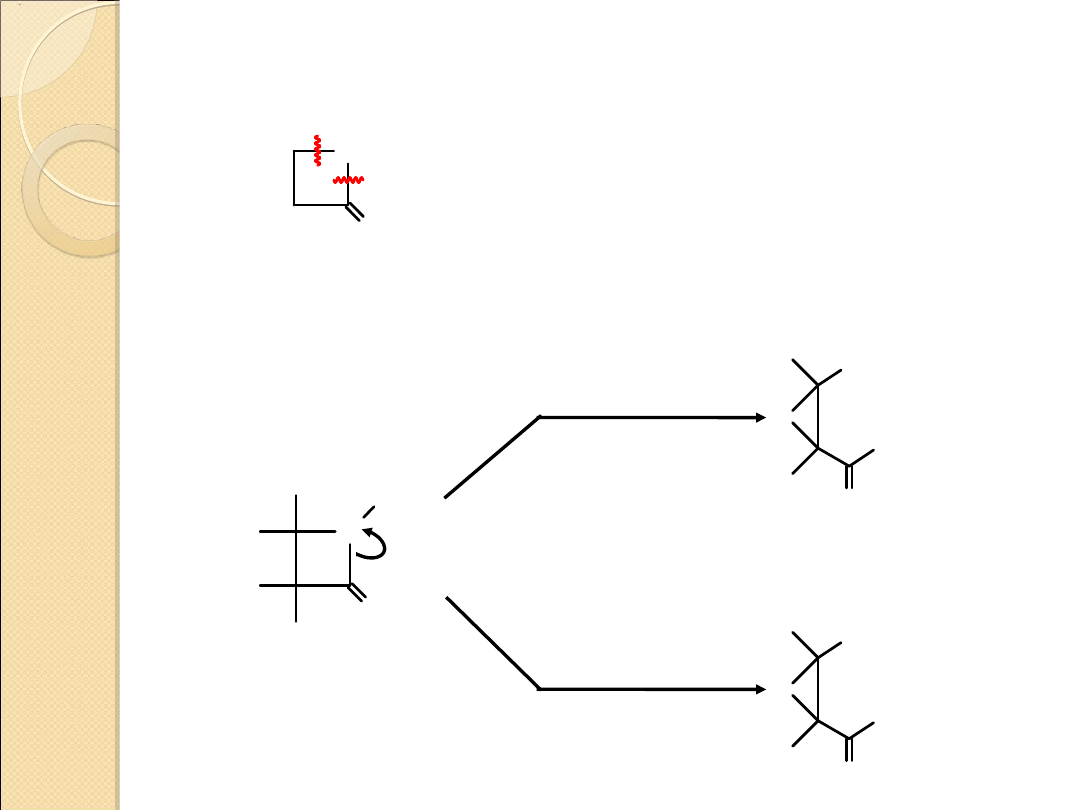
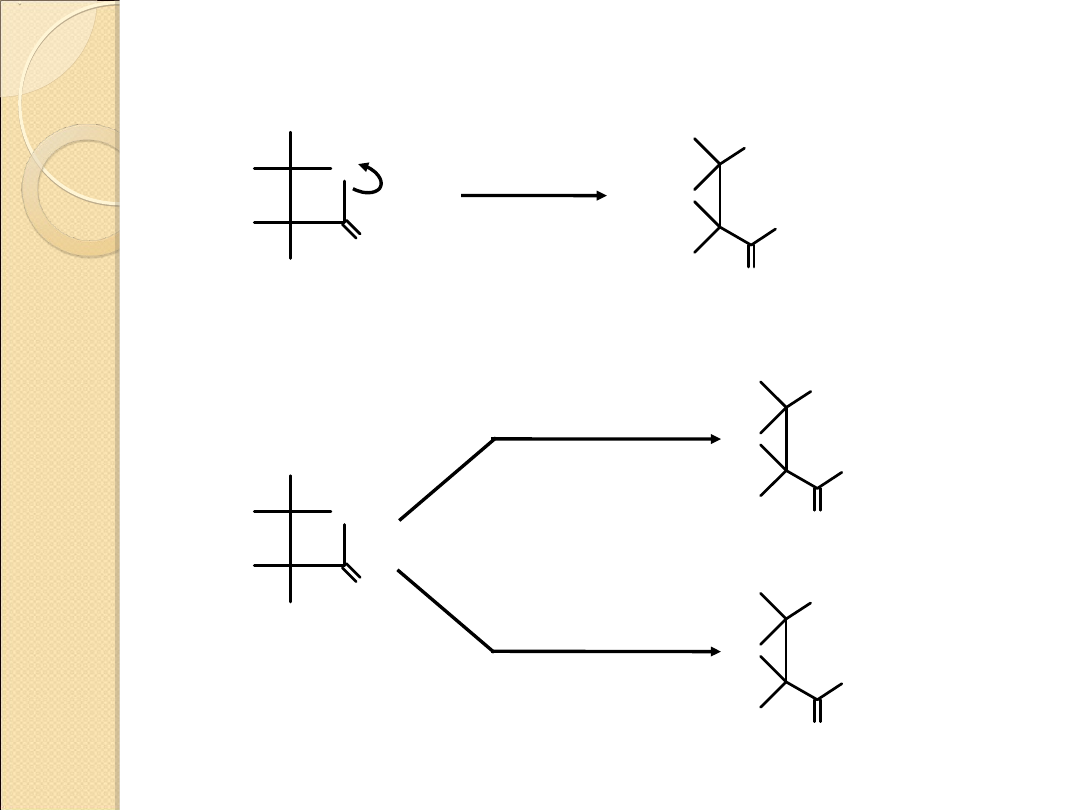
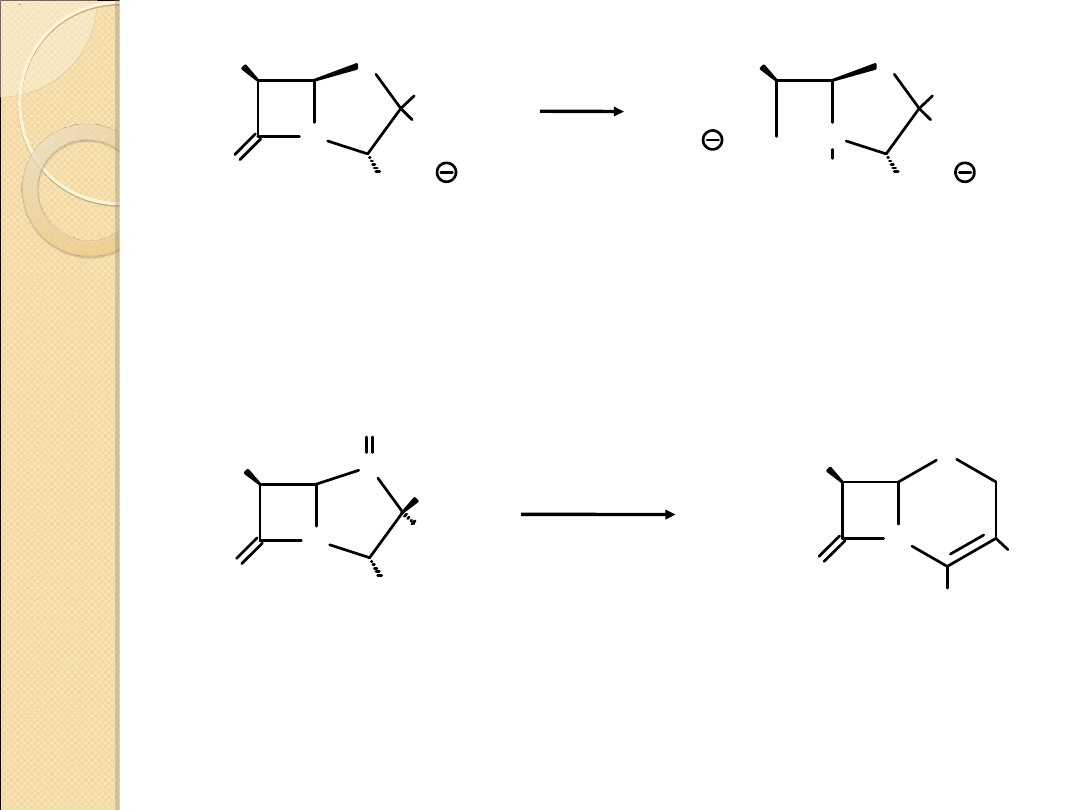
Reakcje otwierania pierścienia
X
O
A
B
X = O, NR, NH
Reakcje 2–azetydonów – otwarcie pierścienia β–
laktamowego
N
O
R
OH
NHR
O
OEt
NHR
O
NaBH
4
, EtOH
H
2
O, H
+
R = H, alkil,
aryl
Reakcje 2–oksetanonów – otwarcie pierścienia β–
laktonowego
O
O
OH
OH
O
OPh
O
18
H
O
H
2
O
18
,pH = 7
1. 20% NaOH
2. HCl
OPh
OH
O
O
O
PhOH, H
+
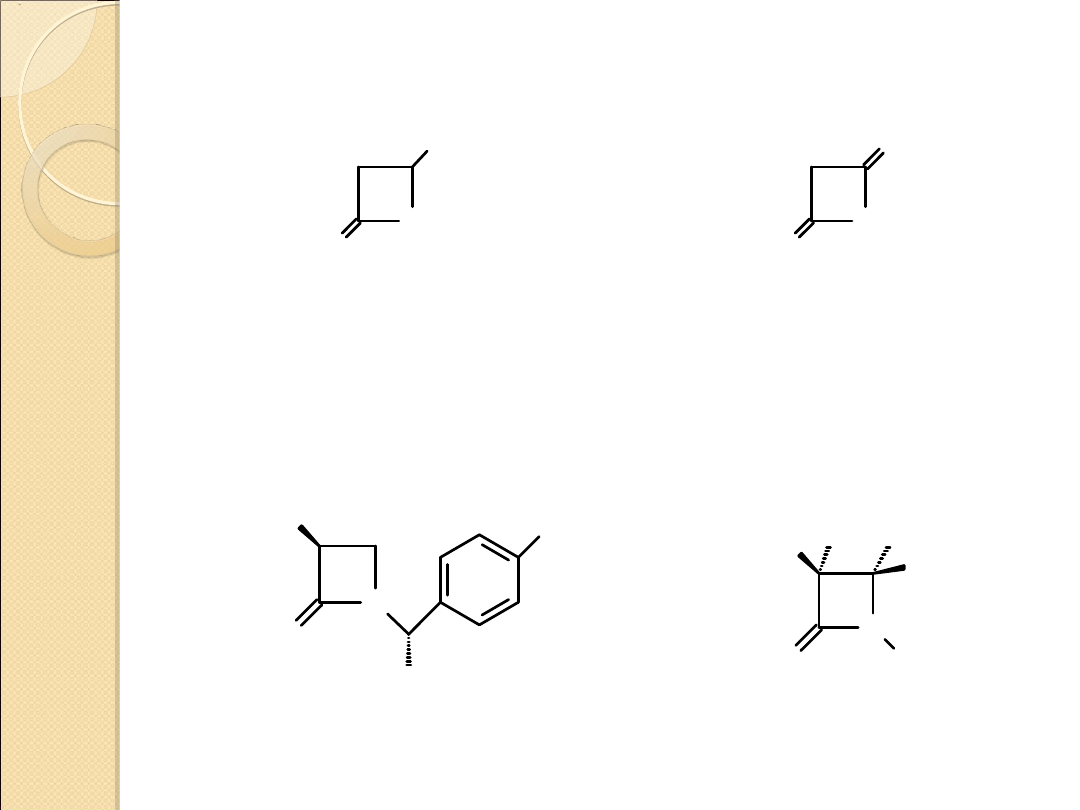
Pochodne 2–oksetanonów i 2–azetydonów posiadające
znaczenie praktyczne
O
O
CH
3
O
O
CH
2
4–metylo–2–oksetanon
(β–propiolakton)
synteza organiczna – polimery
silna trucizna – sterylizacja na zimno,
czynnik sieciujący włókna wełniane i
bawełniane (ochrona przed owadami)
diketen
synteza organiczna
i sieciowanie polimerów
N
COOR
2
OH
O
R
1
CONH
N
O
H
R
1
CONH
CH
3
H
SO
3
K
+
antybiotyk z grupy
monolaktamów
antybiotyk β–laktamowy
nokardicyna
antybiotyk β–laktonowy 1233A
O
HO
COOH
O
N
O
S
1
2
3
4
5
6
7
N
O
S
1
2
3
4
5
6
7
8
penam
cefam
Antybiotyki cefalosporynowe
N
O
S
R
1
CONH
COOH
CH
2
R
2
S
CH
2
R
1
=
R
2
= ―OAc
R
1
= N≡CCH
2
―
R
2
= ―OAc
N
N
N N CH
2
N
S
N
Me
R
1
=
R
2
=
S
CH
2
N
R
1
=
R
2
=
Antybiotyki penicylinowe
N
O
NH
S
H
C
O
C
6
H
5
CH
2
H
HCOOH
CH
3
CH
3
N
O
S
R
Me
Me
COOH
R =
penicylina G
R =
penicylina V
R =
ampicylina
Ph
NH
O
PhO
NH
O
NH
2
Ph
NH
O
penicylina G
N
O
S
R
Me
Me
COO
N
S
R
Me
Me
COO
H
OOC
OH
–
N
O
S
RCONH
Me
Me
COOR
O
N
O
RCONH
S
COOR
Me
(AcO)
2
O, Δ
Rozszczepienie wiązania β–laktamowego w cząsteczce penicyliny
zachodzi łatwiej niż hydroliza wiązania amidowego w łańcuchu
bocznym R
Przekształcenie penicyliny w cefalosporynę (przegrupowanie
penicylinowe)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Homo i heteroglikany 2012 2013
ANOMALIE HETEROCHROMOSOMÓW
Związki heterocykliczne, Chemia
Lekcja 7 ?presja inbredowa i heterozja
heteroazeotrop
Cząsteczki heterojądrowe
modelowanie DFT w katalizie heterogenicznej
20 ODŻYWIANIE HETEROTROFICZNE ORGANIZMÓW
I heterofobi dla stud pedag, Kulturoznawstwo, III rok, Etyka
Kinetyka reakcji heterogenicznych
Mikrobiologia, - na dł, LPS = endotoksyna: lipopolisacharydy inaczej heteropolimery złożone z trzech
HETEROCYKLE
Stereotyp jezykowy - heterostereotypy, Językoznawstwo
heterocykle zinczenko, Pytania z zeszłego roku od Zinczenko:
zwiazki heterocykliczne
2 heterocykle
Dealing with large heterogeneous classes
więcej podobnych podstron