
PIERŚCIENIE
PIERŚCIENIE
PIĘCIOCZŁONOWE Z
PIĘCIOCZŁONOWE Z
JEDNYM LUB DWOMA
JEDNYM LUB DWOMA
HETEROATOMAMI
HETEROATOMAMI

ZWIĄZKI HETEROCYKLICZNE
O CHARAKTERZE
AROMATYCZNYM,
ZAWIERAJĄCE
PIĘCIOCZŁONOWY PIERŚCIEŃ
Z JEDNYM HETEROATOMEM
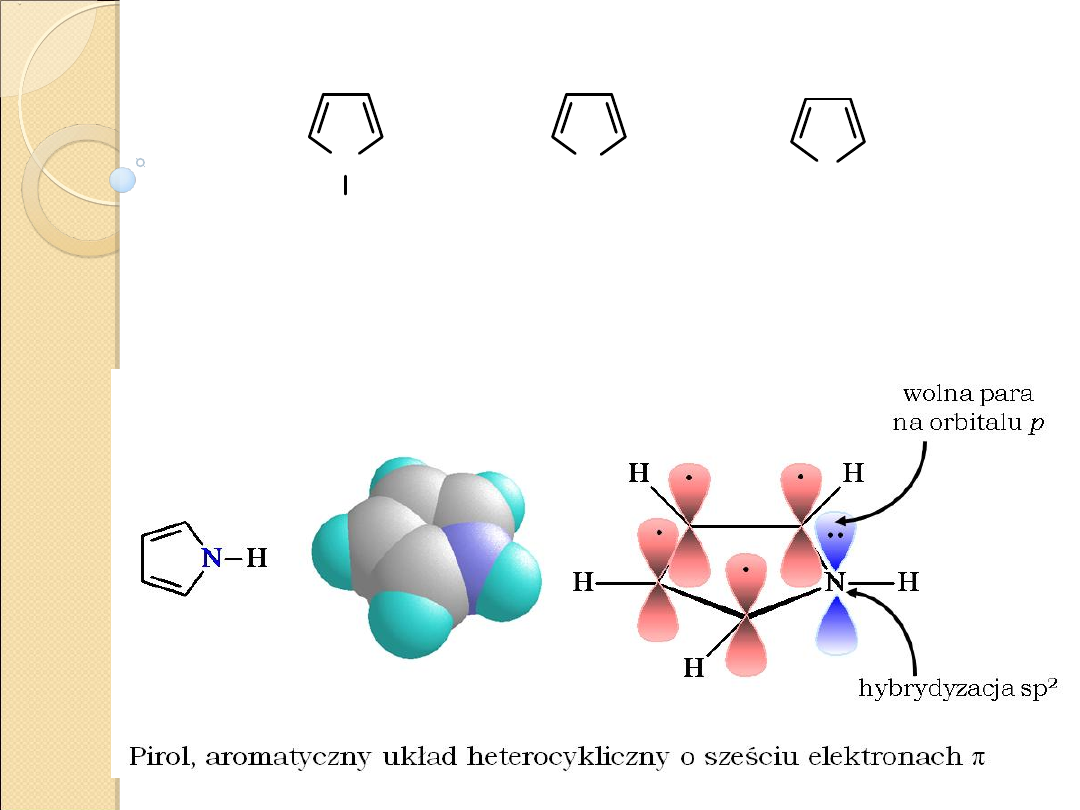
pirol
furan
tiofen
N
H
1
2
3
..
S
1
2
3
..
..
..
..
O
1
2
3
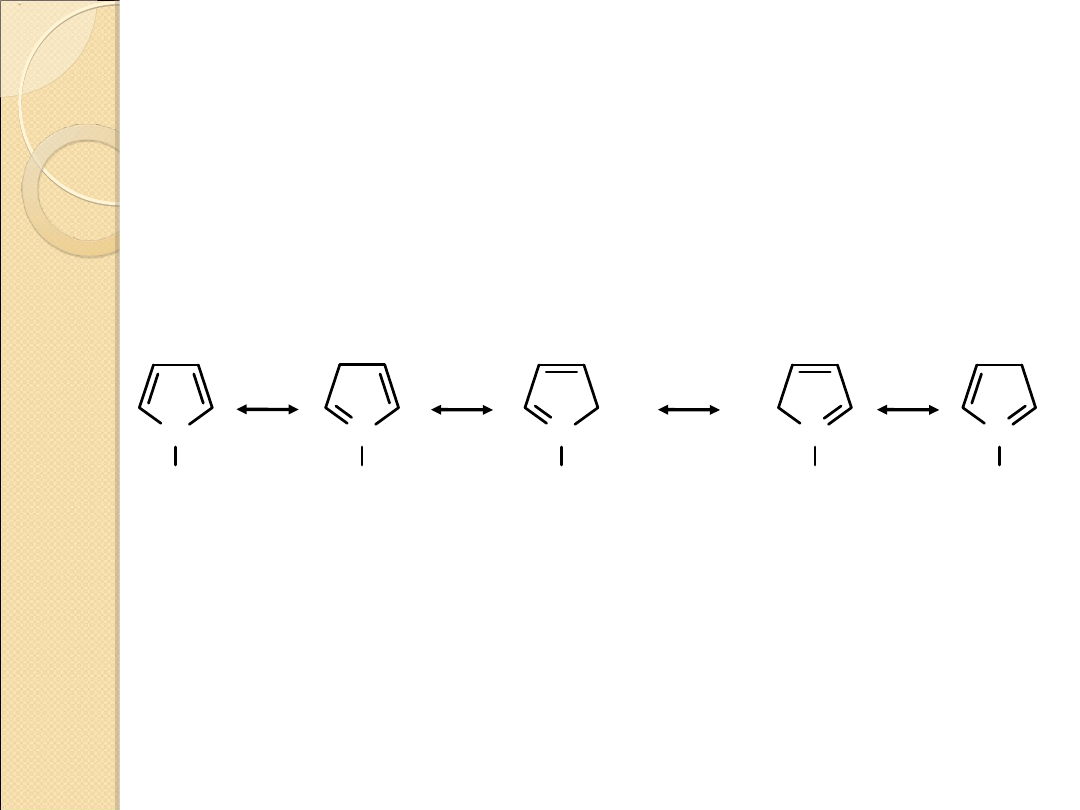
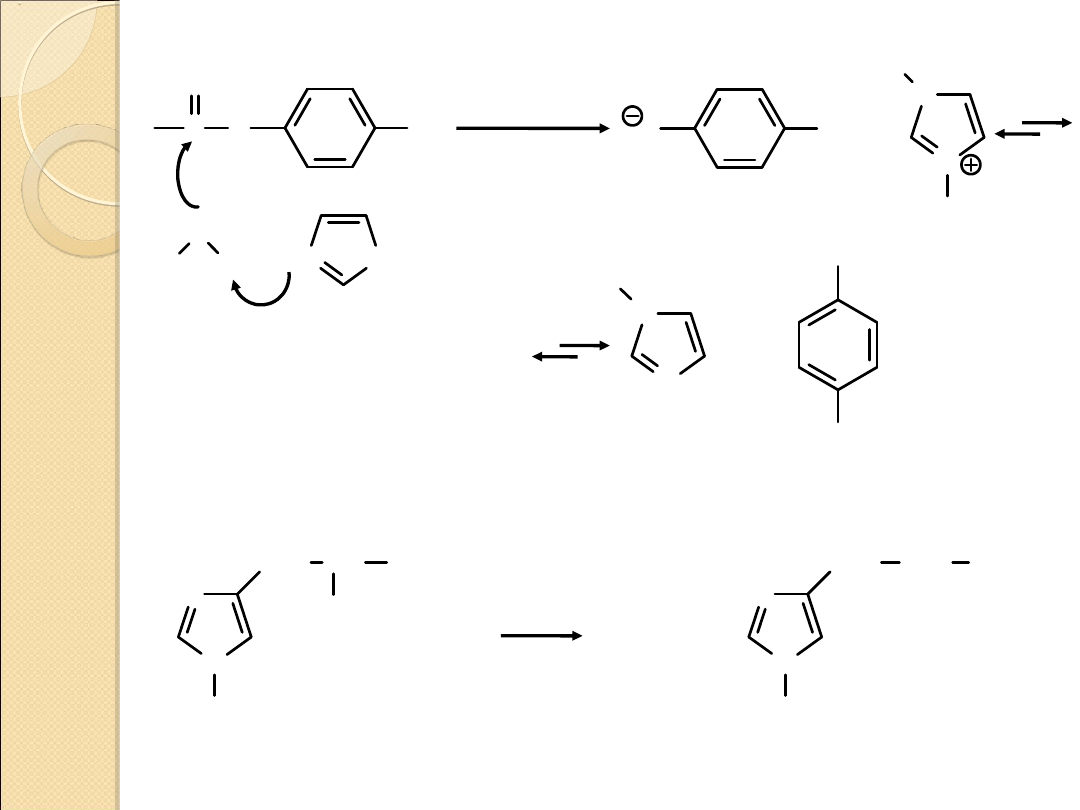
Struktury rezonansowe pirolu
N
H
..
N
H
+
–
..
N
H
+
..
–
N
H
+
..
–
..
N
H
+
–
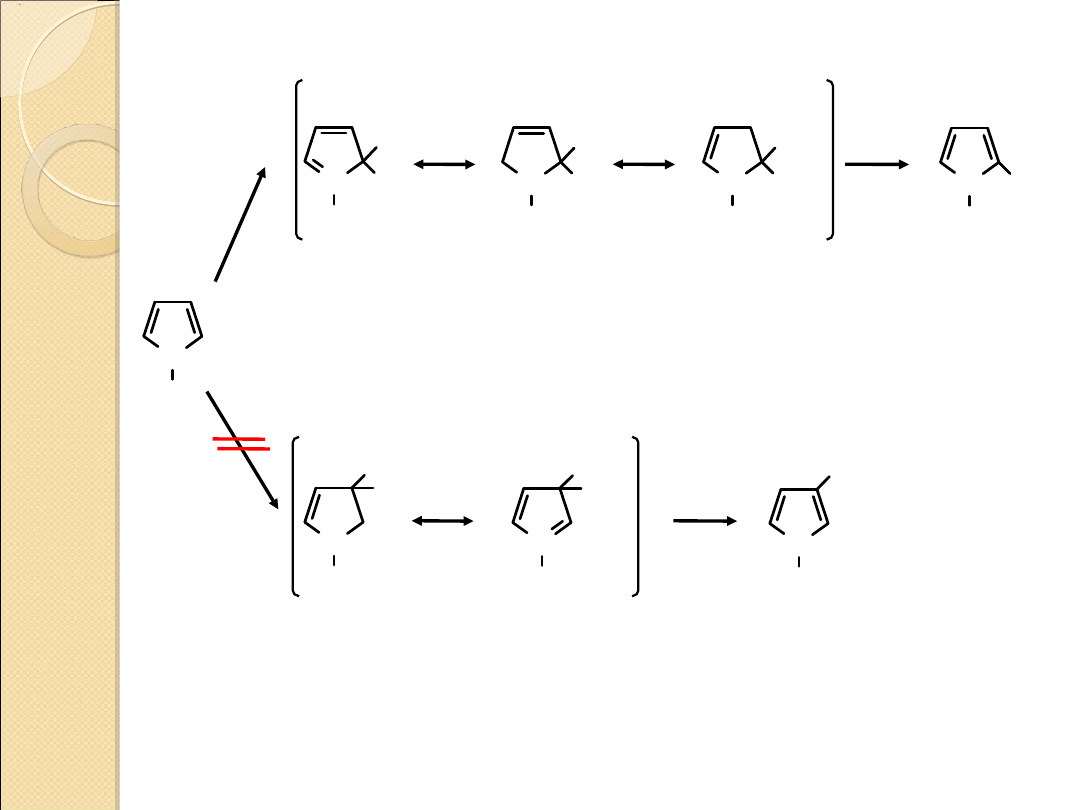
Reakcja substytucji elektrofilowej
N
H
NO
2
N
H
..
..
N
H
NO
2
H
+
N
H
H
NO
2
+
N
H
NO
2
..
N
H
H
NO
2
..
+
N
H
H
NO
2
..
+
N
H
NO
2
H
..
+
2–nitropirol
3–nitropirol
(NIE tworzy się)
Reakcja elektrofilowego nitrowania pirolu. Produkt pośredni
utworzony w wyniku reakcji na atomie węgla C2 jest bardziej trwały
niż analogiczny produkt wytworzony w wyniku reakcji na atomie
węgla C3.
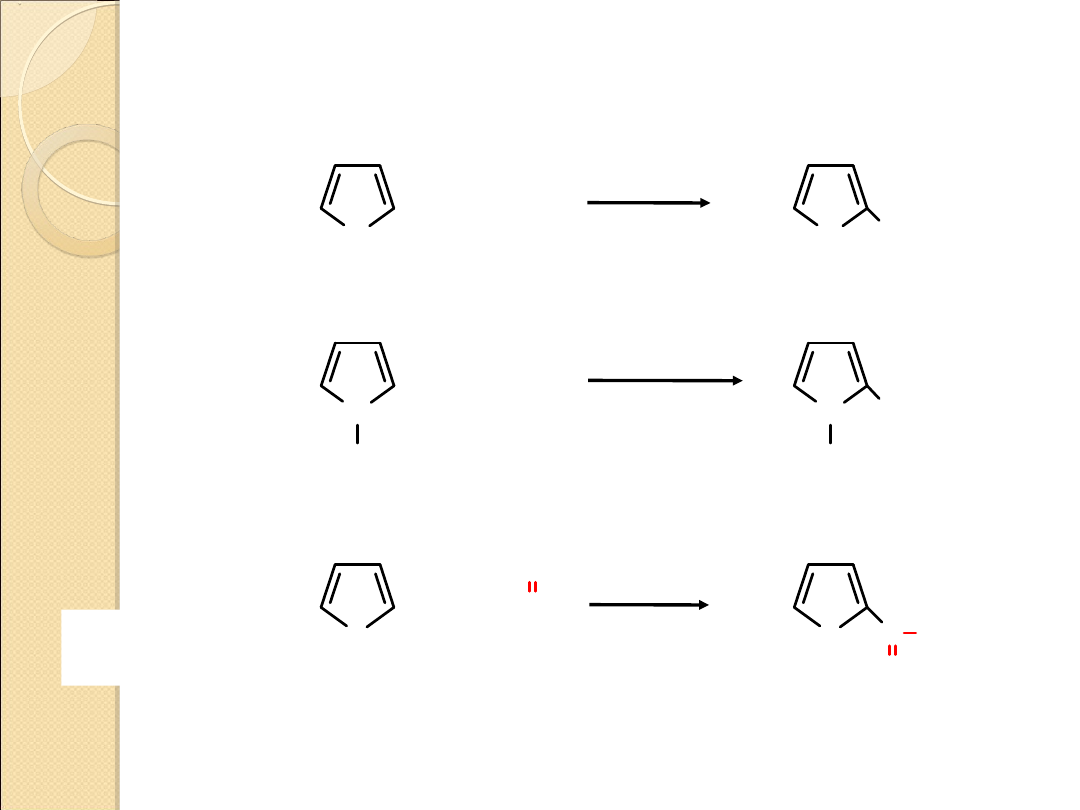
REAKCJE SUBSTYTUCJI ELEKTROFILOWEJ PIROLU,
FURANU I TIOFENU
O
Br
2
O
Br
H
Br
+
dioksan
0
o
C
+
bromowanie
furan
2–bromofuran
(90%)
..
..
..
..
N
H
N
H
NO
2
HNO
3
H
2
O
+
bezwodnik
octowy
+
nitrowanie
..
..
2–nitropirol
(83%)
pirol
S
S
C
O
CH
3
CH
3
CCl
O
H
Cl
+
benzen
SnCl
4
+
acylowanie
Friedela-Craftsa
..
..
..
..
2–
acetylotiofen
(83%)
tiofen

Właściwości chemiczne pirolu, furanu i tiofenu przypominają
właściwości pierścienia benzenowego. Pierścienie heterocykliczne są
jednak bardziej reaktywne w stosunku do elektrofili niż pierścienie
benzenowe.
Reaktywność związków maleje w porządku:
furan > pirol > tiofen
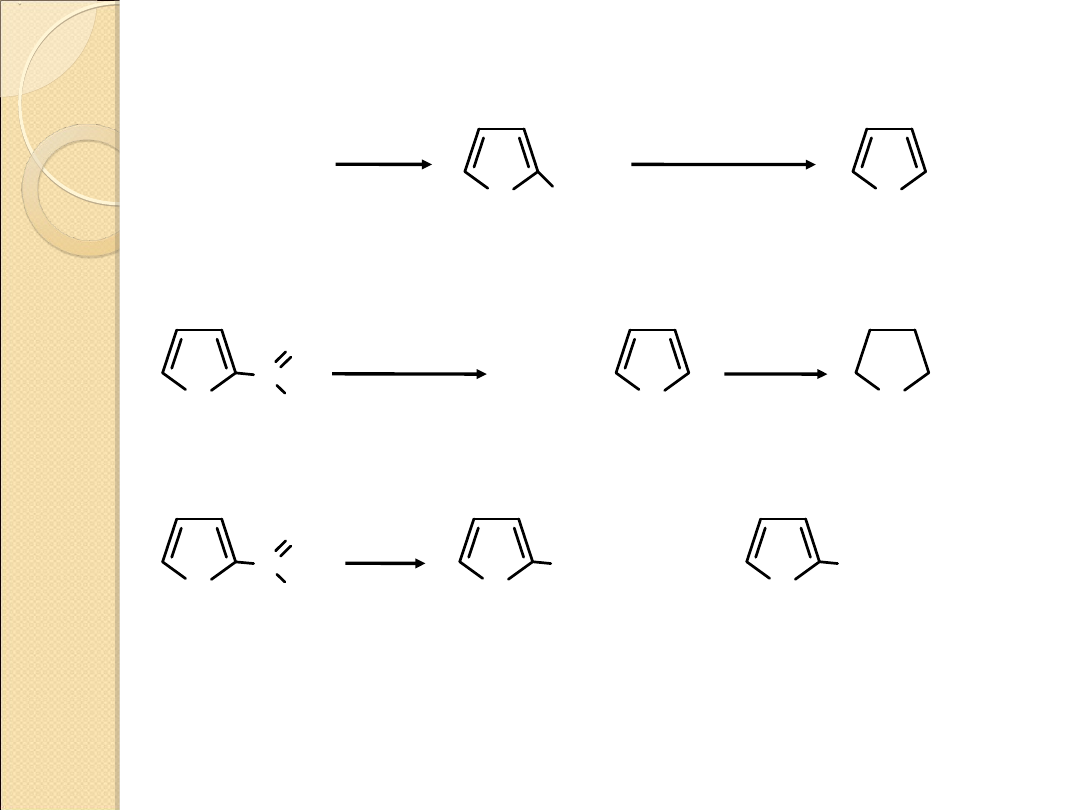
OTRZYMYWANIE I REAKCJE FURANU
C
6
H
10
O
5
O
CHO
CO
O
H
3
O
+
katalizator Ni
280
o
C
+
furan
furfural
mieszanina
pentoz
O
C
O
H
CO
O
O
CaO,400
o
C
H
2
/Ni
+
tetrahydrofura
n
O
C
O
H
+
OH
–
O
CH
2
OH
O
COOH
alkohol
furfurylowy
kwas 2–furano–
karboksylowy
(kwas furoinowy)
O
C
O
H
HNO
3
(CH
3
CO)
2
O
O
CH(OCCH
3
)
2
O
O
2
N
O
C
O
2
N
N NH C NH
2
O
H
H
2
NNHC
O
NH
2
(semikarbazyd
)
nitrofurazon
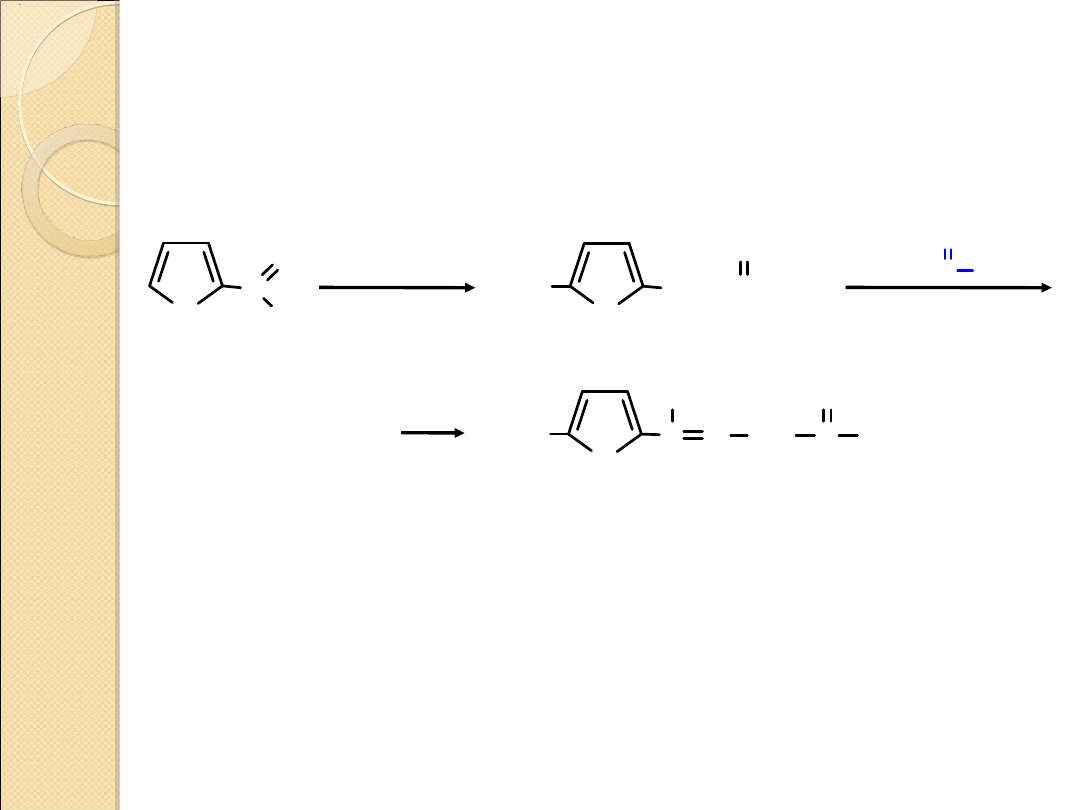
OTRZYMYWANIE TIOFENU
S
CH
2
CH
3
CH
2
CH
3
4S
3H
2
S
650
o
C
+
+
S
CH CH
CH
2
CH
2
H
2
S
S
600
o
C
+
tiofen
1,3–butadien
C
CH
3
CH
2
CH
2
O
C
O
S
CH
3
P
2
S
5
70%
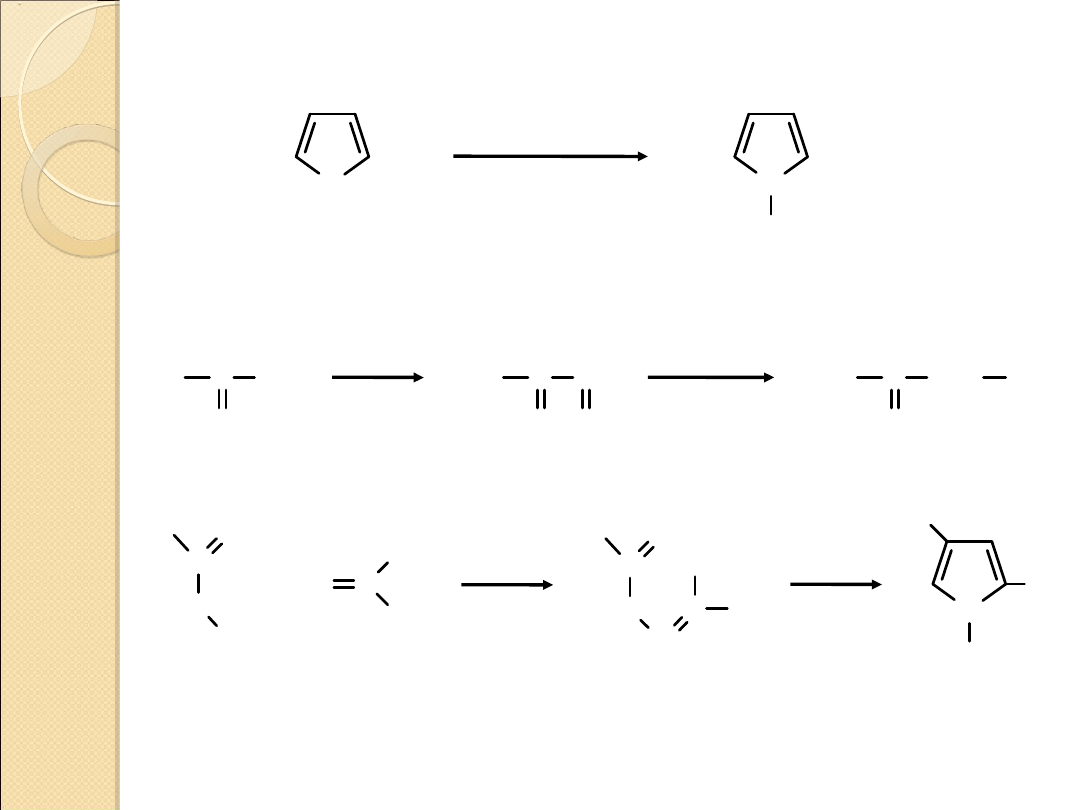
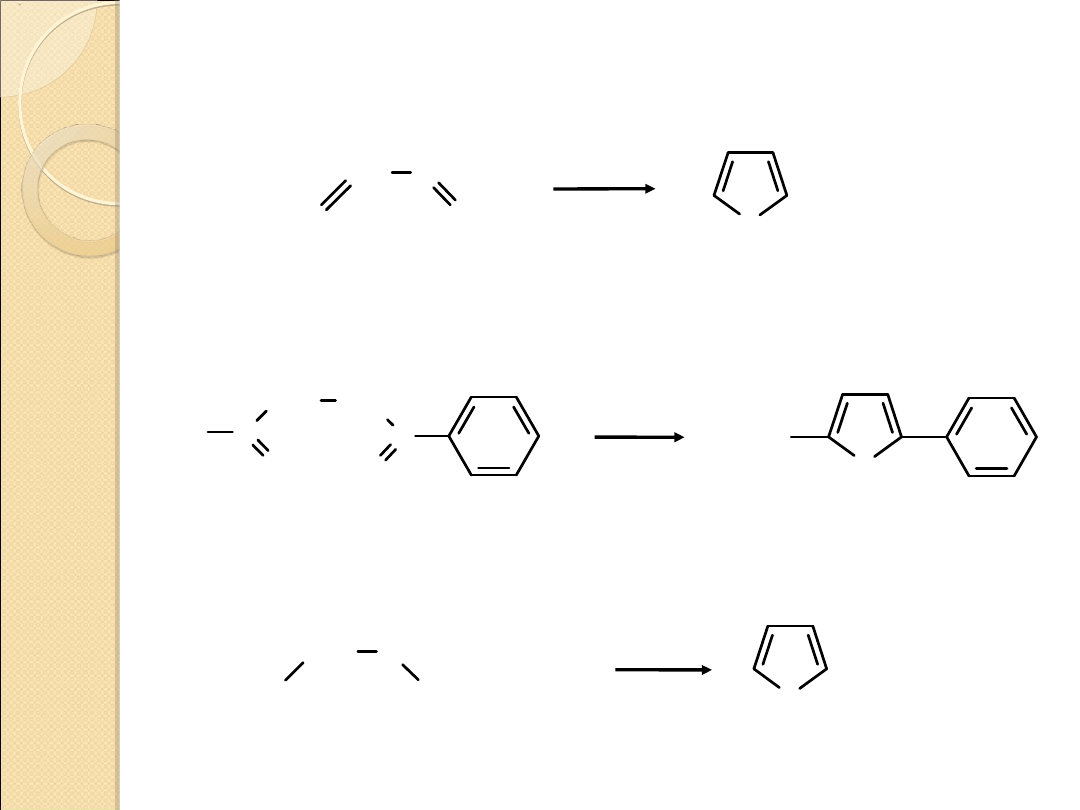
PIROL – OTRZYMYWANIE I REDUKCJA DO PIROLIDYNY
O
N
H
furan
pirol
NH
3
, H
2
O
Al
2
O
3
, 400
o
C
C
CH
3
CH
3
O
C
CH
3
CH
O NOH
C
CH
3
CH
2
O
NH
2
HNO
2
redukcja
H
2
C
C
NH
2
CH
3
O
O C
CH
3
CH
3
H
2
C
N
C
CH
3
O
C
CH
3
CH
3
N
H
CH
3
CH
3
+
– H
2
O
– H
2
O
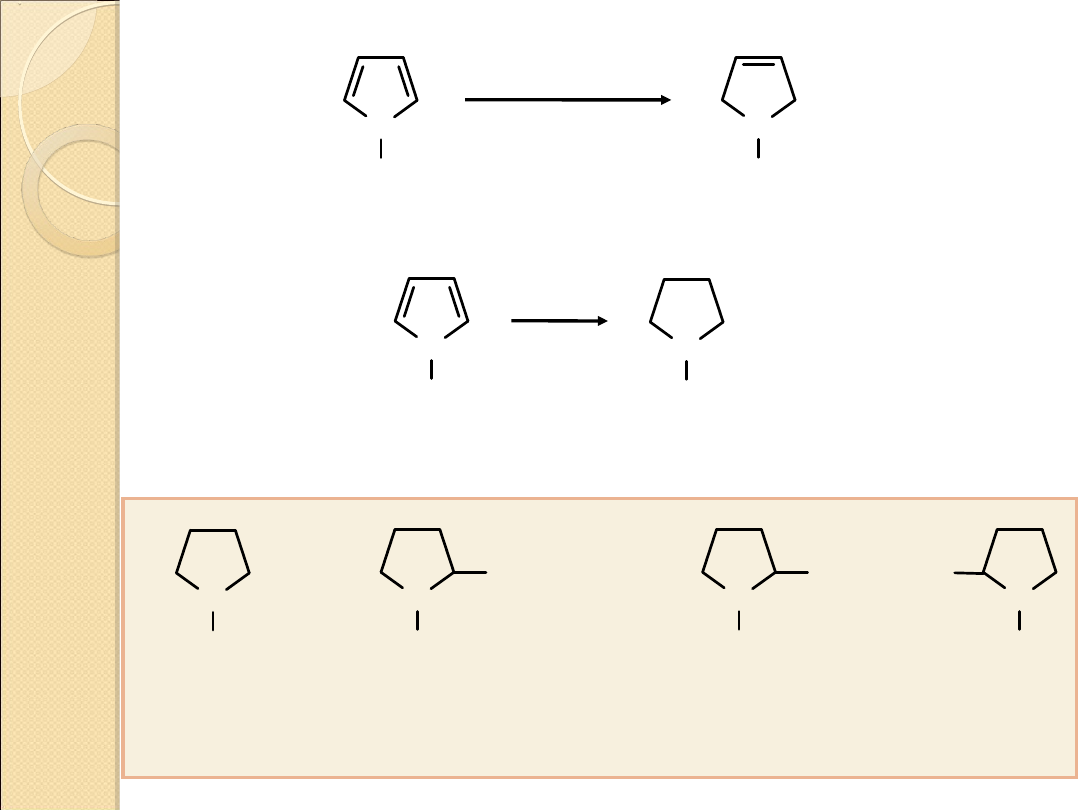
pKa = 0.4
(słaba zasada)
2,5–dihydropirol
N
H
Zn, CH
3
COOH
N
H
pirolidyna
pKa = 11.27
H
2
/Pt
N
H
N
H
N
H
1
2
3
N
CH
3
CH
2
COCH
2
N
CH
3
N
CH
3
CH
2
COCH
3
pirolidyna
higryna
kuskohigryna
Alkaloidy zawierające pierścień pirolidynowy
N
N
N
N
Fe
CH
2
CH
2
CH
2
CH
2
COOH
COOH
H
3
C
CH
3
CH CH
2
H
3
C
CH
3
CH CH
2
N
N
N
N
CH
2
Mg
CH
2
C
O
O
O
C
H
3
C
CH
2
CH
3
CH
3
H
3
C
CH
3
CH CH
2
O
2
CH
3
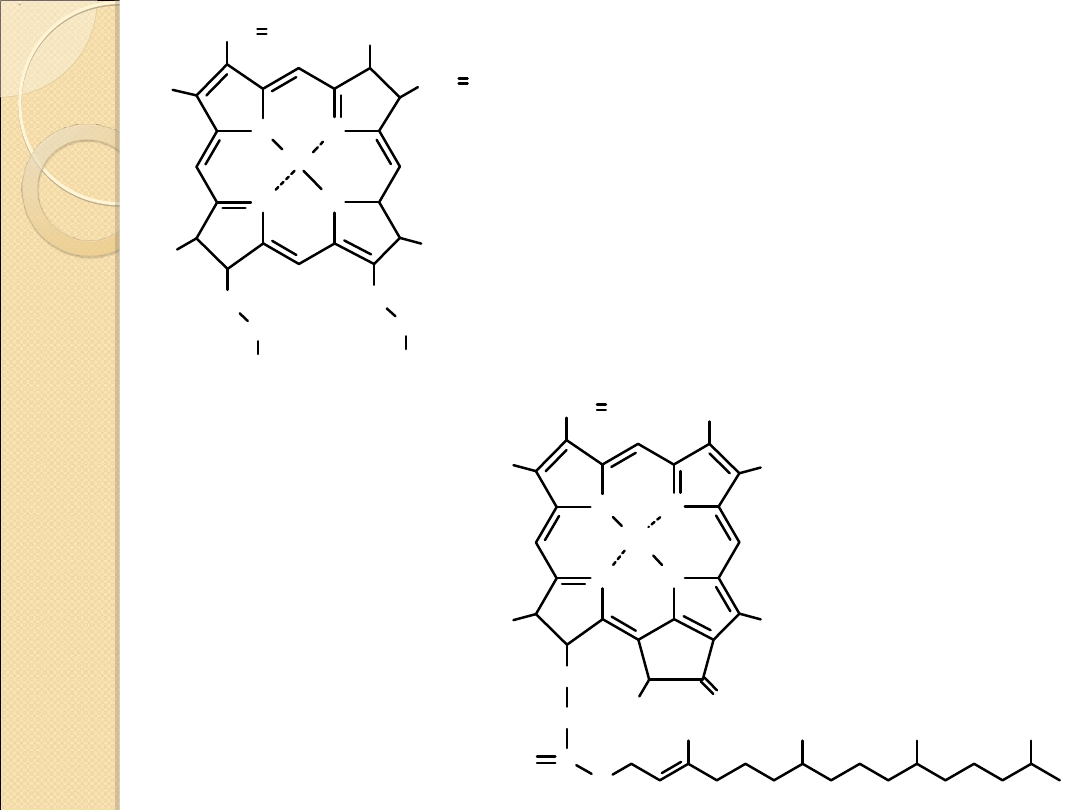
hem
chlorofil
N
N
N
N
H
H
N
N
N
N
Fe
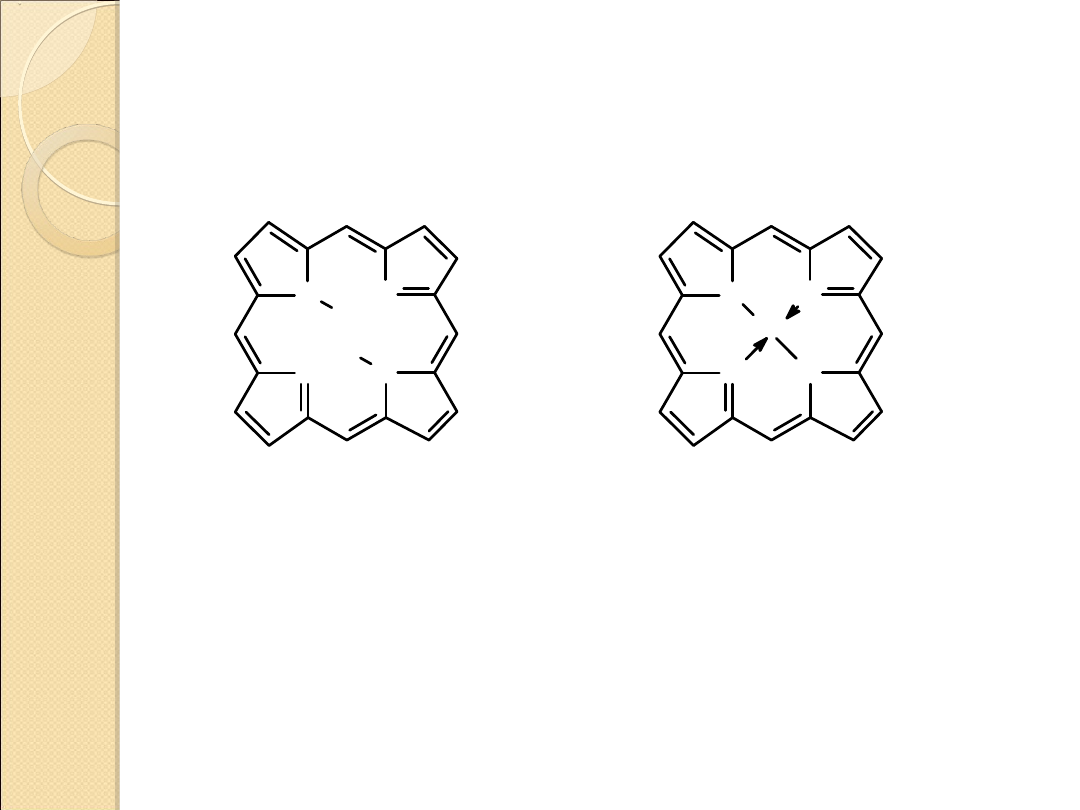
porfiryna
kompleks porfiryny
z jonem Fe
2+
INDOL – ZWIĄZEK HETEROCYKLICZNY POSIADAJĄCY
SKONDENSOWANY PIERŚCIEŃ
N
H
1
2
3
4
5
6
7
indol
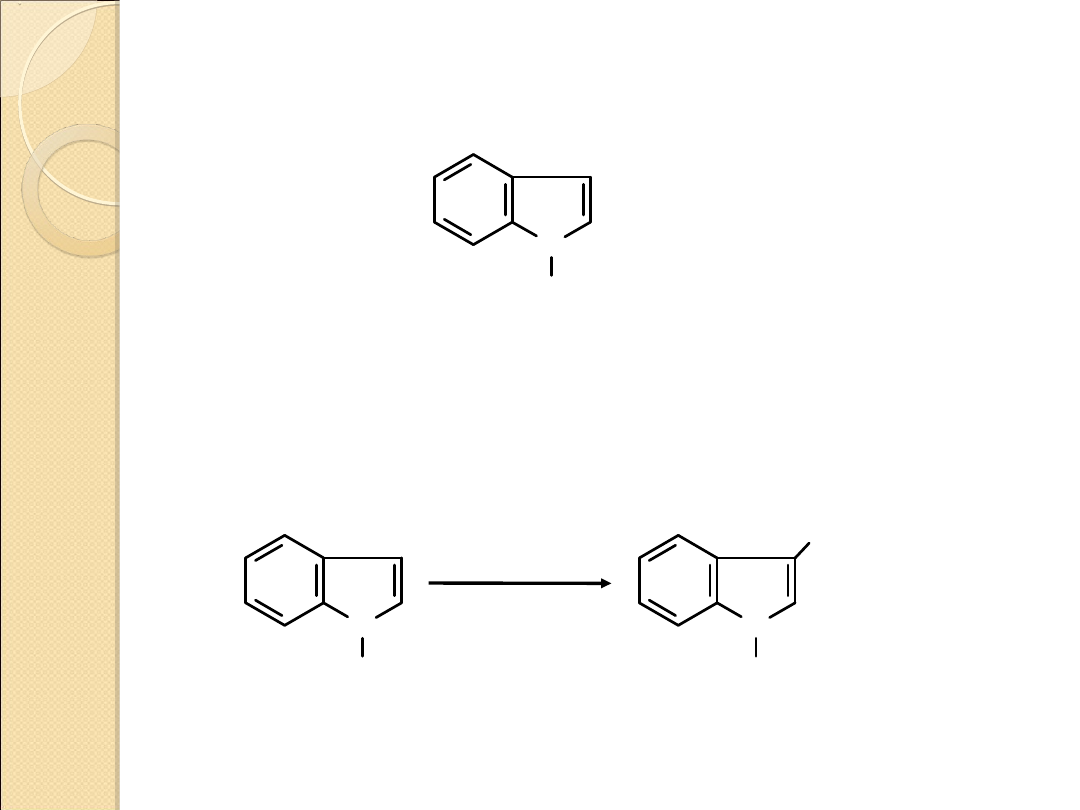
Indol ulega substytucji elektrofilowej łatwiej niż benzen ale
trudniej niż pirol. Ponieważ pierścień pirolowy jest silniej aktywowany
niż benzenowy podstawienie zachodzi na atomie węgla 3 (w
przypadku pirolu podstawnik był kierowany w położenie 2).
Indol jest słabą zasadą podobnie jak pirol.
N
H
N
H
Br
H
Br
indol
3–bromoindol
Br
2
dioksan, 0
o
C
+
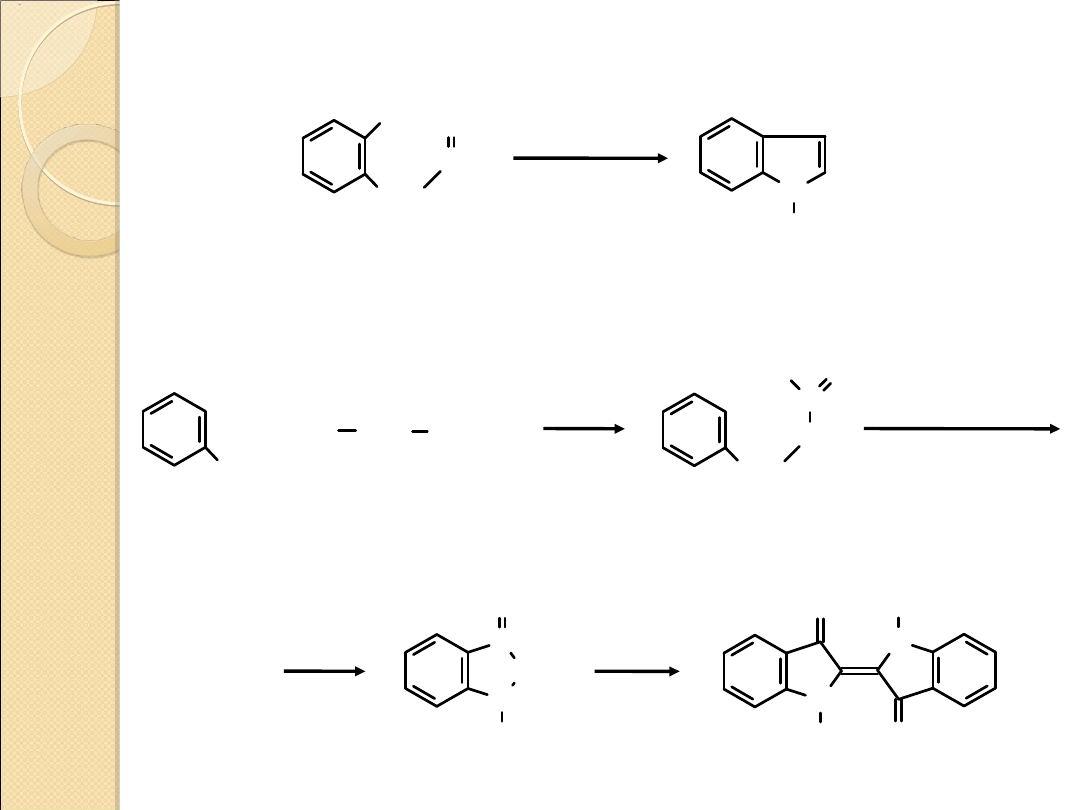
OTRZYMYWANIE INDOLU I JEGO POCHODNYCH
NH
2
Cl CH
2
COOH
NH
CH
2
C
HO
O
C
CH
2
N
H
O
N
O
H
N
O
H
+
O
2
NaNH
2
, NaOH
300
o
C
N–
fenyloglicyna
indoksyl
indygo
CH
3
NH
CH
O
N
H
(CH
3
)
3
COK
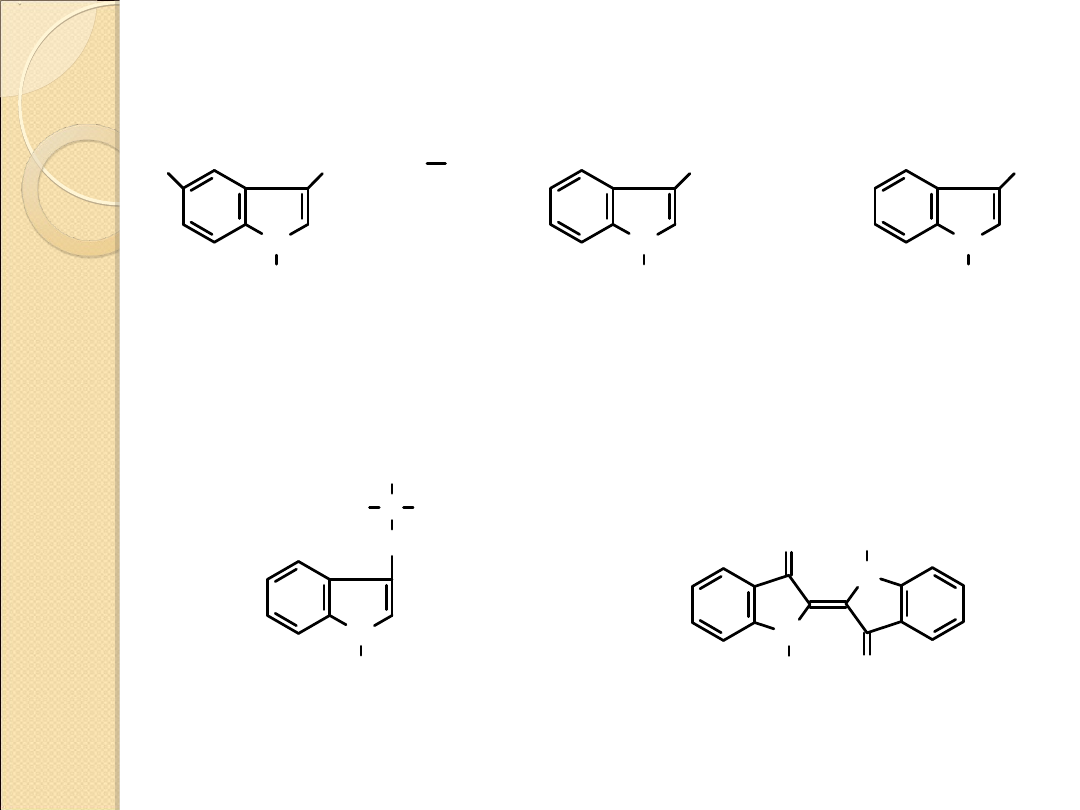
ZWIĄZKI NATURALNE ZAWIERAJĄCE UKŁAD INDOLU
N
H
HO
CH
2
CH
2
NH
2
N
H
CH
2
COOH
N
H
CH
3
5–hydroksytryptamina
(serotonina)
neuroprzekaźnik
kwas indolilooctowy
(auksyna)
hormon wzrostowy
roślin
skatol
N
O
H
N
O
H
N
H
CH
2
C
COOH
H
H
2
N
indygo
barwnik
tryptofan
aminokwas białkowy
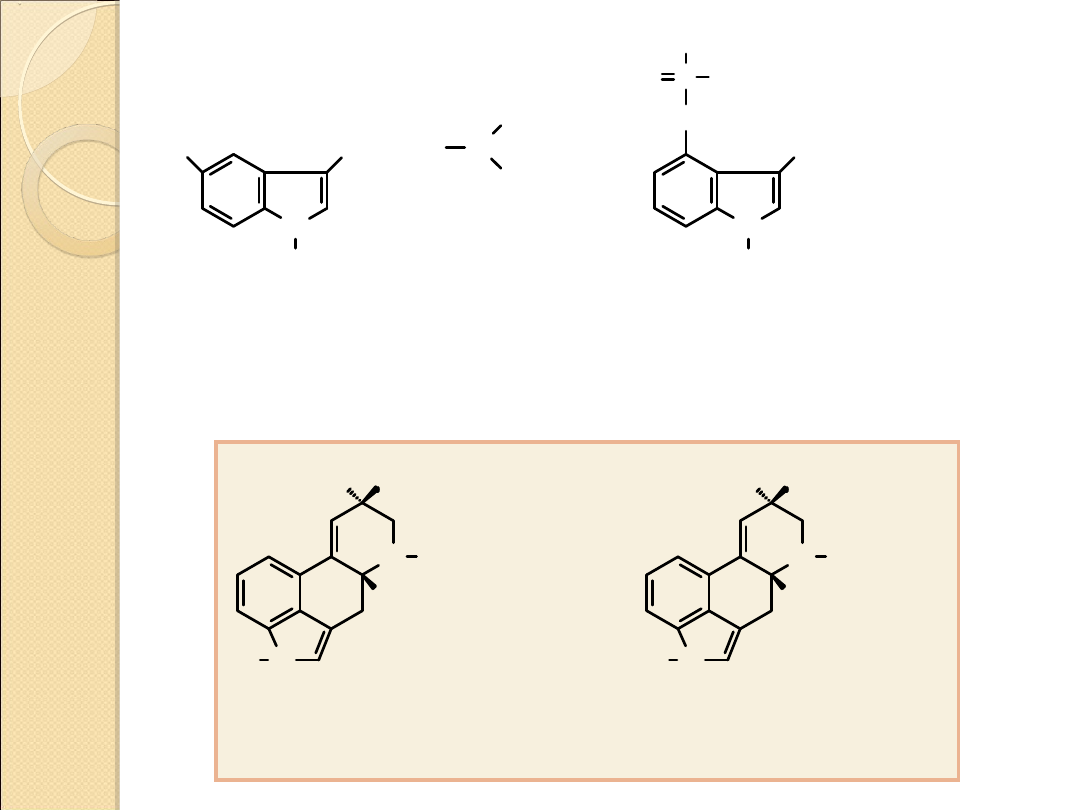
bufotenina
(halucynogen)
występuje w skórze i
jadach ropuch (Bufo)
psylocybina
występuje w meksykańskich
grzybach odurzających
(Psilocybe mexicana)
N
H
HO
CH
2
CH
2
N
CH
3
CH
3
N
H
CH
2
CH
2
N
+
H(CH
3
)
2
O
P
O
OH
O
-
N CH
3
H
H CON(C
2
H
5
)
2
N
H
N CH
3
H
H CONH
2
N
H
LSD–25
amid kwasu lizerginowego
Halucynogeny – pochodne kwasu lizerginowego
N
N
H
OH
CH
3
OOC
O
O
CH
3
H
3
C
O
O
johambina
kantarydyna
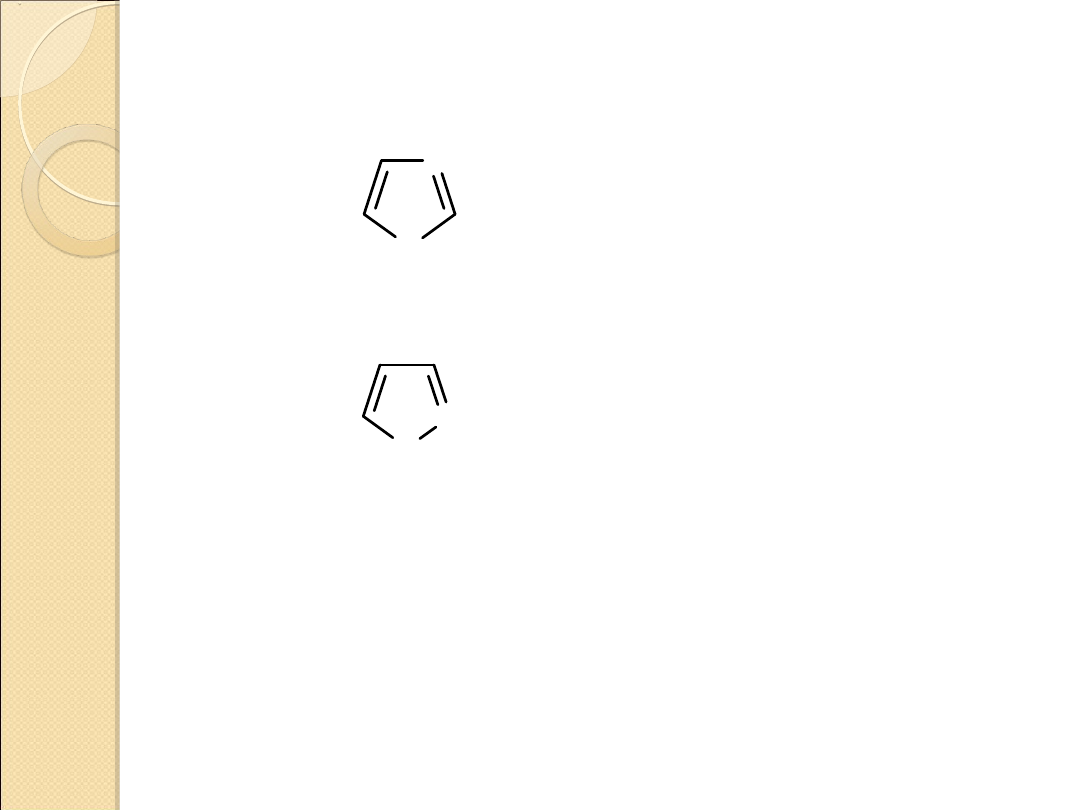
DIAZOLE
N
X
X
N
1,3–diazole
1,2–diazole
X
= NH – imidazol
O – oksazol
S – tiazol
X
= NH – pirazol
O – izooksazol
S – izotiazol
Związki o charakterze aromatycznym.
Energia rezonansu większa niż w przypadku analogicznych
związków zawierających jeden heteroatom i zbliżona do energii
rezonansu benzenu.
Substytucji elektrofilowej ulegają trudniej niż benzen, ale
łatwiej niż pirydyna.
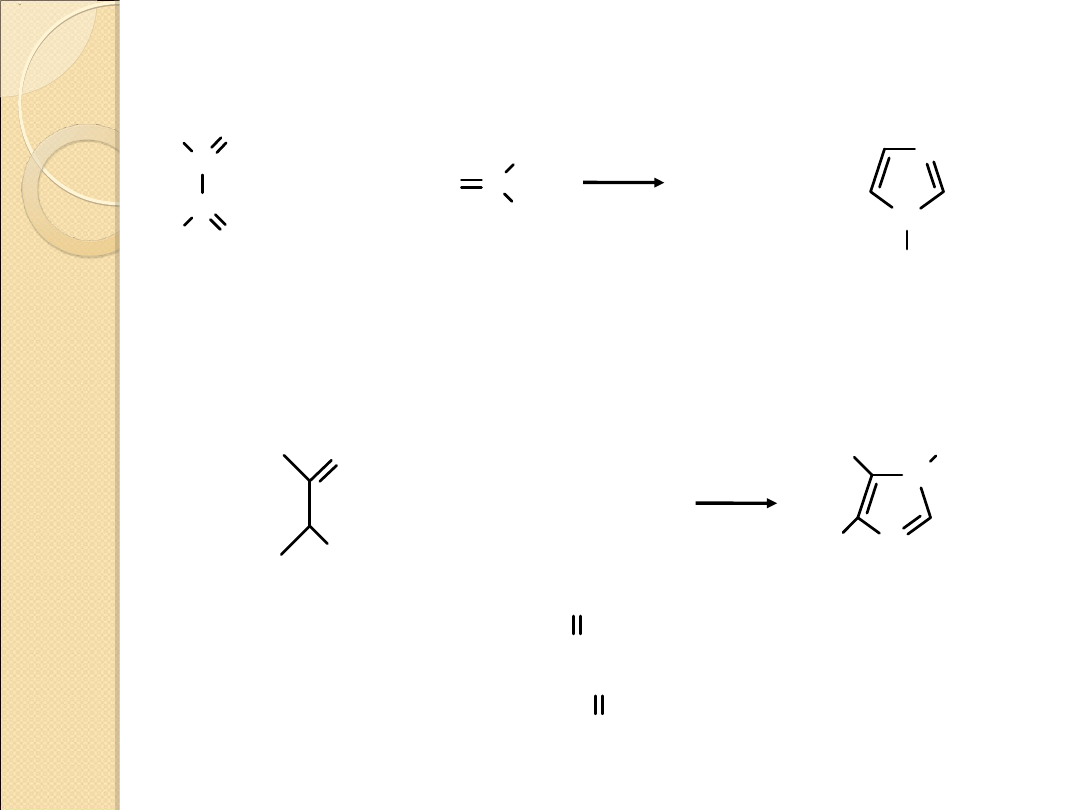
IMIDAZOL – OTRZYMYWANIE I REAKCJE
C
C
H
H
O
O
NH
3
NH
3
O C
H
H
3 H
2
O
N
N
H
1
2
3
4
5
+
+
+
pKa = 6.98
(bardziej
zasadowy od
pirydyny)
R
1
R
2
X
O
MeCONH
2
HCONH
2
RCNH
2
NH
ROCR
NH
N
N
H
R
1
R
2
+
lub
40 – 90%
X = Cl, NH
2
OH, =O
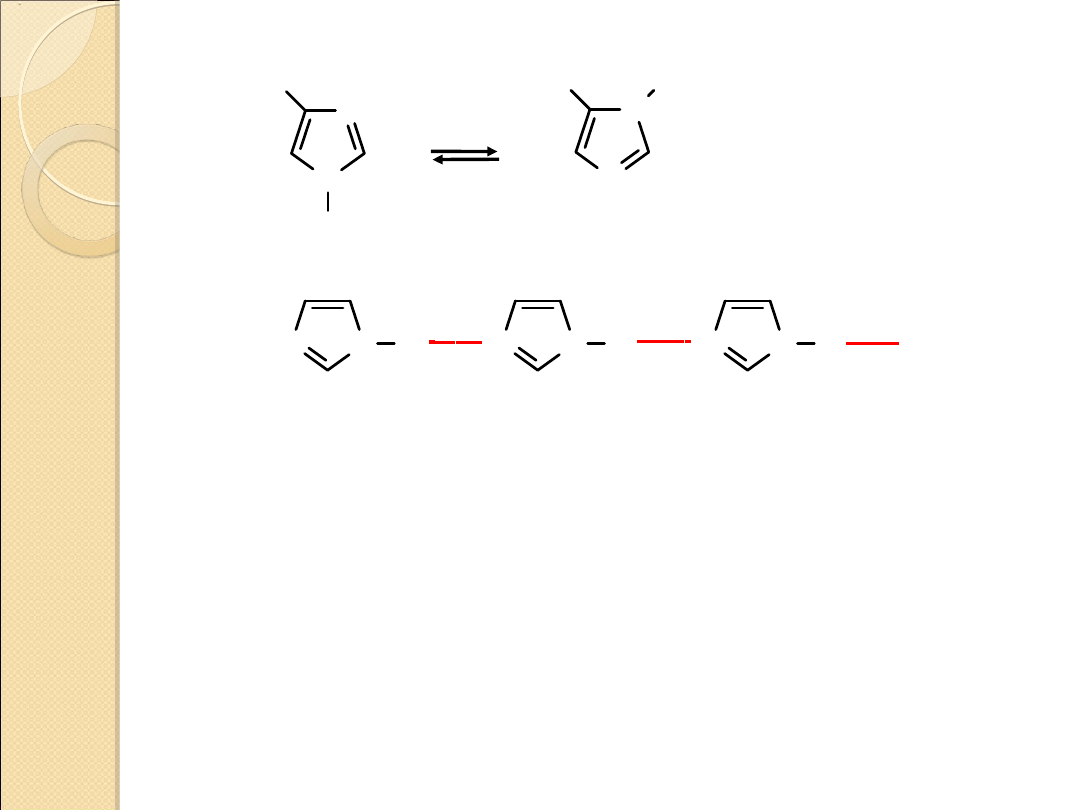
N
N
H
R
N
N
H
R
Tautomeria
N
N H
N
N H
N
N H
Tworzenie wiązań wodorowych
Reakcje substytucji elektrofilowej zachodzą w 1,3–diazolach
łatwiej niż w pirydynie ale trudniej niż w benzenie. Podstawnik
kierowany jest w położenie 5.
Reaktywność maleje ze wzrostem elektroujemności
heteroatomu:
imidazol > tiazol > oksazol
ZWIĄZKI O DZIAŁANIU BIOLOGICZNYM
ZAWIERAJĄCE PIERŚCIEŃ IMIDAZOLOWY
HN
N
CH
2
CHCOOH
NH
2
aminokwas białkowy
histydyna
R
2
C
OR
1
O
N
NH
N
NH
C
OR
1
R
2
O
N
N
CO
R
2
– OR
1
–
– H
+
N
N
CO
R
2
N
NH
R
2
COOH
+
H
2
O
O
R
2
N
N
H
H
R
2
O
C
O
R
1
O
H
H
..
..
N
NH
..
– R
1
COOH
+
N
N
H
OH
R
2
+
N
N
H
CH
2
CH COOH
NH
2
CO
2
N
N
H
CH
2
CH
2
NH
2
+
histydyna
histamina
CH
3
NHCNHCH
2
CH
2
SCH
2
NH
N
N
H
CH
3
cymetydyna
(lek przeciw chorobie
wrzodowej)
POCHODNE IMIDAZOLU O DZIAŁANIU BIOLOGICZNYM
NH
N
CH
2
N
C
6
H
5
CH
2
C
6
H
5
O
C
H
H
C
2
H
5
O
N
N
CH
3
S
N
N
H
H
O
CH
2
CH
2
CH
2
CH
2
COOH
NH
N
H
O
O
2–benzylofenyloaminometylo–
imidazolina (antazolina)
lek blokujący uwalnianie histaminy
pilokarpina
alkaloid z liści krzewu
(Pilokarpus jaborandi)
biotyna (witamina
H)
hydantoina
Powstaje w reakcji α–aminokwasów i
ich estrów z mocznikiem
Układ hydantoiny występuje w lekach
przeciwpadaczkowych
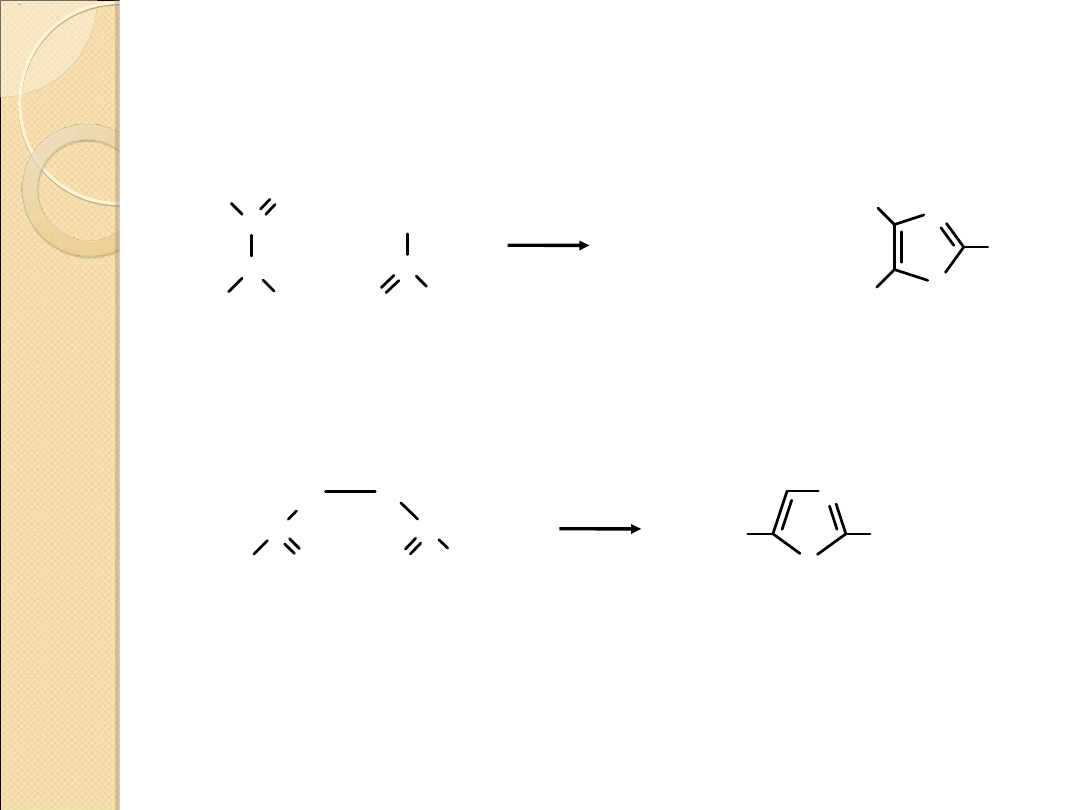
PIRAZOL – OTRZYMYWANIE I WŁAŚCIWOŚCI
CH
CH
N
H
2
C
N
N
N
H
H
2
C C
HC
N
NH
2
H
O
+
– H
2
O
Me
Me
O
O
N
N
Me
H
Me
+
NH
2
NH
2
H
2
SO
4
·
NaOH, H
2
O
15
o
C
77%
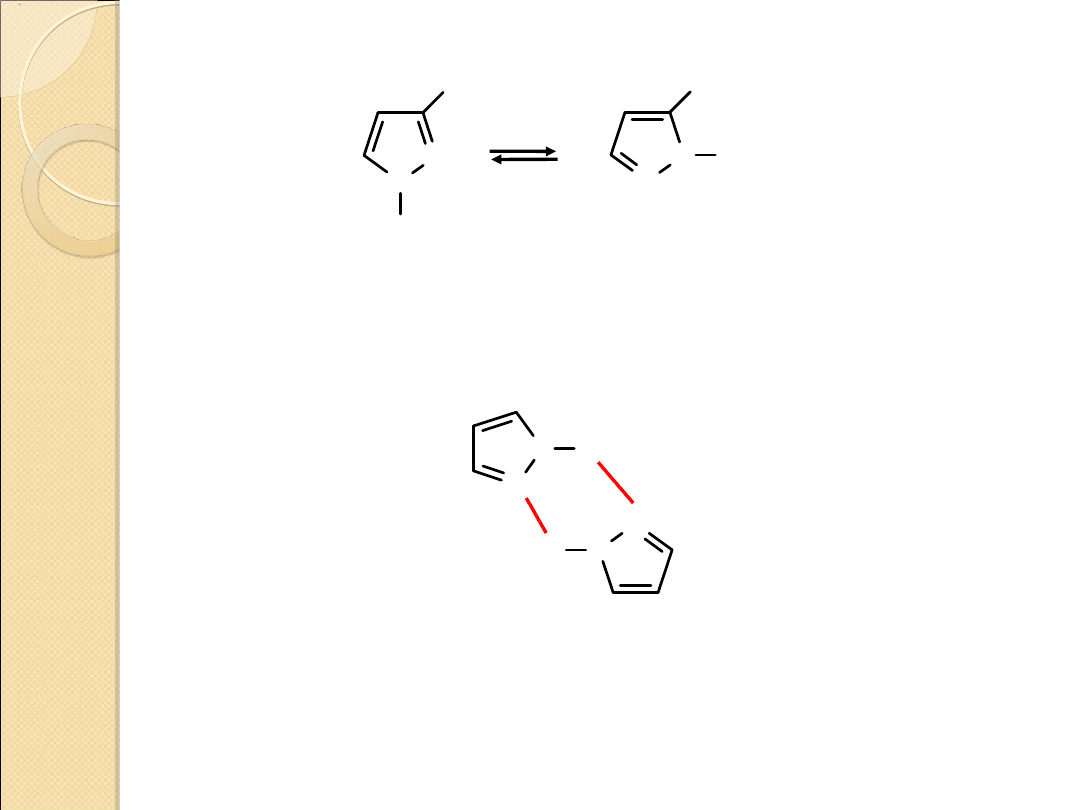
1,2–azole są słabszymi zasadami od 1,3–azoli tzn. że
pirazol jest słabszą zasadą niż imidazol
pKa = 2.52
N
N
H
R
N
N H
R
Tautomeria
N
N H
N
N
H
Tworzenie wiązań wodorowych

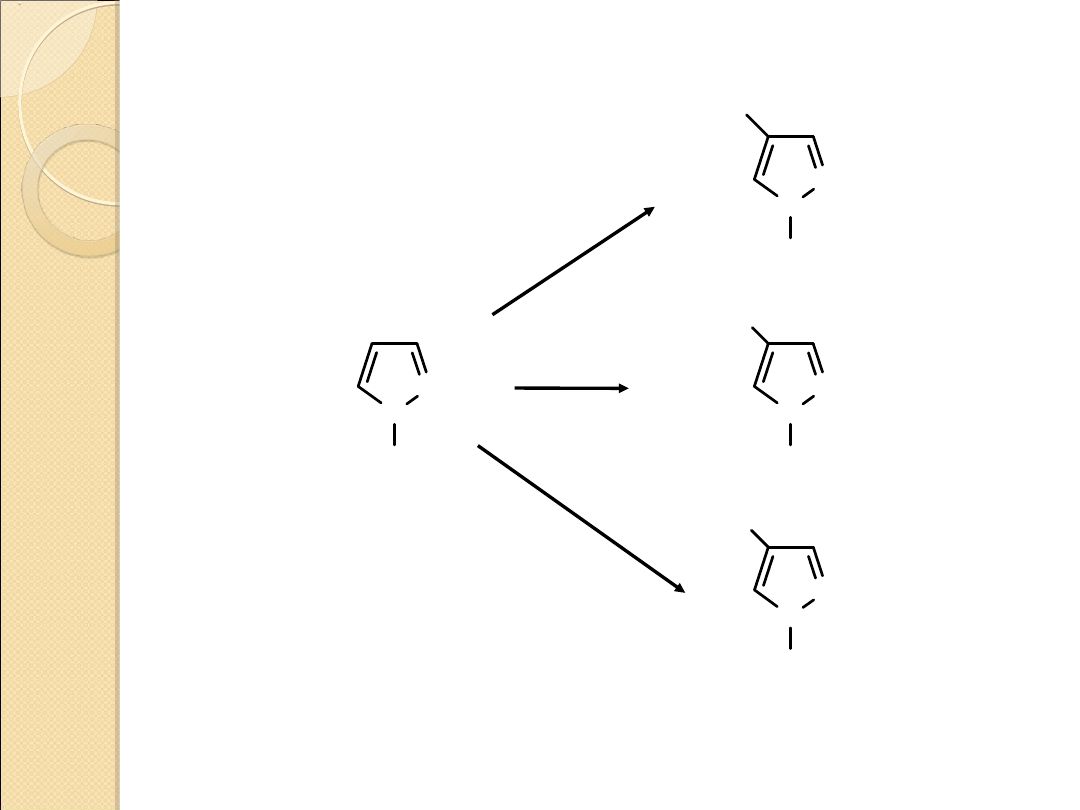
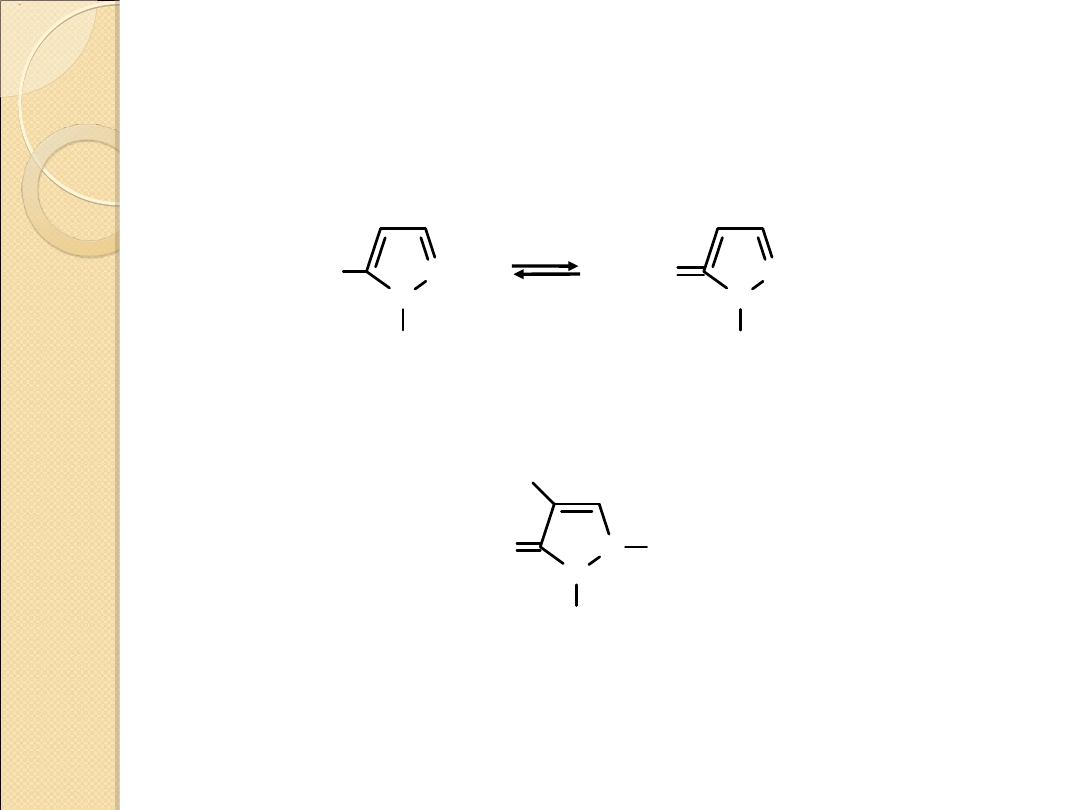
REAKCJA SUBSTYTUCJI ELEKTROFILOWEJ PIRAZOLU
Reakcje substytucji elektrofilowej zachodzą w 1,2–diazolach
(podobnie jak w przypadku 1,3–diazoli) dość trudno i wymagają
silnych elektrofili
Podstawnik kierowany jest w położenie 4.
Reaktywność maleje ze wzrostem elektroujemności
heteroatomu:
pirazol > izotiazol > izooksazol
N
N
H
N
N
H
Cl
N
N
H
O
2
N
N
N
H
HO
3
S
Cl
2
HNO
3
H
2
SO
4
POCHODNE PIRAZOLU O DZIAŁANIU LECZNICZYM
(PRZECIWBÓLOWYM I PRZECIWGORĄCZKOWYM)
ZAWIERAJĄCE UKŁAD 5–PIRAZOLONU
N
N
H
HO
N
N
H
O
5–hydroksypirazol
5–pirazolon
N
N
C
6
H
5
O
CH
3
(CH
3
)
2
N
aminofenazon
OTRZYMYWANIE POCHODNYCH TIAZOLU
C
CH
R
O
R
Cl
C
S
NH
2
R
S
N
R
R
R
H
2
O
HCl
+
+
+
H
2
C
C
O
R
NH
C
O
R'
N
S
R
R'
P
2
S
3
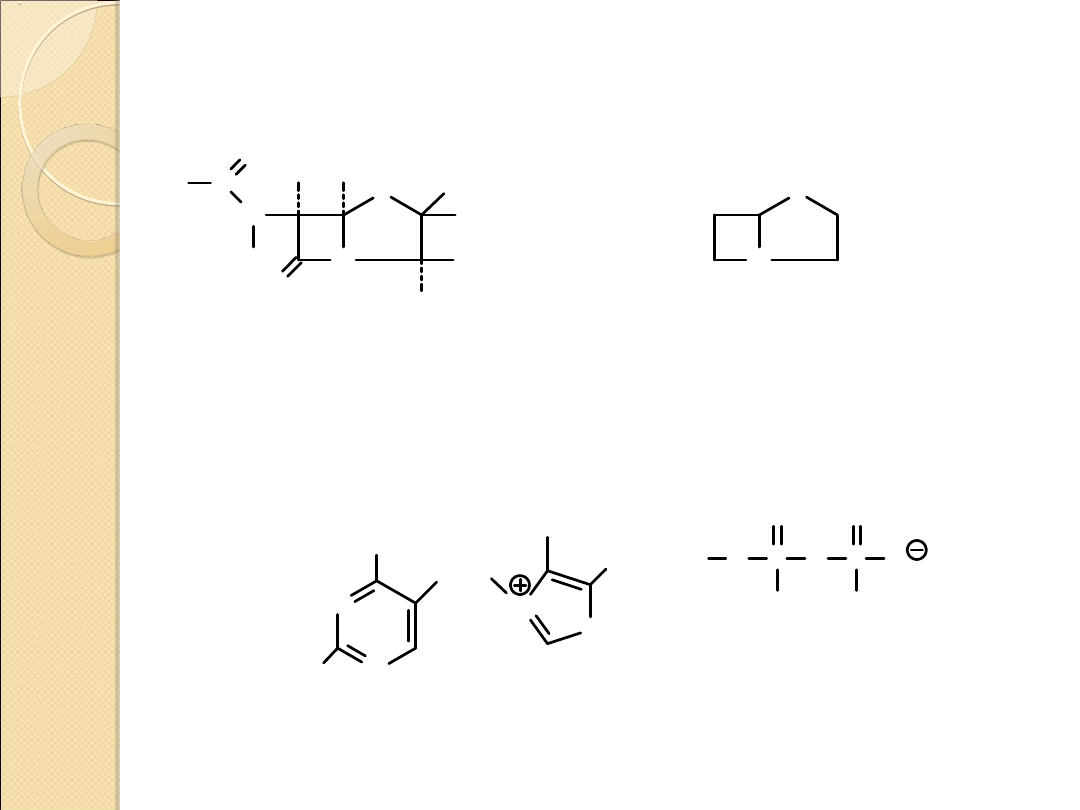
S
N
CH
3
CH
2
CH
2
O P O P O
OH OH
O
O
CH
2
N
N
NH
2
H
2
N
2
1
POCHODNE TIAZOLIDYNY I TIAZOLU WYKAZUJĄCE
WAŻNE DZIAŁANIE BIOLOGICZNE
N
S
O
N
H
C
R
O
H
COOH
CH
3
CH
3
H
H
N
S
7
6
5
4
3
2
1
penicylina
numeracja podstawowego
szkieletu
pierścień tiazolidyny
skondensowany z układem
β–laktamu
pirofosforan tiaminy (TPP) –
koenzym
tiamina – witamina B
1
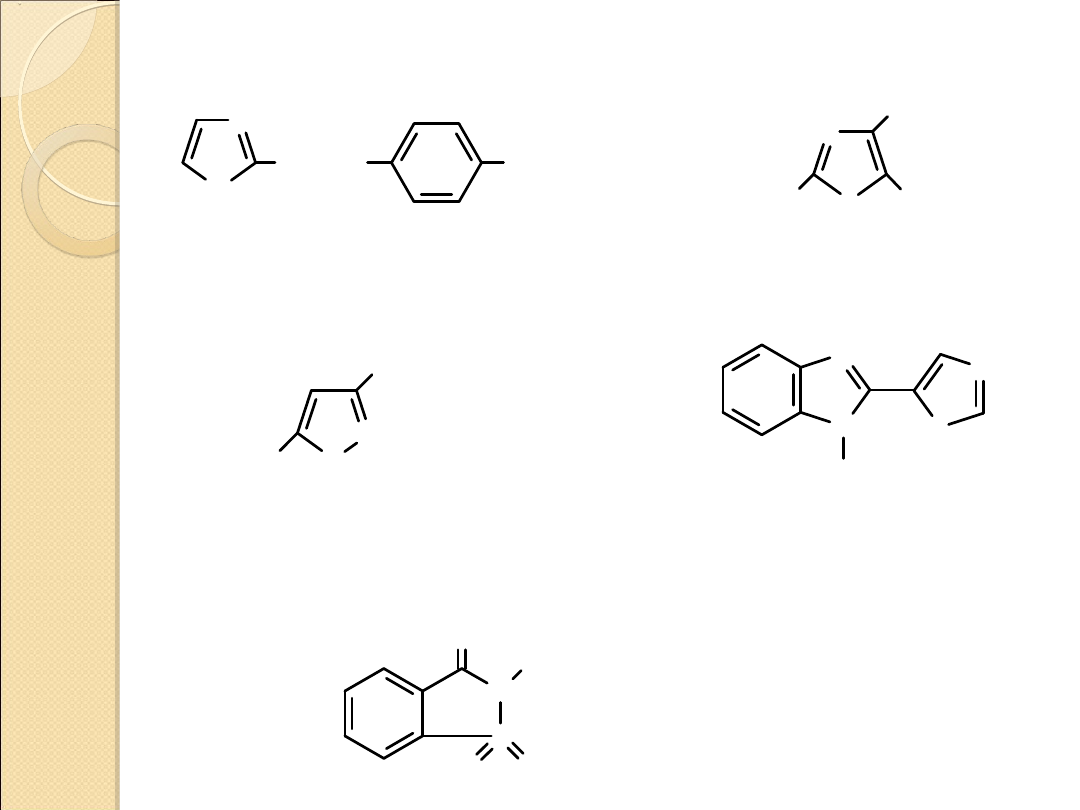
INNE POCHODNE AZOLI O DZIAŁANIU BIOLOGICZNYM
N
N
NHSO
2
NH
2
N
S
NH
2
Ph
H
2
N
sulfamid
2–sulfanilamidotiazol –
lek z
grupy sulfamidów
aminophenazol
2,4–diaminofenylotiazol
stosowany przy zatruciu
morfiną
O
N
Me
CONHNHBz
N
N
H
N
S
2– (4–tiazolilo)benzimidazol
thiabendazol
lek przeciwgrzybiczny
benzylohydrazyd kwasu
5–metylo–3–
izoksalilokarboksylowego
izokarboxazid – lek antydepresyjny
S
N
O
H
O
O
sacharyna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Homo i heteroglikany 2012 2013
ANOMALIE HETEROCHROMOSOMÓW
Związki heterocykliczne, Chemia
Lekcja 7 ?presja inbredowa i heterozja
heteroazeotrop
Cząsteczki heterojądrowe
modelowanie DFT w katalizie heterogenicznej
20 ODŻYWIANIE HETEROTROFICZNE ORGANIZMÓW
I heterofobi dla stud pedag, Kulturoznawstwo, III rok, Etyka
Kinetyka reakcji heterogenicznych
Mikrobiologia, - na dł, LPS = endotoksyna: lipopolisacharydy inaczej heteropolimery złożone z trzech
HETEROCYKLE
Stereotyp jezykowy - heterostereotypy, Językoznawstwo
heterocykle zinczenko, Pytania z zeszłego roku od Zinczenko:
1 heterocykle
zwiazki heterocykliczne
Dealing with large heterogeneous classes
więcej podobnych podstron