
Choroby tarczycy u kobiety ciężarnej
Praca specjalizacyjna z zakresu farmacji klinicznej
mgr farm. Magdalena Łapiak
Opiekun specjalizacji : dr n. farm. Katarzyna Oporowska - Moszyk
Poznań 2013

Organizm człowieka to najdoskonalsza ''maszyna'' na Ziemi. Składa się z wielu narządów
działających jak skomplikowany mechanizm. Na pracę narządów wpływają : tryb życia, stosowane
używki, rodzaj spożywanego pokarmu. Bardzo ważne miejsce zajmuje gospodarka hormonalna.
Hormony zapewniają homeostazę w organizmie. Wytwarzane są przez gruczoły endokrynne, w tym
dokrewne. Gruczoł tarczowy powstaje z endodermy i jest najwcześniej rozwijającym się narządem
dokrewnym - początek około 16-17 dnia życia płodowego. Około 10 tygodnia tarczyca płodu
wychwytuje już jod i rozpoczyna produkcję tyreoglobuliny. Dojrzałość wydzielniczą uzyskuje
około 11 tygodnia życia płodowego (1). Tarczyca (glandula thyroidea) umiejscowiona jest u
człowieka w dolnej części szyi na wysokości 2/3 chrząstki tchawicy. Zbudowana jest z tkanki o
budowie drobnopłacikowej podzielonej tkanką łączną. Składa się z pęcherzyków, które wypełnione
są koloidem. Jego głównym składnikiem jest białko glikoproteinowe - tyreoglobulina. Gruczoł ten
jest bardzo unaczyniony. Syntetyzowane w jego obrębie hormony są rozprowadzane przez sieć
naczyń krwionośnych i częściowo chłonnych (2). Głównymi hormonami tarczycowymi są
tyroksyna T
4
i trójjodotyronina T
3
. Tyroksyna wytwarzana jest z aminokwasu tyrozyny, natomiast
trójjodotyronina powstaje przez odjodowanie tyroksyny pod wpływem dejodynazy jodotyroninowej
na poziomie tkankowym i magazynowana jest w postaci tyreoglobuliny. W niewielkim stopniu
₃
powstaje także rT – odwrócona trójjodotyronina, która wykazuje bardzo słabe działanie
metaboliczne. Właściwym, aktywnym metabolicznie hormonem jest T
3
. Jego rola polega na :
· wzmożone wytwarzanie pompy Na
+
/K
+
ATP-zależnej i enzymów mitochondrialnych (biorących
udział w metabolizmie węglowodanów i tłuszczów),
· nasila przemiany energetyczne - zwiększa zużycie tlenu i tworzenie ciepła w całym
organizmie (z wyjątkiem mózgu),
· nasila glikogenolizę i glukoneogenezę w wątrobie,
· zwiększenie liczby receptorów LDL w błonie komórkowej hepatocytów oraz gęstości
receptorów β
1
w sercu,
· działa anabolicznie (w wyższych stężeniach katabolicznie),
· wzmaga lipolizę w osoczu, a w tkance tłuszczowej i wątrobie pobudza lipogenezę,
· warunkuje prawidłowy wzrost na długość organizmu, a także prawidłowy rozwój zawiązków
narządów i dojrzewanie organów wewnętrznych, głównie tkanki kostnej i mózgu,
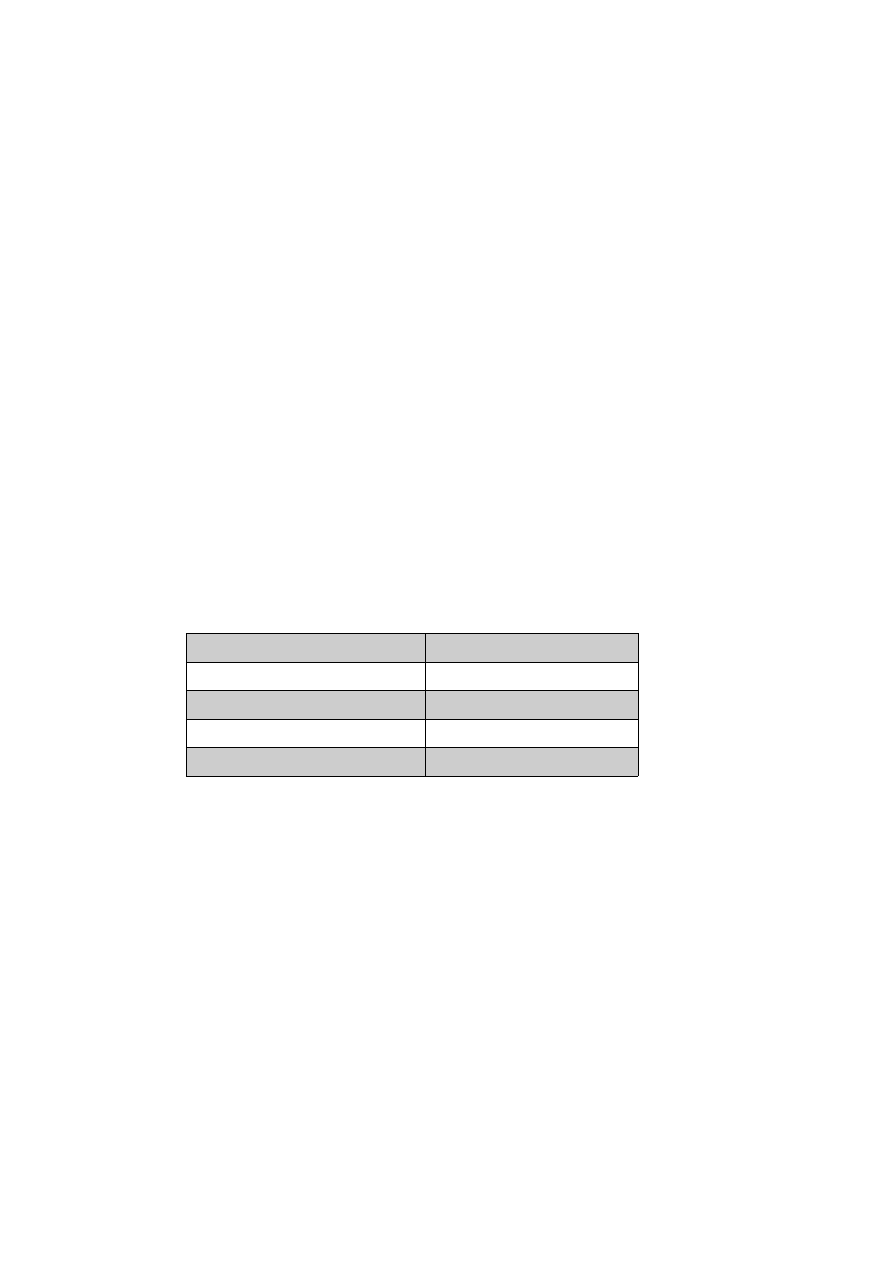
· pobudza rozwój mózgowia poprzez stymulację mielinizacji i tworzenie dendrytów.
₄
₃
Dziennie tarczyca wydziela ok. 90 mikrogramów T i 8 mikrogramów T . Krążąca we
krwi tyroksyna jest prawie całkowicie związana z białkami. Jedynie 0,05% występuje w postaci
₄
wolnej. Ok. 60% T wiąże się z globuliną wiążącą tyroksynę (TBG) i 30% z prealbuminą
₃
wiążącą tyroksynę (TBPA) oraz ok. 10% z albuminami. Ilość wolnej T wynosi 0,5% . Okres
półtrwania tyroksyny w osoczu wynosi ok. 7 dni, natomiast trijodotyroniny tylko 1-2 dni (3).
Ponadto w tarczycy znajdują się komórki C , które produkują hormon kalcytoninę.
Wydzielanie hormonów tarczycy jest regulowane przez układ podwzgórze-przysadka: w zależności
od stężenia hormonów tarczycy w osoczu wydzielany jest w odpowiedniej ilości TRH
(tyreoliberyna), a pod jego wpływem jest wydzielana tyreotropina. TSH pobudza tarczycę do
₄
₃
uwalniania do krwi T oraz w mniejszym stopniu T , które zwrotnie wpływają na przysadkę i
podwzgórze na zasadzie ujemnego sprzężenia.
Prawidłowe stężenia hormonów (2)
Tyroksyna T₄
4,2-11,6 ug/100ml
Wolna tyroksyna fT₄
0,8-1,7 ng/100ml
Trójjodotyronina T₃
85-190 ng/100ml
Wolna trójodotyronina fT₃
2,23-0,6 ng/100ml
Tyreotropina TSH
0,3-5,0 mU/l
Tarczyca jest niewielkim gruczołem. Jej waga waha się od 30 do 60 gramów. U kobiet
zmienia się wraz z cyklem miesiączkowym. Może się powiększać w czasie ciąży (2). Starożytni
Egipcjanie zwykli oceniać, czy kobieta jest ciężarna, czy nie, wiążąc jej wokół szyi trzcinę. Jeśli po
kilku tygodniach trzcina pękała, była to pewna oznaka ciąży. Zmiany te są następstwem
zwiększonego zapotrzebowania kobiety ciężarnej na jodki, zwiększonego klirensu nerkowego
jodków i produkcji hormonów tarczycy, a także działania tarczycy płodu i łożyskowego czynnika
tyreotropowego (1).
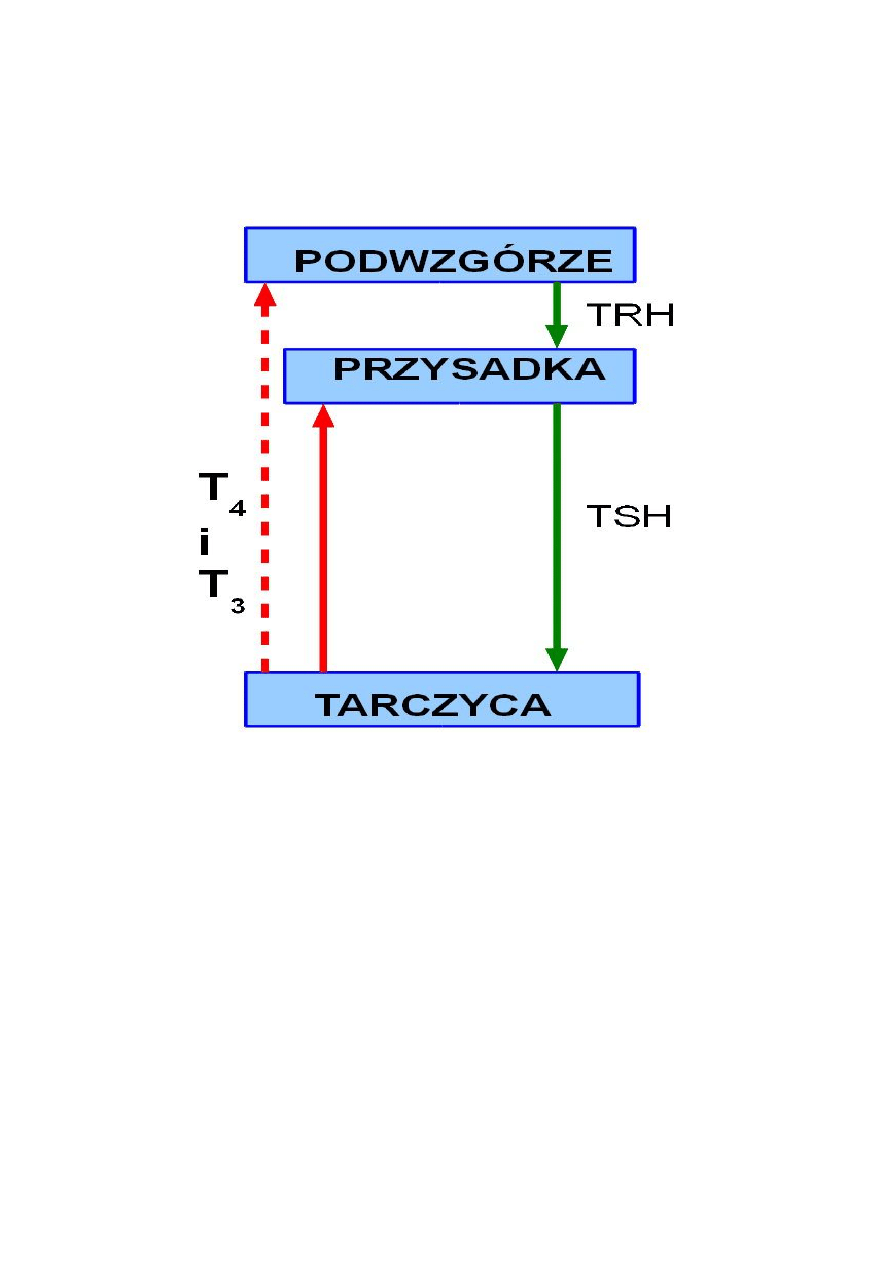
Schemat osi podwzgórze-przysadka-tarczyca
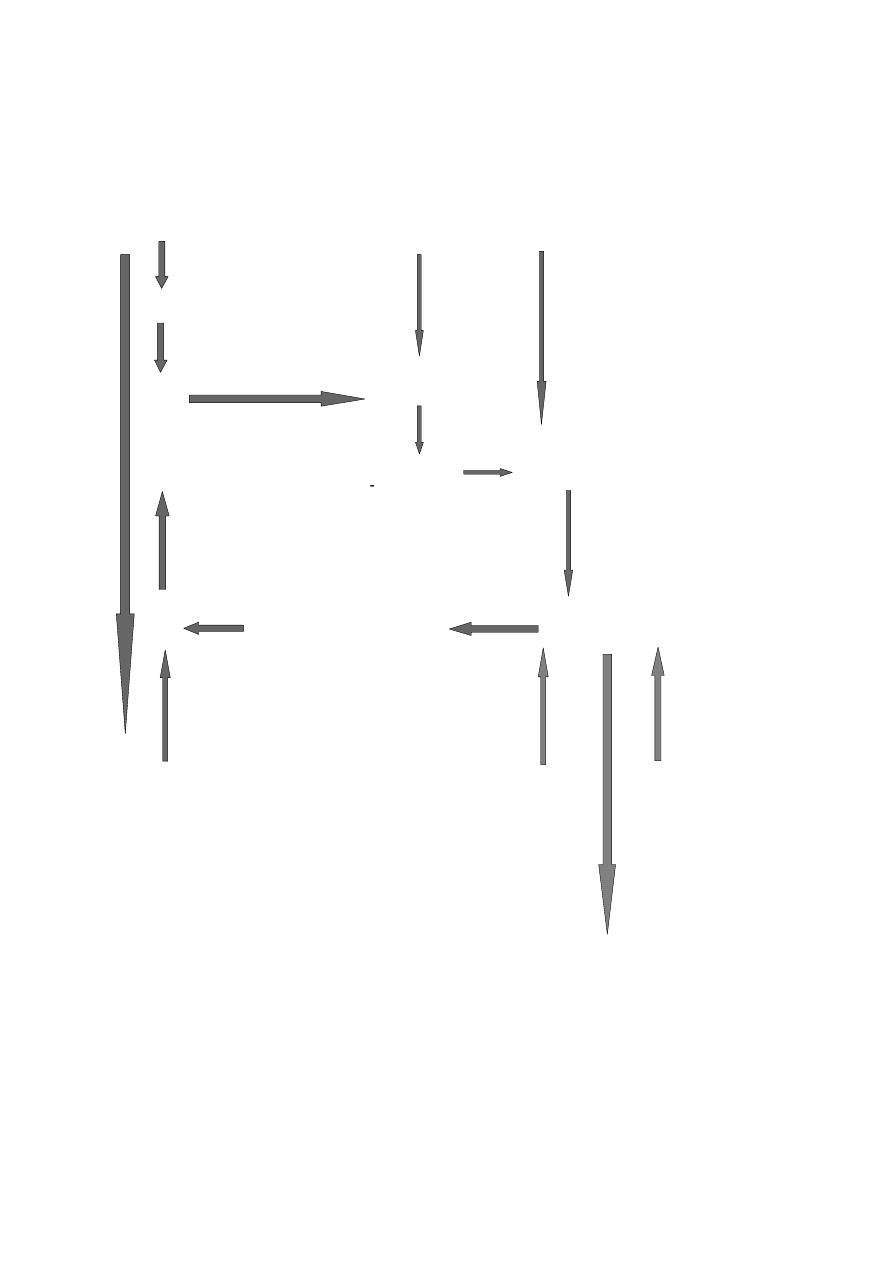
Zmiany w czynności tarczycy kobiet ciężarnych (4)
↑ estrogenów
obecność hCG i hCT we krwi ciężarnej
↑TBG
(-)
↓FT4
(+)
przysadka
→TT₄
→TT₃
↑ TSH*
rozrost tarczycy ↑ HT
↑rT₃
↑ aktywności dejodazy ↓stężenia jodu
↑ aktywności dejodynazy III ↑wychwytu jodu ↑klirensu nerkowego
przez łożysko
↑zapotrzebowania na jod
*
w I trymestrze ciąży czynniki wpływające hamująco na wydzielanie TSH przeważają nad czynnikami pobudzającymi
– TSH jest w supresji.

FIZJOLOGICZNA CZYNNOŚĆ TARCZYCY PODCZAS CIĄŻY
Zmiany występujące u kobiety po implantacji blastocysty zapewniają stan eutyreozy
zarówno u matki, jak i u płodu. Funkcja tarczycy adaptuje się do wzmożonego zapotrzebowania na
jod i energię, rośnie klirens nerkowy jodu, wzrasta produkcja hormonów tarczycy (HT) oraz
wychwyt jodu przez łożysko (4). W surowicy ciężarnych rośnie stężenie globuliny wiążącej
tyroksynę – TBG, głównego białka odpowiedzialnego za transport hormonów tarczycy. Jest to
wynik zwiększonej produkcji TBG przez wątrobę w następstwie hiperestrogenizacji oraz
zwolnionego klirensu tego białka. Prowadzi to do zwiększonej syntezy hormonów tarczycy o 25-
50% oraz wzrostu stężenia całkowitych hormonów tarczycy (TT
₄
₃
i TT ) w surowicy.
Jednym z istotnych czynników wpływających na czynność tarczycy kobiety ciężarnej jest ludzka
gonadotropina kosmówkowa (hCG) produkowana przez łożysko. Podjednostka β w TSH i hCG
wykazuje bardzo duże podobieństwo. Dlatego też, szczególnie w I trymestrze ciąży, znaczny wzrost
stężenia hCG pomimo jej niewielkiego powinowactwa do receptora TSH, pobudza tarczycę (13).
Wykazuje ona aktywność tyreotropową (hCT) – ok. 0,02% aktywności TSH. Wzrasta hCT, a spada
₄
wydzielanie TSH, przy jednoczesnym wzroście stężenia wolnej tyroksyny FT . Pod wpływem hCT
tarczyca rozrasta się, zwiększa się jej ukrwienie i wychwyt jodu (4). W I trymestrze ciąży jest
₄
wysoki poziom hCG, z kolei w II i III trymestrze poziom się obniża – obniża się również FT .
Istotnym czynnikiem jest także zmieniony metabolizm jodu w wyniku zwiększonej syntezy
hormonów tarczycy, klirensu nerkowego oraz przechodzenia jodków i jodotyronin przez łożysko do
płodu. Prowadzi to do spadku stężenia jodu w surowicy i zwiększonej jodochwytności (4).
Obserwuje się wysoką aktywność dejodazy typu III, co powoduje odjodowanie tyroksyny do
₃
nieaktywnej odwrotnej trijodotyroniny rT i jej wzrost stężenia w surowicy.
Pod wpływem czynników wydzielanych przez łożysko następują przejściowe zmiany
immunologiczne, dzięki czemu odpowiedź immunologiczna matki jest obniżona. Zapobiega to
reakcji odrzucenia płodu oraz przyczynia się do złagodzenia objawów chorób o podłożu
immunologicznym (5,6).
Łożysko jest narządem biorącym udział w transporcie i metabolizmie hormonów tarczycy oraz
substancji wpływających na rozwój i czynność tarczycy w okresie płodowym. Jod przenika przez
łożysko i jest wykorzystywany w tarczycy płodowej do syntezy jodotyronin. Z krążenia
matczynego jod jest intensywnie wychwytywany przez łożysko i płód. W stanach niedoboru jodu
dochodzi do hipotyroksynemii i rozwoju wola u kobiety, a duży deficyt jodu prowadzi do
uszkodzenia mózgu i powstania hipotyreozy u płodu. Matczyne hormony tarczycy przechodzą
przez łożysko w ilościach zapewniających prawidłowy rozwój płodu, zwłaszcza w I trymestrze
ciąży. W II i III trymestrze płód jest zaopatrzony w hormony pochodzące z własnego gruczołu.
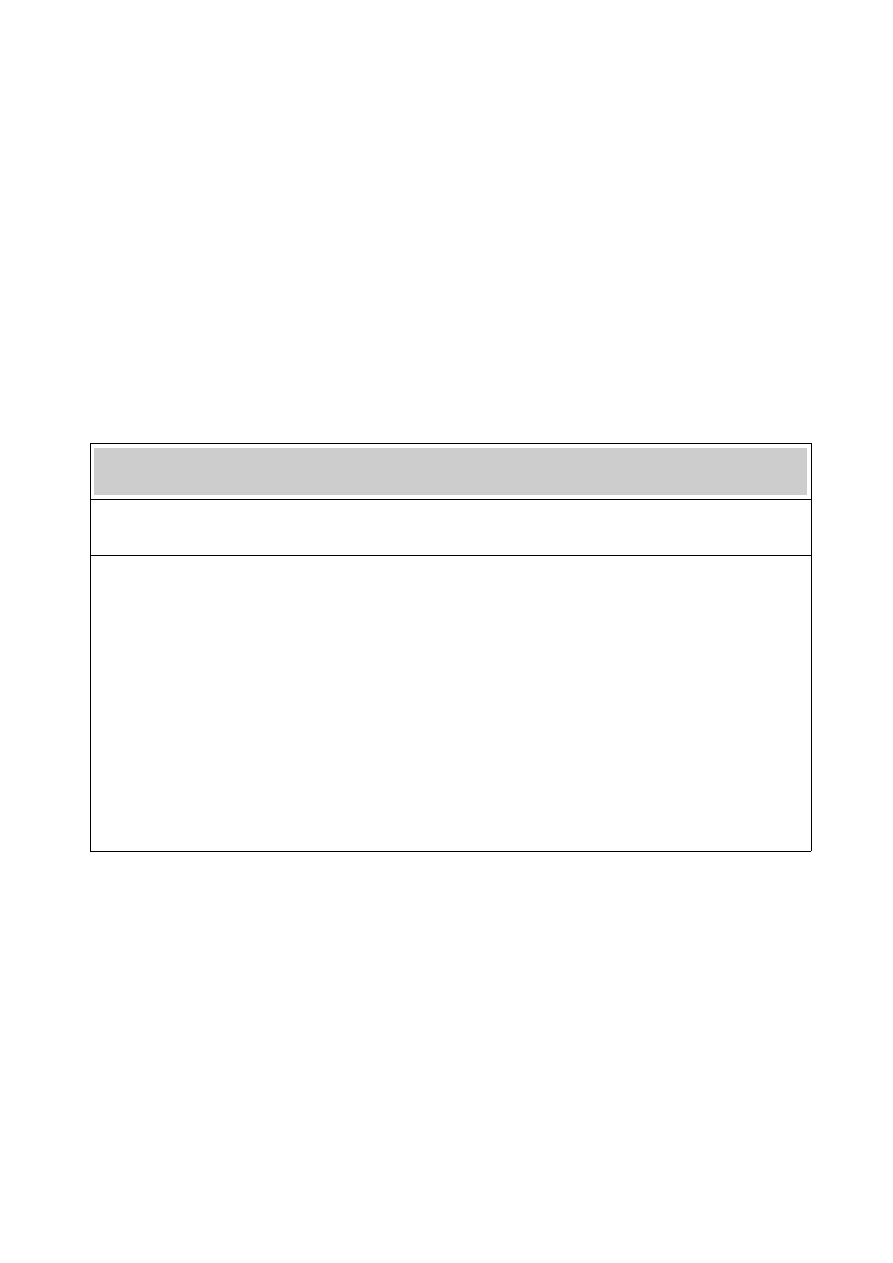
Łożysko jest nieprzepuszczalne dla TSH, natomiast TRH przenika całkowicie do krążenia płodu,
jednak nie odgrywa żadnej roli w stymulacji tarczycy u płodu (7).
Ciąża jest zatem stanem nadmiernego stymulowania tarczycy, wzrostu zapotrzebowania na
tyroksynę i wzmożonego jej metabolizmu. Właściwa ocena stanu klinicznego kobiety i
rozwijającego się płodu w powiązaniu z odpowiednią interpretacją badań laboratoryjnych ma
zasadnicze znaczenie w postępowaniu leczniczym u ciężarnych z chorobami tarczycy. Wiele zmian
fizjologicznych, zachodzących w przebiegu ciąży może maskować objawy dysfunkcji tego
gruczołu (8). Oznaczanie hormonów wolnych ma największą wartość diagnostyczną.
Zmiany fizjologiczne zachodzące podczas ciąży, wpływające na wyniki badań czynności
tarczycy (9)
Zmiana fizjologiczna Wpływ na wynik
badania
↑
stężenia globuliny wiążącej hormony tarczycy ↑stężenia całkowitej T₄ i T₃
w surowicy
↑stężenia hCG w I trymestrze ciąży ↑stężenia wolnej T₄ i ↓
stężenia TSH
↑objętości osocza ↑puli T₄ i T₃
↑stężenia 5-dejodynazy typu III spowodowane ↑degradacji T₄ i T₃ (wymóg
zwiększonej
zwiększoną masą łożyska produkcji hormonów)
powiększenie tarczycy (u części pacjentek) ↑stężenia tyreoglobuliny w
osoczu
↑klirensu jodyny ↓wytwarzanie hormonów
na terenach
ubogich w jod
Zjawiska te nie mają istotnego znaczenia klinicznego, jeśli ciąża rozwija się w warunkach
wystarczającej podaży jodu w diecie (200 μg/dobę lub więcej). W środowisku ubogim w jod,
takim jak Polska (poniżej 100 μg/dobę), ciąża nasila niedobory jodu i wywiera wyraźny efekt
wolotwórczy (11).

PROFILAKTYKA JODOWA W CZASIE CIĄŻY
W Polsce od wielu lat systematycznie maleje liczba porodów. Szukając przyczyn tych
niekorzystnych zjawisk demograficznych należy wziąć pod uwagę także czynniki zdrowotne, a
wśród nich wpływ zaburzeń tarczycy na płodność, przebieg ciąży i zdrowie dziecka. Także
obecność przeciwciał przeciwtarczycowych u kobiet bez zaburzeń funkcji tarczycy mogą być
czynnikami ryzyka niepłodności, poronień, a także patologii stwierdzanych u dzieci (12).
Przyjmuje się, że głównym czynnikiem patogennym odpowiedzialnym za rozpowszechnienie
schorzeń tarczycy na Ziemi jest niedobór jodu w środowisku zewnętrznym, a przez to jego
niedobór w pożywieniu. Niedobór jodu dotyczy 50 proc. całej populacji europejskiej, w tym kobiet
w wieku rozrodczym i ciężarnych. Polska, podobnie jak większość obszarów lądowych planety, to
obszar znacznego lub granicznego niedoboru jodu. W 1935 r. wprowadzono – jako w jednym z
pierwszych krajów Europy- jodowanie soli kuchennej, co już w ciągu dwóch lat dało efekt –
zmniejszyło się rozpowszechnienie wola (12). W latach II wojny światowej i w latach 1980-1986
zaprzestawano jodowania soli kuchennej. Obserwowano szybki wzrost liczby nowych przypadków
wola. Mimo wprowadzenia w 1997 roku w Polsce profilaktyki jodowej, której podstawą jest
jodowanie soli kuchennej, dzienne spożycie tego mikroelementu jest niedostateczne, aby pokryć
zwiększone zapotrzebowanie w okresie ciąży i karmienia. U kobiety ciężarnej z niedostatecznym
dziennym spożyciem jodu dochodzi do :
–
ograniczenia dobowej utraty jodu z moczem,
–
stopniowego wyczerpywania uprzednio już zubożonych tarczycowych zapasów jodu,
–
wystąpienia względnej tyroksynemii,
–
wzrost stężenia TSH (działanie mechanizmów sprzężenia zwrotnego),
–
powiększenie się tarczycy i powstawanie wola.
Mały i umiarkowany niedobór jodu wiąże się z zaburzeniami rozwoju psychomotorycznego oraz z
zespołem nadaktywności ruchowej z zaburzeniami uwagi (ADHD) u dziecka. Ciężki niedobór
jodu, występujący w niektórych krajach rozwijających się, powoduje rozwój kretynizmu. WHO
rekomenduje dzienne spożycie jodu dla karmiących i ciężarnych 250ug/d. Taką ilość jodu zapewnia
dzienne spożycie soli kuchennej plus suplementacja 150-200 ug jodu w preparatach
wielowitaminowych zawierających KJ (13).

HORMONY TARCZYCY W OKRESIE PŁODOWYM
W okresie życia płodowego od działania hormonów tarczycy zależy prawidłowy rozwój
mózgu, móżdżku, kości i zawiązków zębów. Są one potrzebne dla migracji, podziałów i
dojrzewania komórek układu nerwowego. W komórkach mózgu u płodu wykazano aktywność
₃
dejodynaz już we wczesnym okresie ciąży. Przekształcają one tyroksynę do T . Ten proces
warunkuje prawidłowy przebieg rozwoju kory mózgowej. W drugiej połowie ciąży aktywność
dejodynaz w komórkach nerwowych u płodu osiąga poziom dorosłego (14).
Niedobór hormonów tarczycy u płodu prowadzi do trwałego uszkodzenia mózgu, a w
konsekwencji do upośledzenia rozwoju psychoruchowego, deficytów intelektualnych, trudności w
nauce szkolnej.
ZABURZENIA CZYNNOŚCI TARCZYCY U CIĘŻARNYCH
Powszechnie wiadomo, że kobiety chorują co najmniej 3 razy częściej na choroby tarczycy
niż mężczyźni. Współistnienie chorób tarczycy w ciąży jest więc dość częstym zjawiskiem w
praktyce położniczej.
NADCZYNNOŚĆ TARCZYCY
Tyreotoksykoza w ciąży występuje nawet u 0,2% kobiet (12). 90% przypadków
nadczynności wynika wtórnie z choroby Gravesa-Basedowa, w mniejszym procencie z zapalenia
tarczycy o podłożu autoimmunologicznym czy z wola guzowatego oraz pojedynczych gruczolaków
gruczołu tarczowego. Czasem przyczyną nadczynności tarczycy w ciąży jest przebyte zapalenie
gruczołu lub niepowściągliwe wymioty ciężarnych.
Rozpoznanie jest utrudnione, ponieważ część objawów nadczynności towarzyszy ciąży w
warunkach fizjologicznych. Jeżeli to powikłanie wystąpiło po raz pierwszy w ciąży, to objawy są

zauważalne. Należą do nich:
–
przyspieszenie czynności serca matki oraz płodu (powyżej 100 uderzeń/min),
–
drobnofaliste drżenie rąk,
–
zwiększona pobudliwość nerwowa,
–
osłabienie siły mięśniowej,
–
nadmierna potliwość,
–
znużenie,
–
zła tolerancja ciepła,
–
brak przyrostu masy ciała pomimo prawidłowego wzrostu macicy i rozwoju płodu,
–
objawy oczne i skórne (wytrzeszcz gałek ocznych, obrzęk przedgoleniowy, lokalne
scieńczenie skóry),
–
towarzyszyć mogą wymioty, biegunka, limfadenopatia.
Rozpoznanie laboratoryjne nadczynności tarczycy u ciężarnych opiera się na oznaczeniu
hormonów wolnych (fT4 i fT3). Nadczynność może mieć niekorzystny wpływ na przebieg ciąży
(porody przedwczesne 11-25%, niższe masy urodzeniowe). Wzrasta też ryzyko tyreotoksykozy u
płodu i noworodka na skutek przenikania przez łożysko przeciwciał w chorobie Gravesa-
Basedowa. Najczęstszym powikłaniem nadczynności tarczycy w ciąży jest zwiększone ryzyko
rozwoju nadciśnienia indukowanego ciążą, stanu przedrzucawkowego , a nawet rzucawki
porodowej (10). Z chwilą rozpoznania nadczynności tarczycy należy podjąć decyzję o sposobie
leczenia.
Podstawowym postępowaniem w nadczynności podczas ciąży jest podawanie
tyreostatyków. Leczenie tyreostatykami rozpoczyna się od dawki 300-400 mg/dobę
propylotiouracylu (PTU), metylotiouracylu (MTU) lub 20-40 mg/dobę Metizolu. Zaletą metizolu,
której pozbawiony jest propylotiouracyl, jest stosunkowo długi okres biologicznego półtrwania, co
umożliwia podawanie go w jednej lub dwóch dawkach. Metizol pozostaje lekiem drugiego wyboru
w razie alergii, nietolerancji, lub złej odpowiedzi na propylotiouracyl. Z uwagi na niewielkie
wydzielanie do mleka, PTU jest powszechnie uważany za lek z wyboru u kobiet karmiących.
Poprawę leczenia obseruje się często już po 10 dniach, czasem na pełen efekt należy poczekać do 6
tyg. Zaleca się kontrolę fT3 i fT4, aby nie dopuścić do powstania hipotyreozy. Dawkę redukuje się
w czasie terapii, zalecając całkowite odstawienie tyreostatyków po 34 tyg. ciąży. Działania
niepożądane leków to: nudności, świąd skóry, wysypka skórna, zapalenie wątroby, agranulocytoza.

Kontrowersyjne pozostaje stosowanie beta- blokerów podczas ciąży. Propranolol jest dość
często zalecany w leczeniu nadczynności tarczycy u kobiet nieciężarnych, podczas ciąży może być
stosowany w ograniczonym zakresie (przełom tarczycowy, niedostateczny efekt leczniczy przy
stosowaniu tyreostatyków). Propranolol może powodować przedwczesną czynność skurczową,
łatwo przenika przez łożysko i może powodować bradykardię u płodu, hipoglikemię i depresje
układu oddechowego noworodka.
Leczenie preparatami jodu powinno ograniczyć się tylko do przygotowania
przedoperacyjnego. Jod łatwo przenika przez łożysko i może spowodować u płodu powstanie wola
i niedoczynność tarczycy. Zaleca się stosowanie małych dawek w krótkim okresie (ok. 10 dni).
Użycie jodu radioaktywnego jest w ciąży bezwzględnie przeciwwskazane. Przypadkowe użycie
jodu ¹³¹J po 10-12 tygodniu ciąży powodowało wystąpienie wrodzonej hipotyreozy, a nawet
kretynizmu u noworodka.
Leczenie chirurgiczne nadczynności tarczycy zasadniczo stosuje się dla przypadków, które
nie poddają się leczeniu farmakologicznemu,np. u kobiet uczulonych na tyreostatyki lub gdy
leczenie jest przeciwwskazane. Zaletą takiego leczenia jest uniknięcie bezpośredniego wpływu
leków na tarczycę płodu i duża skuteczność leczenia. Operację tyroidektomii powinno się
przeprowadzić w stanie eutyreozy, najlepiej w II trymestrze ciąży. W I lub III trymestrze występuje
ryzyko niedotlenienia płodu oraz ryzyko poronienia (10).
Leki stosowane w leczeniu nadczynności tarczycy u kobiet w ciąży (10)
Nazwa preparatu Dawka Mechanizm działania
Propylotiouracyl PTU
(Thyrosan, Propycil) 150-450mg/dobę hamowanie syntezy hormonu
Metylotiouracyl MTU 150-450mg/dobę hamowanie konwersji obwodowej
(Methylthiourcyil) T4 do T3
Tiamazol (Metizol) 15-40mg/dobę hamowanie syntezy hormonu
Jodki (potasu i sodu) doustnie:krople,tabletki:
domięśniowo, dożylnie
bet-blokery adrenergiczne 40-200mg/dobę hamowanie konwersji obwodowej
(Propranolol) T4 do T3, osłabienie objawów
adrenergicznych

NIEDOCZYNNOŚĆ TARCZYCY W OKRESIE CIĄŻY
Niedoczynność tarczycy występuje u 3-5 proc. ciężarnych. Jest przyczyną częstszych
poronień samoistnych i przedwczesnych porodów. Przyczyny występowania: limfocytarne
przewlekłe zapalenie tarczycy (choroba Hashimoto), leczenie chirurgiczne lub jodem
radioaktywnym choroby Gravesa-Basedowa oraz endemiczny niedobór jodu (15). Niedoczynność
może także wystąpić w przebiegu niewłaściwego leczenia lekami tyreostatycznymi (Letrox,
Euthyrox). Narządem najbardziej wrażliwym na niedobór hormonów tarczycy jest mózg, stąd ich
niedobór u kobiety ciężarnej może zaburzyć rozwój OUN u płodu z nieodwracalnymi
następstwami. Rozpoznanie niedoczynności, podobnie jak nadczynności, tarczycy u ciężarnych
może być trudne. Objawy kliniczne są niecharakterystyczne, podobne do tych, które towarzyszą
ciąży fizjologicznej, jak np. zmęczenie, wypadanie włosów, suchość skóry, nietolerancja ciepła,
zaparcia, senność. U ok. 20 proc. pacjentek przebiega bezobjawowo (16). W ostrych przypadkach
występuje spowolnienie mowy, zaburzenia słuchu, wodobrzusze, nacieki opłucnej i osierdzia,
obrzęk twarzy, rąk i kostek. W badaniach laboratoryjnych stwierdza się podwyższone stężenie TSH
₄
i obniżone stężenie FT w surowicy. Wskazane jest ponadto oznaczenie stężenia przeciwciał
przeciwtarczycowych, zwłaszcza antyperoksydazowych (TPO-Ab) i antytyreoglobulinowych (TG-
Ab) (1). Nieprawidłowo leczona niedoczynność tarczycy u kobiety ciężarnej może prowadzić do
nadciśnienia tętniczego, rzucawki, przedwczesnego oddzielenia łożyska, niskiej wagi urodzeniowej
dziecka, zwiększonej umieralności okołoporodowej oraz wad wrodzonych u dziecka (4).
Leczenie niedoczynności tarczycy w ciąży ma prowadzić do stanu eutyreozy klinicznej i
wyrównania wyników badań laboratoryjnych. U pacjentek ze zdiagnozowaną i/lub leczoną przed
ciążą niedoczynnością dawka L-tyroksyny powinna być zwiększona od 25 do 50 proc. , w
zależności od wartości TSH (17). Po porodzie dawki L-tyroksyny należy stopniowo redukować w
ciągu 6-8 tygodni. Ciężarne z niedoczynnością w przebiegu choroby Hashimoto wymagają
stosowania mniejszych dawek L-tyroksyny, tzn. 1,9 ug/kg m.c. /dobę.
U około 50 proc. pacjentek z eutyreozą, mieszkających na obszarach o niedoborze jodu, występuje
jawna lub subkliniczna niedoczynność tarczycy w ciąży. Dochodzi do podwyższenia w surowicy
stężenia TSH już w I trymestrze, obniżenia całkowitej i wolnej T4 i T3 oraz wzrost stosunku T3/T4
(1). Zawartość jodu w diecie łatwo określić badając jego wydalanie z moczem. Przyjmuje się, że
wydalanie jodu poniżej 10 (g/ dl) świadczy o niskiej podaży jodu. Zalecana przez WHO dzienna
dawka jodu dla ciężarnych i karmiących wynosi 200 ug (18). Stwierdzono, że dzieci urodzone
przez kobiety z nieznaczną nawet niedoczynnością tarczycy wykazują obniżony iloraz inteligencji

(17). Każdy noworodek, a szczególnie noworodek matki z hipotyreozą, powinien być poddany
testom na obecność hipotyreozy wrodzonej.
Zasady postępowania u kobiet z niedoczynnością tarczycy :
–
przed ciążą rozpoznanie choroby w kierunku płodności lub zaburzeń miesiączkowania,
–
zajście w ciążę w stanie eutyreozy,
–
kontynuacja leczenia preparatami w normalnej dawce,
–
badania położnicze co miesiąc,
–
kontrola tyreologiczna co 2-3 mies.,
–
w stanie eutyreozy poród drogami natury,
–
podczas połogu obserwacja w kierunku zaostrzenia objawów choroby.
PRZEWLEKŁE AUTOIMMUNIZACYJNE ZAPALENIE TARCZYCY A ZABURZENIA PŁODNOŚCI
Najczęstszą przyczyną zaburzeń funkcji tarczycy u młodych kobiet są choroby o podłożu
autoimmunologicznym. Przewlekłe autoimmunizacyjne zapalenie tarczycy (choroba Hashimoto)
jest najczęściej rozpoznawanym zapaleniem tarczycy u ciężarnych – 6-11 % u kobiet z eutyreozą i
40-60 % z podwyższonym TSH. Sposobem wykluczenia albo potwierdzenia tej przyczyny są
badania na obecność przeciwciał antymikrosomalnych, inaczej antyperoksydazowych (a-TPO) oraz
antytyreoglobulinowych (a-TG). Częstość występowania poronień u kobiet w eutyreozie z
dodatnim mianem przeciwciał przeciwtarczycowych anty-TPO i/lub anty-TG jest 2-3-krotnie
wyższe niż u zdrowych kobiet.
Przesiewowe oznaczanie anty- TPO jest konieczne u kobiet w grupie ryzyka : nawracające
poronienia, leczone z powodu chorób autoimmunizacyjnych, TSH > 2,5 mIU/l, obraz USG
sugerujący autoimmunizacyjną chorobę tarczycy. Dotychczas nie ustalono jednoznacznych zasad
postępowania w chorobie Hashimoto z eutyreozą u ciężarnych.
Niedobór hormonów tarczycy także w istotnym stopniu zmniejsza płodność. W łagodnej
niedoczynności tarczycy ciąża jest możliwa, ale wiąże się z ryzykiem poronienia i porodu
przedwczesnego. Ponadto niedobór hormonów tarczycy matki może mieć niekorzystny wpływ na
funkcję rozwijającej się tarczycy dziecka i co najważniejsze na rozwój jego centralnego układu
nerwowego. Niedoczynność tarczycy (wysokie TSH) sprzyja pośrednio nadprodukcji prolaktyny,
co dodatkowo niekorzystnie wpływa na płodność.
Nadczynność tarczycy nie upośledza w sposób istotny płodności, ale jeśli jest bardzo nasilona to

wywołuje problemy. Nadmiar hormonów tarczycy może blokować receptory estrogenowe
sprawiając, że estrogeny działają w organizmie mniej efektywnie (np. na endometrium).
Nadczynność może prowadzić też do komplikacji w ciąży (nadciśnienie, stan przedrzucawkowy,
zmiany w układzie sercowo naczyniowym).
W ciąży i w czasie stymulacji owulacji (głównie gonadotropinami) wzrasta zapotrzebowanie na
hormony tarczycy dlatego, że pod wpływem wysokich stężeń estrogenów zmniejsza się ich
biologiczna dostępność tzn. potrzeba więcej T4 i T3 dla utrzymania dostatecznego poziomu fT4 i
fT3. W związku z tym często trzeba zmodyfikować dawkę leku u osób z niedoczynnością tarczycy,
a subkliniczną niedoczynność należy uważnie obserwować.
JOD W CIĄŻY
Dobowe zapotrzebowanie na jod jest bardzo małe, ok. 200 mikrogramów. Norma jodu dla
ciężarnych wynosi ok. 200-250 ug/l i nie powinna przekraczać 500 ug/l. Zawartość jodu w
przykładowych produktach (ug/100g) : dorsz – 116, tuńczyk – 20, wieprzowina – 7-12, wołowina –
15-19, kurczak – 15-18, mleko – 21-25, ser biały – 26, jajko – 25/szt., ryż – 3.
W czasie ciąży kobieta powinna jeść ryby nawet trzy razy w tygodniu. Nie wszystkie gatunki są
wskazane – należy zachować ostrożność w spożywaniu dużych ryb morskich, których mięso
zawierać może śladowe ilości metali ciężkich (np. tuńczyk, rekin), szkodliwych dla rozwoju płodu.
Picie niektórych wód mineralnych oraz używanie podczas gotowania jodowanej soli kuchennej
również zaopatruje nasz organizm w ten pierwiastek. Niektóre warzywa głównie z rodziny
krzyżowych (np. kapusta) zawierają rodanki, które działając antagonistycznie do jodków, mogą
pogorszyć przebieg niektórych schorzeń tarczycy.
W czasie ciąży wielu lekarzy przepisuje też doustne preparaty jodu. Na ogół ciężarne zażywają
tabletki zawierające od 100 mg do 200 mg jodu – jest to dawka dobowa. Jodu nie wolno zażywać
na własną rękę – bez konsultacji z lekarzem. Wszystkie kobiety planujące ciążę lub będące w
pierwszym okresie ciąży nieplanowanej powinny przechodzić badania tarczycy : badanie fizykalne
i USG tarczycy, ocenę stężenia tyreotropiny (TSH), tyroksyny (T4), trójjodotyroniny (T3) oraz
przeciwciał przeciwko tyreoperoksydazie (anty-TPO).
Na polskim rynku dostępne są preparaty jodu przepisywane przez lekarza i preparaty
wielowitaminowe zawierające jod, które mogą być polecane i stosowane przez ciężarne oraz w
okresie laktacji :

P
renatal Complex 150mcg jodu Jodid 100mcg jodu
Doppelherz aktiv Mama 100mcg Jodid 200mcg
Centrum Materna 200mcg Jodthyrox
Falvit Mama 150mcg
Femibion Natal Classic 150mcg
PregnaPlus 150mcg
Prenate Elite 150mcg
Vita miner Prenatal 150mcg
Vita-Femin 75mcg
Dobór preparatu i dawki jodu musi uwzględnić podaż jodu w diecie i powinien zapewniać dobową
podaż tego pierwiastka na poziomie 200 mcg (19).
Jeśli endokrynolog zdiagnozował nadczynność tarczycy, warto zastosować specjalną dietę. Należy
dostarczać organizmowi więcej energii i jeść 5-6 posiłków dziennie oraz podporządkować się
pewnym zasadom. Należy jeść więcej białka (mleko i jego przetwory, jaja, chude mięso, wędliny,
chude ryby – dorsz, sandacz), wszystkie posiłki powinny być bogate w witaminy – zwłaszcza A
(marchew, pomidory, papryka, brzoskwinie), C ( natka pietruszki, czerwona papryka, cytrusy), B1
(produkty zbożowe, jaja, kasza) oraz składniki mineralne, takie jak wapń (mleko i jego przetwory).
Należy wybierać potrawy lekkostrawne, unikać smażonych i tłustych. Nie należy często jeść
kapusty, kalarepy, brukselki, chrzanu, rzodkiewki – zawarte w nich substancje sprzyjają rozrostowi
wola. Do minimum należy ograniczyć napoje z kofeiną tj. kawa, herbata, coca-cola.
Wobec potwierdzonych danych, dotyczących konsekwencji chorób tarczycy dla dzieci
chorych matek, konieczna jest bardzo wnikliwa obserwacja kobiet w ciąży z tymi schorzeniami.
Wczesne rozpoznanie oraz prawidłowe leczenie u matki powinny zapewnić prawidłowy rozwój jej
potomstwa. Dzieci urodzone przez kobiety z chorobami tarczycy powinny być w okresie
noworodkowym lub wczesnoniemowlęcym poddane diagnostyce, gdyż trafne rozpoznanie i
odpowiednio wdrożone postępowanie terapeutyczne pozwoli na uniknięcie nieprawidłowości
rozwojowych u tych dzieci.

Bibliografia
1) Bartel H. Embriologia, Wyd. Lek. PZWL W-wa 1995
2) Karolczak J. '' Gospodarka hormonalna tarczycy – regulator organizmu.'' Farmakoterapia
3) Mutschler E. Farmakologia i toksykologia 2010 ,
4) Łącka K. , Łakoma H. ''Tarczyca a ciąża – fizjologia i patologia'' , Wiadomości Lekarskie
2002, LV, 7-8,
5) Nauman J., Nauman A. '' Wpływ ciąży na tarczycę.'' Medipress Gin 1997; 3(2):2-4,
6) Lazarus JH., Ludgate ME., ''Prevention and treatment of postpartum Graves' disease.''
Baillieres Clin Endocrinol Metab 1997; 11(3):549-560,
7) Szymborska M. ''Noworodek od matki z nadczynnością i niedoczynnością tarczycy.''
Klinika Pediatryczna Choroby Okresu Noworodkowego Vol. 14 No 2, 1999
8) Davies T.F. , The thyroid immunology of the postpartum period. '' Thyroid , 1999; 9: 675-
684,
9) '' Choroby tarczycy związane z ciążą '' , Medycyna Praktyczna – Ginekologia i Położnictwo
3/2005 , Artykuły poglądowe i wytyczne,
10) Drews K. , Seremak-Mrozikiewicz A. , Brzezińska E. , Perlik M. ''Zaburzenia czynności
tarczycy w przebiegu ciąży i porodu'' Ginekologia Praktyczna 2001
11)
Glinoer D. '' Thyroid Regulation and Disfunction in the Pregnant Patient .[w:] The Thyroid
and its Diseases. w
ww.thyroidmanager.org
. (Revised 30 Sept. 2001 )
12) Mardowicz G., Łopatyński J. ''Niekorzystny wpływ chorób tarczycy na płodność, przebieg
ciąży, okres poporodowy i stan zdrowia potomstwa.'' Polska Medycyna Rodzinna 2002, 4
13) Postępowanie w chorobach tarczycy u kobiet w ciąży. Endokrynologia Polska tom 62
numer 4 /2011 ISSN 0423- 104 X
14) Morreale de Escobar G. , Obregon M.J. '' Role of thyroid hormone during early brain
development.'' Eur J Endocrinol 2004, 151, Suppl.3
15) Funkcja osi podwzgórzowo-przysadkowo-tarczycowej w jednostce matczyno-połodowej:
analiza czynności endokrynnej u matki. K.Żwirska-Korczala, K. Kamiński, K.Gajewska, A.
Berdowska Ginekologia Praktyczna 2001
;
R.9 nr 8(61)
16) Lazarus JH, Othman S. Thyroid disease in relation to pregnancy. Clin Endocrinol 1991
17) Nauman J, Nauman A. Wpływ ciąży na tarczycę (Pregnancy and thyroid). Medipress
Ginekologia 1997
18) Glinoer D, Delange F, Laboureur I, de Nayer P, Lejeune B, Kinthaert J, Bourdoux P.

Maternal and neonatal thyroid function at birth in area of marginally low iodineintake. J
Clin Endocrinol Metab 1992
19) Lewiński A., Karbownik M., Zygmunt A. ''Leczenie wola nietoksycznego u kobiet w ciąży
i w okresie laktacji.'' Endokrynologia Polska 1999,
Wyszukiwarka
Podobne podstrony:
13 CHOROBY TARCZYCY U KOBIET W CIĄŻY
Postępowanie w chorobach tarczycy u kobiet w ciąży
endokrynologia, HORM2 -Darek 1, NAGŁE STANY W ENDOKRYNOLOGII Podostre zapal tarczycy kobiety50rż
Składniki mineralne w diecie kobiet ciężarnych prezentacja
Choroby tarczycy w ciazy
Tarczyca i choroby tarczycy
choroby tarczycy w okresie prze Nieznany
Kobieta ciezarna
Kondycja fizyczna kobiety ciężarnej(1), Szkoła Rodzenia
Leczenie chorób tarczycy, fizjoterapia
choroby tarczycy, Leki stosowane w chorobach tarczycy
Leczenie chorób tarczycy, Patologia i choroby
Choroby tarczycy
1 KOBIETA CIĘŻARNA – URAZ, ZASADY RESUSCYTACJI
CHOROBY TARCZYCY
badanie przeciwciał odpornościowych u kobiet ciężarnych, Diagnostyka laboratoryjna
DIETY, jedzenie na miescie, Bulimia - choroba współczesnych kobiet
więcej podobnych podstron