OPRACOWANIE
DO EGZAMINU
Z
IMMUNOLOGII
Kochani! To już nasza trzecia udana akcja!!! Niektórzy uczestniczą w niej pierwszy raz, inni jako „stara gwardia”... ale wszyscy tak samo starali się, żeby wypadła jak najlepiej. Z tego miejsca chciałabym Wam serdecznie podziękować za dobra organizacje, wkład pracy i rzetelność. Tak naprawdę ile kto włożył w to serca, zapału wie tylko on sam i chyba największa satysfakcją w tym wszystkim jest świadomość, ze mógł dołożyć swoją cegiełkę do tego wspólnego dzieła.
Jeszcze raz dziękuję!!!
Oto lista naszych mróweczek (kolejność różna)
Martyna Dybaś(!), Basia Rogula(!), Diana Sawicz, Maciek Gajda, Krzysia Jaworska, Paulina Ślusarska, Agnieszka Witkowska, Ala Ramczykowska, Paulina Marchewka, Edyta Sołecka, Ola Famulska, Kasia Ranoszek, Ania Raginia, Łukasz Szczukowski, Benek Szczotka, Rafał Wedlarski, Ewelina Serafin, Magda Borowicz, Mateusz Pawłowski, Marta Bogacz, Gosia Zmyślona, Marta Winter, Gosia Kardasz, Iwona Urban, Ala Burakowska, Sabina Czajka, Basia Berezowska, Agnieszka Wróblewska, Ewelina Fus, Marta Piotrowska, Kamila Stasyszn, Krzysiu Pietrusiak, Martyna Kurczaba, Marta Fijałkowska, Paulina Chwiałkowska, Karolina Brumer, Justyna Ciepłucha, Ewa Drabińska, Karolina Barancewicz, Kasia Jawna.
p.s. Wesołych Świąt!
1. Ontogeneza układu immunologicznego
Komórki ukł. Immunolog. Uczą się odróżniać obce antygeny od własnych antygenów zgodności tkankowej podczas dojrzewania i różnicowania, które rozpoczyna się już w życiu płodowym.
Prekursory kom. Immunologicznych (bez markerów) trafiają z mezenchymy o zawiązków wątroby i śledziony, dalej do grasicy (limf. T) i szpiku kostnego (limfocyty B). Ma to miejsce ok. 7-8 tygodnia życia płodowego. W życiu plodowym komorki ukladu immunologicznego (limfocyty B i T) nie rozpoznaja obcych antygenow (nie widza ich). Dopiero po urodzeniu komorki maja kontakt z antygenami, co warunkuje ich roznicowanie funkcjonalne. Dalej wedruja one do obwoowych naczyn limfatycznych, gdzie zachodza reakcje immunologiczne.
Uklad immunologiczny funkcjonuje prawidlowo, gdy jego komorki sa kompetentne immunologicznie, czyli wtedy gdy po kontakcie z antygenem dochodzi do reakcji.
Populacja komorek ukladu immunologicznego nie jest homogenna. Z komorek hemopoezy (bez receptorow) wyodrebniaja się dwie linie: linia leukocytalna (limfocyty NK,K,T,B, komorki dendrytyczne) i linia mielocytalna (z mielocytow powstaja m.in. plytki krwi, bazofile i neutrofile). Kazda komorka ma markery na swojej powierzchni, które umozliwiaja ich wykrycie i rozroznienie.
limfocyty T
Grasica odpowiada za dojrzewanie limfocytow T. Skladaja się na nia dwa platy zbudowane z drobniejszych placikow ( na każdy sklada się kora, rdzen, cialka grasicze). Zrab (kora+rdzen) to najwazniejsza czesc grasicy - zawiera makrofagi (rdzen i kora), komorki dendrytyczne (rdzen), zas na granicy kory i rdzenia znajduja się tymocyty - cialka grasicze bedace prekursorami limfocytow T. Tymocyty w korze tworza zbite struktury otoczone nablonkiem (tkanka opiekuncza). Im dalej do wnetrza, tym staja się one luzniej ulozone, aż do pojedynczych komorek. Dojrzewanie i roznicowanie zachodzi poczatkowo w korze, potem w rdzeniu, naczyniach limfatycznych, z których wedruja do krwioobiegu i naczyn obwodowych.
Na powierzchni makrofagow, komorek dendrytycznycg i nablonka znajduja się antygenty, których rozpoznawania : „ucza się” tymocyty. Dzieki barierze krew-grasica tymocyty nie maja kontaktu z obcymi antygenami, stad ucza się tolerancji jedynie dla wlasnych antygenow.
Grasica nie zanika z wiekiem, ale zanika tkanka limfoidalna. Poczatkowo zanika ok. 1% tkanki rocznie. Po 50 roku zycia - 0,8%, zas calkowity zanik wysepuje około 120 roku zycia.
Organizm pochlania duzo energii na produkcje tymocytow. Po urodzeniu na (obwod trafia 100mld komorek/dobe. Jest to 5% produkowanych tymocytow (reszta ulega apoptozie). Są to komorki dlugozyjace.
Rozniowania limfocytow T nie można przedstawic w sposób calkowicie klarowny.
Protymocyty (prekursory tymocytow) docieraja do grasicy w 7-9 tygodniu zycia plodowego. Pochodza one z komorek których poprzednimi miejscami pobytu był: woreczek zoltkowy, watroba plodowa i szpik. Roznicuja się one z limfoidalnych komorek macierzystych, których w szpiku jest ok. 0,1%. Protymocyty maja na swojej powierzchni m.in. struktury CD7, CD38 i CD45, zawieraja transferaze nukleotydow terminalnych i może w nich już zachodzic ekspresja lancucha TCRγ. Do grasicy przyciagaja je pewne czynniki chemotaktyczne, produkowane przez komorki zrebu. Wazna role w zasiedlaniu grasicy przez protymocyty odgrywaja obecnena nich czasteczki CD44 (pgp-1) - umozliwaja im interakcje ze srodblonkiem. Rozpoczyna się wewnatrzgrasicze roznicowanie tymocytow. Schemat ponizej (nawiasy symbolizuja limfocyty)
→(CD4-8-TCRγδ) → na obwod
(CD4-8-TCR-) →(CD4+8-TCRαβ)
→ (CD4-8+TCR-)→(CD4+8+TCR-)→ (CD4+8+TCRαβ)
→(CD4-8+TCRαβ)
Podczas roznicowania tymocyty intensywnie proliferuja, przesuwaja się z kory do rdzenia, gdzie dominuja dojrzale limfocyty T gotowe do opuszczenia grasicy. W czasie pobytu w grasicy na powierzchni tymocytow pojawiaja się kolejno struktury CD2, CD8 i CD4 także receptory TCRαβ wraz z CD3. tymocyty posiadajace zarówno CD4 jak i CD8 (podwojnie dodatnie) przeksztalcaja się w komorki z CD4 lub CD8 (pojedynczo dodatnie). Nieliczne nabywaja receptory TCRγδ - receptory te pojawiaja się wczesniej, a tymocyty które je posiadaja nie maja zazwyczaj struktur CD4 i CD8, wczesniej opuszczaja grasice i proliferuja inaczej jeśli chodzi o lokowanie poza grasica. W grasicy zachodzi również proces selekcji pozytywnej oraz negatywnej.
Limfocyty T nie wiaza antygenow wolnych antygenow, lecz tylko antygeny zwiazane przez czasteczki MHC i prezentowane na powierzchni komorek prezentujacych. . Limf. T CD4+ rozpoznaja antygeny zwiazane z czasteczkami MHC klasy II, natomiast CD8+ - MHC klasy I.
selekcja pozytywna - zachodzi w korze grasicy i dotyczy limfocytow T podwojnie dodatnich. Jej wynikiem jest tak zwana restrykcja MHC, czyli nastawienie limfocytow, które przeszly ta selekcje na rozpoznawanie antygenow w polaczeniu z wlasnymi czasteczkami MHC. W selekcji tej uczestnicza glownie obecne w korze komorki nablonkowe zrebu (wazna role odgrywaja grasicze komorki opiekuncze). Limfocyty które rozpoznaja MHC klasy I traca w nastepnym etapie zdolnosc do syntezy CD4 i odwrotnie, limfocyty, które wiaza czasteczki MHC klasy II traca CD8. Gdy nie dochodzi do polaczenia antygenu i receptora TCR komorka kierowana jest na apoptoze (smierc z zaniedbania)
selekcja negatywna - zachozi glownie w korze, kontynuowana jest w trakcje przechodzenia tymocytow do rdzenia grasicy. Dotyczy glownie tymocytow podwojnie dodatnich, ale może obejmowac również te pojedynczo dodatnie. W tym procesie aktywnie uczestnicza kom. Dendrytyczne i makrofagi, sugeruje się także udzial limfocytow B i kom. nablonkowych. Wynikiem selekcji jest eliminacja tymocytow które z duza swoistoscia i powinowactwem rozpoznaja autologiczne MHC lub inne antygeny organizmu. Eliminacja zahcodzi droga apoptozy. W wyniku selekcji negatywnej ginie około 95% tymocytow, te które pozytywnie przejda proces selekcji opuszczaja grasice jako dojrzale limfocyty T.
Dojrzewanie limfocytow T w grasicy jest regulowane przez szereg czynnikow humoralnych - m.in. specyficznych dla grasicy czynnikow takich jak tymozyna, tymulina, a także interleukiny, oraz czynnik stymulujacy kolonie granulocytow i makrofagow (GM-CSF). IL3 bierze udzial w roznicowaniu limfoidalnych komorek macierzystych w kierunku protymocytow w szpiku, a tymozyna β4 indukuje w grasicy w promonocytach aktywacje TdT. Roznicowanie wczesnych form tymocytow stymuluja IL 1,2,4. interleukiny te można uznac za autokrynowe czynniki wzrostu i dojrzewania tgymocytow z racji tego ze sa one wlasnie przez tymocyty produkowane (oraz oczywiście komorki zreu grasicy). W procenie tym uczestnicza także IL 6 i 7 oraz GM-CSF, produkowanych przez komorki nablonkowe grasicy.
limfocyty B
na samym poczatku na uwage zalsuguje fakt, ze limfocyty B na kazdym etapie dojrzewania mogą ulec transformacji nowotworowej, stad poznanie tego procesu jest niezwykle wazne !!!
schemat dojrzewania (nawiasy symbolizuja limfocyty)
1()→2(TdT)→3(TdT R O H L)→4(TdT R R/O H L)+μ→5(R R H L)+IgM,FcR→
→6(R R H L)+IgD,IgM,FcR,CR
1 -pluripotencjalna komorka macierzysta; TdT- transferaza nukleotydow terminalnych; CR-receptor dla dopelniacza; FcR-receptor dla Fc przeciwcial; H-gen dla lancucha ciezkiego, O-gen w konfiguracji zarodkowej, R-gen zrekombinowany
z pluripotencjalnej kom. macierzystej (oznaczona na schemacie nr 1), wspolnej dla wszystkich krwinek, powstaje macierzysta komorka limfoidalna(oznaczona naschemacie nr 2), która jest wspolna dla limfocytow B i T i wykazuje aktywnosc transferazy nukleotydow terminalnych (TdT). Pierwszym genem pozwalajacym na stwierdzenie ze dana komorka zaczyna się roznicowac w kierunku limf. B jest rekombinacja genow dla czesci zmiennej lancucha ciezkiego. Komorka taka to pro-B lub pre-pre-B.(3) Kolejnym etapem jest pojawienie się w cytoplazmie roznicujacej się komorki lancuchow ciezkich μ. Komorka taka to pre-B(4). Tradycyjnie uwaza się ze pre-B nie ma na swojej powierzchni receptorow immunoglobulinowych, mimo to na niektórych komorkach znajduja się takie receptory mimo braku na tym etapie rozwoju lancuchow κ czy α. Zbudowane sa one z lacuchow ciezkich μ i nie opisywane wczesniej lancuchy lekkie, niespotykane w pozniejszym rozwoju limf. B.
Limfocyty pre-B emigruje z watroby plodowej do szpiku, ulega tam rekombinacjii ekspresji gen dla lekkiego lancucha κ co pozwala na pojawienie się na ich powierzchni receptorow immunoglobulinowych IgM. Komorke taka okresla się jako niedojrzaly albo wczesny limfocyt B (5). Gdy na jego powierzchni ekspresji ulegaja receptory IgD oraz receptory dla frag. Fc przeciwcial oraz dla skladnikow dopelniacza możemy mowic o dojrzalym lub dziewiczym limfocycie B (6).
Dojrzale limfocyty B, których receptory immunoglobulinowe wiaza wlasne antgeny organizmu mogą ulec w szpiku eliminacji. Jest toproces analogiczny do negatywnej selekcji limfocytow T w grasicy.
Dojrzale limf B zasiedlaja wszystkie narzady limfatyczne, obecne sa również we krwi. Przed interakcja z antygenem znajduja się w fazie G0 cyklu komorkowego i na tym etapie sa znane jako limfocyty spoczynkowe. W wyniku pobudzenia przez antygen i kooperacji z limfocytami T w trakcie pierwotnej reakcji immunologicznej, limfocyty B roznicuja się w dwoch kierunkach:
w komorki intensywnie produkujace i uwalniajace immunoglobuliny i ostateczinie przeksztalcajace się w komorki plazmatyczne,
w komorki pamieci, które na swojej powierzchni posiadaja receptory immunoglobulinowe IgG, IgA lub IgE, sa gotowe do ewentualnej odpowiedzi wtornej przy ponownym kontakcie z antygenem.
Poszczegolne etapy roznicowania można identyfikowac glownie na podstawie obecnosci czasteczek CD:
komorka macierzysta pluripotencjalna - CD34
komorka macierzysta limfopoetyczna - CD10,34,38,HLA-DR
limfocyt pro-B- CD19,34,38,HLA-DR
limfocyt pre-B - CD9,10,19,20,24,38, HLA-DR
limfocyt B dojrzaly spoczynkowy- CD19,20,21,24,31,32,35,37,40,45RA,45RB,45RO,w49d,63,72,74,75-78, HLA-DR.
W procesie regulacji wzrostu i roznicowania limfocytow B uczestniczy wiele czynnikow, m.in. Il od 1 do 7, interferon γ, TGF-β. IR-7 ( zwana także limfopoetyna 1) produkowana jest przez komorki zrebowe szpiku. Indukuje ona proliferacje i roznicowanie limfocytow pro-B, pre-B, IL-4 oddzialuje m.in. na limfocyty pre-B.
(przy limfocytach T była opisana także struktura czastek CD4 i CD8, ale w wykladach tych strukturach nie było mowy stad ich nie zamiescilam w skrypcie. Dla ambitnych - informacje o ich strukturze sa na str.126 w Jakóbisiaku. Dodam jeszcze ze to z Jakubisiaka pisalam ten temat bo w golebiu jest to zbyt rozwlegle w porownaniuz tym co było na wykladach).
PODSTAWOWE SKŁADOWE UKŁADU IMMUNOLOGICZNEGO
Ponieważ poszczegolne skladowe ukladu immunologicznego zostana opisane w innych zagadnieniach które maja moi koledzy i kolezanki pokusze się jedynie o wymienienie tych skladowych i jedynie wstepna charakterystyke, bo wydaje mi się bez sensu szczegolowo charakteryzowac wszystkie po kolei skoro zostanie to zrobione duzo bardziej szczegolo w dalszych fragmentach naszej wspolnej pracy.
limfocyty - komorki posiadajace duze jadro, relatywnie mala ilosc cytoplazmy, srednica waha się od 6 do 15 μm
komorki dendrytyczne - posadaja dlugie, waskie, ddrzewiasto rozgalezione wypustki, komorki prezentujace
makrofagi - powstaja z monocytow, jednojadrzaste komorki zerne, zawieraja liczne lizosomy i wakuole, prezentuja antygeny
limfocyty T: poszczegolne subpopulacje roznia się obecnoscia okreslonych antygenow powierzchniowych i receptorow, a także pewnych enzymow
cytotoksyczne - zdolne do zabicia innych komorek (obcych, nowotworowych, zakazonych wirusami)
pomocnicze - dzialanie wspomagajace
supresorowe - reguluja odpowiedz immunologiczna; dzialanie hamujace
kontrsupresorowe - chronia limfocyty Th przed supresja
limfocyty B - zdolne do wytwarzania przeciwcial i roznawania antygenow
plazmocyty - wytwarzaja przeciwciala
limfocyty K - zdolne do cytotoksycznosci zaleznej od przeciwcial
limfocyty NK - komorki zerne
komorki tuczne, bazofile - udzial w odpowiedzi typu wczesnego, anafilaksji
eozynofile - zdolne do fagocytozy i zabicia niektórych pasozytow przy uzyciu przeciwcial, wydzielaja czynniki hamujace anafilaksje
neutrofile - zdolne do fagocytozy i zabicia mikroorganizmow
monocyty, makrofagi - zdolne do fagocytozy i zabicia mikroorganizmow, oraz innych obcych komorek
megakariocyty - wytwarzaja trombocyty które biora udzial w krzepnieciu krwi i reakcjach zapalnych
erytrocyty - przez receptor dla dopelniacza wiaza kompleksy immunogloiczne i uczestnicza w ich usuwaniu
przeciwciala - glebsza charakterystyka w zagadnieniu dot. Przeciwcial
antygeny - substancje charakteryzujace się immunogennoscia (zdolnosc do wywolywania przeciwko sobie swoistej odpowiedzi immunologicznej) i antygenowoscia (zdolnosc do swoistego laczenia się z immunoglobuinami). Antygen majacy tylko druga z tych cech nazywa się haptenem i jest antygenem niepelnowartosciowym. Immunogennosc zyskuje dopiero po polaczeniu z nosnikiem (np. czasteczka bialka). Antygeny mogą być ciagle (kiedy aminokwasy antygenu bialkowego kontaktujace się z przeciwcialem sa zwarte w jednym odcinku lancucha bialkowego) lub nieciagle (aminokwasy sa o siebie oddalone w lancuchu bialkowym lecz zblizone przy danej konformacji bialka). W obrebie jednego antygenu może znajdowac się kilka miejsc wiazacych przeciwciala (epitopy lub determinanty antygenowe). Antygen posiadajacy wiele epitopow to antygen wielowartosciowy lub poliwalentny. antygeny możemy podzielic na grasiczozalezne (limfocyty B potrzebuja pomocy ze strony lifocytow T) i grasiczoniezalezne (nie wymaga pomocy ze strony limfocytow T, np. LPS, dekstran, PPD).
PIERWOTNE narzady limfatyczne to grasica, kaletka Fabrycjusza i szpik kostny
grasica
kaletka Fabrycjusza
szpik kostny
WTÓRNE - nieotorbione grudki limfatyczne (m.in. plamki mleczne, migdalki, tkanka limfatyczna zwiazana z blonami sluzowymi), wezly limfatyczne, sledziona, naczynia limfatyczne
nieotorbione gruki limfatyczne - wystepuja pojedynczo lub w grupach w tkance lacznej wiotkiej, najczesciej w scianie przewodu pokarmowego, drog oddechowych i narzadow moczowo-plciowych. Uczestnicza w wytrwarzaniu limfocytow, stanowia jeden z elementow obrony przed inwazja drobnoustrojow. Należy pamietac ze pokryte wydzielinami nablonki tych narzadow kontaktuja się bezposrednio ze srodowiskiem zewnetrznym. Po pobudzeniu antygenem w srodowisku grudki pojawia się owalne przejasnienie zwane osrodkiem lub centrum rozmnazania, która kontrastuje z ciemno barwiacym się obwodem grudki, zwany pasem zageszczenia.
plamki mleczne - sa to skupiska limfocytow i makrofagow wystepujace w blonie surowiczej pokrywajacej jame otrzewnej i oplucnej. Sa zrodlem przynajmniej czesci limfocytow imakrofagow w tych jamach. Sa obecne tylko u dzieci
migdalki - sa to grudki limfatyczne ulozone pojedynczo lub w skupiskach tuz pod nablonkiem w miejscu krzyzowania się gornego oddcinka drog oddechowych z przewodem pokarmowym. Jest to miejsce strategiczne dla obrony organizmu przed zakazeniami. W obrebie nablonka pokrywajacego migdalki (szczególnie w kryptach) obserwuje się liczne limfocyty i plazmocyty
tkanka limfatyczna zwiazana ze sciana jelita - stanowi rozproszone limfocyty i grudki limfatyczne. Nablonek jelitowy pokrywajacy grudki i oddzielajacy je od swiatla jelita zawiera liczne limfocyty. Charakterystyczna cecha tego obszaru jest brak kosmkow i krypt jelitowych oraz obecnosc komorek, które zamiast wystepujacych na enterocytach mikrokosmkow maja liczne pofaldowania - nazwiano je komorkami M, które uczestniczą w transporcie niektórych makroczasteczek, w tym antygenow ze swiatla jelita do lezacej pod nalbonkiem tkanki limfatycznej
samotne grudki limfatyczne - rozrzucone wzdluz calego jelita
skupione grudki limfatyczne - zwane również kepkami Peyera; wystepuja przede wszystkim w jelicie kretym. Charakteryzuja się relatywnie duza azzwartoscia supresorowych limfocytow T i proliferacja limfocytow B bez przeksztalcania ich w komorki plazmatyczne. Posiadaja zylki pozawlosowate wyslane wysokim srodblonkiem, które sa miejscem przechodzenia limfocytow krazacych z krwi do grudek limfatycznych.
Grudki limfatyczne wyrostka robaczkowego
wezly limfatyczne - leza na przebiegu naczyn limfatycznych, które uchodza do wezla, a nastepnie go opuszczaja. Tym samym wezly limfatyczne można porownac do filtrow lezacych na rodze limfy. Do zasadniczych czynnosci wezlow chlonnych naleza filtracja limfy i zatrzymywanie zawartych w niej antygenow (wolnych i obecnych na komorkach dendrytycznych) a także drobnoustrojow, komorek nowowtworowych i drobnych czasteczek stalych; wytwarzanie aktywowanych limfocytow T i B; udzial w odpowiedzi immunologiczenej.
Sledziona - najwiekszy narzad limfatyczny (okreslany jako narzad krwiolimfatyczny). zachodzi tu aktywowanie limfocytow przez antygeny oraz ich roznicowanie w komorki efektorowe. Przy czym sledziona jest pobudzania nie tylko przez antygeny które dostaly się bezposredni do krwi, ale także przez te które przedostaly się do krwi po tym jak były obecne w limfie inie zostaly zatrzymane przez wezly chlonne. Do najwazniejszych czynnosci sledziony należy wytwarzanie limfocytow i monocytow przez cale zycie, a innych krwinek w zyciu plodowym; udzial w odpowiedzi immunologicznej; fagocytoza i niszczenie zuzytych erytrocytow, krwinek bialych i trombocytow; wspoludzial w wytwarzaniu bilirubiny; magazynowanie krwi i krwinek
tymocyty potrójnie ujemne (CD4- CD8- TCR-)
tymocyty podwójnie dodatnie (CD4+ CD8+)
tymocyty CD4+ lub CD8+
dojrzałe limfocyty
zachodzi w grasicy ( stąd nazywana jest czasem „grasiczą edukacją”)
w jej wyniku tylko niewielki odsetek tymocytów zostaje wyselekcjonowany w celu dalszego dojrzewania i zasilania populacji dojrzałych limfocytów T na obwodzie (około 5%)
dzięki niej eliminacji ulega duża liczba komórek prekursorowych, których receptor TCR nie spełnia żadnego pożytecznego zadania lub jest zdolny do autoagresji
selekcja ta zależy od dwóch czynników:
1) powinowactwo receptora TCR do prezentowanego autoantygenu(peptydu)
2) zagęszczenia tych peptydów (ligandów) czyli liczby kompleksów peptyd/MHC prezentowanych danemu limfocytowi Twypadkową tych czynników nazywamy zachłannością, decyduje ona o wyniku selekcji tymocytów w grasicy
I selekcja pozytywna- zachodzi w szpiku na etapie limfocytu pre-B (jeżeli kombinacja genów VDJ dla łańcucha ciężkiego μ odbyła się we właściwej ramce odczytu to umożliwia to ekspresję łańcucha μ receptora pre-BCR; pozostałe komórki umierają na drodze apoptozy, chyba że ponowna rekombinacja wymieniająca gen V umożliwi im syntezę funkcjonalnego łańcucha μ)
II selekcja pozytywna- na etapie niedojrzałego limfocytu B(przeżycie umożliwia ekspresja ostatecznego, funkcjonalnego receptora BCR)
III selekcja- podczas dojrzewania odpowiedzi immunologicznej w grudkach limfatycznych
część komórek autoreaktywnych ulega apoptozie już w szpiku na skutek zetknięcia się z autoantygenem(około 2/3 komórek pre-B umiera na tej drodze)
drugim mechanizmem jest znowu możliwość powtórnej rearanżacji genów immunoglobulinowych, tym razem głównie dla łańcucha lekkiego κ(w ten sposób wymiana autoreaktywnego receptora BCR może uratować komórkę przed apoptozą)
weryfikacja nosząca cechy selekcji negatywnej:
selekcja pozytywna:
jej zadaniem jest wyłonienie limfocytu B o jak największym powinowactwie do danego antygenu(na skutek mutacji somatycznych w obrębie genów VDJ w limfocytach B)
stanowią 20% limfocytów krwi obwodowej i śledziony, 40-60% krwi pępowinowej
mają receptory skierowane przeciw autoantygenom, są narażone na ciągłą aktywacją przez co mogą sprzyjać transformacji nowotworowej (są subpopulacją należącą do białaczek limfatycznych)
wytwarzają głównie przeciwciała IgM
biorą udzia w odpowiedzi pierwotnej- pierwsza linia obrony, nie różnicują się w komórki pamięci
uwalniają czynniki regulujące różnicowanie lmfocytów B
naturalne, których źródłem są tkanki, komórki, narządy, białka surowicy krwi, cząsteczki MHC, wirusy, glikoproteiny, hormony, itp. ; obecne są w ilościach podprogowych
sztuczne, proste substancje będące haptenami, czyli niepełnowartościowymi antygenami nabywającymi cechę immunogenności dopiero po połączeniu z nośnikiem, np. leki
syntetyczne, polimery aminokwasów(linearne, rozgałęzione)
autogeniczne - dawcą i biorcą jest ten sam osobnik, stanowią one zmienione własne antygeny (wrodzone lub nabyte)
syngeniczne - między identycznymi osobnikami tego samego gatunku (identyczna struktura), np. bliźnięta jednojajowe
alogeniczne - najistotniejsze przy przeszczepach, dawca i biorca są różnymi genetycznie osobnikami tego samego gatunku
ksenogeniczne - między osobnikami odmiennych gatunków
Ciężkich α, δ, ε, γ, μ - podział na klasy i podklasy
Lekkich κ, λ - podział na typy i podtypy
Izotypowe - zdrowi osobnicy mają zazwyczaj wszystkie odmiany izotypowe; są uwarunkowane przez pewne zasadnicze różnice w budowie łańcuchów ciężkich i lekkich-umożliwiają podział na klasy i podklasy
Allotypowe - zależne od obecności w obu łańcuchach (gł. w częściach stałych) różnych aminokwasów w określonej pozycji łańcucha polipeptydowego.
Idiotypowe - związane z różnicami w budowie części zmiennych łańcuchów polipeptydowych. P/ciała o tej samej swoistości maja te same markery idiotypowe.
wiążącantygeny na powierzchni komórek ( np. zakażonych wirusami lub nowotworowych, bądź na powierzchni niektórych mikroorganizmów) mogą indukować ich zniszczenie przez:
aktywację dopełniacza
indukcję immunofagocytozy
indukcję cytotoksyczności komórkowej zależnej od p/ciał
wiążąc antygeny na powierzchni mikroorganizmów mogą blokować ich wnikanie, np.. przez nabłonek jelit
Wiążąc toksyny mogą blokować ich działanie
IgA
Jest ich wiecej niż innych p/ciał razem wziętych
Większośc IgA jest wytwarzana miejscowo w sąsiedztwie odpowiedniego nabłonka i wydalana wraz z wydzielinami śluzowo-surowiczymi
Wydzielnicze IgA stanowi główny element obrony błon surowiczych i śluzowych przed inwazją mikroorganizmów
W osoczu człowieka 80-95% w formie monomerycznej reszta to formy polimeryczne
W wydzielinach tj. łzy, pot, wydzieliny gruczołów przewodu pokarmowego, dróg oddechowych i dróg moczowych występują w formie dimerów i są związane z fragmentem wydzielniczym są to S-IgA
Istnieja 2 podklasy IgA-region (zawiasowy ma 20 aminokwasów) i IgA2 (region zawiasowy ma 7 amonokwasów); IgA2 odporny na działanie proteaz bakteryjnych i wyst. w przewodzie pokarmowym
Fragmenty Fab sa bardziej do siebie zbliżone a ich ruchliwość wobec siebie jest ograniczona
IgD
Występują dość licznie wraz z IgM na powierzchni limfocytów B, które nie zetknęły się jeszcze z antygenem
Region zawiasowy ma 64 aminokwasów co pozwala na duża ruchliwośc fragmentów Fab wobec siebie
Maja udział w indukowaniu dojrzewania powinowactwa p/ciał
IgE
Maja 4 domeny w częściach stałych łańcuchów ciężkich, ale nie mają regionu zawiasowego
P/ciała te wiążąc się z odpowiednimi receptorami FcR na kom. tucznych wywołują po związaniu antygenu degranulację
IgG
Wszystkie podklasy mają region zawiasowy w IgG3 ma on 62 aminokwasy
Fragmentem Fc łączą się wszystkie klasy z białkiem G paciorkowca a klasy IgG1,2,4 z białkiem A gronkowca złocistego
Opłaszczając komórkin i czasteczki umożliwiają komórka K ich zabicie cytotoksyczność komórkowa zależna od p/ciał) a komórką żernym fagocytoze (immunofagocytoza)
Występują w surowicy w największym stężeniu
U człowieka występują w 4 podklasach
Inicjują klasyczna droge aktywacji dopełniacza
Przechodzą przez łożysko do organizmu płodu (przechodzą wszystkie podklasy)
IgM
Są syntezowane w początkowej fazie odpowiedzi immunologicznej
Sa uwalniane jako pierwsze w pierwotnej odpowiedzi immunologicznej (ale ich powinowactwo jest małe bo są przed dojrzewaniem powinowactwa)
Są pentamerami (płatek śniegu)
Efektywniej aktywują dopełniacz niż IgG
Siły elektrostatyczne
Wiązania wodorowe
Oddziaływania hydrofobowe
Siły Van der Waalsa
Rodzaje przeciwciał (humoralne, poliklonalne, monoklonalne).
Udział przeciwciał w odpowiedzi immunologicznej.
indukują zniszczenie niektórych komórek, np. nowotworowych lub zakażonych wirusami poprzez:
blokują wnikanie mikroorganizmów np. przez nabłonek jelit
blokują działanie toksyn poprzez ich wiązanie
IgA zwalczają szkodliwe działanie wirusów podczas przechodzenia do światła jelita przez zakażone enterocyty
IgG neutralizują toksynę listeriolizynę O w komórkach zakażonych przez Listeria Monocytogenes
skóra
błony śluzowe
warstwa zrogowaciałych komórek nabłonka - przepuszcza cząsteczki o odpowiednim ładunku elektrycznym;
nieustanne złuszczanie się martwych komórek;
kwaśna powłoka hydro-lipidowa - wydzielina gruczołów łojowych (wolne kwasy tłuszczowe, cholesterol, związki woskowe kwasy tłuszczowe i kwas mlekowy zapewniają niskie pH skóry oraz mają działanie grzybostatyczne i bakteriostatyczne) i potowych (woda, mocznik, kwas moczowy, NaCl, śladowe ilości: białka (np. defensyny), kwasów tłuszczowych, kwasu mlekowego, cholesterolu)
odpowiedni stopień nawodnienia - turgor;
substancja międzykomórkowa (kwas hialuronowy i chondroitynosiarkowy);
flora fizjologiczna - nieszkodliwe bakterie komensalne (zajmują miejsca wiązania na powierzchni komórek gospodarza, wydzielają różne substancje);
wyspecjalizowana tkanka limfatyczna skóry (SALT) - część układu immunologicznego.
jama ustna - nabłonek wielowarstwowy i warstwa śluzu;
ślina - zawiera lizozym (nzym bakteriobójczy);
kwas solny żołądka - niskie pH ~ 1 uniemożliwiające przeżycie drobnoustrojów
dwunastnica: gwałtowna zmiana pH
perystaltyka jelit oraz złuszczający się nabłonek;
bakteryjna flora fizjologiczna - wydzielanie bakteriocyn (np. kolicyna), substancji przeciwgrzybiczych). Naturalna konkurencja w kolonizacji.
tkanka limfatyczna związana z błonami śluzowymi, czyli MALT. Wyróżniamy: GALT, związaną z układem trawiennym, głównie z jelitami i BALT, związaną z układem oddechowym, głównie z oskrzelami.Za odporność błon śluzowych odpowiadają immunoglubuliny IgA, występujące w błonach śluzowych w postaci sekrecyjnych sIgA.
aparat rzęskowy dróg oddechowych, kichanie kaszel - zapobiegają przyczepianiu się patogenów i w sposób mechaniczny usuwają je z układu oddechowego;
wydzieliny śluzowo-surowicze - przemywanie oraz sklejanie zanieczyszczeń w pęcherzykach, które są pochłaniane przez makrofagi.
mruganie i wydzielane łzy - mechaniczne oczyszczanie;
lizozym - bakteriobójczy.
woskowina - chroni przed niektórymi bakteriami, a także grzybami i insektami.
cewka moczowa - oddawany mocz przemywa drogi moczowo-płciowe oraz zapewnia niskie pH;
pochwa - produkowana wydzielina działa bakteriobójczo, kwaśne środowisko dzięki obecności flory fizjologicznej rozkładającej glikogen do kwasu mlekowego.
mocz - działanie spłukujące, pH kwaśne
flora bakteryjna pochwy (Lactobacillus rhamnosus etc.)
sperma - aminy bakteriostatyczne, np. spermina.
C1 (C1q, C1r, C1s), C2, C3, C4, C5, C6, C7, C8, C9. Białka te były nazywane w kolejności odkrywania, dlatego cyfry arabskie przy literze "C" nie oddają kolejności udziału w reakcji dopełniacza,
Czynniki B, czynnik D, czynnik H, czynnik I - białka związane z alternatywną droga aktywacji
Inne czynniki osoczowe np..
Rozpuszczania i rozpadu (bakterioliza, cytoliza)
Chemotaksji, która polega na przemieszczaniu się komórek w kierunku wzrastającego stężenia czynnika zwanego chemotaktycznym (dotyczy głównie neutrofilów)
Degranulacji, która polega na uwolnieniu ziaren przez komórkę (dotyczy głównie komórek tucznych i bazofilów)
W warunkach fizjologicznych C1 znajduje się w formie dwóch odwracalnie łączących się ze sobą podjednostek C1q i tetrameru C1r2s2. Po związaniu przeciwciała klasy IgG (z wyjątkiem IgG4) lub IgM z antygenem na jej powierzchni są aktywowane w określonej kolejności składniki dopełniacza.
Aktywację zapoczątkowuje przyłączenie się C1q do związanej z antygenem immunoglobuliny. C1q łączy się główkami z przeciwciałami, a ogonkiem z C1r i C1s.
Zmiana konformacyjna w obrębie C1q indukuje zmianę konformacyjną w obrębie C1r, eksponując miejsce enzymatyczne o właściwościach proteinazy serynowej.
Aktywny C1r aktywuje nieczynny C1s do C1s o właściwościach proteinazy serynowej.
Aktywny C1s rozkłada C4 na C4a i C4b. C4b łączy się z błoną komórkową i wiąże C2. Kompleks C2C4b jest rozkładany na C2a i C2b.
Powstaje kompleks C4b2a, mający właściwości proteolityczne i nosi on nazwę konwertazy C3
C3b łączy się z błoną komórki docelowej.
Kompleks C4b2a ma również właściwości konwertazy C5, ale rozkłada on C5 tylko wtedy, gdy C5 związany jest z C3b (czyli gdy w błonie komórkowej w pobliżu kompleksu nagromadzi się wiele C3b).
Konwertaza C3 jest inicjującym enzymem tej drogi. Aktywuje się ona spontanicznie, w wolnym tempie, w osoczu. Podczas tej aktywacji czynnik B wiąże się w obecności Mg2+ z formą C3(H2O)
Umożliwia to czynnikowi D rozłożenie czynnika B na Bb i Ba. Powstaje C3(H2O)Bb.Następnie powstaje C3bBb, czyli ostateczna konwertaza C3 drogi alternatywnej, która rozkłada kolejne C3. Aktywacja ta podlega wzmocnieniu, gdyż produkt uwalniany w wyniku działania konwertazy C3 - C3b- jest podjednostką konwertazy.
Podobnie jak w drodze klasycznej C3b związany z jakąś powierzchnią wiąże C5, co umożliwia kompleksowi C3bBb (czyli konwertazie C5) rozłożenie C5.
W wyniku działania konwertazy C5 powstaje C5b, który przyłącza kolejno składniki: C6, C7, C8, C9.
Od momentu przyłączenia C8 zaczyna tworzenie się kanałów w błonie komórkowej.
Cząsteczki dopełniacza tworzą kanały, zwracając się fragmentami hydrofilowymi do wnętrza kanału, a hydrofobowymi na zewnątrz.
Kompleks C5b678 wiąże i polimeryzuje kilka cząsteczek C9 oraz ułatwia wbudowanie w błonę, zwiększając średnicę kanału.
Przyłączenie C8 i C9 nadaje kompleksowi zdolność uszkadzania błony komórkowej, dlatego kompleks C5b6789 nazywamy kompleksem atakującym błonę - MAC (membrane attacking complex). Wbudowywanie się kompleksów w błonę powoduje reorientację znajdujących się w niej lipidów i deformację błony, a nawet uwalnianie się pęcherzyków fosfolipidowych. Przez kanały wpływają z komórki jony, np. potasowe i makromolekuły, np. ATP. Inne jony, woda, lizozym, wpływają do komórki.
Korzystna dla organizmu gospodarza:
Opsonizacja (opłaszczenia komórek lub cząsteczek składowymi białek dopełniacza), ułatwia fagocytozę (uczestniczą tu cząsteczki C3b, C4b)
Chemotaksja i aktywacja komórek żernych (C3a i C5a)
Liza komórek bakteryjnych oraz zakażonych komórek gospodarza
Usuwanie kompleksów immunologicznych
Eeliminacja komórek apoptotycznych
Szkodliwa dla gospodarza:
Stan zapalny (przewlekły)
Wstrząs
Rozpoznanie przez komórkę żerną odpowiednimi receptorami cząsteczki lub komórki, która ma ulec fagocytozie poprzez:
bezpośrednio określone struktury w ścianie bakterii
czynniki opłaszczające komórkę bakteryjną i ułatwiające fagocytozę, czyli tzw. OPSONINY (przeciwciała i składniki dopełniacza). Indukowana przez nie fagocytoza nosi nazwę IMMUNOFAGOCYTOZY!!!
Otoczenie jej wypustkami cytoplazmatycznymi komórki żernej.
Powstanie fagosomu pierwotnego - obniżenie zjadliwości drobnoustroju poprzez wydzielane przez komórkę fagocytującą wolne rodniki szeregu tlenowego.
Powstanie fagosomu wtórnego poprzez fuzję fagosomu pierwotnego z lizosomem - śmierć komórki (niszczenie enzymami lizosomalnymi)
Powstanie niepatogennych ciałek resztkowych i determinanty antygenowej, która będzie prezentowana limfocytom T i służyła do produkcji przeciwciał
indukują fagocytozę
aktywują komórki, np. do cytotoksyczności komórkowej zależnej od przeciwciał (ADCC) - receptory te mają w swej części wewnątrzkomórkowej aktywujące sekwencje ITAM (immunoreceptor tyrosine-based activation motifs), przekazujące sygnały.
biorą udział w regulacji odpowiedzi immunologicznej oraz prezentacji antygenów po związaniu kompleksów immunologicznych indukują wydzielenie z neutrofilów, monocytów i płytek krwi mediatorów reakcji zapalnej, np. IL-1, IL-6 i TNF
nadają mającym je komórkom zdolność do ADCC
w rzadkich sytuacjach mogą stać się wrotami zakażenia makrofagów
pełnią również negatywną rolę w chorobach autoimmunizacyjnych, w których przeciwciała przeciw określonym komórkom organizmu spłaszczają je i indukują niszczenie tych komórek za pośrednictwem FcγR komórek żernych
FcεRI to receptor o dużym powinowactwie do Fc IgE, wiąże wolne IgE, indukuje uwolnienie z komórek tucznych i bazofilów mediatorów reakcji alergicznej
FcεRII ma małe powinowactwo do Fc IgE; obecny jest na ponad 90% limfocytów B mających receptory immunoglobulinozewnątrzkomórkowe CD23; może indukować fagocytozę cząsteczek opłaszczonych przeciwciałami IgE; bierze udział w regulacji odpowiedzi humoralnej w zakresie przeciwciał IgE i aktywuje limfocyty B
pIgR - receptor dla polimerycznych form immunoglobulin, obecny na podstawnej i bocznej powierzchni komórek nabłonka jelitowego, który przenosi wydzielnicze IgA poprzez te komórki na drodze transcytozy do światła jelita.
najważniejsze znaczenie w fagocytozie ma CR1 i CR3; wiążą one cząsteczki lub komórki odpowiednim składnikiem dopełniacza, ale na ogół nie indukują procesu fagocytozy (dopiero, gdy komórka otrzyma odpowiedni sygnał aktywujący)
niektóre bakterie mogą być fagocytowane za pośrednictwem CR bez udziału przeciwciał
aktywacja oksydazy NADPH (kompleksu cząsteczek przenoszącego elektrony)
przemieszczenie elektronu z NADPH na tlen cząsteczkowy
powstawanie nadtlenku wodoru z anionu ponadtlenkowego w wyniku dysmutacji (część H2O2 jest redukowana do O2 i H2O przez katalazę)
z udziałem jonów żelazowych powstają rodniki hydroksylowe (.OH), a także tlen singletowy (1O2):
W reakcji katalizowanej przez mieloperoksydazę powstaje kwas podchlorawy - HOCl o właściwościach bakteriobójczych (eozynofile zawierają peroksydazę, która katalizuje powstanie kwasu podbromawego HOBr)
W wyniku reakcji kwasu podchlorawego z aminami powstają chloraminy
wiąże się z zewnętrzną błoną wrażliwych bakterii i zwiększa jej przepuszczalność dla cząsteczek hydrofobowych
aktywuje bakteryjne enzymy rozkładające fosfolipidy i peptydoglikany
opsonizacja
neutralizuje i hamuje aktywność endotoksyny
glikoproteina występująca w ziarnach azurofilnych neutrofilów człowieka oraz monocytach i komórkach tucznych
zabija bakterie G+ np. Staph. aureus, Strep. faecalis i niektóre bakterie G- oraz grzyby
uwrażliwia niektóre bakterie na lizozym
działa synergistycznie z elastazą na E. coli
jest proteazą, ale jej główne działanie jest chemotaktyczne na monocyty i limfocyty
małe, obejmujące 29-34 aminokwasów peptydy obecne w ziarnach azurofilnychneutrofilów, skąd przechodzą do fagolizosomów
to PEPTYDOWE ANTYBIOTYKI będące elementem obrony przeciwzakaźnej, których mechanizm działania polega na uszkadzaniu i wytwarzaniu kanałów w błonie komórkowej zabijanych mikroorganizmów
peptydy kationowe o działaniu podobnym do defensyn
wytwarzane przez neutrofile i magazynowane w ich ziarnach swoistych
tylko 1 u człowieka - hCAP18, z której w wyniku działania elastazy uwalniany jest aktywny peptyd LL-37 o właściwościach bakteriobójczych
białko kationowe o działaniu litycznym w stosunku do bakterii
obecny w ziarnach azurofilnych i swoistych neutrofilów, monocytów i makrofagów, osoczu krwi, łzach, ślinie i wydzielinach śluzowo- surowiczych dróg oddechowych
działanie: przecina wiązanie Beta-1,4- glikozydowe między kwasem N-acetylomuraminowym i N-acetyloglukozaminą w ścianie bakterii
α i β - powstają nie tylko w wyniku zakażeń komórek przez wirusy. Ich synteza indukowana jest także przez: endotoksynę, syntetyczne polimery (np. kopolimer piranu), polisacharydy, polinukleotydy (np. kwas polilizynocytydylowy), kontakt z niektórymi bakteriami i pierwotniakami. Ich ekspresja jest też stymulowana przez cytokiny, wytwarzane w trakcie odpowiedzi immunologicznej: IL-1, IL-2, TNF. Głównym źródłem interferonu α w krwi obwodowej są niedojrzałe komórki dendrytyczne-wytwarzają 1000-krotnie więcej tego interferonu, niż inne leukocyty.
γ - produkowany przez limfocyty T i komórki NK stymulowane: IL-2, IL-12, IL-15, IL-18, IL-21
Działanie przeciwwirusowe- nie wykazują bezpośredniego działania przeciwwirusowego, ale wytworzone pod wpływem działania wirusów stymulują inne komórki do produkcji czynników przeciwwirusowych;
pobudzają syntezę syntetazy oligoizoadenylanowej - wiele enzymów o podobnych właściwościach. W obecności dwuniciowego RNA indukują one powstanie oligonukleotydów adenylanowych, określanych jako 2'-5'-oligoA. Te z kolei aktywują latentną endorybonukleazę (RNazę L). Działa ona zarówno na wirusowy, jak i komórkowy jednoniciowy RNA
aktywują kinazę białkową R - ulega ona autofosforylacji i fosforyluje podjednostkę α czynnika inicjującego syntezę białka, poza tym fosforyluje także inne białka komórkowe. Rezultatem jest zahamowanie translacji i syntezy białek wirusowych. Działa tylko w obecności dwuniciowego RNA, jest więc aktywowana tylko przez niektóre wirusy.
Aktywują ekspresję genu Mx- obecny w komórkach wszystkich ssaków; produkt tego genu hamuje replikację wirusa grypy i niektórych innych wirusów RNA
Aktywują ekspresję kilku izoform deaminazy adenozynowej - dezaminują one adenozyny w obrębie dwuniciowego RNA (obecny tylko u niektórych wirusów) w efekcie powstają inozyny zamist adenozyn i RNA staje się niefunkcjonalny.
Do innych mechanizmów wywołanych przez interferony należą: hamowanie wiązania się wirusów z komórkami, hamowanie penetracji oraz uwalniania nukleokapsydu z otoczki.
Wzmożoną degradację wirusowego mRNA
Hamowanie inicjacji syntezy łańcucha białkowego
Hamowanie wydłużania łańcucha białkowego
Wpływ na układ odpornościowy- działanie to polega na:
nasilaniu cytotoksyczności (limfocyty T cytotoksyczne, komórki K, komórki NK)
wzmaganiu ekspresji cząsteczek i receptorów powierzchniowych (CD80, FcR)
wzmaganiu ekspresji cząsteczek głównego układu zgodności tkankowej(wszystkie interferony wzmagają ekspresję MHC I, a INF- γ dodatkowo MHC II; nasila to prezentację antygenów limfocytom T, zwiększa również syntezę antygenów związanych nowotworowo, sprawiając, że są one łatwiejsze do rozpoznania i zniszczenia przez układ immunologiczny).
aktywacji makrofagów (cytotoksyczność, fagocytoza)
wzmaganiu fagocytozy
indukcji ekspresji cytokin (IL-1, IL-6, TNF, IP10, MIG)
Wpływ na proliferację i różnicowanie komórek
Zastosowanie terapeutryczne
białaczki włochatokomórkowej
przewlekłej białaczki szpikowej
mięsaka Kaposiego
szpiczaka
czerniaka złośliwego
raka nerki
kłykcin kończystych
raka pęcherza
raka jajnika
Bezpośrednie- hamowanie proliferacji i pobudzanie różnicowania komórek nowotworowych lub rzadziej bezpośrednie oddziaływanie cytotoksyczne na te komórki.
Pośrednie - zależy od zwiększonej ekspresji antygenów nowotworowych, hamowania powstawania naczyń nowotworowych oraz od wpływu interferonów na układ immunologiczny (aktywacja mechanizmów cytotoksycznych, wzmożona produkcja cytokin)
fragmenty C5a i C3a uwalniane w trakcie aktywacji dopełniacza (C5a wraz z FMLP i chemokiny należą do najefektywniejszych)
formylowane peptydy np. N-formylometionyloleucynofenyloalanina (FMLP) uwalniane przez bakterie
defensyny wytwarzane przez komórki nabłonkowe i neutrofile
IL-1, TNF, TGF-β a przede wszystkim IL-8 i inne cytokiny z grupy chemokin
leukotrien LTB4 i czynnik aktywujący płytki (PAF) uwalniane przez różne komórki
czynniki uwalniane przez limfocyty T np. fotoksyny
Tufisyna -tetrapeptyd powstały w wyniku proteolizy łańcucha ciężkiego immunoglobulin
Białko C - reaktywne
Alfa-trombina
Kalikreina
Galektyny
Fragmenty włóknika
Nabywania wzmożonych właściwości cytotoksycznych (bakteriobójczych, przeciwpasożytniczych)
Zwiększania ekspresji enzymów i innych białek cytotoksycznych
Powiększenia komórki
Pojawienia się pofałdowań błony komórkowej
Wysuwania licznych pseudopodiów
Przemiany metaboliczne
Właściwości bakteriobójcze
Cytotoksyczność wobec komórek nowotworowych
Prezentacja antygenów limfocytom T
Fagocytoza
Pinocytoza
Przyleganie do podłoża
Zawartość enzymów w lizosomach
Wydzielenie czynników i cytokin
TGF-β
Prostaglandynę E2
IL-10
Rozpoznanie (komórki żerne poprzez receptory mogą rozpoznać albo bezpośrednio określone struktury ściany albo pewne czynniki opłaszczające komórkę bakteryjną )
Związanie przez komórkę żerną cząsteczki lub komórki, która ma ulec fagocytozie
Otoczenie komórki lub cząsteczki przez wypustki cytoplazmatyczne komórki żernej
Przeciwciała (IgG są najefektywniejszymi opsoninami)
Składniki dopełniacza
Białko C-reaktywne (które wiąże wielocukry na bakteriach gram+)
Białko wiążące LPS - w ścianie bakterii gram-
Kolektyny np. białko wiążące mannozę obecną na bakteriach, grzybach i wirusach , białko A i D surfaktantu płucnego oraz konglutynina
Mechanizmy tlenowe
Aktywację oksydazy NADPH
Katalizowane przez NADPH powstanie anionu ponadtlenkowego
Powstanie z anionu ponadtlenkowego nadtlenku wodoru
Powstanie przy udziale jonów żelazawych rodników hydroksylowych i tlenu sigletowego(najaktywniejsze związki)
Powstanie kwasu podchlorawego w reakcji katalizowanej przez mieloperoksydazę
Powstanie chloraminy w wyniku reakcji kwasu podchlorawego z aminami
Mechanizmy beztlenowe
Lizozym (Występuje w osoczu krwi, ślinie, łzach i wydzielinach ślinowo-wydzielniczych, rozkłada wiązanie β-1,4-glikozydowe między kwasem N-acylomuraminowym a N-acyloglukozaminą)
BPI (czynnik bakteriobójczy zwiększający przepuszczalność)
Katepsyna G
Defensyny (peptydowe antybiotyki)
Laktoferyna
MBP (główne białko zasadowe)
Azurocydyna
Elastaza, kolagenaza
Proteaza 3
zaleznej od uwalniania perforyny, granzymow i granulizyny
zaleznej od interakcji czasteczki nadrodziny TNF w blonie eżektorowej i czasteczek z nadrodziny TNFR w blonie komorki docelowej .
niektóre limfocyty T posiadają receptor TCR złożony z heterodimeru łańcuchów gamma i delta.
komórki dendrytyczne - pochodzenia szpikowego. Wśród komórek dendrytycznych człowieka można wyróznic tak zwane mieloidalne i limfoidalne komórki dendrytyczne.
limfocyty B - prezentują antygen głównie po to by uzyska pomoc od limfocytów T w wytwarzaniu przeciwciał. Ich zdolnośc do prezentacji antygenów usprawnia odpowiedź humoralną. W narządach limfatycznych , gdzie kontaktują się oba typy limfocytów, limfocyt B prezentujący antygen limfocytowi T jest wystawiony w zamian na duże stężenie cytokin wytwarzanych przez limfocyty T. Cytokiny te są elementem pomocy. Ważną rolę odgrywają również sygnały pomocnicze otrzymywane przez limfocyt B przez cząstki kostymulujące. Limfocyt B może prezentowac każdy antygen, ale najskuteczniej prezentuje te, które rozpoznawane są przez jego immunoglobuliny powierzchniowe (BCR). Komórka ta jest zaangażowana głównie w prezentację antygenów, przeciw którym przy pomocy limfocytów Th będzie wytwarzała przeciwciała.
Makrofagi - na ogół nie mają cząsteczek MHC klasy II, ale syntezują je w trakcie aktywacji pod wpływem interferonu gamma. Wyposażone w lizosomy w pełni niszczą fagocytowany materiał. Odgrywają ważną rolę w prezentowaniu antygenów dużych fagocytowanych komórek lub bakterii; pochłaniają znaczną częśc kompleksów immunologicznch.
Inne komórki prezentujące antygen - monocyty, neutrofile, komórki śródbłonka,enterocyty, keratynocyty, chondrocyty, komórki mezangium, astrocyty, oligodendrocyty, komórki nabłonkowe tarczycy, komórki nabłonkowe kanalików nerkowych,, komórki nabłonkowe pęcherzyków gruczołu sutkowego, komórki nabłonkowe dróg żółciowych i pobudzone limfocyty T. Wiele z tych komórek nie posiada MHC II ale może je syntetyzowac pod wpływem interferonu gamma.
Aktywacja limfocytu B. w czasie aktywacji dochodzi do czasowego wytwarzania IgM (chyba, że jest to limfocyt B pamięci IgE+ - wtedy komórki takie od razu przekształcają się w komórki plazmatyczne i produkują przeciwciała) i - po przełączeniu klas - do wytwarzania przeciwciał klasy IgE. Przełączenie klas odbywać się może bezpośrednio: IgM->IgE lub dwuetapowo IgM-> IgG4 i IgG4->IgE. W procesie tym niezbędne jest uzyskanie przez limfocyt B określonych sygnałów:
Przyłączenie do limfocytu antygenu z udziałem immunoglobulinowych receptorów powierzchniowych BCR
Przekazanie sygnału poprzez IL-4 lub IL-13. Prowadzą one do powstania w limfocycie czynnika transkrypcyjnego STAT6. Niezbędna jest również interakcja cząsteczki CD40 z ligandem CD40L obecnym na limfocycie T CD4+
proliferacja i przekształcenie się limfocytów B IgE+ (ukierunkowanych) w komórki plazmatyczne.
hamują uwalnianie rozpuszczalnej formy receptora FcεRII po związaniu z nim IgE lub kompleksu IgE z antygenem
blokowanie wiązania się sFcεRII z CD21 na limfocycie B
hamowanie wydzielania IgE przez limfocyt T po związaniu się kompleksu antygen-IgE z receptorem FcεRIIb
poprzez związanie antygenu przez przeciwciała IgE połączone z błoną komórkową ( za pośrednictwem FcεRI)
z pominięciem mechanizmów immunologicznych ( niezależne od udziału antygenu-alergenu). Są to np. przeciwciała anty-IgE, przeciwciała przeciwko receptorowi FcεRI, morfina, ATP, neurotensyna.
mediatory perforowane - magazynowane w ziarnach
aminy biogenne. Wyróżniamy tutaj serotoninę (nie występuje w kom tucznych człowieka) i histaminę. Histamina jest jednym z najważniejszych mediatorów procesu zapalnego. Powoduje ona zwiększoną przepuszczalność naczyń krwionośnych (powstanie obrzęku w reakcji natychmiastowej), skurcz mięśni gładkich w drzewie oskrzelowym, nasila wydzielanie innych mediatorów (m.in. prostaglandyn), działa chemotaktycznie na komórki, takie jak eozynofile. Po dostaniu się dużej ilości histaminy do krwi (masywna degranulację kom tucznych i bazofilów) mogą wystąpić objawy ogólnoustrojowe - spadek ciśnienia, przyśpieszenie akcji serca, zaczerwienienie skóry, w skrajnej postaci prowadzić to może do wstrząsu anafilaktycznego.
Proteoglikany. Wyróżniamy dwa typy proteoglikanów: zawierające heparynę lub siarczan chondroityny. Heparyna ma słabe właściwości antykoagulacyjne. Proteoglikany tworzą „rusztowanie” dla innych mediatorów, jak histamina i proteazy serynowe.
Naturalne proteazy serynowe
Czynniki chemotaktyczne są to peptydy o różnej masie cząstkowej, które stanowią czynniki chemotaktyczne dla neutrofilów i eozynofilów
TNF i IL-4 TNF indukuje miejscowo stan zapalny
Mediatory generowane należą tutaj metabolity kwasu arachidonowego ( prostaglandyny i leukotrieny) oraz czynnik aktywujący płytki.
Cytokiny
ADCC
Działanie dopełniacza - utworzenie MAC (kompleks atakujący błonę)
reakcje potransfuzyjne - następują po przetoczeniu krwi niezgodnej w układzie AB0. Dochodzi tutaj do wewnątrznaczyniowego niszczenia przetaczanych erytrocytów w wyniku ADCC i działalności dopełniacza.
cytopenie polekowe - lek lub jego zanieczyszczenia mogą osadzać się na powierzchni krwinek lub łączyć się z białkami ich błony komórkowej. Prowadzi to do wytwarzania swoistych przeciwciał i przy długotrwałym stosowaniu leku do uszkodzenia komórek szpiku i krwi. Do takich leków zaliczmy: sulfonamidy, piramidon, fenacetyna. Objawami tych reakcji są granulocytopenia, trombocytopenia, niedokrwistość hemolityczna.
konflikt serologiczny - niezgodność w zakresie układu Rh, gdy matka ma krew grupy Rh-, a płód Rh+. Własne erytrocyty płodu niszczone są przez matczyne przeciwciała klasy IgG, które przechodzą do płodu przez łożysko. Indukcja pierwotnej odpowiedzi na antygen D wynika z przedostania się krwi Rh+ do krwiobiegu matki. Jeśli w następnej ciąży płód jest Rh+, to jego erytrocyty będą niszczone. Aby tego uniknąć podaje się matce przeciwciała anty-D do 48 h po urodzeniu dziecka, w celu neutralizacji erytrocytów płodu.
ziarniniaki - w przewlekłym zakażeniu prątkami gruźlicy
niewielkie nacieki z duża ilością bazofilów - reakcja Jonesa-Mote'a .
Naturalną (autotolerancja) - względem antygenów własnego organizmu (autoantygenów), przeciwciała nie atakują własnych białek. Brak tej tolerancji prowadzi do chorób autoimmunizacyjnych.
Sztuczną (indukowana, nabyta) - powstaje na skutek różnych działań modyfikujących funkcje układu odpornościowego, ma głównie zastosowanie w leczeniu potransplantacyjnym, przeciwalergicznym.
czynniki endogenne
geny głównego układu zgodności tkankowej - to jakie epitopy będą prezentowane przez cząsteczki MHC decyduje o tym, czy autoreaktywne limfocyty zostaną usunięte w grasicy i czy zostaną utworzone regulatorowe swoiste dla danego antygenu. Może zostać zaprezentowany antygen podobny do antygenu wirusa, który zaatakował organizm - choroba autoimmunizacyjna. Najsilniejszy związek dla MHC II.
inne geny - brak genu, np. dla składników dopełniacza powoduje toczeń (choroba powstaje na skutek nagromadzenia ciałek apoptotycznych), mutacja w obrębie genu dla DNadzy powoduje nagromadzenie materiału genetycznego. Poziom ekspresji danego antygenu w grasicy warunkuje, czy na obwód nie dostaną się limfocyty wysokoreaktywne. Mutacja genu będącego czynnikiem transkrypcyjnym dla innych genów też może być przyczyną chorób autoimmunizacyjnych.
Nadprodukcja cytokin - dotyczy IL-12 (aktywująca Th1), IL-15, IL-18
Hormony płciowe - estrogeny i progesteron w małych stężeniach mogą nasilać wytwarzanie IFN-γ, promując odpowiedź Th1 (w dużym stężeniu działają immunosupresyjnie - stąd kobiety ciężarne chore na stwardnienie rozsiane obserwują poprawę)
Zaburzenia apoptozy - np. w wyniku zmniejszonej ekspresji genu Fas. Ten czynnik wpływa głównie na zwiększone ryzyko rozwoju tocznia.
Czynniki egzogenne
uraz - złamanie mechanicznej sekwestracji, np. w wyniku urazu fizycznego, termicznego, zapalenia. Autoantygeny wydostają się poza istniejącą barierę i prowadzi to do odpowiedzi autoimmunologicznej.
Infekcje wirusowe i bakteryjne - teoria molekularnej mimikry - zakażenie wirusem lub bakterią mającą podobne epitopy do antygenów gospodarza może prowadzić do aktywacji limfocytów autoreaktywnych., np. w gorączce reumatyczne aktywowane są limfocyty swoiste wobec antygenów paciorkowca, m.in. antygenu M5 bardzo podobnego do białka w zastawkach serca. Drobnoustroje mają też działanie adiuwantowe aktywujące mechanizmy odpowiedzi nieswoistej
Immunostymulatory bakteryjne i izolowane z grzybów
BCG - atenuowany szczep prątka bydlęcego gruźlicy; aktywuje odpowiedź immunologiczną (makrofagi i monocyty); stosowany w leczeniu raka pęcherza moczowego u chorego nie zakażonego wirusem HPV.
dipeptyd muramylowy(MDP) - składnik ścian bakterii z rodzaju Mycobacterium; do leczenia zakażeń bakteryjnych; zwiększa nieswoiście odporność na zakażenia bakteryjne, grzybicze i pasożytnicze; skutki uboczne: senność, gorączka, wymioty.
preparaty zawierające zabite bakterie :OK-432 (Picibanil) - zawiera bakterie z rodzaju Streptococcus; aktywuje komórki NK, makrofagi; przyspiesza odnowę krwiotworzenia po napromieniowaniu; stosowany w leczeniu nowotworów.
lipopolisacharyd (LPS) - składnik ściany komórkowej bakterii G(-); czynny immunologicznie. Aktywuje kom. B, CD14, immunofagocytoze.
preparaty izolowane z grzybów - polisacharydy :
Lentinan - indukcja aktywności przeciwnowotworowej makrofagów- aktywacja wydzielania IL-1
β- glukan - stosowany w onkologii, aktywuje jednojądrzaste komórki żerne
Bestatyna - dipeptyd; aktywuje makrofagi, komórki NK, pełny zakres obrony:
Syntetyczne związki inicjujące działanie elementów bakterii i wirusów
oligonukleotydy zawierające niemetylowane sekwencje CpG
sekwencje CpG to DNA bakterii, owadów, pasożytów
motywy CpG są rozpoznawane przez receptory TLR 9 znajdujące się w kom. żernych, dendrytycznych, limfocytów B, silnie aktywując te komórki
następuje indukcja odpowiedzi immunologicznej swoistej regulowanej przez limfocyty Th1
aktywację właściwości żernych
zdolność wytworzenia cytokin, NO, reaktywnych rodników tlenowych przez kom. żerne
indukują dojrzewanie kom. dendrytycznych
wzrost aktywności prezentacji antygenu
aktywacja limfocytów B, kom. NK, wytwarzanie IFN-γ
polinukleotydy - zbudowane są z 2 nici nukleotydów, inicjujące dwuniciowy RNA wirusów; stymuluja kom. NK i wydzielają IFN; preparaty: poli J i C (zawierające inozynę i cytydynę) i poli A i U( zawierające adenozynę i urydynę).
Małocząsteczkowe immunostymulatory syntetyczne.
Naturalne (endogenne) stymulatory odpowiedzi immunologicznej.
cytokiny - stosowane w onkologii (w leczeniu uzupełniającym), chorobach zakaźnych i chorobach autoimmunizacjnych; najważniejsze cytokiny: IL-2, IFN, chemokiny, GM-CSF który stymuluje powstawanie granulocytów i makrofagów, indukuje odnowę szpiku
hormony grasicy - tymozyna, tymulina, tymopoetyna; odpowiedzialne za dojrzewanie limf. T; stosowane w leczeniu chłoniaków i WZW typu B
preparaty immunoglobulinowe - stosowane w niektórych chorobach autoimmunizacyjnych np.: małopłytkowości, stwardnieniu rozsianym, działają jak przeciwciała antyidiotypowe.
Immunostymulatory bakteryjne i preparaty naśladujące ich działanie:
BCG (atentowany szczep prątka bydlęcego gruźlicy stosowany jako szczepionka przeciwko gruźlicy u człowieka); właściwości immunostymulujące- wzmaga u gryzoni odporność na rozwój przeszczepialnych nowotworów (dzięki aktywacji monocytów i makrofagów); u człowieka stosuje się w leczeniu raka pęcherza moczowego; w onkologii jako adiuwant w terapii „szczepionkami” nowotworowymi; inne preparaty bakteryjne o właściwościach immunostymulujących i cechach adiuwantów to np. Bordatella pertussis, Listeria monocytogenes.
Dipeptyd muramylowy (MDP- najprostszy składnik ściany bakterii z rodzaju Mycobacterium o właściwościach adiuwantowych); zwiększa nieswoiście odporność na zakażenia bakteryjne, grzybicze i pasożytnicze, wywołując jednak objawy uboczne, m.in. gorączkę i senność; MDP i pochodne (murabutyd, MDP-GDP, MTP-PE) stymulują chemotaksję makrofagów, ich właściwości fagocytarne, aktywność przeciwnowotworową oraz zdolność do wydzielania cytokin (np. IL-1, IL-6, TNF-ɣ).
Oligonukleotydy zawierające niemetylowane sekwencje CpG:
Polinukleotydy (związki syntetyczne, zbudowane z dwóch nici nukleotydów); imitują dwuniciowy RNA wirusów; ich działanie polega na stymulacji wydzielania interferonów przez różne komórki układu odpornościowego oraz na aktywowaniu komórek NK; najbardziej znane to poli I:C i Poli A:U- związki o dużej toksyczności; zmodyfikowany poli I:C to preparat Ampligen testowany w leczeniu AIDS.
Lipopolisacharydy (główny immunologicznie czynny element strukturalny ściany komórkowej bakterii); za właściwości immunostymulujące odpowiada lipid A wchodzący w skład LPS; LPS działa nieswoiście na limfocyty B- jako poliklonalny mitogen oraz na makrofagi i słabo na limfocyty T; zastosowanie LPS in vivo wywołuje często objawy toksyczne (gorączka, objawy grypopodobne, spadek ciśnienia tętniczego).
Inne immunostymulatory bakteryjne (preparaty zawierające zabite bakterie, ich lizaty lub elementy bakteryjne); stosowane jako nieswoiste szczepionki w celu wzmożenia odporności w nawracających lub przewlekłych zakażeniach o różnej etiologii; przykłady preparatów: Biostim, Esberitox, Luivac; najbardziej znany- Picibanil (OK.-432), zawiera bakterie z rodzaju Streptococcus, aktywuje komórki NK, makrofagi, przyspiesza odnowę krwi otworzenia po napromieniowaniu, ma właściwości adiuwantowi.
Immunostymulatory izolowane z grzybów:
To preparaty zawierające składniki grzybów (głównie polisacharydy) o działaniu immunostymulacyjnym.
Najbardziej znany- lentinan- wyizolowany z grzyba Lentinus edodes, indukuje aktywność przeciwnowotworową makrofagów i zdolność do wydzielania przez nie cytokin, zwiększa aktywność komórek NK.
Inne: β-glukan- aktywuje układ jednojądrzastych komórek żernych; schizofylan; Krestin (PSK).
Probiotyki:
To żywe mikroorganizmy wywierające korzystny wpływ na organizm poprzez poprawę równowagi mikroflory jelitowej.
Najczęściej stosowane- pałeczki kwasu mlekowego- Lactobacilli i Bifidobacteria (obecne np. w jogurtach).
Ich korzystny efekt wynika z: konkurowania z bakteriami patogennymi o receptory na komórkach nabłonkowych, wytwarzania związków o działaniu przeciwbakteryjnym i p-wirusowym, współzawodniczenia z patogenami o składniki odżywcze, zakwaszania treści jelitowej, przez co hamowany jest wzrost niektórych bakterii chorobotwórczych, wzmacniania mechanizmów odporności w obrębie błon śluzowych.
Korzystny efekt w leczeniu i zapobieganiu biegunkom infekcyjnym oraz w zapobieganiu biegunkom poantybiotykowym.
Immunomodulatory syntetyczne o małej masie cząsteczkowej:
Lewamizol- stosowany w połączeniu z 5-fluorouracylem (5-FU) u pacjentów po resekcji raka okrężnicy; wpływa na mechanizmy odpowiedzi typu komórkowego: makrofagi, neutrofile i limfocyty T; wzmaga chemotaksję, przyleganie makrofagów i neutrofilów, aktywuje ich zdolność do fagocytozy i mechanizmy cytotoksyczne.
Cymetydyna- lek blokujący receptory H2 dla histaminy, używany w leczeniu choroby wrzodowej żołądka i dwunastnicy; nasila odpowiedź humoralną i zdolność wytwarzania IL-2 przez limfocyty T, wzmaga ekspresję cytokin w guzie, osłabia hamujący wpływ histaminy na chemotaksję neutrofilów.
Inozyna pranobeks- słabe działanie immunostymulujące; indukuje różnicowanie i aktywację limfocytów T, stymuluje makrofagi i komórki NK, działa przeciwwirusowo; lek mało toksyczny, stosowany w leczeniu np. opryszczki, WZW typu B, odry, zapalenia mózgu.
Retinoidy- pod względem budowy pokrewne witaminie A; w onkologii stosowane w leczeniu ostrej białaczki promielocytowej.
Talidomid- właściwości immunomodulujące: hamuje wytwarzanie TNF, ko stymuluje limfocyty CD8+, wzmaga aktywność komórek NK, hamuje angiogenezę (powstawanie nowych naczyń krwionośnych); w niektórych krajach dopuszczony do leczenia postaci lepromatycznej trądu; u pacjentów z AIDS: indukuje regresję mięsaka Kaposiego, przyspiesza gojenie aftowych owrzodzeń jamy ustnej, zmniejsza objawy kacheksji.
Inne związki: 1.kwas acetylosalicylowy (lek przeciwzapalny i p-gorączkowy, zmniejsza wydzielanie IL-4 przez limfocyty T CD4+); 2.lowastatyna (obniża stężenie cholesterolu we krwi, zmniejsza ekspresję MHC klasy II na komórkach śródbłonka i makrofagach przez co zmniejszają one stan zapalny w obrębie naczyń krwionośnych); 3.salbutamol (działa rozkurczająco na oskrzela, hamuje wytwarzanie IL-12 i TNF przez makrofagi, łagodzi w ten sposób stan zapalny); 4.cyklofosfamid (działanie immunosupresyjne i cytostatyczne, może także działać immunostymulująco- przed podaniem szczepionki nowotworowej wzmaga reakcje immunologiczne w stosunku do antygenów nowotworowych).
Szczepionki swoiste
Szczepionki nieswoiste
Adiuwanty
BCG jako najważniejszy adiuwant bakteryjny
Picibanil
Dipeptyd muramylowy
Niemetylowane sekwencje CpG
LPS
Preparaty izolowane z grzybów:
Cytokiny
Interferony: wzrost odporności na zakażenia wirusowe; alfa-interferon wykazuje właściwości przeciwnowotworowe; beta-INF w leczeniu stwardnienia rozsianego, mononukleozy (przewlekłe zakażenie EBV); gamma-INF w chorobie ziarniniakowej w celu zmniejszenia infekcji, powoduje wzrost aktywności kom. żernych
IL-2 (rekombinowana o nazwie Aldesleukin): wzmaga proliferację limfocytów T i aktywność limfocytów Tc stymuluje komórki NK, nasila uwalnianie innych cytokin (m.in. INF-gamma, TNF, IL-1)
Czynniki stymulujące wzrost kolonii:
Hormony grasicy: tyrozyna, tymulina, tymopentyna
Preparaty immunoglobulinowe
Lewamizol (Decaris) - w małych dawkach pobudza komórkową odpowiedź immunologiczną (stymulacja odp. kom., wzrost aktywności makrofagów, limfocytów T); stos. jako adiuvant w połączeniu z 5-fluorouracylem w raku jelita grubego (po resekcji guza)
Inozyny pranobeks (Groprinosin) - aktywacja limfocytów, indukcja różnicowania i stymulacja kom. NK - dział. p-wirusowe
Cimetydyna (Altramet) - broker receptorów H2, dodatkowe działania immunostymulujące: nasila zdolność produkcji IL-2 przez limfocyty, wpływa na limfocyty Ts
Takrolimus (Prograf) - hamuje limfocyty T oraz wytwarzanie cytokin (zwłaszcza IL-2, IL-4) i kom. dendrytyczne; stos. w profilaktyce odrzucania przeszczepów nerek i wątroby i in.
Sirolimus (Rapamycyna / Rapamune) - hamowanie profileracji limf.T i B
Mykofenolan mofetilu (CellCept) i sodu (Myfortic)
Immunosupresja farmakologiczna - zastosowanie kliniczne.
*TGF B
* wzrost proliferacji Th2
autologiczny (autograft)- w obrębie 1 osobnika (bliźniaki monozygotyczne, zwierzęta szczepu wsobnego)
izogeniczny - synergiczne osobniki (izograft - bliźniaki jednojajowe)
allogeniczne - ten sam gatunek, różnica genetyczna
ksenogeniczne - różne gatunki.
ortotropowe - to samo miejsce
heterotropowe - miejsce autonomicznie odmienne.
główny MHC I - dziedziczenie wg praw Mendla; loci A, B, C.
MHC II - loci R, DQ, DB.
Składniki dopełniacza C2, C4 i czynnik B
Produkt protoonkogenu Notch 4
21-hydroksylaza steroidowi CYP 21 B (synteza sterydów - mineralo- i glikokortykosterydów)
receptor dla produktów glikozylacji
czynnik transkrypcyjny macierzy komórkowej
jądrowa kineza serynowo - tyreoinowa.
Czynne antygeny - molekuły układu MHC
Liczba klonów limfocytów T odpowiadających na obce cząsteczki MHC jest 100 x większa niż na inne Ag białkowe
Przyczyna - tylko kombinacje MHC-peptyd są rozpoznawane przez kom. T a mnogość peptydów rzutuje na liczbę pobudzonych klonów kom. T („puste” MHC nie są rozpoznawane)
Prezentacja bezpośrednia - przez APC dawcy obecne w przeszczepie.
Prezentacja pośrednia - przez APC biorcy
APC biorcy mogą wnikać do przeszczepu lub prezentować alloantygeny uzyskane na drodze krwi
Jest częstsza niż bezpośrednia, zwłaszcza gdy w przeszczepie nie ma kom. APC dawcy lub gdy brak jest w nim antygenów MHC klasy II
Uważa się, że u człowieka prezentacja pośrednia warunkuje odrzut przewlekły.
nadostre - parę minut po przeszczepieniu
ostre - kilka dni do kilku tygodni po przeszczepie
przyspieszone - odrzucane przeszczepy alogeniczne u biorców, którzy wcześnie odrzucili przeszczep tego samego dawcy
przewlekłe - mechanizm mieszany: odpowiedź transplantacyjna i procesy ze strony tkanki przeszczepionej
syngeniczne - choroba autoimmunologiczn (cukrzyca, bliźniacy).
Zależą od stopnia niezgodności genetycznej między dawcą i biorcą
Kluczową rolę odgrywają limfocyty T
Pod względem molekularnym reakcja odrzutu jest wynikiem interakcji receptora dla antygenu (TCR) i MHC
Molekuły MHC przeszczepu i gospodarza prezentują różne peptydy, co indukuje odpowiedź immunologiczną
Limfocyty T mogą rozpoznawać i reagować bezpośrednio z obcymi molekułami MHC
aktywacja limfocytów cytotoksycznych CD8+ poprzez uwalniane cytokiny
indukcja odpowiedzi o typie nadwrażliwości później z udziałem makrofagów
bezpośrednim efekcie cytotoksycznym wobec komórek przeszczepionego narządu
uszkadzając komórki (śródbłonka i miąższowe) w następstwie reakcji dopełniacza
wywołując reakcje ADCC
nasilając odczyn zapalny składniki dopełniacza C3a, C5a
aktywując układ krzepnięcia
aktywując swoiste limfocyty C ( IL-2,4,7,12,15,21, INF-γ)
bezpośrednio uszkadzają komórki przeszczepu (IL-1, TNF)
aktywują limfocyty B , zmiana izotopu wytwarzanych przeciwciał(ADCC) IL-2,INF-γ
odczyn zapalny (IL-1,2,4,5,6, INF-γ,TNF)
przyciągają chemotaktycznie Tc, monocyty , NK (chemokiny :RANTES, MIP-1α,MCP -1)
hamują nagiogenezę (MIG, IP 10)
inicjują nadwrażliwość typu późnego (INF-γ,GM-CSF, TNF )
aktywują komórki prezentujące antygen (INF-γ)
hamują odpowiedź immunologiczną (IL-10, TGF )
z przebytymi epizodami przewlekłego odrzucania
mało z podanych antygenów HLA
niedostateczna immunosupresja
nadciśnienie tętnicze
wirus cytomegalii
długo narząd przechowywany przed transplantacją
palenie papierosów
hiperglikemia
nieproporcjonalna masa nerki do masy ciała
zgodność w AB0
nie ma przeciwciał biorca-antydawca
HLA -B i DR rozpoznanie
przebyte transfuzje krwi
dodatkowe HLA
inna grupa krwi, zgodna
wiek
ryzyko raka
chorby
Testy serologiczne, typowanie:
Mieszana reakcja limfocytów. Komórki homozygotyczne limfocytów B reagują z limfocytami T. Brak lub obecność wspólnego antygenu.
Metody genetyczne- dokładniejsze, można wyznaczyć więcej antygenów. Informacje na chromosomie 6.
noworodkowa- wstrzykujemy komórki od przyszłego dawcy
letalna dawka chemio lub radioterapii, a następnie przeszczepianie szpiku przyszłego dawcy- trwały chimeryzm. Zdolność do odpowiedzi immunologicznej bez genu dawcy
eliminacja przeszczepu z komórek dendrytycznych i modyfikacja antygenowości przeszczepionej tkanki
surowi lub przeciwciała przeciwko antygenom transplantacyjnym przyszłego dawcy. Wydłużenie życia przeszczepu
przeciwciała antyidiotypowe ( podanie lub indukcja)
podanie komórek przyszłego dawcy biorcy
do grasicy wprowadzamy tkanki dawcy w połączeniu z nieswoista immunosupresją swoista tolerancja.
delecja klonalna- eliminacja klonów limfocytów zdolnych do rozpoznawania i odpowiedzi immunologicznej
anergia klonalna- inaktywacja ale nie eliminacja komórek alloreaktywnych zachodząca centralnie lub na obwodzie
supresja - za tolerancję może być odpowiedzialna indukcja komórek supresorowych
przewaga aktywacji limfocytów pomocniczych Th 2
adaptacja.
ostre i przewlekłe białaczki
szpiczak mnogi
ciężki złożony niedobór odporności
niedokrwistość plastyczna
wrodzone choroby spichrzowe (galaktozemia)
osteoporoza
nieodwracalne uszkodzenie szpiku przy chemioterapi guzów litych
z udziałem cząsteczek MHC klasy I
z udziałem cząsteczek MHC klasy II.
profesjonalne komórki prezentujący antygen zdolne do pobudzenia dziewiczych limfocytów Th obejmujące głównie komórki dendrytyczne. Są niezwykle istotne, gdyż jako jedyne mogą dokonać pobudzenia komórek, które nigdy wcześniej nie zetknęły się z antygenem.
nieprofesjonalne komórki prezentujące antygen zdolne jedynie do pobudzenia limfocytów pamięci obejmujące głównie limfocyty B i makrofagi.
komórki Langerhansa występujące głównie w naskórku, skórze właściwej, nabłonku przewodu pokarmowego, dróg moczowo-płciowych itp. Po związaniu antygenów, przechodzą do naczyń limfatycznych doprowadzających i jako welonowate docierają do węzłów limfatycznych, gdzie przekształcają się w komórki dendrytyczne splatające się.
śródmiąższowe komórki dendrytyczne występujące w tkance łącznej większości narządów. Po opuszczeniu narządów, z limfą docierają one do węzłów limfatycznych, część także do krwi i następnie do śledziony. W strefach grasiczozależnych węzłów limfatycznych i śledziony przekształcają się w komórki dendrytyczne splatające się.
komórki dendrytyczne grasicy biorące udział w selekcji negatywnej dojrzewających limfocytów T
komórki pozostałych narządów obejmujące:
komórki dendrytyczne splatające się zdolne do prezentacji antygenów swoistym limfocytom T. Ich cechą charakterystyczną jest wysoki poziom ekspresji białka MHC klasy II.
komórki dendrytyczne grudek obecne w ośrodkach rozmnażania grudek limfatycznych. Odgrywają ważną role w rozwoju odpowiedzi humoralnej wtórnej. Mają receptory dla fragmentu Fc IgG i dla C3, które służą im do utrzymywania przez długi okres na swojej powierzchni antygenów głównie w postaci kompleksów immunologicznych. Otaczają one limfocyty B (rzadziej limfocyty T) swymi dendrytycznymi wypustkami. Niektóre wypustki dendrytyczne zawierają ułożone w szeregu tzw. iccosomy zawierające antygeny. Iccosomy ulegają endocytozie przez limfocyty B, gdzie antygeny ulegają fragmentacji i mogą być prezentowane limfocytom Th, które dostarczają odpowiednich cytokin niezbędnych do proliferacji i różnicowania limfocytów B w komórki intensywnie wytwarzające przeciwciała. Tak więc kompleksy immunologiczne dostarczane limfocytom B przez komórki dendrytyczne działają na nie aktywująco.
wzmagając syntezę cząsteczek MHC poprzez wydzielany IFN - gamma
pobudzając wydzielanie IL-1.
procesów naturalnych (zakażenie)
w wyniku interwencji medycznej- odpornośc nabyta sztucznie ( szczepienia, podanie immunoglobulin)
pierwotna
wtórna
znacznie szybsza reakcja organizmu ( proliferacja komórek produkujących głównie immunoglobuliny IgG, które mają duże powinowactwo do antygenu)
dużo krótsza faza narastania poziomu przeciwciał, występuje większe stężenie immunoglobulin, które utrzymują się przez dłuższy czas.
monowalentne- zawieraja jeden gatunek lub typ drobnoustroju
poliwalentne- zawieraja kilka serotypów tego samego gatunku drobnoustroju ( grypa, pneumokoki, poliomyelitis)
skojarzone- jednoczesne podawanie kilku antygenów może spowodowac wzajemne oddziaływania , konkurencje o receptory komórek immunokompetentnych, a także zwiększenie działań niepożadanych.
zawierające żywe lecz zmodyfikowane drobnoustroje ( bardzo immunogenne), np. dur brzuszny , gruźlica, odra
zawierające uśmiercone chemicznie bądź termicznie drobnoustroje, np. cholera, grypa, wścieklizna
zawierające oczyszczone produkty drobnoustrojów, np. antygeny powierzchniowe, inaktywowane toksyny I są to np.: blonica ( anatoksyna), krztusiec
zawierające produkty inaktywowanego DNA np. WZW B
zawierające żywe drobnoustroje :
zwykle po podaniu pojedynczej dawki uzyskuje się trwała odpowiedź
duża immunogennośc tych szczepionek jest związana z częściowym namnażaniem się żywych drobnoustrojów w organizmie, z zawartościa wielu antygenów stymulujących szeroki zakres odpowiedzi komórkowej i humoralnej
prezentacja antygenów żywych drobnoustrojów, które namnażają się wewnątrz komórek, odbywa się poprzez kompleksy z cząsteczkami MHC klasy I, co pozwala na aktywację specyficznych dla genu cytotoksycznyh limfocytów T
szczepionki zawierające inaktywowane drobnoustroje:
wykazują mniejszą immunogennośc niż szczepionki zawierające żywe drobnoustroje
wymagają podania większej dawek do uzyskania trwałej odporności
inaktywacja drobnoustroju może zachodzic pod wpływem temp, zw.chem., i właściwości chemicznych
szczepionki zawierające rekombinowane antygeny:
nie zawierają zanieczyszczeń biologicznych i w ukierunkowany sposób stymulują odpowiedź immunologiczną
Łatwośc produkcji dzięki dostępności przeciwciał monoklonalnych
Czystośc uzyskiwanych produktów
Brak ich toksycznosci
Pierwszym etapem rozwoju nowotworu jest inicjacja. Faza ta dotyczy pojedynczej komórki danego organizmu i polega na zaindukowaniu przez czynniki kancerogenne nieodwracalnych zmian w materiale genetycznym komórki. Rezultatem tych zmian są niekontrolowane podziały oraz stopniowa utrata zróżnicowania funkcjonalnego danej komórki. W aspekcie morfologicznym może prowadzić to do dysplazji (nieprawidłowości w budowie tkankowej) lub hiperplazji (przerostu tkanki i zwiększenia jej masy). Zmiany te można wykryć technikami biologii molekularnej. W tym momencie układ immunologiczny działa, ale czasami produkuje zbyt mało komórek i czynników do walki z nowotworem.
Następny etap to promocja (wczesna inwazja). Etap ten cechują nadmierne podziały komórkowe, uzyskanie pewnej ruchliwości komórek. Ponadto:
utrata zdolności funkcjonalnych właściwych prawidłowym komórkom danego typu (czyli np. zahamowanie produkcji prawidłowych białek enzymatycznych);
utrata łączności z komórkami prawidłowymi oraz pojawienie się inwazyjności;
niekiedy na tym etapie następują zmiany w strukturze i liczbie chromosomów.
Kolejnym etapem jest progresja. W tej fazie zachodzą bardzo intensywne podziały komórkowe, a ponadto komórki stają się praktycznie autonomiczne (autokrynna regulacja wzrostu, brak reakcji na sygnały zewnątrzkomórkowe). Prócz tego wstępują ogromne zmiany w genomie komórek nowotworowych (zachodzą liczne mutacje). Dodatkowo
w niektórych komórkach dochodzi do produkcji czynników angiogennych (koniecznych do powstania naczyń krwionośnych, co w efekcie umożliwia rozrost nowotworu).
W trakcie tej fazy zachodzi zjawisko mające ogromne znaczenie w późniejszym rozwoju nowotworu, czyli selekcja klonów komórek najlepiej przystosowanych do niekontrolowanego wzrostu i inwazyjności. Układ immunologiczny już nie działa. Komórki nowotworowe można wykryć metodami immunologii laboratoryjnej.Podczas ostatniego etapu rozwoju nowotworu, jakim jest tworzenie przerzutów, dochodzi do odłączenia się komórek nowotworowych od głównego guza, następnie wędrówki przez naczynia limfatyczne i krwionośne do innych tkanek i narządów, osiedlanie się w nich i zapoczątkowywanie nowych guzów (przerzutów lub inaczej metastaz). Aby do tego doszło wystarczy aby oderwała się jedna komórka nowotworowa. Znana tutaj jest teoria ziarna i gleby, która wskazuje, iż komórki nowotworowe zagnieżdżają się najchętniej w niektórych organach, które mają dla nich charakterystyczne receptory. Serce jest organem uprzywilejowanym, gdyż szybko wyrzucana krew uniemożliwia komórkom nowotworowym zagnieżdżenie się w tym organie.
onkogeny,
geny supresorowe (antyonkogeny),
oraz geny mutatorowe (tzw. geny naprawy DNA).
gen HER (erb-B) → kodujący białka będące receptorami naskórkowych czynników wzrostu (EGF), które w momencie zaktywowania wysyłają sygnały podziału do jądra. W przypadku gdy białka są zmutowane mamy do czynienia ze zjawiskiem amplifikacji - duża ilość receptorów na powierzchni komórki. Występuje wtedy zwielokrotnienie sygnału, co w konsekwencji daje dużo podziałów nieprawidłowych komórek. Ważne są tutaj cykliny, które są inhibitorami cyklu komórkowego (faza G1S). Wykrywa się przede wszystkim HER-1 i HER-2, które są zaraz po p53 są najczęściej uszkadzanymi genami. Mutacje tego genu są przyczyną raka piersi oraz nowotworów mózgowych. Leczenie odbywa się w oparciu o herceptyne;
gen sis → kodujący białka budujące płytkowy czynnik wzrostu ( PDGF );
gen src → kodujące białko błonowe o właściwościach kinazy tyrozynowej.
degradację niektórych białek (np. p53 - HIV)
stymulację wzrostu i podziału komórki
deregulację cyklu komórkowego(HIV)
zakażenie spoczynkowych limfocytów B i pre-B, dochodzi do ich aktywacji (G 0 >G 1 ), czego efektem może tzw. immortalizacja, w wyniku której, dochodzi do transformacji nowotworowej komórek.
aktywację genów komórkowych np. powstają komórki, które same wytwarzają i reagują na własną IL-2, co odgrywa istotną rolę w procesie ich transformacji nowotworowej.
długotrwałe zakażenie wiąże się z pogłębianiem się choroby i powstawaniem nieodwracalnych zmian w tkance.
żywej regeneracja hepatocytów.( HCV- transformacja hepatocytów w komórki nowotworowe może zajść w wyniku złej regulacji hormonalnej, zmienionego przestrzennie układu komórek (przebudowa), zwiększonej syntezy czynników wzrostowych i nieprawidłowej ekspansji onkogenów.
Bezpośrednia (w bardzo szybkich przypadkach). Przeciwciało monoklonalne są bezpośrednio znakowane fluorochromem. Metodę tę przeprowadza się tylko na materiale świeżym. Cała reakcja zajmuje 1,5 godziny. Musi być kontrola tej reakcji, aby sprawdzić czy ni zachodzą reakcje krzyżowe. W tym celu dodaje się bufo do płukania na PM.
Pośrednia w pierwszym etapie znakowania stosuje się czyste przeciwciało, a następnie po podpłukaniu nie znakowanego przeciwciała dodaje się drugie przeciwciało znakowane fluorochromem, które reaguje z pierwszym przeciwciałem. Ten pośredni test ma dwie zalety, większa czułość i wymaga znakowania tylko jednego przeciwciała. (dłuższa reakcja). Pm nie jest związane z fluorochromem. Ważne są kolejne płukania, kilka inkubacji. Określa się % ile komórek wykazuje obecność antygenu.
Bezpośrednie- cytometria przepływowa. Znacznikiem przeciwciał jest enzym: fosfataza alkaliczna, peroksydaza chrzanowa. Przeciwciało to łączy się z antygenem , po odpłukaniu następnie nanosi się substrat dla tego enzymu i znowu spłukuje. Jeśli w badanej próbce były obecne antygeny nowotworowe to zmienia się barwa od produkt końcowego (rozkład substratu) barwę na produkt końcowy. Oznaczanie w pracowni histopatologicznej. Reakcja zajmuje 1 h. Produkt reakcji antygen-przeciwciało zabarwia się na brązowo przy peroksydazie. Obowiązuje kontrola negatywna i pozytywna. Wszystko musi być negatywne, nie może być nawet jednego w polu widzenia.
Pośrednia - wolne przeciwciała monoklonalne i poliklonalne przeciw antygenów bakteryjnym, wirusowym, nowotworowym. W przypadku antygenów nowotworowych szuka się produktów genów supresorowych, onkogenów. Antygen przyłączony do stałej powierzchni wiąże przeciwciało. Jest on następnie wykrywany za pomocą znakowanego drugiego przeciwciała reagującym z pierwszym. Dalej reakcje przebiegają podobnie jak w metodzie bezpośredniej.
Kwaśna fosfataza - odzwierciedla zaawansowanie raka prostaty
Fosfataza alkaliczna - odzwierciedla zajęcie układu kostnego, wątroby przez nowotwór lub przerzuty. Można Różnicować, oznaczając izoenzym. (Stężenie fosfatazy alkalicznej w granulocytach jest zwiększone w przypadkach chłoniaków o rozrostów układu krwionośnego)
Dehydrogenaza mleczanowa (LDH) - stężenie jej jest zwiększone w wielu chorobach nowotworowych. W ziarnicy złośliwej i nowotworach jądra jej stężenie jest czynnikiem prognostycznym.
Mogą posłużyć do wykrywania nowotworów w grupach wysokiego ryzyka
Mogą być pomocne w rozpoznawaniu nowotworu u osoby z objawami sugerującymi istnienie procesu nowotworowego
Pozwalają na określenie stopnia zaawansowania nowotworu, a zatem na rokowanie, ponieważ im dalszy stopień klinicznego zaawansowania, tym wyższe jest stężenie
Pozwalająca lokalizacje nowotworów, a zwłaszcza przerzutów
Najbardziej przydatne dla monitorowania przebiegu procesu nowotworowego i/lub skuteczności leczenia, a zwłaszcza dla wykrycia wznowy w fazie jej operacyjności lub też przerzutów po leczeniu uznanym radykalne
określenia kierunku różnicowania komórek nowotworowych cechujących się podobnym wyglądem w preparatach mikroskopowych zabarwionych przeglądowo
ustalenia histogenezy nienowotworowych komórek, nietypowych dla badanego narządu
określenie lokalizacji guza pierwotnego po ujawnieniu przerzutu
immunofenotypowania komórek układu krwiotwórczego (białaczek) i chłonnego (chłoniaków) w celu odróżnienia rozrostów nienowotworowych od nowotworowych oraz identyfikacji typów nowotworów
wykazania naciekania naczyń przez komórki nowotworowe
ustalenia markerów biologicznych o znaczeniu rakotwórczym
identyfikacji pozakomórkowych złogów w tkankach i narzadach
antygeny powszechnie występujące - są obecne na komórkach nowotworowych i różnych komórkach prawidłowych
antygeny różnicowania - obecne na komórkach nowotworowych i prawidłowych, z których wywodzi się nowotwór
antygeny wspólne, - tzw. antygeny nowotwór/jądro, bo występują na komórkach nowotworowych i na spermatocytach, i spermatogoniach
antygeny swoiste dla nowotworu - obecne są tylko na komórkach nowotworowych
CD19, CD20, CD21,CD22 obecne na chłoniakach wywodzących się z limfocytów B
antygen karcyno-embrionalny CEA, obecny głównie w raku jelita grubego, trzustki, żołądka (wykrywany równocześnie przez limfocyty T i przeciwciała. Jest to powierzchniowa glikoproteina, zawiera ponad 50% węglowodanów, należy do nadrodziny immunoglobulinopodobnych, funkcjonuje jako cząsteczka adhezyjna.)
CA125 obecny w raku jajnika, trzustki, płuc
aktywność komórek NK
cytotoksyczność limfocytów Tc
aktywność cytokin wydzielanych przez limfocyty T
cytotoksyczność pobudzonych makrofagów i neutrofilów
cytotoksyczność komórkowa zależna od przeciwciał
cytotoksyczność przeciwciał zależna od dopełniacza
wspomagają syntezę swoistych przeciwciał przez limfocyty B (IL-4, IL-5, IL-6)
aktywują makrofagi tak, że stają się one zdolne do zabicia komórek nowotworowych (IFN-γ)
aktywują komórki NK (IL-2)
wspomagają różnicowanie i aktywację limfocytów Tc (IL-2)
bezpośrednio zabijają komórki nowotworowe lub hamują ich proliferację (TNF i limfotoksyny)
IL-12, -15,-18, -21 aktywują limfocyty Tc i komórki NK.
chemokiny - odgrywają rolę w odpowiedzi przeciwnowotworowej. Działając chemotaktycznie, przyciągają komórki, np. neutrofile, monocoty, limfocyty; chemokiny zwiększają naciekanie przez nie nowotworu. Niektóre mogą hamować powstawanie naczyń w obrębie nowotworu (IP10, MIG); mogą stymulować angiogenezę (IL-8).
mechanizmy odporności nieswoistej:
cytotoksyczność makrofagów i neutrofilów,
aktywność eozynofilów, mastocytów, komórek NK,
aktywność cytokin (IFN, TNF),
obecność białek chelatujących żelazo (laktoferryna i transferryna)
aktywność składników układu dopełniacza.
Swoiste komórkowe i humoralne mechanizmy odporności przeciwnowotworowej, zachodzące po prezentacji (w kontekście MHC klasy I i/lub II) komórkom odpornościowym antygenów związanych z nowotworem, obejmują:
cytotoksyczność limfocytów Tc,
aktywność cytokin wydzielanych przez limfocyty Th,
cytotoksyczność komórkową zależną od przeciwciał
cytotoksyczność przeciwciał zależną od dopełniacza.
wspomagają syntezę swoistych przeciwciał przez limf. B (IL 4 IL5 IL6)
aktywują makrofagi tak, że stają się one zdolne do zabicia komórek nowotworowych (IFN-γ)
aktywują komórki NK (IL2)
wspomagają różnicowanie i aktywacje limf. Tc (IL2)
bezpośrednio zabijają komórki nowotworowe (TNF, limfotoksyny)
bezpośrednio hamują proliferacje komórek nowotworowych (TNF, limfotoksyny)
Nowotwór może się „bronić” wydzielając np. czynniki hamujące chemotaksję monocytów i makrofagów.
Makrofagi mogą również wydzielać czynniki wzrostowe dla niektórych nowotworów, czynniki przyspieszające tworzenie naczyń krwionośnych w obrębie nowotworu. Mogą również być źródłem czynników hamujących reaktywność immunologiczną (PG, TGF-β).
Przeciwciała mogą w niektórych sytuacjach ułatwiać wzrost nowotworu- tzw. ułatwienie immunologiczne, będące elementem „wypaczonej” reaktywności immunologicznej obserwowanej w organizmie z rozwijającym się nowotworem.
Czynna (wzmaganie reaktywności immunologicznej pacjenta przez podawanie komórek nowotworowych lub ich antygenów/ preparatów immunostymulujących)
Bierna (podawanie przeciwciał)
Adoptywna ( podawanie aktywowanych pozaustrojowo komórek układu immunologicznego)
Bezpośredni efekt cytotoksyczny cytokin wobec komórek nowotworu np. TNF
Wpływ na szybkość migracji limfocytów
Zwiękasza wrażliwość nowotworów na efekty cytotoksyczne
Hamowanie proliferacji komórek
Aktywacja leukocytów
Ułatwia prezentacje antygenów w tym nowotworowych
INF-α
Wzmaga ekspresje cząsteczek MHC na powierzchni komórek nowotworowych
Wpływa na różnicowanie limfocytów
Aktywuje komórki NK i makrofagi
Nasila tworzenie cytokin
Nasila proliferacje NK
Interferencja ze zjawiskiem lekkooporności
IL-2
TNF
Zawiesina BCG
Lewamizol
LAK
Monocyty
Immunosupresja
Zewnątrzpochodna (niektóre leki, infekcje wirusowe)
Wewnątrzpochodna (komórki i czynniki supresorowe)
Immunoselekcja
Immunomodulacja
„Prześlizgiwanie się”
Uwalnianie antygenów nowotworowych
Maskowanie antygenów na komórkach nowotworowych
Tworzenie kompleksów antygenów nowotworowych ze swoistymi przeciwciałami i blokowanie odpowiednich komórek efektorowych
Opsonizacja komórek reagujących z antygenem
Aktywność przeciwciał antyidiotypowych
Stymulacja wzrostu niektórych nowotworowych przez czynniki wzrostowe uwalniane przez limfocyty
Stymulacja wzrostu komórek nowotworowych przez swoiste przeciwciała obecne w małym stężeniu
Selekcja immunologiczna jest wynikiem poddawania komórek nowotworowych presji efektorowych mechanizmów immunologicznych, które nie prowadzą do całkowitego zniszczenia nowotworu. W wyniku tej presji dochodzi do selektywnego przeżycia takich klonów komórek nowotworowych, których wrażliwość na cytotoksyczne mechanizmy efektorowe jest osłabiona, np. w wyniku zmiejszonej antygenowości. Komórki nowotworowe mają bowiem bardzo często zmniejszoną ekspresję cząsteczek MHC, które konieczne są do prezentacji antygenów nowotworowych limfocytom T, i na ogół nie mają kostymulujących cząsteczek, takich jak CD80, CD86.
Immunomodulacja w odniesieniu do komórek nowotworu polega na okresowym zmniejszeniu się ich antygenowości w wyniku zadziałania na nie swoistych przeciwciał p/nowotworowych. Kompleksy antygen-przeciwciało przesuwają się w płaszczyźnie błony komórkowej i skupiają się na jednym biegunie komórki, „ogołacając” na określony czas błonę komórkową z antygenów nowotworowych (ryc. 34.4)
„Prześlizgiwanie się” <ang. sneaking through> jest terminem wprowadzonym do określenia zjawisk obserwowanych niekiedy przy przeszczepianiu komórek nowotworowych. Średnie dawki komórek odrzucane są przez gospodarza, natomiast podanie dużych dawek prowadzi do postępującego wzrostu nowotworu. Nieoczekiwanie, przeszczepianie bardzo małej liczby komórek nowotworowych prowadzi również do wzrostu nowotworu. Nie można wykluczyć, że małe dawki komórek indukują odpowiedź ułatwiającą wzrost nowotworu, a gdy liczba komórek nowotworowych osiąga liczbę dawki średniej, reaktywność immunologiczna ustroju macierzystego jest już zmieniona i dlatego nie może on rozwinąć odpowiedzi immunologicznej prowadzącej do odrzucenia przeszczepionych komórek.
wolne antygeny
swoiste przeciwciała przeciwnowotworowe
kompleksy antygen-przeciwciało
opsonizacja komórek reagujących z antygenem (uczestniczą tu limfocyty T regulatorowe/supresorowe wraz z wydzielanymi przez siebie czynnikami)
reakcje idiotypowe
makrofagów - są to dojrzałe formy monocytów, zasiedlają prawie wszystkie tkanki i narządy, usytuowane na pograniczu odpowiedzi nieswoistej i swoistej, mają na swojej powierzchni liczne cząsteczki, uczestniczące w procesie wiązania patogenów i fagocytozy; pobudzenie makrofagów powoduje zwiększenie zdolności fagocytarnych, wydzielanie aktywnych form tlenu i azotu, tworzenie fagolizosomów, ekspresja cząst. MHC kl II
granulocytów obojętnochłonnych - licznie gromadzą się w miejscu uszkodzenia tkanek, tworzą ropę; szczególna rola w odp. Przeciwbakteryjnej, zdolnośc do fagocytozy, tworzenia fagolizosomu, aktywacja enzymów, synteza aktywnych związków tlenu i azotu
komórek dendrytycznych
NK- uczestniczą w obronie p-wirusowej
NKT- uczestniczą w odpowiedzi przeciw bakteriom wewnątrzkomórkowym, pierwotniakom i niektórym wirusom
Pobudzone makrofagi i kom dendrytyczne wydzielają IL-1 i Th 1, które stymulują limfocyty B do produkcji przeciwciał uczestniczących w opsonizacji, pobudzają limfocyty cytotoksyczne i makrofagi.(Częściej zachodzi przy zakażeniach wirusowych i bakteriami wewnątrzkomórkowymi )
Pobudzone limfocyty T wydzielają IL-2 i Th 2, które pobudzają limfocyty B do produkcji przeciwciał neutralizujących, pobudzają eozynofile, komórki tuczne ulegają degranulacji, działają hamująco na makrofagi. (Dominuje przy zakażeniach bakteryjnych i pasożytniczych, w reakcjach alergicznych)
2. Rola pierwotnych i wtórnych narządów limfatycznych
w pelni rozwinieta w momencie urodzenia, otoczona torebka lacznotkankowa, sklada się z dwoch platow, każdy zas z wielu placikow, w których można wyroznic czesc rdzenna i korowa (poszczegolne czesci korowe sa oddzielone od siebie przegrodami lacznotkankowymi). W czesci rdzennej znajduja się cialka grasicze (cialka Hassala). W sklad zrebu grasicy wchodzi torebka i przegrody lacznotkankowe oraz komorki z dlugimi wypustkami tworzace w miazszu grasicy siec. Można tam wyroznic kom. nablonkowe, makrofagi (zarówno w korze jak i rdzeniu) i kom dendrytyczne (tylko w rdzeniu i na granicy rdzen-kora). Na komorkach zrebu obecne sa czasteczki MHC co ma znaczenie dla czynnosciowego dojrzewania limfocytow T. W zrebie znajduja się tymocyty (gesto w czesci korowej, luzno w rdzennej). Komorki nablonkowe scisle otaczaja tymocyty (sa to komorki opiekuncze) - chronia one tymocyty przed obcymi antygenami i ucza je tolerancji dla wlasnych antygenow. W grasicy zachodzi intensywna proliferacja i roznicowanie limfocytow T, a konkretnie komorek prekursorowych. Proliferacja zachodzi w zew, czesci korowej i przesuwaja się do czesci wewnetrznej. Należy zaznaczyc ze grasica UTRUDNIA kontakt antygenu z tymocytami (komorkiopiekuncze, bariera krew-grasica). Zachodzi tu także selekcja negatywna i pozytywna powstalych limfocytow T. Wszystkie procesy zwiazane z procesem dojrzewania i roznicowania limfocytow T w grasicy jest opisany w dziale ontogeneza ukladu immunologicznego
W grasicy wytwarzane sa także liczne czynniki wplywajace na roznicowanie i proliferacje limfocytow. Sa to hormony grasicy (tymozyna, grasiczy czynnik humoralny, tymopoetyna, tymulina, tymopentyna i tymostymulina) oraz IL 1-12, IL15, czynniki stymulujace tworzenie kolonii granulocytow, makrofagow, czynnik martwicy nowotworow, czynnik transformujacy wzrostu β, czynnik komorek macierzystych, czynnik hamujacy bialaczke oraz chemokiny.
wystepuje tylko u ptakow, nie ma jej u ssakow. Stwarza wlasciwe srodowisko do roznicowania limfocytow B
spelnia funkcje krwiotworcza (wytwarzanie erytrocytow, granulocytow, monocytow i plytek krwi) oraz funkcje cetralnego narzadu limfatycznego w którym powstaja limfocyty B - proces ten opisany jest szczegolowo w dziale ontogeneza ukladu immunologicznego
Sledziona odpowiada na antygeny, które docieraja do niej z krwia; uczestniczy w odpowiedzi typu humoralnego.
e) naczynia limfatyczne - odprowadzaja limfe do ukladu zylnego
3. Budowa grasicy
- Ogolna budowa grasicy
Grasica w chwili urodzenia jest w pelni rozwinietym narzadem. Jest otoczona torebka lacznotkankowa. Sklada sie z dwoch platow, a kazdy z nich z wielu placikow. W placikach wyrozniamy czesc korowa i rdzenna. Czesci korowe sa oddzielone od siebie przegrodami lacznotkankowymi, natomiast ich czesci rdzenne lacza sie ze soba. W czesci rdzennej placikow sa widoczne owalne twory zbudowane z koncentrycznie ulozonych komorek nablonkowych (cialek grasiczych = cialek Hassala). Czesc obwodowa cialka grasicznego zajmuja splaszczone komorki zachodzace na siebie dachowkowato. Niektore z nich lacza sie z komorkami zrebu nablonkowego. W sklad zrebu grasicy wchodzi torebka i przegrody lacznotkankowe oraz komorki z dlugimi wypustkami, tworzace siec w miazszu. Wsrod tych komorek mozna wyroznic komorki nablonkowe, makrofagi i komorki dendrytyczne. Komorki nablonkowe i makrofagi wystepuja w korze i rdzeniu, natomiast komorki dendrytyczne wystepuja tylko w rdzeniu i na granicy rdzen-kora. Wsrod komorek nablonkowych mozemy wyroznic: podtorebkowe i okolonaczyniowe, korowe, rdzeniowe, komorki obecne w cialkach grasiczych. Na komorkach zrebu grasicy wystepuja w duzym stezeniu czasteczki glownego ukladu zgodnosci tkankowej (ma to znaczenie przy dojrzewaniu limfocytow T).
W okach sieci wytworzonej przez komorki zrebu leza lifmocyty grasicze (tymocyty), gesto ulozone w czesci korowej i luzno w czesci rdzennej. Niektore nablonkowe komorki znajdujace sie w korze grasicy scisle otaczaja tymocyty swoimi wypustkami, ze zyskaly nazwe grasiczych komorek opiekunczych lub pielegnujacych. Wystepuja one glownie w zewnetrznej warstwie korowej, gdzie obserwuje sie intensywna proliferacje tymocytow. Niektore makrofagi kory zawieraja sfagocytowane tymocyty znajdujace sie na roznych etapach dezintegracji.
Prekursory tymocytow dostaja sie w zyciu plodowym do grasicy najpierw z watroby, a nastepnie ze szpiku. W grasicy ulegaja one intensywnej proliferacji i roznicowaniu na limofocyty T. Wskaznik mitotyczny tymocytow jest bardzo wysoki, jednak olbrzymia czesc komorek powstalych w wyniku tej proliferacji ginie wewnatrz grasicy na skutek apoptozy. Tymocyty proliferuja w zewnetrznej czesci korowej i roznicuja sie przesuwajac sie w kierunku wewnetrznej czesci korowej. Wiekszosc z nich przedostaje sie do zylek pozawlosowatych i opuszcza grasice. Po opuszczeniu grasicy limfocyty T zasiedlaja obszary grasiczozalezne narzadow limfatycznych, a czesc przedostaje sie do krazenia ogolnego.
- Bariera krew-grasica
Grasica utrudnia kontakt limfocytow z antygenami, ktore dostaly sie do krwi lub limfy. Naczynia krwionosne wnikaja do grasicy od strony torebki, a nastepnie wnikaja w glab narzadu wraz z przegrodami lacznotkankowymi. Na granicy kory i rdzenia tworza one gesta siec naczyn wlosowatych, ktore w obrebie rdzenia przechodza w zylki pozawlosowate. Naczynia wlosowate w korze grasicy sa otoczone przestrzenia okolonaczyniowa oraz otoczka zbudowana z komorek nablonkowych.
- Hormony grasicy i wplyw hormonow na grasice
Hormony grasicy: tymozyna, grasiczy czynnik humoralny, tymopoetyna, tymulina, tymopentyna i tymostymulina. Hormony grasicy sa wytwarzane przez komorki nablonkowe i indukuja roznicowanie i dojrzewanie czynnosciowe limfocytow T. W grasicy sa wytwarzane rozwniez rozne czynniki powszechnie wystepujace w ukladzie odpornosciowym, m. in. IL 1 - 12, 15, a takze czynniki stymulujace tworzenie kolonii: granulocytow, makrofagow, granulocytow i makrofagow i TNF. Wystepuje tu takze transformujacy czynnik wzrostu "beta" (TGF "beta"), czynnik komorek macierzystych, ligand Flt3 i czynnik hamujacy bialaczke oraz rozne chemokiny. Sposrod wymienionych cytokin i czynnikow najwazniejszy dla wewnatrzgrasiczego dojrzewania limfocytow T wydaje sie interleukina 7.
Hormon wzrostu i tyreotropowy stumuluje wzrost grasicy, natomiast wiekszosc hormonow steroidowych indukuje jej inwolucje.
- Inwolucja grasicy
Grasica z wiekiem ulega inwolucji, czyli zanikowi. Sam narzad sie nie zmiejsza, ale obszary limfoepitelialne zastepowane sa przez tkanke tluszczowa, laczna oraz przez przestrzenie okolonaczyniowe.
4. Komórki ukladu immunologicznego. Dojrzewanie limfocytów T i B.
Dojrzewanie limfocytów T
Grasica (w niej dojrzewają limfocyty T) powstaje we wczesnym okresie życia płodowego. Pierwsze komórki progenitorowe limfocytów T napływają do niej już w 7-8 tygodniu ciąży. Początkowo prekursory limfocytów T powstają w płodowym pęcherzyku żółtkowym oraz w wątrobie płodowej. W późniejszym okresie oraz po urodzeniu prekursory limfocytów T docierają do grasicy ze szpiku. Jak dotąd nie ustalono fenotypu komórek zasiedlających grasicę będących prekursorami limfocytów T. Fenotyp komórek macierzystych krwiotworzenia (hemopoezy) określany jest obecnością markerów powierzchniowych oraz brakiem markerów charakterystycznych dla dojrzałych linii rozwojowych krwinek. Komórki te są multipotencjalne (mogą się różnicować w kierunku każdego rodzaju krwinek) oraz mają zdolność do samoodtwarzania. W wyniku podziału z jednej komórki powstają: jedna komórka ulegająca różnicowaniu i druga komórka identyczna jak rodzicielska. Grasice zasiedlają 2 rodzaje komórek: pierwsze - bezpośrednie prekursory tymocytów i drugie całkowicie ukierunkowane do tworzenia limfocytów T określane jako wspólne komórki progenitorowe limfopoezy (CLP), gdyż mogą z nich powstać też limfocyty B, komórki NK i komórki dendrytyczne. Najważniejszym czynnikiem transkrypcyjnym pojawiającym się w komórkach ukierunkowanych w rozwoju w stronę limfocytów jest Icaros. W wyniku bezpośredniego kontaktu z komórkami tworzącymi zrąb grasicy (komórki nabłonkowe, makrofagi, komórki dendrytyczne) oraz pod wpływem cytokin komórki zasiedlające grasicę różnicują się w kierunku limfocytów T. Jedną z cząsteczek powierzchniowych komórek zasiedlających grasicę, determinującą dalszy rozwój w kierunku limfocytów T jest Notch-1.
Etapy dojrzewania limfocytów T
Proces dojrzewania limfocytów T można podzielić na 2 fazy:
- faza wczesna, w trakcie której dojrzewające komórki nie mają receptorów TCR. Faza ta zaczyna się od powstania komórek progenitorowych już w obrębie szpiku kostnego i obejmuje: zasiedlenie grasicy, ekspansję komórek zasiedlających, ukierunkowanie rozwoju w stronę wczesnych tymocytów, rearanżację genów TCRγ, α i β, selekcję β, wyłączenie alleliczne i izotopowe oraz podjęcie decyzji rozwojowej w kierunku linii αβ lub γδ
- faza późna, w której tymocyty mają pełną ekspresję receptorów rozpoznających antygen. W tej fazie limfocyty poddane są selekcji pozytywnej i negatywnej.
W zależności od ekspresji TCR/CD3 oraz cząsteczek CD4 i CD8 dojrzewające tymocyty są zwykle podzielone na 4 populacje komórek, odpowiadające kolejnym etapom ich dojrzewania:
Selekcja pozytywna i negatywna limfocytów T
Celem selekcji jest wyłonienie puli limfocytów T rozpoznających obce antygeny w połączeniu z własnymi cząsteczkami MHC. Tych obcych antygenów nie tylko w grasicy nie ma, ale możliwe jest również, że powstające limfocyty nigdy nie będą miały okazji ich rozpoznać. Selekcji pozytywnej poddawane są tymocyty podwójnie dodatnie (mające CD4 i CD8). W tym etapie dojrzewania dochodzi do wyłonienia takich komórek, które potrafią rozpoznać peptyd prezentowany przez autologiczne cząsteczki MHC. Następuje tu sprawdzenie czy w wyniku rearanżacji genów kodujących podjednostki α i β powstały prawidłowe receptory TCR rozpoznające antygen. Jeśli dojrzewający tymocyt nie rozpozna żadnego antygenu ulega po czasie apoptozie. Ten rodzaj programowej śmierci komórek określany jest jako „śmierć z zaniedbania”. Spośród tymocytów, które przeszły pozytywną selekcje nawet do 80% ginie w wyniku selekcji negatywnej, określanej często jako delecja klonalna.
W przebiegu selekcji pozytywnej dochodzi jednocześnie do restrykcji MHC. Te limfocyty, które będą rozpoznawać antygeny prezentowane przez MHC klasy I zachowują ekspresje CD8, a te które mają wiązać antygen prezentowany przez MHC klasy II pozostają CD4+.
W selekcji pozytywnej uczestniczą korowe komórki nabłonkowe. Limfocyty podwójnie dodatnie mają zaledwie 3-4 dni (tyle żyją) na rozpoznanie peptydów prezentowanych przez komórki nabłonkowe.
Niewiele wiadomo na temat komórek uczestniczących w selekcji negatywnej, wiele obserwacji wskazuje na grasicze komórki dendrytyczne oraz komórki nabłonkowe rdzenia grasicy. Niewykluczone ze korowe komórki nabłonkowe mogą eliminować te tymocyty, które z nadzwyczaj dużym powinowactwem rozpoznają prezentowane im antygeny.
Mechanizm selekcji w grasicy
Ważną rolę odgrywają tutaj receptory TCR. Jeśli mają one konformacje umożliwiającą rozpoznanie peptydu zakotwiczonego w rowku dowolnej napotkanej cząsteczki MHC, wówczas receptory te poprzez towarzyszący im kompleks CD3 przekazują sygnał aktywujący tymocyt. Jeśli w wyniku rearanżacji genów powstał wadliwy TCR lub jeśli w ogóle nie powstał taki receptor, tymocyt nie otrzymuje żadnego sygnału i wkrótce ulega apoptozie. Tymocyty potrzebują do przeżycia przede wszystkim sygnałów hamujących ich apoptozę. Głównymi cząsteczkami umożliwiającymi uniknięcie apoptozy są białka Bcl-2 i Bcl-xL. We wczesnych etapach dojrzewania główną rolę w utrzymaniu tymocytów przy życiu pełni IL-7, w trakcie selekcji β pre-TCR, a w czasie selekcji pozytywnej i negatywnej - TCR. Jeśli nie rozpoznaje on żadnego peptydu wówczas tymocyt nie otrzymuje sygnałów warunkujących przeżycie (brak indukcji Bcl-2 i Bcl-xL). Jeśli sygnały pobudzające TCR są zbyt silne wówczas następuje endocytoza receptorów i taki tymocyt nie otrzymuje dalszych sygnałów.
Peptydy uczestniczące w selekcji pozytywnej i negatywnej
Dany TCR może rozpoznawać wiele różniących się między sobą peptydów. Peptydy te mogą:
- pobudzać proliferacje i cytotoksyczność limfocytu (agoniści)
- powodować długotrwałą anergię lub apoptozę limfocytu (antagoniści)
- częściowo aktywować limfocyt - wydzielanie IFN-γ, ale komórka się nie dzieli (częściowy agonista).
Największy wpływ na selekcję limfocytów ma awidność TCR do peptydów, która zależy od intensywności sygnałów przekazywanych tymocytowi przez TCR. Jeśli awidność będzie zbyt mała wówczas dochodzi do śmierci z zaniedbania, jeśli za duża - tymocyt ulega apoptozie, czyli selekcji negatywnej (istnieje zbyt duże ryzyko, że ta komórka może rozpoznać autoantygen po opuszczeniu grasicy co może doprowadzić do choroby autoimmunizacyjnej). Jeśli awidność jest optymalna to tymocyt ulega selekcji pozytywnej, gdyż „istnieje szansa” że z optymalną awidnością będzie rozpoznawał obce antygeny, prezentowane przez MHC.
Redagowanie receptorów
Zbyt duża awidność wobec rozpoznawanego antygenu niekoniecznie musi prowadzić do apoptozy (selekcji negatywnej). Tymocyty nie ulegają apoptozie, ale utrzymywana jest w nich ekspresja RAG1 i RAG2, umożliwiająca próbę ponownej rearanżacji genów kodujących TCR. Dzięki temu tymocyty unikają apoptozy i mogą znów być poddane selekcji. Proces ten zwany jest redagowaniem receptorów i zachodzi tylko w obrębie locus TCRα.
Migracja tymocytów w grasicy
Pierwsze prekursory tymopoezy wnikają do zawiązka grasicy, zanim rozwiną się w nim naczynia krwionośne. Powstające naczynia mają dość charakterystyczny układ. Do grasicy wnikają one od strony torebki i wraz z przegrodami łącznotkankowymi dostają się w głąb narządu. W okolicy podtorebkowej oraz w korze grasicy naczynia otoczone są dość ściśle przylegającymi do siebie komórkami nabłonkowymi, które tworzą jak gdyby barierę krew-grasica. Na granicy kory i rdzenia komórki nabłonkowe stają się luźniejsze. To właśnie tędy napływają do grasicy prekursory tymopoezy. Następnie kierują się do kory w okolicę podtorebkową, mijając przemieszczające się w przeciwnym kierunku - do rdzenia - bardziej dojrzałe tymocyty. W regionie korowym tymocyty przechodzą kolejne etapy dojrzewania, aż do momentu selekcji pozytywnej. Następnie po przejściu selekcji negatywnej wnikają do naczyń i zasiedlają obwodowe narządy limfatyczne.
Najwazniejszą rolę w nadawaniu prawidłowego kierunku migracji tymocytów w grasicy odgrywają chemokiny. Uczestniczą one (głównie SDF-1) już w przyciąganiu prekursorów tymopoezy do grasicy. Następnie działając na tymocyty umożliwiają efektywne rozpoznanie ligandów przez ich cząsteczki adhezyjne.
Pozagrasicze dojrzewanie limfocytów T
Limfocyty T mogą powstawać również w błonach śluzowych przewodu pokarmowego. Większość z nich to limfocyty Tγδ. Tworzą się one z komórek progenitorowych mających antygen Kit, a główne miejsce ich powstawania to tzw. kryptokępki w obrębie blaszki właściwej błony śluzowej.
Dojrzewanie limfocytów B
Etapy rozwoju limfocytów B:
limfocyt pre-pro B
↓
limfocyt pro-B
↓
limfocyt pre-B (pre-BI i pre-BII)
↓
niedojrzały limfocyt B
↓
dojrzały limfocyt B
Limfocyty T i B powstają ze wspólnej komórki progenitorowej limfopoezy. Limfocyty B powstają głównie w szpiku. Najważniejszym czynnikiem transkrypcyjnym determinującym różnicowanie w kierunku limfocytów B jest Pax5. Komórki, w których pojawia się ten czynnik transkrypcyjny nazywane są limfocytami pre-pro B. Są to pierwsze komórki „nieodwołalnie skazane” na dojrzewanie w kierunku limfocytów B. Mają one fenotyp: CD34+ CD10+ B220+ (izoforma CD45). W komórkach tych rozpoczyna się ekspresja genów RAG1, RAG2 i Tdt, których produkty uczestniczą w rearanżacji genów dla składowych receptora immunoglobulinowego.
Komórki, w których dochodzi do pierwszych rearanżacji genów immunoglobulinowych nazywane są limfocytami pro-B. Na ich powierzchni pojawia się cząsteczka CD19 (marker wszystkich limfocytów B niezależnie od stadium dojrzewania). W błonie komórkowej zaczynają się również pojawiać cząsteczki głównego układu zgodności tkankowej klasy II oraz prymitywny prekursor receptorów BCR zbudowany z łańcuchów Igα, Igβ oraz kalneksyny. Łańcuchy Igα i Igβ są odpowiednikami CD3 u limfocytów T i uczestniczą w przekazywaniu sygnałów przez BCR. W połączeniu z kalneksyną tworzą receptor rozpoznający nieznany ligand. W kolejnych etapach powstawania limfocytów B ważną rolę odgrywa receptor immunoglobulinowy, który przekazuje komórkom sygnały warunkujące przeżycie (hamujące apoptozę).
Pojawienie się w cytoplazmie, a następnie w błonie komórkowej łańcucha ciężkiego jest oznaką przemiany komórki pro-B w limfocyt pre-B. Populacja komórek pre-B jest zwyczajowo dzielona na dwie odrębne subpopulacje komórek: pre-BI i pre-BII. Zostały one wydzielone ze względu na odrębne właściwości biologiczne, ponieważ markery maja identyczne. Za kryterium podziału przyjęto udział w cyklu komórkowym. Komórki pre-BI są populacją dużych, aktywnie dzielących się komórek, natomiast pre-BII są małymi, postmitotycznymi limfocytami, zatrzymanymi w fazie G1 cyklu.
W komórkach pre-BI pojawia się pre-BCR, co jest sygnałem wstrzymującym dalsze rearanżacje genów immunoglobulinowych.. Dochodzi teraz do wyłączenia allelicznego, sprawdzenia funkcjonalności łańcucha ciężkiego oraz do ekspansji klonalnej prekursorów limfocytów B. Wyłączenie alleliczne wynika z zahamowania ekspresji genów RAG. W wyniku tego procesu prekursory limfocytów B wykorzystują geny immunoglobulinowe tylko jednego chromosomu. Komórki te niemal natychmiast sprawdzają, czy łańcuchy ciężkie są prawidłowo zrearanżowane (selekcja pozytywna). Te, które udanie przeszły selekcję pozytywną, intensywnie proliferują, aby wystarczająco duża liczba komórek dotarła do kolejnych stadiów dojrzewania.
W populacji limfocytów pre-BII rozpoczyna się rearanżacja genów dla łańcucha
lekkiego κ. Jest to też moment, gdy dochodzi do wznowienia ekspresji genów RAG1/2. W wypadku niewytworzenia sprawnego łańcucha κ może dojść do rearanżacji genów odpowiedzialnych za powstanie łańcucha λ. Wytworzenie funkcjonalnego łańcucha lekkiego jest sygnałem do powolnego zaniku ekspresji Tdt.
Zakończenie rearanżacji genów dla łańcucha lekkiego i pojawienie się na powierzchni komórki dojrzałego receptora immunoglobulinowego klasy IgM (IgM BCR) są oznaką przemiany w niedojrzały limfocyt B. Na powierzchni niedojrzałego limfocytu B mogą się przez pewien czas znajdować oprócz IgM BCR także nieliczne pre-BCR. Na tym etapie z powierzchni limfocytu powoli znika cząsteczka CD10. Powstałe w ten sposób niedojrzałe limfocyty B mogą opuszczać szpik kostny, przedostawać się do krwioobiegu i wędrować do obwodowych narządów limfatycznych.
Wytworzenie przez limfocyt łańcucha ciężkiego δ i pojawienie się na powierzchni, oprócz BCR IgM, także receptora immunoglobulinowego IgD jest markerem zakończenia dojrzewania (dojrzały limfocyt B). Pojawienie się powierzchniowych IgD towarzyszy indukcja ekspresji cząsteczek CD21 i CD23, które będą uczestniczyć w kostymulacji, gdy tylko dojrzały limfocyt włączy się do swoistej odpowiedzi immunologicznej.
Selekcja pozytywna i negatywna limfocytów B
Ze względu na specyfikę aktywacji limfocytu B proces zabezpieczania organizmu przed powstaniem autoreaktywnych limfocytów nie musi być tak dokładny jak w przypadku limfocytów T. Główną tego przyczyną jest zależność limfocytów B od kooperujących z nimi limfocytów Th.
Selekcja pozytywna polega na sprawdzeniu czy doszło do prawidłowej rearanżacji genów kodujących łańcuch ciężki μ oraz pre-BCR. W procesie selekcji łańcucha ciężkiego μ nie dochodzi do rozpoznawania konkretnego antygenu. Sama obecność prawidłowego łańcucha w kompleksie z Igα i Igβ wystarcza do przekazania dojrzewającej komórce odpowiednich sygnałów. Selekcja pozytywna łańcucha ciężkiego μ służy zatem sprawdzeniu, czy geny kodujące łańcuch ciężki uległy rearanżacji w prawidłowej ramce odczytu.
Do przeżycia limfocytu pre-B niezbędne jest przekazanie sygnału przez pre-BCR. Również w tym procesie nie jest niezbędne wiązanie antygenu. Celem tej selekcji jest sprawdzenie, czy zrearanżowany w odpowiedniej ramce odczytu łańcuch ciężki potrafi się łączyć z łańcuchem lekkim. Jeśli się nie połączy to zostaje on związany przez białko opiekuńcze BiP i ulega uwięzieniu w siateczce śródplazmatycznej. Jeśli pre-B rozpozna jakiś antygen to oznacza, że komórka ta jest potencjalnie autoreaktywna i sygnał przekazywany przez pre-BCR prowadzi do selekcji negatywnej.
Ekspansja klonów oraz dojrzewanie receptora immunoglobulinowego zachodzące w grudkach limfatycznych również są rozpatrywane jako selekcja pozytywna.
Selekcja negatywna - jej celem jest usunięcie limfocytów autoreaktywnych. W procesie tym ważna jest awidność autoantygenu do receptora immunoglobulinowego. Duża siła wiązania powoduje, że komórka zostaje skierowana na drogę apoptozy, mniejsze powinowactwo do antygenu nie wystarcza, aby komórka uległa apoptozie, jest jednak wystarczające aby doprowadzić do anergii limfocytu. Optymalne jest rozpoznawanie antygenu z umiarkowanym powinowactwem.
Czynniki wpływające na dojrzewanie limfocytów B
Na proliferację, dojrzewanie i przeżycie poszczególnych prekursorów limfocytów B mają wpływ:
- stymulacja komórki przebiegająca poprzez pierwotne receptory BCR (pre-BCR)
- bodźce pochodzące od komórek otoczenia (najczęściej komórek zrębowych szpiku)
Odpowiednie warunki do dojrzewania limfocytów B zapewniają w szpiku komórki zrębowe, dzięki którym limfocyty mogą przechodzić kolejne fazy dojrzewania. Oprócz bezpośredniej interakcji komórek zrębowych z dojrzewającymi limfocytami B bardzo ważne są też czynniki wydzielane przez te komórki (zrębowe) m.in.:
- IL-7 - znajduje się na powierzchni wszystkich form rozwojowych; wpływa na przeżycie, proliferację oraz dojrzewanie limfocytów; współdziała z innymi czynnikami w rozwoju limfocytów B
- chemokina SDF-1 - ważna rola w wielu etapach dojrzewania limfocytów B: przyciąga komórki macierzyste do odpowiednich regionów szpiku podtrzymujących limfopoezę, jest silnym czynnikiem wzrostu dla wszystkich komórek linii rozwojowej limfocytów B. Limfocyty B mające w pełni wykształcone immunoglobuliny powierzchniowe tracą ekspresję receptora dla tej chemokiny, dzięki czemu mogą opuścić szpik kostny i dotrzeć do krążenia.
Również proteoglikany (np. siarczan heparanu) stanowiące element zrębu szpiku biorą udział w dojrzewaniu limfocytów B wiążąc cytkoiny oraz inne czynniki wzrostu , które w ten sposób są przytrzymywane na powierzchni komórek zrębowych, czy też na powierzchni dojrzewających komórek.
W czasie ciąży limfocyty pro-B w ogniskach hematopoezy stwierdza się już od 8-9 tygodnia. Ogniska hematopoezy stwierdza się najpierw w wątrobie płodowej, dopiero później w szpiku. Spośród limfocytów powstających w życiu płodowym dominują limfocyty o fenotypie komórek B1.
5. Selekcja limfocytów T i B
Selekcja limfocytów T
Eliminacja |
Selekcja pozytywna |
Selekcja negatywna |
Niedojrzałe tymocyty z TCR są zaprogramowane do apoptozy. Jeśli w ciągu 3-4 dni receptor nie zwiążą się z MHC na komórkach nabłonkowych grasicy, to samoczynnie ulegają apoptozie. |
Zachodzi gdy receptor TCR rozpoznał prawidłowo i związał się nie za mocno i nie za słabo, skutecznie z MHC na komórkach nabłonkowych grasicy. |
Zachodzi gdy TCR rozpoznał kompleks peptyd/MHC, ale reakcja ta doprowadziła do nadmiernego pobudzenia komórki rozpoznającej (stanowiłoby to zagrożenie dla autotolerancji). |
„Uratowanie” tymocytu od apoptozy w procesie selekcji umożliwia mu wejście w proces różnicowania się w kierunku populacji CD4 lub CD8. Do tej pory podwójnie dodatnie tymocyty wchodziły w kooperację z cząsteczkami MHC bez różnicowania ich na klasy I i II. W drugim etapie pozytywnie wyselekcjonowane tymocyty różnicują się początkowo na dwie populacje CD4+8lo i CD4lo8+. Następnie na drodze selektywnej obumierają te, które mają nieadekwatne koreceptory. W pełni dojrzeją tylko komórki z pasującą kombinacją koreceptorów TCRαβ-CD4 lub CD8 zdolne do połączenia z odpowiednią cząsteczką klasy MHC I lub MHC II.
Po pomyślnym przejściu tymoctyów przez tą selekcję opuszczają one grasicę jako limfocyty T. Komórki mające na swojej powierzchni dojrzałe receptory TCR, kompletne cząsteczki CD4+ lub CD8+ nazywane są dojrzałymi limfocytami T.
Selekcja Limfocytów B
W trakcie dojrzewania limfocytów B kilkakrotnie mamy do czynienia z selekcją, dzięki której eliminowane są komórki mające nieprzydatny receptor BCR. Komórki takie obumierają na drodze apoptozy, do której dochodzi dzięki obniżeniu się ekspresji genu Bcl-2 będącego tzw. Genem przeżycia limfocytów B.
Negatywna selekcja limfocytów w szpiku ma dwojaki przebieg:
Selekcja w grudkach limfatycznych:
Komórki dendrytyczne grudki wiążą dużą ilość antygenu w postaci kompleksów immunologicznych, które są rozpoznawane i przekazywane limfocytom B. One z kolei prezentują te antygeny limfocytom Th i w konsekwencji otrzymują sygnały kostymulujące i ulegają aktywacji. Na tym etapie obserwuje się obniżenie ekspresji Bcl-2 , co świadczy o podatności tych komórek na apoptozę.
Jeżeli do węzła limfatycznego dostaną się autoreaktywne limfocyty B o fenotypie IgMhighIgDlo to ulegną one pobudzeniu w wyniku kontaktu z antygenami. Ich pobudzeniu jednak nie będzie towarzyszył jednoczesny sygnał kostymulujący ze strony limfocytów Th. Zostaną uznane za autoreaktywne i sygnał pobudzający uruchomi program prowadzący do apoptozy.
Tą drogą 3% puli początkowej przemieni się w długowieczne limfocyty B o fenotypie IgMloIgDhigh, które zasiedlą inne narządy limfatyczne.
Jeśli receptor ma najwyższy stopień powinowactwa do danego antygenu , a ponadto komórka otrzymała dodatkową stymulację ze strony specyficznych limfocytów Th to przejdzie pomyślnie tą selekcję. |
Jeśli komórka otrzyma stymulację ze strony limfocytu ale słabo połączyła się z danym antygenem to dojdzie do apoptozy(na skutek ekspresji cząsteczki Fas na limfocycie B).
Jeśli poza tym ulegnie pobudzeniu receptor BCR to cząsteczka Fas nie indukuje apoptozy. |
Po kilku tygodniach limfocyty opuszczające węzły chłonne mają za sobą kilka rund takiej selekcji. Te limfocyty przekształcają się w komórki wytwarzające przeciwciała lub komórki pamięci.
6. Markery powierzchniowe
Są to struktury powierzchniowe- tzw. cząsteczki CD które ułatwiają diagnostykę poszczególnych stadiów dojrzewania limfocytów. Wyróżniamy ok. 270 markerów występujących na limfocytach. Jeśli na powierzchni komórek nie ma markerów CD to takie komórki nie mają odpowiedzi immunologicznej.
Najważniejsze markery opisujące subpopulacje limfocytów:
*CD2- jest jednym z wczesnych markerów dojrzewania limfocytów T w grasicy. Jej rola polega na umożliwieniu bezpośredniego kontaktu między komórkami między komórkami poprzez wiązanie liganda, jakim jest cząsteczka CD58. W ten sposób dojrzewanie tymocytów jest kontrolowane przez komórki zrębu grasicy, a także stanowi poważny mechanizm kostymulujący w aktywacji dojrzałych limfocytów T. Cząsteczka CD2 była wykorzystywana jako identyfikator limfocytów T poprzez tworzenie rozet z erytrocytami owcy.
*CD3- jest markerem późniejszych form dojrzewających limfocytów T. Jako struktura polimeryczna, połączona w błonie komórkowej z receptorem limfocytu T, składa się ona z pięciu niezmiennych łańcuchów. Kompleks ten pełni rolę w przekazywaniu sygnału aktywującego limfocyt do wnętrza komórki, po związaniu antygenu z receptorem TCR. Ważną rolę w przekazywaniu tego sygnału przypisuje się kinazom tyrozynowym, powiązanym frakcjonalnie z receptorem TCR-CD3. CD3 jest odpowiednikiem cząsteczek Igα i Igβ w limfocytach B.
*CD4 i CD8- cząsteczki CD4 i CD8 znajdują się na 95% ogólnej populacji dojrzałych limfocytów T. Pozostałę 5% stanowią limfocyty nie mające żadnej z tych cząsteczek lub mające ich nietypowe formy, np. CD8αα. Cząsteczki CD4 i CD8 zalicza się do rodziny cząsteczek immunoglobulinopochodnych. Cząsteczka CD4 jest zbudowana z pojedynczego łańcucha α, zaś CD8 z dwóch łańcuchów: α i β. W czasie wiązania receptora TCR z antygenem prezentowanym w polimorficznej części cząsteczki MHC, zadaniem cząsteczek CD4 i CD8 jest połączenie się z monomorficznym fragmentem cząsteczki MHC. Cząsteczki CD4 i CD8 poprzez wiązanie się z dwoma różnymi klasami antygenów MHC stanowią podstawę podziału populacji limfocytów T na dwie subpopulacje:
-limfocyty T pomocnicze (Th)- mają na swej powierzchni cząsteczkę CD4, rozpoznają
antygeny prezentowane przez cząsteczki MHC klasy II.
-limfocyty T cytotoksyczne (supresorowe)- mają cząsteczkę CD8, rozpoznają antygeny prezentowane im w polimorficznej części cząsteczki MHC klasy I.
Istnieją także subpopulacje limfocytów T nie mające na swej powierzchni ani cząsteczki CD4, ani też CD8. Są to tzw podwójnie negatywne (DN) limfocyty T i spotyka się je u ludzi głównie w obrębie limfocytów Tγδ
*Inne cząsteczki CD są w tabeli `Immunologia' M. Jakóbisiaka str 653-663
7. Subpopulacje limfocytów T i B, fenotyp, udział w odpowiedzi immunologicznej
Limfocyty B
B1 B2
B1a B1b
(mają CD5) (mają wszystkie inne niż CD5)
B1:
Limfocyty T
cytotoksyczne pomocnicze supresorowe
Tc Th Ts
Th1 Th2 Th0
Th1:
-wytwarzają IL-2(stymulacja cytotoksyczności limfocytów) oraz IFNγ (aktywacja makrofagów), mają udział w odpowiedzi typu komórkowego. Czynnik ich wzrostu i różnicowania to L-12,18 i IFNγ
Th2:
-wytwarzają IL-4,5,10,13 (wzrost i różnicowanie limfocytów), wspomagają głównie odpowiedź humoralną. Autokrynowym czynnikiem ich wzrostu i różnicowania jest IL-4
Antagonizm między Th1 i Th2 (tzw DEWIACJA IMMUNOLOGICZNA): IFNγ (wydzielany przez Th1) hamuję proliferację i czynność Th2, IL-10 hamuje wytwarzanie cytokin przez Th1oraz Il-4 i 13 hamują odpowiedź typu komórkowego
Th0:
-wydzielają IL-2,3,4,5,10, IFNγ, GM-CSF
Ts:
-hamują aktywność autoreaktywnych limfocytów T (zabezpieczają przed autoagresją)
-tolerancja pokarmowa (tolerancja na antygeny podane doustnie)
-tolerancja na zmienione ligandy peptydowe (zmienione antygeny nabierające cech antagonistów)
-tolerancja transplantacyjna (tolerancja na przeszczepy allogeniczne)
-tolerancja infekcyjna- indukują powstawanie innych regulatorowych limfocytów T, co umożliwia przenoszenie tolerancji z jednego osobnika na drug.i
Najważniejsze subpopulacja limofcytów T wykazujących czynność regulatorową:
-Th2 i Th1(dewiacja immunologiczna patrz wyżej :D)
-Th3 (wydzielają TGF-β
-Trl (IL-10,TGF-β)
-limf CD4+CD25+CD62L+
-limfocyty T CD8+CD28-
Tc:
-niszczenie komórek zakażonych przez wirusy i inne mikroorganizmy
-niszczenie komórek nowotworowych
-mogą leczyć komórkę zakażoną przez wirusy nie zabijając jej, hamujące w niej replikację wirusów
Limfocyty Tc zdolne są do zabijania komórek na skutek uwalniania enzymów(perforyny, granzyny, granulizyny) oraz na skutek interakcji cząsteczek z nadrodziny TNF(w błonie komórki efektorowej) i TNFR (w błonie komórki docelowej)
Limfocyty Tc
limfocyty TαβCD8+ limfocyty Tγδ limfocyty NKT komórki NK
limfocyty TαβCD4+ limfocyty NKT
Limfocyty T mające TCRγδ:
-zabijają komórki zakażone mikroorganizmami, komórki nowotworowe
-są zdolne do spontanicznej cytotoksycznosci wobec komórek nowotworowych oraz cytotoksyczności komórkowej zależnej od przeciwciał
Limfocyty NKT:
-immunregulacja (zaburzenia ich czynności sprzyjają rozwojowi chorób autoimmunizacyjnych
-są w stanie zabić komórki nowotworowe
Limfocyty trzeciej populacji:
-główny odsetek stanowią komórki NK: mają zdolność do spontanicznej cytotoksyczności wobec komórek nowotworowych, zabijają komórki zakażone przez wirusy i bakterie wewnątrzkomórkowo, ponadto są zdolne do cytotoksyczności zależnej od przeciwciał
Komórki veto:
-mają zdolność zabijania rozpoznających je limfocytów B
8. Rodzaje antygenów. Reakcje antygen-przeciwciało.
Antygeny to substancje białkowe pobudzające organizm do wytwarzania przeciwciał, które likwiduje infekcję organizmu i wzmacniają jego odporność. Mogą być wprowadzone do organizmu z zewnątrz, np. bakterie chorobotwórcze, obce białka, lub mogą powstawać w jego wnętrzu(autoagresja). Wykazują zdolność swoistego reagowania z przeciwciałami. W reakcji antygen-przeciwciało dochodzi do zlepiania, wytrącania lub rozpuszczania antygenu.
Dwie podstawowe właściwości antygenów:
- immunogenność
- antygenowość
Rodzaje antygenów:
W obrębie jednego antygenu może się znajdować wiele miejsc wiązanych przez przeciwciała. Są to tzw. epitopy lub determinanty antygenowe. Epitopy w jednej cząsteczce antygenu mogą być identyczne lub różne i mogą być wiązane przez przeciwciała o tej samej lub różnej swoistości. Antygen zawierający wiele epitopów to tzw. antygen wielowartościowy in. poliwalentny. Epitopy decydują o swoistości wiązania z przeciwciałami - im mniejszy fragment tym większa swoistość tworzenia przeciwciał.
Podział determinantów antygenowych:
- immunodominujące - rozmieszczone na powierzchni antygenu, najbardziej korzystne, szybka odpowiedź immunologiczna
- przytłumione - w głębszych warstwach antygenu, np. antygeny nowotworowo związane
- konformacyjne - o strukturze przestrzennej
- sekwencyjne - fragmenty łańcucha, słaba odpowiedź immunologiczna
Antygeny indukujące powstawanie przeciwciał (reakcje antygen-przeciwciało) możemy podzielić na:
1) GRASICZOZALEŻNE (aby powstały przeciwciała, potrzebna jest „pomoc” limfocytów T)
* w odpowiedzi na niektóre antygeny limf. T można zastąpić wydzielanymi przez nie
cytokinami
* dla reszty antygenów limf. T są niezastąpione
- wymagają prezentacji przez komórki APC (sygnał przekazywany przez limfocyt Th)
- wywołują odpowiedź humoralną i komórkową
2) GRASICZONIEZALEŻNE (nie wymagają „pomocy” limfocytów T)
- jest ich mniej niż antygenów grasiczozależnych
- przykłady: LPS, dekstran (oczyszczony preparat tuberkuliny), pewne antygeny grasiczoniezależne występują na wirusach, bakteriach i grzybach
- mają dużą masę cząsteczkową
- aktywują limfocyty B bezpośrednio (na nich znajdują się ich właśne receptory)
- są słabo metabolizowane w ustroju
- przy szybkiej reakcji na infekcje bakteriami G(-) od razu są wytwarzanie przeciwciała humoralne
- nie wywołują odp. komórkowej
- liczne powtarzające się determinanty antygenowe
W immunologii transplantacyjnej, przy przeszczepianiu narządów różnice genetyczne między dawcą a biorcą sprawiają, że układ odpornościowy biorcy rozpoznaje antygeny przeszczepu jako obce i uruchamia reakcję (odrzucanie) dążącą do jego zniszczenia.
Antygeny przeszczepu dzielimy na:
9. Cechy chemiczne antygenu , immunogenność , antygenowość.
Antygeny są to związki chemiczne, najczęściej wielkocząsteczkowe, które są rozpoznawane przez komórki układu immunologicznego jako składniki nie własne. Prowadzi to do produkcji komplementarnych przeciwciał lub uczulonych komórek, które w sposób swoisty reagują z tymi przeciwciałami.
Głównymi cechami antygenów są :
Immunogenność to znaczy zdolność do wywołania przeciw sobie swoistej odpowiedzi immunologicznej,
Antygenowość czyli zdolność do swoistego łączenia się z immunoglobulinami (zarówno wolnymi , jak i stanowiącymi receptory limfocytów B) i receptorami limfocytów T.
Antygen wykazujący tylko antygenowość nazywamy haptenem.
Haptenami mogą być proste związki chemiczne , np. glukoza lub trinitrofenol . Immunogenność zyskują one dopiero po połączeniu z nośnikiem , którym może być np. cząsteczka białka. W odpowiedzi na hapten połączony z nośnikiem limfocyty B rozpoznają hapten ,a limfocyty Th nośnik białkowy.
Immunogenność antygenu zależy od wielu czynników m.in. wielkości cząsteczki (za małe nie wywołują reakcji), budowy chemicznej, degradowalności , stężenia (za mała i zbyt duża dawka nie wywołują odpowiedzi) i drogi wniknięcia do ustroju. W zależności od drogi podania antygenu jego degradacja zachodzi w różnych narządach (śledziona, wątroba, płuca, węzły chłonne i inne).Reakcja ta może być wzmocniona przez związki zwane adjuwantami. Zwiększają one zdolność do odpowiedzi immunologi
10. Antygeny pełnowartościowe, hapteny.
Antygen - to makrocząsteczka, która wykazuje dwie cechy: immunogenność, czyli zdolność wzbudzenia przeciwko sobie odpowiedzi odpornościowej swoistej, oraz antygenowość, czyli zdolność do reagowania z przeciwciałami oraz TCR.
Ze względu na występowanie powyższych cech, wyróżnia się dwa typy antygenów:
- antygeny pełnowartościowe (immunogeny) - posiadające obie wymienione cechy,
- antygeny niepełnowartościowe (hapteny) - wykazujące tylko antygenowość
a) Immunogenami są zwykle białka, które mogą spowodować indukcję swoistej odpowiedzi odpornościowej
Cechy substancji zwiększające jej immunogenność:
- duża masa cząsteczkowa
- złożona budowa
- mała rozpuszczalność
- możliwość łatwego tworzenia kompleksów z białkami MHC
Ponadto immunogenność wykazują substancje podane w dawkach niezbyt dużych, ale też nie za małych. W przypadku białek liczy się także podobieństwo do białek danego organizmu (im większe, tym większa immunogenność) oraz to, czy białko jest zdenaturowane, czy nie (zdenaturowane jest bardziej immunogenne).
Wpływ na immunogenność ma też droga podania danej substancji, przy czym podanie podskórne jest najbardziej efektywne we wzbudzeniu odpowiedzi odpornościowej.
Sposobem na zwiększenie immunogenności jest również zastosowanie adiuwantów, przy czym istotne jest, aby adiuwant uwalniał się powoli z miejsca podania.
b) Hapteny to małe cząsteczki, najczęściej jednowartościowe, które nie posiadają właściwości immunologicznych, czyli są niezdolne do pobudzania wyższego ustroju do wytwarzania swoistych przeciwciał, natomiast posiadają one właściwości antygenowe, tzn. reagują z przeciwciałami powstałymi pod wpływem pełnowartościowych antygenów, w skład których wchodzi dany hapteny.
Przykłady haptenów:
- Antybiotyki, gentamycyna, penicylamina
- Aspiryna,
- Składniki roślinne, np. żywice
- Analgetyki,
- Peptydy niskocząsteczkowe,
- Wielocukry bakteryjne,
- Kwasy nukleinowe
Hapteny po związaniu z nośnikiem, którym mogą być albuminy, globuliny, syntetyczne polipeptydy nabywają właściwości immunogennych.
Leki często wiążą się do nośników występujących naturalnie w organizmie, co powoduje, że stają się one immunogenne. Niejednokrotnie hapteny są alergenami
11. Budowa przeciwciał, klasy i podklasy, powinowactwo, wartościowość.
Immunoglobuliny (przeciwciała) to najważniejsze cząstki układu odpornościowego. Wytwarzane są przez pobudzone limfocyty B (odpowiedz typu humoralnego) pod wpływem antygenów, mają zdolność do swoistego wiązania się z nimi przez co powodują ich inaktywację
Budowa i właściwości:
Występują w płynach ustrojowych wszystkich kregowców. Cząsteczka immunoglobuliny zbudowana jest z 4 łańcuchów polipeptydowych; 2 lekkich L i 2 ciężkich H połączonych wiązaniem dwusiarczkowym.
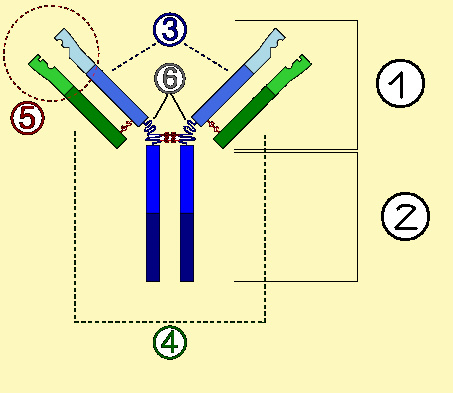
1Schemat budowy przeciwciał
1. Fragment Fab
2. Fragment Fc
3. Łańcuch ciężki
4. Łańcuch lekki
5. Części zmienne łańcuchów (V)- miejsca wiązania
antygenu
6. Regiony zawiasowe
****** oznacza mostki disiarczkowe
Fragment Fab zawiera miejsce wiążące antygen tzw. paratop i jest on przestrzennie dopasowany do determinanty antygenowej- epitopu.
Region zawiasowy- umożliwia ustawienie się fragmentów Fab pod różnym kontem względem siebie i fragmentu Fc. Tu znajdują się wiązania dwusiarczkowe, które łączą obydwa łańcuchy ciężkie.
We fragmencie FC są odcinki odpowiadające za aktywację dopełniacza, a także za wiązanie się z komórkowymi receptorami dla fragmentu Fc przeciwciała.
Podstawą do klasyfikacji przeciwciał są różnice w budowie ich łańcuchów:
Drobne różnice w budowie łańcuchów ciężkich w obrębie tej samej klasy są podstawą różnicowania u człowieka podklas, np. IgG1-4, w analogicznych odmianach występują łańcuchy lekkie λ. Te różnice to tzw. odmiany izotypowe przeciwciał.
Przeciwciała występują nie tylko w formach monomerycznych (4 łańcuchy) mogą także tworzyć formy polimeryczne (posiadają dodatkowy polipeptydowy łańcuch łączący J „joing”). IgA jako monomer występuje w surowicy, a w wydzielinach śluzowo-surowiczych jako dimer.
W łańcuchach ciężkich i lekkich można wyróżnić części zmienne (V) leżące w odcinku N- końcowym i części stałe (C) obejmujące odcinek C-końcowy.
Swoistość przeciwciał wynika z konfiguracji przestrzennej w części zmiennej łańcuchów ciężkich i lekkich tzn. zależy od kolejności aminkowasów w tych częściach. Części zmienne fragmentu Fab są różne dla p/ciał wiążących różnej epitopy, a części stałe są identyczne dla wszystkich p/ciał danej klasy, ewentualnie podklasy.
Regiony hiperzmienne determinują swoistość p/ciał bo to one tworzą miejsca wiążące antygen (regiony determinujące dopasowanie CDR)
Wśród p/ciał, które wiążą ten sam epitop, mogą jeszcze występować różnice pod względem dopasowania, czyli tzw. powinowactwo p/ciała do antygeu.
Obszary homologiczne (domeny) to liniowo powtarzająca się sekwencja aminokwasów występująca zarówno w łańcuchach ciężkich jak i lekkich. Obejmuje ok. 110 aminokwasów i pętle zamknięte mostkiem dwusiarczkowym.
Po 1 domenie zawierają części zmienne łańcuchów lekkich i ciężkich oraz części stałe łańcuchów lekkich. Po 3 doemny zawierają części stałe łańcuchów ciężkich IgA, IgG, IgD, a 4 domeny maja IgE i IgM.
Wszystkie immunoglobuliny zawierają przyłączone łańcuchy cukrowe. Ludzkie IgG ma od 2 do 3 N- związanych oligosacharydów. Brak tych łańcuchów cukrowych zaburza łączenie się IgG z receptorami dla fragmentu Fc p/ciał na makrofagach i monocytach.
Markery antygenowe pozwalają na klasyfikacje p/ciał:
Właściwości p/ciał:
Krótka charakterystyka immunoglobulin różnych klas:
Wartościowość, powinowactwo;
Wartościowość to liczba determinant antygenowych, które może związać cząsteczka p/ciała. Immunoglobuliny IgG, IgD i IgE, mają po 2 miejsca wiążące antygen i stąd są 2-wartościowe, IgA 2- lub 4-wartościowe (w zależności od tego czy są mono-, czy dimerem), a IgM 10-wartościowe.
Określony antygen łączy się z miejscem wiążącym p/ciała z tym większą siłą, im bardziej antygen i miejsce wiążące są do siebie ściślej dopasowane. W wiązaniu tym biorą udział:
Siła wiązania pojedynczej determinanty antygenowej przez miejsce wiążące p/ciała określamy jako powinowactwo. Antygeny o tej samej swoistości mogą się różnić powinowactwem
Przeciwciała humoralne
Limfocyty B w wyniku aktywacji bezpośredniej przez antygeny grasiczoniezależne, lub w wyniku aktywacji przez antygeny grasiczozależne przy udziale limfocytów Th ulegają transformacji blastycznej czego wynikiem jest powstanie komórki plazmatycznej produkującej przeciwciała humoralne.
Zawsze jako pierwszy jest syntezowany łańcuh ciężki. Powstanie prawidłowego łańcucha ciężkiego jest sygnałem przerywającym rekombinację w obrębie kodujących go genów. Następnie rozpoczyna się rekombinacja genów kodujących lekki łańcuch κ. Po przejściu do światła siateczki śródplazmatycznej łańcuch ciężki łączy się z należącym do białek opiekuńczych tzw. białkiem wiążącym (binding protein), przytrzymującym go w oczekiwaniu na łańcuch lekki, z którym ma się połączyć. Białko to wiąże hydrofobowe sekwencje łańcuchów ciężkich zapobiega ich agregacji a także wolne łańcuchy lekkie. Powstałe przeciwciała przechodzą do aparatu Golgiego, gdzie np. wzbogacane są w grupy węglowodanowe. Następnie immunoglubuliny są uwalniane przez komórkę. Przeciwciała humoralne obecne są w płynach tkankowych oraz w wydzielinach śluzowo-surowiczych. Biorą udział w humoralnej odpowiedzi immunologicznej. Przyczyną ich ogromnej różnorodności i możliwości wiązania każdego możliwego antygenu są mutacje w obrębie genów kodujących łańcuchy immunoglobulin.
Przeciwciała monoklonalne
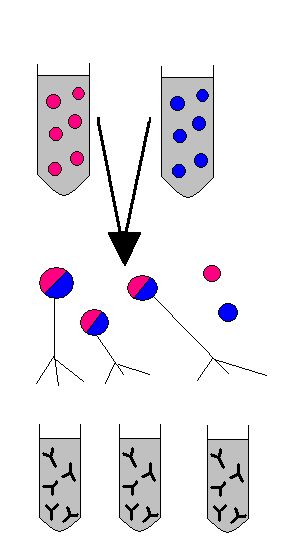
Przeciwciała monoklonalne to homogeniczna populacja cząsteczek przeciwciał. Jeden klon przeciwciał monoklonalnych jest złożony z identycznych łańcuchów ciężkich i lekkich. Jest więc specyficzny względem tego samego epitopu i wiąże się do niego z takim samym powinowactwem. Otrzymywanie przeciwciał monoklonalnych polega na fuzji limfocytów B z komórkami szpiczakowatymi. Limfocyty B otrzymywane są w wyniku immunizacji myszy. Następnie ze śledziony zwierzęcia pobiera się komórki plazmatyczne. Komórki szpiczaka, czyli komórki plasmocytoma są to mysie komórki nowotworowe. Swoistość przeciwciał produkowanych przez tak otrzymaną hybrydę gwarantuje limfocyt B, komórka nowotworowa z kolei zapewnia hybrydzie „nieśmiertelność” co pozwala na długą hodowlę in vitro. Poza tym, szpiczak dostarcza wielu rybosomów i rozwinięty aparat Golgiego co pozwala na syntezę dużej ilości białek.
Takie substancje jak lizolecytyna czy glikol etylenowy ułatwiają fuzję błon i sprzyjają tworzeniu się hybryd.
Mimo to, tylko część komórek ulega fuzji, z kolei wśród komórek ulegających fuzji tylko część stanowi hybryda szpiczaka i pobudzonego antygenem limfocytu B. Do produkcji przeciwciał monoklonalnych najlepiej nadają się komórki szpiczaka które:
•są nieprawidłowe lub niezróżnicowane na tyle, że nie wytwarzają przeciwciał
•mają defekt metaboliczny - brak transferazy hipoksantynoguaninofosforybozylowej, który przyśpiesza ich obumieranie co pozwala na szybką eliminacje ze środowiska tych komórek nowotworowych, które nie uległy fuzji
Kiedy zawiesina zawiera wyłącznie hybrydy rozcieńcza się ją tak, że na jeden dołek płytki hodowlanej przypada jedna komórka.
Każda hybryda wytwarza pojedynczy typ cząsteczki przeciwciała.
Tylko niektóre hybrydy będą wytwarzały przeciwciała, bo tylko niektóre użyte do fuzji limfocyty B posiadały taką zdolność.
Alternatywna metoda produkcji PM polega na „unieśmiertelnianiu” limfocytów B wytwarzających odpowiednie przeciwciała przez transformację wirusem Epsteina-Barr
Przeciwciała monoklonalne wzbudzają wielkie zainteresowanie naukowców, bo:
•Sa identyczne
•Komórki je wytwarzające hoduje się in vitro
•Można otrzymać ich olbrzymią ilość
Obecnie tylko kilkanaście PM zostało zaakceptowanych do stosowania u ludzi, są to m. in. przeciwciała
przeciw cytomegalowirusowi oraz przeciw Pseudomonas aeruginosa, E.coli, K. Pneumoniae, które są skierowane przeciw lipidowi A endotoksyny
Ponad to, już przeszło sto przeciwciał monoklonalnych wypróbowuje się w badaniach klinicznych.
PM są używane do wykrywania i określania stężeń leków, hormonów i enzymów występujących w płynie tkankowym nawet w znikomej ilości. Stosuje się je także w diagnostyce chorób zakaźnych, która została skrócona z kilku dni do kilku minut
PM OKT3 to jedne z najczęściej stosowanych przeciwciał monoklonalnych. Skierowane przeciw cząsteczkom CD3 na limfocytach T powodują ich niszczenie, wywołują immunosupresję dlatego są stosowane przy przeszczepach. Podobnie w zapobieganiu odrzucaniu przeszczepów allogenicznych wykorzystywane są PM przeciw receptorowi dla interleukiny 2 obecnemu na pobudzonych limfocytach T.
Przeciwciała monoklonalne stosowane są także w leczeniu chorób nowotworowych:
PM anty-CD20 - niektóre typy chłonniaków
PM 17-1A - rak okrężnicy
PM anty-HER2neu - rak sutka
W medycynie szerokie zastosowanie znalazły także liczne pochodne przeciwciał monoklonalnych, do których należą:
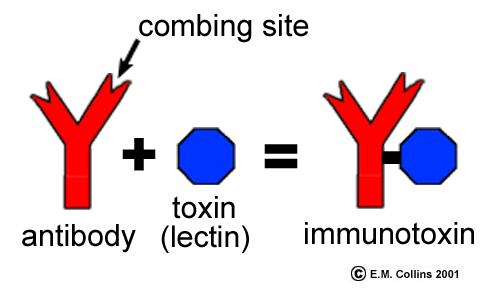
Immunotoksyny - wyspecializowani zabójcy komórek nowotworowych
•Tworzone są przez chemiczne połączenie immunoglobuliny z cząsteczką toksyny
•Wykorzystuje się toksyny roślinne, bakteryjne oraz grzybicze wykazujące dużą aktywność
•Cytotoksyczność immunotoksyn to najbardziej skuteczny sposób walki z rakiem
•Cząsteczka PM łączy się z antygenami na komórce nowotworowej, a przyłączona cząsteczka toksyny atakuje ją
•Czasami do zabicia wystarczy jedna cząsteczka toksyny
•Blokowana jest synteza białek więc giną komórki dzielące się i nie dzielące
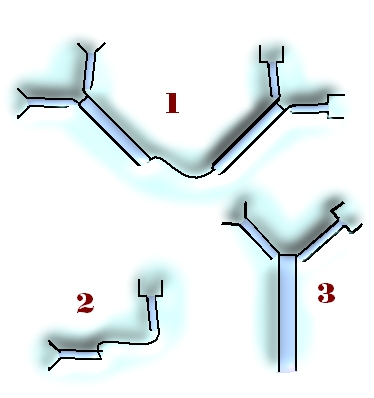
•Z reguły zdrowe komórki pozostają niezagrożone
Przeciwciała o podwójnej swoistości
Zawierają dwa różne fragmenty Fab łączące się z dwoma różnymi antygenami
Sposoby uzyskania podwójnej swoistości przeciwciał monoklonalnych:
•1. Sprzężenie chemiczne dwóch różnych przeciwciał o różnej swoistości
•2. Chemiczne połączenie dwóch fragmentów Fab od różnych przeciwciał
•3. Podwójne hybrydy - „kwadroma” - jedno przeciwciało z dwoma fragmentami Fab o różnej swoistości
Przeciwciała monoklonalne o podwójnej swoistości próbuje się stosować klinicznie w zwalczaniu nowotworów. Jeden fragment Fab wiąże komórkę nowotworową, zaś drugi toksynę lub cytotoksyczny limfocyt T zdolny do zabicia komórki nowotworowej.
Przeciwciała katalityczne - abzymy
Udało się uzyskać przeciwciała, zmniejszające energię aktywacji określonych reakcji chemicznych, przyspieszając je nawet milion razy. Było to możliwe, ponieważ dopasowanie przeciwciał do antygenu przypomina dopasowanie enzymu do substratu.
Przeciwciała antygenizowane
Ich działanie opiera się na odpowiedniej modyfikacji trzeciego regionu hiperzmiennego łańcucha ciężkiego immunoglobuliny CDR3. Jeżeli słabo immunogenną determinantę antygenową (epitop) wbudować w region CDR3, staje się ona bardziej immunogenna. Takie przeciwciała otrzymuje się przez odpowiednią modyfikację genu łańcucha ciężkiego - dodając gen kodujący odpowiedni epitop
Jednołańcuchowe białka wiążące antygen.
Otrzymane przez połączenie części zmiennej łańcucha lekkiego i ciężkiego. Mają zdolność wiązania antygenu przy stosunkowo małych rozmiarach cząsteczki. Małe rozmiary ułatwiają penetrację do komórek nowotworowych. Wykorzystuje się to łącząc je z odpowiednimi toksynami lub izotopami w celu zwalczania nowotworów.
Miniciała (minibodies)
Możliwe jest również połączenie dwóch fragmentów Fv wiążących różne antygeny. Powstaje wtedy zminiaturyzowany wariant przeciwciał o podwójnej swoistości.
Przeciwciała poliklonalne.
Są uzyskiwane na drodze wyizolowania ich ze zwierzęcia np. konia, królika, które zostało poddane wcześniej immunizacji ludzkimi tymocytami lub innymi komórkami ludzkiego układu odpornościowego. Przeciwciała poliklonalne są więc zdolne do hamowania komórkowej odpowiedzi immunologicznej, nazywa się je także przeciwciałami przeciw limfocytom T. Tego rodzaju immunoglubuliny, jak sama nazwa wskazuje pochodzą z więcej niż jednego klonu komórek plazmatycznych. Różnią się między sobą składem łańcuchów ciężkich i lekkich. Wynika z tego, że mają odmienne powinowactwo do epitopów antygenu - mogą się wiązać do różnych epitopów i z odmienną siłą. Surowica zawierająca te przeciwciała, analogicznie, nosi nazwę surowicy poliklonalnej. Przeciwciała poliklonalne są łatwiejsze i tańsze do otrzymania niż monoklonalne.
Po podaniu tych przeciwciał następuje spadek liczby limfocytów krążących we krwi, dochodzi do ich opsonizacji oraz fagocytozy, zostaje zaaktywowana ADCC (antibody-dependent cellular cytotoxicity czyli cytotoksyczność komórkowa zależna od przeciwciał.) W związku z powyższym, przeciwciała poliklonalne stosowane są w leczeniu i profilaktyce ostrego odrzutu przeszczepu. Zastosowanie tej terapii powoduje efekty uboczne, do których należą m.in.: reakcja anafilaktyczna, gorączka, leukopenia, małopłytkowość, dreszcze, gorączka, zakażenie wirusowe oraz najważniejsze i najczęstsze tj. choroba posurowicza z artralgią
Przeciwciała to najważniejsze cząsteczki układu immunologicznego. Są to substancje białkowe, wytwarzane przez pobudzone limfocyty B w organizmach wyższych zwierząt i człowieka pod wpływem działania antygenów. Mają one zdolność do swoistego wiązania się z nimi, co powoduje inaktywację owych antygenów. Cząsteczka immunoglobuliny zbudowana jest z czterech łańcuchów polipeptydowych: 2 lekkich-L i 2 ciężkich połączonych wiązaniami dwusiarczkowymi zależności od różnić w budowie łańcuchów: α (alfa), δ (delta), ε (epsilon), γ (gamma) i μ (mi) wyróżniamy 5 klas przeciwciał: IgA, IgD, IgE, IgG, IgM. Łańcuchy lekkie występują w dwóch wariantach: typu κ (kappa) i typu λ (lambda).Drobne różnice w budowie łańcuchów ciężkich w obrębie tez samej klasy są podstawa do odróżnienia podklas: IgG(IgG1-IgG4), IgA(IgA1,IgA2).Powyższe różnice w budowie łańcuchów ciężkich w obrębie(klasy i podklasy)i lekkich(typy i podtypy) to odmiany izotopowe przeciwciał. Właściwości przeciwciał:
-aktywację układu dopełniacza
-indukcję immunofagocytozy
-indukcję cytotoksyczności komórkowej zależnej od przeciwciał
Udział poszczególnych immunoglobulin w odpowiedzi immunologicznej:
IgA- Organizm wytwarza więcej IgA niż wszystkich innych immunoglobulin razem wziętych. Większość IgA jest wytwarzana miejscowo w sąsiedztwie odpowiedniego nabłonka i wydalana wraz z wydzielinami śluzowo-surowiczymi. Wydzielnicze IgA stanowią główny element obrony błon surowiczych i śluzowych przez inwazją mikroorganizmów błony te są potencjalnie największymi wrotami zakażenia. U osoczu człowieka występuje w 80-90% w formie monomerycznej. W wydzielinach surowiczych i śluzowo-surowiczych, wydzielinach gruczołów przewodu pok., dróg oddechowych,i dróg moczowych IgA występuje w formie dimerów związanych z tak zwanym fragmentem wydzielniczym. Są to S-IgA(sekrecyjne.) S-IgA bierze udział w obronie błon śluzowych przed zakażeniami wirusowymi i bakteryjnymi i jest związana z większą zdolnością neutralizowania cząsteczek wirusów i większa efektywnością aglutynacji bakterii przez formy polimeryczne IgA w porównaniu do form monomerycznych. S-IgA mogą nieswoiście chronić błony śluzowe przed zakażeniami bakteryjnymi. zapobiegają kolonizacji patogenów.
IgD-Wystepują dość licznie wraz z IgM na powierzchni limfocytów B, które nie zetknęły się jeszcze z antygenem, jako ich receptory immunoglobulinowe. IgD jako receptory immunoglobulinowe dziewiczych limfocytów B wydają się bardzo skuteczne w wiązaniu antygenu.
IgE-podobnie jak IgM zawierają 4 domeny w częściach stałych łańcuchów ciężkich, ale nie zawierają regionu zawiasowego. W odróżnieniu od IgM, IgE nie zawierają odcinków ogonowych. Immunoglobuliny tej klasy wiążąc się z odpowiednimi receptorami FcR na komórkach tucznych wywołują po związaniu antygenu de granulacje tych komórek, co leży u podstaw anafilaksji. Odpowiedzialne za reakcje alergiczne typu natychmiastowego. Powodują uwalnianie histaminy z mastocytów. Odgrywają także rolę w zwalczaniu pasożytów.
IgG-Wszystkie podklasy IgG zawierają region zawiasowy, a w IgG3 jest on bardzo wydłużony(62 aminokwasy) i w regionie jest aż 11 wiązań dwusiarczkowych łączy łańcuchy ciężkie.IgG1,IgG2,IgG4 wiąże się z fragmentem Fc z białkiem A gronkowca złocistego. Wszystkie klasie IgG łączą się również tym fragmentem z białkiem G paciorkowca. Wiele komórek ma receptory dla fragmentu Fc przeciwciał IgG(FcγR). Dzięki tym receptorom komórki K są zdolne do zabicia komórek opłaszczonych przez IgG w wyniku cytotoksyczności komórkowej zależnej od przeciwciał. Z kolei komórki żerne np. makrofagi i neutrofile, dzięki obecności na nich FcγR, energicznie fagocytują komórki i cząsteczki opłaszczone przeciwciałami w procesie zwanym immunofagocytozą. IgG są bardzo ważnymi immunoglobulinami w walce z mikroorganizmami wnikającymi do tkanek. IgG są w sposób aktywny, z udziałem receptorów FcR transportowane z organizmu matki poprzez łożysko do organizmu płodu. Przez łożysko przechodzą wszystkie podklasy IgG.
IgM-Przeciwciała tej klasy są syntetyzowane w początkowej fazie odpowiedzi immunologicznej; są to również pierwszej przeciwciała syntetyzowane w rozwoju osobniczym. W trakcie pierwotnej odpowiedzi immunologicznej IgM są uwalniane najpierw i ich powinowactwo do antygenu jest na ogół małe, gdyż ich uwalnianie zachodzi jeszcze przed dojrzewaniem powinowactwa. Ma aż 10 fragmentów Fab, łączy się z antygenem posiadającym wiele epitopów z dużą zachłannością(awidnością).IgM aktywuje układ dopełniacza o 100-400 lepiej niż IgG.
IgM eliminują ponadto patogeny we wczesnych stadiach odporności zależnej od limfocytów B, zanim zostaną wyprodukowane wystarczające ilości IgG.
14. Nieswoista odpowiedź immunologiczna, układ dopełniacza, fagocytoza.
(zagadnienia bardzo obszerne, wiec przepraszam, za objętość - ale to dla Waszego dobra )
Mechanizmy nieswoiste są filogenetyczne starsze niż swoiste. Są mało precyzyjne, ale za to reagują szybko stanowiąc pierwszą linię obrony. Biorą w nich udział przede wszystkim bariery mechaniczne, komórki żerne (zarówno makrofagi, jak i granulocyty), komórki NK, układ dopełniacza, lizozym, interferon, transferyna, białko C-reaktywne i inne białka ostrej fazy, komórki zdolne do cytotoksyczności spontanicznej.
Omawiając nieswoiste mechanizmy odporności należy przypomnieć, że równolegle działające mechanizmy swoiste - zainicjowane przez połączenie się przeciwciał lub receptorów limfocytów T ze swoistym antygenem - ściśle kooperują z odpornością nieswoistą w walce z infekcjami mikroorganizmów.
/Uwaga! Zagadnienia z makrofagów, granulocytów, interferonu oraz odporności związanej z błonami śluzowymi i skórą opracowane są w tematach 15, 16 i 17/
BARIERY MECHANICZNE w odporności organizmu chronią przed wnikaniem drobnoustrojów do wnętrza organizmu. Głównymi barierami są:
Skóra
Elementy zapewniające ochronę:
Błony śluzowe
Przewód pokarmowy:
Drogi oddechowe:
Spojówki:
Ucho zewnętrzne:
Drogi moczowo - płciowe:
UKŁAD DOPEŁNIACZA
(zdjęcia i obrazki dostępne są w prezentacji pt. Dopełniacz; może trochę szeroko rozwinięte, ale nie umiem bardziej streścić)
Układ dopełniacza jest układem ochronnym występującym u wszystkich kręgowców. Należy do odporności nieswoistej, gdyż sam nie rozpoznaje precyzyjnie antygenów. Nazwa pochodzi od tego, że stanowi on uzupełnienie (czyli dopełnienie) roli przeciwciał. Jest to jeden z przykładów ścisłych powiązań między swoistymi, a nieswoistymi mechanizmami odporności. U człowieka składa się, wliczając czynniki regulujące, z ok. 30 białek surowicy i płynów tkankowych oznaczonych najczęściej literą C (complement) i odpowiednimi cyframi. Białka te syntezowane są przez hepatocyty i monocyty.
Do głównych składników układu dopełniacza należą:
Rola niektórych czynników osoczowych regulujących aktywność dopełniacza:
- inhibitor C1 - Łączy się z C1r i C1s i usuwa je z kompleksów C1
- Białko wiążące C4 - łączy się z C4b i przyspiesza odłączenie C2b
- DAF (ang. decay accelerating factor) - Czynnik przyspieszający rozkład C3 i C5
- białko S (witronektyna) - Wiąże C5b-7 zapobiegając wbudowywanie się tego kompleksu w błonę komórkową
- receptor C1 (CR1) - białka regulatorowe
Przy odpowiednim pobudzeniu składniki te reagują ze sobą kaskadowo i wywierają odpowiedni efekt, głównie w stosunku do błony komórkowej. Efekt ten przejawia się w postaci:
Dopełniacz może doprowadzić nie tylko do zniszczenia komórek bakteryjnych, pasożytniczych i nowotworowych przez uszkodzenie ich błony komórkowej, ale dzięki licznym receptorom na komórkach żernych, może przyciągnąć te ostatnie do miejsca infekcji i ułatwić fagocytozę bakterii.
Dopełniacz może być aktywowany bezpośrednio przez przeciwciała związane z bakterią bądź jakimkolwiek antygenem (droga klasyczna) lub przez pewne cząsteczki związane z bakteriami (droga alternatywna). Składnik C3 obecny w surowicy w dużym stężeniu jest niezbędny do prawidłowego przebiegu obu szlaków aktywacji, a jego przemiana w C3a i C3b jest najważniejszym etapem aktywacji całego układu.
Klasyczna droga aktywacji dopełniacza:
Przeciwciała potrafią precyzyjnie rozpoznać antygeny obecne na powierzchni intruzów i połączyć się z tymi antygenami. Jednak same przez się nie są w stanie ich zniszczyć. Rola czynnika niszczącego przypada dopełniaczowi.
Proces aktywacji:
Na tym etapie kończy się enzymatyczna aktywacja dopełniacza.
Alternatywna droga aktywacji dopełniacza
Uczestniczą w niej czynniki: B, D, H, I, P(properdyna) i składnik C3 dopełniacza.
Do aktywatorów drogi alternatywnej (czyli bez udziału przeciwciał) zalicza się: bakterie G+ i G-, szczególnie polisacharydy ścian bakteryjnych, wirusy i zakażone przez nie komórki, grzyby, pierwotniaki, niektóre robaki pasożytnicze i niektóre komórki nowotworowe, a także kompleksy immunologiczne zawierające IgG, IgA, IgE. Aktywacja ta zachodzi w zasadzie spontanicznie.
Aktywacja dopełniacza drogą alternatywną ma znaczenie dla szybkiej odpowiedzi przeciw inwazji mikroorganizmów, zanim rozwinie się bardziej precyzyjna i skuteczna, ale powolniejsza swoista odpowiedź immunologiczna i pojawią się przeciwciała.
Przebieg procesu:
Konwertazę C3 i C5 drogi alternatywnej stabilizuje properdyna, chroniąc ją przed czynnikami H i I. Od momentu rozszczepienia C5 dalsza aktywacja dopełniacza jest wspólna dla obu dróg.
Kompleks atakujący błonę
Główna rola MAC to niszczenie wnikających do naszych tkanek mikroorganizmów. Wrażliwe na ten atak są bakterie G-, niektóre wirusy, pierwotniaki i mykoplazmy. MAC zdolny jest tez do niszczenia erytrocytów np. zakażonych wirusem, jeżeli rozpoznane są one i opłaszczone aktywującymi dopełniacz przeciwciałami.
Rola układu dopełniacza:
FAGOCYTOZA
Fagocytoza jest szczególnie ważnym mechanizmem immunologicznym służącym do zabijania mikroorganizmów. Jest to bardzo wydajny proces przeprowadzany przez granulocyty i makrofagi.
Etapy procesu fagocytozy:
Receptory na komórkach żernych uczestniczące w fagocytozie:
1) Dla fragmentu Fc przeciwciał (FcR receptory):
Receptory FcR - dla fragmentu Fc przeciwciał:
a) klasy IgG. Przeciwciała klasy IgG to najefektywniejsze opsoniny. Indukowana przez nie fagocytoza zależy od obecności na komórkach żernych receptorów, które możemy podzielić na trzy zasadnicze typy:
- FcγRI największe powinowactwo do IgG; jako jedyny wiąże wolne przeciwciała
- FcγRII najpowszechniejszy; wiąże tylko IgG połączone z antygenem
- FcγRIII wiąże tylko IgG połączone z antygenem
Przeciwciała IgG rozpoznają i wiążą określone cząsteczki lub komórki, np. bakterie, dzięki czemu umożliwiają ich fagocytozę (bez udziału przeciwciał mogłyby nie być „dostrzeżone” przez granulocyty i makrofagi).
Inne właściwości FcγR:
b) inne receptory dla fragmentu Fc przeciwciał
2) Dla składników dopełniacza
3) Inne receptory i czynniki ułatwiające fagocytozę:
a) receptory na monocytach i makrofagach o charakterze integryn zdolne do wiązania fibronektyny, która indukuje przez swe receptory na komórkach żernych fagocytozę
b) białka ostrej fazy: białko C-reaktywne, które wiąże pewne wielocukry na bakteriach G(+), białko wiążące LPS w ścianie G(-)
c) kolektyny wiążące oligosacharydy na powierzchni różnych mikroorganizmów, np.lektyna wiążąca mannozę - indukuje fagocytozę oraz pobudza komórki żerne do zabicia mikroorganizmu; jest elementem odpowiedzi nieswoistej i przykładem udziału lektyn w fagocytozie (lektynofagocytoza)
d) receptory zmiatacze (obecne na monocytach i makrofagach) - uczestniczą w usuwaniu mikroorganizmów, ich toksycznych produktów oraz komórek apoptotycznych
Zabijanie poprzez fagocytozę i zniszczenie wewnątrzkomórkowe:
a) mechanizmy tlenowe
b) mechanizmy pozatlenowe
Mechanizmy tlenowe: fagocytoza drobnoustrojów powoduje pobudzenie procesów oddechowych i powstanie reaktywnych utleniaczy o właściwościach toksycznych, do których należą zarówno toksyczne związki tlenowe, jak i utlenowane halogenki.
Przemiany prowadzące do powstawania tych związków, zachodzące w komórkach żernych:
Reaktywne formy tlenu - RFT działają w fagolizosomie i są toksyczne wobec bakterii, pasożytów, grzybów, a nawet komórek nowotworowych. Najaktywniejsze z nich to rodnik hydroksylowy i tlen singletowy. RFT , które mogą częściowo wydostać się z fagolizosomu, są potencjalnie toksyczne dla samej komórki żernej i mogą być mutagenne dla komórek otaczających. Dlatego też są dezaktywowane przez: dysmutazę ponadtlenkową, katalazę i glutation.
Mechanizmy pozatlenowe:
BPI (bactericidal/permeability increasing factor) - czynnik bakteriobójczy zwiększający przepuszczalność (bactericidal/permeability increasing factor). To białko kationowe bogate w lizynę , zawarte w ziarnach azurofilnych neutrofilów człowieka, ma silne właściwości bakteriobójcze, działa na wiele bakterii G- (np. E.coli, S.typhimurium) ale nie na G+ i grzyby
Działanie BPI:
Katepsyna G
Defensyny
Kateliny- katelicydyny
Lizozym - muramidaza
15. Rola interferonów w odpowiedzi immunologicznej
Interferony to cytokiny wytwarzane i uwalniane przez komórki w odpowiedzi na zakażenie wirusowe.
Komórki ludzkie wytwarzają pięć typów interferonów: α, β, κ, ω (typ I) i γ (typ II). α wytwarzany jest przez leukocyty, β przez fibroblasty, κ przez keratynocyty. Natomiast interferon γ (immunologiczny) wytwarzany jest przez limfocyty T (pod wpływem działania antygenów, cytokin lub mitogenów), komórki NK (stymulowane cytokinami), komórki NKT oraz aktywowane makrofagi .Organizm ludzki wytwarza ponad 20 rodzajów interferonów α i po jednym rodzaju pozostałych.
Powstawanie interferonów:
Komórki traktowane interferonem w niewielkich stężeniach wytwarzają go więcej niż komórki nie traktowane interferonem. Zjawisko to określane jest jako priming.
Rola interferonów:
Działanie przeciwwirusowe interferonów polega na interferacji z replikacją wirusów na poziomie transkrypcji i translacji oraz utrudnianiu formowania się wirionów. Translacja wirusowego mRNA hamowana jest przez:
Różnorodność mechanizów działania sprawia, że wirusy nie dysponują skutecznymi formami oporności na interferony. Jedynie niektóre hamują aktywność kinazy białkowej R i syntetazy oligoizoadenylanowej; mogą także wiązać i rozkładać interferony.
INF α i β mają znacznie silniejsze działanie przeciwwirusowe niż γ. Działanie to częściowo zależy od wpływu interferonów na układ odpornościowy, np. od aktywacji komórek cytotoksycznych zdolnych do zabijania komórek zakażonych przez wirusy oraz od stymulacji makrofagów do działania cytotoksycznego i fagocytarnego.
W tym przypadku interferon γ jest znacznie bardziej aktywny niż α i β: ułatwia różnicowanie limfocytów T, wzmaga cytotoksyczność komórkową zależna od przeciwciał oraz cytotoksyczność komórek NK, LAK, makrofagów (ekspresja indukowanej syntetazy tlenku azotu) i TNF
Wirusy mogą być w niektórych przypadkach mieć hamujący wpływ na ekspresję cząsteczek MHC, co ułatwia im wymknięcie się spod kontroli układu immunologicznego Tak np. wirus HBV hamuje wytwarzanie IFN- γ i odpowiedź komórkową na INF- α. Innym przykładem jest wiązanie się białka 19 kDa (będącego produktem genu E3 adenowirusa) z łańcuchem ciężkim cząsteczki MHC klasy I, co blokuje ekspresję tych cząsteczek.
Wraz ze wzrotem ekspresji cząsteczek MHC maleje wrażliwość na atak ze strony komórek NK.
INF- γ jest najsilniejszym aktywatorem makrofagów; aktywuje cytotoksyczność makrofagów, wzmaga fagocytozę, hamuje migrację makrofagów, zatrzymując je w miejscu rozwijającej się odpowiedzi immunologicznej; pobudza je także do wydzielania reaktywnych związków tlenowych, wydzielania TNF, IL-1 i innych cytokin. Ponadto INF- γ uczestniczy w różnicowaniu limfocytów B w kierunku komórek uwalniających przeciwciała biorące udział w immunofagocytozie oraz ADCC.
Interferony hamują proliferację i indukują różnicowanie wielu komórek, ale są od tej reguły wyjątki. IFN- γ działa na ogół antyproliferacyjnie efektywniej niż INF-α i INF-β. INF hamują ekspresję związaną ze wzrostem komórek protoonkogenów (Myc, Fos, Ras); być może hamują także ekspresję związaną z aktywacją enzymu rozkładającego tryptofan. Ze względu na swe działanie antyproliferacyjne, interferony są inhibitorami krwiotworzenia (IFN-γ bierze udział w patogenezie niedokrwistości aplastycznej). Z drugiej jednak strony INF-γ stymuluje różnicowanie komórek szeregu mieloidalnego w kierunku monocytów.
Do tych celów najwcześniej został użyty INF-α. Obecnie stosuje się go do leczenia następujących chorób nowotworowych:
Połączenie IFN- α oraz pochodnych kwasu retinowego stosuje się do leczenia raka skóry i raka szyjki macicy. Interferony wykazują działanie przeciwnowotworowe bezpośrednie i pośrednie.
Skuteczne wydaje się być połączenie interferonów z innymi metodami terapii, np. łączenie ich z: TNF, limfotoksyną, chemioterapią, radioterapią i przeciwciałami przeciwnowotworowymi.
INF- α wykorzystuje się do leczenia wirusowego zapalenia wątroby typu B, C i D; skuteczny także w leczeniu AIDS we wczesnych stadiach (w połączeniu z azydotymidyną), zakażeń narządów płciowych wirusem brodawczaka ludzkiego, a także innych chorób wirusowych. Natomiast INF- γ stosuje się u dzieci z przewlekłą chorobą ziarniniakową; próby jego stosowania mają miejsce u chorych z atopowym zapaleniem skóry, cierpiących na gruźlicę, chorobę kala-azar. INF- β stosowano u pacjentów ze stwardnieniem rozsianym, co zmniejszyło liczbę nawrotów oraz zaostrzeń choroby.
W organizmie mogą wystąpić przeciwciała anty-INF oraz mogą pojawić się efekty uboczne (objawy grypopodobne, rzadziej ze strony układu pokarmowego i ośrodkowego układu nerwowego).
16. Rola komórek NK, granulocytów, makrofagów w odporności.
Komórki NK
To limfocyty mające zdolność spontanicznego zabijania komórek docelowych (nowotworowych lub zakażonych wirusem). Ich efekt cytotoksyczny nie podlega regulacji w restrykcji MHC. Stanowią ok. 10% obwodowej krwi człowieka. Mają morfologię dużych, ziarnistych limfocytów (liczne azurofilne ziarna cytoplazmatyczne, mała powierzchnia jądra w stosunku do powierzchni cytoplazmy, nerkowate jądro z wyraźną heterochromatyną i jąderkiem, liczne mikrokosmki i pofałdowania powierzchni komórki). Nie posiadają uniwersalnej cząsteczki identyfikującej wyłącznie komórki NK.
Komórki NK mogą wywoływać efekt cytotoksyczny bezpośrednio lub za pośrednictwem przeciwciał w procesie ADCC. Bezpośredni regulowany jest przez sygnały hamujące i pobudzające przekazywane za pomocą receptorów powierzchniowych. W zależności od tego, które sygnały przeważają, komórka jest oszczędzana lub eliminowana. Hamujące z reguły dominują. Najlepiej poznanymi receptorami hamującymi są receptory KIR. Właściwości cytotoksyczne związane są głównie z obecnością ziaren azurofilnych, zawierających wiele związków cytotoksycznych. Najważniejsze to perforyna (wbudowuje się i tworzy kanały w błonie komórek docelowych), proteazy serynowe (granzymy i granulizyna-modyfikują perforynę i uczestniczą w indukcji apoptozy, mają także właściwości proteolitczne; aktywują kaspazy i rozkładają organella komórkowe) oraz jeszcze nie scharakteryzowane toksyny oraz białko TIA-1. Aktywacja NK prowadzi do ekspresji cząsteczki FasL i TRIAL. Aktywacja zachodzi pod wpływem cytokin; aktywowane NK są znacznie efektywniejsze, intensywnie wydzielą cytokiny:IL-3, IL-5, IL-8, GM-CSF, M-CSF, INF, TNF a także chemokiny: MIP-1α i MIP-1β. Aktywność NK jest głównie regulowana przez IL-2, która z jednej strony stymuluje ich proliferację, z drugiej- wzmaga aktywność cytotoksyczną.
Udział komórek NK w odporności przeciwnowotworowej.
Na podstawie badań na zwierzętach wysnuto hipotezę, że wysoki poziom NK zmniejsza ryzyko choroby nowotworowej, a gdy już się ona pojawi zapobiega jej rozwojowi oraz ogranicza przerzuty. U pacjentów z niektórymi chorobami (biorcy nerek, zespół Chediaka-Higashiego, zespół limfoproliferacyjny sprzężony z chromosomem X) obserwuje się małą aktywność NK i zwiększoną zapadalność na nowotwory. Komórki NK pełnią rolę uzupełniającą w stosunku do limfocytów T i niszczą zmienione komórki, których limfocyty T nie są w stanie rozpoznawać i eliminować. Dzieje się tak, gdy zmienione komórki mają zmniejszoną ekspresję cząsteczek klasy MHC I. We wczesnym etapie karcenogenezy zmieniające się komórki nowotworowe zdolne do prezentacji antygenów są usuwane przez limfocyty T, a powstałe w wyniku selekcji klony o zmniejszonej ekspresji cząsteczek MHC- przez NK.
Udział komórek NK w odporności przeciwzakaźnej.
Dotyczy zwłaszcza wirusów z rodziny Herpes. W trakcie zakażenie obserwuje się zwiększoną aktywność NK. Zjawisko to rozpoczyna się kilkanaście godzin po zakażeniu i dotyczy głównie narządu objętego infekcją, korelując ze stężeniem interferonu. Za napływ komórek NK do narządu odpowiadają chemokiny, głównie MIP-1α. Komórki NK mogą niszczyć zakażone wirusem komórki wykorzystując efekt cytotoksyczny, jednak większe znaczenie ma mechanizm związany z wydzielaniem przez te komórki cytokin, głównie INF-γ. W komórkach niezainfekowanych indukuje on stan gotowości, natomiast w makrofagach- stymuluje wytwarzanie NO (zaburza replikację wirusów w komórkach już zakażonych). W obronie przeciwwirusowej uczestniczy także TNF, który razem z INF-γ działa na komórki APC i ekspresję cząsteczek adhezyjnych, sprzyjając wykształceniu się swoistych mechanizmów odpowiedzi przeciwwirusowej. Komórki NK są także w stanie wywołać efekt cytotoksyczny w stosunku do grzybów chorobotwórczych (Cryptococcus neoformans) i bakterii (E. coli). Pełnią też ważna rolą w odpowiedzi przeciwko pasożytom (Toxoplasma gondii, Leishmania major)- poprzez wydzielanie INF-γ aktywującego makrofagi.
Udział komórek NK w regulacji odpowiedzi immunologicznej
Dzięki wydzielaniu wielu cytokin regulują procesy proliferacji, różnicowania i dojrzewania innych komórek. Wpływają hamująco na odpowiedź humoralną - ograniczają proliferację limfocytów B, a ca za tym idzie - produkcję przeciwciał (takie działanie ma głównie INF-γ). Redukują także odpowiedź komórkową- wykazują efekt cytotoksyczny w stosunku do tymocytów, hamują proliferacją cytotoksycznych limfocytów T. Uczestniczą także w reakcjach odrzucenia szpiku .
Granulocyty i makrofagi
Są to komórki żerne, tzw. siły szybkiego reagowania. Docierają do miejsca inwazji drobnoustrojów jako pierwsze. Ich rolą w odpowiedzi immunologicznej są: chemotaksja, aktywacja, fagocytoza i mechanizmy zabijania drobnoustrojów.
Granulocyty powstają w szpiku z multipotencjalnych komórek macierzystych poprzez komórki macierzyste mielopoetyczne, mieloblasty, promielocyty, mielocyty, i metamielocyty. Granulocytopoeza hamowana jest przez chalony, a stymulowana przez czynnik wzrostowy granulocytw, czynnik wzrostowty pierwszy i czynnik wzrostowy makrofagów. Najliczniejszą i najważniejszą ich grupą są neutrofile. Są to komórki okrągłe, po wyjściu ze szpiku jądro komórki ma kształt pałki, przebywają we krwi mniej niż jeden dzień. Część z nich krąży, a część pozostaje w kontakcie ze śródbłonkiem, szczególnie w żyłkach pozawłosowatych. Po opuszczeniu krwi przechodzą do tkanek, gdzie żyją 1-2 dni. W swoich ziarnistościach posiadają substancje bakteriobójcze: leukotrieny, lipoksyny, lizozym, dzięki czemu fagocytują bakterie i martwe komórki.
Makrofagi także powstają w szpiku z mulipotencjalnej komórki macierzystystej poprzez komórkę macierzystą mielopoetyczną, monoblast, promonocyt, monocyt i makrofag. Czynniki pobudzają monocytopoezę to: czynnik wzrostowy granulocytów i makrofagów, czynnik wzrostowy CSF-1, IL-6
Chemotaksja to zjawisko polegające na `przyciąganiu' komórek żernych do miejsca inicjowanej odpowiedzi zapalnej lub immunologicznej za pomocą czynników chemotaktycznych. Wśród nich wyróżniamy:
Do czynników działających chemotaktycznie na ezynofile zaliczamy:
- eotaksynę
- RANTES
- MCP-2
- czynnik aktywujący płytki
Aktywacja
Istnieją dwie grupy czynników aktywujących makrofagi - pochodzenia bakteryjnego i czynniki uwalniane głównie przez pobudzone komórki tuczne i limfocyty T czyli cytokiny
Makrofagi i neutrofile ulegają natomiast aktywacji w wyniku kontaktu z mikroorganizmami i pochodzącymi od nich związkami np. endotoksynami. Cytokiną która najsilniej aktywuje makrofagi jest INF - δ. Ważnym aktywatorem neutrofilów jest IL-8 i inne chemokiny: CXC, G-CSF, GM- CSF, a eozynofilów - eotaksyny, RANTES, IL-3, IL-5 a także czynnik aktywujący płytki.
W wyniku aktywacji dchodzi do:
W już aktywowanych makrofagach pobudzeniu ulegają:
Proces ten jest negatywnie hamowany przez:
Fagocytoza
Proces fagocytozy, mający na celu unieszkodliwienie drobnoustroju, jest trzyetapowy:
Proces polegający na opłaszczeniu komórki bakteryjnej przez pewne czynniki i tym samym ułatwieniu fagocytozy to opsonizacja . Z kolei czynniki te nazywane są opsoninami. Taki typ fagocytozy określany jest jako immunofagocytoza.
Do opsonin, dla których komórka żerna ma odpowiednie receptory, zaliczamy:
Sposobem zabijania drobnoustrojów, będącym połączeniem mechanizmów swoistych i nieswoistych jest ADCC, czyli toksyczność zależna od przeciwciał. Przeciwciała opłaszczają komórkę docelową warunkując swoistość reakcji, natomiast komórki efektorowe (komórki NK, makrofagi, monocyty ,niektóre limfocyty, neutrofile, eozynofile, trombocyty) wiążą końce fragmentów Fc tych przeciwciał, warunkując efekt cytotoksyczny. Komórki żerne- efekt ADCC wobec erytrocytów i komórek nowotworowych, komórki limfoidalne (głównie LGL)-komórki nowotworowe i zakażone wirusem, eozynofile, trombocyty i monocyty - współuczestniczą w ADCC wobec pasożytów.
Mechanizmy zabijania drobnoustrojów
Komórki dysponują kilkoma mechanizmami zabijania drobnoustrojów. Niektóre zabijane są zęwnatrzkomórkowo, jednak podstawowym mechanizmem jest fagocytoza i niszczenie wewnątrzkomórkowe.
Większość reaktywnych związków tlenowych działa w fagolizosomie i są one toksyczne zarówno w stosunku do bakterii jak i grzybów, pasożytów i komórek nowotworowych. Do najaktywniejszych nalezą rodnik hydroksylowy i tlen singletowy.
Fagocytoza drobnoustrojów powoduje pobudzenie procesów oddechowych i powstanie toksycznych utleniaczy (związków tlenowych i utlenowanych halogenków). Przemiany te zachodzą głównie w neutrofilach i prowadzą do powstania reaktywnych utleniaczy.
Główne przemiany tlenowe zachodzące w komórkach żernych obejmują:
Komórki żerne syntezują wiele białek zdolnych do zabicia mikroorganizmów. Znajdują się one w szczególności w ziarnach azurofilnych (pierwotnych) i swoistych (wtórnych). W procesie fagocytozy ziarna te zlewają się z zawierającym pochłonięte mikroorganizmy fagosomem. Umożliwia to komórkom żernym zabicie mikroorganizmów, gdy fagocytoza nie pobudza syntezy reaktywnych związków tlenowych.
Czynniki biorące udział w tym mechanizmie to:
17. Odporność związana z błonami śluzowymi i skórą.
Rozproszone w błonach śluzowych i podśluzowych zorganizowane skupiska grudek limfatycznych i grudki limfatyczne samotne określane są wspólnie jako tkanka limfatyczna związana z błonami śluzowymi - mucosa-associated lymphoid tissue - MALT. Obejmuje ona tkankę limfatyczną: błon śluzowych przewodu pokarmowego - GALT, dróg oddechowych w obrębie oskrzeli - BALT, gruczołów sutkowych, łzowych, ślinianek, a także nosa i gardła zwaną NALT.
Podstawową funkcją układu limfatycznego błon śluzowych jest wytwarzanie przeciwciał IgA, przedostających się do wydzielin takich jak: sok jelitowy, ślina, łzy. Pełnią tam rolę obronną jako wydzielnicze S-IgA, które zawierają połączone łańcuchem J dwie cząsteczki IgA oraz komponent wydzielniczy - SC (secretory component). SC jest odpowiedzialny za transport dimerów IgA przez nabłonek do światła danego narządu (jelita, oskrzela). S-IgA stanowią dwie trzecie wszystkich przeciwciał wytwarzanych w organizmie.
Barierę ochronną układu pokarmowego stanowi ponadto: niskie pH soku żołądkowego, enzymy proteolityczne, lizozym, laktoferyna, defensyny, śluz, fizjologiczna flora bakteryjna oraz obecne w nabłonku enterocyty, komórki kubkowe i leukocyty śródnabłonkowe. Komórki M obecne również w nabłonku, wychwytują makrocząsteczki i mikroorganizmy ze światła jelita dzięki charakterystycznemu glikokaliksowi, a następnie przenoszą je w głąb, gdzie „przekazują” je makrofagom bądź komórkom dendrytycznym, które skolei prezentują je limfocytom.
Miejscem indukcji odpowiedzi immunologicznej są zorganizowane struktury limfatyczne takie jak: kępki Peyera, migdałki i wyrostek robaczkowy. Limfocyty aktywowane w układzie pokarmowym wędrują z krwią do innych narządów lub osiedlają się powtórnie w błonach śluzowych, dzięki interakcji ich receptorów (głównie integryna α4β7) z komórkami śródbłonka.
Z tkanką immunologiczna przewodu pokarmowego wiąże się zjawisko tolerancji pokarmowej, które ma na celu zapobieżenie uogólnionej odpowiedzi immunologicznej na antygeny pokarmowe. Mechanizm ten jest dobrze wykrztałcony u osobników dorosłych, stąd częste alergie pokarmowe u dzieci, u których jest jeszcze słabo rozwinięta GALT, enzymy trawienne są mało efektywne, a nabłonek jelita dość przepuszczalny.
Niezwykle istotną rolę w ochronie błon śluzowych pełni prawidłowa (fizjologiczna) mikroflora przewodu pokarmowego oraz dróg rodnych kobiet. Mikroflora jelit bierze udział w trawieniu, wytwarza witaminy z grupy B, witaminę K, kwas foliowy i pantotenowy oraz w istotny sposób zapobiega rozwojowi bakterii potencjalnie chorobotwórczych, a nawet wzmaga odporność. Drogi oddechowe są pozbawione mikroorganizmów, ponieważ ruch rzęsek przesuwa wydzielinę śluzową komórek kubkowych z przylepionymi cząstkami w kierunku gardła. Tkanka limfoidalna występująca na skrzyżowaniu górnych dróg oddechowych i przewodu pokarmowego określana jest jako pierścień Waldeyera. Obejmuje ona migdałek gardłowy, językowy, migdałki podniebienne i trąbkowe. W układzie oddechowym tak jak w GALT wytwarzane są IgA, natomiast w pęcherzykach płucnych dominują IgG pochodzące z krążenia. Oprócz mechanicznego usuwania mikroorganizmów przez rzęski, są one również zabijane przez białka wydzielane przez nabłonek: lizozym, laktoferynę, SLPI, fosfolipazę A, defensyny oraz makrofagi i neutrofile. Kolektyny - białka surfaktantu obecnego w pęcherzykach płucnych ułatwiają niszczenie bakterii przez makrofagi.
Skóra stanowi narząd immunologicznie czynny, spełniający ważne funkcje obronne. W skład układu odpornościowego skóry wchodzą rozmaite komórki naskórka i skóry właściwej, które zbiorczo określa się jako tkankę limfatyczną związaną ze skórą (skin associated lymphoid tissue - SALT lub SIS). Najważniejsze z nich to komórki dendrytyczne, keratynocyty, limfocyty T, komórki śródbłonka naczyniowego i inne (makrofagi, granulocyty, komórki tuczne, melanocyty). Komórki dendrytyczne biorą udział w prezentacji antygenu limfocytom T i są to np. komórki Langerhansa, które stanowią 3-8% komórek naskórka. Limfocyty T wykazują ekspresję TCRγδ i biorą udział w reakcjach naturalnej cytotoksyczności podobnie jak komórki NK.
Keratynocyty stanowią około 95% masy komórkowej naskórka i są bardzo istotną częścią SIS. Związane jest to ze zdolnością pobudzonych keratynocytów do wytwarzania wielu cytokin i czynników wzrostowych oraz z ekspresją na tych komórkach antygenów i cząsteczek adhezyjnych charakterystycznych dla komórek efektorowych odpowiedzi immunologicznej. Keratynocyty wykazują ekspresję receptorów dla wielu cytokin, np. dla INF-y, TNF, IL-l, IL-6, które warunkują odbiór bodźców generowanych przez naciekające limfocyty oraz wzmagają efekty parakrynowe cytokin.
Interleukina 1 jest naskórkopochodnym czynnikiem aktywującym tymocyty, jest uwalniana po zadziałaniu bodźca aktywującego i bierze udział w regulacji miejscowej reakcji zapalnej. Odgrywa też istotną rolę w regulacji melanogenezy.
Interleukina 6 jest cytokiną, która wywiera wiele efektów miejscowych i ogólnoustrojowych, w tym pobudzenie syntezy białek ostrej fazy. Może hamować proliferację komórek niektórych nowotworów, a ponadto działa immunostymulująco.
Interleukina 8 należy do grupy chemokin, ma duże znaczenie w patogenezie łuszczycy i alergicznego zapalenia skóry. Pobudzenie chemotaksji neutrofilów oraz za hamowanie ich przylegania do śródbłonka prowadzi do nagromadzenia się tych komórek w miejscu reakcji zapalnej. IL-8, w przeciwieństwie do IL- i IL-6, nie wywołuje gorączki i nie indukuje syntezy białek ostrej fazy. Dodatkowo IL-8 wykazuje właściwości chemotaktyczne w stosunku do keratynocytów, co może mieć znaczenie w przebiegu gojenia się ran.
TNF jest niezwykle ważną cytokiną w bardzo złożone efekty biologiczne i odgrywającą podstawową rolę w odporności przeciwnowotworowej oraz w patogenezie różnych chorób skóry. Pobudzane keratynocyty są istotnym źródłem TNF.
Ważnym czynnikiem o silnych właściwościach immunosupresyjnych w naskórku jest wytwarzany przez pobudzone keratynocyty TGF-β. Cytokina ta działa nieswoiście i hamuje proliferację limfocytów T i B oraz aktywność komórek NK.
Inną ważną cytokiną o właściwościach immunosupresyjnych jest IL-10. Do czynników immunosupresyjnych wytwarzanych przez keratynocyty należą również niektóre prostaglandyny i kwas prokainowy.
W warunkach prawidłowych keratynocyty wykazują ekspresję cząsteczek MHC klasy I, receptora typu III dla fragmentu Fc IgG, LFA-3 oraz niektórych integryn z rodziny β1. W wielu chorobach skóry o podłożu immunologicznym dochodzi do pobudzenia keratynocytów, które stają się komórkami aktywnie biorącymi udział w reakcjach zapalnych i immunologicznych.
Pod wpływem promieni UV następuje efekt immunosupresji (np. upośledzają czynność komórek Langerhansa). Istnieje ponadto związek między nadmiernym nasłonecznieniem, a ryzykiem wystąpienia nowotworów skóry.
18. Rola cytokin w odpowiedzi immunologicznej, rodzaje cytokin- mechanizm działania.
Cytokiny-duża grupa białek i glikoprotein, produkowanych i wydzielanych w niewielkich ilościach przez aktywowane komórki układu odpornościowego (po spotkaniu z antygenem). Są one zatem nośnikami informacji o toczącej się reakcji obronnej a działanie ma z reguły niewielki zasięg. Receptory cytokin znajdują się nie tylko w komórkach odpornościowych ale także poza tym układem, co oznacza że informacja niesiona przez cytokiny może być odbierana w wielu miejscach organizmu. Cytokiny działają zazwyczaj w stężeniu pikomolowym.
Cytokiny odgrywają ważna rolę w odpowiedzi immunologicznej:
1.Odpowiedź typu humoralnego
Cytokiny wydzielane są przez limfocyty Th. Na każdym z etapów tej odpowiedzi na limfocyt B działają inne czynniki, choć żaden z nich nie ogranicza się do oddziaływania wyłącznie na limfocyty B i reguluje najczęściej więcej niż jeden etap. W trakcie tej odpowiedzi cytokiny:
-indukują aktywację limfocytów B- IL-4
-stymulują proliferację - IL-4, IL-5, IL-2
-pobudzają różnicowanie: IL-5, IL-6, IL-10, IL-2, IL-4
Limfocyt B również jest zdolny do wytwarzania cytokin, jednak mogą one spełniać istotna rolę w odpowiedzi humoralnej na antygeny grasiczozależne.
2.Odpowiedź typu komórkowego
Limfocyty Th1 oraz wydzielane przez nie cytokiny spełniają w tej odpowiedzi większą rolę. Cytokiny wydzielane są przez limfocyty Th1, które bezpośrednio naciekają miejsce podania antygenu lub miejsce wtargnięcia mikroorganizmów. Wydzielane cytokiny to np.:IFN-gamma, TNF, MIF, które aktywują makrofagi zwiększając ich właściwości fagocytarne, a także umożliwiają im zabicie rozwijających się w nich bakterii i pasożytów. Makrofagi i limfocyty wytwarzają również czynniki indukujące uwolnienie histaminy, przez komórki tuczne. Należą do nich: chemokiny.
Można wyróżnić wśród nich:
interleukiny-
umożliwiają komunikację leukocytów i wpływ jednych populacji na drugie i vice versa, są to np.
IL-1 jest jednym z głównych regulatorów odpowiedzi immunologicznej i zapalnej
IL-2 pobudzanie proliferacji limfocytów cytotoksycznych CD8+
IL-3 spotęgowanie procesu fizjologicznego krwiotworzenia w sytuacjach wzmożonej reaktywności immunologicznej
IL-4 stymuluje proliferację limfocytów B pobudzonych swoistym antygenem
IL-6 jeden z centralnych czynników regulujących mechanizmy obronne
IL-7 odgrywa wybitną role w limfopoezie
IL-8
IL-10 spełnia wiele funkcji, które w efekcie hamują odpowiedź immunologiczną typu komórkowego i odpowiedź zapalną
IL-12 stymuluje proliferację, aktywację i cytotoksyczność limfocytów T i komórek NK oraz wytwarzanie przez te komórki IFNgamma i TNF; indukuje powstanie limfocytów Th1
IL-18 działa przede wszystkim na różne populacje limfocytów T i komórki NK
Chemokiny- biorą udział w pobudzaniu leukocytów, wyznaczają gradient chemotaktyczny, którego śladem leukocyty podążają do miejsca zapalenia, np.eotaksyna, gr.MCP. Odgrywają kluczową rolę w reakcjach zapalnych, w odporności przeciwzakaźnej, krwiotworzeniu, limfopoezie, w odpowiedzi przeciwnowotworowej i mechanizmach odrzucania przeszczepów.
Interferony-grupa 5-ciu cytokin zaangażowanych w obronę przeciwwirusową,
Hematopoetyny-wpływają na procesy różnicowania komórek szlaku krwiotworzenia, np. G,M-SCF; G-SCF; M-SCF; erytropoetyna)
Niektóre czynniki wzrostu
TNF białko zdolne do zabijania komórek nowotworowych in vitro oraz indukujące martwicę krwotoczną guzów wszczepionych zwierzętom doświadczalnym.
19. Mechanizmy zaangażowane w odpowiedź immunologiczną: odpowiedź typu komórkowego - rola limfocytów Th1 i Tc.
W odpowiedzi typu komórkowego z antygenem reagują bezpośrednio komórki- limfocyty T. W interakcji ze swoistym antygenem wydzielają one cytokiny, które sprawują wiele funkcji, a między innymi wciągają do odpowiedzi immunologicznej także makrofagi i granulocyty. Podanie lokalne odpowiedniego antygenu wywołuje odpowiedź typu komórkowego powoduje naciekanie przez komórki miejsca podania antygenu dopiero po ok. 24h. Dlatego ten typ odpowiedzi określa się czasami jako odpowiedź późną. Poza odpowiedzią typu późnego której dominujące znaczenie mają pomocnicze limfocyty T i uwalniane przez nie cytokiny drugim waznym składnikiem odpowiedzi kom. Jest efekt cytotoksyczny limfocytu T.
Odpowiedź komórkowa to odpowiedz w której główną rolę odgrywają uczulone limfocyty T bezpośrednio znajdujące się w miejscu wstępowania antygenu i oddziałujące z komórkami efektorowymi (np. makrofagami różnych typów, granulocytami itp.), lub same biorące bezpośredni udział w likwidacji komórek niosących antygen wobec którego jest wyzwolona reakcja limfocytu Tc. Przykładami procesów odpornościowych o podłożu komórkowym mogą być reakcje głównie przeciw patogenom wewnątrzkomórkowym jak wirusy, prątki oraz nowotworom. Przykładami spaczonej odpowiedzi typu komórkowego są: nadwrażliwości typu IV, niektóre choroby autoimmunizacyjne jak np. (stwardnienie rozsiane, cukrzyca typu I).
Limfocyty Th są pobudzane przez komórki prezentujące antygen (w skrócie APC) w obrębie węzła chłonnego. Po pobudzeniu dochodzi do produkcji cytokin, które mają zdolność modulowania odpowiedzi odpornościowej.
Limfocyty Th1 działają pomocniczo w odpowiedzi komórkowej. Limfocyty te mają na swojej powierzchni czasteczki L3T4 bedace odpowiednikami CD4 u człowieka i rozpoznaja antygen prezentowany w polaczeniu z czasteczkami MHC klasy II
komórki Th1, wydzielające IL-2(stymulująca miedzy innymi cytotoksyczność limfocytow) IL-3, IFN-&gamma(aktywujący makrofagi, hamuje on proliferacje i czynność limfocytow Th2), i GM-CSF,INF-beta podobnie jak limfocyty Th2 wywodzą się z limfocytów Th0.
Choc Limfocyty Th1 badane In vitro w wysokich stężeniach mogą nie tylko hamowac odpowiedz typu humoralnego ale nawet zabijac limfocyty B to uzyte w niskich stężeniach działają wspomagająco na te odpowiedz podobnie do limfocytow Th2. Przykładem roli tych limfocytow SA zjawiska immunologiczne w leiszmaniozie u myszy. W chorobie tej oporność przeciwzakazna jest glownie związana z odp. Komorkowa . Okazuje się ze u myszy opornych na zakazenie lub zdrowiejących po przebytym zakazeniu przewaza aktywność limf Th1 natomiast u myszy wrażliwych na zakazenie i chorujących na leiszmanioze przewaza aktywność limf Th2. Pod względem wydzielanych limfokin limf Th1 przypominaja limfocyty T cytotoksyczne CD8+. Efekty pożyteczne tych limfocytów występują w tradzie i nadwrażliwości typu I. Efekty szkodliwe wywolane przez te limfocyty Sa uwidocznione w rozwoju chorob autoimmunologicznych w których patogenezie dominuje odp komorkowa czyli w stwardnieniu rozsianym, cukrzycy typu I, reumatoidalnym zapaleniu stawów. Jedna z ich cech jest fakt ze nie wytwarzaja eozynofilów.
Limfocyty Tc czyli cytotoksyczne .Jest to subpopulacja limfocytów, zwykle CD 8+ posiadająca tę cechę, że potrafią uśmiercić komórkę prezentującą w kontekście MHC I uczulający dany limfocyt antygen
Spośród limfocytów zdolnych do efektu cytoksycznego (tzn. do zabijania Komorek) wyróżniamy:
1)Limfocyty Tαβ CD8+
2) Limfocyty Tαβ CD 4+ subpoplulacji Th1
3)limfocyty Tγδ
4) limfocyty NKT
5) limfocyty NK
Limf Tc CD8+ zabijaja komorki rozpoznające obce(allogeniczne) cząsteczki MHC klasy I lub antygeny polączone z własnymi (autogenicznymi)cząsteczkami MHC klasy I. Ich Głowna rola to niszczenie komórek zakażonych przez wirusy i inne mikroorganizmy, a także niszczenie komórek nowotworowych. Profil wydzielanych przez nie cytokin przypomina na ogół profil cytokin wydzielanych przez limf Th1 choc można wśród nich wyróżnić limfocyty nie wydzielające INF-gamma i wydzielające znaczne ilości IL4 i IL5 co stalo się podstawa podzialu na Tc1 i Tc2.Limfocyty T rozpoznając komorke mogą również wyleczyc ja nie zabijając jej , hamując w niej replikacje wirusow. Jest to następstwem wydzielenia przez limfocyt T cytokin np. INF gamma który wywiera swój efekt przeciwwirusowy bezpośrednio, albo pośrednio-przez pobudzenie makrofagów do wydzielania działające przeciwwirusowo TNF, Limfocyty dysponuja 2 zasadniczymi mechanizmami zabijania komórek przez indukcje w nich apoptozy:
Limf Tc CD8+ sA zdolne do zabijania obydwiema drogami z dominacja I
Cytotoksyczne limfocyty T, które mają na powierzchni białka FasL, potrafią wykorzystać cząsteczki białka Fas atakowanej przez siebie komórki do uruchomiania programu apoptozy w komórkach zakażonych przez wirusy i komórkach rakowych.
20. Odpowiedź typu humoralnego na antygeny: grasiczozależne, grasiczoniezależne, rola limfocytów Th2 w odpowiedzi immunologicznej .
Antygeny grasiczozależne to takie antygeny, które do indukcji odpowiedzi immunologicznej wymagają pomocy limfocytów Th(albo w niektórych przypadkach odpowiednich, wydzielanych przez nie cytokin). Cechuje je to, że:
- aktywują dopełniacz na drodze klasycznej,
- indukują pamięć immunologiczną i proces przełączenia klas,
- mają małą masę i są w miarę dobrze metabolizowane,
- większość antygenów jest grasiczozależna,
Antygeny grasiczoniezależne to takie antygeny, które nie wymagają komórek Th do indukcji odpowiedzi immunologicznej. Możemy je podzielić na 2 grupy:
- antygeny które mają zdolność bezpośredniego aktywowania limfocytów B( tzw. cecha poliklonalnych aktywatorów limfocytów B) i stymulacji odpowiedzi immunologicznej. Indukują odpowiedź immunologiczną u noworodków mysich. Określa się je mianem antygenów TI-1(thymus independent - grasiczoniezależne) i należą do nich m.in.: LPS i Dekstran.
- antygeny nieposiadające cechy poliklonalnych aktywatorów limfocytów B i niezdolne do indukowania odpowiedzi immunologicznej u noworodków mysich. Są to antygeny wielowartościowe, które oddziałują nie tylko na limfocyty B, ale też przez wytwarzanie przez limfocyty B cytokiny na komórki np.: NK. Określa się je mianem antygenów TI-2 i należa do nich np.: Ficoll i polisacharyd pneumokoków
Antygeny grasiczoniezależne cechuje to, że:
- aktywują dopełniacz na drodze alternatywnej,
- są słabo metabolizowane i zazwyczaj mają duża masę,
- słabo indukują pamięć immunologiczną i proces przełączania klas,
- wzbudzają wytwarzanie IgM i IgG3
- zawierają liczne powtarzające się epitopy.
Odpowiedź na antygeny grasiczozależne:
Przebiega w ten sposób, że antygen przechwycony przez komórkę APC(antigen presenting cell) jest przez nią prezentowany komórce Th, a ona wydzielając odpowiednie substancje aktywuje komórki Tc (aktywowane przez Th1), lub B (aktywowane przez Th2).
Odpowiedź na antygeny grasiczoniezalezne:
Jest uzależniona od tego, z jakim antygenem mamy do czynienia(TI-1, TI-2), ale ogólnie polega na tym, że antygen grasiczoniezależny bezpośrednio oddziałuje na limfocyt B co prowadzi do jego aktywacji.
Rola Th2 w odpowiedzi immunologicznej polega na aktywacji limfocytów B, które są odpowiedzialne za odpowiedź humoralną. Ponadto niektóre wydzielane przez nich substancje hamują rozwój i aktywność limfocytów Th1 co powoduje wytworzenie się delikatnej równowagi pomiędzy tymi 2 populacjami(Th1 wydzielają substancje hamujące rozwój Th2) która, gdy zostanie zaburzona decyduje, jaka odpowiedź będzie dominowała. Th2 aktywują także makrofagi. Stymulują one też znacznie wytwarzanie IgE i powstawanie komórek tucznych, które mogą sprzyjać nadwrażliwości typu 1. Th2 są też wiązane z chorobami autoimmunizacyjnymi związanymi z nadprodukcja przeciwciał, np.: miastenią.
21. Mechanizm rozpoznawania antygenów obcych
Zasadnicze rodzaje odpowiedzi immunologicznej: a) eliminacja, b) tolerancja i c) wspomaganie metabolizmu, odpowiednio adresowanymi do rozpoznanych struktur antygenowych.
Zainicjowanie odpowiedzi zależy od nawiązania dialogu między dwoma komórkami reprezentującymi strony zawiązującego się układu: komórką immunogenną (APC) wyrażającą poprzez szczególny system sygnalizacji swój aktualny stan i potrzeby, a komórką immunologicznie kompetentną (limfocyt T CD4) o strukturze receptora antygenowego (TCR) komplementarnej wobec immunogennego sygnału "nadanego" przez partnerkę - komórkę APC.
Immunogenne oraz odpowiadające im immunologicznie kompetentne funkcje układu mogą być realizowane w zakresie repertuaru możliwości predeterminowanych genetycznie.
Repertuar immunogenności określają geny odpowiedzi immunologicznej (Ir - immune response genes) u człowieka ulokowona w 6 chromosomie, w głównym kompleksie zgodności tkankowej (MHC - major histocompatibility complex), programujące ekspresję antygenów zgodności tkankowej (HLA I i II klasy). Charakterystyczna dla indywidualnego organizmu strukturalna jakość tych antygenów obejmuje obszar możliwych sygnalizacji stanu własnych tkanek. Na ten stan mogą wpływać jedynie te struktury lub oddziaływania energetyczne (antygeny konwencjonalne, pola magnetyczne i promieniowania jonizujące), które wykazują zdolność wywoływania swoistej zmiany jakości własnego sygnału. Tym sposobem genetycznie uwarunkowana jakość własnych struktur sygnalizacyjnych otwiera się w określonym zakresie na wpływy zewnętrzne „obce”. Innymi słowy, zakres możliwych odpowiedzi immunologicznych jest podstawowo determinowany zakresem żądań tkankowych (geny Ir), a wtórnie zakresem możliwych rozpoznań.
Ten drugi zakres pozostaje w gestii komórek immunologicznie kompetentnych, rozpoznających i inicjujących wynikajacy z rozpoznania pożądany typ odpowiedzi immunologicznej. Lokalizacja genów określających możliwości rozpoznawcze jest odmienna od usytuowania genów Ir. Geny dla łańcuchów alfa i beta receptora antygenowego limfocytów T (TCR) znajdujemy odpowiednio w chromosomie 14 i 7, geny dla łańcuchów ciężkich immunoglobulin ulokowane są w chromosomie 14, a geny dla łańcuchów lekkich kappa i lambda odpowiednio w chromosomach 2 i 22. Rearanżacje tych genów pozwalają na zaprogramowanie szerokiego spektrum możliwych rozpoznań.
Układ odpornościowy dysponuje zatem dwoma repertuarami możliwości czynnościowych. Pierwszy z nich mówi o cechach jakościowych organizmu i aktualnym stanie jego tkanek uwzględniając wpływy środowiskowe (repertuar immunogenności), drugi - o możliwości rozpoznawania pierwszego (repertuar immunologicznej kompetencji). Wzajemne zrównoważenie tych repertuarów i ich komplementarność decydują o sprawności czynnościowej układu odpornościowego, pozwalającej na odpowiedź dostosowaną do rodzaju żądania. Braki z jednej lub z drugiej strony pozostawiają albo żądania bez właściwej odpowiedzi, albo zaledwie możliwość odpowiedzi, nie zrealizowaną wobec braku wywołującego ją żądania
LIMFOCYTY B i T POSIADAJĄ NA SWOJEJ POWIERZCHNI RECEPTORY SWOIŚCIE WIĄŻĄCE ANTYGEN:
Limfocyty B
• receptor BCR w skład, którego wchodzi
cząsteczka immunoglobuliny
zakotwiczona w błonie limfocytu oraz
dwóch heterodimerów Ig alfa i Ig beta.
Limfocyty T
• receptor zakotwiczony w błonie limfocytu (TCR) składa się z heterodimeru - zwykle łańcucha alfa i beta oraz cząsteczki CD3 (trimer).
Limfocyty gamma i delta różnią się od limfocytów a i b szeregiem właściwości. Prawdopodobnie są to najbardziej pierwotne limfocyty T - pierwsze,jakie pojawiły się w rozwoju filogenetycznym.
LIMFOCYTY B i T ROZPOZNAJĄ ANTYGEN W RÓŻNY SPOSÓB:
Limfocyty B
• powstaje kompleks dwóch cząsteczek:
antygenu i immunoglobuliny zakotwiczonej
w błonie limfocytu (BCR)
• do rozpoznania nie potrzebne są
cząsteczki głównego układu zgodności
tkankowej (MHC)
• mogą wiązać antygeny rozpuszczalne
• wiążą białka, polisacharydy i lipidy
• rozpoznawana jest konformacja
cząsteczki
Różnice dotyczą :
- sposobu oddziaływania z antygenem
- konieczności zaangażowania cząsteczek MHC
- zdolności do wiązania rozpuszczalnego antygenu
- chemicznej natury antygenu
- właściwości epitopu
Limfocyty T
• powstaje kompleks trzech cząsteczek:
antygenu związanego przez cząsteczkę
MHC i receptora zakotwiczonego
w błonie limfocytu (TCR)
• do rozpoznania konieczne są
cząsteczki MHC (restrykcja MHC)
• nie mogą rozpoznawać antygenów
rozpuszczalnych
• rozpoznają peptydy związane przez
cząsteczki MHC lub lipidy związane z
cząsteczkami CD1
Wiele innych komórek pobudzonych przez IFN γ
może syntetyzować cząsteczki MHC klasy II i prezentować
antygeny limfocytom T.
Należą do nich m. in. monocyty, neutrofile, komórki
śródbłonka, enterocyty, keratynocyty, chondrocyty, astrocyty
Restrykcja MHC klasy I i II.
Selekcja pozytywna i negatywna -Zjawiska immunologiczne odpowiedzialne za utrzymanie tolerancji wobec własnych tkanek .celem selekcji jest wyłonienie puli limfocytów T rozpoznających obce antygeny w połączeniu z własnymi cząsteczkami MHC
Selekcji pozytywnej poddawane są limfocyty podwójnie dodatnie mające zarówno CD4 jak i CD8
W przebiegu selekcji pozytywnej dochodzi jednocześnie do restrykcji MHC .Te limfocyty ,które będą rozpoznawać antygeny prezentowane przez MHC klasy 1,zachowują ekspresję CD8 ,a te które mają wiązać antygen w kontekście MHC klasy II pozostają CD4 +
KOMÓRKI UCZESTNICZĄCE W SELEKCJI TYMOCYTÓW
W selekcji pozytywnej uczestniczą jedynie korowe komórki nabłonkowe .Limfocyty podwójnie dodatnie mają niewiele czasu na rozpoznanie peptydów prezentowanych przez komórki nabłonkowe .żyją zaledwie 3-4 dni .Po tym okresie tymocyty ulegają apoptozie
MECHANIZMY SELEKCJI W GRASICY
Mechanizmy edukacji grasiczej -istotną rolę w tym procesie odgrywają receptory TCR ,Jeśli tylko mają one konformację umożliwiającą rozpoznanie peptydu zakotwiczonego w rowku dowolnej napotkanej cząsteczki MHC wówczas receptory te, poprzez towarzyszący im kompleks CD3 przekazują sygnał aktywujący tymocyt .Jeśli w wyniku rearanżacji genów powstał wadliwy TCR lub jeśli w ogóle nie powstał taki receptor, tymocyt nie otrzymuje żadnego sygnału i wkrótce ginie w mechanizmie apoptozy(śmierć z zaniedbania)
Rola kompleksu TCR-CD3 w selekcji tymocytów
Łańcuchy γ δ ε ζ kompleksu CD3 uczestniczą w przekazywaniu sygnałów z TCR .Wydaje się ,iż w zależności od awidności receptorów TCR do antygenów prezentowanych w grasicy dochodzi zróżnicowanej fosorylacji odpowiednich tyrozyn łańcuchów kompleksu TCR .Im większa awidność
Tym więcej tyrozyn ulega fosorylacji ( czerwone pola symbolizujące fosforyzyny .Liczba ufosforylowanych tyrozyn determinuje ilość i jakość aktywowanych szlaków przekazujących sygnały w tymocytach
Jeśli awidność TCR do peptydów będzie zbyt mała wówczas dochodzi do śmierci „z zaniedbania”(może to oznaczać ,iż TCR nie ma prawidłowej konformacji umożliwiającej rozpoznanie jakiegokolwiek peptydu) .Jeśli awidność będzie zbyt duża ,wówczas tymocyt ulega apoptozie ,czyli selekcji negatywnej (istnieje zbyt duże ryzyko ,że ta komórka może rozpoznać autoantygen po opuszczeniu grasicy,co z kolei może doprowadzić do powstania choroby autoimmunizacyjnej ) Okazuje się ,że zbyt duża awidność wobec rozpoznawanego antygenu niekoniecznie musi natychmiast prowadzić do selekcji negatywnej ( apoptozy ) .Te tymocyty ,które rozpoznają antygeny ze zbyt dużą awidnością ,nie ulegają żadnej selekcji ,ale utrzymywana jest w nich ekspresia RAG1 i RAG2 ,umożliwiająca próbę ponownej rearanżacji genów kodujących TCR .Dzięki temu, tymocyty te unikają egzekucji ( apoptozy) i jeszcze raz mogą podejść do egzaminu (selekcji) Proces ten .określany jako redagowanie receptorów zachodzi jedynie w obrębie locus TCR α .Jeśli awidność mieści się w optymalnym zakresie (ani za duża, ani zbyt mała) wówczas tymocyt ulega selekcji pozytywnej ,gdyż „istnieje nadzieja „ ,że z optymalną awidnością będzie rozpoznawał obce antygeny, prezentowane przez cząsteczki MHC
W wyniku edukacji grasiczej powstają limfocyty T rozpoznające obce antygeny .Jednocześnie komórki te nie powinny rozpoznawać własnych antygenów .Pojawia się więc kolejny paradoks -w jaki sposób tymocyty mają się nauczyć tolerancji wobec własnych antygenów ,skoro wszystkich i tak grasicy nie ma.
ROLA APC, CZYLI KOMÓREK PREZENTUJĄCYCH ANTYGEN (antigen presenting cell)
Komórki dendrytyczne kontaktują się z antygenami za pomocą chemokin, mogą się przeciskac przez obwódki zamykające enterocytów i wychwytywac mikroorganizmy bez pośrednio z treści jelitowej, lub za pomocą komórek M. Następnie komórki dendrytyczne transportują antygeny drogą naczyń limfatycznych doprowadzających (aby je prezentowac limfocytom T w węzłach limfatycznych) albo drogą krwi w celu prezentacji w śledzionie.
Czynność komórek dendrytycznych uzupełnia się z czynnością limfocytów T w obronie przeciwzakaźnej. Komórki dendrytyczne zawarte we wszystkich tkankach nabywają antygeny mikroorganizmów pochłaniając je bezpośrednio albo fagocytując zabijane przez nie komórki
Komórki dendrytyczne nabywają antygeny głównie na drodze endocytozy zależnej od receptorów FcR, receptora dla mannozy, dla składników dopełniacza, receptorów Toll-podobnych (TCR) oraz w drodze fagocytozy i makropinocytozy. Po dotarciu do narządów limfatycznych zdolności komórek dendrytycznych do endocytozy, fagocytozy maleją. Mogą one natomiast przez długi czas prezentowac antygeny limocytom T poprzez synapsy immunologiczne (na styku limfocytów T i komórek dendrytycznych).
a1) komórki dendrytyczne narządów nielimfatycznych - komórki Langerhansa i śródmiąższowe komórki dendrytyczne.
Komórki Langerhansa po związaniu antygenu, przechodzą do naczyń limfatycznych doprowadzających i jako komórki welonowate docierają do węzłów limfatycznych, gdzie z kolei przekształcają się w komórki dendrytyczne splatające się.
Śródmiąższowe komórki dendrytyczne docierają z limfą do węzłów limfatycznych, częśc z nich trafia do krwi i następnie do śledziony. W strefach grasiczozależnych przekształcają się w komórki dendrytyczne splatające się. Mają zatem rolę podobną do komórek Langerhansa. Liczba ich wzrasta gwałtownie w przypadku rozwoju miejscowej reakcji zapalnej.
a2) komórki dendrytyczne narządów limfatycznych - komórki dendrytyczne grasicy biorą udział w selekcji negatywnej dojrzewających limfocytów T. W pozostałych narządach limfatycznych występują komórki dendrytyczne splatające się i komórki dendrytyczne grudek. Komórki dendrytyczne splatające się po związaniu i obróbce antygenów wędrują do stref grasiczozależnych węzłów limfatycznych i śledziony żeby prezentowac te antygeny swoistym limfocytom T.
Komórki dendrytyczne grudek odgrywają rolę w odpowiedzi humoralnej.
Kooperacja limfocytów T i B.
Kooperacja limfocytów T i B polega na współpracy obu rodzajów komórek w wytwarzaniu odpowiedzi immunologicznej.
Odpornośc organizmu:
komórkowa - charakteryzuje się gromadzeniem wokół antygenu komórek, głównie limfocytów T, które bezpośrednio reagują z antygenem, a poprzez m.in. wydzielanie substancji zwanych limfokininami wciągają do odpowiedzi immunologicznej także makrofagi oraz granulocyty.
humoralna - polega na wytwarzaniu i uwalnianiu do płynów środowiska organizmu przeciwciał; wiąże się ona z czynnością limfocytów B.
Schemat powstawania i dojrzewania limfocytów w układzie odpornościowym człowieka.
Szpik kostny
powstawanie limfocytów B
Grasica
powstawanie limfocytów T oraz dojrzewanie limfocytów T i B
Węzły chłonne
różnicowanie się limfocytów T i limfocytów B oraz komórek plazmatycznych
współpraca
odpowiedź komórkowa
odpowiedź humoralna
Schemat humoralnego typu odpowiedzi immunologicznej po wniknięciu antygenu
Limfocyty T stymulują limfocyty B do szybkiego namnażania się
Różnicowanie się licznych limfocytów B w komórki:
plazmatyczne pamięci
Wydzielanie specyficznych przeciwciał Komórki pamięci pozostają przez wiele lat
i ich transport we krwi w organizmie
Wiązanie antygenów przez przeciwciała w nieaktywne Szybka reakcja humoralna po ponownym
kompleksy kontakcie z antygenem
Fagocytoza antygenów Przyciąganie makrofagów w rejon odpowiedzi immunologicznej
Schemat komórkowego typu odpowiedzi immunologicznej organizmu
Wniknięcie antygenu do organizmu
Związanie antygenu z makrofagiem
i aktywacja limfocytów T
Szybkie namnażanie Gromadzenie się komórek pamięci
limfocytów T komórek pamięci w węzłach chłonnych
Powstawanie limfocytów T Po ponownym kontakcie
w węzłach chłonnych z antygenem szybka
odpowiedź
immunologiczna
Gromadzenie się limfocytów T Uwalnianie cytotoksycznych Przyciąganie makrofagów
w miejscu wtargnięcia antygenu białek niszczących antygeny w rejon odpowiedzi immunologicznej
22. Cytotoksyczność komórkowa zależna od przeciwciał (ADCC).
Cytotoksyczność zależna od przeciwciał, w skrócie ADCC (ang. Antibody-Dependent Cell Cytotoxicity) - proces, w którym komórka docelowa jest zabijana przez komórkę K.
Do zabicia komórki docelowej w ADCC konieczny jest jednoczesny udział przeciwciał i komórek efektorowych. Przeciwciała spłaszczają komórkę docelową warunkując swoistość reakcji, natomiast komórki efektorowi, wiążąc końce fragmentów Fc tych przeciwciał, warunkują efekt cytotoksyczny. Obecność dopełniacza nie jest konieczna do wystąpienia ADCC, choć może on nasilać to zjawisko.
W zjawisku ADCC może uczestniczyć większość leukocytów: komórki NK(LGL), makrofagi, monocyty, niektóre limfocyty T, neutrofile, eozynofile, a także trombocyty. Efekt ADCC mogą również wywierać komórki niektórych linii nowotworowych(np. linii monocytarnej U937). Komórki uczestniczące w ADCC określano kiedyś komórki K(killer cells). Aktualnie termin „komórki K” używany jest rzadko, w wąskim znaczeniu-określa komórki limfoidalne uczestniczące w ADCC. Dotyczy to przede wszystkim komórki NK i limfocytów T CD3+, CD16+. Udział komórek efektorowych uczestniczących w tym zjawisku jest uzależniony od obecności receptora dla fragmentu Fc przeciwciała. Komórki żerne(makrofagi, monocyty, neutrofile) wywierają efekt ADCC wobec erytrocytów i w pewnym stopniu w stosunku do komórek nowotworowych. Komórki limfoidalne(głównie LGL) niszczą komórki nowotworowe i zakażone wirusem. Eozynofile podobnie jak trombocyty(także monocyty) współuczestniczą natomiast w ADCC wobec pasożytów. Niektóre cytokiny są w stanie wzmagać efekt ADCC(np. poprzez zwiększenie ekspresji FcR). Wśród nich można wyróżnić IFN-γ (aktywuje makrofagi i neutrofile), GM-CSF(nasila ADCC z udziałem neutrofilów i eozynofilów) i IL-2, która aktywuje komórki NK.
Mechanizm ADCC
Największe znaczenie w zjawisku ADCC w ujęciu klasycznym, mają IgG. Przeciwciała IgE uczestniczą w odpowiedzi przeciw pasożytom w ADCC. Efekt cytotoksyczny wiąże się z wydzielaniem mediatorów przez wymienione komórki. Reakcje ADCC warunkują przede wszystkim IgG1 i IgG3, co związane jest z ich dużym powinowactwem do odpowiednich receptorów FcγR.
Przeciwciała opłaszczają komórkę docelową,
Komórka K, zawierająca receptory dla części Fc przeciwciał, łączy się za pośrednictwem przeciwciał do komórki docelowej,
Następuje pobudzenie komórki K, Komórka K ulega degranulacji, czego wynikiem jest zabicie komórki docelowej.
To opracowanie może być trochę chaotyczne, ale w taki sposób i w takiej kolejności był ten temat przedstawiony na wykładzie.
23. Typy reakcji nadwrażliwości - patomechanizm, udział czynników komórkowych i humoralnych, mediatory procesu zapalnego.
Nadwrażliwością nazywamy stan spaczonej odpowiedzi immunologicznej, który prowadzi do uszkodzenia tkanek i zapoczątkowania procesu zapalnego. Nadwrażliwość jest silną reakcją immunologiczną w stosunku do niezbyt szkodliwego czynnika, reakcją nadmiernie aktywującą układ immunologiczny.
Wyróżniamy cztery typy nadwrażliwości. W przypadku trzech pierwszych typów za nadwrażliwość odpowiedzialne są czynniki humoralne, a za nadwrażliwość typu IV czynniki komórkowe.
Nadwrażliwość typu I.
U jej podłoża leżą reakcje antygenu z przeciwciałami klasy IgE, które łączą się z receptorami powierzchniowymi komórek tucznych i bazofilów. Efekt kliniczny związany jest głównie z wydzielaniem przez te komórki różnych mediatorów. Nazwa „nadwrażliwość typu I” jest często zamiennie stosowana z terminem „alergia”.
Alergię definiujemy na podstawie obecności swoistych przeciwciał IgE w surowicy, dodatnich prób skórnych i objawów klinicznych takich jak np. astma.
Na wystąpienie alergii mogą mieć wpływ czynniki genetyczne oraz środowiskowe. W przypadku czynników dziedzicznych poszukiwania genów odpowiedzialnych za wystąpienie alergii zmierzają w dwóch kierunkach: 1) badania nad korelacją występowania określonych antygenów MHC z odpowiedzią na dany antygen. 2) dziedziczenie predyspozycji do alergii - badania te dowidzą, że za wystąpienie alergii nie odpowiada jeden gen, ale interakcja kilku genów odpowiedzialnych za kodowanie białek uczestniczących w reakcjach immunologicznych (bardzo duże znaczenie odgrywają tutaj geny kodujące np. IL-4,5,13). Jeśli chodzi o czynniki środowiskowe, to istotne znaczenie odgrywają tutaj tzw. czynniki infekcyjne - w dzisiejszych czasach-czystość, umiejętność obrony przed drobnoustrojami- kontakt z mikroorganizmami jest ograniczony. Uważa się, że brak takiego „treningu” immunologicznego może prowadzić do spaczenia niektórych mechanizmów obrony i rozwoju alergii. Jest to tak zwana koncepcja higieny. Poza czynnikami infekcyjnymi wpływ na rozwój nadwrażliwości typu I mają czynniki toksyczne i zanieczyszczenia środowiska. Występowanie alergii jest rzadsze w krajach uboższych niż w krajach rozwiniętych- w krajach uboższych jest mniej zanieczyszczeń, ale ludzie przechodzą bardziej intensywny „trening” immunologiczny (brak szczepionek, higiena).
MECHANIZMY REAKCJI ALERGICZNYCH
Udział Th2 - limfocyty te regulują procesy alergiczne wpływając na limfocyty B wytwarzające IgE, komórki tuczne/bazofile i eozynofile. Wydzielają szereg cytokin oddziaływujących na wymienione komórki. IL-4, 6, 13 wpływają na limfocyty B, IL-3,4,10 na bazofile i komórki tuczne. Pobudzone komórki tuczne wydzielają z kolei IL4,5 pobudzając tym samym eozynofile.
Limfocyty Th2 dojrzewają z Th0 pod wpływem IL-4 (można dodać, że działając na Th0 interleukiną 12 i INF-gamma otrzymamy Th1).
IgE w reakcjach alergicznych
IgE łączy się z komórkami eżektorowymi za pomocą odpowiednich receptorów. Przede wszystkim są to FcεRI i FcεRII. Pierwszy z nich jest receptorem o dużym powinowactwie do IgG i uczestniczy bezpośrednio w reakcjach alergicznych. Jest charakterystyczny dla komórek tucznych i bazofilów. FcεRII uczestniczy natomiast w niszczeniu pasożytów przez eozynofile (w mechanizmie ADCC).
Regulacja wytwarzania IgE - regulacja pozytywna
Regulacja negatywna
na powyższych etapach działają czynniki, które przekazują sygnały supresyjne, ograniczające aktywacje i dojrzewanie limfocytów B oraz hamujące wytwarzanie IgE. W procesach przełączenia klas są to INF-gamma, TNF-alfa TGF-beta i IL-12. Właściwości supresorowe wykazuje IL-10, która hamuje w sposób naturalny reakcję alergiczną-hamuje wydzielanie IgE. Hamująco na duże stężenia IgE lub kompleksów IgE z antygenami działaj sprzężenia zwrotne:
Udział komórek tucznych i bazofilów w reakcji alergicznej
Komórki te odpowiedzialne są za uwalnianie mediatorów procesu zapalnego. Nie jest wiadome, które z komórek dominują. Prawdopodobnie jednak dominujące stanowisko zajmują komórki tuczne.
Komórki tuczne posiadają na swojej powierzchni receptory Toll, dzięki czemu są wrażliwe na wiele czynników pochodzenia bakteryjnego i wirusowego. Ponadto na degranulację ziaren tych komórek wpływają chemokiny uwalniane we wczesnych etapach zakażenia. Należy dodać, że komórki tuczne nie krążą w organizmie - pozostają w narządach, natomiast bazofile krążą we krwi, a w tkankach występują w niewielkiej liczbie.
Komórki tuczne i bazofile mogą być aktywowane na dwa sposoby:
Mediatory uwalniane przez komórki tuczne i bazofile - mediatory procesu zapalnego.
Prostaglandyny-najważniejsza to PGD2, która współuczestniczy w zwiększaniu przepuszczalności i rozszerzeniu naczyń, a także w skurczu oskrzeli. Hamuje agregację płytek i jest czynnikiem chemokinetycznym dla neutrofilów.
Leukotrieny - odpowiedzialne za migrację różnego rodzaju komórek do miejsca objętego procesem zapalnym, działanie chemotaktyczne na neutrofile (LTB4). Inne wzmagają kurczliwość mięśni gładkich np. w oskrzelach i są współodpowiedzialne za obfite wydzielanie śluzu podczas reakcji alergicznych ( LTC4 LTD4 LTE4)
Poza tym, że są magazynowane w ziarnach mogą być również wydzielane w wyniku aktywacji komórki tucznej poprzez receptor FcεRI. Są to głównie IL-4 i TNF.
Udział eozynofilów w reakcjach alergicznych
Eozynofile odpowiedzialne są za generowanie procesu zapalnego. Proces zapalny prowadzi do zmian wykrywalnych w badaniach klinicznych. W przypadku nie leczonej astmy atopowej następuje przerost błony podstawnej w wyniku odkładania się tam kolagenu (typu I i III). Na obrazie widoczna jest gruba warstwa kolagenu wypełniająca pęcherzyki płucne, jednak jej grubość nie zależy od długości trwania choroby. (to było na wykładzie tylko, więc może posłużyć jako dobry przykład i dowód na to, że się chodziło na wykłady :P )
Najistotniejszą rolę w działaniu eozynofilów odgrywają mediatory ziaren, do których należą: główne białko zasadowe - MBP, peroksydaza eozynofilowa - EPO (współuczestniczy w zabijaniu wirusów, bakterii, kom nowotworowych), białko kationowe eozynofilów - ECP (indukowanie uwalniania histaminy z bazofilów, silna aktywność cytotoksyczna), neurotoksyna eozynofilowa - EDN=EPX-białko X (hamowanie proliferacji limfocytów T).
W chorobach alergicznych liczba eozynofilów zwiększa się, na skutek chemotaktycznego i/lub aktywującego działania różnych czynników:
ECF-A wydzielany przez kom tuczne
GM-CSF, IL-5,2,3,4,16 wydzielane przez limfocyty
TNF przede wszystkim przez makrofagi
ODPOWIEDŹ IMMUNOLOGICZNA NA ALERGEN
Reakcja natychmiastowa (anafilaktyczna) - czas mierzony od wprowadzenia antygenu do organizmu do rozpoczęcia reakcji to maksymalnie 5 minut. Reakcja ta wiąże się z degranulację komórek tucznych i bezpośrednim oddziaływaniem mediatorów.
reakcje anafilaktyczne mogą dotyczyć różnych układów, ale najczęściej obejmują układ krążenia, oddechowy, pokarmowy i skórę. Reakcje mogą mieć też przebieg o różnym nasileniu. W najcięższej postaci dochodzi do niewydolności oddechowej (następuje obkurczanie pęcherzyków płucnych - na skutek wysokiego stężenie serotoniny lub histaminy. W takim wypadku należy natychmiast podać adrenalinę) i krążeniowej - tzw. wstrząs anafilaktyczny. W skrajnych przypadkach prowadzi do śmierci.
Reakcja późna - LPR w przypadku częstego lub ciągłego narażenia na alergen prowadzi ona do przewlekłego stanu zapalnego i nieodwracalnego uszkodzenia tkanek. Nie można jej mylić z nadwrażliwością typu późnego. Charakteryzuje się ona podobnymi objawami do natychmiastowej, ale często ich nasilenie jest większe.
Nadwrażliwość typu II - reakcje cytotoksyczne
Główną rolę odgrywają tutaj IgM i IgG. Uszkodzenie narządów jest wynikiem zabijania komórek obcych lub komórek posiadających na powierzchni nowe antygeny (np. po przebyciu infekcji bakteryjnej lub wirusowej fragmenty struktur tych drobnoustrojów pozostają w organizmie i są opsonizowane, co może prowadzić do uszkodzeń narządów). Wyróżniamy następujące mechanizmy uszkadzania tkanek:
Reakcje cytotoksyczne:
Mechanizm działania jest dwukierunkowy - 1) kompleks lek-przeciwciało „zagnieżdża się gdzie chce” np. jest absorbowany na powierzchni komórki i aktywuje dopełniacz. 2) lek przyłącza się do komórek np. erytrocytów, ale też innych komórek narządowych - opsonizacja i zniszczenie komórki.
Nadwrażliwość typu III - reakcje z udziałem kompleksów immunologicznych
Kompleksem immunologicznym nazywa się cząsteczki składające się z antygenów połączonych z przeciwciałami. Do nich mogą być również przyłączone składniki dopełniacza. Kompleksy te w pewnych warunkach mogą odkładać się w tkankach i inicjować miejscowo proces zapalny. Na odkładanie się kompleksów ma wpływ wiele czynników. 1)wielkość kompleksu - wyróżniamy małe, średnie i duże kompleksy. Małe są usuwane w wątrobie i nerkach, duże niszczone przez komórki żerne wątroby i śledziony. Natomiast średnie kompleksy wykazują silne działanie patogenne. Można powiedzieć, że najbardziej niebezpieczne są te kompleksy, których „poruszanie” się we krwi nie jest zakłócane - są to kompleksy średniej wielkości. Małe kompleksy mogą zostać nie wychwycone przez komórki, a duże są zatrzymywane „po drodze”.2) powinowactwo i klasa przeciwciała - np. przeciwciała o dużym powinowactwie do antygenu tworzą duże kompleksy. 3) dopełniacz - hamuje odkładanie się kompleksów, ale również nasila stan zapalny po przyłączeniu się do kompleksów już odłożonych w tkankach.
Przykłady:
Odczyn Arthusa - antygen wprowadza się podskórnie; odpowiednie przeciwciała łączą się z antygenem, formuje się kompleks; immunokompleksy aktywują płytki krwi i komórki tuczne; indukcja IL-1, TNF gamma, wytwarzanie histaminy; następuje zwiększeni przepuszczalności naczyń; rozwija się proces zapalny. Objawia się obrzękiem, zaczerwienieniem lub nawet martwicą skóry.
Zewnątrzpochodne alergiczne zapalenie pęcherzyków płucnych: płuco farmera, płuco hodowcy pieczarek, płuco hodowcy gołębi. W tym przypadku antygeny dostają się do organizmu drogą wziewną.
Odczyn Arthusa i zewnpoch. alerg. zap. pęch. pł. Są przykładami reakcji patologicznych występujących po miejscowym podaniu antygenu.
Możemy jeszcze wyróżnić sytuację, w której kompleksy krążą po organizmie i odkładają się w różnych tkankach - choroba posurowicza (podanie obcogatunkowego białka)
Nadwrażliwość typu IV (późnego) - dominacja odpowiedzi typu komórkowego
Reakcje wynikają tutaj z pierwotnego zaangażowania limfocytów typu T. Odpowiedź ta występuje po kilku godzinach. Procesy zapalne są wynikiem uwalniania przez limfocyty cytokin, które aktywują inne komórki, w tym limfocyty cytotoksyczne (uwalniają perforyny, granzymy), makrofagi, bazofile. Duże znaczenie odgrywa w zakażeniach bakteryjnych, wirusowych, grzybiczych.
Typowym przykładem jest śródskórne podanie tuberkuliny - do reakcji dochodzi dlatego, że osoba miała już wcześniej kontakt z prątkami - została uczulona. Reakcje nadwrażliwości przyjmują histologicznie różne postaci:
Najczęstszą formą nadwrażliwości typu IV jest nadwrażliwość kontaktowa. Np. kontaktowe zapalenie skóry.
24. Choroby alergiczne a możliwości terapeutyczne.
Nadwrażliwość typu pierwszego jest synonimem alergii.
Alergia to patologiczna odpowiedź organizmu na alergen. Alergia wywołana jest przez reakcję antygenu z przeciwciałem Ig E związanym z receptorami powierzchniowymi komórek tucznych i bazofili.
Efekt kliniczny związany jest z wydzielaniem przez te komórki tuczne i bazofile mediatorów stanu zapalnego np.: histamina, leukotrieny, aktywatory kinin.
Alergię definiuje się przez obecność swoistych przeciwciał Ig E w surowicy, dodatnie próby skórne, objawy kliniczne ( katar sienny, pokrzywki na skórze, astma).
Czynniki wywołujące alergię możemy podzielić na genetyczne tj. geny kodujące cytokiny- IL 4, 5,13 oraz środowiskowe.
Stany chorobowe: katar sienny, astma atopowa, wstrząs anafilaktyczny, atopowe zapalenie skóry.
Rodzaje alergenów: białkowe( białka enzymatyczne i transportowe),główne(trawy, roztocza), słabe, hapteny (leki, które działają po połączeniu z białkami surowicy np. antybiotyki).
Receptory Ig E to FcεRI, FcεRII , które znajdują się komórkach tucznych, bazofilach, eozynofilach, monocytach.
Regulacja wytwarzania Ig E:
-pozytywna: aktywacja limfocytu B i uzyskanie przez niego sygnałów od antygenu, a drugi sygnał od IL 2,13, CD4, a następnie przekształcenie limfocytów B Ig E+ w komórki plazmatyczne
-negatywna: hamowanie wydzielania rozpuszczalnej formy FcεRII, blokowanie wiązań sFcεRII z CD 21 na limfocycie B, związanie kompleksu antygen-Ig E z FcεRII
Komórki tuczne wydzielają mediatory:
-perforynowe
-genorowane
-cytokiny
Możliwości terapeutyczne:
-indukowanie przeciwciał Ig A, Ig G
-blokowanie przeciwciał Ig E przez limfocyty B
-wzrost ilości limfocytów Th1 (wzrost pod wpływem IFN gamma, IL 2)
-blokowanie działania cytokin IL 4,5,13
-neutralizacja Ig E
-blokowanie receptorów FcεRI
-terapia genowa alergenu limfocytem Ts blokowanie Ig E
25. Wrodzona i nabyta tolerancja immunologiczna, przełamanie tolerancji.
To brak reakcji układu odpornościowego na antygen. Odnosi się do danego, konkretnego antygenu. Wyróżniamy tolerancję
AUTOTOLERANCJA - MECHANIZMY JĄ WARUNKUJĄCE:
Wyróżniamy mechanizmy centralne (w centralnych narządach limfatycznych) i obwodowe.
Centralne - limfocytyT autoreaktywne usuwane są w grasicy podczas ich dojrzewania, apoptozie ulegają wszystkie te, które wykażą duże powinowactwo do autoantygenów w kontekście własnych MHC. Na obwód przedostają się te o średnim lub małym powinowactwie. Brak ekspresji danego epitopu w grasicy może doprowadzić do wyjścia na obwód autoreaktywnych limfocytów. (charakterystyczny fenotyp CD45RA+ CD62L+).
Obwodowe - ogólnie mają na celu nie dopuścić do aktywacji autoreaktywnych limfocytów T. Są to:
# delecja klonalna - usunięcie autoreaktywnych limfocytów w wyniku apoptozy, poprzez „samobójstwo” lub „bratobójstwo”
# ignorancja (sekwestracja) antygenu - antygeny np. oddzielone od krwi szczelnym śródbłonkiem (sekwestracja anatomiczna). W autoantygenach istnieją epitopy bardziej i mniej immunogenne (sekwestracja molekularna). W grasicy usuwane są limfocyty o dużym powinowactwie do tych bardziej immunogennych. W przypadku zapalenia białka mogą odsłonić epitopy mniej immunogenne, co może doprowadzić do reakcji limfocytów.
# anregia klonalna - by aktywować limfocyt, komórka dendrytyczna musi mu przekazać sygnał przez receptory TCR i CD28. Gdy sygnał zostanie przekazany tylko przez TCR, wtedy komórka limfocytu w anergii, czyli nie wytwarza IL-2, nie proliferuje. Ten stan może się pogłębiać poczynając od coraz mniejszej ekspresji TCR aż do śmierci komórki. Komórki te mogą także reagować z kom. Dendrytycznymi i hamować odpowiedź immunologiczną na inne antygeny prezentowane na tej samej APC.
# aktywna supresja - poprzez komórki regulatorowe, które potrafią „wyciszyć” odpowiedź immunologiczną, są to
♣ Tr1 i Th3 - produkują IL-10 i TGF-β, zmniejszają zdolność komórek prezentujących antygen do aktywacji i stymulacji innych limfocytów T. Hamują też proliferację limfocytów dziewiczych
♣ T CD4+ CD25+ - mają receptor dla IL-2 i cząsteczki CTLA-4, mają cechy komórek w anergii, hamują proliferacje limfocytów CD4+ CD8+ oraz wytwarzanie przez nie innych cytokin. Po aktywacji wywierają efekt supresorowy w sposób antygenowo nieswoisty
♣ Limfocyty NKT - mają cząsteczki powierzchniowe charakterystyczne dla T i NK, wytwarzają wiele cytokin; IL-4, IL-10, IL-13, TGF-β. Hamują limfocyty oraz poprzez IL-13 wpływają na APC i powodują zmniejszone wydzielanie IL-12
♣ Komórki NK2 - znaczenie w podtrzymywaniu remisji i „wyciszaniu” procesu zaplanego, nie znane są jeszcze mechanizmy. Istnieją też badania nad NK1, które eliminują po prostu komórki zakażone wirusami i tłumią w zarodku infekcję, która mogłaby prowadzić do choroby autoimmunizacyjnej.
♣ równowaga Th1-Th2 - w przypadku chorób spowodowanych nadmierną aktywnością Th1 efekt terapeutyczny próbowano uzyskać po nadmiernej aktywacji Th2, np. poprzez podanie przeciwciał przeciw IL-12, IFN-γ lub podając IL-4 i przetaczając limfocyty Th2. Jednak badania wykazały, że nie zawsze mamy efekt terapeutyczny, a czasem nawet może dojść do indukcji procesu chorobowego.
Indukcja tolerancji sztucznej (głównie przy przeszczepie) może być uzyskana poprzez podawanie obcych antygenów już w życiu płodowym, podawanie ich do grasicy w celu wywołania delecji limfocytów, wyniszczenie komórek krwiotwórczych i podanie szpiku dawcy narządu. Poza tym tolerancję sztuczną można wywołać poprzez anergię klonalną, delecję klonalną, podwyższenie aktywacji Th2, supresję wybranych limfocytów. Organizm może też zaadaptować się do obcych antygenów -ten fakt wykorzystuje się przy leczeniu alergii - pacjentowi podaje się zwiększające się dawki alergenu, powstają przeciwciała blokujące, które uniemożliwiają wiązanie się alergenu do IgE a limfocyty Zostają zahamowane w wytwarzaniu IgE poprzez interakcję z kompleksami alergen-IgE.
ZNIESIENIE AUTOTOLERANCJI
Inne elementy - UVB może indukować charakterystyczne zmiany w toczniu, chlorek winylu i związki krzemu indukują twardzinę układową, niektóre leki wpływają na rozwój tocznia - w wyniku struktury histonów w wyniku czego stają się one immunogenne.
26. Immunomodulacja - udział leków.
Immunomodulację stosuje się w różnych stanach chorobowych; w zależności od tego czy chcemy pobudzić czy zahamować układ immunologiczny wyróżniamy odpowiednio : immunostymulację i immunosupresję.
Immunomodulatory są to związki zarówno naturalne, jak i syntetyczne, które mają za zadanie stymulować bądź hamować.
I. Środki immunostymulujące
Są to preparaty, które z reguły wzmagają odpowiedź immunologiczną.
Analog MDP to murabutyd - pochodna hydrofilowa; działa głównie na makrofagi
wzrost chemotaksji, aktywności przeciwnowotworowej; aktywacja wydzielania
IL-1, IL-6, IFN-γ .
Skutki uboczne: wzrost IL-1, INF, gorączka.
Podawany doguzowo w chorobach nowotworowych.
odpowiedź komórkowa i humoralna; leczenie białaczek (leczenie uzupełniające).
Działanie sekwencji CpG obejmuje:
Zastosowanie: alergie, choroby o podłożu autoimmunizacyjnym w celu
przywrócenia równowagi między Th1 i Th2.
Są to związki o dużej toksyczności. Zmodyfikowany wariant J i C, w którym co 12 cytozyna jest zastąpiona uracylem nazywa się Ampligen i jest stosowany w AIDS.
a) Lewamizol - podawany łącznie z 5-fluorouracylem; redukuje masę guza, wydłuża
czas życia u chorych ( rak okrężnicy); stymulacja odpowiedzi immunologicznej: makrofagów, neutrofilów i limfocytów T; wzmaga: fagocytozę, mechanizmy cytotoksyczne i chemotaksję
b) Cymetydyna - blokuje receptory H2 dla histaminy; stosowana w chorobie wrzo-
- dowej żołądka i dwunastnicy; działa stymulująco na: odpowiedź humoralną, wydzielanie IL-2 przez limfocyty T; wpływa hamująco na limfocyty Ts, osłabia działanie histaminy na chemotaksję neutrofilów
c) Inozyna pranobeks - indukuje różnicowanie i aktywację limf. T, makrofagów,
kom. NK, działa przeciwwirusowo; leczenie: opryszczki, zapalenia wątroby typu B
odry, HIV, zapalenia mózgu
d) retinoidy - podobne do witaminy A; działanie: wzrost wydzielania przeciwciał,
wzrost cytotoksyczności limf. T, działanie przeciwzapalne, hamowanie wzrostu
kom. nowotworowych; leczenie: białaczek, raka szyjki macicy.
II. Środki immunosupresyjne
Charakteryzuje je zdolność hamowania odpowiedzi immunologicznej. Zadaniem środka immunosupresyjnego jest blokowanie reakcji na określony antygen oraz intensywnie działa w pierwotnej odpowiedzi immunologicznej.
1.Glikortykosteroidy (pochodne hormonów kory nadnerczy)
Z dużej grupy glikokortykosteroidów (GS) zastosowanie jako leki immunosupresyjne znalazły tylko nieliczne :prednizon, prednizolon i metyloprednizolon. Inne preparaty GS ( triamcinolon, betametazon czy deksametazon) podaje się miejscowo lub ogólnie w celu wywołania efektu przeciwzapalnego.
Wykazano, że w przebiegu reakcji zapalnej endogenne GS stymulują wytwarzanie białek ostrej fazy, np. IL-6 i TGF-β oraz powoduje wzrost proliferacji limfocytów pomocniczych typu Th2.
GS wiążą się ze swoistym receptorem w cytoplaźmie który zawiera 2 białka szoku termicznego, następuje oddzielenie białek od receptorów, mamy aktywny receptor który wędruje do jądra komórkowego. Tam kompleks przyłącza się do regionu promotorowego DNA (GRE). Po związaniu leku z GRE może dojść do pobudzenia lub hamowania genów. Między innymi dochodzi do aktywacji genu białka, które jest inhibitorem czynnika transkrypcyjnego NF-κB. W wyniku hamowania tego czynnika przez indukowany GS zostaje zahamowana zdolność wytwarzania mediatorów odczynu zapalnego. Inny mechanizm bezpośredniego immunosupresyjnego działania GS może wiązać się ze zdolnością tych leków do wywołania procesu apoptozy w komórkach.
GS hamują wytwarzanie: IL-1, 4, 6, 8, TNF-alfa, genów dla prostaglandyn i leukotrienów stąd nie ma działania limfocytów, nie ma migracji kom. do miejsc prezentacji antygenów, zmniejszenie ekspresji MHC i cząsteczek adhezyjnych.
W ciągu 4godz. po podaniu człowiekowi jednorazowej dawki GS dochodzi do: wzrostu liczby neutrofilów, spadku produkcji przeciwciał i cytokin, może wybiórczo wzrastać poziom IgE, zablokowanie funkcji układu immunologicznego, zaburzenie w funkcjonowaniu Tc i NK.
W klinice GS stosuje się do leczenia chorób autoimmunizacyjnych, zapobiegają odrzucaniu przeszczepu, mają działanie przeciwzapalne.
2.Cyklosporyna - supresor (CsA),działa na limfocyty T, hamuje proliferację, blokuje CD4 i CD8,powoduje zahamowanie wytwarzania IL-2, zatrzymuje syntezę IL-3,4 czy TNF.
CsA blokuje uwolnienie ziarnistości ziaren kom. tucznych, neutrofilów, bazofilów, zatrzymuje apoptozę, blokuje limf. T, hamuje wytwarzania przeciwciał.
Stosuje się ją do leczenia takich chorób jak łuszczyca, reumatoidalne zapalenie stawów, astma atopowa czy kłębuszkowe zapalenie nerek.
Lek ten najsilniej zapobiega reakcji odrzucania przeszczepu.
3. Takrolimus - blokuje receptor IL-2 (efekt silniejszy od cyklosporyny). Stosuje sie go przy przeszczepach narządowych oraz w leczeniu chorób autoimmunizacyjnych.
4. Sirolimus (rapamycyna) - zapobiega aktywacji i proliferacji limf. T i B, pobudzenie limfocytu w obecności rapamycyny powoduje, że cykl komórkowy zostaje zatrzymany w fazie G1, zmniejszeniu ulega aktywność cykliny A i E, cdk2 i cdc2. Stosuje się go przy ostrym odrzucaniu przeszczepu.
5. Cyklofosfamid - lek alkilujacy, jego efekt immunosupresyjny to: hamowanie proliferacji limf. T i syntezy przeciwciał. Stosuje się go w leczeniu chorób autoimmunizacyjnych (ziarniaki Wegenera).
Efekty terapeutyczne: tworzą trwałe wiązania z DNA (kompleksy z DNA), zaburza podziały komórkowe.
6. Azatiopryna - lek ten działa głównie na kom. dzielące się, hamuje czynność limf. T i B, wywiera słabe działanie przeciwzapalne.
7. Mykofenolan mofetilu - pochodna kwasu mykofenolowego; hamuje proliferację limf. T i B stymulowaną anygenem, mitogenami i cytokinami. Lek ten blokuje przenoszenie reszt cukrowych na cząsteczki białek. W ten sposób zostaje zatrzymana synteza wielu ważnych cząsteczek adhezyjnych.
Skuteczny w leczeniu niektórych chorób autoimmunizacyjnych.
27.Zastosowanie terapeutyczne immunomodulacji.
W pewnych okolicznościach homeostaza układu odpornościowego może być zaburzona: pewne mechanizmy odporności ulegają wzmocnieniu, inne z kolei- osłabieniu (np. w alergiach, chorobach autoimmunizacyjnych, zakaźnych i nowotworowych). W różnych stanach chorobowych podaje się leki albo hamujące reaktywność immunologiczną (IMMUNOSUPRESYJNE) albo stymulujące tę reaktywność (IMMUNOSTYMULUJĄCE).
CpG (niemetylowane sekwencje dinukleotydowe) znajdują się w DNA bakterii, owadów i pasożytów wielokomórkowych, określane są jako motywy CpG; są one rozpoznawane przez receptor TLR9 znajdujący się w komórkach żernych, dendrytycznych i limfocytach B i silnie aktywują te komórki.
Immunostymulujący efekt bakteryjnego DNA naśladują sztucznie syntetyzowane oligonukleotydy (ODN) zawierające niemetylowane motywy CpG. Działanie ODN obejmuje: aktywację właściwości żernych, zdolności wytwarzania cytokin, tlenku azotu i reaktywnych rodników tlenowych przez komórki żerne, indukcję dojrzewania komórek dendrytycznych, pobudzenie zdolności prezentacji przez nie antygenu oraz wydzielania cytokin, aktywację limfocytów B, wzmaganie aktywności komórek NK i wytwarzania INF- ɣ. ODN budzą nadzieję w alergologii (ich użycie będzie mogło przywracać zaburzoną równowagę w zakresie funkcji Th1/Th2).
28. Rodzaje modulatorów układu immunologicznego, przykłady działania.
Immunomodulacja polega na działaniu hamującym (immunosupresja) lub wzmagającym (immunostymulacja) w zależności od wyjściowego stanu ukł. immunologicznego.
1. Immunostymulujące
1.1. Środki izolowane z bakterii i grzybów (w tym szczepionki)
1.2. Substancje endogenne (otrzymane na drodze rekombinacji genetycznej)
1.3. Syntetyczne
2. Immunosupresyjne
2.1. Środki farmakologiczne
2.1.1. Glikokortykosteroidy
2.1.2. Cytostatyki
2.1.3. Cyklosporyna
2.1.4. Inne leki stos. w transplantologii
2.1.5. Globulina antylimfocytarna
2.2. Promieniowanie jonizujące
1. Immunostymulacja
- wzmagają odpowiedź immunologiczną
- pobudzają wytwarzanie przeciwciał
- nasilają działanie cytotoksyczne i fagocytozę
- mechanizm często nie do końca wyjaśniony (zwłaszcza środków pochodzenia naturalnego)
1.1.
a) zawierają antygeny drobnoustrojów, po ich podaniu powstaje odporność swoista przeciwko danemu patogenowi;
np. Di-Per-Te, szczepionka przeciwko polio, odrze, różyczce
b) zawierają atenuowane szczepy drobnoustrojów, wiążą receptory na kom. docelowych, zwiększają miejscową odp. immunologiczną, np. wzrost ilości przeciwciał Ig-A na błonie śluzowej
- zawierają zabite bakterie oraz produkty ich rozpadu
- nie chronią przed konkretnym zakażeniem,
- pobudzają nieswoiste mechanizmy odpornościowe
- zwiększają ogólną zdolność do reakcji:
pobudzają fagocytozę makrofagów, wzrost ilości limfocytów, zwiększają ilość Ig-A w obrębie bł. śluz. dróg oddechowych - stos. w nawracających zakażeniach jako profilaktyka (np. Ribomunyl, Polyvaccinum, Broncho-Vaxom, Luivac)
- aktywacja odp. komórkowej (makrofagi, monocyty)
- leczenie raka pęcherza moczowego
- liofilizowany preparat z atenuowanych Streptococcus pyogenes
- wzrost cytotoksyczności limfocytów T, aktywności komórek LAK i przeciwnowotworej aktywacji makrofagów (wpływ na poziom cytokin: IL-1, TNF, INF-gamma)
- lentinan - indukcja aktywności przeciwnowotworowej makrofagów (zwrost wydzielania IL-1)
- beta-glukan
1.2.
G-CSF - pobudza w szpiku namnażanie i dojrzewanie prekursorowych linii granulocytów (np. Filgrastim)
GM-CSF - zwiększa liczbę neutrofili, eozynofili, makrofagów we krwi obwodowej (np. Molgramostim)
- pobudzają Th1 i T h2
- leczenie małopłytkowości, jako p-ciała antyidiotypowe
1.3. Syntetyczne
2. Immunosupresja
- blokowanie reakcji na określony antygen (podstawa transplantologii)
- intensywne działanie w pierwotnej odp.immunolog.
- korzystne dział. w przeszczepach allogencznych
2.1.1. Glikortykosteroidy
- hamują syntezę licznych cytokin: IL-1, IL-3, IL-4, IL-5, IL-6, IL-8, TNF-alfa, GM-CSF (konsekwencje: zahamowanie chemotaksji, fagocytozy)
- zmniejszają poziom Ig-A, Ig-G, Ig-M, Ig-D; zaburzają działanie Tc i NK
- stos. w chorobach autoimmunizacyjnych i zapobieganiu odrzucaniu przeszczepów narządowych
2.1.2. Cytostatyki
- leki alkilujące np. cyklofosfamid - zahamowanie proliferacji limfocytów limfocytów syntezy p-ciał
- inhibitory puryn i pirymidyn np. metotreksat, merkaptopuryna
2.1.3. Cyklosporyna (Sandimmun-Neoral)
- mechanizm działania: zahamowanie wytwarzania IL-2 przez limfocyty T (blokuje CD4+ i CD8+), wzrost syntezy TGF-beta, hamowanie wytwarzania p-ciał i aktywności makrofagów (poprzez Th) oraz w niewielkim stopniu hamujący wpływ na limfocyty B
- najważniejszy i najsilniejszy lek zapobiegający odrzucaniu przeszczepów, stos. także w chorobach autoimmunizacyjnych tj. łuszczyca, kłębuszkowe zapalenie nerek, choroba Crohna i reumatoidalne zapalenie stawów
2.1.4. Inne immunosupresanty
2.1.5. Globulina antylimfocytarna
- skuteczne środki stos. do hamowanie procesu ostrego odrzucania przeszczepu
Supresja immunologiczna - blokowanie reakcji na dany antygen
- intensywne działanie w pierwotnej odp. Imm. ( korzystne w przeszczapach allogenicznych) stosowana, gdy chcemy wyłączyć układ immunologiczny.
FARMAKOLOGICZNA:
I GLIKOKORTYKOSTEROIDY (GS) - pochodne hormonów kory nadnerczy
Działanie endogennych GS - stymulują wytwarzanie
* białek ostrej fazy
* IL6
- GS wiąże się z receptorem w cytoplazmie
- receptor zawiera hsp 90, hsp 70 ( białka szoku termicznego )
- oddzielanie białek od receptora
- aktywny receptor wędruje do jądra komórki
- łączenie się z DNA w obrębie regionu promotorowego GRE (10-100 genów zawiera GRE - miejsce wiązania receptora GS)
- po związaniu receptora z sekwencją GRE może dochodzić do pobudzenia, hamowania transkrypcji genów NF-KB
-zahamowanie czynnika przez GS prowadzi do hamowania syntezy mediatorów procesu zapalnego
- indukcja apoptozy
GS hamuja wytwarzanie:
* IL-1,3,4,5,6,8
* TNFa
*GM-CSF
Geny cytokin zawierają hamujące sekwencje GRE.
GS pobudzają:
* syntezę lipokortyn
* wiązanie lipokortyn z fosfolipidami błon komórkowych ( receptory dla lipokortyn są obecne w monocytach i neutrofilach)
GS powodują:
*hamowanie ekspresji genów dla prostaglandyn i leukotrienów
* zmniejszenie ekspresji cząsteczek adhezyjnych MHC
Po podaniu op 4 godz. Obserwuje się:
- przejściowa limfopenia związana z przemieszczeniem ( redystrybucją ) limfocytów do tkanek i innych obszarów ukł. Limf.. (szcz. Dotyczy to L CD4+)
- wzrost liczby neutrofilów
- spadek poziomu monocytów, eozynofilów, bazofilów
- zahamowanie syntezy Il-5, GM-CSF( czynniki wzrostowe eozynofilów)
- apoptozę eozynofilów
- u chorych zaburzenia w funkcjonowaniu Tc i NK
- zmniejszenie poziomu IgA, IgG, IgM(zwiększony katabolizm Ig, zahamowanie wytwarzania swoistych przeciwciał)
- wzrost IgE
- redystrybucja monocytów we krwi
- zahamowanie chemotaksji, fagocytozy i zdolności bakteriobójczych makrofagów
Wykorzystanie GS w klinice:
* działanie przeciwzapalane
* immunosupresyjne
* leczenie chorób autoimmunologicznych
* zapobieganie odrzucaniu przeszczepów
PRZYKŁADOWE LEKI
CYKLOSPORYNA
--> pierwszym źródłem były hodowle grzyba Tolypocladium inflatum
Oddziałuje na proces aktywacji LT, hamując proliferację LT stymulowaną wieloma bodźcami: mitogenami, przeciwciałami anty-CD3, alloantygenami. Podobnie blokuje aktywację klonów L CD4+ i CD8+ w obecności swoistych antygenów. Z wyjątkiem dużych dawek - nie hamuje proliferacji LT stymulowanej Il-2, IL- 4.
Mechanizm działania supresyjnego na odp imm:
- zahamowanie wytwarzania IL-2 przez LT. Wykazano, że w obecności CsA, w aktywowanych komórkach nie pojawia się mRNA dla IL-2
- Ekspresja genu dla IL-2 pozostaje pod kontrolą promotora, z którym wiąże się wiele czynników transkrypcyjnych, m.in. AP-1, AP-3, NK-kB, OCT-1, NF-AT(interakcja z nim - podstawowe znaczenie dla działania leku)
- Receptor wiążący w komórce CsA - cytoplazmatyczne białko - cyklofilina
- Kompleks: CsA - cyklofiliną nabywa zdolności wiązania się z kalcyneuryną i blokowania jej funkcji. Nie dochodzi zatem do defosforylacji NF-ATc, co uniemożliwia powstanie aktywnego czynnika transkrypcyjnego - hamowanie syntezy IL-2
Efekt:
- W obecności CsA w LT nie dochodzi też do syntezy: IL-3,4, INFg, TNFa
- w wyniku działania CsA- zatrzymana aktywacja LT
- CsA nie wpływa na aktywacją LT za pomocą CD28
- CsA prze blokowanie kalcyneuryny - hamuje uwalnianie zawartości ziaren - egzocytozę z limfocytów cytotoksycznych, osłabiając ich zdolności cytolityczne. Blokuje też egzocytozę innych kom. np. Bazofilów, komórek tucznych, neutrofilów.
- CsA zatrzymuje apoptozę
- zaburza proces selekcji pozytywnej i negatywnej w grasicy
- CsA pośrednio hamuje wytwarzanie przeciwciał i aktywację makrofagów przez wpływ na LTh
- w niewielkim stopniu hamuje też LB
- zmniejsza wydajność ekspresji MHC klasy II na powierzchni komórek prezentujących antygen
- stymuluje wytwarzanie TGF-b - która hamuje aktywację limfocytów i pobudza rozwój tkanki łącznej
Leczenie:
- najsilniej zapobiega odrzuceniu przeszczepu - jest w składzie wszystkich używanych schematów leczenia immunosupresyjnego w transplantologii
- leczenie chorób o podłożu autoimmunizacyjnym ( kłębuszkowe zapaleni nerek, reumatoidalne zapalenia stawów, łuszczyca, choroba Crohna, zapalenie błony naczynowej oka)
- i alergicznym ( astma atopowa )
TAKROLIMUS (FK - 506)
--> budowa antybiotyku makrolidowego, otrzymany z kolonii Streptomyces tsukubaensis
Działanie:
* podobnie jak CsA cytoplazmatycznym receptorem są białka z rodziny immunofilin
* jedna z nich wiążąca takrolimus - FKBP12 - po połączeniu z FK506 nabywa zdolności hamowania aktywności kalcyneuryny --> zablokowanie transkrypcji genu dla IL-2
Efekt:
- 10-100x skuteczniejszy od CsA
- większy pośredni wpływ na LB
- przedłuża przeżycie przeszczepów narządowych - działa zapobiegawczo oraz powstrzymuje rozpoczęty proces odrzucania
Leczenie:
* może okazać się skuteczny u chorych, u których nie daje się opanować odrzucania przeszcepu pomimo CsA
* przeszczep wątroby ( stymuluje regenerację )
* schorzenia autoimmunizacyjne, w których może być stosowany miejscowo
* choroby skóry o podłożu autoimmunizacyjnym i alergicznym
SIROLIMUS (RAPAMYCYNA)
--> z rodziny makrolidów,z hodowli promieniowca - streptomyces hygroscopicus
Działanie:
- swoisty receptor: immunofilina FKBP12
- pobudzenie limfocytu w obecności rafamycyny zatrzymuje cykl komórkowy w fazie G1
- hamuje proliferację LT, nie wpływając na wydzielanie IL-2
- zmniejszeniu ulega aktywność białek, istotnych dla dalszych etapów cyklu komórkowego( CDK2, CDC2, cykliny A i E )
Efekt:
- zapobiega aktywacji i proliferacji LT w obecności egzogennej IL-2
- w przeciwieństwie do CsA i takrolimusu , nie zaburza apoptozy w grasicy
- znacznie silniej hamuje proliferację LB- zarówno indukowaną mitogenami, jak i antygenami grasiczozależnymi lub grasiczoniezależnymi
Leczenie:
* może zmniejszyć częstość występowania epizodów ostrego odrzucania przeszczepu
* niewielka nefrotoksyczność
* hamuje proliferację mięśni gładkich wywołaną różnymi bodźcami - może lepiej zapobiegać odrzucaniu przeszczepów
CYKLOFOSFAMID
--> grupa leków alkilujących - radiomimetyki ( podobnie działa do promieniowania jonizującego)
Działanie:
- ulega metabolizmowi w wątrobie przez układ cytochromu P450 do 4-hydroksysyklofosfamidu, z którego poprzez nieenzymatyczny rozkład powstaje aktywna pochodna iperytu azotowego
- powstała substancja tworzy wiązania kowalencyjne z wieloma podstawnikami(szcz. Łatwo dochodzi do alkilacji tego atomu azotu czasteczki guaniny)
- zakłócenia kodu genetycznego - śmierć komórki
- zaburzenia podziału komórki poprzez tworzenie trwałych wiązań między nićmi DNA
- alkilacja zmienia także właściwości wielu białek strukturalnych i enzymów - dzięki temu obejmuje też komórki niedzielące się
Efekt:
* oddziałuje głównie na proliferujące limfocyty
* w większym stopniu od innych hamuje wytwarzanie przeciwciał
Leczenie:
- choroby autoimmunizacyjne ( ziarniak Wgenera, toczeń układowy i rumieniowaty)
- przygotowanie przeszczepu allogenicznego szpiku
- w transplantologii - ograniczone zastosowanie ze względu na częste objawy toksyczne
ZASTOSOWANIE PRZECIWCIAŁ
POLIKLONALNE PRZECIWCIAŁA PRZECIW LIMFOCYTOM T
Działanie:
* bezpośrednio po podaniu: spadek liczby limfocytów w krążeniu
* po związaniu na powierzchni limfocytów moga je eliminować poprzez immunofagocytozę, w wyniku aktywacji dopełniacza lub ADCC
* modulacja cząsteczek w błonie komórkowej limfocytu - efekt immunosupresyjny nawet po powrocie liczby limfocytów do wartości początkowej
Leczenie:
- globulinę antytymocytarną antylimfocytarną (ATG, ALG) stosuje się profilaktycznie lub w leczeniu toczącego się ostrego odrzucenia przeszczepu przy braku efektów terapii dużymi dawkami GS
- najbradziej skuteczny środek w terapii ostrego odrzucenia
- ponieważ ATG i ALG posiadają obce białko, ich stosowanie powoduje powstanie przeciwciał nuetralizujących - ograniczają skuteczność i mogą być przyczyną powikłań
PRZECIWCIAŁA MONOKLONALNE
Działanie:
* IG2a - przeciw łańcuchowi e kompleksu CD3 obecnemu na wszystkich LT (CD3 ulega endocytozie lub złuszczeniu)
* po kilku min. Znikają wszystkie LT z krążenia
* przy kontynuacji po kilku dniach pojawiają sie LT z CD4 lub Cd8 bez CD3 --> nie mogą uczestniczyć w reakcji immunologicznej
Efekt:
- brak kłopotów związanych z przeciwciałami poliklonalnymi - tj. Mała swoistość, standaryzacja, zmienna aktywność w poszczególnych partiach preparatu)
Leczenie:
-anty-CD3- jedne z najskuteczniejszych środków immunosupresyjnych
- ostre odrzucenie
- profilaktyka po zabiegu
- ryzyko powikłań - zespół przesiękania przez włośniczki
- CD3 uczestniczy w aktywacji receptora LT --> anty CD3 może spowodować nieswoiste pobudzenie LT i uwolnienie cytokin) --> rozlane uszkodzenie śródbłonków - duże st. TNFa
- zwiększa ryzyko zarażeń oportunistycznych oraz nowotworów wywodzących się z układu limfatycznego
PRZECIWCIAŁA PRZECIW RECEPTOROWI DLA IL-2 ( monoklonalne)
* receptor ten jest na powierzchni pobudzonych LT- względna swoistość wobec komórek zaangażowanych w odpowiedź immunologiczną
* duża skuteczność w profilaktyce ostrego odrzucenia
* spadek ciśnienia i przyspieszenia akcji serca
* zaburzenie czynności nerek
* anty- CD-25 - skuteczne w leczeniu już istniejącego odrzucenia
30. Immunologiczne mechanizmy transplantantacji narządowej; reakcje gospodarz kontra przeszczep, przeszczep kontra gospodarz.
Nerka - końcowe stadium niewydolności nerek
Serce - skrajna niewydolność
Płuca/ płuca i serce/- nadciśnienie płucne, mukowiscydoza
Wątroba - marskość, rak, artezja dróg żółciowych
Rogówka - dystrofia, zapalenie
Trzustka lub Wysepki Langerhansa - cukrzyca
Szpik - niedobór immunologiczny, białaczka
Jelito cienkie - rak
Skóra - oparzenie
Rodzaje przeszczepów:
Miejsce:
Reakcja gospodarza przeciw przeszczepowi:
Antygeny zgodności tkankowej:
Budowa MHC I - łańcuchy ciężkie i lekkie (alfa 2 i alfa 1 - kieszonka, w której eksponowany peptyd pochodzenia endogennego).
Pokazywanie własnych antygenów swoim komórkom.
MHC II - tylko na niektórych komórkach - prezentujących antygen. 2 łańcuchy ciężkie.
MHC I i MHC II cechuje polimorfizm.
MHC III to m.in.:
Ludzkie MHC określane są mianem HLA (ang. human leukocyte antigens - ludzkie antygeny leukocytarne). Wyróżniamy następujące fazy w przebiegu odpowiedzi na antygeny przeszczepu:
I. Faza indukcji odpowiedzi (aferentna) - prezentacji i rozpoznanie antygenów;
Identyczna cząsteczka HLA na komórkach biorcy - prezentacja peptydu przez HLA limfocytom T. Przygotowanie białka do prezentacji przez cząsteczki HLA.
Nie przeszczepiamy pomiędzy płciami, kobieta ↔ mężczyzna (unika się).
Przeszczep:
- prezentacja bezpośrednia (alloantygen z przeszczepu i limfocyt T).
- prezentacja pośrednia - antygen obcy
PRZESZCZEP ALLOGENICZNY-PREZENTACJA BEZPOŚREDNIA ANTYGENU:
PRZESZCZEP ALLOGENICZNY - PREZENTACJA POŚREDNIA ANTYGENU:
II . Faza efektorowa (eferentna) - swoiste i nieswoiste mechanizmy odpowiedzi na przeszczep.
Odrzucanie przeszczepów:
MECHANIZMY ODRZUTU
Składowe odrzucania: APC rozpoznawane przez komórki Th. Aktywacja killerów. IL - 2,4,5 - przeciwciała. INF α,β.
Udział limfocytów Th CD4+:
Przeciwciała:
CYTOKINY:
Th rozpoznaje antygen obcy, następnie poprzez IL-2 działa na limfocyt Tc.
Rozpoznanie cząsteczek Fast komórka przechodzi na drogę apoptozy.
Przewlekłe odrzucanie u chorych:
Immunogenne: szpik kostny, skóra, wysepki Langerhansa, serce, nerka, wątroba
Istotne przy przeszczepach są:
+ |
- |
Kryteria jakie bierzemy pod uwagę przy szukaniu biorcy:
-HLA rodzeństwa (najczęściej przyjmowane przeszczepy)
-spokrewniony żywy
- HLA identyczny ze zwłok
-ze zwłok
Szukamy biorcy do danego narządu, a nie odwrotnie. Rodzeństwo może mieć identyczne HLA.
Wpływ zgodności HLA na powodzenie transplantacji (nerki):
- brak niezgodności HLA- A, B,DR 65-70% co najmniej 10-cioletniego funkcjonowania przeszczepu, czas półtrwania 20 lat
- jeden niezgodny 40-50% do 10-12 lat czas półtrwania
- większa liczba - 30-35% , czas półtrwania 7-10 lat
-na izolowanych limfocytach dawcy.
-surowica biorcy.
-dopełniacz.
- barwnik- błękit trepanu
IMMUNOSUPRESJA- zablokowanie odpowiedzi immunologicznej na wszystkie antygeny
Pacjent narażony na wszelkiego rodzaju infekcje; jest szczepiony. Podaje się dawki progowe, najczęściej 3 o różnej zasadzie działania. Np. cyklosporyna, FK 506 (od promienic).
Mechanizm działania leków- steroidy. Blokowanie stanu zapalnego. Cyklosporyna blokuje produkcję IL-2. działa neurotoksycznie. Azatiopryna blokuje proliferację łącząc się z DNA. Leki podajemy przed przeszczepianiem narządu albo razem z przeszczepem.
Trudno stwierdzić pierwsze objawy odrzucania przeszczepu. Stosuje się oznaczanie cytokin helisą. Sprawdzamy nacieki. Ocena messenger rRNA. Jeżeli któryś z tych parametrów będzie za wysoki - przeszczep został odrzucony.
METODY WYWOŁYWANIA TOLERANCJI IMMUNOLOGICZNEJ:
Ułatwienia immunologiczne:
- czynne ( antygen dawcy ) transplantacja przeżycie
- bierne (przeciwciała antydawca) transplantacja przeżycie
Mechanizmy tolerancji:
Przeszczepy szpiku stosowane w przypadku:
REAKCJA PRZESZCZEPU PRZECIW GOSPODARZOWI (GRAFT VS. HOST - GVH)
Czynniki ryzyka rozwoju przeszczepu przeciwko gospodarzowi :
Ostra GVH |
Przewlekła GVH |
- uprzednie ciąże u kobiety -dawcy szpiku - liczba limfocytów T w szpiku - niezgodność HLA -kobieta dawcą dla mężczyzny - podeszły wiek dawcy i biorcy - brak stosowania immunosupresji |
- niezgodność HLA - podeszły wiek dawcy i biorcy -kobieta dawcą dla mężczyzny - przetaczanie leukocytów dawcy |
31. Rola cząsteczek MHC, makrofagów oraz subpopulacji limfocytów T i B, komórek APC w prezentacji antygenów.
Prezentacja antygenu jest mechanizmem odpornościowym polegającym na ukazaniu antygenu limfocytom T przy udziale cząsteczek MHC (głównego układu zgodności tkankowej). Ponieważ większość antygenów to łańcuchy peptydowe zawierające bardzo wiele aminokwasów muszą one być poddane wcześniejszej obróbce głównie przez pocięcie ich przez proteazy na odpowiednie fragmenty.
Prezentacja antygenów limfocytom T może zachodzić dwoma drogami:
Prezentacja antygenów z udziałem MHC klasy I.
Polega na związaniu peptydów przez cząsteczki MHC klasy I, przeniesieniu ich do błony komórkowej i prezentowaniu limfocytom Tc, które po rozpoznaniu obcego antygenu zabijają komórkę prezentującą. Prezentacja ta dotyczy antygenów syntetyzowanych wewnątrz komórki prezentującej czyli tzw. antygenów endogennych, którymi są głównie antygeny wirusowe. Ponieważ cząsteczki MHC klasy I występują powszechnie w organizmie, prawie wszystkie komórki są zdolne do prezentacji połączonych z tymi cząsteczkami antygenów.
Białka syntetyzowane w komórce, przed połączeniem z cząsteczkami MHC klasy I w siateczce śródplazmatycznej, ulegają najpierw pocięciu na fragmenty. Proteoliza może zachodzić w cytoplazmie, ale też w samej siateczce śródplazmatycznej. Proteoliza w cytoplazmie odbywa się głównie z udziałem ubikwityny, która najpierw wiąże się z białkiem przeznaczonym do fragmentacji. Białka są modyfikowane przez przyłączenie do swych lizyn pojedynczych ubikwityn (monoubikwitynacja) lub rozgałęzionych wielołańcuchowych ubikwityn (poliubikwitynacja). Ubikwitynowane białka kierowane są następnie do proteasomu. Jest on kompleksem obejmującym nielizosomalne enzymy proteolityczne, który dokonuje cięcia białek na pojedyncze peptydy. Powstałe peptydy są transportowane następnie do siateczki śródplazmatycznej z udziałem specjalnego transportera, zbudowanego z dwóch białek TAP. Białka TAP transportują głównie peptydy o długości optymalnej do łączenia się z cząsteczkami MHC klasy I ok. 10 aminokwasów. Gdy dłuższe peptydy trafią do siateczki śródplazmatycznej, to są często z powrotem transportowane do cytoplazmy. W siateczce śródplazmatycznej odpowiedniej długości peptyd trafia do rowka cząsteczki MHC klasy I. Cząsteczka MHC wraz z fragmentem antygenu przechodzi przez aparat Golgiego, gdzie ulega glikolizacji, po czym trafia na powierzchnię komórki. Od tej pory MHC klasy I z peptydem może być rozpoznawany przez limfocyty Tc, na których powierzchni znajduje się cząsteczka CD8+. Jeśli prezentowany antygen okaże się obcy dla organizmu, komórka prezentująca go limfocytowi T CD8+ zostanie zabita.
Prezentacja z udziałem MHC klasy I ma istotne znaczenie w odporności przeciwko patogenom wewnątrzkomórkowym. Wynika to z faktu, że białka patogenów, które znajdują się w komórce, są ubikwitynowane i cięte na fragmenty tak samo, jak własne białka komórki. W ten sposób patogen nie może ukryć się we wnętrzu komórki w celu oszukania układu odpornościowego. Nie jest on wprawdzie osiągalny dla przeciwciał, ale limfocyty Tc są często wystarczająco silną bronią, powstrzymującą rozwój choroby. Ma to duże znaczenie w przypadku wirusów, gdyż często przestawiają one syntezę białek w komórce na swoje potrzeby.
U jednego osobnika występuje od 4 do 6 różnych cząsteczek MHC klasy I. Cząsteczki MHC klasy I występują na powierzchni wszystkich komórek jądrzastych, a w niewielkich ilościach również na erytrocytach.
Prezentacja antygenów z udziałem cząsteczek MHC klasy II.
Polega na prezentowaniu antygenów limfocytom Th, które nie wywołują śmierci komórki prezentującej antygen. W prezentacji tą droga uczestniczą głównie komórki dendrytyczne limfocyty B i makrofagi. Prezentacja ta dotyczy przede wszystkim antygenów pochłoniętych przez komórkę prezentującą, czyli tzw. antygenów egzogennych
Także w tym przypadku nie następuje prezentacja natywnych białek - muszą one najpierw ulec przeróbce. Pierwszym krokiem przeróbki antygenu jest endocytoza, która rozpoczyna się wiązaniem pochłanianych cząstek przez określone receptory błonowe. W wyniku pochłonięcia powstaje endosom zawierający antygen. Na skutek działania pomp protonowych w błonie endosomu następuje stopniowe obniżanie pH od 6,5-6 we wczesnych endosomach przez 5,5 w późnych endosomach do 5-4,5 w lizosomach. W endosomach dochodzi do odłączenia peptydu CLIP (fragmentu łańcucha In) od rowka cząsteczki MHC klasy II i przyłączenia do tej cząsteczki pochłoniętego przez komórkę i obecnego w endosomach peptydu (antygenu). W wymianie peptydu CLIP na antygen w rowku cząsteczki MHC klasy II uczestniczą u ludzi cząsteczki HLA-DM. Kompleksy powstałe z połączenia cząsteczki MHC i antygenu wędrują następnie do błony komórkowej i są prezentowane limfocytom Th, na których powierzchni znajduje się cząsteczka CD4+. Pobudzone limfocyty Th wydzielają cytokiny pobudzające komórkę prezentującą antygen do bardziej efektywnego aktywowania innych limfocytów T.
Głównym zadaniem prezentacji antygenu przez MHC klasy II jest rozwinięcie swoistej odpowiedzi odpornościowej.
APC - komórki prezentujące antygen, na których powierzchni znajdują się cząsteczki MHC klasy II.
Wyróżnia się dwa rodzaje APC:
Głównym zadaniem komórek prezentujących antygen jest pobudzenie swoistych antygenowo limfocytów Th, dzięki czemu może rozwinąć się swoista odpowiedź odpornościowa.
Komórki dendrytyczne
Charakteryzują się obecnością długich wypustek przypominających dendryty oraz wypustek blaszkowatych porównywanych do welonów. Są pochodzenia szpikowego. Droga ich wędrówki ze szpiku prowadzi przez krew do tkanek większości narządów (z wyjątkiem mózgu). Przedostają się nawet pomiędzy komórki wielu nabłonków. Z krwi dostają się również do grasicy i śledziony. W nabłonkach i w tkance łącznej większości narządów dochodzi do ich kontaktu z antygenami. Komórki dendrytyczne transportują następnie antygeny naczyniami limfatycznymi doprowadzającymi, aby je prezentować dziewiczym limfocytom T w węzłach limfatycznych albo krwią w celu prezentacji w śledzionie.
Komórki dendrytyczne obecne n narządach nielimfatycznych nabywają antygeny głównie przez receptory FcγRI, FcγRII, receptor dla mannozy oraz w drodze makropinocytozy. Po dodarciu do narządów limfatycznych zdolności komórek dendrytycznych do endocytozy, a szczególnie fagocytozy ulegają wyraźnemu zmniejszeniu. Mogą one natomiast przez długi okres bardzo efektywnie prezentować antygeny limfocytom T.
Do komórek dendrytycznych narządów nielimfatycznych należą:
Do komórek dendrytycznych narządów limfatycznych należą:
Limfocyty B
Jednym z głównych celów prezentacji antygenów limfocytom T jest pobudzenie ich do udzielenia pomocy limfocytom B w wytwarzaniu przeciwciał. Stąd zdolność limfocytów B do prezentacji antygenów jeszcze bardziej usprawnia odpowiedź immunologiczną. Limfocyty T i limfocyty B prezentujące antygen kontaktują się ze sobą w strefach narządów limfatycznych. W wyniku tego kontaktu limfocyty T wydzielają cytokiny, które wspomagają limfocyty B w produkcji immunoglobulin. Kontakt obu limfocytów poprzedzony jest proliferacją odpowiedniego klonu limfocytów T wywołaną dzięki prezentacji antygenu limfocytom T poprzez komórki splatające się. Tak więc w narządach limfatycznych antygen jest prezentowany limfocytom T zarówno przez limfocyty B jak i komórki splatające się.
Limfocyt B może pochłaniać antygeny na drodze pinocytozy oraz endocytozy adsorpcyjnej. W procesach tych biorą udział m.in. receptory dla fragmenty Fc przeciwciał, receptory dla składników dopełniacza, a także immunoglobuliny powierzchniowe. Dany limfocyt B najskuteczniej prezentuje antygeny, które są rozpoznawane przez jego immunoglobuliny powierzchniowe (BCR), a więc antygeny swoiste. W efekcie komórka ta jest zaangażowana głównie w prezentację „na własny użytek”, tzn. antygenów, przeciw którym po otrzymaniu pomocy ze strony limfocytów Th będzie wytwarzała przeciwciała. Limfocyt B pobudzony prezentuje antygeny ok. 10-krotnie sprawniej w porównaniu z limfocytem niepobudzonym, co związane jest ze zwiększoną ekspresja cząsteczek MHC klasy II i cząsteczek kostymulujących. Na antygeny prezentowane przez limfocyty B mogą odpowiadać tylko limfocyty T pamięci.
Makrofagi
W przeciwieństwie do komórek dendrytycznych i limfocytów B na ogół nie mają cząsteczek MHC klasy II, ale w trakcie aktywacji syntetyzują je pod wpływem interferonu gamma. Wyposażone są obficie w lizosomy, w związku z tym nastawione są na pełną degradację fagocytowanego materiału. Odgrywają ważną rolę w prezentacji antygenów pochodzących np. z dużych fagocytowanych cząstek lub bakterii, do czego nie są zdolne inne komórki prezentujące antygen. Podobnie jak limfocyty B zdolne są do pobudzenie limfocytów T pamięci.
-------------------------------------------------------------------------------------------------------------
Przekazywanie sygnałów między limfocytem T i komórką prezentującą nie jest jednokierunkowe. Limfocyt T oddziałuje bowiem na komórkę prezentującą:
IL-1 wpływa nie tylko na limfocyt T, ale autokrynowo wzmaga czynność samej komórki prezentującej antygen.
-------------------------------------------------------------------------------------------------------------
Celem prezentacji antygenu limfocytom T jest aktywacja tych komórek. W przypadku limfocytów Th aktywacja ta ma, w wyniku proliferacji i różnicowania, zainicjować przekształcenie ich w komórki, które poprzez wydzielane cytokiny będą wspomagać przekształcenie spoczynkowych limfocytów B i prekursorów limfocytów Tc w komórki efektorowe. Do aktywacji limfocytów T potrzebne jest również oddziaływanie cytokin oraz bezpośrednie oddziaływanie komórki prezentującej antygen poprzez szereg cząsteczek powierzchniowych obecnych na komórce prezentującej i łączących się z odpowiednimi cząsteczkami na limfocycie T.
32. Rodzaje szczepionek a typ odpowiedzi immunologicznej. Przeciwciała antyidiotypowe jako szczepionki.
Szczepionką nazywamy produkt pochodzenia biologicznego zawierający substancje zdolne do indukcji określonych procesów immunologicznych warunkujących powstanie trwałej odporności bez wywołania działań toksycznych.
Celem wykonywania szczepień jest wyeliminowanie drobnoustroju ze środowiska, w którym je człowiek i wytworzenie indywidualnej odporności.
W wyniku szczepienia dochodzi do aktywacji układu odpornościowego w podobny sposób jak w przypadku zakażenia. Następuje pobudzenie komórek układu , wytwarzanie cytokin i produkcja przeciwciał.
Najważniejsza role odgrywają tutaj komórki pamięci, które zapewniają szybką indukcję przeciwciał w kolejnych kontaktach z antygenem.
Odpornośc przeciw chorobom zakaźnym może powstac w wyniku
Zarówno odpornośc naturalna, jak i nabyta sztucznie mogą być wytworzone w sposób czynny( zakażenie, szczepienia) lub bierny ( przeniesienie przeciwciał przez łożysko, podanie immunoglobulin). W wyjątkowych sytuacjach stosuje się jeednoczesne podanie immunoglobulin ze szczepionką -jest to tzw uodpornienie czynno-bierne(np. tężec).
Dla większości opracowanych szczepionek znane są tak zwane zabezpieczające stężenia przeciwciał, czyli takie które chronią przed zakażeniem po kontakcie z przeciętna dawką zakażającą drobnoustroju. Zwiększenie dawki zakażającej lub upośledzenie czynności układu immunologicznego przez dodatkowe schorzenie, może mimo zabezpieczającego stężenia przeciwciał, doprowadzic do wystąpienia objawowego zakażenia.
Oprócz stężenia istotne jest: przynależnośc do podklasy, powinowactwo do antygenu, zdolnośc wiązania dopełniacza, obecnośc przeciwciał wydzielniczych klasy IgA w błonach śluzowych oraz prawidłowo funkcjonujące mechanizmy pamięci immunologicznej.
Rodzaje odpowiedzi poszczepiennych:
-powolny okres narastania immunoglobulin i krótki czas ich istnienia we krwi
-początkowo IgM i IgA ( 5-10 dni) zanikają szybko, a w ich miejsce pojawiają się przeciwciała klasy IgG, które dłużej utrzymują się w organizmie i mają właściwości ochronne
Szczepionki swoiste- indukcja trwałej i specyficznej odpowiedzi immunologicznej przeciw określonemu drognoustrojowi:
Szczepionki swoiste ( podział ze względu formę drobnoustroju)
Szczepionki nieswoiste: Działają na nieswoiste mechanizmy obronne, prowadząc do zwiększenia miana przeciwciał typu IgA w wydzielinach błon śluzowych , aktywności fagocytarnej i wytwarzania interferonu gamma. Mogą także stymulowac wytwarzanie swoistych przeciwciał przeciwko antygenom bakteryjnym wchodzącym w skład preparatu.
Szczepionki swoiste a odpowiedź immunologiczna:
Autoszczepionki- są to zawiesiny inaktywowanych drobnoustrojów przygotowane na podstawie wyizolowanej od chorego flory bakteryjnej.
Szczepionki antyidiotypowe
Konstrukcja tego typu szczepionek polega na wykorzystaniu przeciwciał monoklonalnych do wytworzenia przeciwciał antyidiotypowych o potwierdzonym działaniu ochronnym. Jeśli zostanie dobrany idiotyp, to swoiste przeciwciało antyidiotypowe zastępuje naturalny antygen i stymuluje powstanie odpowiedzi immunologicznej. Strategia ta jest wykorzystywana do produkcji szczepionek przeciw antygenom, które nie są dostępne na powierzchni komórki, na przykład przeciw endotoksynom uwalnianym z komórek już po zakażeniu, lub antygenom, które nie są dostatecznie immunogenne ( polisacharydy otoczkowe)
Plusy:
Ograniczeniem zaś jest mała immunogennośc idiotypów oraz trudnośc w zidentyfikowaniu właściwego przeciwciała antyidiotypwego na skutek heterogenności.
U ludzi szczepionki antyidiotypowe próbuje się na razie stosowac tylko w odniesieniu do antygenów nowotworowych.
33. Współczesne koncepcje ma temat powstawania nowotworów, udział genów supresorowych i onkogenów w powstawaniu nowotworu.
Proces powstawania nowotworu jest po pierwsze wieloetapowy, po drugie zazwyczaj długotrwały (mamy tu do czynienia z tzw. czasem utajenia, kiedy to nowotwór rozwija się
w sposób niedostrzegalny).
Układ immunologiczny działa, lecz zupełnie sobie nie radzi ze zmianami nowotworowymi. Produkowane są cytokiny supresyjne (hamujące odpowiedź immunologiczna).
W procesie nowotworzenia uczestniczą rozmaite geny:
Proces nowotworzenia może być regulowany na dwa sposoby: stymulujący lub hamujący namnażanie i wzrost. Aby powstał nowotwór, muszą zajść mutacje, które spowodują wzmożoną aktywność genów stymulujących namnażanie komórek lub takie, które zdezaktywują geny hamujące ich wzrost. Geny odpowiedzialne za prawidłowy wzrost komórek to protoonkogeny, kodujące białka regulujące proliferację i różnicowanie się komórek. Protoonkogeny po zajściu mutacji stają się onkogenami. Produkt onkogenu pozostaje stale w aktywnej formie, prowadząc do niekontrolowanej proliferacji, której konsekwencją jest transformacja nowotworowa. Do najlepiej poznanych onkogenów zalicza się :
Dla komórki, działanie genów supresorowych ma znaczenie przy przechodzeniu komórki przez poszczególne fazy cyklu komórkowego. Geny te są bezpośrednio zaangażowane
w proces cyklu komórkowego. Ich produkty działają hamująco na odpowiednich etapach cyklu komórkowego i mają za zadanie naprawiać wszystkie uszkodzenia i zmiany zachodzące na poziomie DNA lub jeśli to nie jest możliwe to skierować komórkę na drogę apoptozy.
W przypadku mutacji tych genów nieprawidłowe działanie ich produktów powoduje intensywne namnażane się komórek zmutowanych.
Gen kodujący białko Rb zlokalizowany jest na 13 chromosomie. Białko kodowane przez gen Rb odpowiedzialne jest za prawidłowy przebieg cyklu komórkowego. Jest ono produkowane w jądrze komórkowym i odpowiada ono za hamowanie replikacji DNA
w komórce. Natomiast mutacje genu Rb powoduje, że wynikiem jego ekspresji jest białko nieaktywne, w związku z czym nie wstrzymuje ono namnażania materiału genetycznego
i podziałów komórkowych. Przyczyną mutacji genu Rb jest retinoblastoma ( schorzenie układu wzrokowego ) u dzieci.
Gen p53 zlokalizowany jest w chromosomie 17 i koduje białko p53, które
w warunkach normalnych obecne jest w organizmie w śladowych ilościach. Jeśli dochodzi do zniszczenia DNA następuje produkcja dużej ilości białka p53, które wywołuje zjawisko apoptozy w komórkach z uszkodzonym materiałem genetycznym. W przypadku mutacji genu p53, powstałe w wyniku jego ekspresji białko nie ma zdolności niszczenia komórek
o uszkodzonym DNA. W takiej sytuacji dochodzi do namnażania się nieprawidłowych komórek o zniszczonym materiale genetycznym. Prawidłowe białko p53 - dzika forma ma lokalizację cytoplazmatyczna a jej okres półtrwania wynosi 20min. Wykrywana jest przez przeciwciała monoklonalne. W przypadku zmutowanego genu powstaje stabilna forma, która jest wykrywana w jądrze. Aż w 80% procentach nadekspresji tego białka mamy do czynienia z mutacją.
W powstawaniu procesu nowotworowego mają udział różne czynniki zewnętrzne
i wewnętrzne, tak zwane czynniki ryzyka. Wśród czynników ryzyka można wyodrębnić takie grupy czynników jak: chemiczne, fizyczne, biologiczne, dziedziczne, immunologiczne. Infekcje bakteryjne i wirusowe należą do biologicznych czynników ryzyka powstawania nowotworów. Wśród wirusów powodujących powstawanie nowotworów u człowieka należy wymienić:
- wirus Epsteina - Barr związany z częstszym występowaniem chłoniaka Burkitta i raka jamy nosowo-gardłowej,
- wirusy Herpes Simplex (Herpes Simplex Virus, HSV-2) i wirusy Papilloma zwiększające ryzyko zachorowania na raka szyjki macicy,
- wirusy Hepatitis B i Hepatitis C wpływające na patogenezę nowotworów wątroby,
- wirus T-limfocytotropowy związany z patogenezą białaczki wywodzącą się z limfocytów T ludzi dorosłych.
Jeśli wykryje się u pacjenta wirus HPV należy od razu sprawdzić poziom białka p53, gdyż ok. 90% pacjentów z tym wirusem ma wyłączone niektóre funkcje kierowane przez p53. Jest to o tyle niebezpieczne, że w początkowym etapie przebiega to bezobjawowo.
W przypadku zakażenia wirusem HPV często występuje ekspresja białek E6, E7, które łączą się z p53 dając tetramer, który jest formą stabilną. Aby móc skutecznie eliminować czynniki biologiczne (zakażenie bakteryjne i wirusowe), które są przyczyną powstawania nowotworów, ważne jest wczesne wykrycie zakażenia danym drobnoustrojem. Pozwala to wybrać właściwy sposób leczenia i może zmniejszyć lub całkowicie wyeliminować ryzyko rozwoju nowotworu. Osoby po przeszczepie na przestrzeni 3 lat są narażone w dużym stopniu na mutacje i powstanie nowotworu.
34. Rola wirusów w karcynogenezie
Karcynogeneza też kancerogeneza, czyli powstawanie nowotworu. Jest to wieloetapowy proces zachodzący na poziomie DNA komórki, a prowadzący do rozwoju nowotworu.
Patogeniczność drobnoustroju jest czynnikiem warunkującym zapoczątkowanie procesu chorobotwórczego. W zależności od stopnia zjadliwości, drobnoustrój jest w stanie zainicjować określony rodzaj, czy stopień złożoności danej choroby. Zasięg i natężenie schorzeń wywołanych zakażeniem drobnoustrojami może być nieznaczne i niezauważalne, ale może także okazać się wyjątkowo ciężkie w leczeniu i prowadzić do drastycznych następstw, jakim jest na przykład rozwój nowotworu, który należy do najcięższych, najtrudniej uleczalnych i najbardziej zagrażających życiu człowieka chorób. Wszelkie czynniki i sytuacje, które powodują zwiększenie prawdopodobieństwa zachorowania na nowotwór u człowieka należą do tzw. czynników ryzyka i są to: czynniki chemiczne, fizyczne, biologiczne, dziedziczne, oraz immunologiczne.
Ważną grupą czynników ryzyka powstawania nowotworów są czynniki biologiczne, wśród których wyróżniamy infekcje wirusowe.
Wśród wirusów powodujących powstawanie nowotworów u człowieka należy wymienić: wirus Epsteina - Barr związany z częstszym występowaniem chłoniaka Burkitta i raka jamy nosowo-gardłowej, wirusy Herpes Simplex (Herpes Simplex Virus, HSV-2), wirusy Papilloma zwiększające ryzyko zachorowania na raka szyjki macicy, wirus Hepatitis B i Hepatitis C wpływające na patogenezę nowotworów wątroby, oraz ludzki wirus T-limfocytotropowy związany z patogenezą białaczki wywodzącą się z limfocytów T ludzi dorosłych.
Wirusy te mogą brać czynny udział w procesie powstawania nowotworów poprzez:
Ostatecznie we wszystkich tych przypadkach powodują niekontrolowaną proliferację komórek i rozwój nowotworu.
35. Możliwości immunodiagnostyczne w procesie nowotworowym
Podstawowymi korzyściami badań laboratoryjnych w diagnostyce nowotworów jest ich niska inwazyjność i niewielkie obciążenie dla chorego oraz możliwość wielokrotnego powtarzania badań. Wykrycie niektórych specyficznych substancji (np. białka monoklonalnego) może pomóc ukierunkować dalszą diagnostykę.
Badania morfologiczne krwi stanowią prosty. Ale niezastąpiony element diagnozowania nowotworów hematologicznych. Współczesne techniki laboratoryjne umożliwiają wykrycie obecności we krwi, moczu i tkankach markerów nowotworowych. Są to najczęściej antygeny nowotworowe lub produkty przemiany materii nowotworu. Stwierdzenie ich podwyższonego stężenia w płynach ustrojowych, szczególnie we krwi, pozwala w wybranych nowotworach istotnie przybliżyć ostateczne rozpoznanie choroby nowotworowej. Do najczęściej poszukiwanych markerów należą; specyficzny antygen dla gruczołu krokowego (PSA), antygen rako-płodowy (CEA), alfa-1 proteina (AFP) i inne rozmaite antygeny rakowe.
Przeciwciała monoklonalne przeciwko antygenom związanym z określonym stadium różnicowania komórki są czasami stosowane w celu oznaczania pochodzenia nowotworu i etapu różnicowania komórki zdrowej, z której się on wywodzi. Informacje te pozwalają określić skuteczną terapię. Za pomocą przeciwciał monoklonalnych można zdefiniować wiele markerów związanych Z komórkami linii limfoidalnej i mieloidalnych oraz ich różnymi stadiami różnicowania.
METODY IMMUNODIAGNOSTYCZNE:
1.Reakcje immunofluorescencji - stosuje się przeciwciała monoklonalne, które wykazują dużą swoistość w stosunku do określonych antygenów i epitopów.
Znakowane fluorochromem przeciwciała przeciwko antygenom nowotworowym są bardzo użyteczne w badaniu wycinków tkanek Czy komórek wykazujących ekspresje antygenu. Test ten wykonuje się inkubując próbki tkanki ze znakowanymi przeciwciałami (bezpośrednia immunofluorescencja) lub za pomocą pośredniej immunofluorescencji. Ocenę preparatów dokonuje się za pomocą mikroskopu fluorescencyjnego. Jeśli wynik próby jest pozytywny to w polu widzenia obserwujemy świecące plamki(kompleks przeciwciała z antygenem nowotworowym)
Przy interpretacji wyników ważne jest nasilenie antygenu, ile go jest. Trzeba to przechowywać w lodówce i szybko odczytać
(-) - brak antygenu (+) (+)(+) (+)(+)(+ )- najwyższa koncentracja ag
2. Testy immunoenzymatyczne - testy ELISA..Testy te pozwalają ocenić różne typy antygenów, a także stężenie i izotopy przeciwciał swoistych dla określonego antygenu.
Test ABC (awidyna- biotyna) -> lokalizacja antygeny jądrowe
Enzymy
3. Immunoblotting- technikę ta stosuje się do badania obecności cząsteczek w zawiesinie. Technika Western blot wymaga rozdzielenia cząsteczek za pomocą elektroforezy na żelu z siarczanem dodecylu sodu, przeniesienia ich na błonę i analizy cząsteczek z w/w testów ELISA i RIA. Test ten jest często stosowany do potwierdzenia w surowicy pacjentów przeciwciała przeciwko czynnikom zakaźnym (np. wirus HIV).
4. Radioimmunodiagnostyka
Metoda ta opiera się na zastosowaniu przeciwciał monoklonalnych znakowanych izotopem, np. jod-125. Pozwala to na bardzo wysoka dokładność pomiaru, otrzymuje się dużą czułość oznaczenia, nieosiągalna innymi metodami. Biochemiczne markery nowotworowe maja zastosowanie:
Sondy genetyczne - do DNA/RNA patogenu.
Hybrydyzacja in situ. Jest bardzo czuła i specyficzna, pozwala na wykrycie kilku komórek. Sonda genetyczna wbudowuje się w DNA/RNA i do tego przyłącza się przeciwciało monoklonalne sprzężone ze znacznikiem i oglądamy w mikroskopie świetlnym.
Metody te służą do diagnozowania, 1.kiedy lekarze w obrazie klinicznym nic nie widzą, a pojawiają się płyny wysiękowe, 2.można ustawić celowaną immunoterapie, 3.monitorować przebieg choroby, 4ryzyko nawrotu choroby nowotworowej
Możliwości wykrywania infekcji wirusowych - musi być infekcja, wbudowanie do RNA/DNA lub ekspresja białek kodowanych przez gen. Pacjenci z infekcją wirusową i nowotworem maja mniejsze rokowania na leczenie
36. Zastosowanie immunocytodiagnostyki w leczeniu i prognozowaniu procesu nowotworowego oraz w chorobach o podłożu autoimmunologicznym.
W immunodiagnostyce nowotworów wykorzystuje się substancje uwalniane do krwi lub innych płynów ustrojowych przez nowotwór (swoiste antygeny nowotworowe TSAs) oraz związane z obecnością nowotworu (TAAs) w stężeniach niespotykanych u osób zdrowych. Chociaż są antygenami, nie zawsze wywołują odpowiedź immunologiczną gospodarza. Nowotwory złośliwe u ludzi są słabo immunogenne. Ekspresja niektórych antygenów jest większa w przypadku poszczególnych nowotworów, bywają jednak wspólne dla raków różnych typów. Użyteczne w diagnostyce są te uwalniane do krwi, charakteryzujące się wysoką czułością (liczba pozytywnych wyników do rzeczywistej choroby) i swoistością (liczba negatywnych wyników, gdy brak choroby).
Do metod immunocytodiagnostyki zaliczamy immunocytochemię - jest to technika badawcza, której celem jest ujawnienie swoistych antygenów w komórkach i tkankach na zasadzie wywoływania reakcji antygen-przeciwciało i uwidocznienie tego zjawiska w preparatach mikroskopowych.
Badania immunocytochemiczne przeprowadza się w celu:
Duża liczba monoklonalnych przeciwciał przeciwko antygenom serii CD umożliwia identyfikację i klasyfikację nowotworów układu hematopoetycznego i chłonnego.
Ocena obecności markerów biologicznych o znaczeniu prognostycznym lub predykcyjnym np. onkoprotein (c-erbB-2), produktów zmutowanych genów supresorowych (p53) lub obecności receptorów estrogenów i progesteronu.
Choroby autoimmunizacyjne są to choroby przewlekłe, w których reakcja immunologiczna skierowana jest przeciwko własnym antygenom szeroko rozpowszechnionym w wielu tkankach i narządach ustroju. Ze względu na reakcję immunologiczną skierowaną przeciwko autoantygenom rozpowszechnionym w ustroju obserwujemy zmiany w wielu narządach, najczęściej w stawach, skórze, mięśniach, nerkach, błonach surowiczych, płucach, sercu, rzadziej w przewodzie pokarmowym i w układzie nerwowym.
Immunodiagnostyka tych chorób jest zwykle związana z obecnością autoprzeciwciał przeciwko autoantygenom danego narządu. Często są to hormony lub ich receptory ale także enzymy i inne białka.
Oznaczanie stężenie immunoglobulin w surowicy - często występuje hypergammaglobulinemia, IgG, zaś materiał do badań stanowi krew pobrana „na skrzep” w ilości ok. 5ml. Badanie ilościowe IgG można wykonać za pomocą turbidymetrii.
Oznaczenie autoprzeciwciał w surowicy krwi - jest to najważniejsze badanie dodatkowe w diagnostyce chorób autoimmunizacyjnych, w których dominuje odpowiedź humoralna z wytworzeniem autoprzeciwciał (przeciw własnym antygenom).
Oznaczanie większości autoprzeciwciał (zwłaszcza przeciwjądrowych) ze względu na dużą różnorodność powinno być wykonywane wg następującego schematu:
1. badanie wstępne „skryningowe” - metodą immunofluorescencji pośredniej - jakościowa ocena pozwalająca na stwierdzenie obecności autoprzeciwciał
i zaszeregowanie do określonego rodzaju,
2. badanie potwierdzające obecność określonego przeciwciała - metodą blotową lub metodą ELISA - jakościowa ocena pozwalająca określić swoistość autoprzeciwciała,
3. badanie ilościowe - metodą ELISA; ilościowa ocena badanego autoprzeciwciała.
Nie w każdym przypadku wymagane jest badanie stężenia autoprzeciwciał, czasem wystarczy jedynie określenie ich rodzaju, badanie ilościowe ważne jest np. w monitorowaniu tocznia układowego (autoprzeciwciała anty-dsDNA) lub ziarniniaka Wegenera (autoprzeciwciała ANCA).
37. Odpowiedź immunologiczna na antygeny związane z nowotworem.
Większość antygenów nowotworowych powstających spontanicznie nie ma charakteru antygenów swoistych i występuje też na niektórych komórkach prawidłowych, stąd nazwa antygeny związane z nowotworem (TAA - tumor associated antigens)
Antygeny związane z nowotworem dzielimy na:
Można zaobserwować dobre wyniki terapii niektórych chłoniaków z użyciem przeciwciał monoklonalnych połączonych z radioizotopami i skierowanych przeciw antygenom obecnym na komórkach chłoniaka i prawidłowych limfocytach B, które tłumaczy się tym, że przeciwciała te umiejscawiają się na obydwu typach komórek. Nawet jeśli komórka chłoniaka otoczona jest przez prawidłowe limfocyty B, to jest skutecznie niszczona przez krzyżowe promieniowanie pochodzące z radioizotopów połączonych z przeciwciałami związanymi z limfocytami.
Antygeny nowotworowe rozpoznawane są przez limfocyty T albo przez przeciwciała, rzadziej przez limfocyty i p/c jednocześnie, np. antygeny CEA, MAGE.
Antygeny rozpoznawane przez limfocyty T są prezentowane przez cząsteczki MHC klasy I i II
Przykłady antygenów rozpoznawanych przez przeciwciała:
Antygeny nowotworowe wykorzystuje się do szczepionek w immunoterapii nowotworów np. szczepienie samymi antygenami, szczepienie antygenami podawanymi z adiuwantami i cytokinami, szczepienie komórkami dendrytycznymi „nakarmionymi” antygenami nowotworowymi.
Obronne mechanizmy immunologiczne wkraczają do akcji z chwilą powstania komórek nowotworowych, czyli na etapie późnym, kiedy zawiodły inne naturalne mechanizmy antykancerogenne( tzn. przed działaniem rodników tlenowych i utlenowanych przez nie związków chronią nas witaminy C i E, glutation i enzymy: katalaza, dysmutaza ponadtlenkowa, peroksydaza glutationowa. )
Odpowiedź przeciwnowotworowa obejmuje wytwarzanie przeciwciał i mechanizmy komórkowe. Do najważniejszych mechanizmów immunologicznych przeciwstawiających się rozwojowi nowotworu należą:
Bardo ważne w odpowiedzi komórkowej przeciwnowotworowej są swoiste limfocyty Th. Rozpoznają one TAA prezentowane im w połączeniu z cząsteczkami MHC klasy II. W wyniku następującej aktywacji limfocyty Th wydzielają cytokiny, które wspomagają lub aktywują kolejne komórki układu odpornościowego albo bezpośrednio niszczą komórki nowotworowe.
Cytokiny:
IFN-γ jest najważniejszą cytokiną aktywującą makrofagi. Pobudzone makrofagi mogą zabijać lub hamować proliferację komórek nowotworowych w wyniku kontaktu bezpośredniego lub poprzez wydzielane cytokiny, np. TNF lub IL-1
Cytokiny wydzielane przez makrofagi:
Kilkakrotnie więcej makrofagów jest w nowotworach litych ulegających regresji niż w nowotworach rozwijających się progresywnie. Makrofagi mogą zabijać komórki nowotworowe, ale też mogą wydzielać czynniki wzrostowe dla niektórych z nich, np. EGF i PDGF, a także czynniki przyspieszające tworzenie się naczyń w obrębie nowotworu. Makrofagi są źródłem czynników hamujących reaktywność immunologiczną, np. prostaglandyn i TGF-β.
Komórki nowotworowe mogą też wydzielać czynniki chemotaktyczne dla monocytów i makrofagów, np. MCP-1 i przyspieszające powstawanie tych komórek i aktywujące je, np. M-CSF, GM-CSF, a także czynniki hamujące chemotaksję.
Niektóre cytokiny wydzielane przez limfocyty Th stymulują reakcję fibroblastyczną wokół nowotworu, co może na drodze nieimmunologicznej hamować jego rozwój, odgradzając go od otaczających tkanek.
Odpowiedź typu humoralnego też może prowadzić do zabicia komórek nowotworowych. Dochodzi do tego po związaniu odpowiedniego przeciwciała z TAA na komórce nowotworowej i aktywacji dopełniacza albo przyłączenia komórki K mającej receptor dla fragmentu Fc przeciwciał i zdolnej do ADCC.
Czasem przeciwciała mogą ułatwić wzrost nowotworu, jest to tzw. ułatwienie immunologiczne. Jest to „wypaczona” reaktywność immunologiczna obserwowana w organizmie z rozwijającym się nowotworem.
38. Supresja odpowiedzi immunologicznej, kontrasupresja, mechanizmy odporności przeciwnowotworowej.
SUPRESJA ODPOWIEDZI IMMUNOLOGICZNEJ
Zadaniem supresji jest wyciszenie odpowiedzi na antygeny gdyż nadmierna mobilność komórek mogła by się skończyć tragicznie. Supresja skierowana jest głównie na antygeny pokarmowe, autoantygeny, antygeny bakterii saprofitycznych. Oto przykłady komórek posiadających takie zdolności :
1) Th1 - Th2
W przypadku choroby autoimmunizacyjnej występuje odpowiedz komórkowa indukowana przez Th1. Nadmierna aktywność Th1 jest znoszona przez Th2 co prowadzi do hamowania limfocytów autoreaktywnych, odpowiedz komórkowa zostaje wyciszona.
2) Tr1 i Th3
Hamują odpowiedz immunologiczną poprzez działanie na komórki prezentujące antygen (APC). Zmniejszają ich zdolność aktywacji i stymulacji LiT oraz limfocytów dziewiczych dzięki czemu zostaje zahamowana ich proliferacja. Efekty te są możliwe dzięki wydzielaniu IL-1 przez Tr1 oraz TGF-β przez Th3.
4) Limfocyty T CD4+ CD25+
Działanie związane jest z kontaktem bezpośrednim. Aktywacja tych komórek wymaga swoistego antygenu dla TCR. Aktywowane działają antygenowo nieswoiście rozwijając odpowiedz na wiele komórek autoimmunogennych. W działaniu przypominają komórki w stanie anergii: hamują proliferacje i wydzielanie cytokin przez komórki CD8+ i CD4+ , wydzielają IL-10 (tak jak Tr1), wykazują osłabioną zdolność proliferacji.
5)Limfocyty T CD8+ z receptorem TCRγδ
Występują na błonach śluzowych. Indukują proces tolerancji antygenów jednak tylko tych w nienaruszonym stanie np. przez trawienie. Więc podczas podania do ustnego nie działają. Podane donosowo aktywują proces tolerancji antygenów np. podanie donosowe insuliny.
6) NKT
Rozpoznają ligandy glikoproteinowe prezentowane przez APC , zapewniając ich tolerancje i hamują limfocyty diabetyczne . Myszy bez NKT zapadają na ostrą postać cukrzycy. Limfocyty te produkuja wiele cytokin: IL-4,10,13 , TGF-β.
7) NK2
Nie wiadomo co je aktywuje i jaki jest ich mechanizm działania :] . Mają wpływ na podtrzymanie remisji stawardnienia rozsianego wyciszając proces zapalny.
KONTRASUPRESJA jest słabo poznanym mechanizmem hamującym supresję. Udział w niej mają limfocyty Tcs. Funkcją limfocytów kontrasupresorowych Tcs jest zapewnienie przebiegu odpowiedzi immunologicznej przy nadmiarze komórek Ts, szczególnie w przypadku wtórnej odpowiedzi. Kontrasupresja jest immunoregulatorem aktywności pomocniczych limfocytów Th, głównie w niwelowaniu sygnałów komórek supresorowych.
MECHANIZMY ODPORNOŚCI PRZECIWNOWOTWOROWEJ
Odpowiedź przeciwnowotworowa angażuje wszystkie typy reakcji immunologicznej ustroju. Obejmuje:
Większość antygenów nowotworowych nie jest swoista dla nowotworów i występuje też na prawidłowych tkankach ustroju, z czym m.in. może się wiązać mała immunogenność nowotworów. Nowotwory są mało immunogenne, ponieważ wykazują zdolność do maskowania antygenu. Ze względu na małą immunogenność nowotworów uważa się, że w odporności przeciwnowotworowej większą rolę odgrywają raczej naturalne, mało swoiste mechanizmy odporności niż mechanizmy swoiste
Odpowiedź komórkowa
Bardzo ważnym elementem komórkowej odpowiedzi przeciwnowotworowej są swoiste limfocyty Th, zdolne do rozpoznania TAA (antygenów związanych z nowotworem) prezentowanych im w połączeniu z cząsteczkami MHC klasy II. Powoduje to aktywację limfocytów Th i wydzielanie cytokin, które wspomagają/aktywują kolejne komórki układu immunologicznego albo niszczą komórki nowotworowe bezpośrednio:
INF- γ potężnie aktywuje makrofagi- mogą one zabijać/ hamować proliferację komórek nowotworowych (przez kontakt bezpośredni/ wydzielanie cytokin).
Wydzielane cytokiny aktywują limf. Tc, komórki NK.
Wydzielane chemokiny powodują chemotaksję komórek (takich jak neutrofile/monocyty/limfocyty) i zwiększać naciekanie przez nie nowotworu. Niektóre z nich hamują powstawanie naczyń wewnątrz nowotworu (MIG, PF4, IP10).
Odpowiedź humoralna
Odpowiedź typu humoralnego również może prowadzić do zabicia komórek nowotworowych. Dochodzi do tego po związaniu odpowiedniego przeciwciała z TAA na komórce nowotworowej i aktywacji dopełniacza/ przyłączenia komórki K mającej receptor dla fragmentu Fc przeciwciał i zdolnej to ADCC (cytotoksyczności komórkowej zależnej od przeciwciał).
UWAGA!
IMMUNOTERAPIA NOWOTWORÓW:
IMMUNOTERAPIA SWOISTA
a.) „Szczepionki” przeciwnowotworowe- podaje się komórki nowotworowe/ich antygeny w połączeniu z adiuwantami (BCG, związki glinu) lub cytokinami. Są skuteczne w leczeniu nowotworów względnie immunogennych (np. czerniak)
Testuje się również podawanie odpowiednio spreparowanych komórek dendrytycznych, przeciwciał antyidiotypowych, bądź wykorzystanie metod inżynierii genetycznej (wprowadzenie do komórek nowotworowych genów dla cytokin, dla cząsteczki B7.1 oraz wprowadzanie genów dla antygenów nowotworowych do wirusa krowianki).
b.) Immunoterapia przeciwciałami (monoklonalnymi modyfikowanymi pod kątem zastosowania immunoterapeutycznego)
c.) Immunoterapia adoptywna- wykorzystanie komórek TIL (limf. naciekających guz), pobrane od pacjentów z nowotworem i namnażane w hodowlach, reagują swoiście z komórkami nowotworowymi. Problemem jest fakt, że większość komórek nowotworowych wykazuje bardzo słabą lub brak immunogenności. Ponadto niewiele TIL trafia do guza po ich podaniu choremu.
IMMUNOTERAPIA NIESWOISTA
Badania w tym kierunku zostały prowadzone po zaobserwowaniu zaniku guza wskutek ostrego zakażenia bakteryjnego. A oto główne kierunki owej terapii:
1) Cytokiny
Znalazły zastosowanie dzięki regulacji ważnych procesów układu odpornościowego: proliferacji, różnicowania, ruchliwości. Co czyni z nich ważne meiatory procesu zapalnego.
Główne cechy w terapii nowotworów to :
Stosowane cytokiny w leczeniu nowotworów:
Skuteczny w terapii białaczki włochatokomórkowej. Podaje się też jako uzupełnienie terapii konwencjonalnej w przypadku: mięsaka Kaposiego, czerniaka nerki. Cytokina ta daje lepsze efekty niż chemioterapeutyki. Dobry efekt zawdzięczamy bezpośredniemu efektowi na układ immunologiczny:
Stosowana z komórkami LAK które potrafi aktywować. Głównie używana do uzupełnienia terapii konwencjonalnej np. czerniaka. Po jej zastosowaniu występuje bielactwo (albinizm) co świadczy o wykształceniu swoistej odpowiedzi na melanocyty.
Do stosowania zniechęcają liczne skutki uboczne. Optymistyczne są próby łączenia z INF-γ do leczenia nowotworów kończyn trudnych do leczenia operacyjnego. TNF-α stosuje się także do leczenia nowotworów rozsianych w jamie opłucnej i otrzewnej.
2) Inne preparaty
Wychodząc z założenia że mechanizmy odpornościowe u chorych z zaawansowanym stadium są osłabione , szukano alternatywnej drogi pobudzenia tego układu testując preparaty pochodzenia bakteryjnego, roślinnego, syntetycznego. Z pośród nich 2 zasługują na uwagę:
Stosowana w postaci wlewów do pęcherza moczowego zmniejszają ryzyko pooperacyjnych nawrotów.
Stosowana w częstszych przypadkach raka okrężnicy po resekcji guza obniża ryzyko nawrotów. Syntetyczny lek ma działanie immunostymulujące wpływa na odpowiedz: LiT, neutrofili, makrofagów, wzmaga chemotaksję, adhezję, fagocytozę.
3) Aktywowane komórki limfoidalne LAK i monocyty
Podawanie IL-2 w postaci wlewów dożylnych. Następnie w procesie leukaferazy odzyskiwanie limfocytów z krwi i hodowla ich podając IL-2. Tak stymulowane komórki podawano z powrotem. Efekt był niezadowalający , mały efekt uzyskano w leczeniu czerniaka, raka nerki i wątroby.(LAK- komórki cytotoksyczne aktywowane przez limfokiny będące subpopulacją komórek NK)
Potrafią wywołać bardzo silny efekt cytotoksyczny nieswoiście. Monocyty izolowano z krwi i hodowano in vitro w obecności czynnika zrostu GM-CSF . Aktywowano je za pomocą rekombinowanego INF-γ najsilniejszego aktywatora makrofagów. Podanie miejscowe makrofagów wywołuje pewien efekt w leczeniu regionalnym nowotw
39. Mechanizmy immunologiczne ułatwiające rozwój nowotworu
U chorych na nowotwór obserwuje się osłabienie reaktywności immunologicznej, szczególnie typu komórkowego. Ponadto pewne procesy immunologiczne obserwowane u tych chorych nie tylko nie działają p/nowotworowo, ale mogą nawet sprzyjać rozwojowi nowotworu. Zaliczamy do nich następujące :
Niektóre z tych procesów interferują z p/nowotworowymi mechanizmami efektorowymi odpowiedzi immunologicznej. Są wśród nich jednak i takie, które wręcz stymulują wzrost nowotworu.
Za udziałem immunoselekcji w rozprzestrzenianiu się nowotworu pzremawiają pośrednio wyniki badań wskazujące na różnice antygenowe między nowotworem pierwotnym a jego przerzutami.
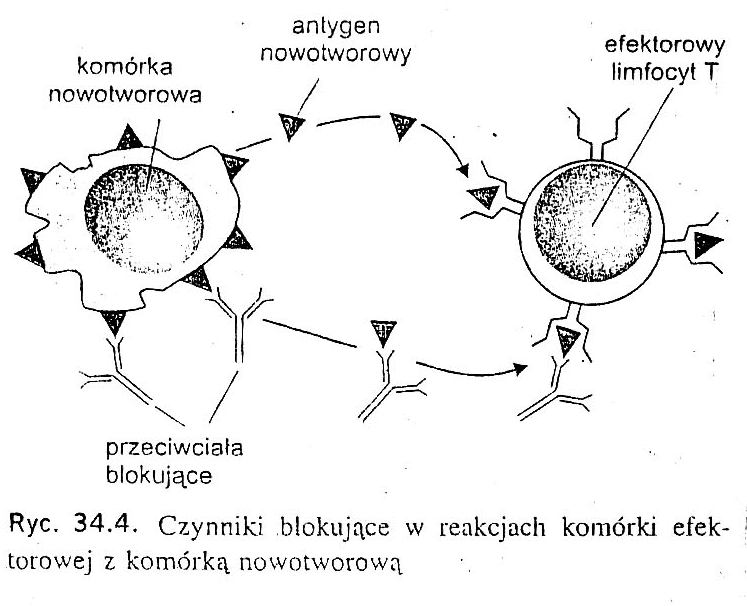
Część zjawisk immunologicznych sprzyjających rozwojowi nowotworu określa się mianem ułatwienia immunologicznego.
Ułatwienie immunologiczne polega na przyspieszonym wzroście nowotworu, obserwowanym czasami u zwierząt swoiście uczulonych przeciw komórkom tego nowotworu. Ma ono prawdopodobnie bardzo istotne znaczenie dla rozwoju choroby nowotworowej. Należy jednak pamiętać, że ułatwienie immunologiczne opisano, badając nowotwory u zwierząt doświadczalnych i nie wiadomo, w jakim stopniu wnioski z tych obserwacji odnoszą się do nowotworów powstających spontanicznie, szczególnie do nowotworów człowieka.
Punktem wyjścia wielu badań dotyczących ułatwienia immunologicznego były obserwacje, które wykazały, że surowice od osobników z rozwijającym się nowotworem są zdolne do blokowania in vitro cytotoksyczności swoistych limfocytów T wobec komórek nowotworowych, a podane zwierzęciu z nowotworem ułatwiają (przyspieszają) wzrost guza. Czynniki odpowiedzialne za ułatwienie immunologiczne nazwano wtedy czynnikami blokującymi.
Ułatwienie immunologiczne obejmuje wiele różnych mechanizmów. Większość z nich ma charakter swoisty, to znaczy, że interferują one z reaktywnością immunologiczną tylko w stosunku do określonego nowotworu. Choć mechanizm tego zjawiska nadal nie został do końca wyjaśniony, przypuszcza się, że występuje ono zarówno u osobników z rozwijającym się nowotworem, jak i w mniejszym stopniu u biorców przeszczepów allogenicznych. Ponadto, podobne zjawisko uczestniczy prawdopodobnie w ochronie płodu przed odpowiedzią immunologiczną matki w okresie ciąży.
Wśród czynników inicjujących proces ułatwienia immunologicznego wymienia się :
Ponieważ wymienione czynniki i mechanizmy uczestniczą również w takich zjawiskach, jak tolerancja immunologiczna indukowana w życiu noworodkowym, a także tolerancja transplantacyjna, brak obecnie podstaw, by traktować tolerancję immunologiczną i ułatwienie immunologiczne jako dwa całkowicie różne procesy.
Większość komórek uwalnia do środowiska antygeny związane z ich błonami komórkowymi. Antygeny związane z nowotworem także są uwalniane do środowiska, podobnie jak fragmenty błon komórek nowotworowych, co może być szczególnie nasilone w nowotworach z dużą skłonnością do zmian martwiczych. Rola wolnych antygenów nowotworowych i fragmentów błon komórek nowotworowych może polegać na blokowaniu limfocytów efektorowych odpowiedzi immunologicznej(ryc.34.4).
Wykazano, że swoiste cytotoksyczne limfocyty T tracą zdolność zabijania komórek nowotworowych, gdy w środowisku obecne są wolne antygeny nowotworowe albo fragmenty błon komórek nowotworowych, gdy w środowisku obecne są wolne antygeny nowotworowe albo fragmenty błon komórek nowotworowych. Wolne antygeny nowotworowe podane myszom z rozwijającym się nowotworem przyspieszały wzrost guza i ułatwiały tworzenie się przerzutów. W obserwacjach klinicznych wydawało się, że stężenie uwalnianego przez komórki neuroblastoma gangliozydu GD2 koreluje z przyspieszonym wzrostem nowotworu i skróconym czasem przeżycia chorych. Intensywność uwalniania TAA przez komórki nowotworowe może korelować pozytywnie ze złośliwością nowotworu.
Brak efektywnej odpowiedzi na antygeny nowotworowe może się wiązać z tym, że układ odpornościowy pacjenta styka się ze stopniowo wzrastającymi ich stężeniami, od bardzo małych, w początkowym okresie rozwoju, do dużych. Sytuację tę można porównać do odczulania przez podawanie małych, a następnie stopniowo wzrastających dawek antygenu.
W ułatwieniu immunologicznym biorą udział również niektóre przeciwciała przeciwnowotworowe. Chodzi tu między innymi o przeciwciała nie aktywujące dopełniacza, które wiążą się z antygenami na powierzchni komórek nowotworowych maskując je i blokując tym samym dostęp komórek efektorowych odpowiedzi immunologicznej, np. cytotoksycznych limfocytów T. Obecnie wiadomo, że przeciwciała mogą w wieloraki sposób ułatwiać rozwój nowotworu i chronić go, albo wprost przeciwnie, z udziałem dopełniacza, komórek żernych lub komórek K indukują jego niszczenie.
Rola przeciwciał w ułatwieniu immunologicznym nie ogranicza się prawdopodobnie do blokowania efektu cytotoksycznego i ochrony komórek nowotworowych lub przeszczepu. Okazało się, że w pewnych sytuacjach swoiste przeciwciała użyte w małych stężeniach mogą stymulować proliferację komórek docelowych. Niektóre cytokiny wydzielane w reakcjach immunologicznych będąc czynnikami wzrostowymi, mogą również pobudzać proliferację komórek nowotworowych.
Rola kompleksów antygen-przeciwciało w ułatwieniu immunologicznym może polegać nie tylko na blokowaniu reaktywności komórek efektorowych, ale też na opsonizacji tych komórek ich ewentualnym niszczeniu przez komórki mające receptor dla fragmentu Fc przeciwciał, np. makrofagi (ryc.34.5). Jeżeli efektorowy limfocyt T połączy się z determinantami antygenowymi kompleksów, to może on ulec zniszczeniu przez własne komórki żerne. W procesie tym biorą udział głównie makrofagi wątrobowe. Kompleksy antygen-przeciwciało mogą również swoiście hamować odpowiedź humoralną, a poprzez fragmenty Fc związanych z nimi przeciwciał mogą z kolei unieczynniać komórki K, wiążąc się z ich receptorami Fc i hamując tym samym cytotoksyczność komórkową zależną od przeciwciał. Interakcję limfocytów i komórek nowotworowych mogą również blokować uwalniane przez niektóre komórki nowotworowe rozpuszczalne cząsteczki adhezyjne, np. ICAM-1.
W ułatwieniu immunologicznym, obok w/w czynników, mogą też uczestniczyć przeciwciała skierowane przeciw receptorom limfocytów T(TCR), a także przeciwciała antyidiotypowe.
Rola przeciwciał antyidiotypowych w tej odpowiedzi jest bardzo złożona. Mogą one zarówno swoiście hamować, jak i stymulować odpowiedź przeciwnowotworową. Przeciwciała te mogą bowiem imitować budową przestrzenną swych determinant idiotypowych antygeny nowotworowe.
Hamująco na odpowiedź przeciwnowotworową mogą też wpływać limfocyty T regulatorowe/supresorowe oraz makrofagi i monocyty, przy czym w tym ostatnim mechanizmie uczestniczą prawdopodobnie prostaglandyny.
Immunosupresyjny charakter mogą też mieć niektóre mediatory uwalniane przez same komórki nowotworowe, np. TGF-β (wydzielany również przez niektóre limfocyty Treg), a także IL-10, która ponadto może być uwalniana przez makrofagi pod wpływem TGF-β. Wydzielany przez wiele typów komórek nowotworowych czynnik wzrostu śródbłonka naczyń <ang. vascular endothelial growth factor > VEGF nie tylko stymuluje formowanie się naczyń w obrębie nowotworu, ale też hamuje ich różnicowanie się komórek dendrytycznych z ich prekursorów. Niektóre komórki nowotworowe broniąc się przed cytotoksycznymi limfocytami T syntetyzują inhibitor proteaz serynowych, który ma właściwości nieodwracalnego blokowania czynności granzymu B, używanego przez limfocyty Tc do zabijania komórek docelowych.
Nieoczekiwanie okazało się, że w komórkach niektórych nowotworów dochodzi również do ekspresji ligandu dla białka Fas. Dzięki temu nabywają one zdolność do indukowania apoptozy atakujących je limfocytów T, które mają w swej błonie komórkowej białko Fas. Przypomina to przysłowie :”Złapał Kozak Tatarzyna, a Tatarzyn za łeb trzyma”. Tylko w tym przypadku ten Tatarzyn (kom. nowotworowa) nie tylko Kozaka (limfocyt T) trzyma, ale i.... zarzyna...
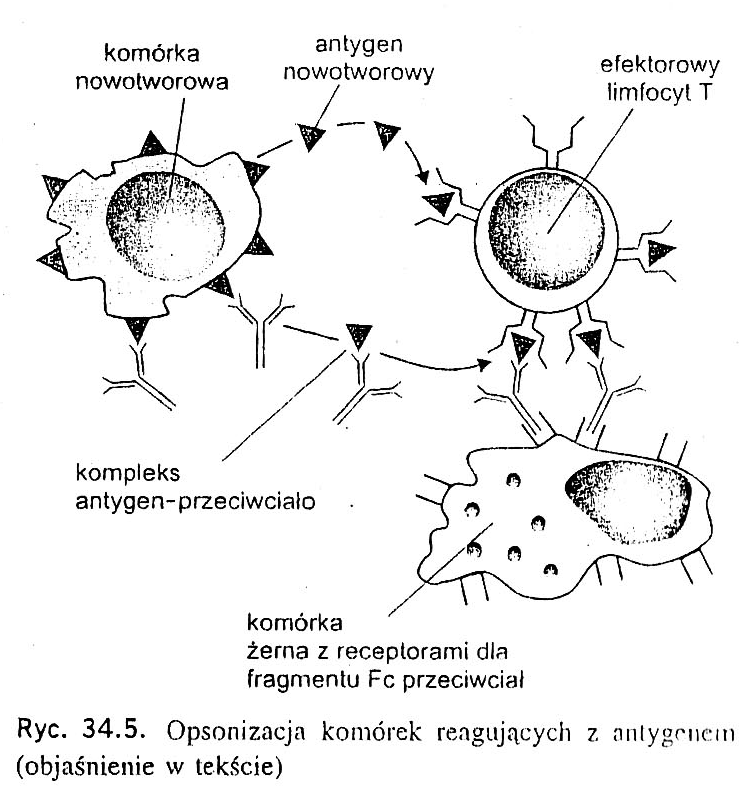
40. Znaczenie markerów krążących, techniki oznaczania, możliwości praktycznego wykorzystania oznaczeń markerów.
Krążące markery nowotworowe, to substancje antygenowe (substancje wielkocząsteczkowe - najczęściej białko z komponentą węglowodanową lub lipidową, albo glikolipid) uwalniane do krążenia chorego przez komórki nowotworowe, w wartościach mierzalnych. Ich poziom można oznaczyć w próbce krwi. Oznaczona wartość jest cechą osobniczo zmienną i zależy od wielu czynników, dlatego nie można jednoznacznie powiedzieć, że dana osoba choruje na nowotwór, biorąc pod uwagę jednokrotne oznaczenie, w którym miano danego markera jest powyżej normy. Bardziej istotne są zmiany miana danego markera w czasie. Systematyczny, ciągły przyrost świadczy najprawdopodobniej o rozroście masy nowotworowej. Więcej komórek nowotworowych „produkuje” coraz to więcej odpowiedniego antygenu. Nagły skok z poziomu normalnego, do wysokich wartości przekraczających ustalone normy, niekoniecznie świadczy o procesie nowotworowym, a wręcz może sugerować ostry proces zapalny danego narządu, z którego te markery są uwalniane (np. markery ostrego zapalenia trzustki).
Antygeny nowotworowe to antygeny róznicowania - pojawiają się one we wczesnych stadiach embrionalnych, przykładem czego mogą być:
CEA - antygen płodowo-nowotworowy
AFP - alfa fetoproteina
beta HCG - gonadotropina kosmówkowa
Są one obecne także u zdrowych ludzi, ale w dużo niższym stężeniu.
Identyfikacja i pomiar krążących markerów nowotworowych są użyteczne w diagnozowaniu pacjentów oraz w planowaniu terapii.Testy diagnostyczne, oparte na analizie poziomu markerów nowotworowych, powinny charakteryzować się:
a) czułością - % pacjentów ze złośliwą chorobą nowotworową, u których wynik testu wyszedł pozytywnie. Im mniej fałszywy wynik, tym czułość testu jest większa.
CZUŁOŚĆ TESTU = [prawdziwe pozytywne wyniki/ (prawdziwie pozytywne+ fałszywie negatywne)] * 100%
b) swoistością - % osób zdrowych albo chorych na niezłośliwą formę nowotworu, u których wynik wyszedł negatywnie. Swoistość oznacza, że marker, poziom którego chcemy wyznaczyć, powinien być związany z rozwojem tylko jednego, określonego rodzaju nowotworu.
SWOISTOŚĆ = [prawdziwie negatywne wyniki/ (pr.negatywne+fałszywie pozytywne)] * 100%
c) tym, że poziom wykrywanego markera poiwinien ściśle odzwierciedlać zaawansowanie choroby oraz odpowiedź organizmu na zastosowaną terapię.
Prawdopodobieństwo, że wynik dodatni będzie potwierdzał chorobę, a wynik ujemny ją wykluczał, nazywa się WARTOŚCIĄ PRZEPOWIADAJĄCĄ..
Obecnie jednak, żaden test diagnostytczny oparty na znanych jak i stosowanych markerach nowotworowych, nie spełnia całkowicie powyższych kryteriów, co nie umniejsza roli tych testów w celach diagnostycznych, chociażby ze względu na fakt, iż pozwalają one na odnotowanie wzrostu ilości badanych przez nas markerów nawet na długo przed wystąpieniem objawów klinicznych (nawet 26 miesięcy).
Do najczęściej analizowanych markerów antygenowych uwalnianych przez komórki nowotworowe określonych narządów należą:
a) płuca - wyróżniamy:
- raka drobnokomórkowego, występującego częściej - markery: NSE (neurospecyficzna enolaza) i peptyd progastronowy
- raka niedrobnokomórkowego - np. gruczolak: CYFRA 21-1(pochodna cytokeratyny 19), CEA (antygen karcinoembrionalny, antygen rakowo-płciowy, chemicznie: glikoproteina)
- raka płaskonabłonkowego: CEA, SCC - należy do rodziny inhibitorów proteaz serynowych, zwiększone uwalnianie do surowicy jest sygnałem zmian w aktywności proliferacyjnej komórek nabłonka
b) wątroba - markery:
AFP - alfa fetoproteina - białko płodowe, pojawiające się w życiu pozapłodowym tylko w określonych stanach fizjologicznych (np. ciąża) luib patologicznych (nowotwór), jego poziom jest bardzo wysoki w pierowotnych rakach, wzrasta także przy marskości wątroby, ale nie tak znacznie
CEA - (antygen karcinoembrionalny) - charakterystyczny dla przerzutów ukł. pokarmowego do wątroby
c) żołądek:
CA 19-9 - antygen nowotworowy 19-9 mający główną wartość diagnostyczną
CA 72-4 i CEA - antygeny służące do potwierdzenia rozpoznania
d) okrężnica:
CA 19-9 - wartośc prognostyczna - gdy poziom tego markera wzrasta - rokowania są złe
CEA - wartość diagnostyczna
e) prostata:
PSA - swoisty antygen prostaty
PAP - fosfataza kwaśna sterczowa
f) jądra:
AFP
free beta HCG (ludzka gonadotropina kosmówkowa)
g) trofoblast:
free beta HCG
CEA
h) endometrium:
CEA
CA 19-9
i) jajnik:
CA 125 - jego podwyższony poziom wykrywany jest u 80-90% pacjentek z rakiem jajnika, nalezy jednak pamiętać, że wzrost stężenae tego markera zmienia się także np. podczas cyklu menstruacyjnego czy w pierwszym trymestrze ciąży
CEA
CA 72-4
j) szyjka macicy: SCC - antygen płaskonabłonkowy
k) rak piersi:
CA 15-3 - jego podwyższony poxziom stwierdza się w surowicy osób cierpiących na raka piersi, nie jest swoisty-jego wzrost obserwuje się także u chorych z niewielkiemi zmianami wątrobie
CEA - wartość diagnostyczna
l) tarczyca:
Ct (kalcytonina) - polipeptydowy hormon złożony z 32 aminokwasów, odgrywa istotną rolę w regulacji gospodarki wapniowo - fosforanowej w organizmie
Tg (tyreoglobulina) - glikoproteina produkowana wyłącznie przez komórki pęcherzykowe tarczycy nowotworowo zmienione, ale także prawidłowe.
ł) głowa: SCC
m) mózg: NSE
Do natygenów swoistych narządowo należą:
a) AFP - obecny przy nowotworze jąder, nowotworach trofoblastycznych i zarodkowych u kobiet
b) beta HCG - j/w
c) Tg - nowotwory tarczycy
d) PSA -swoisty antygen prostaty (wykorzystywany jednak także do diagnozy raka piersi u kobiet), jest to jedyny marker używany do badań przesiewowych (norma: 4 mikrogramy). Czynniki wpływające na wzrost czułości i specyficzności oznaczeń PSA, szczególnie u osób z PSA między 4 a 10 mikrogramów:
* specyficzny dla wieku referencyjny zakres PSA (u młodszych mężczyzn niższa granica referencyjnego zakresu, u starszych mężczyzn podwyższenie granicy referencyjnego zakresu w zależności od wieku):
40-49 lat < 2,5 mikrogramy/litr
50-59 lat < 3,5
60-69 lat < 4,5
70-79 lat < 6,5
* gęstość PSA - stosunek stężenia PSA do objętości prostaty mierzonej USG per rectum albo rezonansem
* szybkość zmian stężeń PSA zachodzących w czasie (w raku prostaty wysoki wzrost surowiczego stężęnia PSA w porównaniu do zmian łagodnych)
* molekularne formy PSA (jest on eznymem z rodziny kalikrein) - zróżnicowanie na fPSA (wolny PSA) i tPSA (związany w kompleksie) - w raku prostaty niższy % fPSA w stosunku do tPSA niż u pacjentów z BPH (przerostem prostaty)
* indeks raka prostaty - porównannie różnych czynników: wiek, badanie per rectum (przy łagodnym przesoście prostaty obydwa płaty prostaty sa jednakpowych rozmiarów), stężenie PSA w surowicy, ocena aktywności kinazy kreatynowej.
Drażnienie gruczołu krokowego powoduje wzrost PSA, o czym pacjenci powinni być poinformowani w celu uwiarygodnienia otrzymanych wyników. Ponadto, jako że różne testy dają różne wyniki (ze względu na stosowanie w tych testach przeciwciał monoklonalnych o różnej swoistości) badania należy wykonywać w ośrodkach referencyjnych).
Markery tkankowe umożliwiają nam:
a) określić pochodzenie tkanki - filamenty pośrednie - cytokeratyny:
* w rakach nabłonkowcyh cytokeratyny (które możemy podzielić na kwaśnie, zasadowe i obojętne) występują w parach
* wimentyna - wskazuje na tkanki mezenchymalne ---> czerniak, chłoniak (trzeba oznaczyć też inne markery)
* desmina - wskazuje na komórki mięsniowe ---> mięsaki, sarkoma
* kwaśne białko glejowe - centralny układ nerwowy ---> glejaki, astrocytomy
* neurofilamenty - obwodowy układ nerwowy ---> np. nerwiaki
b) ocenę rokowań przebiegu choroby:
* Ki67 - białko, marker komórkowej proliferacji. W czasie interfazy można wykazać obecność antygenu Ki-67 w jądrze komórkowym, podczas gdy w czasie mitozy Ki-67 stwierdzany jest na powierzchni chromosomów. Ki-67 jest obecny w komórce podczas wszystkich faz czynnych cyklu komórkowego (G1, S, G2 i mitoza), i niewykrywalny w fazie G0. Ki-67 u ważany jest za dobry wskaźnik indeksu mitotycznego komórek i frakcji dzielacych się komórek. Indeks Ki-67 często koreluje z przebiegiem choroby nowotworowej, zwłaszcza raka prostaty i raka sutka, i ma dużą wartość prognostyczną w tych chorobach.
* PcMA - marker na proliferację
* p53 - czynnik transkrypcyjny o właściwościach supresora nowotworowego
* VEGF - nabłonkowy czynnik wzrostu naczyń
* Her 2 - ludzki nabłonkowy czynnik wzrostu - jeden z podstawowych czynników prognostycznych raka piersi (obok m.in. wielkości guza, stanu węzłów chłonnych, typu histologicznego raka). W świetle obecnej wiedzy receptor HER2 jest zaliczany do negatywnych czynników rokowniczych, czyli wskazuje na bardziej agresywny przebieg choroby. Jest to także czynnik predykcyjny, określający jakie leczenie będzie dla danej chorej najwłaściwsze.
* Her 2/neu - związany ze szczególnie agresywnym przebiegiem choroby nowotowrowej
c) przewidywanie odpowiedzi na leczenie:
* białko p53
* Her 2/neu - onkogen
* GP-P - glikoproteina P
* receptor estrogenowy i progersteronowy - Osoby z nowotworem sutka, u których stwierdzono obecność ER (ER+) i PR (PR+) mają znacznie większe szanse na skuteczne leczenie, lepszą prognozę niż te, u których receptorów brak (lub ich liczba jest niewielka).Ponadto obecność receptorów jest wskaźnikiem predykcyjnym ułatwiającym określenie sposobu leczenia. U chorych ER+ i/lub PR+ stosuje się z powodzeniem leczenie anty-estrogenami np. tamoxifenem, po zabiegu usunięcia pierwotnego guza lub też można odpowiednio wybrać sposób leczenia w przypadku wznowy.gdy mamy do czynienia z ich dużą ekspresją, możemy zastosować hormonoterapię.
Techniki oznaczania markerów krążących:
1) Immunohistochemia - jest to metoda wykrywania rozmaitych substancji antygenowych w skrawkach mikroskopowych, stosowana w histopatologii i histologii. Polega na zastosowaniu przeciwciała skierowanego przeciwko poszukiwanym składnikom preparatu a następnie systemu detekcji, tworzącego barwną, nierozpuszczalną substancję, widoczną w mikroskopie. Do związków chemicznych stosowanych do lokalizacji stosowanych w tej metodzie przeciwciał należą:
* fluorochromy (fluoresceina, rodamina)
* metale (złoto koloidalne, ferrytyna zawierająca żelazo)
* enzymy (peroksydaza, fosfataza zasadowa)
Metoda ta znajduje zastosowanie w diagnostyce różnicowej chorób, szczególnie nowotworów złośliwych.
2) ELISA - (test immunoenzymatyczny lub immunoenzymosorbcyjny - jeden z najpowszechniej stosowanych testów w badaniach biomedycznych, zarówno naukowych, jak i diagnostycznych. Służy on do wykrycia określonych białek w badanym materiale z użyciem przeciwciał poliklonalnych lub monoklonalnych skoniugowanych z odpowiednim enzymem.
Zasada działania testu ELISA polega na tym, że przeciwciało związane z określonym enzymem może specyficznie rozpoznawać dane białko (zawarte w materiale biologicznym), które wcześniej zostało unieruchomione na podłożu. Po dodaniu przeciwciał następuje utworzenie kompleksów immunologicznych, zatem przeciwciało także zostaje unieruchomione. Po wypłukaniu niezwiązanego przeciwciała i dodaniu substratu dla enzymu związanego z przeciwciałem zajdzie reakcja enzymatyczna, czemu z kolei będzie towarzyszyło pojawienie się produktu. Wykrycie jego obecności (może to być np. produkt barwny powstający z bezbarwnego substratu) świadczy o obecności danego białka w badanym materiale. Mierząc z kolei ilość powstającego produktu można także przeprowadzić analizę ilościową.
3) Immunofluorescencja:
a. bezpośrednia - plega na identyfikacji antygenu przez znane, znakowane przeciwciało
b. pośrednia - polega na identyfikacji kompleksu - antygen-p/ciało poprzez znakowaną surowicę antyglobulinową.
Nie mam pojęcia, czy sa jeszcze jakies inne metody...:( Jeśli wiecie, że są a ich tu nie opisałam-przepraszam..Pytalam mądrzejszych ode mnie w tej materii i też nie bardzo się orientują.:( Ufam, że nikt z nas nie dostanie tego pytania:D;p Tyle mego wywodu - pozdrawiam Was wszystkich serdecznie i magicznych Świąt życzę:)
41. Mechanizmy nieswoiste i swoiste odporności p-zakaźnej.
1)mechanizmy odporności nieswoistej:
- obecne są u wszystkich organizmów wielkomórkowych, zanim dojdzie do zakażenia
patogenem
- działają zanim rozwinie się odporność swoista, jednocześnie ściśle z nimi współpracując
- często są wystarczające do wyeliminowania zakażenia
- są obecne zanim dojdzie do zakażenia konkretnym patogenem
Wyeliminowanie patogena zachodzi przy dzięki:
a)działaniu komórek :
b) naturalnym barierom dla zakażenia (skóra, błony śluzowe ukł. pokarmowego, oddechowego, moczowo- płciowego)
c) fagocytozie - pochłanianie przez komórkę całych mikroorganizmów lub dużych ich fragmentów (makrofagi i granulocyty)
d) miejscowej i ogólnej reakcji zapalnej - rozszerzenie naczyń, zwolnienie przepływu krwi, zwiększenie przenikalności naczyń (zaczerwienienie, obrzęk, podwyższona temperatura), wydzielanie: IL-1, IL-6, IL-8, IL-12, TNF, histaminy, prostaglandyn, enzymów, PAF
e) układowi dopełniacza - działa natychmiast po przełamaniu przez patogen mechanicznych barier obronnych,alternatywna droga aktywacji dopełniacza ogranicza rozprzestrzenianie się zakażenia
f) interferonom- stymulatorem syntezy INF jest dwuniciowy RNA wirusów, hamują mechanizmy replikacyjne wirusów
2) mechanizmy odporności swoistej:
pierwotny- aktywacji ulegają limfocyty T i B, wcześniej nie nieuczulone
wtórny- kiedy dochodzi do pobudzenia antygenami z którymi układ odpornościowy miał kontakt
Patogen wnikający przez skórę lub błony śluzowe jest wychwytywany przez komórki prezentujące antygen (w przypadku skóry kom. Langerhansa ), następie transportowany do okolicznych węzłów limfatycznych, pojawiają się liczne populacje komórek należących do swoistych klonów. Limfocyty T i komórki pamięci migrują w kierunku miejsca zakażenia (głównie pod wpływem czynników chemotaktycznych)
Odpowiedz humoralna na polisacharydy, glikolipidy, kwasy nukleinowe nie jest uzależniona od współpracy ze swoiście uczulonymi limfocytami T pomocniczymi.
Odpowiedz humoralna z ich udziałem charakteryzuje się syntezą przeciwciał o większym powinowactwie.
Różnice właściwości antygenowych determinują rodzaj odpowiedzi:
IgG przy zakażeniach wirusowych
IgM przy zakażeniach bakteriami otoczkowymi
IgE przy zakażeniach pasożytniczych
Przebycie zakażenia zakończone eliminacją danego patogenu pozostawia pamięć immunologiczną, która w razie ponownego zakażenia umożliwia szybszą odpowiedz wtórną.
Wtórna stymulacja antygenami konkretnego czynnika nie ma wpływu na limfocyty dziewicze, pobudzeniu ulegają jedynie komórki pamięci.
P-ciała „naturalne” - u osób wcześniej nie uczulonych na konkretny antygen mogą występować przeciwciała reagujące z tym antygenem, należą głównie do IgM, są wytwarzane przez populację limfocytów B1,reagują z bakteriami i ich toksynami.
42. Rodzaj patogenu a odpowiedź immunologiczna.
1. Odpowiedź immunologiczna na zakażenia wirusowe.
Wirusy są patogenami bezwzględnie wewnątrzkomórkowymi; ich replikacja możliwa jest tylko wewnątrz komórki gospodarza do czego wykorzystują jej zasoby. Wyróżniamy wirusy
a) cytopatyczne - powodujące zaburzenia funkcji i lizę komórki zakażonej
b) niecytopatyczne - nie uszkadzające bezpośrednio komórki
Odpowiedź na zakażenie wirusowe ma za zadanie:
- zahamować replikację wirusów wewnątrz komórki i ich rozprzestrzenianie się na sąsiednie komórki,
- eliminację z organizmu,
-wytworzenie trwałej odporności.
Wczesne, nieswoiste mechanizmy odpowiedzi przeciwwirusowej obejmują działanie: dopełniacza, interferonu ( patrz: działanie przeciwwirusowe interferonu!!! pyt. nr15), komórek NK. W miarę trwania zakażenia istotną rolę zaczynają odgrywać przeciwciała, zwłaszcza IgG, które zapobiegają zakażeniu innych komórek (przeciwciała neutralizujące). Ich fragment Fab wiąże się z antygenami wirusa, zaś fragment Fc z odpowiednimi receptorami na komórkach NK, makrofagach i innych; co umożliwia fagocytozę i ADCC oraz bezpośrednie niszczenie z udziałem dopełniacza.
W rozwoju humoralnej odpowiedzi przeciwwirusowej aktywnie uczestniczą uczulone limfocyty CD4+, a synteza swoistych przeciwciał obywa się jeszcze przed wniknięciem wirusa do komórki docelowej oraz w trakcie uwalniania go z komórki.
Właściwości neutralizujące mają również przeciwciała IgA, gdy wrotami zakażenia są błony śluzowe przewodu pokarmowego i dróg oddechowych.
Limfocyty CD8+ cytotoksyczne rozpoznają antygeny wirusa na zakażonych komórkach i je niszczą, mogą indukować w komórkach zakażonych syntezę nukleaz niszczących materiał genetyczny wirusa oraz pobudzać syntezę IFN.
Konsekwencjami nieprawidłowości w przebiegu odpowiedzi przeciwwirusowej mogą być:
- uszkodzenia wynikające z tworzenia się i odkładania w tkankach kompleksów immunologicznych (np. kłębkowe zapalenie nerek),
- przewlekłe zapalenie wątroby typu B i C spowodowane przewlekłą odpowiedzią cytotoksyczną bez eliminacji wirusa,
- zakażenie komórek odpornościowych może powodować zaburzenia odporności lub transformację nowotworową,
- rozwój zjawisk autoimmunizacyjnych prowadzących do autoagresji.
2. Odpowiedź immunologiczna na zakażenia bakteryjne.
A/ BAKTERIE NAMNAŻAJĄCE SIĘ ZEWNĄTRZKOMÓRKOWO
a) Mechanizmy odpowiedzi nieswoistej:
- aktywacja dopełniacza drogą alternatywną (bez udziału przeciwciał), w której mogą uczestniczyć LPS bakterii G-, peptydoglikany bakterii G+, cząsteczki mannozy.
- fagocytoza i rozwój reakcji zapalnej warunkowanej przez makrofagi pobudzone antygenami bakterii.
b) Mechanizmy odpowiedzi swoistej to przeciwciała skierowane przeciwko antygenom ścian bakterii i ich toksynom, a ich działanie opiera się na:
- zapobieganiu wiązania bakterii z komórką gospodarza poprzez wiązanie z rzęskami bakterii;
- działaniu bakteriobójczym poprzez aktywację dopełniacza drogą klasyczną (bakterie G-)
- ułatwianiu fagocytozy dzięki opsonizacji (bakterie G+);
- hamowaniu wzrostu bakterii poprzez blokowanie bakteryjnego receptora dla transferyny i zaburzenie pobierania jonów żelaza niezbędnych do wzrostu bakterii;
- hamowaniu inwazji bakterii powodowanym blokowaniem kolagenazy i hialuronidazy, ułatwiających rozprzestrzenianie się zakażenia w tkankach;
- neutralizacji toksyn bakteryjnych.
B/ BAKTERIE NAMNAŻAJĄCE SIĘ WEWNĄTRZKOMÓRKOWO
Np. Mycobacterium tuberculosis. Bakterie te mają możliwość przetrwania oraz replikacji wewnątrz komórek żernych oraz pozostawania poza zasięgiem większości mechanizmów odpowiedzi immunologicznej. Stąd zakażenia te mają tendencję do przewlekania się oraz nawrotów.
Bakterie te wykształciły mechanizmy unikania zniszczenia w fagolizosomie:
- oporność na niszczące działanie enzymów lizosomowych,
- zdolność do szybkiej ucieczki z fagolizosomu do cytoplazmy poprzez naruszenie błony fagolizosomu,
- blokowanie tworzenia fagolizosomu.
a) Odpowiedź nieswoista to działanie komórek NK pobudzonych przez makrofagi i neutrofile.
b) Odpowiedź swoista obejmuje współdziałanie makrofagów, limfocytów CD4+ i CD8+.
Limfocyty różnicują się w kierunku Th1, które wydzielają IFN-gamma, pobudzający makrofagi do syntezy enzymów lizosomalnych, aktywnych form tlenu i niszczenia bakterii.
Stymulowane są również limfocyty T cytotoksyczne CD8+.
3. Odpowiedź przeciwgrzybicza
a) Odpowiedź nieswoista to granulocyty obojętnochłonne oraz makrofagi.
b) Odpowiedź swoista obejmuje głównie odpowiedź typu komórkowego, biorą w niej udział limfocyty CD8+ i CD4+.
4. Do mechanizmów unikania odpowiedzi immunologicznej przez patogeny należą:
- występowanie otoczek polisacharydowych- hamowanie fagocytozy i działania dopełniacza, osłabienie immunogenności,
- wydzielanie toksyn- niszczących komórki układu odpornościowego,
- zmienność patogenu- spowodowana mutacjami materiału genetycznego- uniemożliwia swoistą reakcję obronną,
- przetrwanie w komórkach - patogeny mogą indukować apoptozę tych komórek lub zaburzać tworzenie i funkcję fagosomu oraz fagolizosomu; lub jak Shigella i Listeria indukować syntezę włókien aktyny, co umożliwia im przemieszczanie się z komórki zakażonej bezpośrednio do sąsiedniej bez fazy pozakomórkowej. Staph. aureus hamuje działanie aktywnych form tlenu poprzez wydzielanie katalazy. Wirusy integrują swój materiał genetyczny z DNA komórki lub hamują apoptozę komórek zakażonych.
- ukrywanie się przed układem odporności- np. w kom. nabłonkowych czy fibroblastach,
- zdolność zaburzania odpowiedzi immunologicznej - np. poprzez wydzielanie białek regulatorowych lub hamowanie aktywności interferonu poprzez wpływ na czynniki odpowiedzialne za jego syntezę (wirusy).
5. Odpowiedź przeciwpasożytnicza.
Organizm w walce z pasożytami posługuje się odpowiedzią nieswoistą oraz swoistą: zarówno komórkową jak i humoralną, a rodzaj odpowiedzi zależy od rodzaju pasożyta i miejsca jego bytowania w organizmie człowieka.
a) pierwotniaki z rodzaju Plasmodium - stadium wątrobowe pasożyta jest eliminowane dzięki mechanizmom cytotoksyczności komórkowej, stadium krwinkowe - za pomocą przeciwciał.
b) w przypadku leiszmaniozy - odpowiedź komórkowa prowadzi do aktywacji makrofagów i zniszczenia pasożytów bytujących w ich wnętrzu (choroba przebiega w skórze); odpowiedź humoralna to zahamowanie wytwarzania IFN-gamma oraz brak aktywacji makrofagów (choroba przebiega w całym organizmie);
c) Schistosoma mansoni - współdziałanie odpowiedzi humoralnej i komórkowej prowadzi do eliminacji pasożyta;
d) pasożyty bytujące we krwi - pod wpływem TNF oraz IFN-gamma dochodzi do wzrostu ekspresji indukowanej syntetazy tlenku azotu (iNOS) obecnej m.in. w komórkach śródbłonka naczyniowego. Zwiększone wydzielanie tlenku azotu umożliwia eliminację pasożytów z krążenia;
e) pasożyty przewodu pokarmowego np. nicienie - wytwarzane są przeciwciała, które opłaszczają powierzchnię ciała pasożyta oraz prowadzą do degranulacji komórek tucznych , w wyniku czego uwalniane mediatory zapalne prowadzą do zniszczenia pasożyta oraz przyspieszenia motoryki jelit, co ułatwia jego eliminację. Uwalniane z makrofagów TNF i IL-1 stymulują komórki kubkowe do wytwarzania śluzu niezbędnego w usuwaniu pasożyta ze światła jelita.
6. Metody unikania przez pasożyty mechanizmów obronnych gospodarza:
a) Część pasożytów hamuje inicjację kaskady dopełniacza przez uniemożliwienie wiązania specyficznych przeciwciał lub zwiększenie wiązania czynnika H. Inne wykazują aktywność czynnika DAF lub protaktyny albo potrafią unieczynniać kompleks atakujący błonę (MAC) i poszczególne składowe układu dopełniacza.
b) Pasożyty wewnątrzkomórkowe unikają śmierci w lizosomie- np. Toxoplasma gondii wnika do komórki na drodze innej niż fagocytoza, a Leishmania za pomocą receptorów dla składowych dopełniacza. Ponadto Leishmania broni się przed wolnymi rodnikami za pomocą dysmutazy ponadtlenkowej; hamuje ekspresję cząsteczek MHC klasy II oraz osłabia aktywność enzymów lizosomowych. Część pasożytów hamuje proces prezentacji antygenów, mechanizmy kostymulacji i adhezji limfocytów T, wpływa też na produkcję cytokin przez makrofagi.
c) Pasożyty pozakomórkowe - posiadają tegument (np. tasiemce) lub wytwarzają ochronne cysty, guzki kolagenowe. Trypanosoma cruzi natomiast zmienia strukturę glikoproteiny powierzchniowej VSG, przeciwko której skierowane są przeciwciała.
KONIEC!!!!!
Teraz już umiesz wszystko i dostaniesz
5 z egzaminu!!!
Presja efektorowa prowadząca do selektywnego przeżycia klonów komórek nowotworowych z osłabioną wrażliwością na efekty cytotoksyczne
Małe dawki podanych przy przeszczepach komórek nowotworowych indukują odpowiedź ułatwiającą wzrost nowotworu
MECHANIZMY IMMUNOLOGICZNE UŁATWIAJĄCE ROZWÓJ NOWOTWORU
IMMUNOSELEKCJA
IMMUNOMODULACJA
Okresowe zmniejszenie antygenowości komórek nowotworowych po zadziałaniu swoistych przeciwciał
„PRZEŚLIZGIWANIE SIĘ”
UŁATWIENIE IMMUNOLOGICZNE
Przyspieszony wzrost nowotworu obserwowany u zwierząt swoiście uczulonych przeciw komórkom tego nowotworu, inicjowany przez : wolne antygeny, swoiste przeciwciała przeciwnowotworowe i kompleksy antygen-przeciwciało, opsonizację komórek reagujących z antygenem(limfocyty T, reakcje antyidiotypowe)
Wyszukiwarka
Podobne podstrony:
egzamin pytania opracowanie, PODSTAWY IMMUNOLOGII
egzamin pytania opracowanie, immunologia
egzamin IMMUNOLOGIA 15 OPRACOWANE (część)
egzamin pytania opracowanie, Immunologia(1)
immunologia opracowanie do egzaminu (sciaga)
egzamin z sorbentów opracowanie pytań 1 2 JM
Egzamin licencjacki Opracowane pytania finanse i rachunkowość collegium mazowia
Egzamin GPS opracowane zagadnie Nieznany
egzamin chemia opracowanie
elektro otwarte, Mechanika i Budowa Maszyn PWR MiBM, Semestr III, elektronika, Egzamin - pytania, op
EGZAMIN FILOZOFIA OPRACOWANE ZAGADNIENIA
Pytania na egzamin do opracowania
egzamin do opracowania
Egzamin HF opracowanie
ZAGADNIENIA DO EGZAMINU MAGISTERSKIEGO opracowane przez nas
egzamin z NOMu opracowane pytania
Egzamin Immunologia 12
więcej podobnych podstron