II. ELEKTROCHEMIA
Podejmując próbę klasyfikacji różnych reakcji chemicznych często stwierdzamy fakt, że niektóre
z nich są reakcjami elektrochemicznymi, ponieważ zachodzą z wymianą elektronów między reagentami.
Elektrochemia jest dziedziną nauki i techniki, która między innymi zajmuje się właściwościami elektrolitów, przewodnictwem elektrycznym roztworów elektrolitów i stopionych soli oraz procesami przemiany energii reakcji chemicznych
w energię elektryczną i odwrotnie. Rozwój elektrochemii zapoczątkowały na przełomie XVIII
i XIX wieku badania, odkrycia i wynalazki Volty, który zajmował się aktywnością chemiczną metali (szereg napięciowy) i skonstruował pierwszą baterię, ogniwo srebrowo - cynkowe (tzw. stos Volty).
Allessandro Volta (1745-1827)
włoski fizyk, profesor Uniwersytetu w Pawii
Szereg elektrochemiczny (napięciowy) metali
Volta uszeregował metale pod względem malejącej aktywności chemicznej wiedząc, że metal
bardziej aktywny chemicznie zawsze wypiera metal o mniejszej aktywności z roztworu jego soli. Przykładowo, już w średniowieczu stosowano żelazo do wydzielania miedzi z roztworów CuSO4:
CuSO4 + Fe = Cu + FeSO4 (1)
Reakcja (1) ma charakter reakcji elektrochemicznej, polegającej na równoczesnym utlenienia żelaza
i redukcji miedzi(II):
Cu2+ + Fe = Cu + Fe2+ (2)
W podobny sposób z roztworu soli kadmu(II) można wydzielić kadm w reakcji z cynkiem:
Cd2+ + Zn = Cd + Zn2+, (3)
lub z roztworów soli srebra(I) wydzielić srebro za pomocą miedzi:
2Ag+ + Cu = 2Ag + Cu2+ (4)
Volta w podanym przez siebie szeregu umieścił także wodór, który niejako naturalnie rozgranicza metale nieszlachetne od metali szlachetnych. Po pierwsze, metale nieszlachetne o umiarkowanej aktywności chemicznej wypierają wodór w trakcie roztwarzania w kwasach, a najbardziej aktywne (litowce, berylowce, glin) wypierają wodór z wody. Po drugie metale szlachetne nie wypierają wodoru z kwasów i roztwarzają się tylko w kwasach utleniających.
Miarą aktywności chemicznej metali i kryterium oceny ich szlachetności lub nieszlachetności jest znak i wartość potencjału elektrochemicznego (E) - czyli skoku potencjału elektrycznego na powierzchni styku między danym metalem, zazwyczaj w postaci blaszki, a wodnym roztworem jego soli. Przyczyną pojawienia się tego skoku potencjału jest podwójna warstwa elektryczna na powierzchni styku między metalem (M) a roztworem, mająca związek
z położeniem stanu równowagi w procesie utleniania atomów i redukcji kationów metalu:
M ↔ Mn+ + ne- (5)
U metali nieszlachetnych stan równowagi jest przesunięty w prawo, natomiast u metali szlachetnych w lewo.
Rys. 1. Podwójna warstwa elektryczna na granicy metal - roztwór.
Z lewej: Zn - metal nieszlachetny, E < 0,
z prawej: Cu - metal szlachetny, E > 0.
Metale - elektrody (półogniwa) I rodzaju
Układy przedstawione na rys. 1 dla cynku
i miedzi, nazywamy elektrodami lub półogniwami metalicznymi (elektrody I rodzaju), odwracalnymi względem odpowiednich kationów. Potencjał elektrochemiczny elektrody M/Mn+ zależy od rodzaju metalu M, aktywności kationów Mn+
w roztworze, liczby n wymienianych elektronów zgodnie z równaniem (5) oraz temperatury. Zależność tę wyraża równanie podane przez Nernsta:
![]()
, (6)
gdzie: stała gazowa R = 8,314 Jmol-1K-1, stała Faradaya F = 96485 C, a EoM/Mn+ jest standardowym potencjałem elektrody w temperaturze 298 K
w roztworze o jednostkowej aktywności jonów Mn+.
Fizykochemik niemiecki Walther Hermann Nernst (1864-1941),
laureat nagrody Nobla w 1920 roku
![]()
Z fizyki wiadomo, że potencjału dowolnej elektrody nie można zmierzyć bezpośrednio, ponieważ mierzalna jest tylko różnica potencjałów między daną elektrodą a inną elektrodą, wybraną jako układ odniesienia, np. elektrodą wodorową (rys. 2).
Rys. 2. Schemat budowy elektrody wodorowej:
1 - blaszka platynowa pokryta czernią platynową; 2 - przewód doprowadzający wodór; 3 - roztwór elektrolitu (kwas solny);
4 - zamknięcie hydrauliczne blokujące dostęp powietrza;
5 - zbiornik z zapasem elektrolitu.
Czerń platynowa (koloidalna platyna) osadzona na powierzchni blaszki z platyny adsorbuje gazowy wodór. Elektroda wodorowa jest elektrodą gazową, odwracalną względem kationu:
½ H2 = H+ + e- (7)
Równanie Nernsta określające potencjał elektrody wodorowej ma postać:
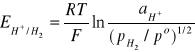
(8)
gdzie pH2 jest ciśnieniem wodoru, a po = 101,3 kPa ciśnieniem standardowym. Gdy czysty wodór przepływa przez elektrodę pod ciśnieniem 101,3 kPa, a aktywność jonów wodorowych jest równa 1 mol/dm3, to jest to standardowa elektroda wodorowa
o potencjale Eo, który nie zależy od temperatury
i z definicji jest równy 0.
Zasady pomiaru potencjału elektrody
Potencjał elektrodowy wyznacza się mierząc siłę elektromotoryczną ogniwa galwanicznego, które składa się z badanej elektrody i standardowej elektrody wodorowej. Obydwie elektrody są zwarte cienkim kablem tworząc obwód zewnętrzny. Odpowiednie elektrolity tworzące obwód wewnętrzny nie mogą się mieszać, dlatego muszą pozostawać w kontakcie przez tzw. klucz elektrolityczny lub porowatą membranę (rys. 3). Klucz elektrolityczny jest odwróconą U-rurką, wypełnioną nasyconym roztworem KCl lub NH4NO3,
i zamkniętą z obydwu stron półprzepuszczalnym materiałem, np. zwitkami waty.
Rys. 3. Warianty budowy ogniw galwanicznych:
z lewej - ogniwo z kluczem elektrolitycznym;
z prawej - ogniwo z przegrodą porowatą.
Elektroda o niższym potencjale jest w ogniwie anodą, natomiast elektroda o wyższym potencjale jest katodą. Na anodzie zachodzi proces utleniania,
a na katodzie zachodzi proces redukcji.
Na podstawie porozumień międzynarodowych (Konwencja sztokholmska, 1953) obowiązuje zasada, że na ideowym schemacie ogniwa anodę umieszcza się po lewej stronie, a katodę po prawej. Pionowe kreski w schematach ogniw oznaczają graniczne powierzchnie styku międzyfazowego: materiał elektrody│roztwór elektrolitu. Natomiast dwie pionowe kreski ║symbolizują klucz elektrolityczny.
W ogniwie do pomiaru standardowego potencjału elektrochemicznego cynku, elektroda cynkowa jest anodą a elektroda wodorowa katodą.
Zn│Zn2+ (a = 1) ║ H+ (a = 1)│H2 (p = 101,3 kPa) │Pt
Anoda: Zn = Zn2+ + 2e- (utlenianie)
Katoda: 2H+ + 2e- = H2 (redukcja)
Odmienną sytuację mamy w ogniwie do pomiaru standardowego potencjału elektrochemicznego miedzi, gdzie elektroda wodorowa jest anodą
a elektroda miedziowa katodą.
Pt│ H2 (p = 101,3 kPa)│H+ (a = 1)║Cu2+ (a = 1)│Cu
Anoda: H2 = 2H+ + 2e- (utlenianie)
Katoda: Cu2+ + 2e- = Cu (redukcja)
Doświadczalne wartości standardowych potencjałów elektrod cynkowej i miedziowej są następujące:
![]()
![]()
Potencjały elektrochemiczne różnych elektrod metalicznych zmieniają się w zakresie od około -3 do około +1,5V. Najniższe, ujemne potencjały elektro-chemiczne są charakterystyczne dla takich nieszlachetnych metali, jak litowce i berylowce. Najwyższe, dodatnie potencjały elektrochemiczne są cechą takich metali szlachetnych, jak srebro, złoto
i platynowce (tabela 1). Niektóre metale szlachetne są elementami składowymi innych typów elektrod, np. elektrod metalicznych odwracalnych względem anionów (srebro, rtęć), elektrod oksydacyjno-redukcyjnych i gazowych (platyna).
Tabela 1. Potencjały standardowe (Eo) elektrod I rodzaju
Pierwiastek |
Układ |
Eo, V |
Lit Sód Potas Magnez Wapń Glin Mangan Cynk Żelazo Kadm Kobalt Nikiel Cyna Ołów Wodór Bizmut Miedź Srebro Rtęć Pallad Platyna Złoto |
Li+/Li Na+/Na K+/K Mg2+/Mg Ca2+/Ca Al3+/Al Mn2+/Mn Zn2+/Zn Fe2+/Fe Cd2+/Cd Co2+/Co Ni2+/Ni Sn2+/Sn Pb2+/Pb 2H+/H2 Bi3+/Bi Cu2+/Cu Ag+/Ag Hg2+/Hg Pd2+/Pd Pt2+/Pt Au3+/Au |
-3,03 -2,71 -2,93 -2,36 -2,86 -1,69 -1,18 -0,76 -0,44 -0,40 -0,27 -0,25 -0,14 -0,13 0,000 0,31 0,34 0,79 0,80 0,91 1,18 1,52 |
Elektrody (półogniwa) II rodzaju
Metal pokryty zwartą warstewką swojej trudno rozpuszczalnej soli, która ma wspólny anion z solą łatwo rozpuszczalną w roztworze elektrolitu, jest elektrodą (półogniwem) II rodzaju, odwracalną względem anionów. Duże znaczenie praktyczne mają elektrody odwracalne względem jonów chlorkowych. np. chlorosrebrowa i kalomelowa.
Elektroda chlorosrebrowa, Ag/AgCl│KCl, jest drutem z czystego srebra pokrytym chlorkiem srebra
i zanurzonym w roztworze chlorku potasu. Na elektrodzie tej ustala się stan równowagi dla reakcji:
AgCl + e- ↔ Ag + Cl- (9)
Elektrodę kalomelową, Hg/Hg2Cl2│KCl, stanowi czysta rtęć z osadem Hg2Cl2 (kalomel) zanurzona
w nasyconym roztworze KCl. Na elektrodzie ustala się stan równowagi w reakcji:
Hg2Cl2 + 2e- ↔ 2Hg + 2Cl- (10)
Rys. 4. Elektroda kalomelowa
Dodatnie potencjały elektrochemiczne obydwu elektrod są dokładnie znane w funkcji temperatury
i stężenia chlorku potasu w elektrolicie. Elektrody chlorosrebrowa i kalomelowa są powszechnie stosowane w analizie chemicznej (miareczkowanie potencjometryczne) oraz jako elektrody odniesienia (zamiast elektrody wodorowej).
Elektrody (półogniwa) oksydacyjno -redukcyjne
Do roztworu, w którym ma miejsce reakcja utleniania i redukcji można zanurzyć blaszkę
z metalu szlachetnego, nie uczestniczącego w tej reakcji. Z reguły jest to blaszka platynowa, która uzyskuje pewien potencjał względem roztworu.
W ten sposób uzyskuje się elektrodę (półogniwo) oksydacyjno-redukcyjne i możliwość pomiaru elektrochemicznych potencjałów oksydacyjno-redukcyjnych. Reakcję potencjałotwórczą w można przedstawić ogólnym równaniem:
reduktor (red) ↔ utleniacz (oks) + ne-, (11)
a potencjał blaszki platynowej (Eoks/red) względem roztworu wyrazić równaniem Nernsta:
![]()
(12)
Rozpatrzmy dwie dobrze rozpuszczalne wodzie sole FeCl2 i FeCl3. Chlorek Fe(II) ma właściwości redukujące, natomiast chlorek Fe(III) wykazuje właściwości utleniające. Zgodnie z równaniem (11), reakcja redukcji jonów Fe3+ i reakcja utleniania jonów Fe2+ są ze sobą nierozerwalne sprzężone:
Fe2+ ↔ Fe3+ + e- (13)
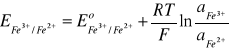
(14)
Standardowy potencjał oksydacyjny ![]()
= 0,76V.
W roztworach kwaśnych sole kwasu HMnO4, np. KMnO4, można zredukować do soli Mn(II),
z kolei sole Mn(II) można utlenić do soli kwasu HMnO4. W reakcji utleniania i redukcji uczestniczą jony wodorowe:
![]()
Mn2+ + 4H2O ↔ MnO4- + 8H+ + 5e- (15)
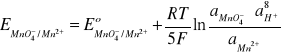
(16)
Standardowy potencjał chemiczny ![]()
= 1,52V.
Metale szlachetne mają wyższy potencjał elektrochemiczny od wodoru (tabela 1), dlatego nie roztwarzają się w kwasach pozbawionych właściwości utleniających, np. w kwasie solnym. Miedź, srebro i pallad roztwarzają się w roztworach kwasu azotowego(V), ponieważ redukcja anionów NO3- do tlenku azotu NO, ![]()
= 0,96V > ![]()
, umożliwia utlenienie ich do odpowiednich kationów: Cu2+, Ag+ i Pd2+:
NO3- + 4H+ + 3e- → NO + 2H2O (redukcja) (17)
Cu → Cu2+ + 2e- (utlenianie) (18)
Ag → Ag+ + e- (utlenianie) (19)
Pd → Pd2+ + 2e- (utlenianie) (20)
Reakcje sumaryczne:
3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O (21)
3Ag + NO3- + 4H+ = 3Ag+ + NO + 2H2O (22)
3Pd + 2NO3- + 8H+ = 3Pd2+ + 2NO + 4H2O (23)
Kwas azotowy(V) nie roztwarza złota i platyny, ponieważ potencjał ![]()
jest zbyt niski, aby skutecznie utlenić obydwa metale do stabilnych form jonowych. Jednak w wodzie królewskiej, czyli mieszaninie stężonych kwasów azotowego(V)
i solnego sporządzonej w stosunku objętościowym 1:3, potencjał redukcji jonów azotanowych(V) wystarcza do utlenienia obydwu metali do trwałych, anionowych chlorokompleksów Au(III) i Pt(IV):
NO3- + 4H+ + 3e- → NO + 2H2O (redukcja) (17)
Au + 4Cl- → AuCl4- + 3e- (utlenianie) (24)
Pt + 6Cl- → PtCl62- + 4e- (utlenianie) (25)
Reakcje sumaryczne
Au + NO3- + 4Cl- + 4H+ = AuCl4- + NO + 2H2O (26)
3Pt + 4NO3- + 18Cl- + 16H+ =
3PtCl62- + 4NO + 8H2O (27)
Ogniwa
Ogniwo jest układem dwóch półogniw zwartych przewodnikiem (obwód zewnętrzny) i oddzielonych od siebie porowatą przegrodą lub połączonych kluczem elektrolitycznym tak, aby umożliwić dyfuzję jonów jako nośników prądu w obwodzie wewnętrznym.
Rys. 5. Ogólny schemat ogniwa
W praktyce ogniwo można zbudować z dwóch dowolnie wybranych elektrod pod warunkiem, że ich potencjały są różne. Jak powiedziano wcześniej,
w ogniwie elektroda o niższym potencjale jest anodą,
natomiast elektroda o wyższym potencjale jest katodą. Ogniwo jest źródłem energii elektrycznej
w wyniku zachodzących reakcji elektrodowych.
Ważną cechą każdego ogniwa jest siła elektromotoryczna (SEM), która jest równa różnicy potencjałów katody i anody:
SEM = Ekatody - Eanody > 0 (28)
Przykłady
Ogniwo Daniella
Najprostszym przypadkiem są ogniwa zbudowane
z dwóch różnych elektrod metalicznych. Ogniwo Daniella: Zn│Zn2+║Cu2+│Cu (rys. 6) składa się
z cynkowej anody zanurzonej w roztworze ZnSO4
i miedzianej katody zanurzonej w roztworze CuSO4.
![]()
Rys. 6. Schemat ogniwa Daniella
Reakcje elektrodowe w ogniwie Daniella:
Anoda: Zn →Zn2+ + 2e- (utlenianie)
Katoda: Cu2+ + 2e- → Cu (redukcja)
-------------------------------------------------------------------------------------------------------------
Sumarycznie: Zn + Cu2+ → Zn2+ + Cu
SEM = 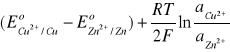
(29)
Gdy aktywności jonów Cu2+ i Zn2+ są równe, to SEM = 1,1V.
Ogniwa stężeniowe
Ogniwa stężeniowe są zbudowane z dwóch takich samych elektrod (półogniw), które różnią się stężeniem elektrolitu: M│[Mn+] = c1 ║[Mn+] = c2│M.
SEM = 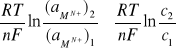
(30)
Reakcje elektrodowe w ogniwach stężeniowych:
Anoda: M → Mn+ + ne- (utlenianie)
Katoda: Mn+ + ne- → M (redukcja)
Obydwie reakcje powodują wzrost stężenia kationów Mn+ w elektrolicie anodowym i spadek ich stężenia
w elektrolicie katodowym. Po wyrównaniu stężeń
w obydwu elektrolitach, SEM = 0, ogniwo stężeniowe jest nieodwracalnie rozładowane i przestaje być źródłem prądu elektrycznego.
Ogniwa użytkowe i akumulatory
Ogniwo cynkowo-grafitowe Leclanche'a
Ogniwo wynalezione przez Leclanche'a (1866) jest tanim źródłem prądu stałego. Anodą ogniwa jest cynk, a pręt grafitowy katodą. Funkcję elektrolitu pełni wilgotna pasta sporządzona chlorków amonu
i cynku z dodatkiem dwutlenku manganu (MnO2).
Reakcje elektrodowe w ogniwie Leclanche'a
Anoda: Zn + 2NH3 → [Zn(NH3)]2+ + 2e-
Katoda: 2NH4+ + 2MnO2 + 2e- → 2NH3 + Mn2O3 + H2O
-------------------------------------------------------------------------------------------------------------
Sumarycznie:
Zn + 2NH4Cl + 2MnO2→[Zn(NH3)2]Cl2 + Mn2O3 + H2O
SEM = 1,5V
Wadą tego ogniwa jest stosunkowo szybkie rozładowanie.
Ogniwa zasadowe
W podstawowym typie ogniw zasadowych anodą jest cynk, a katodą ditlenek manganu z dodatkiem sproszkowanego węgla w celu poprawienia przewodnictwa. Elektrolitem jest roztwór NaOH lub KOH.
Reakcje elektrodowe
Anoda: Zn + 2OH- → ZnO + H2O + 2e-
Katoda: 2MnO2 + H2O + 2e- → Mn2O3 + 2OH-
--------------------------------------------------------------------------------------------------------------------------------------------------
Sumarycznie:
Zn + 2MnO2 → ZnO + Mn2O3
W ogniwie cynkowo-srebrowym anodą jest cynk, a katodą tlenek srebra, Ag2O. Podobnie jak poprzednio, elektrolitem jest roztwór NaOH lub KOH.
Reakcje elektrodowe
Anoda: Zn + 2OH- → ZnO + H2O + 2e-
Katoda: Ag2O + H2O + 2e- → 2Ag + 2OH-
Sumarycznie:
Zn + Ag2O → ZnO + 2Ag
Ogniwa i baterie zasadowe charakteryzuje znacznie wydłużony okres eksploatacji i większa pojemność elektryczna w porównaniu do innych źródeł prądu stałego. Wprowadzono je w drugiej połowie XX wieku z powodu rozwoju badań kosmicznych, potrzeb marynarki wojennej (atomowe okręty podwodne)
i błyskawicznego postępu w mikroelektronice.
Akumulatory
Akumulatory są źródłami prądu stałego,
w których reakcje elektrodowe są odwracalne. Rozładowany akumulator podczas operacji ładowania kumuluje energię elektryczną i ponownie nadaje się do pracy.
Akumulator ołowiowy składa się z ołowiowej katody i ołowiowej anody pokrytej ditlenkiem ołowiu, PbO2. Elektrolitem jest 20% roztwór kwasu siarkowego(VI). Naładowywany akumulator ma SEM około 2,2V. Eksploatacja akumulatora składa się
z naprzemiennych cykli rozładowania i ładowania,
w czasie których zachodzi następująca reakcja sumaryczna:
Pb + PbO2 + 2H2SO4 ↔ 2PbSO4 + 2H2O
W cyklu rozładowania reakcja ta zachodzi z lewa na prawo, w cyklu ładowania w kierunku odwrotnym.
W akumulatorze żelazowo-niklowym katodą jest płytka żelazna, a anodą wodorotlenek niklu(III). Elektrolitem jest roztwór KOH z dodatkiem LiOH. SEM naładowanego akumulatora wynosi około 1,3V. W cyklach rozładowania i ładowania tego akumulatora zachodzi reakcja sumaryczna:
2Ni(OH)3 + Fe ↔ 2Ni(OH)2 + Fe(OH)2
W trakcie rozładowania reakcja ta biegnie z lewa na prawo, a podczas ładowania w kierunku przeciwnym. Podobne działanie ma akumulator niklowo-kadmowy.
Akumulatory żelazowo-niklowe i niklowo-kadmowe są znacznie lżejsze od ołowiowego, co jest ich cenną zaletą.
Ogniwa paliwowe
Ogniwami paliwowymi nazywamy specjalny typ ogniw elektrochemicznych, w których energię spalania paliw stałych, ciekłych lub gazowych zamienia się bezpośrednio w energię elektryczną. Ogniwa paliwowe pracują w podwyższonych temperaturach wykorzystując np. wodór lub metan.
Ogniwo wodorowo-tlenowe jest szczególnie atrakcyjne ze względów ekologicznych, ponieważ finalnym produktem reakcji prądotwórczej jest czysta woda. Elektrody w tym ogniwie mogą być sporządzone ze sprasowanego i spiekanego proszku niklowego, a elektrolitem jest stężony roztwór KOH. Uproszczony schemat ogniwa wodorowo-tlenowego jest pokazany na rys. 8.
Rys. 8. Schemat ogniwa wodorowo-tlenowego
wodór, 2, 3 - obwód zewnętrzny, 4 - tlen, 5 - katoda,
6 - elektrolit, 7 - anoda, 8 - woda, 9 - jony OH- w elektrolicie
Reakcje elektrodowe w ogniwie wodorowo-tlenowym
Anoda: H2→ 2H+ + 2e-
Katoda: ½ O2 + H2O + 2e- → 2OH-
---------------------------------------------------------------------------------------------------------------
Sumarycznie: H2 + ½ O2 → H2O
W ogniwie paliwowym zasilanym metanem
i tlenem produktami reakcji prądotwórczej są ditlenek węgla i woda.
Reakcje elektrodowe
Anoda: CH4 + 2H2O → CO2 + 8H+ + 8e-
Katoda: 2O2 + 8H+ + 8e- → 4H2O
----------------------------------------------------------------------------------------------------------------------------------
Sumarycznie: CH4 + 2O2 → CO2 + 2H2O
Ogniwa paliwowe mają wysoką sprawność, która w przypadku ogniwa tlenowo-wodorowego sięga 70%. Zaletą tych ogniw jest bezgłośna praca,
a także brak lub bardzo niska emisja gazów toksycznych dla środowiska, np. SO2
i tlenków azotu.
ELEKTROLIZA
Z poprzedniej części wykładu wiemy, że energia samorzutnych reakcji chemicznych zachodzących
w ogniwach jest zamieniana na energię elektryczną. Odmienna sytuacja ma miejsce w procesie elektrolizy, gdy energia elektryczna doprowadzona
z zewnętrznego źródła prądu stałego wymusza reakcje chemiczne, które nie zachodzą samorzutnie, np. rozkład wody lub NaCl na pierwiastki:
2H2O = H2 + O2
2NaCl = 2Na + Cl2
UWAGA: Samorzutny przebieg procesów w ogniwach jest uwarunkowany ujemną wartością zmiany entalpii swobodnej (ΔG) reakcji chemicznych, ΔG < 0, oraz wartością siły elektromotorycznej, SEM > 0.
Elektrolizę prowadzi się w elektrolizerach, które od ogniw różnią się tym, że obydwie elektrody, np. metaliczne są zanurzone w tym samym roztworze elektrolitu. Kolejna istotna różnica polega na tym, że w elektrolizerze elektroda ujemna jest katodą,
a elektroda dodatnia anodą, jednak charakter reakcji elektrodowych jest taki sam jak w ogniwie, tzn. na anodzie zachodzi utlenianie, a na katodzie redukcja. Powyższe różnice i analogie są pokazane na rys. 9, gdzie elektrolizer jest zasilany prądem stałym pobieranym z ogniwa, oraz podsumowane
w tabeli 2.
Rys. 9. Elektrolizer zasilany z ogniwa galwanicznego
Tabela 2. Charakterystyka porównawcza ogniwa i elektrolizera
Porównywana cecha |
Ogniwo |
Elektrolizer |
Charakter procesu |
Samorzutny, ΔG < 0 |
Wymuszony, ΔG > 0 |
Elektroda dodatnia |
Katoda |
Anoda |
Elektroda ujemna |
Anoda |
Katoda |
Proces utleniania |
Na anodzie |
|
Proces redukcji |
Na katodzie |
|
Napięcie rozkładowe i potencjały elektrodowe
Aby zapoczątkować proces elektrolizy należy do elektrod przyłożyć pewne minimalne napięcie Ur, zwane napięciem rozkładowym
Ur = SEM + η, (31)
gdzie: SEM jest siłą elektromotoryczną ogniwa,
w którym w tych samych warunkach zachodzi reakcja odwrotna niż w procesie elektrolizy; η - suma nadnapięć anody (ηa) i katody (ηk). Nadnapięcie zależy od materiału elektrody i od właściwości wydzielanego pierwiastka (tabela 3).
Tabela 3. Nadnapięcie η (V) wydzielania wodoru, tlenu i metali
na różnych elektrodach
Symbol pierwiastka |
Elektroda |
|||||||||||||
|
Al. |
Zn |
Cr |
Fe |
Cd |
Ni |
Sn |
Pb |
Bi |
Cu |
Ag |
Hg |
Pt |
grafit |
H2 (pH<7) |
0,8 |
0,7 |
0,5 |
0,5 |
1,2 |
0,4 |
1,0 |
1,3 |
0,8 |
0,6 |
0,4 |
1,2 |
0,1 |
0,5 |
H2 (pH>7) |
0,4 |
0,4 |
|
0,2 |
|
0,4 |
0,8 |
0,9 |
0,5 |
|
|
1,3 |
0,1 |
|
O2 |
|
|
|
0,25 |
0,4 |
0,1 |
|
0,3 |
|
0,2 |
0,4 |
|
0,4 |
0,3 |
Zn |
|
0,2 |
|
|
0,55 |
|
|
|
|
0,4 |
|
|
0,5 |
|
Cr |
|
|
0,6 |
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
0,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
|
|
0,35 |
|
0,35 |
|
|
0,35 |
|
Co |
|
|
|
|
|
|
|
|
|
|
|
|
0,3 |
|
Ni |
|
|
|
|
|
0,6 |
|
|
|
|
|
0,6 |
|
|
Sn |
|
|
|
|
|
|
0,2 |
0,3 |
|
0,3 |
|
|
|
|
Pb |
|
|
|
|
|
|
|
0,2 |
0,12 |
0,02 |
|
|
|
|
Bi |
|
|
|
|
|
|
|
|
0,2 |
0,35 |
|
|
|
|
Cu |
|
|
|
|
|
|
|
|
|
0,2 |
|
|
0,3 |
|
Ag |
|
|
|
|
|
|
|
|
|
|
0,2 |
|
0,8 |
|
Napięcie rozkładowe można wyrazić jako sumę bezwzględnej wartości potencjału redukcji katodowej (Pk) i potencjału utleniania anodowego (Pa).
Ur = │Pk │+ Pa, (32)
gdzie:
![]()
(33)
![]()
(34)
Zależności (31) - (32) ilustruje poniższy schemat: większe napięcie.
Reguły przewidywania przebiegu elektrolizy
w roztworach wodnych
Podczas elektrolizy wodnych roztworów związków litowców, berylowców i glinu, nie można zredukować na katodzie kationów tych metali, dlatego na katodzie wydziela się wodór. Z kolei na anodzie nie można utlenić oksoanionów, np. BO2- CO32-, NO3-, PO43-, SO42-, ClO4-, w których atom pierwiastka kwasotwórczego (B, C, N, P, S) występuje na swoim maksymalnym stopniu utlenienia, dlatego na anodzie wydziela się tlen.
Podczas elektrolizy roztworów kwasów na katodzie wydziela się wodór. W trakcie elektrolizy roztworów zasad na anodzie wydziela się tlen.
Metal o wyższym potencjale elektrochemicznym niż glin wydziela się na katodzie podczas elektrolizy wodnych roztworów jego soli.
Za wyjątkiem anionu fluorkowego (F-), aniony innych kwasów beztlenowych, np. Cl-, Br-, I-, HS- i S2-, oraz oksoaniony, w których atom pierwiastka kwasotwórczego nie występuje na swoim maksymalnym stopniu utlenienia, np. NO2-, SO32-, ClO-, ClO2-, ClO3-, są utleniane na anodzie.
Jeśli w elektrolizowanym roztworze występuje równocześnie kilka rodzajów kationów i anionów, to
w pierwszej kolejności rozładowywane są kationy
o najwyższym potencjale redukcji katodowej
i aniony o najniższym potencjale utleniania anodowego.
Elektrolityczny rozkład wody
Znane z lekcji chemii w szkole doświadczenie rozkładu wody na pierwiastki w eudiometrze Hoffmana (rys. 10) polega na elektrolizie bardzo rozcieńczonych wodnych roztworów kwasów tlenowych, np. HNO3, zasad, np. NaOH, lub soli, np. NaCl. Woda jest dielektrykiem, dlatego niewielki dodatek mocnego elektrolitu ma na celu poprawę jej przewodnictwa.
W zależności od rodzaju elektrolitu reakcje na elektrodach mogą być różne, ale reakcja sumaryczna jest zawsze rozkładem wody na wodór
i tlen, których objętości są w stosunku 2:1.
Reakcje elektrodowe:
Rozcieńczony roztwór kwasu
Anoda: 2H2O → 4H+ + O2 + 4e- (utlenianie)
Katoda: 4H+ + 4e- → 2H2 (redukcja)
Rozcieńczony roztwór zasady
Anoda: 4OH- → 2H2O + O2 + 4e- (utlenianie)
Katoda: 4H2O + 4e- → 2H2 + 4OH- (redukcja)
Rozcieńczony roztwór soli
Anoda: 2H2O → 4H+ + O2 + 4e- (utlenianie)
Katoda: 4H2O + 4e- → 2H2 + 4OH- (redukcja)
--------------------------------------------------------------------------------------------------------------------------------------------------
Sumarycznie : 2H2O → 2H2 + O2
Rys. 10. Elektrolityczny rozkład wody w eudiometrze Hoffmanna
Synteza wody jest reakcją prądotwórczą w ogniwie:
Pt│O2 (p = 101,3 kPa)│OH-║H+│H2 (p = 101,3 kPa)│Pt .
Z równania (8) wynika, że potencjał elektrody wodorowej zależy od pH:
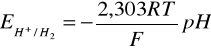
(35)
Wzór Nernsta na potencjał elektrody tlenowej jest następujący:
![]()
(36)
![]()
(37)
SEM tego ogniwa nie zależy od pH i w temperaturze 25oC wynosi 1,229V. Na podstawie wzoru (31) oraz danych z tabeli 3 możemy obliczyć napięcie rozkładowe wody w elektrolizerze z elektrodami platynowymi:
Ur = 1,23 + 0, 1 + 0,5 = 1, 83V (38)
Elektroliza NaCl
Sód jako metal bardzo aktywny chemicznie wypiera wodór z wody. Oznacza to, że sodu oraz innych metali wykazujących tę właściwość (litowce, berylowce, glin) nie można wydzielić elektrolitycznie z wodnych roztworów ich związków. Jest to możliwe wyłącznie na drodze elektrolizy stopionych soli.
Elektrolizę NaCl w stopionych solach (600oC) prowadzi się w elektrolizerze z żelazną katodą
i grafitową anodą.
Katoda: 2Na+ + 2e- → 2Na (redukcja)
Anoda: 2Cl- → Cl2 + 2e- (utlenianie)
Sumarycznie: 2NaCl → 2Na + Cl2
Elektroliza NaCl w stężonych roztworach wodnych ma inny przebieg. Na elektrodach platynowych wydzielają się odpowiednio wodór i chlor, a produktem powstałym w roztworze po elektrolizie jest wodorotlenek sodu.
Anoda: 2Cl- → Cl2 + 2e- (utlenianie)
Katoda: 2H2O + 2e- → H2 + 2OH- (redukcja)
Sumarycznie: 2NaCl + 2H2O = 2NaOH + Cl2 + H2
Obydwa procesy elektrolizy NaCl są stosowane
w praktyce na skałę przemysłową.
Elektrolityczne otrzymywanie aluminium
W hutach aluminium 15-20% roztwór Al2O3
w stopionym kriolicie (Na3AlF6) poddaje się elektrolizie w temperaturze 900-1000oC. W tych warunkach tlenek glinu dysocjuje w stopie na kationy Al3+ i aniony tlenkowe O2-. Katodą jest węglowa wykładzina elektrolizera, anodą jest blok grafitowy.
Anoda: 3C + 3O2- → 3CO + 6e- (utlenianie)
Katoda: 2Al3+ + 6e- → 2Al (redukcja)
Sumarycznie: Al2O3 + 3C → 2Al + 3 CO
Elektrorafinacja miedzi i niklu
Miedź i nikiel otrzymywane w dużej skali przemysłowej metodą hutniczą są zazwyczaj zanieczyszczone domieszkami innych metali, a także pierwiastkami niemetalicznymi pogarszającymi ich cechy użytkowe, np. właściwości mechaniczne niklu,
przewodnictwo elektryczne miedzi. Do szczególnie cennych domieszek metalicznych, które w procesie hutniczym koncentrują się w obydwu metalach, należą metale szlachetne: srebro, złoto, platynowce. Spośród domieszek niemetalicznych na uwagę zasługują selen i tellur. Uzyskanie wysokiej czystości miedzi i niklu oraz wydzielenia półproduktu zawierającego atrakcyjne domieszki uzyskuje się metodą elektrorafinacji.
Z miedzi lub niklu uzyskanych metodą hutniczą odlewa się anody. Katody sporządza się z cienkich blach z najczystszej miedzi lub niklu. Elektrolitem
w procesach elektrorafinacji są roztwory siarczanu(VI) miedzi(II) lub niklu(II) w kwasie siarkowym.
W trakcie elektrorafinacji anoda z miedzi lub niklu powoli roztwarza się w elektrolicie, na katodzie wydziela się czysty metal, natomiast domieszki wytrącają się w postaci wieloskładnikowego osadu, tzw. zwanego szlamu anodowego.
Anoda: M → M2+ + 2e-
Katoda: M2+ + 2e- → M
Prawa Faradaya
Michael Faraday (1791 - 1867),
fizyk i chemik angielski, profesor Uniwersytetu w Oxfordzie
I prawo elektrolizy: Masa (m) substancji wydzielonej na elektrodzie jest wprost proporcjonalna do ładunku Q przeniesionego podczas elektrolizy przez elektrolit. |
m = kQ = kit, (39)
gdzie ładunek Q (wyrażony w kulombach) jest równy iloczynowi natężenia prądu w amperach
i czasu trwania elektrolizy sekundach. Współczynnik proporcjonalności k zależy od masy molowej (M) wydzielonego produktu oraz liczby elektronów n
w równaniu reakcji elektrodowej:
![]()
(40)
Jeżeli ładunek Q = F = 96485 C, to masa produktu jest równa m = M/n, np.:
![]()
![]()
![]()
![]()
![]()
![]()
II prawo elektrolizy:
Masy produktów wydzielonych z elektrolitów przez biorących udział w odpowiednich reakcjach elektrodowych. |
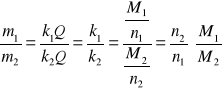
(41)
KOROZJA METALI
Korozja jest to szereg samorzutnych procesów chemicznych, elektrochemicznych i biologicznych, prowadzących do niszczenia metali, wyrobów, produktów i konstrukcji metalowych pod wpływem różnych bodźców ze strony środowiska, np. dużej wilgotności i zanieczyszczenia powietrza, kwaśnych deszczy, zanieczyszczenia wód powierzchniowych, zakwaszenia gleby, rozkładu materii pochodzenia organicznego przez mikroorganizmy.
Najłatwiej korodują metale nieszlachetne, ale
w niekorzystnych warunkach korozji ulegają również takie metale, jak miedź. Korozja jest przyczyną strat w gospodarce narodowej. Jednak największe straty ekonomiczne powoduje korozja żelaza i stali, które w skali globalnej są materiałami o podstawowym znaczeniu.
Korozja chemiczna jest spowodowana przez wszelkie reakcje utleniania metali i ich stopów, zachodzące bez udziału procesów elektrodowych. Są to reakcje metali z suchymi gazami, np. z tlenem atmosferycznym, CO2, H2S, SO2, tlenkami azotu, zwłaszcza w podwyższonych temperaturach.
W zwykłych warunkach korozja chemiczna zachodzi stosunkowo rzadko, a najczęściej ma miejsce
w przemyśle chemicznym.
Korozja elektrochemiczna jest spowodowana przez krótko zwarte mikroogniwa galwaniczne, powstające przy dostępie wilgotnego powietrza
i zanieczyszczeń o charakterze elektrolitów do miejsc o niejednorodnej powierzchni metali lub stopów. Mikrogniwa korozyjne mogą być zlokalizowane na nierównościach powierzchni metalu lub stopu, miejscach o nierównomiernym rozkładzie składników stopu, połączeniach nitowanych, lutowanych lub spawanych oraz w obszarach naprężeń mechanicznych.
Rys. 11. Ogniwo korozyjne w obszarze naprężeń mechanicznych
Elektrochemiczna korozja metalu jest procesem anodowym sprzężonym z procesem katodowym. Procesy korozji metalu zachodzą etapowo.
W pierwszym etapie metal z anody przechodzi do roztworu w postaci kationów, a na katodzie tlen jest redukowany do jonów hydroksylowych. Kationy metalu ulegają serii reakcji wtórnych i tworzą trudno rozpuszczalne osady, np. finalnym produktem elektrochemicznej korozji żelaza jest rdza (rys.12).
Rys. 12. Elektrochemiczna korozja żelaza
Anoda: Fe→ Fe2+ + 2e- ; Katoda: 1/2O2 + H2O + 2e- → 2OH-
Fe2+ + 2OH- → Fe(OH)2
![]()
Fe(OH)2 ![]()
Fe(OH)3
2Fe(OH)3 → Fe2O3·3H2O (rdza)
Wzrost temperatury powoduje wzrost szybkości reakcji chemicznych. Z tego powodu, nawet nieduże podwyższenie temperatury jest niekorzystne, ponieważ przyspiesza procesy korozyjne.
Ochrona przed korozją
Istnieje kilka sposobów ochrony przed korozją. Pierwszy z nich polega na zastosowaniu inhibitorów, tzn. substancji hamujących postęp procesów korozji chemicznej lub elektrochemicznej. Drugi sposób to zastosowanie rożnego rodzaju powłok ochronnych:
● nieorganicznych, np. pokrycie Fe minią (Pb3O4);
● organicznych, np. farby, lakiery, tworzywa sztuczne;
● powłoki metaliczne (rys. 13):
a) z metalu bardziej nieszlachetnego, np. Zn/Fe,
b) z metalu bardziej szlachetnego, np. Cu/Fe.
Rys. 13. Zastosowanie powłok metalicznych do ochrony żelaza przed korozją:
a) powłoka cynkowa, nawet uszkodzona, skutecznie zapobiega
elektrochemicznej korozji żelaza, które pełni funkcję katody;
b) zwarta powłoka miedziowa chroni żelazo przed korozją.
Wszelkie uszkodzenia tej powłoki przyśpieszają proces
elektrochemicznej korozji żelaza, które w powstałym ogniwie
jest anodą.
● ochrona elektrochemiczna
a) ochrona anodowa - chroniony obiekt łączy się
przewodem z płytą z metalu mniej szlachetnego;
b) ochrona katodowa - chroniony obiekt łączy się
z biegunem ujemnym źródła prądu stałego
o niskim napięciu, np. akumulatorem.
Wyszukiwarka
Podobne podstrony:
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
Elektrody, CHEMIA, semestr 1, chemia ogólna, wykłady
chemia organiczna wykład 6
Chemia medyczna wykład 1
Chemia fizyczna wykład 11
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
Chemia ogolna wyklady 5 6 2012 Nieznany
chemia analityczna wyklad 11 i 12
chemia fizyczna I wykład(1)
Chemia organiczna wykłady całość(1)
Chemia żywności wykład 7
chf wykład 6, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 10
Chemia fizyczna wykład 4
Chemia ogólna wykład 2 2012
CAŁOŚĆ elektrodyka, Chemia Fizyczna, Fizyczna - koła, Kolokwium Fizyczna Roszak Lipkowski, 1Kolokwiu
więcej podobnych podstron