skrypt wzory i prawa z objasnieniami68

■ Prawo Maawdla rozkładu prędkości cząsteczek opisuje rozkład prędkości .-/ąsicczck gazu doskonałego pozostającego w równowadze terroodymmicznej, na którv r.ic dziaują ładne siły zewnętrzne. Rozkład len ustala się w wyniku zderzeń między cząsteczkami w ich bezładnym ruchu cieplnym.
■ Na rysunku po prawej stronic przedstawiono prostokątny układ współrzędnych V; ,v | i v.- (składowe wektora prędkości cząsteczki gazu doskonałego i Prędkości każdej cząsteczki odpowiada punkt na rysunku.
Punkty, które wyobrażają prędkości cząsteczek z przedziału od v do v ł dv, są zawarte między sferami o promieniach v i v + dv Objętość tego obszaru wynosi 4nv2dv Liczbę cząsteczek, których prędkości są zawarte w przedziale (v. v + dv) można przedstawić
jako dA\ = ^vj4itv,2dv, gdzie fly) = exp| |. o ,V jesi liczbą
wszystkich cząsteczek. Powyższy wzór można również przedstawić w postaci d.Vv =• \/ tv)dv. Wielkość F\v) =/(v)4nv*jcst funkcją rozkłada prędkości cząsteczek gazu i je.t przedstawiona po prawej stronic Prawdopodobieństwo tego, że prędkość danej
cząs cc/ki jest z przedziału od V do v + dv wynosi d/*v - ~- /’’(v)dv.
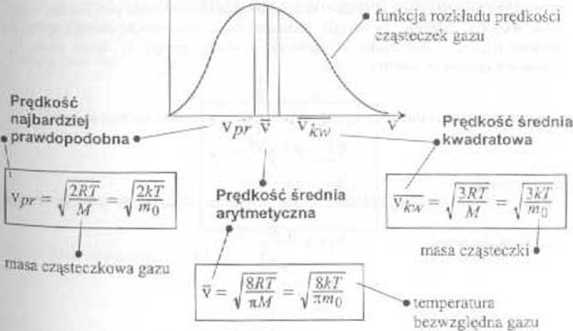
■ Okazuje się, ze każdej temperaturze gazu odpowiada wartość pręckośct cząsteczek v r, tuka, że prędkością tą t do niej zbliżonymi jest obdarzona największa liczba cząsteczek
• Ir ego prędkość tą nazywany prędkością najbardziej prawdopodobną Można ją wyznaczyć ze wzorów 73 W tym celu należy wykorzystać warunek dla maksimum funkcji £Tv):
r /"
Rozwiązanie lego równania ma postać
v , Im
'/» c i «o •
■ Korzysiają; z funkcji rozkładu można obliczyć prędkość średnią (prędkość średną arytmetyczną), czyli sumę prędkości wszystkich cząsteczek podzielić przez ich ilość
Wf\v)v dv
ML
i**o
JydA\
.V
Średni kwadrat prędkości można natomiast znaleźć z zależności podanej dla kinetycznej teorii guzów £j=^y-^|Af (srr. 132,133), skąd otrzymujemy prędkość średnią kwadratową
u wychodząc z rozkładu prędkości cząsteczek można określić rozkład cnergU kinetycznej mchu postępowego cząsteczek. Podstawiając do wzorów < v-(2Et'mo) :'aTXL dv-(2wq£*)"‘ 'd£* otrzymujemy wzór na liczbę cząs*xczck. których energia kinetyczna ruchu postępow ego jest w przedziale od £j do Ł\ - d£
dNs = -jź) ~3/2«*P (-
73. Rozkład Maxwella
cząsteczka o prędkości zawartej w przedziale (v. v + dv)
sfera o promieniu v _ _ // ^ j
s*'cni o promieniu v + dv*— 1 •/* * • #H >
v.<* * J s'y
liczba wszystkich cząsteczek
liczba cząsteczek, których prędkości
są zawarte w przedziale * V* • • od v do vtdv
fdLVv = NF(\) dv
• masa cząsteczKi gazu
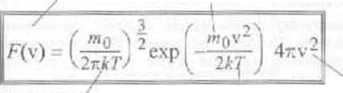
stała Bollzmanna* temperatura bezwzględna gazu cząsteczki 2azu A = 1,38 10 ^J/K
funkcja rozkładu prędkości cząsteczek gazu
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami68 134Rozkład Maxwella ■ Prawo Mas w dla rozkł
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
skrypt wzory i prawa z objasnieniami25 Pole sił zachowawczych (potencjalnych) ■ Jeśli w każdym punkc
skrypt wzory i prawa z objasnieniami37 72Moment bezwładności ■ Moment bezwładności
skrypt wzory i prawa z objasnieniami38 74 Ruch obrotowy ciała ■ Jak wynika z własności iloczynu wekt
skrypt wzory i prawa z objasnieniami49 96 Składanie drgań ■ Przy składaniu drgań o
skrypt wzory i prawa z objasnieniami50 ■ W naszym przypadku częstości drgań wzajemnie prostopadłych
skrypt wzory i prawa z objasnieniami58 114 Zasady zachowania energii i pędu ■ Musimy pamiętać, że w
skrypt wzory i prawa z objasnieniami62 122 Przemiany stanu gazu doskonałego ■ W tr
skrypt wzory i prawa z objasnieniami63 124 Przemiany stanu gazu doskonałego ■ W pr
więcej podobnych podstron