larsen0274
274 I Podstawy farmakologiczne i fizjologiczne
1.1 Kwasy i zasady
Według Bronstedta kwasy i zasady definiowane są w następujący sposób:
- Kwasy są to cząsteczki lub jony, które w roztworze wodnym mogą oddawać jony H+ lub protony. Kwasy są więc donorami protonów.
- Zasady są to cząsteczki lub jony, które w roztworze wodnym mogą przyłączać jony H+ lub protony, są więc akceptorami protonów.
Wszystkie aniony są zasadami, gdyż posiadają jedną lub więcej par elektronów i dlatego mogą przyłączać protony. Po przyłączeniu protonu przez anion (A-) powstaje kwas (HA). Kwasy w roztworze wodnym dysocjują na anion i proton:
A- + H+ = HA.
1.2 Równanie Hendersona--Hasselbalcha
Według Hendersona wszystkie jony H+ pochodzą z kwasów (HA), a wszystkie aniony z soli. Określa to następujący wzór na stężenie jonów H+:
|
Tabela 13.1. Związek między wartościami pH a stężeniem jonów wodorowych | |
|
pH |
HH (nmol/ł) |
|
7,36 |
44 |
|
7,37 |
43 |
|
7,38 |
42 |
|
7,39 |
41 |
|
7,40 |
40 |
|
7,41 |
39 |
|
7,42 |
38 |
|
7,43 |
37 |
|
7,44 |
36 |
- nerkowe wydalanie jonów wodorowych: regulacja metaboliczna,
- wątroba: neutralizacja wodorowęglanów.
1.3.1 Buforowanie
Bufory są to układy słabych kwasów z mogącymi je wiązać zasadami. Jeżeli do tego układu doda się jony H+, to bufor je przyłączy, jeżeli doda się zasadę, to bufor uwolni jony H+ (ryc. 13.1).
Dzięki temu buforowemu mechanizmowi stężenie jonów H+ utrzymywane jest w obrębie określonych granic. Procesy buforowania prze-
(K - stafa dysocjacji kwasu)
Im wyższa K, tym silniejszy kwas. Przekształcenie tego równania w formę ujemnego logarytmu dziesiętnego daje równanie Hendersona-Hasselbal-cha:
pH = pK + log —— (lub --)
[HA] kwas
(pK - ujemny logarytm dziesiętny z K).
Przesunięcie o 0,01 jednostki pH odpowiada zmianom całkowitego stężenia jonów I-ł+ w danym przypadku o 1 nmol/1 (tab. 13.1).
1.3 Regulacja stężenia jonów H+
Stężenie jonów H+, względnie wartości pH, są utrzymywane w stałych granicach przez następujące trzy mechanizmy regulujące:
- natychmiastowe buforowanie w płynie zewnątrz- i wewnątrzkomórkowym,
- wydalanie lotnego kwasu C02 przez płuca: regulacja oddechowa,
|
tkanki pH 6,9 | ||
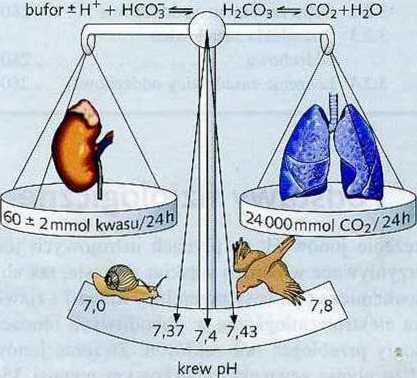
Ryc. 13.1 Drogi eliminacji oraz bilans dla C02 i dla jonów H+ kwasów są wprawdzie w gospodarce kwasowo-zasadowej całkowicie od siebie oddzielone, ale łączą się one jednak ze sobą poprzez układy buforowe. Można tutaj wyróżnić szybko działający bufor (płuca) i wolno reagujący bufor (nerki), (Matthys, 1988; zmodyfikowano).
Wyszukiwarka
Podobne podstrony:
larsen0012 12 I Podstawy farmakologiczne i fizjologiczne 12 I Podstawy farmakologiczne i fizjologicz
larsen0014 14 I Podstawy farmakologiczne i fizjologiczne tycznych i ich wewnętrznej aktywności. Tę w
larsen0016 16 I Podstawy farmakologiczne i fizjologiczne leżności od ukrwienia wątroby, ale wpływają
larsen0018 18 I Podstawy farmakologiczne i fizjologiczne 5.1.1 Powtarzane wstrzykn
larsen0020 20 I Podstawy farmakologiczne i fizjologiczne czas do spadku do 50% [min] czas trwania in
larsen0022 22 I Podstawy farmakologiczne i fizjologiczne 7.3.9 Wątroba.......................45 7.3.
larsen0024 24 I Podstawy farmakologiczne i fizjologiczne Tabela 3.2 Właściwości stosowanych anestety
larsen0026 26 I Podstawy farmakologiczne i fizjologiczne pary) w dwóch fazach, które znajdują się w
larsen0028 28 I Podstawy farmakologiczne i fizjologiczne w ciągu 10-15 minut. Różnica ciśnień parcja
larsen0034 34 I Podstawy farmakologiczne i fizjologiczne nła wziewnego, dalsze podawanie fentanylu w
larsen0036 36 I Podstawy farmakologiczne i fizjologiczne Margines bezpieczeństwa anestetyków wziew-n
larsen0038 38 I Podstawy farmakologiczne i fizjologiczne czyń nie odgrywa w spadku ciśnienia istotne
larsen0040 40 I Podstawy farmakologiczne i fizjologiczne dy” podaje, że martwica taka występuje po 7
larsen0042 42 I Podstawy farmakologiczne i fizjologiczne7.2.8 Wątroba Ukrwienie wą
larsen0044 44 I Podstawy farmakologiczne i fizjologiczne Pojemność minutowa serca. Wyniki obserwacji
larsen0046 46 I Podstawy farmakologiczne i fizjologiczne Właściwości desfluranu: -
larsen0048 48 I Podstawy farmakologiczne i fizjologiczne BU pacjentów z wyraźną klinicznie chorobą n
larsen0050 50 I Podstawy farmakologiczne i fizjologiczne7.4.13 Zastosowanie kliniczne Istotnymi zale
larsen0052 52 I Podstawy farmakologiczne i fizjologiczne Z powodu niskiego współczynnika rozdziału k
więcej podobnych podstron