114

A HibUl. IM1U.1 .Vv»i r„, r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS »*}
IU
4 BUDOWA CZĄSTECZKI
Łatwo zauważyć, żc dzięki utworzeniu wspólnych par elektronowych każdy z atomów w cząsteczkach CCK i PCK uzyskuje pełny oktet elektronowy. Wyjątek stanowi wodór, dla którego trwałą konfiguracją elektronową jest konfiguracja helu. a więc nic oktet. lecz dublet elektronowy (2 elektrony). Oktet elektronowy, u w przypadku wodoru dublet, nie stanowią bynajmniej jedynych trwałych konfiguracji w cząsteczkach kowalencyjnych Jako przykłady wystarczy podać bardzo trwałe cząsteczki PCK lub SF*. którym przypisujemy wzory:
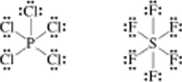
wskazujące na utworzenie układu 10-clckUonowcgo wokół atomu fosforu i 12-clck-tronowego wokół atomu siarki Tego rodzaju układy pojawiają się tylko w przypadku pierwiastków rozporządzających wolnymi orbitalami <1 w powłoce walencyjnej, nic pojawiają się natomiast w przypadku pierwiastków pierwszego i drugiego okresu układu periodycznego, a więc wówczas, gdy atom centralny w powłoce walencyjnej ma tylko orbitale Is lub Ir i 2p.
Za wykorzystaniem orbitali d do tworzenia wiązań kowalencyjnych, zwłaszcza w przypadku oksokwasów, takich jak kwas siarkowy, kwas fosforowy czy kwas nadchlorowy. przemawia następujące rozumowanie Dla każdego z tych kwasów można zaproponować wzór elektronowy, wzór I.cwisa, w którym spełniona będzie reguła oktetu Dla kwasu siarkowego na przykład będzie on mieć postać:
o
II-O S O-ll
o
Konsekwencją takiego wzoru, często podawanego w dawniejszej literaturze, jest jednak zgromadzenie nadmiernego elektrycznego ładunku dodatniego na atomie starki Atom len w stanic elektrycznie obojętnym ma bowiem 6 elektronów walencyjnych. W cząsteczce ILSCL jest natomiast otoczony czterema parami elektronowymi dzielonymi wspólnie z czterema atomami tlenu, „przynależą" więc do niego tylko cztery elektrony. Formalnie biorąc, należy mu więc przypisać ładunek F2r. Równocześnie dwa spośród atomów tlenu związanych z atomem siaiki (atomy tlenu nie tworzące grup OH), korzystając ze wspólnych par elektronowych, „zyskują” niejako po 1 elektronie, zyskują po -c. Możemy to zaznaczyć
II O
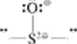
O II
O:
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 44
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 62
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} i
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 30
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 36
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 42
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © l>. WN TOS >«} 21
A HibUl. IM1U.1 .Vvu r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 333
A HibUl. IM1U.1 .Vvu r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 1.4
A HibUl. IM1U.1 .Vv»i r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 3 I D
A HibUl. IM1U.1 .Vv»i r„, r ), buui :uO ISBN D4H1II *?. © l>. »N TOS >«} 57
A HibUl. IM1U.1 ,Vvu r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 1
A HibUl. IM1U.1 .Vv»i r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 122
A HibUl. IM1U.1 .Vvu r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 228
A HibUl. IM1U.1 .Vvu r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 30A
A HibUl. IM1U.1 .Vv»i r„, r ), buui :uO ISBN D4H1II ł-). © l>. »N TOS »*} 332
A HibUl. IM1U.1 ,Vv»i r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 39
więcej podobnych podstron