329
A HibUl. IM1U.1 .Vvu r.», r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS »*}
10 11 ROZTWORY CIAŁ STAŁYCH W CIECZACH 329
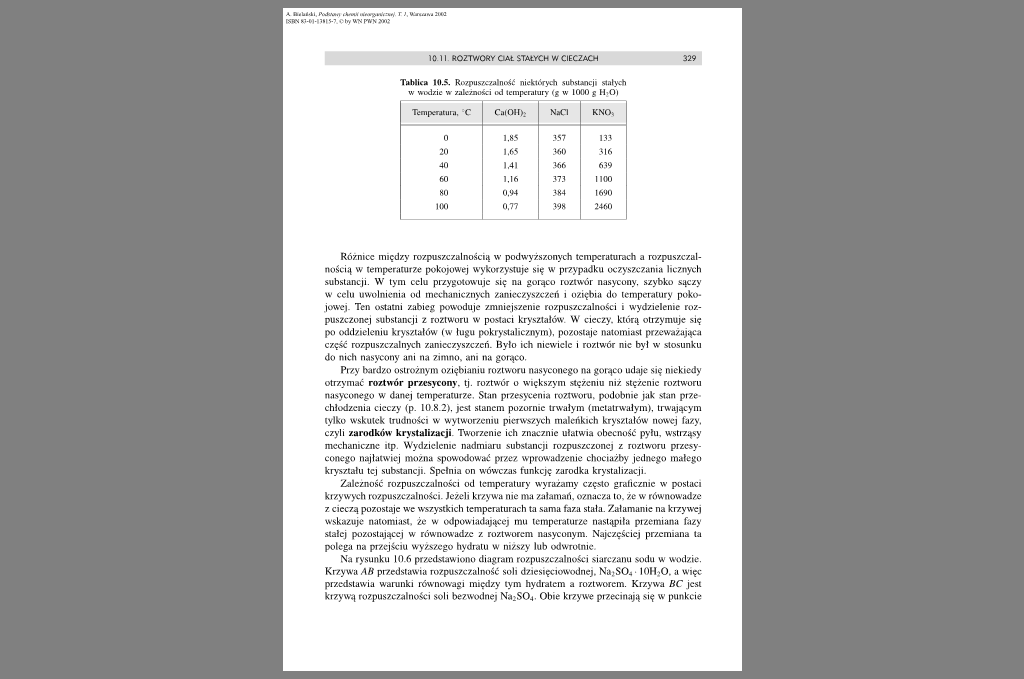
Tablica 10.5. Rozpuszczalność nickrórydi substancji stałych w wodzie w zależności od lempcralury <g w 1000 g Hi O)
|
Temperatura. C |
CaiOtI>: |
NjCI |
KNOi |
|
0 |
1.85 |
357 |
133 |
|
20 |
1.65 |
360 |
316 |
|
40 |
Ml |
366 |
639 |
|
60 |
1.16 |
373 |
1100 |
|
KO |
0.94 |
384 |
1690 |
|
100 |
0.77 |
398 |
2460 |
Różnice między rozpuszczalnością w podwyższonych temperaturach a rozpuszczalnością w temperaturze pokojowej wykorzystuje się w przypadku oczyszczania licznych substancji. W tym celu przygotowuje się na gorąco roztwór nasycony, szybko sączy w celu uwolnienia od mechanicznych zanieczyszczeń i oziębia do temperatury pokojowej. Ten ostatni zabieg powoduje zmniejszenie rozpuszczalności i wydzielenie rozpuszczonej substancji z roztworu w postaci kryształów W cieczy, którą otrzymuje się po oddzieleniu kryształów (w ługu pokrystalicznym), pozostaje natomiast przeważająca część rozpuszczalnych zanieczyszczeń. Było ich niewiele i roztwór nic był w stosunku do nich nasycony ani na zimno, ani na gorąco.
Przy bardzo ostrożnym oziębianiu roztworu nasyconego na gorąco udaje się niekiedy otrzymać roztwór przesycony, tj. roztwór o większym stężeniu niż stężenie roztworu nasyconego w danej temperaturze. Stan przesycenia roztworu, podobnie jak stan prze chłodzenia cieczy (p. 10.8.2). jest stanem pozornie trwałym (metatrwałym). trwającym tylko wskutek trudności w wytworzeniu pierwszych maleńkich kryształów nowej fazy. czyli zarodków krystalizacji Tworzenie ich znacznie ułatwia obecność pyłu, wstrząsy mechaniczne itp. Wydzielenie nadmiaru substancji rozpuszczonej z roztworu przesyconego najłatwiej można spowodować przez wprowadzenie chociażby jednego małego kryształu tej substancji. Spełnia on wówczas funkcję zarodka krystalizacji.
Zależność rozpuszczalności od temperatury wyrażamy często graficznie w postaci krzywych rozpuszczalności. Jeżeli krzywa nie ma załamań, oznacza to, że w równowadze z cieczą pozostaje we wszystkich temperaturach ta sama faza stała. Załamanie na krzywej wskazuje natomiast, że w odpowiadającej mu temperaturze nastąpiła przemiana fazy stałej pozostającej w równowadze z roztworem nasyconym. Najczęściej przemiana ta polega na przejściu wyższego hydratu w niższy lub odwrotnie
Na rysunku 10.6 przedstawiono diagram rozpuszczalności siarczanu sodu w wodzie. Krzywa Ali przedstawia rozpuszczalność soli dziesięciowodnej. Na-SOj 10lł-O. a więc przedstawia warunki równowagi między tym hydratem a roztworem. Krzywa HC jest krzywą rozpuszczalności soli bezwodnej Na>S04. Obie krzywe przecinają się w punkcie
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 .Vvu .•»•»»«. :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 8 10 EL£IORO
A HibUl. IM1U.1 .Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 10 8
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 15 11 R
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 E
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3.5 Oft
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 67 3 5
więcej podobnych podstron