379
A HibUl. IM1U.1 .Vvu :i>, r ), buui :uO
ISBN D4H1II 1-7. © l>. »N TOS »*}
12 5 POTENCJAŁY STANDARDOWE I SZEREG NAPIĘCIOWY PIERWIASTKÓW 379
Pomiar potencjału dowolnej elektrody, np. elektrody metalicznej zanurzonej w roztworze własnych jonów tego metalu, dokonywany wobec elektrody wodorowej jest rów-noznaezny z pomiarem siły elektromotorycznej ogniwa:
Pi.H:|H,0‘(<jh,„. = l>||M"‘(nM«.)|M E — Em. - £,7\'»|. =
gdyż E^. = 0. Jeśli znamy wartość £m--/m w skali wodorowej oraz aktywność jonów
M"'. to z wzoru (12.13)
RT
£\r-,w ■ £"«- u + .. In ovi-•
ir»r
możemy obliczyć wartość E^.. iM w skali wodorowej. Nosi ona nazwę potencjału standardowego W analogiczny sposób, posługując się równaniami (12.9) i (12.15). znaj dujemy potencjały standardowe elektrod redoks. E^.ltd. i gazowych. wyrażone
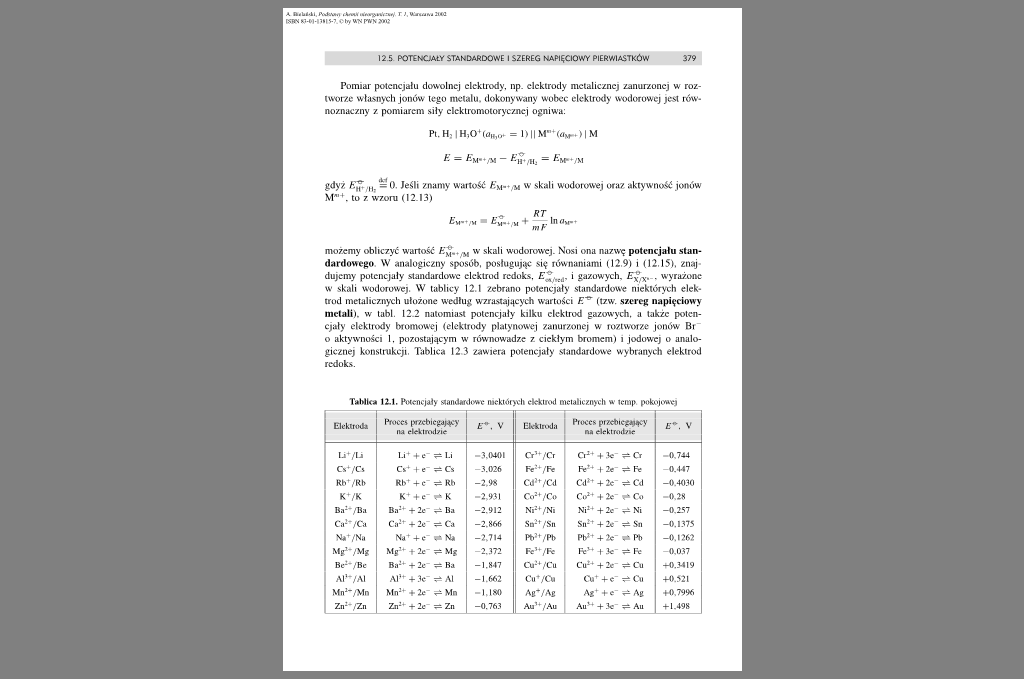
w skali wodorowej. W tablicy 12.1 zebrano potencjały standardowe niektórych elektrod metalicznych ułożone według wzrastających wartości F.~ (tzw. szereg napięciowy metali i. w tabl. 12.2 natomiast potencjały kilku elektrod gazow ych, a także potencjały elektrody bromowej (elektrody platynowej zanurzonej w roztworze jonów Bi o aktywności 1. pozostającym w równowadze z. ciekłym bromem) i jodowej o analogicznej konstrukcji. Tablica 12 3 zawiera potencjały standardowe wybranych elektrod redoks.
Tablic* 12.1. Potencjały standardowe niektórych elektrod metalicznych w temp pokojowe)
|
Elekliodi |
Proccr przebiegający na elektrodzie |
£*. V |
Elektroda |
Proce* przebiegający na dekmdńe |
E*. V |
|
U'/Li |
U++e- 5* Li |
-3.0401 |
Crł'/Cr |
Ci2* + 3e* 5= Cr |
-0.744 |
|
Cs' /Ci |
Ci* + c = Cs |
-3.026 |
Fe2' /Fe |
Fe’* + 2e= Fe |
-0.447 |
|
Rb* /Rb |
Rb* + c_ sa Rb |
-2.9* |
Cd!,/Cd |
Cd2* + 2c‘ aa Cd |
-0.4030 |
|
K'/K |
K* +e- K |
-2,931 |
Co2*/Co |
Co2* +2e‘t* Co |
-0.28 |
|
Ba2*/Ba |
Ba2*' +■ 2e~ sA Ba |
-2.912 |
Ni2* /Ni |
Ni2* +2c- sa Ni |
-0.257 |
|
Ca2*/Ca |
Ca2* + 2c~ — Ca |
-2.866 |
Sn2'/Sn |
Sn2* + 2o sa Sn |
-0.1375 |
|
N*'/Na |
Na ’ + c~ o* Na |
-2.714 |
Pb!,/Pb |
Pb^+2e" •* Pb |
-0.1262 |
|
Mg5'/Mg |
Mg2' + 2e~ as Mg |
-2.372 |
Fe’* /Fe |
Fe'* + 3e- sa Fe |
-0.037 |
|
Bc;/Bc |
Ba2' +■ 2e~ sa Ba |
-1.847 |
CU2‘/Cu |
Cu2* + 2e- sa Cu |
+0.3419 |
|
Al’*/AI |
Al‘* + 3«- Al |
-1.662 |
Cu’/Cu |
Oi* 4-c ‘ s+Cu |
+0.521 |
|
Mn2*/Mn |
Mn2* + 2c^s Mn |
-1,1*0 |
Ag*/Ag |
Ag* +e- ^a Ag |
+0.7996 |
|
Zn; * /Zn |
Zn2' +2e- =Zn |
-0.763 |
Au'* /Au |
Au** + 3e- sa Au |
+ 1.498 |
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu .•»•»»«.--u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 7 12 TEORIA PAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 7 12 TE
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 12
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 12
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS »*} 12 5 POTEN
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 E
więcej podobnych podstron