Ch koordynacyjna II (1)
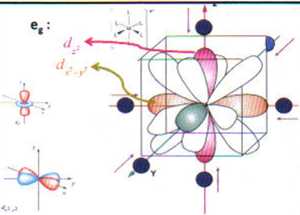
Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale d podniosą swoją energię w odniesieniu do wolnego jonu ze względu na odpychanie związane z ładunkami ujemnymi.
^ Należy jednak zaznaczyć jak to widać z rysunku, że nie wszystkie orbitale będą dotknięte tym oddziaływaniem w jednakowym stopniu.
1 ❖ Orbitale leżące wzdłuż osi (d/1 d2-2) będą dużo silniej odpychane aniżeli orbitale z płatami skierowanymi pomiędzy osie (d^, dKl i dyt ).
*> Stąd orbitale (/rozdzielają się na dwa zestawy tzn. orbitale o wyższej energii d*I d*-y* niż pozostałe trzy.
♦> Podział na te dwie grupy wynika z właściwości symetrii orbitali d w obrębie oktaedrycznego otoczenia, co możemy potwierdzić z tabeli poprzez odniesienie do reprezentacji grup dla grupy punktowej Oh.
Zestaw orbitali d w oktaedrycznym polu wytworzonym przez sześć ligandów. Orbitale eg są pokolorowane a orbitale t2g są białe. Torus orbitalu d2 został pominięty dla przejrzystości rysunku.
Zapis zwyczajowy tych dwóch nowych grup orbitali także symbolizuje te właściwości symetrii: o t2f dla zestawu potrójnie zdegenerowanego i o egdla podwójnie zdegenerowanej pary a małe literki odnoszą się do symetrii orbitali.
3d
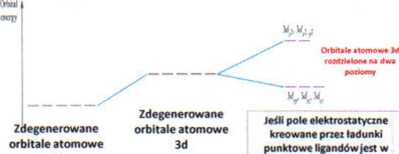
Jon Me"* i sześć ligandów L nieskończonej odległości od siebie
Jeśli pole elektrostatyczne kreowane prze punktowe ładunki ligandów jest ■ sferyczne, energie orbitali d ulegają podwyższeniu
oktaedrze, to energia elektronów orbitali 3d, które są skierowane dokładnie w .kierunku punktowego ładunku Uganda ulegają podwyższeniu w porównaniu do struktury sferycznej, podczas gdy energie orbitali nie skierowanych bezpośrednio w kierunku ładunków punktowych liganda ulegają obniżeniu.
Teoria pola krystalicznego jest modelem elektrostatycznym, który zakłada, źe orbitale d w kompleksie metalu są zdegenerowane. Sposób rozczepienia orbitali d zależy od pola kryształu a to jest uzależnione od rozłożenia i rodzaju liganda.
“7--«, *0 * iilkl
-i----om.,- in,
xy xi fi
Oznaczenie O i q tq wielkościami pochodzącymi z matematycznego wzoru w elektrostatycznym modelu. Zależą one od ładunku fonu metalu, radialnej dystrybucji elektronów walencyjnych d i odległości metal-ligond. Współczynnik 10 w 10Dq pojawia się w układzie jednego elektronu w polu elektrostatycznymo oktaedtycznej symetrii.
|
OiMmI |
—--rt -0.AA.rt ■ |
Zaleta teorii pola krystalicznego: > można wartość wyznaczyć z danych spektroskopowych. | |
|
J---•>. -0.<A - -4/>a Jv rf. * | |||
|
> Separacje energii pomiędzy nimi wynosi A^.,. lub 10Dq. > Całkowita stabilizacja orbitali t7g jest = całkowitej destabilizacji zestawu eg. r Stąd zestaw orbitali et podnosi się o wartość 0,60^ w stosunku do środka „ciężkości" (-) podczas gdy zestaw orbitali t,g obniża się o wartość 0,40^, |
kompleks d1 [Ti(H20)6]3* dla którego stan podstawowy może być przedstawiony za pomocą poniższego diagramu: 22Ti ls2/2s22p6/3s23p63d2/4s2 | ||
|
Na rysunku tym różnica ta pokazana jest również jako różnica energii w terminach 10Dq. Obie notacje tzn. i l0Dq są powszechnie stosowane aczkolwiek w niniejszych rozważaniach będziemy preferować zapis . Notacja Dq ma swój początek związany z teorią pola krystalicznego natomiast pochodzenie zapisu odnosi się do wartości eksperymentalnych. Stabilizacja i destabilizacja zastawów t2(i eE jest podawana w zapisie . Wielkość A,*, jest wyznaczona poprzez siłę pola krystalicznego a dwie skrajności nazywane są słabym i silnym polem |
1—22Ti3ł ls2/2s22p6/3s23p63d‘/4s° _ _ eg “1“ “ ~ tj‘ | ||
|
^ (słabe pole) < A0„ (silne pole) | |||
2
Wyszukiwarka
Podobne podstrony:
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna II 2009-01-12Chemiakoordynacyjna Teoria pola krystalicznego Modelem, który w dużym
Ch koordynacyjna II (3) 2009-01-12itmąfia atatBMtsw# w potu toysjajteanym:W^ftKMUD & ntete»
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
ORTOGRAFIA KL1 4 ZESZYT 4 CH H (31) !i. Rozsypane litery ułóż w wyrazy tak, jak wskazują strzałki.
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
ORTOGRAFIA KL1 4 ZESZYT 4 CH H (43) II Uzupełnij brakujące litery tak, by powstały wyrazy
ORTOGRAFIA KL1 4 ZESZYT 4 CH H (31) !i. Rozsypane litery ułóż w wyrazy tak, jak wskazują strzałki.
Zapisy do Biblioteki aktualizacja 01/12/2017 & Zapisy do Biblioteki aktualizacja 01/12/2017 &
II WARSZTAT EKONOMISTY Ekonomia, tak jak każda nauka wykorzystuje odpowiedni dla siebie zestaw narzę
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
więcej podobnych podstron