Ch koordynacyjna II (3)
Efekt różnej ilości elektronów okupujących orbitale cl w polu oktaedrycznym. dla układu ci' stan podstawowy odpowiada konfiguracji f ,f,
— — e, —.
f --«« I -0,4^ -
o tj*
•£ — — •» *«-•«»
W odniesieniu do środka mamy tutaj energię stabilizacji równą -0,40^,, która jest nazywana energią stabilizacji pola krystalicznego (CFSE crystal field stabilisation •rgy)
|
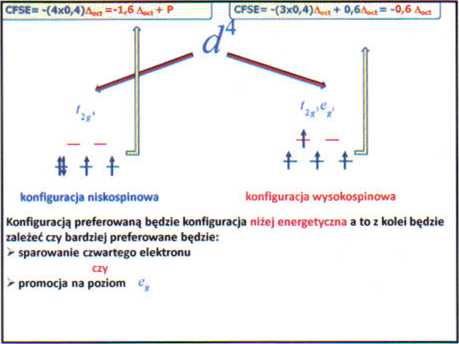
Dla jonu —► |
konfiguracją podstawową jes J1 ==> | |
|
| energia stabilizacji CFSE =-0,8^. zgodnie z poniższy równaniem: | ||
|
*»f ł -» |
=-0.8A«, |
CFSE= -(2x0,4)^ =-0,8^ /, « |
|
e8 |
> =-UA«, |
CFSE=-(3x0,4)^,= -!.^ - |
|
1 ł + | ||
energii parowania P, - energia wymagana do transformacji dwóch e o spinach równoległych z dwóch różnych (zdegenerowanych) orbitali w spinowo sparowane e na tym samym orbitalu Dwa składniki mają swoją kontrybucję w odniesieniu do energii parowania P
r Obniżenie energii wymiany, który zachodzi podczas parowania się e Siły odpychania kulombowskiego pomiędzy spinowo sparowanymi e
Energia wymiany
o Wypełnione lub w połowie wypełnione powłoki ^ posiadają „specjalną stabilność", o Takie określenia bardzo często są zwodnicze.
o Bardziej powinniśmy rozważać energię wymiany pomiędzy danymi konfiguracjami, o To można wytłumaczyć na drodze zaawansowanej kwantowo-mechanicznej. o Idea problemu stosunkowo prosta :
Rozważmy dwa e na różnych orbitalach - odpychanie większe pomiędzy dwoma e jeśli posiadają spinu anty-równoległe aniżeli w sytuacji gdy ich spiny są równolegle jak np. w konfiguracji p' : _p, -j. 4. 4
Różnica energii nazywa się energią wymiany K, tzn. jest dodatkową energią stabilizacji w odniesieniu do konfiguracji po lewej stronie. Całkowita energia wymiany wyrażona w terminach K (rzeczywista wartość K jest uzależniona od rodzaju atomu czy jonu):
Energia wymiany = spinami.
gdzie N jest ilością elektronów z równoległymi
|
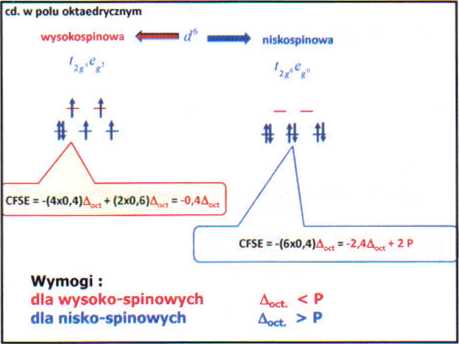
wartości CFSE dla wszystkich konfiguracji dn w polu krystalicznym. | ||||
|
Wysoko spihowe |
- słabe pole |
Nisko spinowe |
silne pole | |
|
dn |
konfiguracja |
CFSE |
konfiguracja |
CFSE |
|
elektronowa |
elektronowa | |||
|
d‘ |
•0.4A*, | |||
|
(P |
'..V |
-o.sa*, | ||
|
(P |
':,V | |||
|
d* |
‘n< |
■0.6A*. |
-1,66* ♦ P | |
|
ds |
0 |
>u< |
2.0 A*, + 2P | |
|
<r |
'*V |
■0.4^. |
2,46,*, ♦ 2P | |
|
d7 |
0.8A*. |
‘u< |
■w**p | |
|
<P |
c«.’ |
-1.2A*. | ||
|
<P |
>u\' |
■o,6A*. | ||
|
dw |
0 | |||
4
Wyszukiwarka
Podobne podstrony:
Ch koordynacyjna II 2009-01-12Chemiakoordynacyjna Teoria pola krystalicznego Modelem, który w dużym
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna II (4) preferencje dla nisko i wysoko spinowych oktaedrycznych kompleksów d*. 4-4
Ch koordynacyjna I 2009-01-12ChemiakoordynacyjnaZwiązki koordynacyjne były wyzwaniem dla chemików n
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
Ch koordynacyjna I (3) 2009-01-12Zastosowanie i ograniczenia teorii VB Kompleksy oktaedryczne kompl
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
2009 01 13 ;01;44 b/rf/ii /VLOl —- 2.cJ •_ l^<d2*-^c>
Foto 0073(1) I rcliitologia i oruani/ncjt* liutlrmsKOI (>KV II M 26.01.2009 /aRmlniciii:i <lo
egzamin mat lut % t tbUA. i . Wytłn.l i IW n,il <./AMIN Z. MMI MATYKI 5 II 200
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
Blok d (7) 2009-01-12licdabont}«acyjBa3 1. Przykłady kompleksów z liczbą koordynac
więcej podobnych podstron