Ch koordynacyjna II (5)
Z kompleksem o takiej orientacji żaden z orbitali d metalu nie jest dokładnie skierowany w kierunku liganda ale orbitale J.. ,d,.,J... są bliżej tego niż orbitale d .
1 , _
Dla regularnego tetraedru rozdzielenie orbitali d jest odwrotnie niż w analogicznej sytuacji w polu oktaedrycznym natomiast wartość różnicy energii (A^J jest mniejsza. Jeśli wszystkie pozostałe elementy są równe (chociaż pamiętajmy, że nigdy nie są) względne rozdzielenia i są ze sobą związane poniższym równaniem:
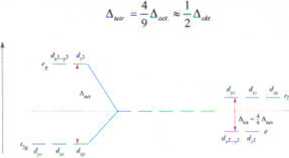
■ Ponieważ jest znacznie niższe niż dla A,^ , tetraedryczne kompleksy są wysoko-spinowe.
■ Skoro mniejsza ilość energii jest potrzebna dla przejścia <: t (tetraedryczne)
niż dla transformacji «- hu (oktaedr) stąd odpowiadające sobie kompleksy oktaedryczne i tetraedryczne bardzo często mają różne kolory
Notacja przejść elektronowych.
Przejścia elektronowe związane są z absorpcją i emisją energii i stosujemy następującą notację:
Emisja: (poziom wysokie energii) t=*> (poziom o niskiej energii) Absorpcja: (poziom wysokie energii) (poziom o niskiej energii)
Dla przykładu, dla opisania przejścia elektronowego z poziomu e do t2w tetraedryeznym kompleksie notacja ta powinna wyglądać : t2 *- e
Efekt Jahna-Teller'a w tctraedrycznych kompleksach manifestuje się zniekształceniami w kompleksach d*(np.
(CuCI4j2 ) I wysoko-spinowych d4. W szczególności silne strukturalne zniekształcenie obserwuje się w (Fe04JŁ jak jest to przedstawione na rysunku dla zelazianu:
125*
A
\7f
oK Fo-O - 1*1 pt
Jeśli usuniemy Ugandy leżące wzdłuż osi z wtedy orbital jest w znaczny sposób stabilizowany; ale i także energie orbitali </. ,c/, ulegają obniżeniu chociaż w mniejszym stopniu.
Zgodnie z tym kwadratowe płaskie kompleksy dł takie jak (Ni(CN)J2 są diamagnetyczne I jest to konsekwencją relatywnie dużej różnicy energii pomiędzy orbitalami dt a orbitalem d K
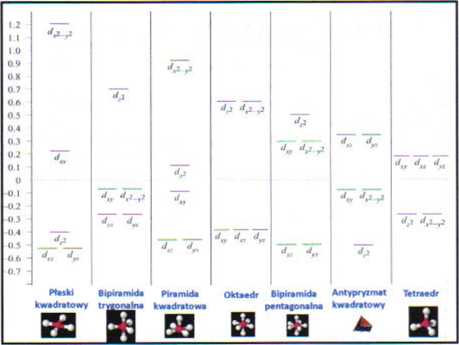
d8 kompleksy [Ni(CN)J}' I (NICIJ2 sq odpowiednio płasko kwadratowy i tetroedryczny. Czy te kompleksy będq paramagnetyczne czy diamagnetyczne?
-f
* *
4^. 41.
Ikiraedryazny '
/NICIJ2 Plaski kwadratowy
fNifcmj>-
Stqd [NICIJ2 jest paramagnetyczny a (Ni(CN)J* jest dlamagnetyczny.
Chociaż [NiCIJ2 jest tetraedryczny i paramagnetyczny to:
[PdCI,]2’ jak i [PtCIJ* są płasko kwadratowe i diamagnetyczne.
Ta różnica jest konsekwencją większego rozczepienia krystalicznego dla drugiego trzeciego szeregu jonów metali w porównaniu do ich pierwszego; kompleksy Pd(ll) i Pt(ll) są zawsze płasko kwadratowe.
Teoria pola krystalicznego próbuje połączyć strukturę kompleksu z jego właściwości magnetycznymi elektronowymi.
Trendy w CFSE dostarczają pewnych aspektów dla zrozumienia termodynamiki i kinetyki kompleksów metali bloku d.
Teoria pola krystalicznego jest zadziwiająco użyteczna kiedy patrzymy na jej prostotę jednak ze jak każda teoria posiada swoje ograniczenia.
Przykładowo, chociaż możemy interpretować kontrastujące właściwości magnetyczne wysoko i nisko spinowych kompleksów oktaedrycznych na podstawie miejsca liganda w spektrochemicznych szeregach ligandów o słabym i mocnym charakterze to jednak teoria ta nic nam nie mówi dlaczego te Ugandy w tych szeregach spektrochemicznych znajdują się w tym a nie innym miejscu.
6
Wyszukiwarka
Podobne podstrony:
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II 2009-01-12Chemiakoordynacyjna Teoria pola krystalicznego Modelem, który w dużym
Ch koordynacyjna II (3) 2009-01-12itmąfia atatBMtsw# w potu toysjajteanym:W^ftKMUD & ntete»
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
Blok d (6) 2009-01-12 Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
Ch koordynacyjna II (4) preferencje dla nisko i wysoko spinowych oktaedrycznych kompleksów d*. 4-4
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
więcej podobnych podstron