Blok d (6)
Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"1 poprzez rozważenie odpychania pomiędzy grupami L. Wolne pary elektronowe sq ignorowane. Dla liczby koordynacyjnej pomiędzy 2 a 6 następujgce rozłożenie atomów donorowych jest brane po uwagę:
2 liniowe
3 płaskie trygonalne
4 tetragonalne
5 trygonalne Bi-piramidatne lub piramida kwadratowa
6 oktaedryczne
Nie wszystkie przedstawione w tabeli rozłożenia dla danej liczby koordynacyjnej pomiędzy 2-9 są możliwe do przewidzenia na podstawi* modelu Keperta.
Przykładowo po rozważeniu odpychania pomiędzy ligandami cyjanowymi w [Cu(CN)j]2 przewidywana sfera koordynacyjna powinna być płasko trygonalna tak jest w rzeczywistości.
Inną opcją z tej tabeli (rzadziej spotykaną) jest dla tego związku układ trygonalne piramidy ale on nie minimalizuje odpychania pomiędzy ligandami.

Jedną z bardziej klasycznych struktur dla której model Keptera nie daje poprawnej odpowiedzi są te dla kompleksów płasko kwadratowych gdzie elektronowy efekt jest zazwyczaj czynnikiem kontrolującym.
Innym czynnik, który może prowadzić do załamania się modelu Keptera może tkwić w ograniczeniach natury liganda. Przykładowo,
|
□ dla czterech atomów donorowych azotu w porfirynowym Ugandzie są ograniczone |
Przed omówieniem geometrii w ciele stałym kompleksów bloku -d | |
|
do płasko kwadratowego układu; |
pamiętajmy, że : wzór cząsteczki może być mylący w określeniu liczby | |
|
koordynacyjnej. Przykładowo, w Cdl2 | ||
|
□ trójnożne Ugandy tzn. takie jak przedstawiono poniżej posiadają ograniczoną |
■ Część dwóch warstw sieci Cdl2, jony Cd7< pokazane są ^ w kolorze jasno szarym a jony na | |
|
fleksyjność co oznacza, że atom donora nie są w pełni swobodne do adopcji pozycji |
Ar ,vy w Każdy jon Cd jest usytuowany oktaedryczne a ■y > cząsteczkowe czy pseudo halogeny (np. [ ]-) ^ Q mogą zawierać mostki M- -M czy istnieć jako oligomery jak np. polimeryczny a-PdCI2: | |
|
wynikających z praw Keperta | ||
|
ph£ Trójnożny Ugand to taki który zawiera trzy ramiona każde z donorowym atomem. Ramiona | ||
|
te rozchodzą się promieniście od atomu centralnego lub grupy, ten centralny punkt może |
O c-L n. | |
|
sam w sobie być donorowym atomem. □ Ugandy makrocykliczne są mniej fleksyjne niż te o otwartych łańcuchach |
Dalsze dwuznaczności pojawiają się wtedy gdy wiązanie liganda może być opisane na więcej aniżeli jeden sposób. Spotykamy się z tym stosunkowo często w chemii organometalicznej jak np. w przypadku cyklopentadienylowego liganda:
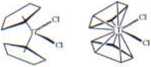
Jak widać z tego rysunku (brak zaznaczenia aromatyczności w pierścieniu) nie jesteśmy pewni czy ligand [r^-C^j zajmuje jedno czy pięć miejsc w sferze koordynacyjnej atomu metalu tak więc koordynacja centrum Ti(IV) w [(ns-C5H$)2TiCIJ może być różna jak to przedstawiono na powyższych rysunkach.
1 UL 1
Przykłady kompleksów z liczbą koordynacyjną 2 należą do rzadkich i są w zasadzie ograniczone do: Cu(l), Ag(l), Au(l) i Hg(ll)
gdzie we wszystkich przypadkach konfiguracja jonu jest -d‘°.
Jako przykładowe możemy wymienić [CuCI2]', [Ag(NHs)2]*,
[Au(CN)2], (RjP)AuCI, [AujRjP))' (gdzie R= alkil lub aryl) i Hg(CN)2w których centrum metaliczne jest w liniowym otoczeniu.
Wyszukiwarka
Podobne podstrony:
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
Blok d 2009-01-12Pierwiastkibloku-d • Trzy okresy metali bloku d •
Blok d (1) 2009-01-12Właściwości fizyczne Prawie wszystkie metale bloku -d są metalami: •
Blok d (7) 2009-01-12licdabont}«acyjBa3 1. Przykłady kompleksów z liczbą koordynac
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
więcej podobnych podstron