Blok d (3)
---■.___
"t—t—-fH+ v°» - -H-+ł- v*>
"tf......
■-H- ...
o.tiJł
•w
Gap energetyczny HOMO - LUMO
Gap energetyczny HOMO-LUMO maleje zgodnie z poniższym szeregiem Fj>Cli>Br2>lI co prowadzi do progresywnego przesunięcia maksimum absorpcji od bliskiego UV do obszaru czerwonego w widmie światła widzialnego.
Dichlor, dibrom i dijod rozpuszczają się bez zmiany koloru w wielu organicznych rozpuszczalnikach (np. alkanach, CCI,).
Jednakie, w innych zawierających donorowe atomy, takich jak etery, ketony czy pirydynie Br2 i l2 (w mniejszym stopniu Cl2) tworzą kompleksy charge transfer z orbitalem MO a‘ halogenu działającym jako orbital akceptorowy. W sytuacji skrajnej, całkowity transfer ładunku może prowadzić do heterolitycznego rozczepienia wiązania i wytworzenia np. [i(py)2j* jak pokazuje poniższa reakcja:
- .. . . . , , , Struktura jonu lllpylj1
2y7y + ; t j / (jjV), j t [ /. | określono no podstawie
krystalografii rentgenowskiej.

• Roztwory l2 w donorowym rozpuszczalniku takim jak: pirydyna, etery czy ketony są brązowe lub ;
■ nawet benzen działa jak donorowy rozpuszczalnik tworząc charge transfer kompleksy z l2 i Br2;
• kolory tych roztworów są wyraźnie inne od tych, które tworzą l2 i Br2 z cykloheksanem (nie donorowy).
• w rozpuszczalnikach donorowych takich jak aminy, ketony i podobne związki przekazują one gęstość elektronową wolnej pary elektronowej orbitalu a
■ podczas gdy benzen używa swoich ti-elektronów; jest to widoczne jeśli popatrzymy na względne orientacje donora (benzen) i akceptora (cząsteczka Br2) na poniższym rysunku:
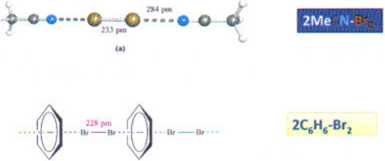
tw
Roztwory kompleksów charge transfer są kolorowe co oznacza, że absorbują one w regionie widzialnym widma (=400-750 nm) to pasmo nazywane jest pasmem charge transfer podczas gdy widma elektronowe zawierają także intensywne pasmo absorpcji w obszarze UV (= 230-330 nm) pochodzące od elektronowego przejścia od rozpuszczalnik - X2 tzn. zajęty wiążący orbital MO do wolne antywiążącego orbitalu MO.
Wiele kompleksów charge transfer udało się wyizolować w fazie stałej.
> W kompleksach gdzie donor jest słaby np. C6H6 długość wiązania X-X prawie się niezmienia poprzez wytworzenie komDleksu (Br-Br w fazie gazowej = 228 pm) - patrz rysunek z 2C6H6-Br2 r Wydłużenie się tego wiązania do 233 pm tak jak dla czy nawet 241 pm jak dla l,2,4,5-(EtS),C6H2-(Br2) jest zgodne z zaangażowanie się silnego donora; jak to zostało oszacowane z teoretycznych obliczeń około -0,25 wartości ładunku ujemnego ulega
2Me N-
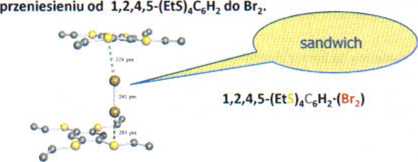
Różny stopień transferu ładunku ma oczywiście swoje odbicie w relatywnych wartościach A,H poszczególnych reakcji.
C6H, + I, -* CA-I, A,H= -5 kj mol1
C2HsNH2 + l2 — C2H5NH2-I2 A,H = -31 kJ mol1
Dowodem osłabienia wiązania X-X są również dane pochodzące z spektroskopii wibracyjnej gdzie obserwuje się przesunięcie pasma pochodzącego od n(X-X) z 215 cm1 w przypadku l2 do 204 cm'1 dla C6H6I2.
4
Wyszukiwarka
Podobne podstrony:
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
Blok d (6) 2009-01-12 Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
Blok d 2009-01-12Pierwiastkibloku-d • Trzy okresy metali bloku d •
Blok d (1) 2009-01-12Właściwości fizyczne Prawie wszystkie metale bloku -d są metalami: •
Blok d (7) 2009-01-12licdabont}«acyjBa3 1. Przykłady kompleksów z liczbą koordynac
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
więcej podobnych podstron