Blok d (5)
Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się koordynacyjnych wiązań poprzez donację wolnej pary e od liganda do centrum Co(lll).
Implikuje to transfer e od liganda do metalu w wyniku czego uzyskujemy dystrybucję ładunku jak na rys (b).
Oczywiście taka dystrybucja jest nierealistyczna ponieważ centrum kobaltu(lll) staje się bardziej ujemnie naładowane niż by to wynikało z jego elektrododatniego charakteru.
Orugą skrajnością byłoby rozważenie wiązanie w terminach w pełni modelu jonowego [rys (c)j gdzie ładunek +3 pozostaje zlokalizowany na jonie kobaltu a sześć ligandów NU pozostaje neutralnych.
Ten model jest też błędny, dane eksperymentalne wskazują ewidentnie na to, że jon kompleksowy [Co(NHj)J** pozostaje jako całość w roztworze wodnym, a elektrostatyczne oddziaływania wynikające z modelu jonowego nie wskazywałyby, że takie fakt mógłby mieć miejsce. Stąd żadna z tych skrajnych sytuacji nie Jest odpowiednia dla naszego opisu.
Jeśli jednak zastosujemy zasadę elektro neutralności to w (Co(NHj)JJ* mamy ładunek netto na centrum metalicznym równy zero. Oznacza to, że jon CoJ* może zaakceptować łącznie jedynie trzy elektrony pochodzące od sześciu ligandów co prowadzi do dystrybucji ładunku takiego jak na rys (d).
Te reguła elektro-neutralności prowadzi do stwierdzenia, że w [CojNHJJ3* wiązanie jest w 50% jonowe (lub w 50% kowalencyjne).
Nil)
,fr*
Liczby koordynacyjne
Pełen opis nie jest możliwym aczkolwiek na kilka kwestii warto zwrócić uwagę:
r w większości przykładów mamy do czynienia z mono-nuklearnymi kompleksami a kompleksy z więcej niż Jednym centrum metalicznym mogą być często dobrze opisane w terminach indywidualnych centrów metalicznych;
> chociaż koordynacyjne otoczenie bardzo często podawane jest w regularnych geometriach (patrz tabela poniżej) to w praktyce są one często zniekształcone jak np. w konsekwencji efektów sferycznych; kiedy różnica energii pomiędzy różnymi możliwymi strukturami jest niewielka (np. dla 5-do I 8-mio koordynacyjnych kompleksów)
możliwe jest obserwowanie zmiennych właściwości w roztworze,
mała różnica energii może prowadzić również do obserwacji różnych struktur w fazie stałej np. w solach [Ni(CN)5]3‘ kształt geometrii koordynacji anionu zależy od obecnych kationów i w [CrfenyiNiłCNjJ- 1,5 HzO zarówno trygonalna biplramida jak i piramida kwadratowa w ich strukturach jest obecna.
|
Liczba koord. |
Rozłożenia atomów donora wokół centrum metalicznego |
Mniej typowe rozłożenia |
|
2 |
Linowe | |
|
3 |
Trygonalny płaski |
Trygonalny piramidalny |
|
4 |
Tetraedryczny, płaski kwadratowy | |
|
5 |
Trygonalna bipiramida, piramida kwadratowa | |
|
6 |
Oktaedryczny |
Słup trygonalny |
|
7 |
Bipiramida pentagonalna |
Jedno kopułowy słup trygonalny, jedno kopułowy oktaedr |
|
8 |
Dwunastościan |
Sześcian, dwu kopułowy słup tetragonalny |
|
9 |
Trój kopułowy słup trygonalny |
Motel Rgpetti
Przez wiele lat po klasycznej teorii Wernera, która położyła fundamenty dla poprawnego formułowania kompleksów metali bloku -d zakładano, że metal na danym stopniu utlenienia powinien posiadać niezmienną liczbę koordynacyjną i geometrię.
W świetle sukcesów teorii VSEPR w przewidywaniu kształtu cząsteczek pierwiastków bloku p rozsądnym może się wydawać, że struktury jonów
kompleksowych [V(H20)6]3* (d2), (Mn(H20)6]3ł (rf*), (Co(H20)6P* (d6), [Ni(H20)J2* (d®) i [Zn(H20)6]2* (d10) będą zmieniać się ze zmianą konfiguracji elektronowej jonu metalu. W rzeczywistości, każde z tych indywiduów posiada oktaedryczne rozłożenia ligandów:
Tak więc jest jasne, że teoria VSEPR nie jest odpowiednia dla kompleksów metali bloku -d.
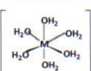
Zamiast tego możemy rozważyć model Keperta w którym:
1. metal leży w centrum sfery a Ugandy są zdolne do przesuwania się wokół powierzchni sfery.
2. Zakłada się, że ligandy są odpychane pomiędzy sobą w sposób podobny jak w teorii VSEPR
(i) jednakże w odróżnieniu do teorii VSEPR model Keperta ignoruje niewiążące elektrony. Stąd też koordynacyjna geometria indywiduów bloku d rozważana jest przez Keperta jako niezależna od elektronowej konfiguracji metalicznego centrum stąd też jony typu i [Mln]m' posiadają tę samą
geometrię.
6
Wyszukiwarka
Podobne podstrony:
Blok d (6) 2009-01-12 Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
Blok d (7) 2009-01-12licdabont}«acyjBa3 1. Przykłady kompleksów z liczbą koordynac
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
12. Rysunek przedstawia układ tekstu a) symetryczny. b)
Blok d 2009-01-12Pierwiastkibloku-d • Trzy okresy metali bloku d •
Blok d (1) 2009-01-12Właściwości fizyczne Prawie wszystkie metale bloku -d są metalami: •
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
więcej podobnych podstron