Ch koordynacyjna II (2)
Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla którego Xm.„=20 300 cm 1 odpowiada zmianie energii* 243 kJ mol'1.

OGO 13 000 20 000 2 3 000
fc- CJctn '
Absorpcja pochodzi ze zmiany elektronowej konfiguracji z
Dla układu z większą Ilością elektronów
wartość jest miarą A^ . niż Jeden elektron no orbitalach d
oszacowonle Jest bardziej skomplikowane; warto pamiętać, że Jest wartością eksperymentalną.
'(Przeliczenie 1 cm'1* 11,96 x 103 kJ molł)
Dla kompleksów oktaedrycznych wartości wzrastają zgodnie z spektrochemicznym szeregiem ligandów;
Jon [NCSy może koordynować odpowiednio przez donor N- lub S- wyróżniony na kolor czerwony poniżej a stąd ma dwa miejsca w tej serii:
I < Br < (NCS] < O < F <(OH] < [ox]2 «H20 <[NCSJ <NH, <en < bpy < phen < (CN) ~CO Wzrost A^
Słabe pole liganda 4 -► Silne pole liganda
o Serie spektrochemiczne są w dużym stopniu ogólne, o Ugandy z tym samym atomem donorowym są dosyć blisko siebie w serii.
Rozważając oktaedryczne kompleksy jonów metali bloku d możemy wymienić kilka dotyczących ich zasad, które możemy zilustrować następującymi przykładami:
3. W sytuacji gdzie analogiczne kompleksy istnieją dla serii jonów metalu w triadach - M"* ( n=const.) wartości A*,, znacznie wzrastają w dół grupy
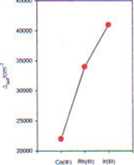
4. Ola danego liganda i dla danego stopnia utlenienia wartość A«, zmienia się nieregularnie wzdłuż pierwszego szeregi bloku metali-d np. w zakresie od 8000 do 14 000 dla jonów IM(H20)J2‘.
Czynniki rządzące wielkościami A**. (patrz tabela poniżej) są identyczne w odniesieniu do stanu utlenienia jonu metalu i natury liganda.
|
Kompleks |
A/cm 1 |
Kompleks |
A . cm 1 | |
|
|TiF„r |
17000 |
Mo.hl' |
14100 | |
|
rr»(OHjKi’ |
20300 |
Mcni.!’ |
35000 |
Jest oczywistym, że parametry |
|
|V(OH...U,‘ |
17850 |
|Kc<CN).|4 |
33800 |
A są również określone dla |
|
|VIOH;U|-‘' |
1: 400 |
ICoF.l’ |
13100 |
innych ułożeń ligandów (np. |
|
ICrF*)' |
15 000 |
|(:o(NH,Mu |
22900 |
A*,). |
|
ICrlOH.j.l' |
17 400 |
|Co(NH,I4|J4 |
10200 | |
|
|Cr(OH.).|; • |
14 100 |
24000 | ||
|
|Cr<NH. |
21 600 |
|Co(OH,Wl- |
18200 | |
|
[Cr(CN),;’ |
26600 |
|Co(OH;),l: |
9 300 | |
|
|Mnlfcj- |
21 800 |
|Ni(OH;),|: |
8 500 | |
|
137(10 |
|Ni(NH0„;- |
10800 |
9 | |
|
[re(OH:U|:' |
0400 |
INi(en),)-’- |
11 500 |
|
1. Kompleksy Cr(lll) wymienione w tabeli ilustruję efekt siły pola różnych ligandów | |
|
na dany jon M"*; |
Kompleks A/cm’1 [CrF6p- 15 000 [Cr(OH2)6P+ 17 400 [Cr(NH3)6Pł 21 600 [Cr(CN)6]3- 26 600 |
|
2. Kompleksy Fe(ll) i Fe(Hi) wymienione w powyższej tabeli ilustrują dla danego | |
|
lieanda i daneeo metalu wartość A. .. która rośnie z wzrostem stopnia utlenienia | |
|
Kompleks |
A/cm1 Kompleks A/cnr1 |
|
[Fe(OH2)6P* |
13 700 [Fe(OH2)6]2+ 9 400 |
|
[Fe(CN)6P |
35 000 [Fe(CN)6]4' 33 800 |
Trend zmiany wartości prowadzi do konkluzji, że :
jony metalu mogą być umiejscowione w szeregu spektrochemicznym, który jest niezależny od liganda:
Mn(ll) < NHII) < Co{H) <Fe(lll) < Cr(l!l) < Co(lll) < MIII) < Mo(lll) <Rh(l1l) < Pd(ll) < lr(lll) <Pt(IV) __Wzrost sHy pola_
Serie spektrochemiczne są uogólnieniem empirycznym a prosta teoria pola krystalicznego nie może wyjaśniać wielkości wartości A^.
3
Wyszukiwarka
Podobne podstrony:
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna II 2009-01-12Chemiakoordynacyjna Teoria pola krystalicznego Modelem, który w dużym
Ch koordynacyjna II (3) 2009-01-12itmąfia atatBMtsw# w potu toysjajteanym:W^ftKMUD & ntete»
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
Blok d (6) 2009-01-12 Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
Ch koordynacyjna II (4) preferencje dla nisko i wysoko spinowych oktaedrycznych kompleksów d*. 4-4
więcej podobnych podstron