Ch koordynacyjna I (1)
Drugim istotnym udział Wernera w rozwoju i badaniach chemii koordynacyjnej to postulat że:
: wiązanie liganda jest zawieszone w przestrzeni a stąd należy je traktować z zastosowaniem zasad strukturalnych.
Za pomocą liczby i właściwości otrzymanych izomerów, Werner byt zdolny do określenia poprawnej geometrycznej struktury dla wielu związków koordynacyjnych dużo wcześniej przed określeniem tej struktury na drodze eksperymentów pozwalających bezpośrednio taką strukturę wyznaczyć.
Metoda Wernera była używana uprzednio przez chemików organików dla wyjaśnienia struktur podstawionych benzenów, mianowicie ilości j izomerów.
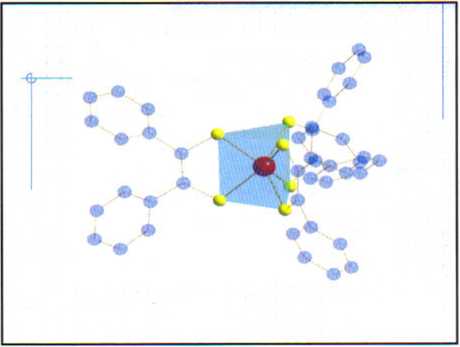
Werner postulował, że sześć ligandów w kompleksie takim jak [Co(NH3)6]3ł było usytuowanych w pewien symetryczny sposób gdzie każda grupa NH3 znajduje się w jednakowej odległości od atomu centralnego tzn. kobaltu.
Od razu przychodzi na myśl:
> płaska heksagonalna struktura - podobna do pierścienia benzenowego
i dwa wielościany tzn.
> graniastosłup trygonalny* i
> oktaedr
9
* Graniastosłup trygonalny jest blisko „spokrewniony" z oktaedrem który tworzy się poprzez obrót jednej z trygonolnych płoszczyzn o 60° (faktycznie oktaedr może być rozważany jako trygonalny antygraniostosłup).
Dla „dwu- podstawionych" kompleksów, MA4B2
• rozłożenie płaskie daje 3-izomery podobne do rozłożenie m, o, i p, w chemii organicznej.
• układ trygonalnego pryzmatu prowadzi również do 3-izomerów '
podczas gdy dla
• układu oktaedrycznego mamy tylko 2-izomery.
Całkowita liczba izomerów spodziewana dla każdego geometrycznego rozłożenia jak i doświadczalnie znaleziona dla różnych składów przedstawiona jest poniżej:
ll/riff HASKA /«!vo\Al'\Y OKTAEbRYl 'ZNA EKSPERYMENT

Konkluzje z tabelki:
liczba znalezionych izomerów była równej tej spodziewanej dla kompleksu oktaedrycznego. Przykładowo, dla [Co(NHj)4CI2]CI znaleziono dwa izomery (jeden fioletowy i jeden zielony).
Chociaż korelacja w tym przypadku była idealna, musi się rodzić myśl, żę:
Obserwacje 2-óch zamiast 3-ch izomerów dla tego związku stanowią negatywne dowody odnoszące się do struktury tych kompleksów. Pomimo tego Werner bardzo dokładnie sprawdzał wiele innych układów, zawsze była możliwość, wprawdzie mała, że trzeci izomer nie został zauważony. Niepowodzenie w syntetyzowaniu związku dla zaobserwowania partykularnej właściwości lub efekt partykularnej reakcji nie może być dowodem nieistnienia tego związku, właściwości czy reakcji. To może być po prostu odzwierciedleniem błędu w technice lub błędu chemika.
Dobrze znanym przykładem błędnego przekonania z ujemnej obserwacji była dogmatyczna wiara o chemicznej obojętności gazów szlachetnych.
WIĄZANIA W CHEMII KOORDYNACYJNEJ
Wykonano wiele prac próbujących formułować teorie opisujące wiązania w chemii koordynacyjnej i racjonalnie przewidzieć ich właściwości. Wśród tych teorii wymienić należy:
• teoria wiązań walencyjnych (VB - valence bond) zastosowana przez Linusa Paulinga i innych w latach 1930.
• w latach 1950 i 60-tych zaczynała górować teoria pola krystalicznego (CfT- crystal field theory) i jej modyfikacja znana pod określeniem teoria pola ligandów (LFT- Ugand field theory) stopniowo przechodząc do:
• teorii orbitali molekularnych (MO molecular orbitaI theory)
2
Wyszukiwarka
Podobne podstrony:
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Ch koordynacyjna I (2) 2009-01-12 r rozważając różne teorie wiązań w kompleksach będziemy chcieli n
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
Blok d (6) 2009-01-12 Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
Skanowanie 10 01 12 47 (3) PAŁUBA wiedział cały fakt żonie. Wywołał przez to następujący kłębek spr
Skanowanie 10 01 12 58 (11) się szczególnie podrażnionym, liczył jednak na to, że Strumieńskiego pr
więcej podobnych podstron