Ch koordynacyjna I (2)
r rozważając różne teorie wiązań w kompleksach będziemy chcieli na ich podstawie tłumaczyć eksperymentalne fakty (właściwości magnetyczne, widma elektronowe) r skoncentrujemy się na kompleksach metali -d pierwszego szeregu r będziemy pamiętali, że wiązanie w kompleksach metali bloku -d nie jest fundamentalnie różne od tego w innych kompleksach A STĄD
^ będziemy chcieli wykazać możliwość zastosowania teorii VB, modelu elektrostatycznego jak i teorii MO do ich opisu.
różnica w podejściu do kompleksów metali bloku -d :
Punktem kluczowym jest to, że trzy z pięciu orbitali -d dla danej głównej liczby kwantowej ma swoje płaty skierowane pomiędzy osiami x, y i z podczas gdy pozostałe dwa orbitale są skierowane dokładnie wzdłuż tych osi jak jest to przedstawione na poniższym rysunku.
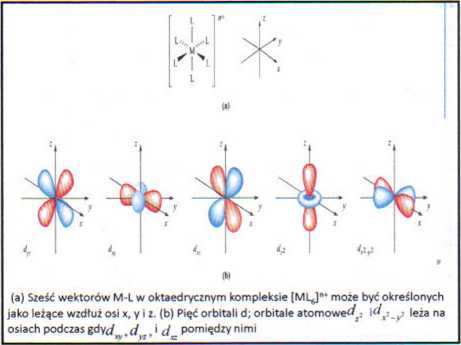

Konsekwencją tej różnicy jest to, że orbitale d w obecności liganda ulegają rozdzieleniu na grupy o różnej energii a typ rozdziału jak i wielkość różnicy energii zależy od rozmieszęzenią j natury Ugandą.
Zarówno właściwości magnetyczne jak i widma elektronowe uzależnione są od tego rozczepienia orbitali -d.
Stany wysoko i nisko spinowe
Jak już zdążyliśmy zauważyć, paramagnetyzm (patrz O^ ale i ponodtlenKi KOjp także ozon ki z paramagnetycznym jonemlOJ ) jest cechą charakterystyczną dla niektórych związków w układzie okresowym a więc i dla metali bloku -d.
Zgódźmy się, że dane magnetyczne pozwalają nam na określenie ilości niesparowanych elektronów. W wyizolowanym pierwszym bloku jonów metali -d 3d orbitale są zdegenerowane i elektrony zajmuje je zgodnie z reguła Hunda tak jak jest to przykładowo przedstawione na poniższym diagramie:
■I + + ++ ttł-ft--
Należy jednak pamiętać, że dla kompleksów oktaedrycznycłW badania magnetyczne wskazują, że powyższe kompleksy mogą zaliczać się do dwóch kategorii tzn.: paramagnetyków lub dlamagnetyków. Pierwszy z wymienionych nazywane są kompleksami wysoko-spinowymł i odnoszą się do tych w których pomimo że orbitale -d uległy rozczepieniu to w dalszym ciągu mamy cztery niesparowane elektrony. W diamagnetycznych kompleksachc/^nazywanych nisko-splnowymi odnosi się to do sytuacji gdzie elektrony zajmują parami trzy orbitale pozostawiając dwa orbitale puste.
Teoria Wiązań Walencyjnych
□ VB tworzenie się kompleksu obejmuje reakcję pomiędzy zasadą Lewis'a (Ugand) a kwasem lewis'a (metal lub jon metalu) z wytworzeniem koordynacyjnego wiązania kowalentnego (lub semipolarnego) między nimi.
□ Ten model wykorzystuje orbitale walencyjne metalu s, p I d dla tłumaczenia obserwowanych struktur i magnetycznych właściwości kompleksu.
□ Chociaż teoria VB w formie przedstawionej przez Paulinga w 1930 r. nie jest już stosowana w dyskusji kompleksów metali bloku d, to terminologia i wiele idei zostało zachowanych i pewna wiedza tej teorii w naszych dyskusjach wydaje się pozostawać niezbędna.
□ Poprzednio już opisywaliśmy zastosowanie hybrydyzacji SP SP ^ I SP‘^ w cząsteczkach o strukturze trygonalnej bi-piramidy, piramidy kwadratowej, oktaedru czy cząsteczki płasko kwadratowej.
□ Te same hybrydyzacje mogą być użyte w opisie wiązania w kompleksach metali bloku -d
Klasyczne użycie teorii wiązań walencyjnych w chemii koordynacyjnej zostab wprowadzone przez Paulinga w jego książce: The Naturę of the Chemical Bond’ J* ed. Come/I University; Ithaca, NY, 1960._
|
Ucz ba koordyn |
Rozłożenie •tomów |
Orbitale hybryduMce |
Za pis |
Przykład | |||
|
2 |
Unio we |
CLJ |
W |
[AgłNH.hr | |||
|
3 |
Płaskie trójkątne |
ffl |
sp2 |
[Hgł,t | |||
|
4 4 |
Tetraedryczne Płaskie kwadratowe |
H HS |
spł sp2d |
lFa8rJ> INHCN)«P | |||
|
s s |
Bipiramida t rygo na Ina Piramida kwadratowa |
fi G9 |
spyd spy d |
(CuCIJ*- (MICNM* | |||
|
6 6 |
Oktaedr Graniastosłup trygonalny |
ja |
sp'd2 sd’ |
(Co(NH,W prMeJ*- | |||
|
7 7 |
Bipiramida pentagonalna Jedno wierzchołkowy trygonalny graniastosłup |
52 |
sp'd' sp'd2 |
(vłcN)Tr [NbF,J' | |||
|
8 8 8 |
Kubki ny Owunastościan Kwadratowy antypryzmat |
S-y |
% |
sP>d’f . ,, sp’d‘ SPd |
[PaF.P (Mo(CN),r [TaFJ> | ||
|
9 |
Graniastosłup trygonalny t rój wie r zchołko wy |
sp’di |
P»eH,P | ||||
3
Wyszukiwarka
Podobne podstrony:
Ch koordynacyjna I (1) 2009-01-12 Drugim istotnym udział Wernera w rozwoju i badaniach chemii koord
Ch koordynacyjna I (4) 2009-01-12 ZASADY ELEKTROUJEMNOŚCII WIĄZANIA ZWROTNE ♦> Jedną z trudności
Ch koordynacyjna I 2009-01-12ChemiakoordynacyjnaZwiązki koordynacyjne były wyzwaniem dla chemików n
Ch koordynacyjna I (3) 2009-01-12Zastosowanie i ograniczenia teorii VB Kompleksy oktaedryczne kompl
Blok d (8) 2009-01-12 wymienione należą do grupy kompleksów wysoko spinowych. W grupie kompleksów ok
Ch koordynacyjna II (1) 2009-01-12 Tak jak w przypadku sferycznego pola i tutaj wszystkie orbitale
Ch koordynacyjna II (2) 2009-01-12 Widmo absorpcyjne takiego jonu posiada jedno szerokie pasmo dla
Ch koordynacyjna II (5) 2009-01-12 Z kompleksem o takiej orientacji żaden z orbitali d metalu nie j
Blok d (5) 2009-01-12 Rysunek (a) przedstawia kompleks w który wyraźnie wskazane jest tworzenie się
12,02,2009(1) 2009-01-12 1 2Kryteria normalności Norma jest wzorem oceny • „stan w
12,02,2009(2) 2009-01-12 T. Scheff: choroba psychiczna to ideologia „białych" 111_i Problem
Blok d (2) 2009-01-12 [&<li]0śEp«M)Ś(§ BEfDdM Kilka uogólnień w odniesieniu do pierwiastków
Blok d (3) 2009-01-12 ---■.___—........4f, •* -f-r 4+4+. 4++r:.■H"*........4f C,
Blok d (6) 2009-01-12 Model Keperta tłumaczy kształt kompleksów metali bloku d [MLJ, czy [ML J"
Blok d (9) 2009-01-12 Określenie przeciw-jonów jest Istotne poniewai rótnice energetyczne pomiędzy 8
AM7 2009.01-12 ANALIZA MATEMATYCZNA 1, Informatyka i Ekonometria rok I Lista 7 Rachunek różniczkow
Skanowanie 10 01 12 58 (11) się szczególnie podrażnionym, liczył jednak na to, że Strumieńskiego pr
więcej podobnych podstron