1
ĆWICZENIE 7
Kwasy karboksylowe, tłuszcze, aminokwasy
I. Reakcje na kwasy karboksylowe
Kwasy karboksylowe w porównaniu z kwasami mineralnymi są kwasami słabymi, ale
mocniejszymi od kwasu węglowego.
Swoistość reakcji, w których biorą udział kwasy karboksylowe zależy albo od rodnika
organicznego, z którym połączona jest grupa karboksylowa albo od obecności w cząsteczce
drugiej, innej grupy funkcyjnej.
1. Wypieranie CO
2
z wodorowęglanu sodu
Wykonanie:
Do około 1 ml roztworu kwasu organicznego dodać około 1 ml 5% roztworu NaHCO
3
.
Wymieszać zawartość probówki. Obserwować wydzielanie się pęcherzyków CO
2.
RCOOH
NaHCO
3
RCOONa
O
H
2
CO
2
+
+
+
2. Próba na kwas mrówkowy
Kwas mrówkowy dzięki obecności jednocześnie grupy aldehydowej i karboksylowej posiada
właściwości redukcyjne, charakterystyczne dla aldehydów i właściwości charakterystyczne dla
kwasów karboksylowych.
C
H
O
OH
HgCl
2
Hg
2
Cl
2
CO
2
HCl
+ 2
+
+ 2
sublimat
kalomel
Wykonanie:
Do około 1 ml roztworu kwasu mrówkowego dodać kilka kropli 5% roztworu sublimatu
(HgCl
2
) i ogrzewać we wrzącej łaźni wodnej do pojawienia się białego osadu kalomelu (Hg
2
Cl
2
).
3. Próba na kwas mlekowy
Kwas mlekowy (2-hydroksypropanowy) podobnie jak i inne 2-hydroksykwasy zmienia
barwę odczynnika Uffelmanna na kolor żółto-zielony.
Wykonanie:
Sporządzić odczynnik Uffelmanna dodając do około 2 ml 1% wodnego roztworu fenolu 2
krople roztworu FeCl
3.
Do około 1 ml roztworu
kwasu mlekowego dodać kilka kropli
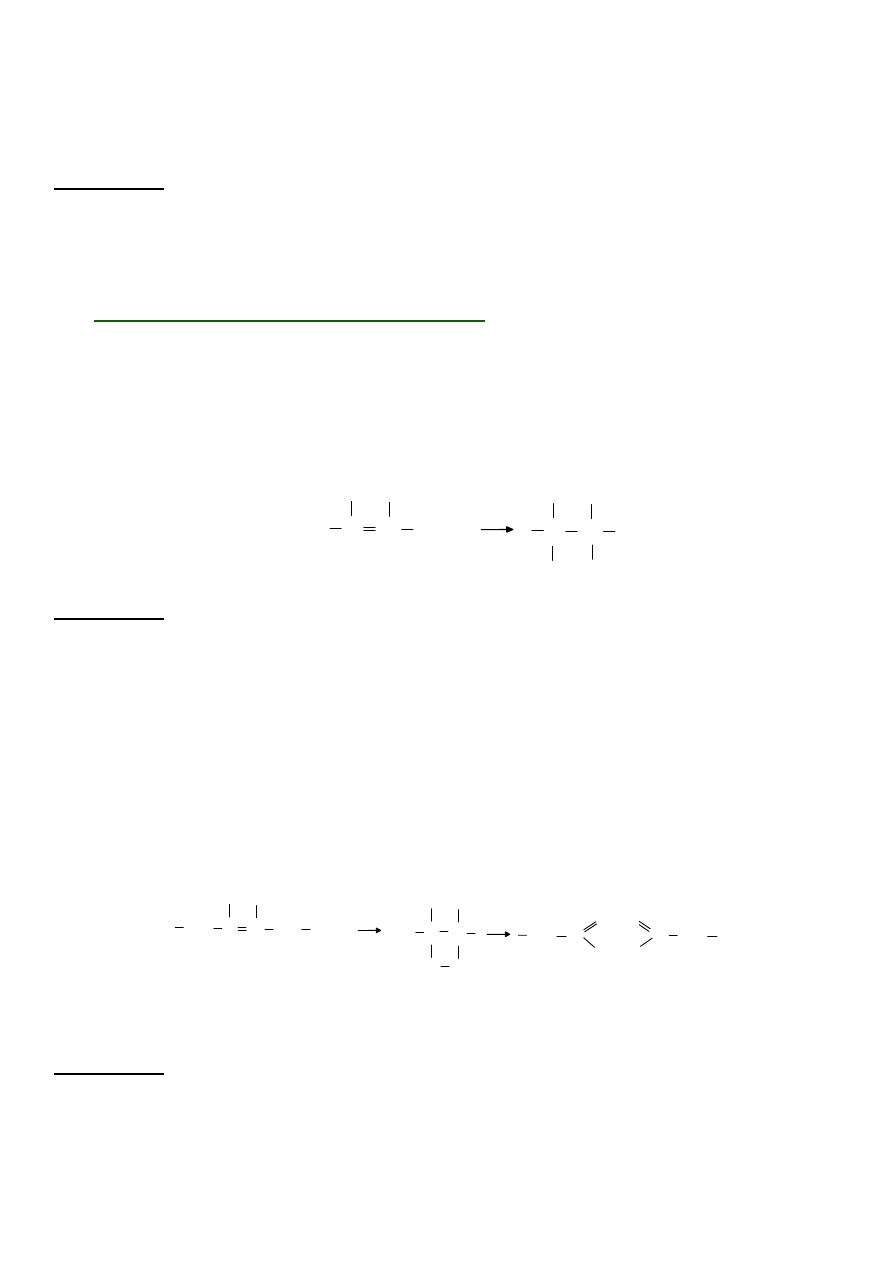
2
przygotowanego odczynnika. Kwas mlekowy zmienia fioletową barwę odczynnika na barwę jasno
żółto-zieloną.
4. Próba na kwas salicylowy
Wykonanie:
Kilka kryształków kwasu salicylowego rozpuścić w 1 ml wody i dodać 1 kroplę roztworu
FeCl
3.
Podobnie jak w roztworze fenoli występuje fioletowe zabarwienie.
II. Reakcje na kwasy tłuszczowe i lipidy
1. Przyłączanie chlorowca do nienasyconych kwasów tłuszczowych
Jod (lub inne chlorowce) łatwo przyłącza się w miejscu podwójnego wiązania, w wyniku
czego brunatny roztwór jodu odbarwia się na skutek powstania bezbarwnego związku z
organicznie związanym jodem.
C
H
C
H
I
2
C
H
C
H
I
I
+
Wykonanie:
Do 3 kropli oliwy dodawać kroplami odczynnik Hűbla (roztwór jodu i chlorku rtęci(II) w
alkoholu). Płyn odbarwia się po pewnym czasie w temperaturze pokojowej lub natychmiast po
ogrzaniu.
2. Utlenianie wiązań podwójnych w nienasyconych kwasach tłuszczowych
Wiązania podwójne łatwo ulegają utlenieniu pod wpływem tlenu z utleniaczy, a także,
chociaż znacznie wolniej, pod wpływem tlenu atmosferycznego. Cząsteczka kwasu tłuszczowego,
w miejscu podwójnego wiązania, ulega rozbiciu na 2 cząsteczki zawierające grupy aldehydowe.
C
H
C
H
CH
2
CH
2
O
2
C
H
C
H
CH
2
O O
CH
2
C
CH
2
C
+
H
O
+
O
H
Reakcja ta zachodzi podczas jełczenia tłuszczów, a gromadzące się aldehydy nadają im przykry
smak i zapach.
Wykonanie:
Rozpuścić kilka kropli oliwy w 1 ml roztworu Na
2
CO
3
. Dodawać kroplami roztwór KMnO
4
,
następuje odbarwienie nadmanganianu.

3
3. Rozpuszczalność tłuszczów
Tłuszcze posiadają długie hydrofobowe reszty kwasów tłuszczowych i dlatego rozpuszczają
się dobrze w rozpuszczalnikach niepolarnych, takich jak chloroform, eter, benzen, nie
rozpuszczają się natomiast w rozpuszczalnikach polarnych.
Wykonanie:
a)
Kilka kropli oliwy zalać 3 ml wody i wytrzasnąć. Tworzy się nietrwała emulsja tłuszczu w
wodzie, która po pewnym czasie rozdziela się na dwie warstwy.
b)
Do kilku kropli oliwy dodać 2 ml chloroformu i wstrząsnąć. Tłuszcz ulega całkowitemu
rozpuszczeniu.
4. Powstawanie mydeł
Ogrzewanie tłuszczu w środowisku alkalicznym doprowadza do hydrolizy wiązań
estrowych, a uwolnione kwasy tłuszczowe tworzą z jonami sodu lub potasu rozpuszczalne sole
zwane mydłami. Z roztworów mydeł rozpuszczalnych można wytrącać mydła nierozpuszczalne
odpowiednimi jonami (Ba
2+
,
Ca
2+
, Pb
2+
).
Wykonanie:
Do kilku kropli oliwy dodać 3-4 ml alkoholowego roztworu KOH i mieszaninę ogrzewać kilka
minut we wrzącej łaźni wodnej. Do mieszaniny dodać 10 ml wody destylowanej i wstrząsnąć.
Pienienie się roztworu świadczy o obecności mydeł.
III. Reakcje na niektóre aminokwasy
1. Reakcja z siarczanem(VI) miedzi(II)
Aminokwasy dają niebieskie zabarwienie z roztworem siarczanu(VI) miedzi(II) CuSO
4
w
wyniku utworzenia się związku kompleksowego.
R
NH
2
CuSO
4
Cu
O
C
O
CH
NH
2
R
R
CH NH
2
O
C
O
H
2
SO
4
COOH
CH
2
+
+
Wykonanie:
Do 1-2 ml 1% roztworu glicyny dodać 5 kropli 10% roztworu CuSO
4
. Mieszanina ciemnieje
po ogrzaniu w płomieniu palnika.

4
2. Reakcja z kwasem azotowym(III)
Aminokwasy, jako I-rzędowe aminy alifatyczne, pod wpływem kwasu azotowego(III) tworzą
alkoholokwas, wodę i azot, który wydziela się z roztworu.
R
NH
2
COOH
C
H
HNO
2
R
COOH
C
H
OH
N
2
2
O
+
+
+ H
Wykonanie
:
(przeprowadzać pod dygestorium)
Rozpuścić szczyptę azotanu(III) sodu w 1 ml 2M H
2
SO
4
. Z roztworu wydzielają się
pęcherzyki gazu (tlenki azotu). Po chwili, gdy ustanie wydzielanie się pęcherzyków, dodać kilka
kropli roztworu aminokwasu. Roztwór zamieszać i obserwować wydzielanie się pęcherzyków
azotu.
3. Próba ksantoproteinowa na aminokwasy aromatyczne
Aminokwasy zawierające pierścień benzenowy (np. tyrozyna) pod wpływem stężonego
kwasu azotowego(V) ulegają nitrowaniu,
w wyniku czego powstają pochodne nitrowe o barwie
żółtej. Po zalkalizowaniu, związki nitrowe słabo dysocjują i barwa roztworu zmienia się na
pomarańczową. Próbę tę dają również inne związki aromatyczne, jak fenol, benzen itp., a także
większość białek, gdyż zawierają aminokwasy aromatyczne.
Wykonanie:
Do 1 ml roztworu aminokwasu aromatycznego (tyrozyny) dodać 5 kropli stężonego HNO
3
,
po podgrzaniu roztwór żółknie.
Wyszukiwarka
Podobne podstrony:
Tłuszcze aminokwasy hormony białkowe białka enzymy kwasy organiczne?rmakognozja
Wyższe kwasy tłuszczowe
11 Kwasy tłuszczowe i ikozanoidy
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
Jelinska kwasy tluszczowe w nowotworzeni
Kwasy tłuszczowe OMEGA 3 Gdzie można je znaleźć (EUFIC)
NIEZBĘDNE NIENASYCONE KWASY TŁUSZCZOWE 5fantastic pl
6 tłuszcze, nienasycone kwasy tłuszczowe, prostanoidy, woski, fosfolipidy Kopia
pros 11 Metabolizm kw tłuszczowe, aminokwasy
Kwasy tluszczowe nasycone i jednonienasycone1111111111111111111111111111
Enzymy, kinematyka, kwasy tłuszczowe
13.Kwasy tłuszczowe, Notatki AWF, Biochemia
Kwasy tłuszczowe LC, Kwasy tłuszczowe LC-PUFA: istotny czynnik wpływający na inteligencję dziecka
kwasy tłuszczowe izomery trans
NIEZBĘDNE NIENASYCONE KWASY TŁUSZCZOWE Z GRUPY N6, Materiały - Biotechnologia
Kwasy tłuszczowe
kwasy tłuszczowe wielonienasycone
Kwasy tłuszczowe OMEGA-3 -Gdzie można je znaleźć (EUFIC)
Nasycone Kwasy Tłuszczowe
więcej podobnych podstron