
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Piotr Korsak
Rozpoznawanie podstawowych materiałów stosowanych
w złotnictwie i jubilerstwie
731[06].O1.03
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
Jerzy Laskowski
Mirosław Muraszkowski
Opracowanie redakcyjne:
Antoni Korsak
Konsultacja:
Zenon W. Pietkiewicz
Korekta:
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej „Rozpoznawanie
podstawowych materiałów stosowanych w złotnictwie i jubilerstwie” 731[06].O1.03
zawartego w modułowym programie nauczania dla zawodu złotnik-jubiler.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Materiał nauczania
7
4.1. Metale szlachetne, metale nieżelazne. Właściwości chemiczne, mechaniczne
i technologiczne metali i stopów
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
12
4.1.3. Ćwiczenia
12
4.1.4. Sprawdzian postępów
13
4. 2. Sporządzanie stopów metali szlachetnych. Polskie Ustawodawstwo Probiercze
14
4.2.1. Materiał nauczania
14
4.2.2. Pytania sprawdzające
18
4.2.3. Ćwiczenia
18
4.2.4. Sprawdzian postępów
20
4. 3. Rafinacja metali szlachetnych. Związki chemiczne stosowane w złotnictwie
21
4.3.1. Materiał nauczania
21
4.3.2. Pytania sprawdzające
24
4.3.3. Ćwiczenia
24
4.3.4. Sprawdzian postępów
25
4. 4. Kamienie jubilerskie
26
4.4.1. Materiał nauczania
26
4.4.2. Pytania sprawdzające
27
4.4.3. Ćwiczenia
27
4.4.4. Sprawdzian postępów
30
5. Sprawdzian osiągnięć
31
6. Literatura
36

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o podstawowych materiałach
stosowanych w złotnictwie i jubilerstwie.
Poradnik ten zawiera:
1. Wymagania wstępne, czyli wykaz niezbędnych umiejętności i wiedzy, które powinieneś
mieć opanowane, aby przystąpić do realizacji tej jednostki modułowej.
2. Cele kształcenia tej jednostki modułowej.
3. Materiał nauczania (rozdział 4) który umożliwi Ci przygotowanie się do wykonywania
ćwiczeń i zaliczenia sprawdzianów. Obejmuje on ćwiczenia, które zawierają:
−
opis ćwiczeń, jakie masz wykonać,
−
wykaz materiałów potrzebnych do realizacji ćwiczenia.
Jeśli będziesz miał trudności ze zrozumieniem tematu ćwiczeń, poproś nauczyciela lub
instruktora o wyjaśnienie i ewentualne sprawdzenie czy dobrze je wykonujesz
4. Sprawdzian osiągnięć który sprawdzi Twoje opanowanie wiedzy i umiejętności z zakresu
całej jednostki. Zaliczenie tego sprawdzianu jest dowodem osiągnięcia umiejętności
praktycznych określonych w tej jednostce modułowej.
5. Wykaz literatury. Wykorzystaj do poszerzenia wiedzy wskazaną literaturę oraz inne
źródła informacji. Zaproponowane lektury pozwolą poszerzyć i pogłębić wiedzę
teoretyczną w tych zakresach, które szczególnie Cię zainteresują lub będą niezbędne w
realizacji zadań zawodowych.
Bezpieczeństwo i higiena pracy
Podczas wykonywania czynności w pracowni należy stosować się do regulaminu,
przepisów bhp oraz instrukcji przeciwpożarowych wynikających z rodzaju wykonywanych
prac. Przepisy te poznasz podczas trwania nauki.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
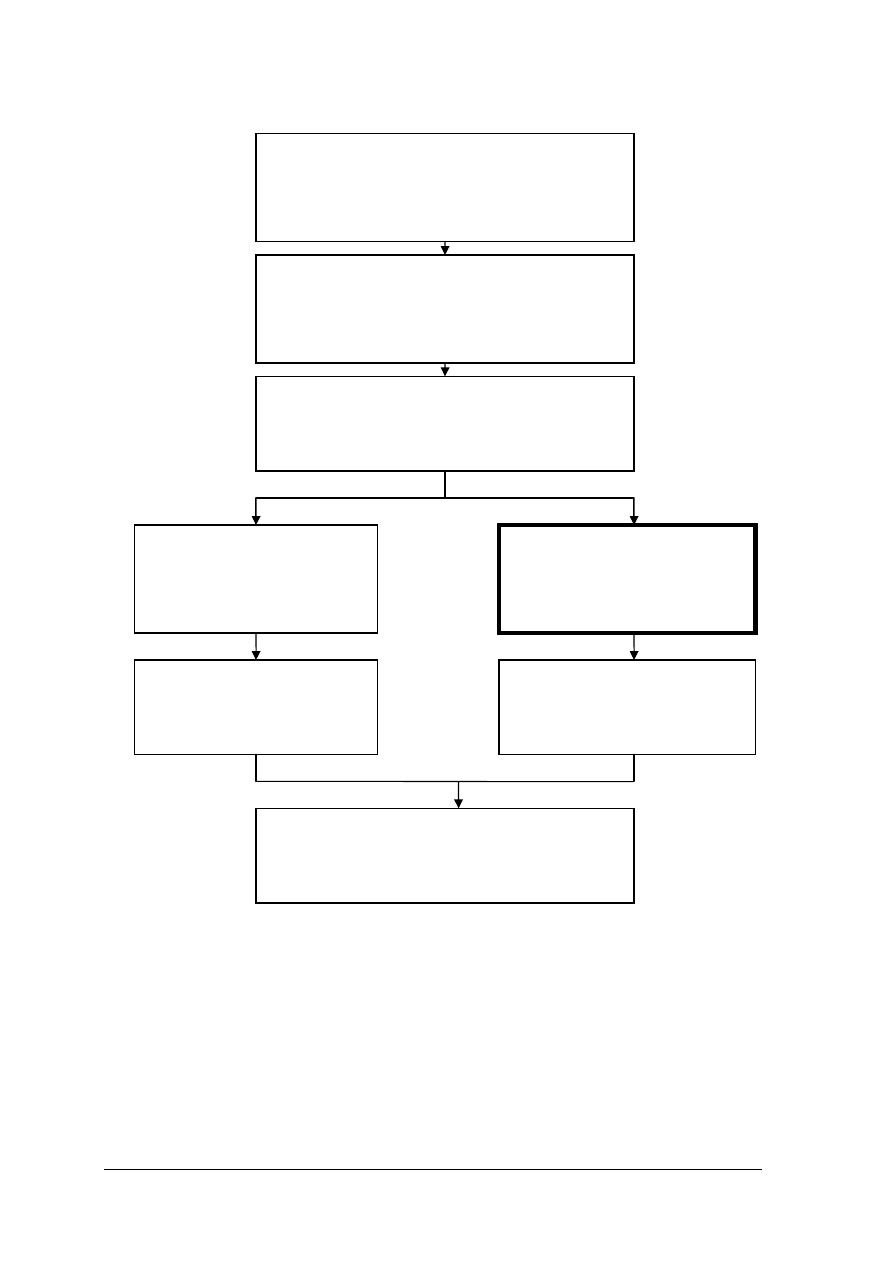
Schemat układu jednostek modułowych w module 731[06].O1
„Podstawy złotnictwa i jubilerstwa”.
731[06].O1
Podstawy złotnictwa i jubilerstwa.
731[06].O1.01
Rozpoznawanie wyrobów złotniczych
pochodzących z różnych okresów historycznych.
731[06].O1.02
Przestrzeganie przepisów bezpieczeństwa
i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska.
731 [06].O1.04
Posługiwanie się
dokumentacją techniczną.
731[06].O1.03
Rozpoznawanie podstawowych
materiałów stosowanych
w złotnictwie i jubilerstwie.
731[06].O1.05
Projektowanie wyrobów
złotniczo–jubilerskich.
731[06].O1.06
Rozróżnianie maszyn
i urządzeń stosowanych
w złotnictwie i jubilerstwie.
731[06].O1.07
Wykonywanie prac z zakresu obróbki ręcznej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2.
WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej, powinieneś umieć:
−
rozpoznawać wyroby złotnicze pochodzące z różnych okresów historycznych,
−
stosować się do przepisów bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej
oraz ochrony środowiska.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej, powinieneś umieć:
−
zastosować zasady bezpieczeństwa, higieny pracy oraz ochrony środowiska podczas prac
z materiałami złotniczymi,
−
określić właściwości fizyczne, chemiczne, mechaniczne i technologiczne metali
i stopów stosowanych w złotnictwie,
−
obliczyć próby stopu,
−
zbadać stopy metali szlachetnych metodami przybliżonymi,
−
objaśnić przepisy ustawodawstwa probierczego,
−
określić zastosowanie poszczególnych związków chemicznych wykorzystanych
w złotnictwie,
−
sklasyfikować kamienie jubilerskie,
−
określić zasady racjonalnej gospodarki materiałami złotniczymi,
−
rozróżnić materiały złotniczo–jubilerskie,
−
posłużyć się normami.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Metale
szlachetne,
metale
nieżelazne.
Właściwości
chemiczne, mechaniczne i technologiczne metali i stopów
4.1.1. Materiał nauczania
Metale szlachetne stosowane w złotnictwie:
Do metali szlachetnych należą:
−
złoto,
−
srebro,
−
platyna,
−
pallad,
−
ruten,
−
rod,
metale z grupy
−
osm, platynowców
−
iryd.
Właściwości fizyczne
−
barwa,
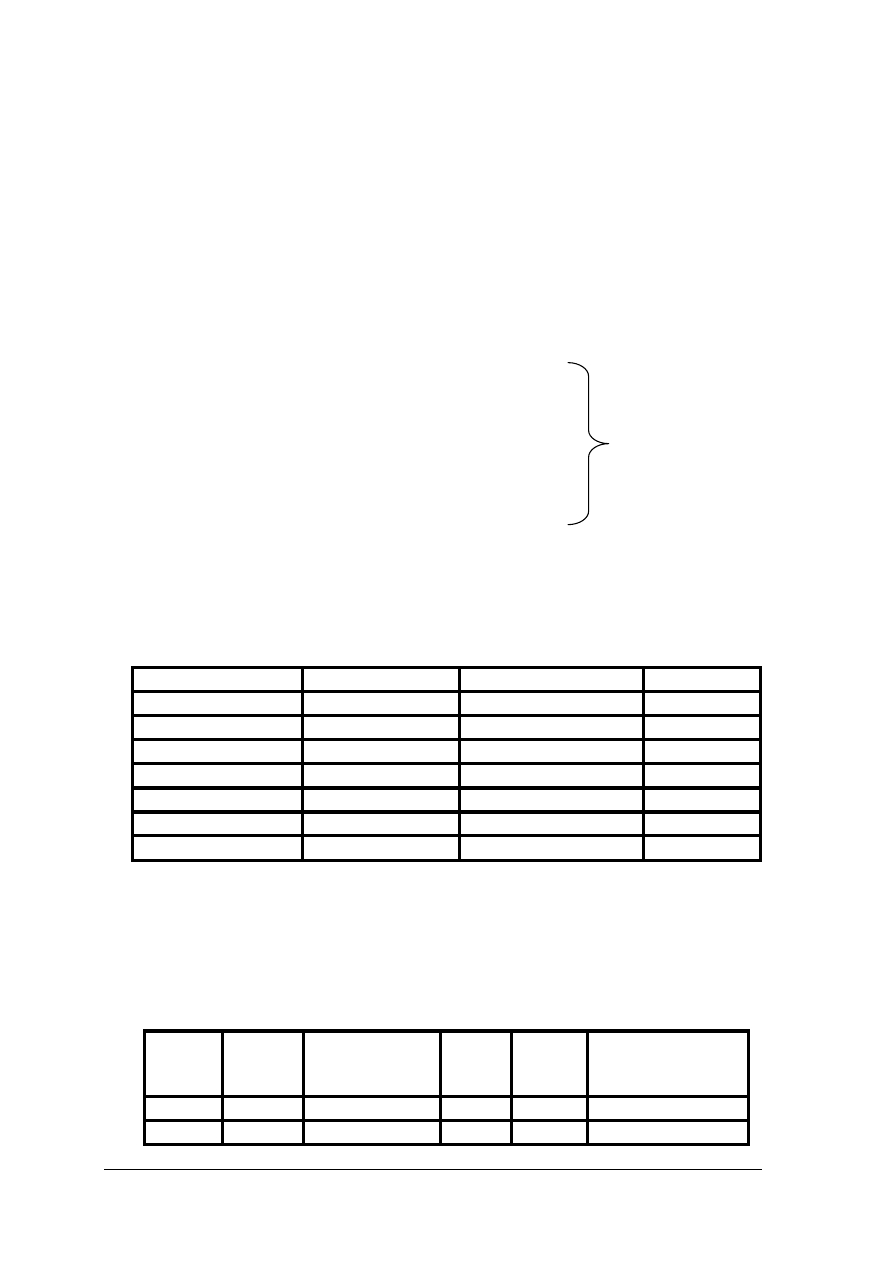
Tab. 1. Barwy metali i stopów [2, s. 19]
Metale i stopy
Barwa
Metale i stopy
Barwa
czyste złoto
żółta
czyste srebro
biała
złoto niskiej próby
żółtoczerwona
srebro niskiej próby
szarobiała
stop złota ze srebrem żółtozielona
nikiel
szara ciepła
miedź
czerwona
chrom
szara zimna
tombak
czerwonożółta
aluminium
matowo szara
mosiądz
żółtozielona
surówka odlewnicza
szaroczarna
brąz
żółtoczerwona
surówka zwierciadlista szarawobiała
−
połysk – zdolność odbijania światła,
−
temperatura topnienia – przejście ze stanu skupienia stałego w stan ciekły,
−
temperatura krzepnięcia – przejście ze stanu skupienia ciekłego w stan stały,
−
gęstość – stosunek masy do objętości.
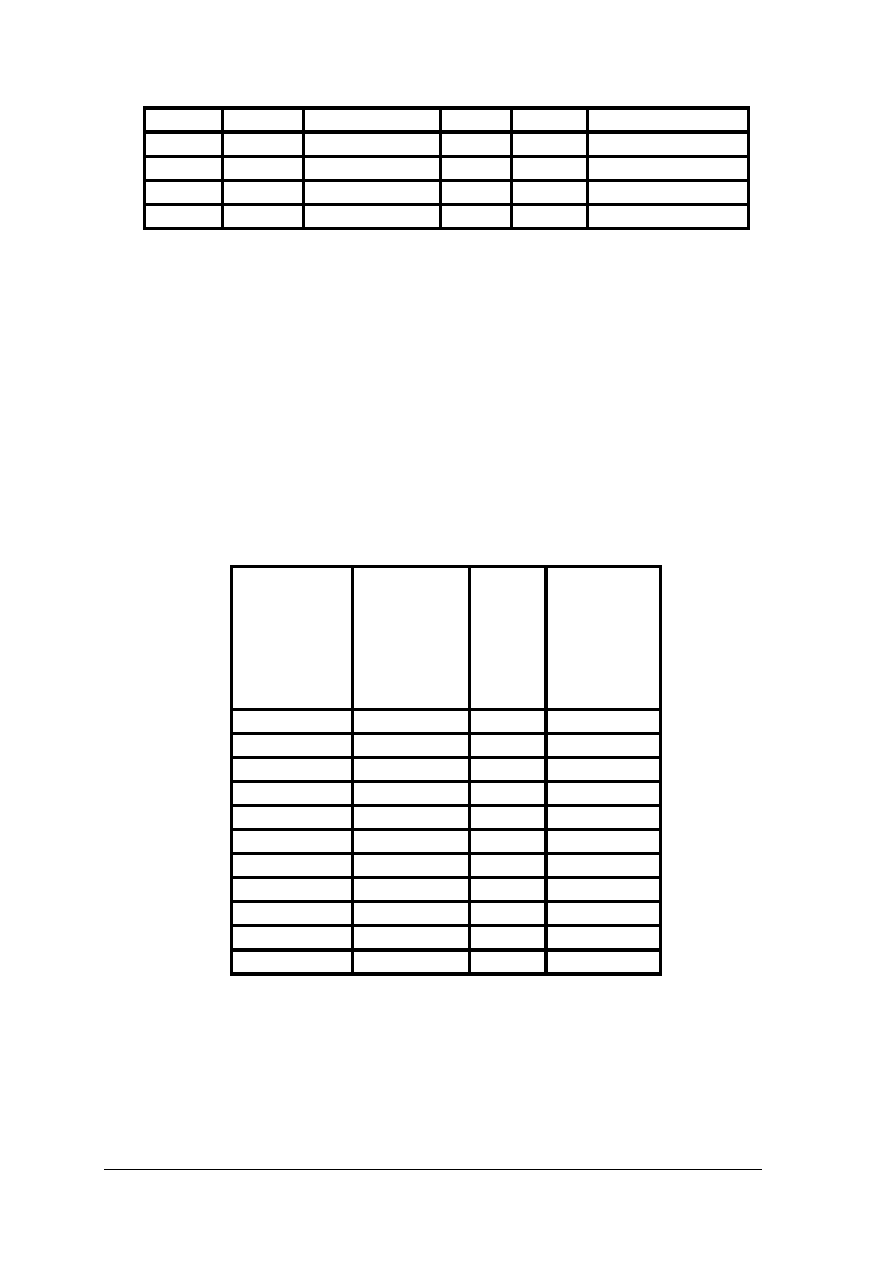
Tab. 2. Gęstość i temperatura metali i stopów najczęściej używanych w wyrobach złotniczo-jubilerskich
Metale
i stopy
Gęstość
w g/cm³
Temperatura
topnienia
w °C
Metale
i stopy
Gęstość
w g/cm³
Temperatura
topnienia
w °C
Cynk
7,14
419,4
Ruten
12,3
2370
Cyna
7,29
231,9
Rod
12,44
1966
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Mosiądz 8,5
900-1045
Rtęć
13,56
-39
Brąz
8,6
1010-1140
Złoto
19,32
1063
Kadm
8,64
321
Platyna 21,5
1773,5
Miedź
8,94
1083
Iryd
22,41
2454
Srebro
10,5
960,5
Pallad
11,4
1773,5
Własności mechaniczne
−
wytrzymałość: opór, jaki dany metal stawia sile próbującej go odkształcić lub rozerwać,
−
sprężystość: zdolność do odzyskania pierwotnego kształtu z chwilą, gdy przestaje działać
siła wywołująca odkształcenie,
−
plastyczność: zdolność do zmiany kształtu bez oznak zniszczenia i zatrzymanie nowego
kształtu po ustaniu działania siły odkształcającej; stosunek przyrostu długości próbki
rozerwanej podczas próby rozciągania do długości pierwotnej, wyrażony w procentach,
nazywamy wydłużeniem względnym,
−
twardość: zdolność do przeciwdziałania przenikaniu do wnętrza metali i stopów innych,
twardszych ciał pod wpływem nacisku zewnętrznego,
−
wytrzymałość zmęczeniowa: właściwość metali, dzięki którym wytrzymują one bez
odkształceń dużą ilość powtarzających się, zmiennych obciążeń.
Tab. 3. Właściwości niektórych czystych metali
Nazwa
metalu
T
w
a
rdo
ść
w
ed
łu
g
B
ri
n
ell
a
H
в
K
g
/mm
²
Wy
trz
y
ma
ło
ść
n
a
ro
zci
ąga
n
ie
K
g
/mm
² Plastyczność
Cynk
42
11,3
dobra
Iryd
150
-
Kadm
16
6,4
b. dobra
Mangan
-
-
kruchy
Miedź
35
15
dobra
Nikiel
80
40
dobra
Pallad
60
16,4
dobra
Platyna
55
20
b. dobra
Rod
-
33,7
Srebro
25
16
b. dobra
Złoto
18
14
b. dobra
Właściwości technologiczne
−
lejność: właściwości gwarantujące dobre wypełnienie formy płynnym metalem (dobrą
lejność wykazuje na przykład: cynk i jego stopy, brąz, cyna); odwrotność lejności
nazywamy gęstopłynnością,
−
skurcz odlewniczy: ubytek objętości podczas krzepnięcia,
−
kowalność: zmiana kształtu bez uszkodzeń pod wpływem uderzeń lub nacisku,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
−
spawalność: zdolność do trwałego połączenia metodą miejscowego podgrzania i
roztopienia łączonych krawędzi,
−
skrawalność: możliwość zmiany kształtu metali przez ręczne lub mechaniczne
zdejmowanie jego warstwy zewnętrznej.
Właściwości chemiczne
−
utlenianie: skłonność metalu do łączenia się z tlenem i tworzenia tlenków metali,
−
rozpuszczalność: skłonności metali i stopów do rozpuszczania się w kwasach i ługach.
W praktyce złotniczej obróbki metali rozróżniamy przypadki częściowego lub
całkowitego rozpuszczenia metali w stopach.
Przykładem częściowego rozpuszczenia się powierzchni metalu jest:
−
trawienie przedmiotów w kwasach, w celu otrzymania gładkiej powierzchni lub wzoru,
Przykładem pełnego rozpuszczenia metalu jest:
−
rozpuszczenie cynku w kwasie solnym,
−
rozpuszczenie srebra w kwasie azotowym,
−
rozpuszczenie złota w wodzie królewskiej.
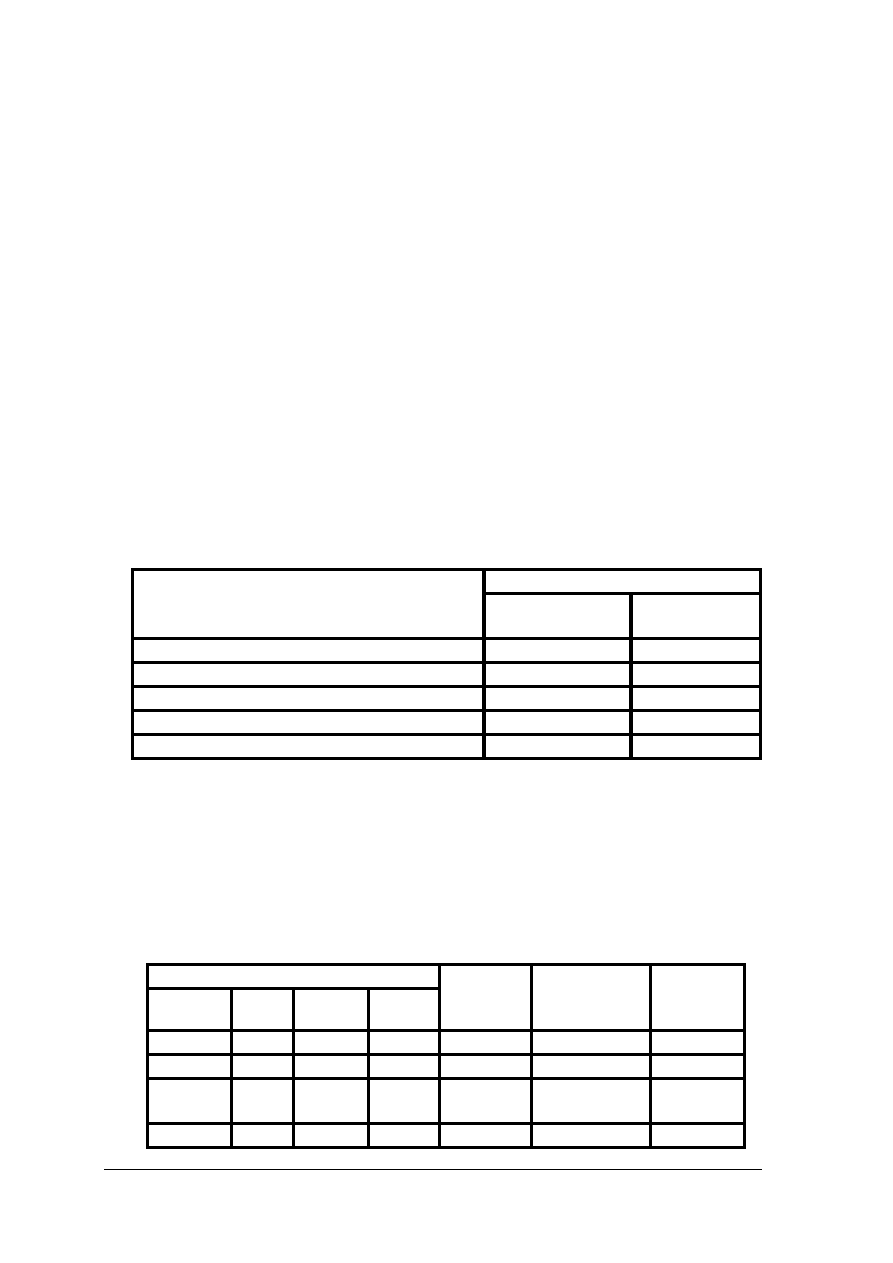
Tab. 4. Tabela rozpuszczalności złota i platynowców [9, s.22]
Związek chemiczny
P
la
ty
na
P
a
ll
ad
Ir
yd
R
od
O
sm
R
u
ten
Z
ło
to
Kwas siarkowy zimny
1
1
1
1
1
1
1
kwas siarkowy gorący
2
3
1
1
1
1
1
Kwas solny zimny
1
1
1
1
1
1
1
Kwas solny gorący
1
1
1
1
1
1
1
Kwas azotowy zimny
1
3
1
1
1
1
1
Kwas azotowy gorący
1
4
1
1
1
1
1
Woda królewska zimna
4
4
1
1
1
1
4
Woda królewska gorąca
4
4
1
2
1
1
4
Kwas fluorowodorowy
1
1
1
1
1
1
1
Ług sodowy stopiony
2
1
1
2
3
2
1
Nadtlenek sodu stopiony
4
4
3
2
3
3
4
Soda stopiona
2
1
1
2
2
1
1
Kwaśny siarczan potasu
2
2
1
2
2
1
1
Azotany alkaliów
1
3
1
1
4
1
1
Cyjanki alkaliów
2
2
1
1
1
1
4
Cyfra 1 oznacza, że dany związek nie działa na metal, 2
lekko atakuje
metal, 3
silnie atakuje metal, 4
całkowicie rozpuszcza metal.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Metale nieżelazne stosowane w złotnictwie
Do metali nieżelaznych stosowanych w złotnictwie należą:
−
miedź
temperatura topnienia
1083°C
−
cynk
temperatura topnienia
419°C
−
cyna
temperatura topnienia
232°C
−
kadm
temperatura topnienia
321°C
−
nikiel
temperatura topnienia
1455°C
Stopy metali szlachetnych
Stopy złota są to stopy posiadające w swoim składzie najwięcej tego metalu. Składnikami
stopów złota są:
−
srebro (wpływa na barwę stopu),
−
miedź (wpływa na barwę stopu),
−
platyna (wykorzystywana w stopach do wyrobów dentystycznych),
−
mangan (wpływa na twardość),
−
cynk (obniża temperaturę topnienia stopu).
Stopy złota kolorowego to złoto czerwone, białe niklowe, białe palladowe, niebieskie i szare.
Tab. 5. Barwy metali i stopów najczęściej stosowanych w złotnictwie [2, s. 19]
Na 1 g złota czystego dodać
Żądana barwa złota próby 0,585
srebra
g
miedzi
g
żółtozielona
0,612
0,103
bladożółta
0,428
0,287
czerwonawa
0,343
0,372
czerwonożółta
0,201
0,514
czerwona
-
0,715
Stopy srebra są to stopy posiadające w swoim składzie najwięcej tego metalu.
Składnikami stopów srebra są:
−
miedź,
−
cynk,
−
kadm,
−
mangan,
−
nikiel,
−
pallad.
Oprócz składu, na właściwości stopów wpływają także proporcje zawartych składników.
Stopy platyny:
Tab. 6. Skład i właściwości niektórych stopów platyny [9, s. 142]
Skład w tysiącznych częściach
platyna
złoto
srebro
miedź
Barwa
Temperatura
topnienia w
°C
Ciężar
właściwy
950
-
50
-
Biała
1515
20,6
950
-
-
50
Biała
1735
20,5
250
80
670
-
Srebrno
biała
1173
13,7
50
700
88
162
żółta
957
16,7

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Stopy palladu:
Tab. 7. Skład i właściwości niektórych stopów palladu [9, s. 143]
Skład w tysiącznych częściach
pallad
srebro
miedź
Barwa
Temperatura
topnienia
w
°C
Ciężar
właściwy
1000
-
-
Srebrno biała
1549
11,9
950
-
50
Srebrno biała
1502
11,5
950
50
-
Srebrno biała
1549
11,6
Stopy metali nieżelaznych
−
stopy miedzi z cynkiem – mosiądz, tombak,
−
stopy miedzi z cyną – brąz,
−
stop niklu z miedza i cynkiem – alpaka,
−
stop miedzi z aluminium – brąz aluminiowy.
Luty
Lutowaniem nazywamy łączenie ze sobą dwóch lub więcej metali przy pomocy
kolejnego, nazywanego lutem.
Lut musi spełniać następujące wymagania:
−
mieć temperaturę topnienia niższą niż łączone metale,
−
rozpuszczać w sobie łączone metale,
−
mieć barwę zbliżoną do łączonych stopów,
−
równomiernie rozpływać się w miejscu lutowania,
−
być plastyczny.
W złotnictwie wyróżniamy lutowanie:
−
miękkie, w temperaturze około 400 ° C,
−
twarde, w temperaturze powyżej 500 ° C.
Struktura metali i ich stopów
Strukturą metali nazywamy ich wewnętrzną budowę. Każdy metal zbudowany jest
z kryształów ciasno do siebie przylegających. Ich wielkość zależy od:
−
warunków krystalizacji (a dokładniej tego, jak długi jest okres przejścia ze stanu
skupienia ciekłego w stan stały – im wolniej schładzamy metal, tym kryształy są większe,
ale jest ich mniej),
−
sposobu obróbki metalu.
Wpływ obróbki mechanicznej i cieplnej na strukturę metali i ich stopów
Obróbka mechaniczna powoduje częściową zmianę budowy wewnętrznej stopu,
właściwości fizycznych i mechanicznych. Jest przyczyną powstania napięć wewnętrznych
stopu. Kryształy ulegają rozdrobnieniu i zmienia się ich kształt. Metale i stopy metali stają się
twardsze i bardziej kruche, co utrudnia ich dalszą obróbkę mechaniczną.
Przykłady obróbki mechanicznej:
−
wyciąganie,
−
ciągnienie,
−
wytłaczanie,
−
kucie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Obróbka cieplna polega na wyżarzaniu i chłodzeniu metalu. Jej celem jest zmiana
struktury metalu, która zależy od temperatury i czasu obróbki. W efekcie kryształy stają się
większe, a metal bardziej plastyczny.
Rozróżniamy następujące rodzaje obróbki cieplnej:
−
wyżarzanie,
−
przesycanie,
−
hartowanie,
−
odpuszczanie.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie są chemiczne właściwości metali szlachetnych?
2. Jakie są fizyczne właściwości metali szlachetnych?
3. Jakie są właściwości technologiczne metali szlachetnych?
4. Co to są stopy metali szlachetnych?
5. Jaki wpływ ma obróbka mechaniczna na właściwości metali szlachetnych?
6. Jaki wpływ ma obróbka cieplna na metale szlachetne?
4.1.3. Ćwiczenia
Ćwiczenie 1
Rozpoznaj za pomocą gięcia i na podstawie barwy próbę w trzech kawałkach drutu
wykonanego z różnych stopów złota: 0,960; 0,585 i 0,333.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) dokonać próby gięcia drutu,
2) określić barwę badanych próbek,
3) wyciągnąć wnioski z przeprowadzonych obserwacji,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności i estetyki wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
próbki metali.
Ćwiczenie 2
Określ próbę trzech próbek stopów platyny na podstawie barwy (biała, srebrno biała,
żółta).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) porównać próbki ze sobą, ustalić ich barwy,
2) zaprezentować wykonane ćwiczenie,
3) dokonać oceny poprawności i estetyki wykonanego ćwiczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Wyposażenie stanowiska pracy:
−
próbki metali,
−
tabela składu i właściwości stopów platyny.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić różnicę pomiędzy metalem a stopem metali?
2) określić, co to jest struktura metalu?
3) zdefiniować pojęcie mosiądzu i brązu?
4) określić, do czego służą luty?
5) wymienić metale, które są domieszkami w stopach srebra?
6) wymienić metale, które odbarwiają złoto, tworząc stop złota barwy białej?
7) zdefiniować pojęcie plastyczności, wytrzymałości, twardości?
8) wymienić czynności, które powodują utwardzanie metali kolorowych?
9) określić, jaki wpływ na strukturę metalu ma obróbka mechaniczna?
10) określić, jaki wpływ na strukturę metalu ma obróbka cieplna?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
4.2. Sporządzanie
stopów
metali
szlachetnych.
Polskie
ustawodawstwo probiercze
4.2.1. Materiał nauczania
Stopy metali szlachetnych wykonujemy, ponieważ czyste metale szlachetne nie nadają się
do sporządzania wyrobów jubilerskich. Czyste srebro i złoto (próby 0,999 jest za miękkie i
wyroby wykonane w tej próbie byłyby bardzo podatne na wszelkie odkształcenia).
Zastosowanie stopów przy wyrobie biżuterii powoduje poprawę także innych właściwości
metali szlachetnych: ciągliwości, sprężystości, wytrzymałości, barwy i połysku.
Sporządzanie stopów złota kolorowego
−
topienie czystego złota,
−
topienie ligury–miedź, srebro,
−
topienie łączne złota z ligurą.
Sporządzanie stopów złota białego niklowego
−
przygotowanie ligury (nikiel, miedź, cynk),
−
przygotowanie czystego złota,
−
topienie w kolejności: nikiel z miedzią, cynk z miedzią,
−
sporządzanie stopu złota białego przez stopienie złota z ligurą.
Sporządzanie złota białego palladowego
−
przygotowanie ligury (pallad, miedź, cynk),
−
przygotowanie czystego złota,
−
topienie w kolejności – pallad z miedzią, cynk z miedzią,
−
sporządzanie stopu złota białego palladowego przez stopienie ligury ze złotem.
Tab. 8. Skład stopów złota białego.
Złoto
Srebro
Miedź
Nikiel
Pallad
Cynk
Próba
g r a m ó w
0,585
10,03
-
3,42
2,48
-
1,20
0,585
10,03
-
4,10
2,56
-
0,45
0,585
10,03
-
3,43
2,25
-
1,42
0,585
10,03
1,03
2,10
2,56
-
1,45
0,585
10,03
-
4 g alpaki
3,10
-
-
0,585
10,03
4,60
-
-
2,50
-
0,750
10
-
1,53
1,80
-
-
0,750
10
-
1,27
1,73
-
0,33
0,750
10
0,67
0,66
-
2,00
-

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Sporządzanie stopów srebra
−
przygotowanie miedzi,
−
przygotowanie czystego srebra,
−
sporządzanie stopu srebra przez stopienie srebra z miedzią.
Obliczanie składu i próby stopów metali szlachetnych
Obliczanie składu stopu polega na określeniu masy czystego metalu i masy domieszek
(ligury) w stopie. Do wykonania obliczeń potrzebne nam będą pojęcia:
−
całkowitej masy stopu,
−
masy metalu szlachetnego zawartego w stopie,
−
masy domieszki w stopie metalu szlachetnego,
−
próby stopu metalu szlachetnego.
Skład stopu obliczamy następująco:
zawartość czystego metalu w stopie = całkowita masa stopu x próba stopu
Przykład obliczenia składu stopu 20 gram stopu złota próby 0,585.
20 gram
całkowita masa stopu
0,585
próba stopu
20 x 0,585
masa czystego złota w stopie
20 – ( 20 x 0,585) = 8,300 g.
masa domieszek w stopie
Próba stopu metalu szlachetnego jest to stosunek masy czystego metalu w stopie do
całkowitej masy stopu, wyrażany z dokładnością do jednej tysiącznej. Obliczamy ją
następująco:
masa metalu szlachetnego
próba metalu =
całkowita masa stopu
Przykład obliczenia próby stopu wykonanego z 2 gram stopu złota próby 0,585 i 4 gram
próby stopu złota 0,750.
2 x 0,585 + 4 x 0,750
próba metalu = = 0,695
2 + 4
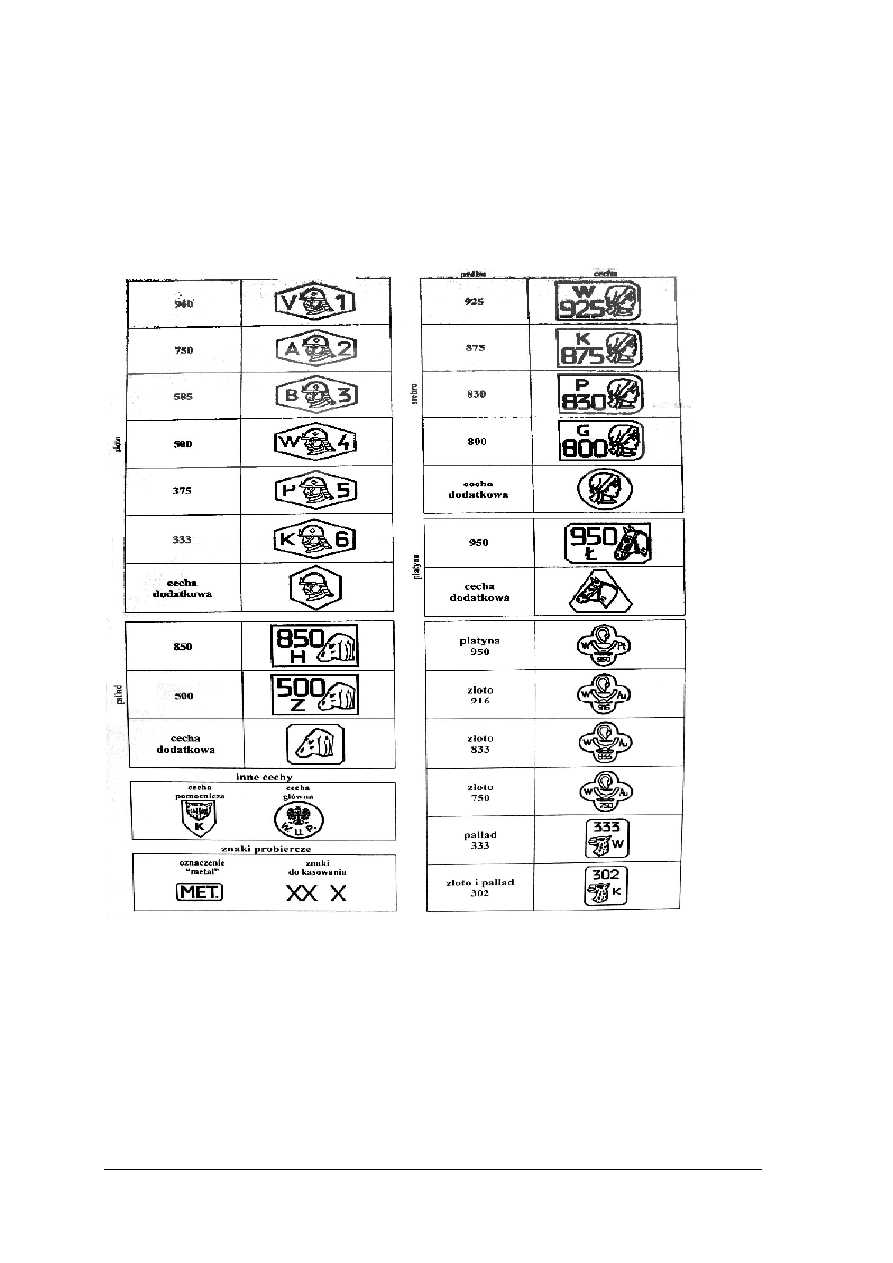
Polskie ustawodawstwo probiercze
Przepisy normujące zasady handlu wyrobami wykonanymi z metali szlachetnych
nazywamy ustawodawstwem probierczym. Do obrotu handlowego na terenie Polski mogą
być dopuszczone tylko takie wyroby z metali szlachetnych, które zostały oznaczone polską
cechą probierczą przez Urzędy Probiercze. Wyjątkiem są wyroby o masie do 1grama
wykonane ze stopów złota i do 5gram wykonane ze stopów srebra. Nie muszą mieć znaków
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Urzędu Probierczego, a tylko znak wytwórcy i próbę. W przypadku braku możliwości
umieszczenia cech na wyrobie powinien on posiadać świadectwo badania.
Wyroby wykonane z metali nieszlachetnych powinny mieć wybity znak „met”. Ustalony
zakres prób i symboli dla każdego z metali i stopów metali stosowany w polskim
probiernictwie.
Tab. 9. Polskie Cechy i znaki probiercze
Na każdym wyrobie musi znajdować się znak wytwórcy. Jego kształt ustala się
i zatwierdza w urzędzie probierczym. Przed oddaniem wyrobu do cechowania wytwórca
umieszcza go na wyrobie. Urząd probierczy ustala próbę stopu i nabija odpowiednią cechę
obok znaku wytwórcy. Gwarantuje to że stop, z którego wykonano wyrób, zawiera nie mniej
metalu szlachetnego, niż wynika to z próby.
Badanie stopów na kamieniu probierczym
Podstawową metodą ustalania próby złota i srebra w pracowniach złotniczych jest badanie
na kamieniu probierczym. Jest to metoda przybliżona, pozwalająca na określenie próby
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
z dokładnością do 5 punktów procentowych. Aby przeprowadzić badanie, stanowisko musi
być wyposażone w:
−
kamień probierczy – lidyt, bądź syntetyczny – czarny korund,
−
iglice probiercze dla złota i srebra (komplet dla złota – 16 iglic, komplet dla srebra – 14
iglic),
−
ciecze probiercze dla złota, srebra i platyny.
Tab. 10. Ciecze probiercze najczęściej stosowane do badania złota [5, s. 123]
Nr Skład cieczy probierczej
Działa na stop o próbie
1
20 cm
3
kwasu azotowego o gęstości 1,42
0,200 – 400
2
Kwas azotowy o gęstości 1,42
0,400 – 0,500
3
30 cm³ kwasu azotowego o gęstości 1,42
0,5 cm³ kwasu solnego o gęstości 1,19
70 cm³ wody destylowanej
0,500 – 0,650
4
40 cm³ kwasu azotowego o gęstości 1,42
1 cm³ kwasu solnego o gęstości 1,19
15 cm³ wody destylowanej
0,650 – 0,850
5
18 cm³ kwasu azotowego o gęstości 1,42
24 cm³ kwasu solnego o gęstości 1,19
6 cm³ wody destylowanej
0,850 – 0,980
Tab. 11. Ciecze probiercze najczęściej stosowane do badania srebra [5, s.124]
Nr Skład cieczy probierczej
Działa na stop o próbie
1
Ciecz chromowa
3 g dwuchromianu potasu
4 cm³ kwasu siarkowego o masie właściwej 1,83
32 cm³ wody destylowanej
Wszystkie próby
2
Ciecz srebrowa
nasycony roztwór siarczanu srebrowego
Wszystkie próby
Tab. 12.
Ciecze probiercze najczęściej stosowane do badania platyny [5, s. 124]
Nr Skład cieczy probierczej
Działa na stop o próbie
1
Ciecz jodowa
15 cm³ kwasu azotowego o gęstości 1,42
35 cm³ kwasu solnego o gęstości 1,19
2,5 g jodku potasowego
Wszystkie próby
2
15 cm³ kwasu azotowego o gęstości 1,42
15 cm³ kwasu solnego o gęstości 1,19
1 – 2 g bromku potasowego lub bromku sodowego
Wszystkie próby
Przebieg badania próby metali szlachetnych na kamieniu probierczym
−
wykonanie narysów długości około 15 – 20mm. i szerokości 5 mm. próbką na kamieniu
probierczym,
−
wykonanie narysów tej samej wielkości iglicą probierczą obok narysów wykonanych
przedmiotem badanym,
−
naniesienie na oba narysy cieczy probierczej,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
−
porównanie intensywności trawienia przez ciecz probierczą.
Porównanie intensywności trawienia przez ciecz probierczą narysów wykonanych próbką
i iglic wskazuje na zawartość metalu szlachetnego w badanej próbce. Jeżeli narys na próbce
ciemnieje szybciej niż na iglicy, to zawartość metalu szlachetnego w próbce jest mniejsza,
jeśli szybciej – większa. Zmieniając iglice, wykonujemy kolejne narysy, aż intensywność
ciemnienia narysu próbki i iglicy będzie równa lub bardzo zbliżona.
Badanie platyny metodą kroplową
Bezpośrednio na badanym przedmiocie, po oczyszczeniu powierzchni, umieszcza się
kropelkę cieczy jodowej. Jeżeli po około 3 minutach powierzchnia przedmiotu nie ciemnieje,
to zawartość platyny jest równa próbie 0,950. W taki sam sposób bada się stopy platynowo-
rodowe i platynowo-irydowe.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Czy potrafisz obliczyć próbę stopu złota?
2. Czy potrafisz obliczyć skład stopu?
3. Jak się sporządza stopy srebra?
4. Czy potrafisz wyjaśnić pojęcie próba stopu?
5. Jak badamy stopy metali szlachetnych na kamieniu probierczym?
6. W jaki sposób badamy stopy platyny metodą kroplową?
4.2.3. Ćwiczenia
Ćwiczenie 1
Oblicz, ile miedzi trzeba dodać do 10 gram złota próby 0,999, żeby otrzymać stop próby
0,585.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) ułożyć równanie,
2) wykonać obliczenia,
3) sprawdzić ich poprawność,
4) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
notatnik i przybory do pisania,
−
kalkulator.
Ćwiczenie 2
Oblicz próbę stopu wykonanego z trzech próbek srebra – 2 gram próby 0,750, 4 gram
próby 0,925 i 3 gram próby 0,800.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) ułożyć równanie,
2) wykonać obliczenia,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
3) wyznaczyć próbę otrzymanego stopu,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności i estetyki wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
notatnik i przybory do pisania,
−
kalkulator.
Ćwiczenie 3
Zbadaj na kamieniu probierczym próbę wyrobu złotego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przygotować kamień probierczy do badania,
2) przygotować próbkę do badania,
3) wykonać narysy badaną próbką,
4) wykonać narysy wybraną igłą probierczą,
5) nałożyć ciecz probierczą dla złota,
6) po odpowiednim czasie porównać intensywność trawienia narysów,
7) zaprezentować wykonane ćwiczenie,
8) opisać wnioski wyciągnięte z wykonanego ćwiczenia i dokonać jego oceny.
Wyposażenie stanowiska pracy:
−
przedmiot do zbadania,
−
kamień probierczy,
−
iglice probiercze,
−
ciecze probiercze.
Ćwiczenie 4
Zbadaj próbkę stopu platyny metodą kroplową.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przygotować próbkę do badania,
2) przygotować odpowiednią ciecz probierczą,
3) nałożyć kroplę cieczy na oczyszczoną powierzchnię próbki,
4) obserwować zachodzącą na powierzchni próbki reakcję,
5) wyciągnąć wnioski z obserwacji,
6) dokonać oceny poprawności wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
badana próbka,
−
ciecze probiercze,
−
notatnik i przybory do pisania.
Ćwiczenie 5
Na podstawie znaków probierczych zidentyfikuj stop i próbę kilku wyrobów jubilerskich
i opisz cechy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odnaleźć miejsce umieszczenia cech na wyrobach,
2) dokładnie obejrzeć cechy,
3) określić stopy i próby,
4) opisać cechy,
5) sprawdzić zgodność notatek z tabelą znaków i cech.
Wyposażenie stanowiska pracy:
−
lupa,
−
ocechowane wyroby,
−
notatnik i przybory do pisania,
−
tabela cech i znaków probierczych.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić składniki stopów poszczególnych metali szlachetnych?
2) obliczyć próbę stopu?
3) obliczyć skład stopu?
4) przeprowadzić badanie próby stopu na kamieniu probierczym?
5) przeprowadzić badanie próby platyny metodą kroplową?
6) określić, co to są stopy i po co je wykonujemy?
7) wyjaśnić, czego dotyczy ustawodawstwo probiercze?
8) określić warunki, jakim musi odpowiadać przedmiot przedstawiony do
cechowania?
9) rozpoznawać znaki probiercze?
10) określić skład cieczy probierczych do badania stopów złota?
11) określić skład cieczy probierczych do badania stopów srebra?
12) określić skład cieczy probierczych do badania stopów platyny?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.3. Rafinacja metali szlachetnych. Związki chemiczne stosowane
w złotnictwie
4.3.1. Materiał nauczania
Związki chemiczne stosowane w złotnictwie
1. Kwasy – związki chemiczne, które dysocjując w wodzie odszczepiając jon H
+
;
w złotnictwie stosowane są głównie kwasy:
−
siarkowy (H
2
SO
4
) do wykonywania bejcy, wygotowywania przedmiotów złotych
i srebrnych,
−
azotowy (HNO
3
) rozkłada wiele substancji i rozpuszcza większość metali,
−
kwas borowy (H
3
BO
3
),
−
kwas fluorowodorowy(HF) używany w złotnictwie przy pracach emalierskich oraz do
badania kamieni szlachetnych,
−
woda królewska – stanowią ją trzy części kwasu solnego i jedna azotowego, łatwo
rozpuszcza złoto.
2. Zasady – związki chemiczne posiadające w swoim składzie grupę wodorotlenową; służą
do neutralizacji kwasów, używane do rafinacji.
−
wodorotlenek sodu (NaOH),
−
wodorotlenek potasu (KOH).
3. Sole – powstają w wyniku reakcji kwasów i zasad w ilościach równoważnych.
−
węglan sodu (Na
2
CO
3
) i azotan sodu (NaNO
3
) używane do topienia metali
szlachetnych,
−
boraks (Na
2
B
4
O
7
) stosowany w procesach topienia i lutowania,
−
chlorek srebra (AgCl) służy do sporządzania srebrnych kąpieli galwanicznych,
−
cyjanek potasowy (KCN) stosowany do galwanicznego srebrzenia i złocenia, bardzo
trujący.
W każdej pracowni złotniczej powinien znajdować się amoniak (NH
3
). Jest to gaz
bezbarwny, łatwo rozpuszczający się w wodzie. Wykorzystywany jest do czyszczenia metali i
zobojętniania wylanych kwasów.
Podstawowe pojęcia chemiczne
−
pierwiastek chemiczny – zbiór jednakowych atomów; pierwiastka nie można rozłożyć
metodami chemicznymi na substancje prostsze; ze 110 znanych obecnie pierwiastków 89
występuje w przyrodzie,
−
cząsteczka – najmniejsza cząstka związku chemicznego zachowująca właściwości
chemiczne tej substancji i mogąca brać udział w reakcjach chemicznych; cząsteczki
gazów szlachetnych są jednoatomowe, cząsteczki azotu, tlenu – dwuatomowe, cząsteczki
związków chemicznych – wieloatomowe,
−
związek chemiczny – jednorodna substancja złożona ze zbioru cząsteczek zbudowanych
z różnych pierwiastków chemicznych, której atomy są związane w sposób
uporządkowany
i w określonych stosunkach ilościowych,
−
reakcja chemiczna – przemiana, w której wyniku z jednych substancji, powstają inne,
o odmiennych właściwościach; związana jest zawsze z wydzieleniem lub pobraniem
energii, najczęściej w postaci ciepła,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
−
roztwór – inaczej nazywany mieszaniną jednorodną czyli taką, w której za pomocą
przyrządów optycznych nie można rozróżnić poszczególnych składników; rozróżniamy
roztwory gazowe, ciekłe i stałe.
Podstawowe czynności chemiczne
−
rozpuszczanie – proces polegający na mieszaniu się dwóch faz, na przykład stałej i
ciekłej,
w wyniku którego powstaje roztwór,
−
filtracja (sączenie) – oddzielania ciał stałych od cieczy poprzez przelewanie mieszaniny
przez ciała porowate ( na przykład sączek z bibuły), które zatrzymują osad, a roztwór
zostaje przepuszczony,
−
odparowywanie – usunięcie z roztworów rozpuszczalnika poprzez ogrzewanie.
Sporządzanie roztworów do bejcowania i barwienia srebra
W złotnictwie związki chemiczne są bardzo często stosowane w postaci roztworów.
Mieszaniny jednorodne stosujemy w celu spowolnienia i osłabienia reakcji chemicznych.
Najczęściej używany jest wodny roztwór kwasu siarkowego, który służy do bejcowania
(bielenia) – wygotowywania stopów srebra. Sporządza się go z kwasu siarkowego i wody w
stosunku 1:3. Przy sporządzaniu roztworu wydziela się znaczna ilość ciepła, dlatego wodę do
kwasu należy wlewać bardzo ostrożnie.
Do barwienia srebra na kolor od brunatnego do czarnego, najczęściej sporządza się roztwór
z 10 gram wielosiarczku potasu i 10 gram węglanu amonu rozpuszczonych w 1 litrze wody.
Przedmiot, który chcemy poczernić, zanurzamy w roztworze lub malujemy pędzelkiem,
a następnie spłukujemy wodą. Proces możemy przyśpieszyć poprzez podgrzanie przedmiotu
lub roztworu.
Rafinacja stopów metali szlachetnych
Rafinacja jest to proces polegający na wydzieleniu czystego metalu ze stopu.
Przeprowadzamy ją w celu:
−
oczyszczenia stopu z zanieczyszczeń,
−
podwyższenia próby.
Rozróżniamy rafinację ogniową i chemiczną:
−
ogniowa polega na prażeniu w tyglu metalu rafinowanego z dodatkiem topników,
−
chemiczna polega na rozpuszczenie stopu metalu szlachetnego w roztworze chemicznym,
a następnie wydzieleniu czystego metalu z roztworu za pomocą środków redukujących.
Obecnie najczęściej stosowana jest metoda rafinacji chemicznej. Musi być przeprowadzana
z dużą precyzją celem uniknięcia strat. Głównymi stopami metali, które poddajemy rafinacji
są stopy złota, srebra i platyny. Cały proces rafinacji przeprowadzamy pod wyciągiem
odprowadzającym wydzielające się w czasie reakcji gazy.
Rafinacja złota
Rafinację stopów złota przeprowadzamy w następujący sposób:
−
stopy złota granulujemy lub walcujemy na cienką blachę i tniemy na drobne kawałki,
−
zalewamy wodą królewską,
−
po rozpuszczeniu metalu odparowujemy roztwór w celu usunięcia kwasu azotowego,
−
dolewamy zimną wodę destylowaną,
−
po kilku godzinach przesączamy roztwór przez bibułę w celu oddzielenia chlorku srebra,
który mógł się w nim znajdować,
−
dodajemy kilka kropel kwasu siarkowego, żeby strącić ołów, który mógł być w stopie,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
−
jeżeli wytrącił się ołów, roztwór ponownie przesączamy przez bibułę,
−
dodajemy roztwór siarczanu żelazowego, który powoduje wydzielenie się złota
w postaci osadu,
−
dodajemy roztwór siarczanu żelazowego aż do zakończenia wytrącania się osadu,
−
całość zostawiamy na kilka godzin, a następnie zlewamy ciecz znad osadu,
−
kilkakrotnie przemywamy osad gorącą wodą z dodatkiem kwasu solnego,
−
odsączamy i przemywamy czystą, gorącą wodą,
−
osad razem z bibułą suszymy, żarzymy i topimy.
Otrzymany stop powinien mieć próbę około 0,999. Tą metodą rafinujemy stopy
o zawartości srebra poniżej 5%. W przypadku stopów złota ze srebrem o zawartości srebra
powyżej 5%, do rafinacji używamy kwasu azotowego:
−
obniżamy próbę stopu złota przez dodanie srebra tak, aby próba złota metalu
rafinowanego wynosiła około 0,200,
−
stop granulujemy lub walcujemy na cienką blachę i tniemy na drobne kawałki,
−
zalewamy kwasem azotowym,
−
kwas azotowy rozpuszcza srebro i inne metale w stopie,
−
złoto pozostaje w roztworze w postaci drobin i osadu,
−
zlewamy roztwór znad osadu,
−
powstały osad kilkakrotnie płuczemy gorącą wodą i filtrujemy przez bibułę,
−
otrzymany osad suszymy razem z bibułą, żarzymy i topimy.
Uzyskany w tym procesie stop złota ma próbę 0,980 – 0,998.
Rafinacja srebra
Rafinację stopów srebra przeprowadzamy w następujący sposób:
−
stop granulujemy lub walcujemy na blachę i tniemy na drobne kawałki,
−
umieszczamy w roztworze kwasu azotowego, sporządzonym z kwasu azotowego z wodą
destylowaną w proporcji 1:1,
−
podgrzanie roztworu przyspieszy rozpuszczenie się stopu srebra, ale nie jest zabiegiem
koniecznym,
−
po kilku godzinach na dnie naczynia zgromadzi się osad niezawierający srebra,
−
zlewamy roztwór znad osadu,
−
do naczynia z osadem dolewamy ciepłą wodę i filtrujemy go,
−
otrzymany roztwór łączymy z tym zlanym wcześniej,
−
do otrzymanej cieczy dodajemy gorący roztwór soli kuchennej w proporcji 350 g. na
1 litr wody,
−
sól kuchenna wytrąca srebro w postaci białego osadu (chlorku srebra),
−
filtrujemy roztwór przez bibułę,
−
otrzymany osad płuczemy kilkakrotnie ciepłą wodą i suszymy.
Otrzymaliśmy w tym procesie chlorek srebra. Następnym etapem rafinacji jest redukcja
z chlorku srebra czystego srebra. Najczęściej stosowaną metodą jest redukcja chlorku srebra
cynkiem:
−
chlorek srebra umieszczamy w kamionkowym naczyniu i dodajemy rozcieńczony kwas
azotowy lub solny, a następnie cynk w kawałkach lub sproszkowany,
−
srebro wydzielające się z chlorku srebra ma jednolitą szarą barwę,
−
jeśli nie wszystkie kawałki cynku rozpuszczą się, dodajemy kwas solny,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
−
jeśli dodanie kwasu solnego nie spowoduje wydzielenia się wodoru w postaci pęcherzy
gazowych, to znaczy, że cynk rozpuścił się całkowicie,
−
zlewamy roztwór znad wydzielonego srebra,
−
pozostałe srebro filtrujemy i kilkakrotnie płuczemy gorącą wodą,
−
suszymy i topimy z boraksem w tyglu grafitowym.
Podstawowe zasady bezpieczeństwa
Ze względu na szkodliwe działanie na zdrowie i ubiór człowieka substancji chemicznych,
ich oparów i gazów wydobywających się podczas reakcji, czynności i reakcje należy:
−
przeprowadzać pod obudowanymi wyciągami z bardzo dobrą wentylacją,
−
substancje chemiczne, a w szczególności kwasy, przechowywać w naczyniach, których
one nie rozpuszczają, zabezpieczających przed parowaniem,
−
kwas siarkowy przechowywać w naczyniu szklanym – ze szklanym korkiem,
−
kwas fluorowodorowy w naczyniu winidurowym lub ołowianym, w pomieszczeniu
wentylowanym,
−
wszystkie czynności wykonywać w ubiorze ochronnym (rękawice gumowe, okulary,
fartuch ochronny, w razie potrzeby maska gazowa),
−
w przypadku tworzenia roztworów, ciecz o większej gęstości, należy wlewać do cieczy
o mniejszej gęstości,
−
w przypadku rozlania kwasu należy go neutralizować zasadą (najpopularniejsza jest woda
z mydłem, wodny roztwór sodu).
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Co to jest rafinacja metali szlachetnych?
2. Jakie potrafisz podać przykłady związków chemicznych będących kwasami?
3. W jaki sposób rafinujemy srebro?
4. Jak sporządzamy ciecz do barwienia srebra?
5. Jak sporządzamy roztwory kwasów?
6. Jakie zasady bezpieczeństwa musimy zachować przy pracy z kwasami?
7. W jaki sposób sporządzamy bejcę?
4.3.3. Ćwiczenia
Ćwiczenie 1
Sporządź roztwór wodny kwasu siarkowego (bejcę).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przygotować stanowisko do przeprowadzenia ćwiczenia,
2) odmierzyć odpowiednie ilości wody destylowanej i kwasu siarkowego,
3) wlać kwas do wody intensywnie mieszając,
4) sprawdzić skuteczność wytrawiania uzyskanego roztworu.
Wyposażenie stanowiska pracy:
−
wyciąg z wentylacją,
−
naczynie szklane,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
−
niezbędne ciecze: woda, kwas siarkowy,
−
naczynie na bejcę oraz szklana pałeczka do mieszania cieczy.
Ćwiczenie 2
Sporządź ciecz do barwienia srebra na czarno i sprawdź jej działanie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) ustalić proporcje wagowe odczynników chemicznych,
2) wykonać płyn do czernienia,
3) poczernić wyrób,
4) dokonać oceny poprawności wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
odczynniki chemiczne (wielosiarczek potasu i węglan amonu),
−
woda destylowana,
−
naczynie do przechowywania cieczy
−
szklana pałeczka do mieszania cieczy,
−
waga jubilerska,
−
wyrób do poczernienia,
−
literatura z punktu 6.
4.3.4.Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) dokonać rafinacji stopu złota?
2) zdefiniować pojęcie kwasów?
3) dokonać rafinacji stopu srebra?
4) wymienić związki chemiczne stosowane w złotnictwie?
5) prawidłowo przechowywać chemikalia złotnicze?
6) zdefiniować pojęcia cząsteczka, związek chemiczny, reakcja chemiczna?
7) sporządzić bejcę do wytrawiania srebra?
8) zachować bezpieczeństwo przy posługiwaniu się chemikaliami?
9) zabarwić przedmiot srebrny na czarno?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.4. Kamienie jubilerskie
4.4.1. Materiał nauczania
Kamieniami jubilerskimi nazywamy kamienie w postaci naturalnej lub szlifowane
i polerowane, które nadają się do stosowania w wyrobach jubilerskich.
Różne sposoby klasyfikacji kamieni jubilerskiej przyjmowały następujące kryteria:
−
wartość kamieni,
−
częstotliwość występowania,
−
twardość,
Tab. 13. Twardość minerałów i innych ciał według skali Mohsa
Stopień
w skali
Mohsa
wzorzec
Stopień
w skali
Mohsa
wzorzec
Stopień
w skali
Mohsa
wzorzec
2,25
bursztyn
9
korund
7
kwarc
3,5
malachit
4
fluoryt
8
topaz
6
turkus
6
ortoklaz
10
diament
−
właściwości mechaniczne, optyczne, dekoracyjne oraz zdolność do obróbki
technologicznej,
−
budowę chemiczną,
−
współczesne zwyczaje i aktualną sytuację w handlu kamieniami,
−
sposoby powstawania (naturalne i syntetyczne).
Ze względu na właściwości fizyczne i chemiczne, kamienie szlachetne podzielono na
następujące grupy:
−
diamentu (diament),
−
korundu (rubin, szafir),
−
berylu (szmaragd, akwamaryn),
−
kwarcu (kryształ górski, ametyst, cytryn, jaspis, chalcedon, agat, opal),
−
granatu (granat, almandyn),
−
skaleni alkaicznych(ortoklaz, kamień księżycowy),
−
plagioklazów (labrador, kamień słoneczny).
Współczesna systematyka dzieli kamienie jubilerskie w następujący sposób:
−
kamienie szlachetne (minerały cechujące się efektownymi i trwałymi własnościami
zdobniczymi),
−
kamienie jubilersko-ozdobne (ze względu na piękną barwę znajdują zastosowanie
w jubilerstwie),
−
kamienie ozdobne (różnego rodzaju skały, rzadko minerały, substancje pochodzenia
organicznego),
−
kamienie rekonstruowane (rozdrobnione lub sproszkowane kamienie naturalne zestalane
w drodze obróbki technologicznej),
−
kamienie syntetyczne (otrzymane sztucznie w drodze syntezy),
−
dublety i tryplety (składające się z dwóch lub trzech warstw sklejonych ze sobą różnych
minerałów),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
−
perły naturalne lub hodowlane (powstałe w płaszczu muszli małży perłopławnych),
−
korale (szkielety organizmów morskich),
−
bursztyny (skamieniała żywica drzew iglastych),
−
imitacje (sztuczne substancje naśladujące kamienie jubilerskie).
Alfabetyczny wykaz ważniejszych kamieni jubilerskich
−
agat,
−
ametyst,
−
beryl,
−
bursztyn,
−
cyrkon,
−
cytryn,
−
diament,
−
granat,
−
jadeit,
−
jaspis,
−
koral,
−
kryształ górski,
−
krzem,
−
malachit,
−
nefryt,
−
onyks,
−
opal,
−
perła,
−
rubin,
−
szafir,
−
szmaragd,
−
topaz,
−
turkus,
−
turmalin.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1. Co to są kamienie jubilerskie?
2. Potrafisz podać kryteria klasyfikacji kamieni jubilerskich naturalnych?
3. Według jakiej skali twardości klasyfikujemy kamienie naturalne?
4. Potrafisz podać przykłady kilku minerałów naturalnych i syntetycznych wykorzystywanych
w jubilerstwie?
5. Czy potrafisz wyszczególnić kamienie pochodzenia organicznego z tabeli zamieszczonej
w materiale nauczania?
4.4.3. Ćwiczenia
Ćwiczenie 1
Za pomocą pilnika dokonaj klasyfikacji przedłożonych kamieni według skali twardości do 5
i powyżej 5 w skali Mohsa.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) uszeregować kamienie według skali Mohsa,
2) zaprezentować efekty swojej pracy.
Wyposażenie stanowiska pracy:
−
kamienie jubilerskie o różnej twardości,
−
pilnik,
−
lupa jubilerska,
−
literatura z punktu 6.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Ćwiczenie 2
Zidentyfikuj przedstawione kamienie na podstawie cech zewnętrznych, określ rodzaj szlifu
i grupę kamieni, z której pochodzą.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) posegregować kamienie według grup, do których należą,
2) określić rodzaj szlifu,
3) umotywować dokonane rozpoznanie,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
kamienie do identyfikacji,
−
lupa jubilerska,
−
literatura z punktu 6.
Ćwiczenie 3
Spośród zaprezentowanych kamieni wskaż kamienie pochodzenia organicznego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) obejrzeć kamienie,
2) wybrać spośród przedłożonych kamieni te pochodzenia organicznego,
3) zaprezentować efekt swojej pracy,
4) dokonać oceny ćwiczenia.
Wyposażenie stanowiska pracy:
−
kamienie do identyfikacji,
−
lupa jubilerska,
−
literatura z punktu 6.
Ćwiczenie 4
Określ rodzaj szlifów w przedstawionych do ćwiczenia kamieniach jubilerskich.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) obejrzeć przedstawione kamienie,
2) porównać szlify z wzorami,
3) określić szlify przedstawionych kamieni,
4) dokonać oceny ćwiczenia.
Wyposażenie stanowiska pracy:
−
kamienie o różnych szlifach,
−
lupa jubilerska,
−
literatura z punktu 6.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie kamieni jubilerskich?
2) dokonać współczesnej klasyfikacji kamieni jubilerskich?
3) wskazać za pomocą jakiej skali określamy twardość kamieni?
4) rozróżnić szlify kamieni jubilerskich?
5) wymienić kamienie jubilerskie pochodzenia organicznego?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
5.
SPRAWDZIAN OSIĄGNIĘĆ
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Wpisz imię i nazwisko na kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Test zawiera 20 zadań dotyczących rozpoznawania podstawowych materiałów i wyrobów
stosowanych w złotnictwie.
5. Zadania: 1, 4, 5, 7, 8, 12 są to zadania wyboru wielokrotnego i tylko jedna odpowiedź jest
prawidłowa; zadania 2, 3, 6, 11 są to zadania z luką, w zadaniach 9, 10, 13, 14, 15, 16, 17, 18
należy udzielić krótkiej odpowiedzi. Zadania 19 i 20 to zadania matematyczne – otwarte
rozszerzonej odpowiedzi.
6. Zadania rozwiązuj tylko na załączonej karcie odpowiedzi:
−
w zadaniach wielokrotnego wyboru zaznacz prawidłową odpowiedź X (w przypadku
pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie ponownie zakreślić
odpowiedź prawidłową),
−
w pytaniach z krótką odpowiedzią wpisz odpowiedź w wyznaczone miejsce,
−
w zdaniach do uzupełnienia wpisz brakujące wyrazy.
7. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8. Test składa się z dwóch części o różnym stopniu trudności:
−
I część – poziom podstawowy – (pytania 1 – 14),
−
II część – poziom ponad podstawowy – (pytania 15 – 20).
9. Jeśli udzielenie odpowiedzi na któreś pytanie będzie Ci sprawiało trudność, to odłóż jego
rozwiązanie na później i rozważ ponownie, gdy zostanie Ci czas wolny.
10. Na rozwiązanie testu masz 90 min.
Powodzenia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
ZESTAW ZADAŃ TESTOWYCH
1. Z grupy platynowców nie pochodzi:
a) pallad,
b) ruten,
c) złoto,
d) rod.
2. Wymień nazwy kamieni, którym nadajemy szlif fasetowy.
3. Temperatura przejścia metalu ze stanu ……………….… w stan …………………… to
temperatura krzepnięcia.
4. Składnikiem stopów srebra nie jest:
a) miedź,
b) cyna,
c) nikiel,
d) mangan.
5. Rubin należy do grupy:
a) diamentu,
b) berylu,
c) kwarcu,
d) korundu.
6. Alpaka to stop:
a) miedzi z cynkiem,
b) miedzi z cyną,
c) niklu z miedzią i cynkiem,
d) miedzi z aluminium.
7. Obróbka cieplna to:
a) walcowanie,
b) kucie,
c) wyżarzanie,
d) tłoczenie.
8. Funkcją lutówki jest zabezpieczenie przed …………………………….powierzchni metalu.
9. Cechowania w urzędzie probierczym nie wymagają wyroby wykonane ze stopu srebra
o masie do:
a) 1 grama,
b) 3 gram,
c) 5 gram,
d) 10 gram.
10. Kamień jubilerski syntetyczny to:
a) diament,
b) rubin,
c) cyrkonia,
d) bursztyn.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
11. Wymień właściwości fizyczne metali.
12. Wyjaśnij, co to jest plastyczność metalu.
13. Wyjaśnij, co to są dublety.
14. Związki chemiczne, które posiadają w swym składzie grupę ………………… reagują
z ……………… tworząc …………….. nazywamy zasadami.
15. Wyjaśnij, na czym polega badanie stopów metodą kroplową.
16. Opisz proces sporządzania stopu złota próby 0,585 ze złota próby 0,999.
17. Oblicz skład 30 gram stopu srebra próby 0,800.
18. Określ definicję chemiczną soli, wymień sole stosowane w złotnictwie i podaj ich
zastosowanie.
19. Opisz proces rafinacji złota.
20. Opisz sposób sporządzania roztworów do barwienia srebra.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
„Rozpoznawanie podstawowych materiałów stosowanych w złotnictwie
i jubilerstwie”
Zakreśl poprawną odpowiedź
,
wpisz brakujące części zdania, a w zadaniach 16 i 17
wykonaj potrzebne obliczenia i podaj
wynik
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
3
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
9
a
b
c
d
10
a
b
c
d
11
12
13
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
14
15
16
17
18
19
20
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
6. LITERATURA
1. Florow A.W.: Artystyczna obróbka metali. PWN, Warszawa 1989
2. Fyson N.: Klejnoty świata. Świat książki, Warszawa 1996
3. Knobloch M.: Polska biżuteria, Ossolineum 1980
4. Knobloch M.: Złotnictwo. WNT, Warszawa 1977
5. Pallai S.: Metaloplastyka użytkowa. WNT, Warszawa 1976
6. Praca zbiorowa.: Wydawnictwo naukowo-techniczne, Warszawa 1974
7. Praca zbiorowa (red.Dubinina M.P).: Technologia metali. PWN, 1956
8. Sobczak N.: Mała encyklopedia kamieni szlachetnych i ozdobnych. „Alfa”, Warszawa 1986
9. Zastawniak F.: Złotnictwo i probiernictwo. WPLiS, Warszawa 1957
Internet
Strona aktualna na dzień 30 maja 2006:
−
Wyszukiwarka
Podobne podstrony:
zlotnik jubiler 731[06] o1 03 n
zlotnik jubiler 731[06] o1 01 n
zlotnik jubiler 731[06] o1 04 u
zlotnik jubiler 731[06] o1 06 n
zlotnik jubiler 731[06] o1 07 n
zlotnik jubiler 731[06] o1 02 n
zlotnik jubiler 731[06] o1 07 u
zlotnik jubiler 731[06] o1 06 u
zlotnik jubiler 731[06] z2 03 n
zlotnik jubiler 731[06] z2 03 u
zlotnik jubiler 731[06] o1 05 n
zlotnik jubiler 731[06] o1 05 u
zlotnik jubiler 731[06] o1 01 u
zlotnik jubiler 731[06] o1 02 u
zlotnik jubiler 731[06] z3 03 u
zlotnik jubiler 731[06] z1 03 u
zlotnik jubiler 731[06] o1 04 n
zlotnik jubiler 731[06] z3 03 n
więcej podobnych podstron