
W
E T E R Y N A R I A
W
T
E R E N I E
• 3 / 2 0 1 0 •
70
B y d ł o
Wrażliwość poszczególnych gatunków
przeżuwaczy w odniesieniu do zmian
chorobowych i gatunku chlamydofi li
powodujących zakażenie przedstawio-
no w tab. 1.
Etiologia
Drobnoustroje z rodziny Chlamydiace-
ae są organizmami wykazującymi cechy
pośrednie między bakteriami i wirusa-
mi. Do wirusów upodabniają je małe
rozmiary, namnażanie się wyłącznie
wewnątrz żywych komórek z równocze-
snym tworzeniem wtrętów komórkowych
będących miejscem ich namnażania.
Podobieństwo do bakterii wyraża się
poprzez obecność ściany komórkowej,
RNA, DNA i organelli komórkowych
oraz ich wrażliwość na niektóre chemio-
terapeutyki. Nietypowy jest także cykl
życiowy tych patogenów. Występują one
w dwóch postaciach morfologicznych,
jako: ciałko elementarne (EB), będące
postacią inwazyjną, która w procesie en-
docytozy dostaje się do wnętrza komórki
gospodarza, gdzie tworzy tzw. inkluzję.
Następnie przekształca się ono w ciał-
ko siateczkowate (RB), które intensyw-
nie się dzieli. Na tym etapie może dojść
do zahamowania rozwoju drobnoustroju
i utrzymania się zakażenia w tzw. formie
latentnej. Zwykle jednak powstałe liczne
ciałka siateczkowate przekształcają się
w ciałka elementarne, doprowadzając
do pęknięcia komórki gospodarza lub
tylko inkluzji i egzocytozy ciałek ele-
mentarnych, które będą zakażały kolej-
ne komórki. Cały opisany proces trwa
od 48 do 72 godzin.
Drogi zakażenia
i patogeneza choroby
Źródłem zarazka są zwierzęta chore
oraz bezobjawowi nosiciele. Źródłem
zarazka jest także poroniony płód
i wody płodowe. Do zakażenia docho-
dzi drogą aerogenną lub alimentarną,
a także w trakcie krycia lub insemina-
cji nasieniem pochodzącym od zakażo-
nego samca. Początkowo zarazek ulega
namnożeniu w migdałkach lub bło-
nie śluzowej żołądka i jelit, następnie
przechodzi do krwi, wtedy też mówimy
o chlamydiemii. Obecna we krwi, roz-
przestrzenia się po całym organizmie
do tzw. narządów predysponowanych.
Obraz choroby
Obraz chorobowy, jaki obserwuje się
u zakażonego osobnika, czy to u cie-
lęcia lub jagnięcia, lub u osobnika do-
rosłego, bywa bardzo różnorodny, gdyż
chlamydofi le mogą wywoływać zaka-
żenia jawne – wyraźnie manifestują-
ce się klinicznie, ale częściej są przy-
czyną zakażeń bezobjawowych, które
ujawniają się jedynie w niekorzystnych
warunkach środowiskowych i spadku
odporności.
Ronienia
U dorosłego bydła i owiec zakażenie
Chlamydophila abortus powoduje stan
zapalny dróg rodnych oraz ronienia,
jednak u bydła jest to schorzenie dużo
rzadziej spotykane niż u małych prze-
żuwaczy, gdzie stanowi główną przy-
czynę kłopotów z rozrodem.
U ciężarnych krów chlamydofi le będą
namnażać się w łożysku i prowadzić
do zakażenia płodu oraz poronienia lub
do przedwczesnego porodu żywego, ale
słabego cielęcia. Jeżeli zakażenie krowy
następuje poprzez zakażone nasienie
buhaja, dochodzi do obumarcia zarod-
ka w pierwszych dniach od poczęcia.
Krowy ronią zwykle w 8-9 miesiącu
ciąży, bez objawów zwiastunowych;
Z
Zmiany w systematyce
dotyczące rodziny
Chlamydiaceae
doprowadziły
do wydzielenia dwóch
rodzajów: Chlamydia
i Chlamydophila.
Do rodzaju Chlamydophila
zaliczono 9 gatunków,
z których 3 są uznane
za chorobotwórcze
dla przeżuwaczy
(Chlamydophila pecorum,
Chlamydophila abortus oraz
Chlamydophila psittaci).
Zakażenia drobnoustrojami
z rodziny Chlamydiaceae
u zwierząt gospodarskich
lek. wet. Aleksandra Kumala
dr hab. n. wet. Krzysztof Rypuła
Zakład Chorób Zakaźnych
i Administracji Weterynaryjnej
Wydziału Medycyny Weterynaryjnej
Uniwersytetu Przyrodniczego we Wrocławiu
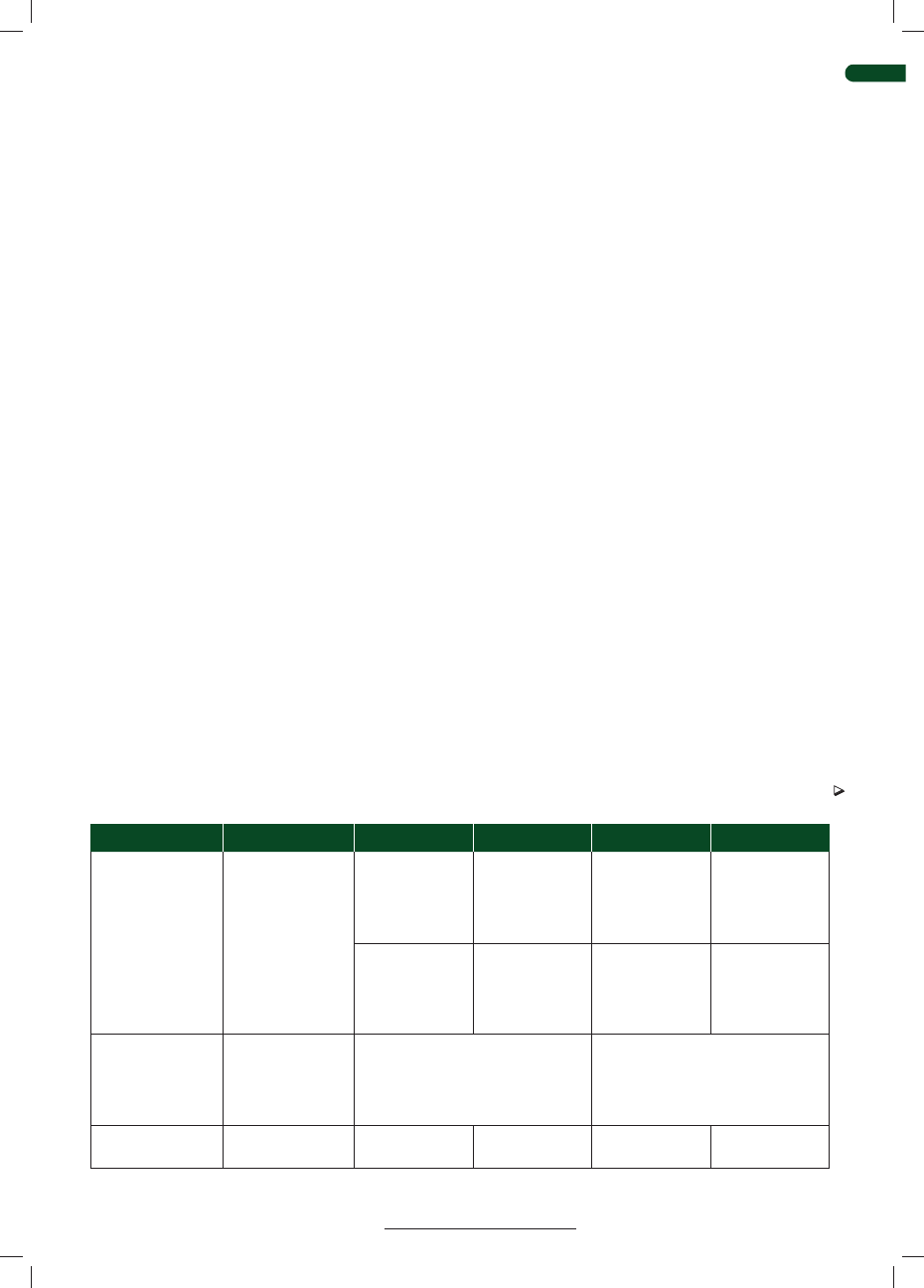
W
E T E R Y N A R I A
W
T
E R E N I E
• 3 / 2 0 1 0 •
71
B y d ł o
żywe, ale bardzo słabe i giną w pierw-
szych dniach życia. Przy ciążach mno-
gich nie wszystkie płody ulegają za-
każeniu. Jeśli do zakażenia ciężarnej
samicy dojdzie stosunkowo późno:
na 5-6 tygodni przed terminem poro-
du, to rozwinie się zakażenie latentne,
a do ronienia dojdzie dopiero w ko-
lejnej ciąży. Blisko w 90% przypad-
ków okres poporodowy przebiega bez
komplikacji i samice w następnej cią-
ży rodzą zwykle zdrowe, czasem nie-
co słabsze jagnięta. W pojedynczych
przypadkach po porodzie może dojść
do powikłań w postaci zatrzymania ło-
żyska i zapalenia macicy.
Poronione płody pokryte są glinia-
stym nalotem, widoczny jest obrzęk
tkanki podskórnej i węzłów chłonnych.
W jamach ciała może być obecny czer-
wonawy płyn, a w wątrobie i śledzionie
ogniska martwicy. Łożysko jest silnie
przekrwione, na liścieniach widoczne
są ogniska martwicy, a tkanka między
liścieniami jest zgrubiała i obrzękła.
Intensywne siewstwo zarazka z wy-
ciekiem z pochwy ma miejsce tydzień
przed i dwa tygodnie po poronieniu,
dlatego też w ograniczeniu zakażeń
ważna jest izolacja roniących samic.
Trwale zakażone samice też wydalają
zarazek z wypływem z pochwy także
w okresie rui.
Wprowadzenie choroby do stada na-
stępuje zwykle z wprowadzeniem no-
wych maciorek. W pierwszym roku od-
setek ronień jest najwyższy i sięga 35%.
rzadko można na kilka dni przed po-
ronieniem zaobserwować patologicz-
ny wypływ z pochwy – o charakterze
wodnistym, barwy żółtej, z domieszką
skrzepłej krwi. Poronione płody są zwy-
kle rozwinięte stosownie do okresu
ciąży. Na sekcji stwierdza się zmiany
o charakterze krwotocznym, liczne wy-
broczyny w tkance podskórnej, pod-
śluzowej, podotrzewnowej, w węzłach
chłonnych i grasicy oraz w mięśniach.
U ponad 60% płodów występuje guzo-
wate powiększenie wątroby ze stward-
nieniem miąższu. Błony płodowe spra-
wiają wrażenie posypanych otrębami,
na kotyledonach widoczne są ogniska
martwicy, a pomiędzy kotyledonami
tkanka jest zgrubiała i galaretowato
nacieczona. Zmiany te są silniej zazna-
czone w przypadkach wczesnych poro-
nień. Wzdłuż sznura pępowinowego
widoczne są krwawe nacieki oraz ogni-
ska martwicze. Krowa roni tylko raz, ale
cielęta z kolejnych ciąż są często słab-
sze. Chlamydofi le w stadzie atakują
najczęściej pierwiastki lub zwierzęta
nowo wprowadzone do stada.
U buhajów zakażenie przebiega zwy-
kle bezobjawowo, rzadko występuje
zapalenie jąder, najądrzy oraz pęche-
rzyków nasiennych i w konsekwencji
bezpłodność.
U owiec zakażenie chlamydofi lą opi-
sywane jest jako enzootyczne ronienie
owiec, w przebiegu którego notuje się
poronienie, zwykle 2-3 tygodnie przed
terminem porodu. Płody te są często
W kolejnych latach spada on do 5-10%
i dotyczy zwykle pierwiastek i osobni-
ków nowo wprowadzonych.
Zapalenie płuc
Chlamydophila pecorum u cieląt i jagniąt
po zakażeniu umiejscawia się w płu-
cach, powodując ich stan zapalny, które-
mu towarzyszy gorączka, suchy kaszel
oraz surowiczy, śluzowy, a w przypad-
ku wtórnych zakażeń bakteryjnych ślu-
zowo-ropny wypływ z nosa. Przy braku
powikłań większość zwierząt zdrowieje,
jednak u niektórych dochodzi do za-
każenia przewlekłego i postępującego
wyniszczenia.
Zapalenie stawów
Chlamydophila pecorum u jagniąt jest
bardzo częstą przyczyną zapalenia sta-
wów, przy czym łatwo się leczy, a śmier-
telność nie przekracza 1%, przy zakaź-
ności sięgającej 80%. Z kolei u cieląt
zakażenie jest rzadziej spotykane, a le-
czenie jest trudne i często kończy
się niepowodzeniem. Obserwowane
u obu gatunków w przebiegu zakaże-
nia objawy chorobowe to obrzęk du-
żych stawów kończyn, bolesnych przy
omacywaniu, kulawizna lub sztywny
chód, czemu towarzyszy z kolei nie-
chęć do poruszania się. Często obser-
wuje się zapalenie spojówek i rogówek
oraz podniesioną wewnętrzną ciepłotę
ciała do 39-42
°
C. Cielęta często pada-
ją w ciągu 2 do 10 dni od wystąpienia
objawów. Klinicznie choroba jest nie
Gatunek
Chorobotwórczość
bydło
owce
Chlamydophila
abortus
Zwierzęta dorosłe
samice
– zapalenia
dróg rodnych
– ronienia
– zapalenia
wymienia
samice
– enzootyczne
ronienie owiec
samce
– zakażenia
bezobjawowe
– zapalenie jąder,
najądrzy, pęcherzy-
ków nasiennych
samce
– zakażenia
bezobjawowe
– zapalenie jąder,
najądrzy, pęcherzy-
ków nasiennych
Chlamydophila
pecorum
Zwierzęta młode
– zapalenia stawów
– zapalenia płuc
– zapalenia rogówki i spojówki
– zapalenia mózgu i rdzenia kręgowego
– zapalenia jelit (?)
– zapalenia stawów
– zapalenia płuc
– zapalenia rogówki i spojówki
– zapalenia jelit (?)
Chlamydophila
psittaci
– zapalenie jelit
Tab. 1. Chorobotwórczość gatunków Chlamydophila patogennych dla owiec i bydła

W
E T E R Y N A R I A
W
T
E R E N I E
• 3 / 2 0 1 0 •
72
B y d ł o
do odróżnienia od zapalenia stawów
wywoływanych przez Mycoplasma sp.
lub Histophilus sp.
Zapalenie jelit
Chlamydophila pecorum izolowano tak-
że od przeżuwaczy z przypadków zapa-
lenia jelit przebiegających z objawami
biegunki, jednakże były to przypadki
zakażeń mieszanych i rola tych chlamy-
dofi li była prawdopodobnie znikoma.
Z kolei Chlamydophila psittaci u cieląt
może być bezpośrednią przyczyną za-
palenia jelit. W tym przypadku źródłem
zarazka są ptaki, głównie kaczki, indyki
oraz gołębie.
Sporadyczne zapalenie mózgu
i rdzenia kręgowego
Notowano je w Kanadzie i Stanach
Zjednoczonych, Japonii i Izraelu oraz
w Australii, Południowej Afryce oraz
na Węgrzech. Wrażliwe na zachorowa-
nie jest tylko bydło, a szczególnie cie-
lęta poniżej 6. miesiąca życia. Zacho-
rowalność u cieląt sięga 25% zwierząt,
a u zwierząt powyżej roku spada do 5%.
Średnia śmiertelność wynosi 31% i jest
z kolei wyższa u zwierząt dorosłych niż
u cieląt. W przebiegu choroby docho-
dzi do zapalenia śródbłonka naczyń
i tkanki mezenchymalnej, zapalenia
mózgu i rdzenia. Objawy nerwowe po-
jawiają się wtórnie. Nie są znane drogi
szerzenia się zakażenia. Na niektórych
fermach choroba wystąpiła jednora-
zowo, na innych pojawia się co roku
w liczbie kilku przypadków, ale noto-
wano też obiekty, gdzie następował wy-
buch choroby i zakażenie obejmowało
niemal całe stado w ciągu miesiąca.
Chore cielęta początkowo są apatycz-
ne, często pojawia się wypływ z nosa,
ślinotok oraz gorączka (40,5-41,5°C),
która utrzymuje się przez cały okres
choroby. Duszność, kaszel, katar i bie-
gunka to pierwsze, niespecyfi czne ob-
jawy choroby. Po około 2 tygodniach
pojawiają się trudności w chodzeniu
oraz niechęć do podnoszenia się i wy-
raźna sztywność stawów pęcinowych,
a następnie chwiejny chód, kręcenie się
w koło. W końcowej fazie może wystą-
pić porażenie tylnych kończyn. Choro-
ba trwa od 3 dni do 3 tygodni.
Zmiany sekcyjne widoczne są w po-
staci zapalenia opłucnej, otrzewnej oraz
osierdzia z silnym przekrwieniem suro-
wiczówki. W początkowej fazie choroby
w jamach ciała obecny jest rzadki płyn,
w miejsce którego pojawia się cienka,
włóknista „siateczka”, pokrywająca rów-
nomiernie narządy wewnętrzne lub nie-
regularnie nagromadzone masy włók-
nika. Histologicznie jest to włóknikowe
zapalenie błony surowiczej otrzewnej,
opłucnej i osierdzia. Rozsiane zapa-
lenie mózgu i rdzenia, często razem
z zapaleniem opon mózgowych, doty-
czy najczęściej rdzenia oraz móżdżku.
Zwierzęta, które powracają do zdrowia,
wykazują znaczną utratę kondycji i po-
woli przybierają na masie.
Diagnostyka laboratoryjna
Rozpoznanie możliwe jest jedynie
na podstawie wyników badań labora-
toryjnych. Można izolować chlamydo-
fi le w hodowli na zarodkach kurzych
lub komercyjnych liniach komórko-
wych. Materiałem do badań mogą być
wycinki narządów poronionego płodu,
fragmenty zmienionego łożyska lub
wypływ z pochwy. Wykonuje się także
badania serologiczne – odczyn wiąza-
nia dopełniacza (OWD) lub test immu-
noenzymatyczny (test ELISA). Jednak
obecność przeciwciał w surowicy krwi
nie zawsze jest jednoznaczna z wystą-
pieniem objawów klinicznych. Dlatego
wykonując OWD, najlepiej pobrać krew
2-krotnie, aby wykazać wzrost lub spa-
dek miana przeciwciał (zakażenie roz-
wija się/wygasa). Test ELISA takiej moż-
liwości nie daje, gdyż informuje jedynie
o obecności lub braku przeciwciał w su-
rowicy krwi. Badania hodowlane oraz
testy serologiczne są zastępowane co-
raz częściej przez techniki biologii mo-
lekularnej (PCR), pozwalające wyka-
zać bezpośrednią obecność bakterii
w badanym materiale, a więc stwierdze-
nie aktualnego zakażenia. Materiałem
mogą być tu wymazy, wycinki tkanek
czy pobrany płyn stawowy.
Leczenie
Chemioterapia zakażeń chlamydiami
musi brać pod uwagę specyfi kę tych
bakterii. Po pierwsze brak w ścianie
komórkowej peptydoglikanów sprawia,
że chlamydie są oporne na antybiotyki
-laktamowe (penicyliny i cefalospory-
ny). Drugim ważnym czynnikiem de-
cydującym o skuteczności leczenia
jest wewnątrzkomórkowa lokalizacja
drobnoustrojów, a więc konieczność
stosowania leków cechujących się do-
brą penetracją do wnętrza komórek.
Do takich chemioterapeutyków nale-
żą makrolidy, tetracykliny i chinolony.
W potwierdzonych przypadkach zapa-
lenia płuc, spojówek lub stawów na tle
zakażenia chlamydiami można stoso-
wać tetracykliny, jednak efekt terapeu-
tyczny bywa różny i często notuje się
nawroty choroby.
W Wielkiej Brytanii w potwierdzo-
nych przypadkach poronień na tle
Chlamydophila abortus stosuje się u cię-
żarnych samic, które nie poroniły, dwie
domięśniowe iniekcje wysokich da-
wek oksytetracykliny o przedłużonym
działaniu. Takie postępowanie znacz-
nie ogranicza wystąpienie ronień oraz
wczesnej śmierci noworodków.
Piśmiennictwo
1. Everett K.D.E., Bush R.M., Andersen
A.A.: Emended description of the order
Chlamydiales, proposal of Parachlamy-
diaceae fam. nov. and Simkaniaceae fam.
nov., each containing one monotypic
genus, revised taxonomy of the famly
Chlamydiaceae, including a new genus
and fi ve new species, and standards for the
identifi cation of organisms. „International
Journal of Systematic and Evolutionary
Bacteriology”, 1999, 49, 415-440.
2. Gliński Z., Kostro K.: Choroby zakaźne
zwierząt. PWRiL, Warszawa 2003.
3. Jones G.E.: Chlamydial diseases of the
reproductive tract of domestic ruminants.
[W:] Hitchcock P.J., MacKay H.T.,
Wasserheit J.N., Binder R.: Sexually
transmitted diseases and adverse outcomes
of pregnancy. „Am. Soc. Microbiol.”,
Washington 1999.
4. McKercher D.G.: Cause and prevention
of epizootic bovine abortion. „J. Am. Vet.
Med. Assoc.”, 1969, 154, 1192-1196.
5. Perez-Martinez J.A., Storz J.: Antigenic
diversity of Chlamydia psittaci of mam-
malian origin determined by microimmu-
nofl uorescence. „Infect. Immun.”, 1985,
50, 905-910.
6. Radostits O.M., Gay C.C., Hinchcliff
K.W., Constable P.D.: Veterinary Medi-
cine, Ames 2007, Wyd. IX, 1433-1
7. Storz J.: Chlamydia and Chlamydia-In-
duced Diseases. USA 1971.
8. Storz J., Shupe J.L., Smart R.A., Thornley
R.W.: Polyarthritis of calves: experimental
induction by a psittacosis agent. „Am.
J. Vet. Res.”, 1966, 27, 987-995.
9. Wilsmore A.J., Dawson M.: Chlamydial
diseases of ruminants in Britain. [W:]
Chlamydial disease of ruminants. Brus-
sels 1986.
Document Outline
Wyszukiwarka
Podobne podstrony:
chlamydiofiloza bo i ov
CHLAMYDIOZY
E book Chlamydia trachomatis 2012
chlamydofilozy
chlamydiozy
Chlamydofiloza bydła
Chlamydiozy i chlamydophilozy u owiec i bydla 2
chlamydie id 114082 Nieznany
Chlamydia
Chlamydioza
Chlamydia psittaci Groźny „prezent” od ptaków
Chlamydiozy i chlamydofilozy na koło
chlamydioza
Ureaplasma, Chlamydia trachomatis
CHLAMYDIE & RIKETSJE, Mikrobiologia
CHLAMYDIOZA, Technik weterynarii, choroby
chlamydia
więcej podobnych podstron