
Zakład Mikrobiologii i Laboratoryjnej Immunologii Medycznej
Metody izolowania
komórek krwi obwodowej

Wybór metody izolacji komórek opiera się na uwzględnieniu:
• rodzaju komórek, które chcemy wyizolować
• wielkości odzysku uzyskanych komórek
• czystość uzyskanych komórek
Prawidłowo przeprowadzona izolacja powinna pozwolić na:
• ocenę sprawności funkcjonalnej komórek
• założenie hodowli komórek.
Źródła komórek:
• krew obwodowa
• płyny ustrojowe
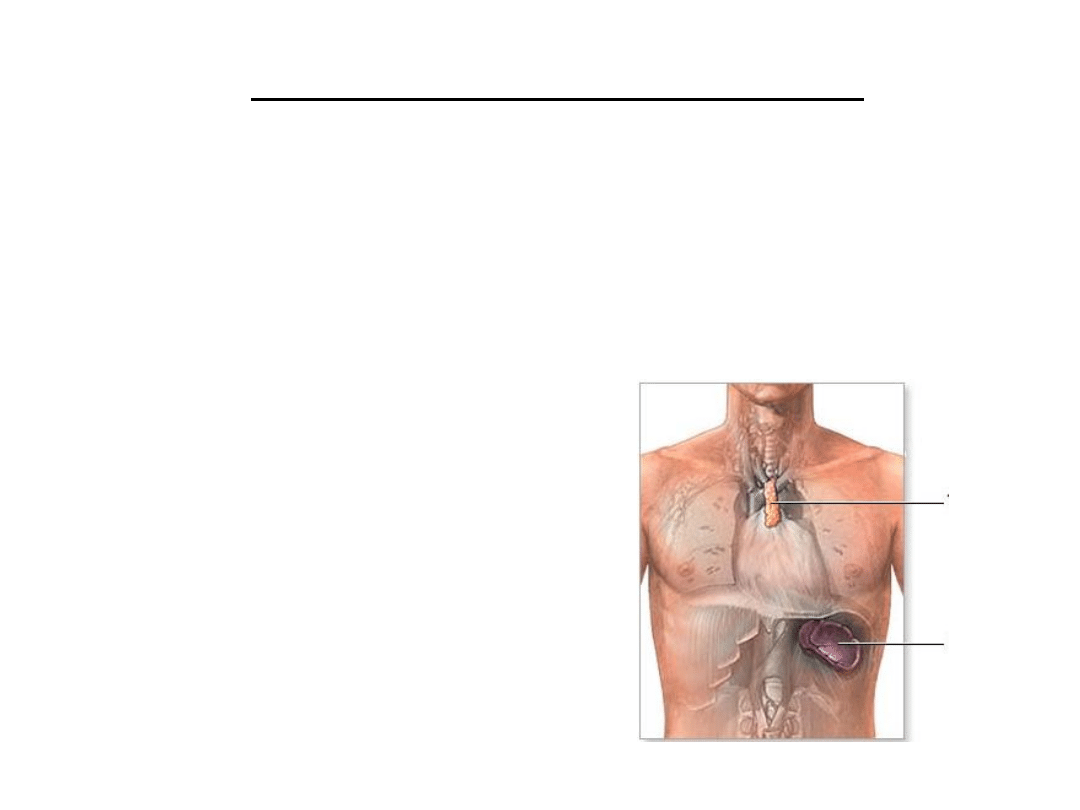
• tkanki – migdałki, węzły chłonne, grasica, śledziona…
I.
Metody izolowania komórek z narządów:
1) mechaniczne
2) enzymatyczne
Ad.1
Mechaniczne rozdrabnianie wyizolowanych narządów,
homogenizacja (przecieranie na sicie, wytłaczanie),
np. izolowanie leukocytów z grasicy, śledziony,
węzłów chłonnych.
Ad.2
Stosowanie enzymów np. trypsyny, powodujących
rozluźnienie tkanki łącznej i uwolnienie komórek do
supernatantu.
grasica
śledziona
II.
Metody izolowania frakcji komórek z krwi obwodowej
Metody biologiczne:
1- wykorzystanie właściwości fagocytarnych komórek
2- wykorzystanie właściwości adhezyjnych komórek
3- rozdział limfocytów T i B na kolumnach z perełkami szklanymi lub wełną nylonową
4- technika negatywnej selekcji
5- rozdział komórek za pomocą chromatografii powinowactwa
6- izolacja z narządów in vivo
Metody fizyko-chemiczne:
1- Metoda sedymentacji
2- Metoda adherencyjna
3- Izolowanie komórek w gradientach gęstości
4- Izolacja komórek z zastosowaniem kulek paramagnetycznych (magnetic beads)
5- Izolacja metodą immunoadsorbcji komórek na fazie stałej (panning)
6- Izolacja przy pomocy sortera komórkowego

Cele pobierania krwi
•
Aby uzyskać surowicę, plazmę, które stanowią materiał badany do różnych oznaczeń
laboratoryjnych tj. oznaczanie poziomu przeciwciał, antygenów
•
Aby wyizolować komórki: erytrocyty, leukocyty itp.
W celu wyizolowania komórek, krew pobieramy na substancje zabezpieczającą
krzepnięciu, na tzw. antykoagulant:
EDTA (wersenian dwusodowy)
cytrynian trójsodowy
Heparyna
•
w przypadku małych zwierząt (myszy, świnki, króliki) krew pobiera się prosto z serca
•
w przypadku zwierząt większych np. owca, krew pobiera się poprzez wkłucie się do
żyły szyjnej
•
człowiek - krew obwodową pobiera się zwykle z żyły łokciowej
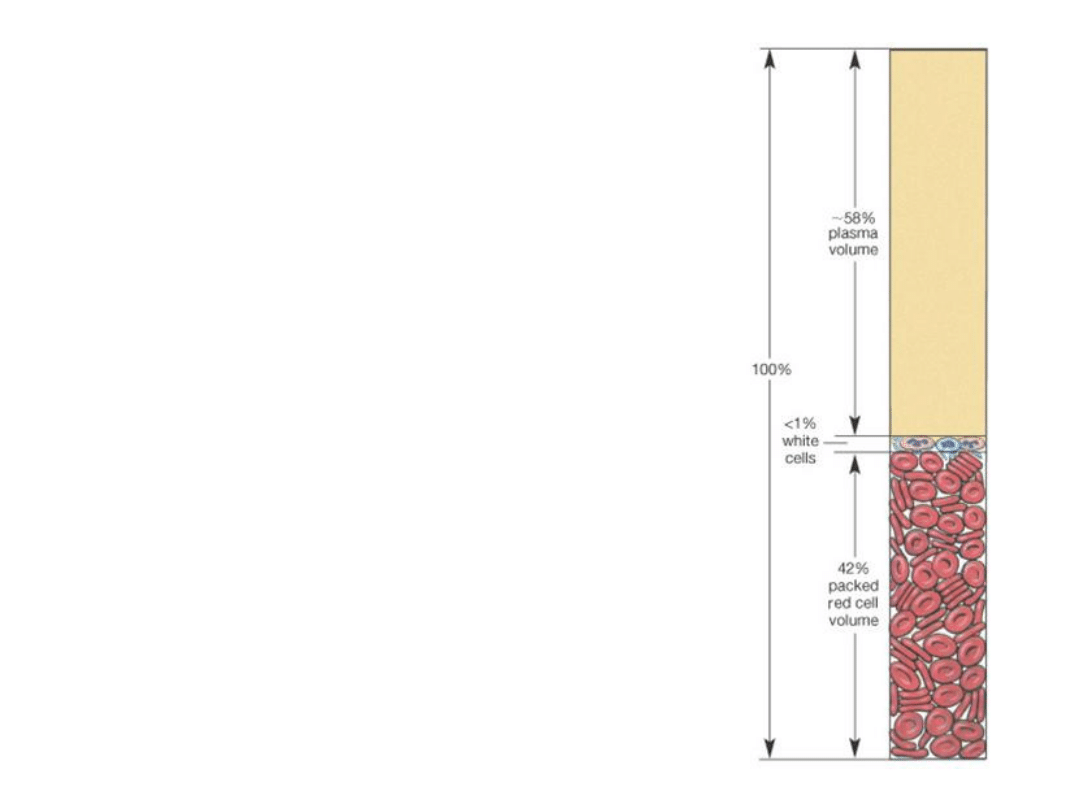
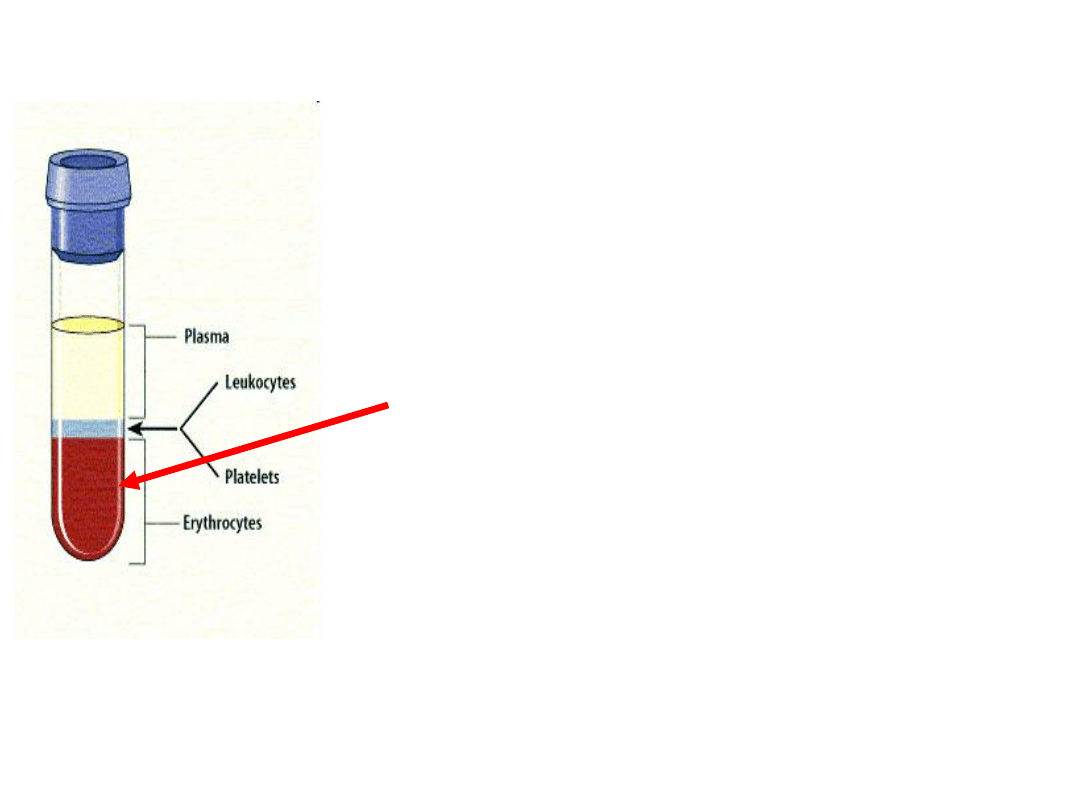
Krew
Tkanka złożona z
elementów morfotycznych
(upostaciowionych) oraz
plazmy
. Całkowita
objętość krwi krążącej wynosi ok.
5 litrów, ponad połowę stanowi osocze, ok. 45%
krwinki czerwone i ok. 1% krwinki białe i płytki krwi
PLAZMA:
to płyn prawie w całości złożony z wody, zawiera:
witaminy, mikro- i makroelementy, produkty
metabolizmu komórek, a także fibrynogen, nie zawiera
komórek
OSOCZE:
to plazma w której zawieszone są elementy morfotyczne
krwi
SUROWICA:
frakcja krwi pozbawiona zarówno elementów
morfotycznych oraz fibrynogenu i czynników krzepnięcia
krwi (pozostałość po oddzieleniu się skrzepu).

Metody izolowania frakcji komórek z krwi obwodowej
Metody biologiczne
:
1- wykorzystanie właściwości fagocytarnych komórek
2- wykorzystanie właściwości adhezyjnych komórek
3- rozdział limfocytów T i B na kolumnach z perełkami szklanymi lub
wełną nylonową
4- technika negatywnej selekcji
5- rozdział komórek za pomocą chromatografii powinowactwa
6- izolacja z na rządów in vivo
Ad. 1 Metoda fagocytarna:
- służy do izolowania komórek monocytarnych z frakcji monocytaro-
makrofagowej i fibroblastów, do izolacji granulocytów
- metoda podobna do separacji magnetycznej
- komórki żerne miesza się z karbozydkiem żelaza i przenosi do zestawu
z magnesem, potrzebne nam komórki przytwierdzają się do ścianek
naczynia, a zebrany nadsącz odlewamy
Ad. 2 Metoda adhezyjna:
- naturalna adhezja (przyleganie) niektórych komórek do szkła lub
plastiku w temperaturze 37ºC
- komórki te w naturalny sposób odklejają się od tych materiałów w 4ºC

Ad.3 rozdział limfocytów
- stosuje się kolumny z perełkami lub wełną nylonową
- wykorzystuje się tu także właściwości adhezyjne
- rozfrakcjonowanie limfocytów na subpopulacje
- limfocyty B adherują do wełny, a limfocyty T przechodzą z roztworem
przez wełnę
- limfocyty T można odzyskać z wełny poprzez mechaniczne odpłukiwanie
podłożem hodowlanym
Ad.4 technika negatywnej selekcji
- wykorzystuje się cytotoksyczną surowicę odpornościową oraz
dopełniacz (komplement)
- surowica skierowana jest przeciw określonej frakcji komórek
- następuje liza komórek, które nas nie interesują
Toksyczne przeciwciało + dopełniacz + komórka swoista liza

Ad.5 rozdział komórek za pomocą chromatografii powinowactwa
- z zastosowaniem złoża np.. Sephadex, (mikrogranulek)
- wykorzystuje się naturalną adherencję komórek, tropizm do Sephadex’u
- można użyć kolumn z przeciwciałami skierowanymi przeciwko określonym frakcjom
komórek
Ad.6 izolacja komórek z narządów in vivo
- narządy jako źródło określonych komórek
- można prowokować gromadzenie się komórek w jamach ciała, dotyczy to głównie
zwierząt laboratoryjnych
- źródło limfocytów: grasica, śledziona, węzły chłonne
- źródło granulocytów i monocytów: u zwierząt przez szczepienie dootrzewnowe
neutralnymi substancjami np.. Peptonem. Granulocyty możemy uzyskać po 4-18
godzinach. Frakcję makrofagową uzyskujemy po 72 godzinach od zaszczepienia
Sephadex

Metody izolowania frakcji komórek z krwi obwodowej
Metody biologiczne
Metody fizyko-chemiczne:
1- Metoda sedymentacji
2- Metoda adherencyjna
3- Izolowanie komórek w gradientach gęstości
4- Izolacja komórek z zastosowaniem kulek paramagnetycznych (magnetic beads)
5- Izolacja metodą immunoadsorbcji komórek na fazie stałej (panning)
6- Izolacja przy pomocy sortera komórkowego
Ad1) Metoda sedymentacji
• metoda najprostsza
• wykorzystuje zjawisko zróżnicowanej szybkości
opadania poszczególnych rodzajów krwinek w
zawiesinie
• pobraną na antykoagulant krew poddaje się
spontanicznej sedymentacji 1-2h w 37 C
• erytrocyty opadają na dno probówki
• przyśpieszenie procesu:
• dekstran wielkocząsteczkowy (Dextran 500)
• 3% żelatyny w NaCl lub z 1,2% alkoholu
poliwinylowego
Izolacja czystych populacji leukocytarnych wymaga
– dalszych metod izolacji
(fizykochemicznych i biologicznych)
Ad 2) Metody adherencyjne
•
Wykorzystują zdolność przylegania komórek do powierzchni szkła i
plastiku ( gł. monocyty)
Izolacja monocytów z frakcji komórek jednojądrowych
• inkubacja komórek na płytkach w medium z surowicą
• 60 min 37 C
• do powierzchni płytki „przyklejają” się monocyty,
limfocyty pozostają w zawiesinie i łatwo je odpłukać
• monocyty po inkubacji w 4 C przez 30 min odklejają się
od płytki
Rozdział limfocytów B i T
• inkubacja w kolumnach z watą nylonową lub wypełnionych
sephadexem D-10
• adherencji ulegają limfocyty B, limfocyty T można odpłukać

Ad 3) Izolowanie komórek w gradientach gęstości
• wykorzystuje różnice w wielkości i ciężarze
właściwym izolowanych komórek
• mieszanina rozdzielająca (gradient) o specjalnie
dobranej gęstości względnej tworzy „sito”, które:
• zatrzymuje na swej powierzchni komórki
lżejsze
• „przepuszcza” komórki cięższe (erytrocyty,
granulocyty)
Cechy gradientu:
niska lepkość
izoosmotyczny względem komórek
nie powinien wnikać do komórek i
osłabiać ich żywotności
łatwy do odpłukania
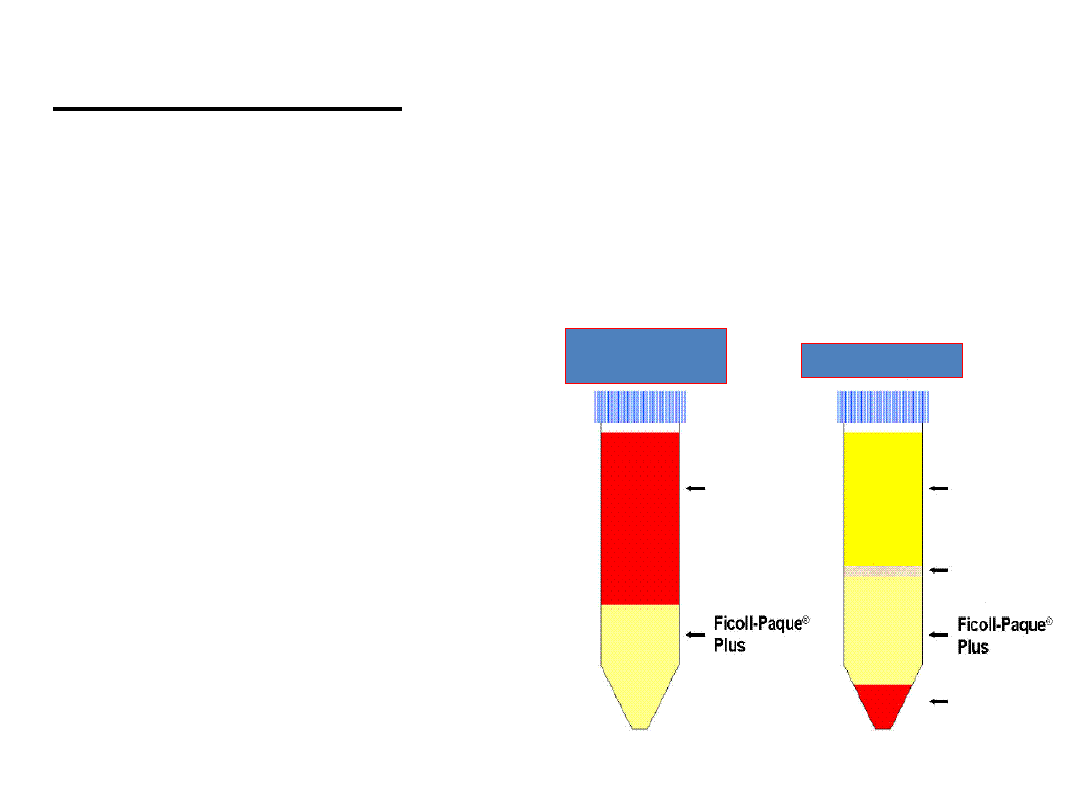
Rodzaje gradientów
:
• gradient jednostopniowy
mieszanina Ficollu (hydrofilowy polimer sacharozy) i
Isopaque
(sodium metrioate) o gęstości 1,077
wprowadzona przez Boyum do izolacji limfocytów.
• na warstwę gradientu (ok. 3ml)
nawarstwić pełną krew
z antykoagulantem (5ml)
• wirowanie w temp. pokojowej przy 400g
przez 20 min
• erytrocyty, granulocyty, martwe
komórki opadają na dno probówki
• interfaza – komórki
jednojądrowe (limfocyty,
monocyty)
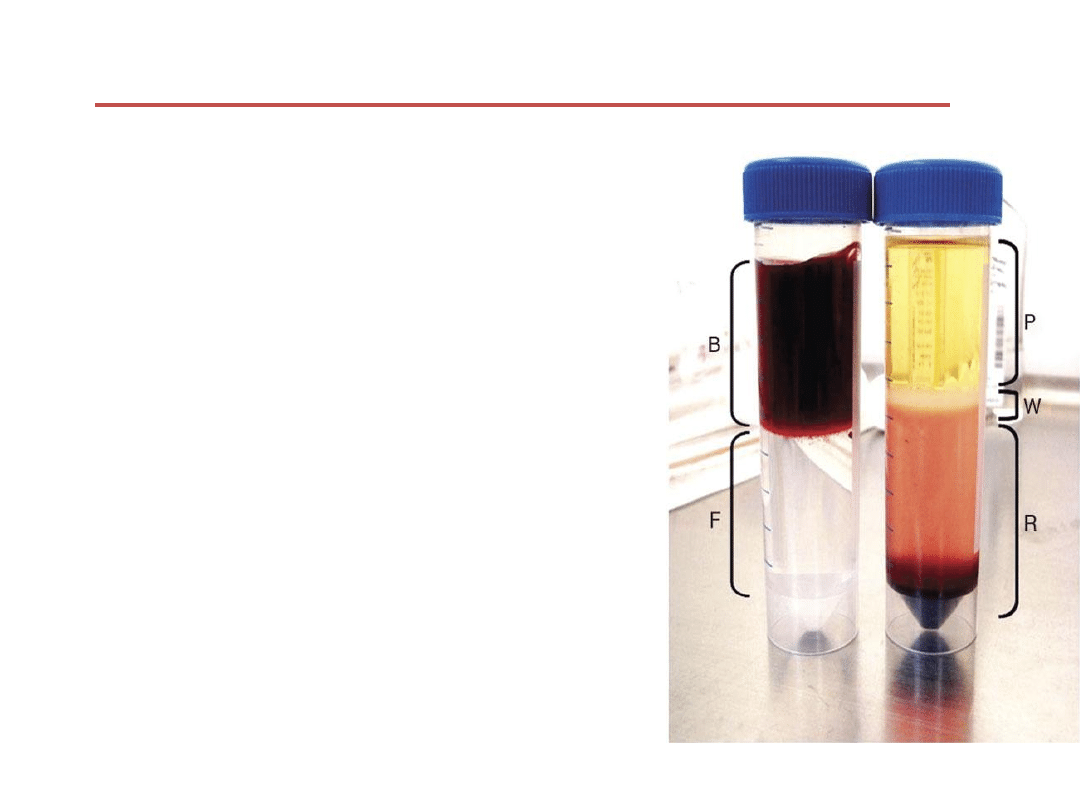
Przed
wirowaniem
Po wirowaniu
Plazma
Interfaza z
komórkami
PBML
Erytrocyty i
granulocyty
Krew
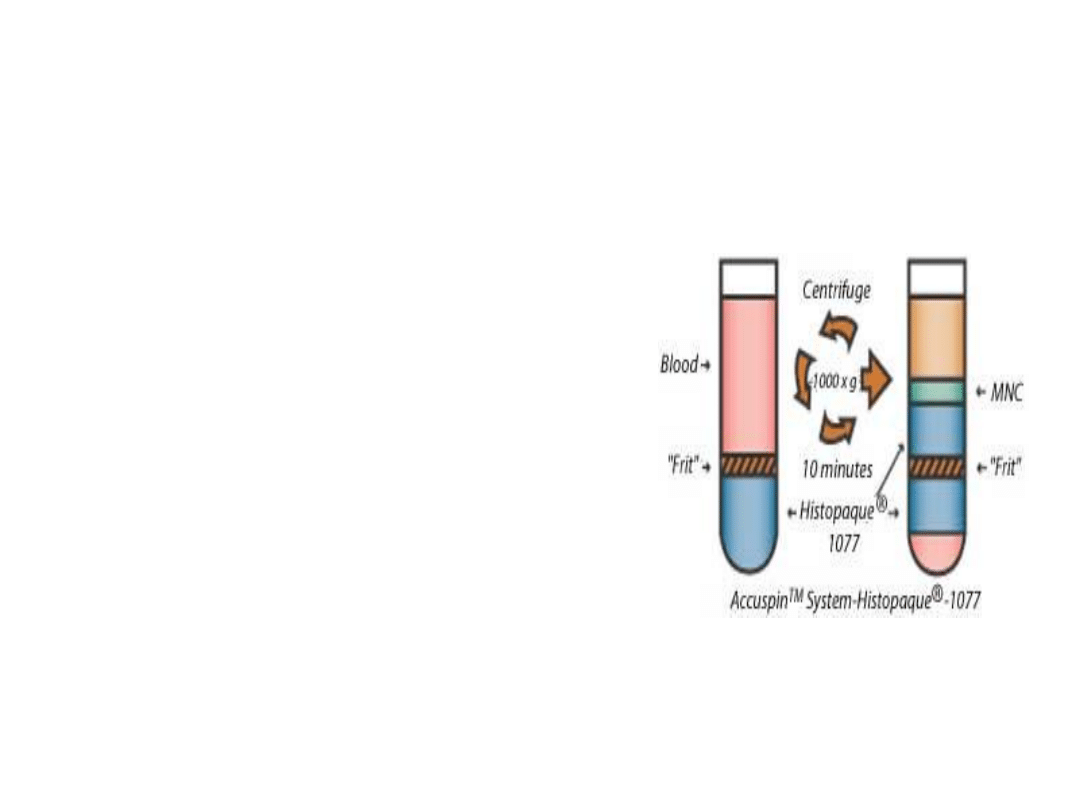
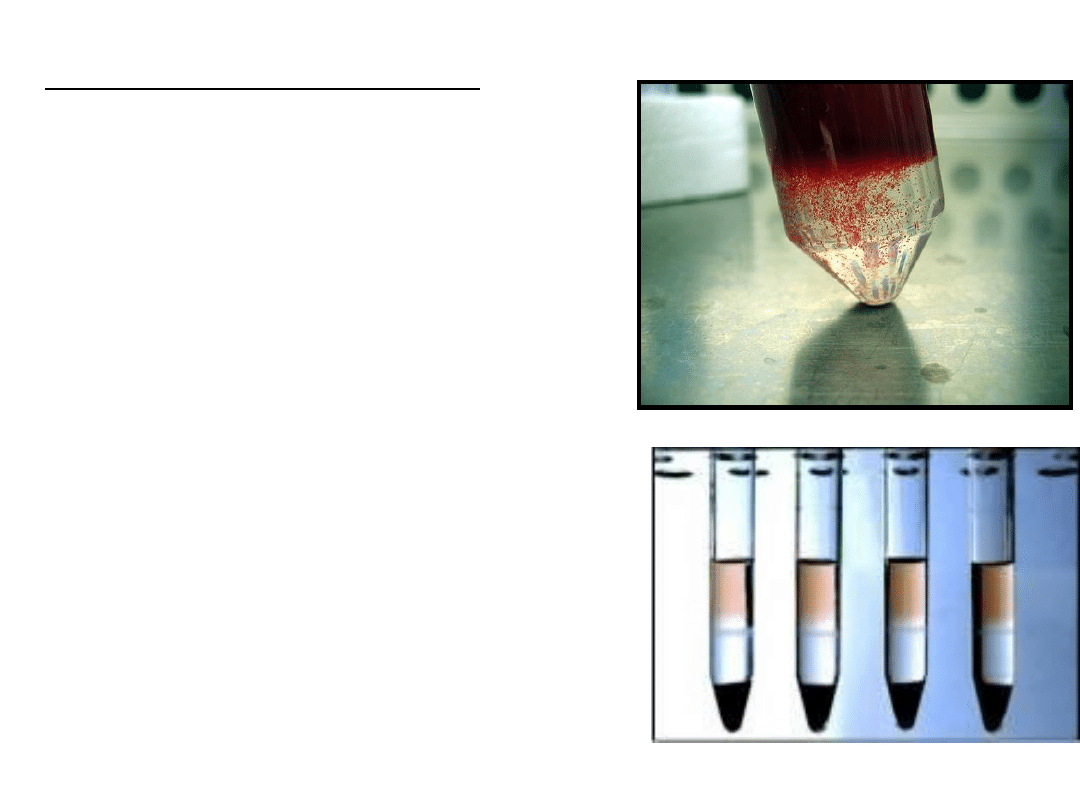
Rodzaje gradientów cd…
•
gradient dwustopniowy
– nawarstwione na siebie preparaty
Histopaq 1,119 i Histopaq 1,077
• wirowanie – 30 min przy 700g w temp. pokojowej
• 2 interfazy:
• pierwsza od góry – limfocyty i monocyty
• druga – granulocyty
• erytrocyty – opadają na dno probówki
Gradisol G
• mieszanina Uropoliny i dekstranu
• jednostopniowy gradient
• po wirowaniu 25min przy 400g – 2 interfazy
Percoll (mikrokuleczki koloidalnej krzemionki pokrytych poliwinylopyrolidonem)
– dowolne wielostopniowe gradienty (rozcieńczając NaCl – 0,15nM)

Ad 4) Izolacja komórek z zastosowaniem kulek paramagnetycznych
(magnetic beads)
• Uzyskiwanie czystych populacji komórek z wstępnie uzyskanej mieszaniny
• Wyizolowane komórki inkubowane są z kulkami magnetycznymi
opłaszczonymi przeciwciałami przeciw Ag (Antigen
)
powierzchniowym komórek
Rozdział frakcji PBML na frakcję monocytarną i limfocytarną za
pomocą sortera komórkowego MACS
Inkubacja
komórek
PBML z cząsteczkami paramagnetycznymi
(opłaszczonymi mysimi monoklonalnymi przeciwciałami przeciwko ludzkiemu
CD14+)
przez 30 min temp. 4
o
C)
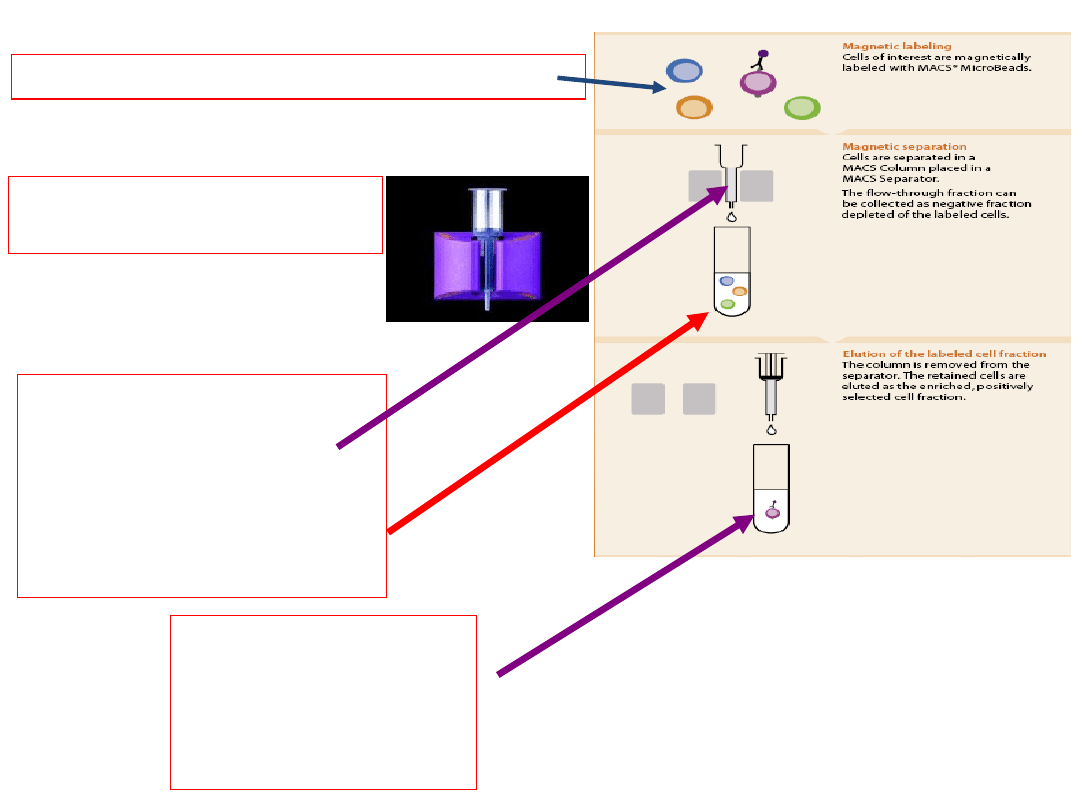
wirowanie
(
1400 obr/min,10 min. w temp. 4
o
C.
)
Rozdział pozytywny
=
frakcja komórek
monocytarnych (CD14+)
>zatrzymana w kolumnie LS
frakcja limfocytarna (CD14 -)
>w przesączu
Naniesienie frakcji komórek
PBML na kolumnę LS.
Frakcja komórek
monocytarnych została
usunięta z kolumny LS
(przy pomocy tłoka do
kolumny).
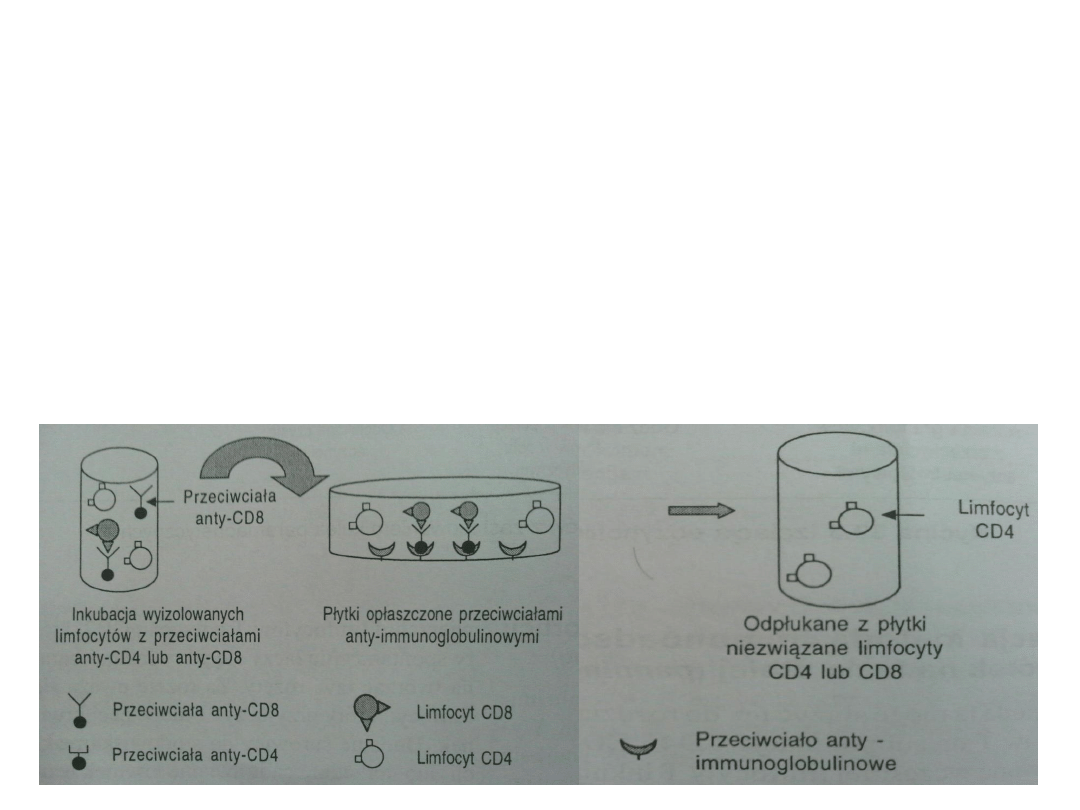
Ad 5) Izolacja metodą immunoadsorbcji komórek na fazie stałej (panning)
• stosowany m.in. do rozdziału limfocytów T na subpopulacje CD4 i CD8
• limfocyty T inkubuje się z Ab (Antibody – przeciwciało) monoklonalnymi np.
anty
– CD4
• zawiesinę komórek wylewa się na płytkę Petriego opłaszczoną Ab anty
mysie białko
• po inkubacji limfocyty CD4 zostają związane a limfocyty CD8 można
odpłukać
Izolacja limfocytów T przy zastosowaniu testu rozetowego E
Zaliczana do grupy biologicznych metod izolacji.
Zasada
– obecność markera CD2 na limfocytach T.
• CD2 na powierzchni limfocytów T łączy się
spontanicznie z krwinkami barana tworząc
rozety
• rozeta = limfocyt + 3 lub krwinek
Powstałe rozetki izoluje się przez wirowanie na gradiencie Percoll.
Hemoliza krwinek czerwonych szokiem osmotycznym
zawiesina limfocytów.
Ad 6)-
Izolacja przy pomocy sortera komórkowego (cytometr przepływowy)
Niezależnie od metody izolacji – ocena żywotności i czystości wyizolowanych
komórek.
żywotność
przyżyciowe barwienie błękitem trypanu (wnika do wnętrza martwych
komórek);
prawidłowo przeprowadzona izolacja
= 100% żywotność;
niska żywotność komórek
= nie pozwala na dalszą wiarygodną ocenę
aktywności
czystość
ocena pod mikroskopem w preparacie wybarwionym metodą Giemsy,
licząc co najmniej 100 komórek i podając procent badanych komórek.
liczba żywych komórek (opalizujące)
liczba wszystkich komórek (niebieskie+opalizujące)
X 100%
Żywotność =

Liczenie gęstości komórek w komorze Bűrkera :
1.
Przygotować komorę.
2.
Rozcieńczyć zawiesinę wyizolowanych
leukocytów w płynie Turka Bűrkera w stosunku
1:20.
3.
Zawiesinę wybarwionych komórek przenieść do
komory zgodnie z intrukcją prowadzącego
ćwiczenia.
4.Metoda liczenia:
KOMORA BŰRKERA
Do zliczania leukocytów i erytrocytów.
– głębokość komory: 0,1 mm
– duży kwadrat: 1 mm
2
– grupowy kwadrat: 0,04 mm
2
– siatka licznika z 9 dużymi kwadratami
– każdy duży kwadrat jest podzielony na 16 grupowych
– kwadraty grupowe nie są podzielone
L
k
x rozcieńczenie x 10
4
2
= l.kom/ml
L
k
– liczba komórek w dwóch dużych
kwadratach
Typy komór do
zliczania
komórek:
Komora Thoma
Komora Neubauera
Komora Bürkera
Komora Fuchs-Rosenthala
• dobór dawców przy przeszczepach – określanie
markerów powierzchniowych zgodności tkankowej.
• badanie chorób nowotworowych – izolowanie
komórek nowotworowych, określanie markerów
powierzchniowych
• badanie reakcji alergicznych – badanie aktywności
komórek układu odpornościowego na alergeny
• w opracowaniu szczepionek – badanie odpowiedzi
immunologicznej
• badanie niedoborów odporności
• immunologia rozrodu – leczenie bezpłodności
• badanie aktywności proliferacji komórek
fagocytujących
• cel diagnostyczny!!!
Cel izolowania komórek układu odpornościowego

Otrzymywanie erytrocytów
1. Świeżo pobraną krew zmieszać w stosunku 1:2 z płynem Alsever’a (glukoza,
cytrynian sodu, chlorek sodu, woda).
2. Tak przygotowaną zawiesinę można przechowywać w 4ºC przez 1-8 tygodni.
3. Przed wykorzystaniem krwinek należy 3-krotnie przepłukać je NaCl 0,85%, wirując za
każdym razem 10 minut, w 4ºC, w 2000 obr/min
.
Izolacja komórek krwi na Gradisolu:
1.
Rozcieńczyć krew w PBS bez jonów wapnia i
magnezu w stosunku 1:3
(9ml krwi + 18ml PBS)
2.
Nanieść rozcieńczoną krew na gradient, stosunek
objętościowy krew – gradient 1:2.
(2ml Gradisolu + 4ml rozcieńczonej krwi)
3.Wirowanie 20-25 min. 400 x g (1600-2000obr/min)
w temp. pokojowej
4.
Zebrać delikatnie warstwę kożuszka do nowych
probówek.
5.
Płukać dwukrotnie PBS bez jonów Ca²
+
i Mg²
+
przez 5 min. 300 x g w temp. pokojowej.
6.
Odlać supernatant i dodać 1ml PBS, wymieszać
aby powstała jednorodna zawiesina komórek.
7.
Policzyć gęstość komórek w komorze Bűrkera.
Wyszukiwarka
Podobne podstrony:
metody dezintegracji komórek, studia, bio, 3rok, 6sem, biotechnologia, wyklad
Metody obserwacji komórek
28a BIOFIZYCZNE I BIOCHEMICZNE METODY BADANIA KOMÓREK
metody izolowania
Ćwiczenie 2 Metody izolacji komórek
biofizyczne i biochemiczne metody badania komorek, MATURA, biologia notatki, biologia
Ćw 03a Centralny i obwodowy układ limfatyczny Izolowanie komórek z narządów limfatycznych
62 Antygeny różnicowania 63 Metody obserwacji komórek
(), mikrobiologia przemysłowa L, Metody?zintegracji komórek
Metody barwienia i różnicowania komórek
metody oznaczania lekowrazliwości, Metody oznaczania lekowrażliwości izolowanych drobnoustrojów
Metody?dania komórek
Metody wydajnej izolacji i hodowli mezenchymalnych komórek macierzystych
T 3[1] METODY DIAGNOZOWANIA I ROZWIAZYWANIA PROBLEMOW
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
więcej podobnych podstron