Niektóre wskaźniki zagrożenia rozwojem choroby wieńcowej u mężczyzn w zależności od wieku
9
The some risk factors for atherosclerosis in men with
coronary artery disease depending on the age
Stasiakowska-Badura E., Kochmański M.
Central Clinical Hospital of Ministry of Interior and Administration in
Warsaw, Poland, Department of Preventive Cardiology,
e-mail: jolanta.seroczynska@CSKMSWIA.pl
The aim of this study was to search to the factors favouring the
earlier revealing of a coronary artery disease by comparing selected
immunological, hormonal and biochemical parameters between two
groups – younger and older men with coronary artery disease and
with responding control groups.
Material and methods. In the study were included 93 men – 60 with
stable angina, confirmed by coronarography (at least 6 months after
CABG, PTCA or myocardial infraction, with EF > 40%) and 33 men
without atherosclerotic changes in the coronary vessels, as the con-
trol group. The two groups were divided depending on age: the youn-
ger subgroups [under 60-ty years old – group A with CAD (n = 30)
and B without CAD (n = 18)] and the older subgroup [over 70-ty
years old group C with CAD (n = 30) and D without CAD (n = 15)].
Results. Significantly lower concentration were noted for TNF-
a –
in control groups – by about 50% in the younger and 23% in the
older group (r = 0.49) and homocysteine (by about 20% and 22%
respectively, r = 0.40). Patients with CAD had higher concentration
of CRP then in the control groups (by 52% and 54%, r = 0.28).
Weak but positive correlation with the presence of a coronary heart
disease was show for IgE and anti-gliadin antibodies (r = 0.22-0.29).
Conclusion. The younger and older men with CAD statistically si-
gnificantly differed in concentration of TNF-
a and homocysteine.
Key words: atherosclerosis, TNF-
a, CRP, homocysteine, immuno-
globulins, testosterone, CAD – coronary artery disease
Pol. Merk. Lek., 2007, XXIII, 133, 9
Niektóre wskaźniki zagrożenia rozwojem choroby
wieńcowej u mężczyzn w zależności od wieku
ELWIRA STASIAKOWSKA-BADURA, MAREK KOCHMAŃSKI
Centralny Szpital Kliniczny MSWiA w Warszawie, Klinika Kardiologii Zachowawczej, kierownik: dr hab. med. M. Kochmański
Niektóre wskaźniki zagrożenia rozwojem choroby wieńcowej
u mężczyzn w zależności od wieku
Stasiakowska-Badura E., Kochmański M.
Centralny Szpital Kliniczny MSWiA w Warszawie, Klinika Kardiologii
Zachowawczej, e-mail: jolanta.seroczynska@CSKMSWIA.pl
Celem badania było znalezienie czynników sprzyjających wcześniej-
szej manifestacji choroby wieńcowej przez porównanie wybranych
parametrów immunologicznych, hormonalnych i biochemicznych
między grupą młodszych i starszych mężczyzn chorych na CAD
a grupą kontrolną.
Materiał i metody. Do badania włączono 93 mężczyzn, w tym 60 cho-
rujących na potwierdzoną koronarograficznie chorobę wieńcową w okre-
sie stabilnym (co najmniej sześć miesięcy po CABG, PTCA lub przeby-
tym zawale serca, EF > 40%) oraz 33 bez stwierdzonych zmian miażdży-
cowych w naczyniach wieńcowych jako grupę kontrolną. Obie grupy
podzielono w zależności od wieku na: młodszą [do 60. r.ż. – grupa A z
CAD (n = 30) oraz grupa B bez CAD (n = 18)] i starszą wiekowo [od 70
r.ż. – grupa C z CAD (n = 30) oraz grupa D bez CAD (n = 15)].
Wyniki. W obu grupach kontrolnych obserwowano znamiennie mniej-
sze stężenie TNF-
a – o 50% u młodszych i 23% u starszych (r =
0,49) oraz homocysteiny – odpowiednio o 20% i 22% (r = 0,40).
Chorzy na CAD mieli większe stężenie CRP niż osoby z grup kon-
trolnych (odpowiednio o 52% i 54%). Słabą dodatnią korelację z wy-
stępowaniem choroby wieńcowej wykazano dla IgE oraz przeciw-
ciał antygliadynowych (r = 0,22-0,29).
Wnioski. Zarówno młodsi, jak i starsi mężczyźni chorujący na CAD
wyróżniali się istotnie statystycznie większym stężeniem TNF-
a oraz
homocysteiny.
Słowa kluczowe: choroba wieńcowa, TNF-
a, CRP, homocysteina,
immunoglobuliny, testosteron, CAD
Pol. Merk. Lek., 2007, XXIII, 133, 9
Znanymi od dawna, niezależnymi wskaźnikami zagrożenia
rozwojem choroby niedokrwiennej serca, zdefiniowanymi jako
czynniki ryzyka, są: starszy wiek, płeć męska oraz obciąże-
nie rodzinne chorobami sercowo-naczyniowymi. Zalicza się
do nich także czynniki zależne od stylu życia i wpływu środo-
wiska, tj.: zaburzenia gospodarki lipidowej, palenie tytoniu,
nadciśnienie tętnicze, cukrzycę, otyłość, małą aktywność fi-
zyczną, stres oraz okres pomenopauzalny u kobiet [22].
Ponieważ czynniki te tłumaczą jedynie około 50-70% przy-
padków choroby niedokrwiennej serca, w ostatnich latach
zwrócono uwagę na kilka nowych czynników ryzyka, a wśród
nich na zwiększone stężenie: CRP (C-reactive protein – biał-
ko C-reaktywne), fibrynogenu, kwasu moczowego czy ho-
mocysteiny.
Gdy stężenie homocysteiny przekracza 12-15 mol/l, do-
chodzi do hiperhomocysteinemi, którą wywołują czynniki ge-
netyczne, a także nabyte skłonności, gdyż jej łagodna po-
stać wiąże się ściśle z niedoborami kwasu foliowego oraz
witaminy B6 i B12 w organizmie. Dotyczy to około 5-7% po-
pulacji [4]. Udowodniono, że suplementacja kwasu foliowe-
PRACE ORYGINALNE
go istotnie zmniejsza stężenie homocysteiny w osoczu, jed-
nak nie udało się dotychczas stwierdzić w badaniach pro-
spektywnych, czy zmniejsza jednocześnie ryzyko chorób ser-
cowo-naczyniowych. Opublikowane wyniki badania NORVIT
[3] jednoznacznie udowodniły, że leczenie witaminami z gru-
py B nie zmniejsza ryzyka wystąpienia schorzeń sercowo-
naczyniowych u chorych po zawale serca.
Proces zapalny wydaje się także krytycznym elementem
w mechanizmie destabilizacji blaszki miażdżycowej. Jej infil-
tracja przez makrofagi, komórki tuczne i aktywowane limfo-
cyty powoduje degradację macierzy zewnątrzkomórkowej
oraz aktywację komórek śródbłonka, czemu towarzyszy
zwiększenie stężenia cytokin i białek ostrej fazy, takich jak
CRP [25]. Czynnik tkankowy uwalniany z pękniętej blaszki
miażdżycowej powoduje procesy krzepnięcia, co wywołuje
zakrzepicę w naczyniu wieńcowym, a tym samym ostry ze-
spół wieńcowy.
Udowodniono związek większego stężenia CRP ze zwięk-
szonym ryzykiem występowania zawału serca i udaru mó-
zgu [1]. Przy czym stwierdzono, że odnosi się to również do

E. Stasiakowska-Badura, M. Kochmański
10
interleukin (np. IL-6) oraz cząsteczek adhezyjnych (ICAM-1
– czyli cząsteczki adhezji międzykomórkowej oraz VCAM-1
– cząsteczki adhezji międzykomórkowej naczyń).
Tumor Necrosis Factor (TNF), zwany czynnikiem martwi-
cy nowotworu, to jedna z głównych cytokin uczestniczących
w odpowiedzi zapalnej i immunologicznej organizmu [7]. Jak
się okazało w ostatnich latach, odpowiada on częściowo tak-
że za insulinooporność w przebiegu cukrzycy, powstawanie
zmian miażdżycowych oraz progresję niewydolności krąże-
nia. U mężczyzn stężenie TNF zwiększa się z wiekiem (u
kobiet dopiero po menopauzie), nie wykazuje natomiast za-
leżności od masy ciała [7].
Znana jest rola TNF w niewydolności serca, jednak w przy-
padku choroby wieńcowej jest znacznie mniej dostępnych
danych klinicznych. Obserwowane zwiększenie jego stęże-
nia w surowicy jest niewielkie, zwłaszcza w stabilnej postaci
CAD (coronary artery disease), bez komponenty kardiomio-
patii niedokrwiennej z istotnym upośledzeniem funkcji skur-
czowej serca i rozstrzenią jego jam.
Już na początku lat 80., na podstawie danych uzyskanych
z badań prospektywnych, zwrócono uwagę na wyraźny zwią-
zek dużego stężenia fibrynogenu ze zwiększonym ryzykiem
chorób sercowo-naczyniowych [18]. Metaanalizy wyników now-
szych badań potwierdziły tę obserwację, jak również zależność
między jego zwiększonym stężeniem a innymi markerami ostrej
fazy, czyli CRP, leukocytozą czy albuminami osocza.
W badaniu kohortowym ARIC (Atheroclerosis Risk in Com-
munities) właśnie fibrynogen okazał się czynnikiem najsilniej
skorelowanym z ryzykiem rozwoju choroby niedokrwiennej
serca spośród wszystkich badanych zmiennych [12].
Obserwowane zwiększenie stężenia fibrynogenu w ciągu
pierwszych dni po zawale (w 4. lub 5. dobie nawet powyżej 5
g/l) oraz w niestabilnej chorobie wieńcowej wynika z odpo-
wiedzi zapalnej w ostrej fazie, natomiast w stanach przewle-
kłych jest wyrazem uogólnionej reakcji zapalnej, obserwo-
wanej w przypadku miażdżycy, na uszkodzenie śródbłonka
naczyniowego. Fibrynogenemia powyżej 3,5 g/l koreluje rów-
nież ze zwiększonym ryzykiem restenozy po zabiegach an-
gioplastyki wieńcowej.
W przypadku większości chorób zakaźnych obserwuje się
zwiększanie stężenia immunoglobulin wszystkich trzech głów-
nych klas: IgG, IgA i IgM [7].
Oznaczone dodatkowo w niniejszej pracy przeciwciała kla-
sy IgE występują w ilościach śladowych w układzie krążenia,
ale warunkują reakcję alergiczną typu nadwrażliwość natych-
miastowa (anafilaktyczna), a ich zwiększone stężenie jest ty-
powe dla chorób alergicznych atopowych, takich jak astma,
katar sienny i pokrzywka, oraz zakażeń pasożytniczych.
W pracy podjęto również próbę orientacyjnej, „przesie-
wowej” oceny badanych chorych na chorobę wieńcową pod
kątem ewentualnego istnienia utajonej, bezobjawowej ente-
ropatii glutenozależnej. Taki cel miało oznaczanie przeciw-
ciał antygliandynowych we wszystkich badanych grupach.
Przesłanką tych działań były obserwacje wskazujące, że wiele
skąpoobjawowych, utajonych przypadków nie jest wykrywa-
na i diagnozowana, dane zaś epidemiologiczne określają, że
częstość ich występowania w populacji Europy Zachodniej
wynosi od 1:2000 do nawet 1:300 czy 1:200 [28].
Mężczyźni, w porównaniu z kobietami, dużo wcześniej i
częściej zapadają na chorobę niedokrwienną serca. Mimo
udowodnionej ochronnej roli estrogenów od dawna przypusz-
czano, że również androgeny mają wpływ na tę różnicę, jed-
nak ich rola nie jest do końca wyjaśniona. Prawdopodobnie
mogłyby oddziaływać niekorzystnie na układ krążenia męż-
czyzn, ale wiele obserwacji wydaje się sugerować wręcz
odwrotny ich wpływ. Faktem jest, że ryzyko choroby niedo-
krwiennej serca u mężczyzn zwiększa się z wiekiem, gdy tym-
czasem stężenie androgenów zmniejsza się w naturalny spo-
sób [2].
Znaczącą rolę wśród androgenów odgrywają: dehydro-
piandosteron (DHEA), siarczan dehydrapiandosteronu
(DHEA-S), testosteron oraz dihydrotestosteron (DHT) [16].
DHEA-S działa więc w zasadzie przez swoje metabolity.
Największe stężenie DHEA i DHEA-S obserwuje się u mło-
dych mężczyzn – jest ono kilkaset razy większe niż stężenie
testosteronu. Z wiekiem stopniowo maleje i u starszych męż-
czyzn wynosi około 20% wartości szczytowych.
Od kilku lat – na podstawie badań epidemiologicznych –
sugerowano zależność między stężeniem testosteronu cał-
kowitego a występowaniem choroby niedokrwiennej serca
[5] oraz odwrotną zależność między stężeniami DHEA i
DHEA-S a rozwojem chorób układu krążenia. Zaobserwo-
wano także, że hipogonadyzm przyczynia się do szybszego
rozwoju miażdżycy naczyń. Małe stężenie androgenów wy-
daje się być związane z samym występowaniem choroby nie-
dokrwiennej serca, nasileniem zmian w naczyniach wieńco-
wych oraz zwiększeniem ryzyka zgonu z powodu chorób
układu krążenia [11].
Celem pracy było znalezienie wśród mniej znanych czyn-
ników ryzyka tych, które najsilniej korelują dodatnio z wystę-
powaniem choroby wieńcowej.
MATERIAŁ I METODY
Badaniami objęto 93 mężczyzn do 60. roku życia albo w wie-
ku 70 lat i powyżej (nie włączono osób w wieku pośrednim),
których pogrupowano w zależności od występowania lub nie-
występowania zmian w naczyniach wieńcowych, potwierdzo-
nych metodą koronarografii.
Byli to pacjenci diagnozowani i leczeni w Klinice Kardiologii
Zachowawczej CSK MSWiA w Warszawie w 2004 r. po wyko-
nanym wcześniej (co najmniej dwa tygodnie) badaniu angio-
graficznym naczyń wieńcowych lub osoby przed tym badaniem.
W przypadku wszystkich mężczyzn choroba wieńcowa
była w okresie stabilnym, bez cech świeżego, ostrego ze-
społu wieńcowego (wartości CK, CKMB i troponin w normie).
Ponadto osoby te nie były poddane zabiegom rewaskulary-
zacji tętnic wieńcowych (PTCA lub operacja CABG) w okre-
sie ostatnich sześciu miesięcy.
Wyodrębniono następujące grupy badanych:
„A” – osoby maksymalnie w wieku do 60. roku życia, z po-
twierdzoną chorobą wieńcową (coronary heart disease –
CAD), niektórzy po przebytych zawałach serca, CABG lub
PTCA, stwierdzonych na podstawie wywiadu; n=30; średnia
wieku 51 lat;
„B” – pacjenci do 60. roku życia, u których nie stwierdzono
zmian miażdżycowych w naczyniach wieńcowych (po bada-
niu koronarograficznym wykonanym do 1,5 roku wcześniej);
n=18; średnia wieku 51 lat;
„C” – osoby starsze, od 70. roku życia, z potwierdzoną CAD,
często po przebytych incydentach wieńcowych stwierdzonych
w wywiadzie, ale nie przed 60. rokiem życia; n=30; średnia
wieku 75 lat;
„D” – osoby starsze, czyli od 70. roku życia, bez zmian
miażdżycowych w naczyniach wieńcowych (nie dłużej niż 1,5
roku po koronarografii); n=15; średnia wieku 76 lat.
Z badania wyłączano chorych, u których stwierdzono:
cechy niestabilnej choroby wieńcowej, chorobę nowotworo-
wą, ujawniony klinicznie ostry stan zapalny, rozpoznaną wcze-
śniej cukrzycę, przewlekłą niewydolność nerek lub wątroby
oraz niewyrównane zaburzenia czynności tarczycy.
Wszyscy uczestnicy badania wyrazili pisemną zgodę na
udział w nim. Protokół badania został zaakceptowany przez
Komisję Etyczną działającą przy CSK MSWiA.
Od wszystkich mężczyzn pobierano rano na czczo (co
najmniej 12 godzin po ostatnim posiłku) krew z żyły łokcio-
wej w celu oznaczenia czynników biochemicznych bezpo-
średnio w laboratorium CSK MSWiA oraz do plastikowych
probówek na skrzep.
U wszystkich badanych dokonano następujących ozna-
czeń: TNF-
a, przeciwciał antygliandynowych, stężenia ho-
mocysteiny, kwasu foliowego i jonów (sodu, potasu i wap-
nia), immunoglobulin (IgA, IgG, IgM, IgE), białka całkowite-
Niektóre wskaźniki zagrożenia rozwojem choroby wieńcowej u mężczyzn w zależności od wieku
11
go, kreatyniny, CRP i fibrynogenu oraz stężenia testostero-
nu i DHEA-S z użyciem metody ELISA, kompetycyjnej na
analizatorze Elecsys 2010 firmy Roche oraz immunologicz-
nej z polaryzacją fluorescencyjną (FPIA).
Ilościowe oznaczanie fibrynogenu w osoczu uzyskanym
z krwi pobranej na cytrynian wykonywano z użyciem zesta-
wu odczynników Multifibren w systemie DADE Bering zgod-
nie z zasadą zależności czasu krzepnięcia od zawartości fi-
bryny w badanej próbce.
Do oznaczenia CK, transaminazy i glukozy oraz morfolo-
gii i OB wykorzystano standardowe techniki laboratoryjne sto-
sowane rutynowo.
Statystycznej ocenie zależności między badanymi zmien-
nymi służyły współczynniki korelacji: Pearsona, Spearmana
i Cramera.
By ocenić istotność różnic rozkładów badanych zmien-
nych między grupami, wykorzystano: test Studenta, test Co-
chrana-Coxa, test Wilcoxona oraz test
c
2
.
Wyniki przedstawiono jako wartości średnie (arytmetycz-
ne) ±SD (odchylenie standardowe) dla zmiennych mierzal-
nych oraz jako odsetek grupy badanych w procentach (dla
zmiennych jakościowych, skategoryzowanych).
Za poziom istotności statystycznej przyjęto p < 0,05.
WYNIKI
Wyniki dla poszczególnych grup chorych w postaci średnich
z odchyleniem standardowym (±SD) przedstawiono w tabe-
lach 1-4, w których zaznaczono również poziom istotności
statystycznej różnic między tymi grupami.
Stężenie homocysteiny istotnie korelowało z występowaniem
choroby wieńcowej (współczynnik korelacji r = 0,40; p < 0,01) i
miało większe wartości zarówno w odniesieniu do mężczyzn w
średnim, jak i podeszłym wieku chorych na tę chorobę – odpo-
wiednio o 25,6% i 28,1% w stosunku do grup kontrolnych.
Poza tym ewidentna była dodatnia korelacja stężenia ho-
mocysteiny z kreatyniną (zwłaszcza dla obu grup kontrolnych:
r = 0,53-0,60), natomiast nie wykazano istotnej korelacji ze
stężeniem kwasu foliowego.
Stężenie tego kwasu wyróżniało istotnie pacjentów do 60.
roku życia, u których nie zaobserwowano zmian w naczyniach
wieńcowych – było u nich średnio o 32% większe w porówna-
niu z chorującymi na chorobę wieńcową. Różnica między gru-
pą A i C łącznie w odniesieniu do obu grup kontrolnych była
również istotna, choć w nieco mniejszym stopniu.
Stężenie kwasu moczowego było istotnie większe – o
22,3% – w porównaniu z grupą kontrolną, zwłaszcza wśród
starszych pacjentów chorujących na chorobę wieńcową. Star-
si mężczyźni, u których nie stwierdzono choroby wieńcowej,
charakteryzowali się mniejszymi jego średnimi wartościami,
nawet w porównaniu z młodszymi chorymi na chorobę wień-
cową i zdrowymi.
Stężenie TNF-
a okazało się istotnie większe w obu bada-
nych grupach ze stwierdzoną chorobą wieńcową w porów-
naniu z grupą kontrolną (p < 0,01), przy czym było najwięk-
sze u chorych na jawną CAD w młodszym wieku, a najmniej-
sze w młodszej grupie kontrolnej (śr. 18,47 vs. 9,23 pg/ml).
Podobna, choć nieistotna statystycznie, różnica występowa-
ła w starszej grupie wiekowej. Dodatkowo udało się ujawnić
istotną różnicę w wartości tego stężenia w odniesieniu do
chorujących na chorobę wieńcową w młodszym i starszym
wieku (śr. 18,47 vs. 13,11).
Z wiekiem dała się zauważyć tendencja do nieco więk-
szych wartości TNF wśród osób z grup kontrolnych.
Stężenie CRP oceniane bardzo czułą metodą (hs CRP –
high-sensitive CRP) również osiągało największe wartości w
grupie młodszych mężczyzn chorych na CAD, średnio o 52%
większe niż w odpowiedniej grupie kontrolnej. Wśród star-
szych osób także obecność CAD wiązała się z większymi
jego wartościami (średnio o 54%) niż w grupie kontrolnej,
jednak ze względu na dość duży rozrzut wartości różnice te
stanowiły tylko pewną tendencję, istotność statystyczną zaś
wykazano, porównując łącznie grupy A i C z kontrolnymi.
Podobnie jak w przypadku TNF-
l, również dla CRP za-
obserwowano różnicę między grupą A i C (u młodszych cho-
rych stwierdzono o 19% większe stężenie CRP niż u cho-
rych w podeszłym wieku).
Istotne statystycznie różnice dotyczyły także parametrów
odczynu zapalnego, takich jak ilość WBC (większa dla cho-
rych na CAD) oraz ilość płytek krwi – istotnie większa u osób
młodszych chorujących na CAD niż u starszych, a średnio
największa w grupie A.
Istotne różnice dotyczyły także OB. Zależały głównie od
wieku. W odniesieniu do wartości fibrynogenu natomiast nie
wykazano istotnych różnic między grupami.
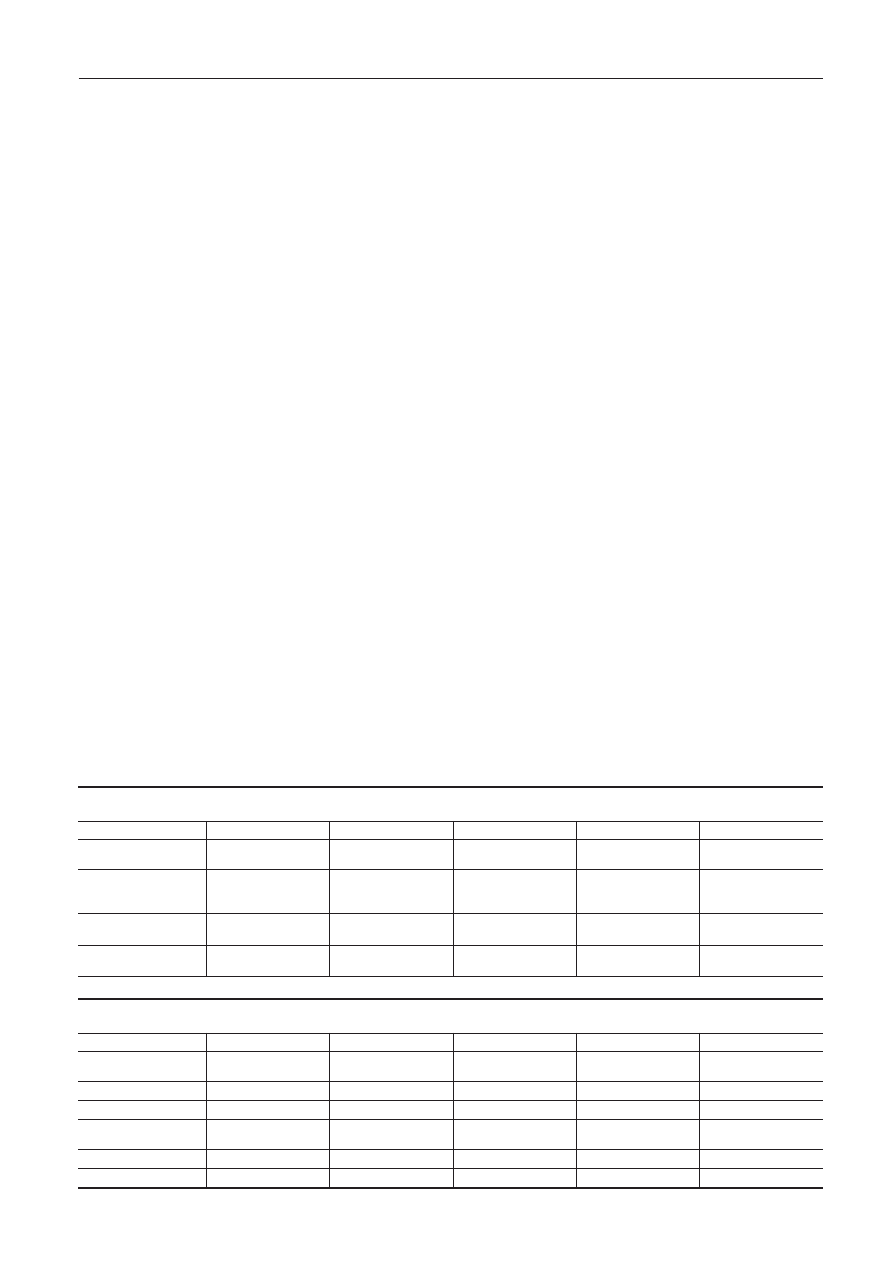
Grupa
A
B
C
D
p
TNF-
a [pg/ml]
18,47±7,16
9,23±4,49
13,11±5,52
10,10±4,07
< 0,01 dla A i B,
A i C, AC i BD
CRP [mg/l]
3,32±2,64
2,19±1,88
2,79±3,3
1,81±1,15
0,037 dla AC i BD
Fibrynogen [mg/dl]
359,1±78,4
331,0±89,5
365,6±73,8
346,1±73,5
ns
OB [mm/h]
7,9±5,2
5,9±3,6
11,47±7,7
9,7±3,9
<0,01 dla B i D;
0,045 dla A i C
WBC [1000/
ml]
7,27±1,67
6,45±1,46
7,16±1,91
6,08±1,16
< 0,01 dla AC i BD
PLT [1000/
ml]
225,6±49,8
207,6±55,8
186,2±53,0
188,7±31,6
< 0,01 dla A i C
Tabela 2. Wyniki oznaczenia stężenia TNF-
a, CRP, fibrynogenu, wartości OB, liczby leukocytów i płytek krwi
Table 2. Results of TNF-
a concentration, CRP, fibrynogen, sedimentation rate, platlets and leukocyte count
Grupa
A
B
C
D
p
Homocysteina [
mmol/l]
15,01±4,74
11,95±6,89
16,95±5,42
13,23±3,37
< 0,01 dla: A i B
C i D, AC i BD
Kwas foliowy [ng/ml]
10,41±3,63
13,76±3,86
10,70±3,76
10,95±3,77
< 0,01 dla A i B
0,027 dla AC i BD
inne ns
Kreatynina [mg/dl]
0,97±0,13
0,92±0,15
1,11±0,17
1,04±0,16
< 0,01 dla A i C
0,071 dla AC i BD
Kwas moczowy
5,78±0,89
5,86±1,08
6,26±1,30
5,12±1,12
< 0,01 dla C i D
0,049 dla AC i BD
Tabela 1. Stężenie homocysteiny, kwasu foliowego, kreatyniny oraz kwasu moczowego
Table 1. Concentrations of homocysteine, folic acid, creatinine and uric acid

E. Stasiakowska-Badura, M. Kochmański
12
Stężenie całkowitych IgE wykazało dość słabo zaznaczo-
ną, ale istotną korelację z występowaniem choroby wieńco-
wej (r = 0,27 przy p = 0,04), podobnie jak przeciwciała anty-
gliandynowe (r = 0,26 przy p = 0,04), chociaż tylko kilka osób
przekroczyło wartości progowe, świadczące o możliwości
zaobserwowania enteropatii jelitowej, oraz zakres normy dla
IgE. Przy czym różnice w stężeniu IgE miały znaczną istot-
ność statystyczną, w odniesieniu zaś do wartości przeciw-
ciał antygliandynowych należy je traktować tylko jako trend
w przypadku obecności choroby wieńcowej (tab. 3).
Stężenia IgA miały jedynie zaznaczone nieco większe
wartości u chorych w podeszłym wieku. W innych grupach
wyniki były podobne.
W odniesieniu do stężenia przeciwciał klasy IgG oraz IgM
zarysowała się tendencja do zwiększania ich wartości wraz z
wiekiem chorych. Nie zauważono natomiast istotnych statystycz-
nie różnic zależnych od występowania choroby wieńcowej.
Nie stwierdzono także istotnych statystycznie różnic mię-
dzy grupami w przypadku wartości TSH (tab. 4).
Średnie stężenia testosteronu w obu grupach kontrolnych
były większe, na granicy istotności statystycznej (p = 0,054).
Stężenie DHEA-S było istotnie mniejsze u starszych cho-
rych na CAD w porównaniu z chorymi młodszymi. Wynika to
raczej z ujemnej korelacji z wiekiem, potwierdzonej dla tego
hormonu zarówno wśród chorych, jaki i dla grup kontrolnych
(r = 0,42-0,44).
Nie wykazano istotnych statystycznie różnic między ba-
danymi grupami w zakresie wartości innych oznaczanych
parametrów (białka całkowitego, stężenia magnezu i potasu,
CK, CKMB), z wyjątkiem:
– stężenia sodu, które było istotnie większe u chorych na
CAD (p = 0,027 dla AC vs. BD) oraz istotnie statystycznie
korelowało z obecnością choroby wieńcowej (r = 0,22 przy
p = 0,041);
– stężenia wapnia całkowitego, które różniło się istotnie
(p = 0,04) wśród mężczyzn w podeszłym wieku, osiąga-
jąc nieco większe wartości w przypadku występowania
choroby wieńcowej (śr. 2,34±0,1 mmol/l vs. 2,27±0,1).
OMÓWIENIE
Związek zwiększonego stężenia homocysteiny z chorobą
wieńcową wykazano w polskiej populacji w kilku badaniach
klinicznych.
Piechota [29] zaobserwował także słabą, lecz znamienną
korelację stężenia homocysteiny z nasileniem zmian miażdży-
cowych, najwyraźniej zaznaczoną u pacjentów, u których
stwierdzono zmiany wielonaczyniowe. Zauważył również
korelację ze stężeniem kreatyniny oraz wiekiem, ale nie wy-
kazał korelacji ze stężeniem kwasu foliowego.
W omawianych badaniach istotnie większe stężenie kwa-
su foliowego wyróżniało jedynie pacjentów w młodszym wie-
ku bez zauważonych zmian w koronarografii, co nie potwier-
dza w pełni jego korzystnego, ochronnego działania w przy-
padku choroby wieńcowej [13].
Stwierdzona w badaniu istotna dodatnia korelacja zwięk-
szonych wartości TNF-
a z występowaniem choroby wieńco-
wej i to większa w młodej grupie pacjentów (r = 0,49) wydaje
się potwierdzać znaczenie komponenty zapalnej w rozwoju
zmian miażdżycowych, zwłaszcza u mężczyzn jeszcze nie w
podeszłym wieku. Zwiększone stężenie tej cytokiny wśród
mężczyzn wydaje się świadczyć o nasilonym stanie zapal-
nym jako czynniku sprawczym, mającym większe znaczenie
w tej właśnie grupie chorych.
Podobne, ponieważ około dwukrotnie większe – w stosun-
ku do grupy kontrolnej – stężenie TNF-
a stwierdził w polskiej
populacji Mizia-Stec i wsp. [19] u chorych zarówno na niesta-
bilną, jak i stabilną chorobę wieńcową, przy czym grupa kon-
trolna była złożona z osób zdrowych (śr. 17,24-18,70 vs. 8,31
pg/ml). Średni wiek tych pacjentów wynosił 55-58 lat, odpo-
wiadali zatem grupie A i B w przedstawionych wynikach, śred-
nia zaś frakcja wyrzutowa lewej komory (EF) wynosiła w gru-
pie chorych około 50%. Autorzy ci obserwowali u chorych na
stabilną chorobę wieńcową istotnie większe stężenie rozpusz-
czalnego receptora dla TNF R1, co tłumaczyli mechanizmem
kompensacyjnym przewlekłego procesu miażdżycowego.
CRP jako marker odczynu zapalnego w wielu prospektyw-
nych badaniach epidemiologicznych pozwalał na przewidywa-
nie zawału serca, udaru mózgu, chorób tętnic obwodowych i
nagłych zgonów sercowych, a u chorych na OZW (ostry ze-
spół wieńcowy) oraz stabilną i niestabilną chorobę wieńcową,
poddawanych PTCA – na prognozowanie ryzyka nawrotu nie-
dokrwienia lub zgonu [24].
Jako marker ryzyka naczyniowego, jest on niezależny od
wieku, nałogu palenia tytoniu, stężenia cholesterolu oraz ci-
śnienia tętniczego i cukrzycy, a więc głównych, klasycznych
czynników ryzyka ocenianych rutynowo. Co więcej, dane pro-
spektywne wskazują, że CRP jest nawet silniejszym predyk-
torem ryzyka niż cholesterol LDL.
Stężenia CRP w przedziałach: <1, 1-3, >3 mg/l wyzna-
czały grupy odpowiednio o małym, umiarkowanym i dużym
ryzyku wystąpienia chorób sercowo-naczyniowych w przy-
szłości. Istotne wydaje się, że stężenie CRP nie zależy w
znaczącym stopniu od pory dnia i rodzaju posiłku oraz od
płci i wieku. Poza tym, ze względu na długi okres półtrwania
oraz stabilność, jest dobrą podstawą rutynowego, przesie-
wowego szacowania ryzyka incydentu naczyniowego jako
Grupa
A
B
C
D
p
IgE całkowite [IU/ml]
74,1±49,1
40,8±44,3
96,2±50,8
59,4±50,8
0,017 dla AC i BD
0,028 dla A i B
IgA [mg/dl]
242,0±119,1
232,7±56,7
290,6±101,7
240,3±56,5
0,042 dla C i D
IgG[mg/dl]
1065±157
976±214
1174±231
1105±172
0,042 dla A i C
IgM [mg/dl]
68,9±48,8
74,4±58,5
100,1±45,1
101,3±61,2
0,015 dla A i C
Przeciwciała
4,85±4,20
3,38±6,89
3,62±3,29
2,28±2,41
ns
antygliadynowe [U/ml]
Tabela 3. Średnie wartości stężenia immunoglobulin klas IgG, IgA, IgM oraz IgE całkowitych, a także przeciwciał antygliandynowych
Table 3. Mean concentrations of IgG, IgA and IgM total IgE immunoglobulins, and antigliadin antibodies
Grupa
A
B
C
D
p
DHEA-S
165,4±77,1
177,1±134,1
102,2±85,9
122,6±66,2
< 0,01 dla A i C
Testosteron
3,92±1,38
4,75±2,24
3,75±1,55
4,42±1,40
0,054 dla A i B
0,072 dla AC-BD
TSH
1,38±0,71
1,84±1,08
1,52±0,86
1,38±0,68
ns
Tabela 4. Stężenie hormonów androgennych i TSH
Table 4. Concentrations of androgenic hormons and TSH

Niektóre wskaźniki zagrożenia rozwojem choroby wieńcowej u mężczyzn w zależności od wieku
13
dopełnienie oznaczania lipidogramu nie tylko u chorych na
przedwczesną, niewyjaśnioną klasycznymi czynnikami ryzy-
ka, rozwijającą się miażdżycę [24].
W pracy wykazano istotnie większe stężenie CRP po po-
łączeniu wyników obu grup chorych na CAD w stosunku do
mężczyzn bez obserwowanych zmian naczyniowych (śr.
3,05±2,9 vs. 2,02±1,6 mg/l, p = 0,037), przy braku ewident-
nej dodatniej korelacji CRP z występowaniem choroby wień-
cowej.
Zwiększone stężenie TNF-
a, a także CRP i fibrynogenu u
chorych na chorobę niedokrwienną serca może być związa-
ne również z seropozytywnością wobec Chlamydii pneumo-
niae, zwłaszcza przy dodatniej reakcji serologicznej przeciwko
Helicobacter pylori, co prawdopodobnie nasila naczyniowy
odczyn zapalny w chorobie wieńcowej, niezależnie od innych
czynników ryzyka [31].
Badanie stężenia immunoglobulin wykazało niewielką,
choć istotną różnicę w odniesieniu do IgE między młodszymi
i starszymi chorymi na CAD (nieco większe wartości u star-
szych osób) oraz nieistotne mniejsze wartości u pacjentów
młodszych bez stwierdzonych zmian w naczyniach. W za-
kresie IgM stwierdzono u młodszych chorych istotnie mniej-
sze wartości niż u chorujących w starszym wieku.
Nie wykazano jednak istotnych korelacji z rozwojem cho-
roby wieńcowej w klasach przeciwciał IgG, IgA i IgM, w od-
różnieniu od klasy IgE całkowitych, dla których wartości –
przy tendencji do pewnego wzrostu wraz z wiekiem – wyka-
zały dodatnią korelację z występowaniem choroby wieńco-
wej. Stężenie IgE korelowało dodatnio w całej badanej po-
pulacji także z wartościami CRP (najsilniej w grupie starszych
pacjentów: r = 0,55 przy p < 0,01).
Na związek i wartość predykcyjną zwiększonego stęże-
nia IgG, IgA i IgE (ale nie IgM) u mężczyzn chorych na dysli-
pidemię, ale bez jawnej choroby wieńcowej i ze zwiększo-
nym ryzykiem wystąpienia ostrych incydentów wieńcowych
– wskazały prace Kovanen i wsp. [15]. Wyjaśniając istotne
jego zwiększenie w przypadku niestabilnej choroby wieńco-
wej, autorzy sugerowali, że stanowiło ono wykładnik reakcji
ostrej fazy na uszkodzenie tkanek.
Immunoglobuliny E, pełniąc funkcje regulacyjne względem
wielu komórek układu immunologicznego, mogą być – po-
dobnie jak CRP – wyznacznikiem ogólnoustrojowej reakcji
na uszkodzenie tkanek w ostrej fazie choroby [15]. Od kilku
lat wskazywano rolę wspomnianych już czynników infekcyj-
nych w stymulowaniu reakcji zapalnej w obrębie blaszki
miażdżycowej, a także antygenów endogennych typu utle-
nionych cząsteczek LDL (stwierdzono występowanie prze-
ciwko nim wolnych przeciwciał krążących we krwi oraz kom-
pleksów LDL – przeciwciało, zdolnych do aktywacji układu
dopełniacza).
W przedstawionych badaniach ujawniono słabą korelację
przeciwciał antygliandynowych z występowaniem choroby
wieńcowej. Stosunkowo największe średnie ich stężenie
oznaczano w grupie młodszych chorych, o 70% większe niż
w odpowiedniej wiekowo grupie kontrolnej, a ponad dwukrot-
nie większe niż w grupie kontrolnej osób w podeszłym wie-
ku. Widoczna była tendencja do zmniejszania się ich stęże-
nia wraz z wiekiem, ale w grupach badanych w obu prze-
działach wiekowych było ono wyraźnie większe niż w grupach
kontrolnych, chociaż z powodu znacznego rozrzutu wartości
różnice nie osiągnęły poziomu istotności statystycznej.
Być może miała tu znaczenie mała czułość metod ozna-
czania IgG-AGA (przeciwciał antygliandynowych w klasie
IgG), wynosząca około 76-95%, przy stosunkowo dobrej
swoistości rzędu 88-89%. Dla porównania, przy użyciu ozna-
czeń IgA anty-endomysialnych wynoszą one odpowiednio –
100% oraz 97-99%. Tej czulszej metody należałoby zatem
użyć w badaniach większej grupy chorych, chcąc dokładniej
wyjaśnić kwestię częstości występowania utajonej postaci
enteropatii glutenowej wśród chorych na wczesną postać CAD.
Niewielka tylko liczba wyników uzyskanych w całej bada-
nej grupie zbliżyła się do wartości wykluczającej podejrzenie
celiaklii, a tylko kilka nieznacznie ją przekroczyło, ale należy
pamiętać, że wartości CRP świadczące o zwiększonym ry-
zyku sercowo-naczyniowym również mieszczą się jeszcze w
normie, choć istotne jest to, że w górnych jej zakresach.
Wykazano, że u mężczyzn, u których stwierdzono prawi-
dłowe, duże stężenie testosteronu, stężenie cholesterolu HDL
było większe, natomiast VLDL mniejsze niż u mężczyzn o
mniejszym stężeniu testosteronu [9]. Również stężenie DHT
(dihydrotestosteronu) dodatnio koreluje z HDL i ApoA-1, małe
zaś stężenie testosteronu współistnieje z większym stęże-
niem triglicerydów.
Wykazano także korzystny wpływ na lipidogram substy-
tucji androgenami w przypadku hipogonadyzmu, kiedy to
dochodziło do istotnego zwiększenia stężenia HDL i zmniej-
szenia stężenia LDL [28]. Ponadto podawanie testosteronu
starszym mężczyznom, u których stwierdzono małe jego stę-
żenie, powodowało zmniejszenie stężenia cholesterolu cał-
kowitego i frakcji LDL, bez niekorzystnego wpływu na HDL
(ewentualnie jego zmniejszenie nie dotyczyło antyaterogen-
nej frakcji HDL2 i apolipoproteiny A-1).
Jednak doniesienia na ten temat nie są spójne. Obserwo-
wano bowiem także niekorzystny wpływ androgenów (zwłasz-
cza syntetycznych i podawanych w dużych dawkach) na profil
lipidowy u mężczyzn bez cech hipogonadyzmu [2].
W dużym badaniu, obejmującym 1032 osoby z populacji
holenderskiej, prowadzonym w ramach The Rotterdam Stu-
dy, oceniano związek stężenia DHEA-S oraz testosteronu z
nasileniem zmian miażdżycowych w aorcie brzusznej u ko-
biet i mężczyzn w wieku powyżej 55 lat. Potwierdzono nieza-
leżną od wieku i innych czynników ryzyka ujemną korelację
między stężeniem testosteronu u mężczyzn a zaawansowa-
niem zmian w aorcie oraz jego ochronną rolę przed progre-
sją tych zmian (ocenianych po 6 i pół roku). U mężczyzn za-
uważono dodatni wpływ mniejszego stężenia DHEA-S na
progresję zmian naczyniowych, jednak nie osiągnął on istot-
ności statystycznej. Nie zaobserwowano także na wstępie
badania związku między stężeniem DHEA-S a obecnością
zaawansowanych zmian miażdżycowych w aorcie [10].
W prezentowanych badaniach własnych duże wartości
stężenia testosteronu wydają się sugerować ochronny jego
wpływ, zwłaszcza w przypadku mężczyzn w średnim wieku.
Warto zauważyć, że średnie wartości stężenia tego hormo-
nu u młodszych mężczyzn chorych na CAD były prawie takie
same, jak u mężczyzn starszych średnio o 25 lat. Natomiast w
grupie najbardziej „odpornych” na miażdżycę tętnic wieńco-
wych u starszych mężczyzn stężenie testosteronu, cechujące
młodszych zdrowych badanych, utrzymywało się na nieznacz-
nie niższym poziomie mimo zaawansowanego wieku.
Nie ma dowodów na protekcyjną rolę DHEA/DHEA-S u
kobiet, natomiast u mężczyzn, u których stwierdzono ich małe
stężenie, obserwowano zwiększone ryzyko incydentów ser-
cowo-naczyniowych o powikłanym przebiegu. Hormony te
mogą wpływać na przemiany lipidów (m.in. przez wpływ na
dehydrogenazę glukozo-6-fosforanową), hamować agrega-
cję płytek krwi, wzmagać aktywność fibrynolityczną oraz spo-
walniać proliferację komórek [23].
U mężczyzn o małym stężeniu testosteronu zwiększa się
jednocześnie stężenie fibrynogenu, który jest – o czym już
wspomniano – niezależnym czynnikiem ryzyka miażdżycy i
zawału serca, podawanie zaś androgenów wpływa na synte-
zę i uwalnianie czynników uczestniczących w procesach
krzepnięcia, głównie przez zwiększenie stężenia jego inhibi-
torów oraz zmniejszenie stężenia czynników hamujących fi-
brynolizę (wpływ na tPA i PAI-1) [2].
Do rozważenia może pozostać zatem ewentualne stoso-
wanie małych substytucyjnych dawek androgenów u stosun-
kowo młodszych mężczyzn chorych na chorobę wieńcową,
gdy obserwuje się u nich bardzo małe stężenie endogennego
testosteronu. Wymaga to jednak dalszych badań klinicznych.
Znaczącą rolę w powstrzymywaniu rozwoju miażdżycy
naczyń wieńcowych z przejściem do ostrych zespołów wień-
cowych mogą odgrywać dzięki testosteronowi również jego

E. Stasiakowska-Badura, M. Kochmański
14
właściwości immunomodulujące oraz przeciwzapalne w za-
kresie fizjologicznego stężenia, gdyż może on hamować ak-
tywność prozaplanych cytokin [17].
WNIOSKI
1. Istotnymi czynnikami wyróżniającymi mężczyzn chorują-
cych na chorobę wieńcową przed 60. rokiem życia w po-
równaniu z chorymi w podeszłym wieku oraz osobami bez
uchwytnych zmian w naczyniach wieńcowych okazały się
większe wartości TNF-
a oraz CRP i homocysteiny.
2. Z występowaniem choroby wieńcowej korelowały dodat-
nio, choć nieco słabiej, IgE, przeciwciała antyglandynowe
i natremia.
PIŚMIENNICTWO
1. Bardella M., Trovato C., Cesana B. i wsp.: Serological markers for co-
eliac disease: is it time to change? Dig Liver Dis., 2001, 33(5), 426-431.
2. Barud W., Palusiński R., Hanzlik J.: Wpływ androgenów na układ krąże-
nia u mężczyzn. Wiad. Lek., 2001, 54, 325-332.
3. Bonaa K., Njolstad J., Veland P. i wsp.: NORVIT Trial Investigators: N.
Engl. J. Med., 354, 15, 1629-1632.
4. Domagała T.: Kwas foliowy-homocysteina a choroba niedokrwienna serca
wraz z komentarzem prof. B. Cybulskiej, Kardiol. Pol., 2004, 60, 66-72.
5. English K., Mandour O., Steeds R. i wsp.: Men with coronary artery dise-
ase have lower levels of androgens then men with normal coronary an-
giograms. Eur Heart J., 2000, 21, 890-894.
6. Giral P., Bruckert E., Jacob N. i wsp.: Homocysteine and lipid lowering
agents. A comparsion between atorvastitan and fenofibrate in patients
with mixed hyperlipidemia. Atheroscl., 2000, 154(2), 421-427.
7. Gołąb J., Jakóbisiak M., Lasek W.: Immunologia. PWN, 2002, 236-244.
8. Gurantz D., Cowling R., Varki N. i wsp: IL-1 beta and TNF-alpha upregu-
late angiotensin II type 1 (ATI) receptors on cardiac fibroblats and are
associated with increased AT1 density in the post-MI heart. J. Mol. Cell.
Cardiol., 2005, 38930, 505-515.
9. Haffner S., Mykknen L., Valdez R. i wsp.: Relationship of sex hormones
to lipids and lipoproteins in non-diabetic men. J. Clin. Endocrinol. Metab.,
1993, 77, 1610-1615.
10. Hak A., Witteman J., De Jong F. i wsp.: Low lewels of endogenous andro-
gens incerase the risk of atherosclerosis in elderly men: The Rotterdam
Study. J. Clin. Endocrinol. Metab. 2002, 87, 3632-3639.
11. Janson J., Nilsson T., Johnson O.: Von Willebrand factor, tissue plasmi-
nog activator, and dehydroepiandrosterone sulphate predict cardiovascu-
lar death in a 10-year follow up of survivors of acute myocardil infraction.
Hart, 1998, 80, 334-337.
12. Jastrzębska M.: Hemostatyczne czynniki ryzyka: rola w patogenezie i
diagnostyce chorób sercowo-naczyniowych. Terapia, 2001, 10, 25-35.
13. Kądziela J., Janas J., Dzielińska Z. i wsp.: Niedobór kwasu foliowe-
go bezpośredni, niezależny od homocysteiny, związek z ryzykiem wy-
stąpienia choroby niedokrwiennej serca. Folia Cardiol., 2003, 10, 619-
624.
14. Kovanen P., Kaartinen M., Paavonen T.: Infiltrates of activated mast cells
at the site of coronary atheromathosus erosion or upture in myocardial
infraction. Circulation, 1995, 92, 1084-1088.
15. Kovanen P.: Prediction of myocardial infraction in dyslipidemic men by
elevated levels of immunoglobulin classes A, E and G but not M. Arch.
Intern. Med., 1998, 158, 1434-1439.
16. Labrie F., Belanger A., Cusan B. i wsp.: Physiological changes in dehy-
droepiandrosteroneare not reflected by serum levels of active androgens
and estrogens but of their metabolites: intracrinology. J Clin. Endocrinol.
Metab., 1997, 82, 2403-2409.
17. Malkin C., Pugh P., Jones R. i wsp.: Testosterone as a protective factor
against atherosclerosis-immunomodulation and influence upon plaque
development and stability. J. Endocrinol., 2003, 178(3), 373-380.
18. Meade T., North W., Chakrabarti R. i wsp.: Haemostatic function and car-
diovascular death: early results of a propective study. Lancet, 1980, I,
1050-1054.
19. Mizia-Stec K., Zahorska-Markiewicz B., Mandecki T. i wsp.: Czynnik mar-
twicy nowotworów
l i rozpuszczalne formy jego receptorów w surowicy u
chorych na chorobę wieńcową. Pol. Med. Lek., 2001, XI(61), 19-25.
20. Monalescot G., Ankri A., Vincent E. i wsp.: Fibrynogen after coronary
angioplasty as a risk factor for restenosis. Circulation, 1995, 92, 31-38.
21. Morrison H., Schaubel D., Desmeules M. i wsp.: Serum folate and risk of
fatel coronary heart disease. JAMA 1996, 275, 1893-1896.
22. Opolski G., Filipiak K.J., Poloński L.: Ostre zespoły wieńcowe. Wydawn.
Medycz. Urban&Partners, Wrocław 2002, 14-25.
23. Porsova-Dutoit I., Sulcova J., Starka L.: Do DHEA/DHEAS play a pro-
tective role in coronary heart disease? Physiol. Res., 2000, 49, supl. 1,
43-56.
24. Ridker P.: Clinical application of Creactive protein for cardiovascular di-
seae detection and prevention. Circulation, 2003, 107, 363-369.
25. Ross R.: Atherosclerosis: an inflammatory disease. N. Engl. J. Med., 1999,
340, 115-126.
26. Schumacher A., Seljeflot I., Lerkerod A. i wsp.: Positive Chlamydia peu-
moniae serology is asociated with elevated levels of tumor necrosis fac-
tor alpha in patients with coronary heart diease. Atheroclerosis, 2002,
164(1), 153-160.
27. Tan K., Shiu S., Pang R. i wsp.: Effects of tetosteronereplacement on
HDL subfraction and apolipoprotein A-1 containing lipoproteins. Clin.
Endocrinol., 1998, 48, 187-194.
28. Trier J.: Celiac sprue. N. Engl. J. Med., 1991, 25(24), 1709-1719.
29. Verhaar M., Stres E., Rabelink T.: Folates and cardiovascular disease.
Aterioscler. Thromb. Vasc. Biol., 2002, 22, 6-13.
Otrzymano 17 sierpnia 2006 r.
Adres: Elwira Stasiakowska-Badura, Klinika Kardiologii Zachowawczej, Cen-
tralny Szpital Kliniczny MSWiA, 02-507 Warszawa, ul. Wołoska 137, tel./faks
(0 22) 508 16 70, e-mail: jolanta.seroczynska@CSKMSWIA.pl
Wyszukiwarka
Podobne podstrony:
Miazdzyca
miażdżyca1b
PROCES MIAŻDZYCOWY A(1)
STRES A MIAŻDŻYCA
Miażdżyca 5
Zapalenie w miażdżycy
AMPUTACJA Siła miażdżąca wywołująca poważne zranienia może spowodować, Technik masażysta-przydatne p
miażdżyca tętnic, FIZYKOTERAPIA
cukrzyca miazdzyca pdf id 12087 Nieznany
Ocena motywacji chorych z miażdżycą do zaprzestania palenia tytoniu
Pacjent latf z zaawansowaną miażdżycą tętnic szyjnych
MIAŻDŻYCA
Miażdżyca, cukrzyca, interakcje 10
Farmakoterapia miażdżycy, Farmakologia(15)
Ćwiczenie 3 hiperlipidemie,miażdżyca
wykad leki p miazdz
więcej podobnych podstron