
1
1
Materiały internetowe
• http://www.angelo.edu/faculty/kboudrea/inde
x/Notes_Chapter_08.pdf
• http://cwx.prenhall.com/petrucci/medialib/po
wer_point/Ch24.ppt
• http://web.mit.edu/2.813/www/Class
%20Slides/Lecture%207%20Mat.Prod.pdf
• http://www.google.pl/search?
hl=pl&lr=&client=firefox-
a&channel=s&rls=org.mozilla:pl:official&q=uk
lad+okresowy+pierwiastkow
%2BPower+Point&start=20&sa=N
•
/~chem1/Lecture%20Notes%20pdfs/Series%20
• http://zchoin.fct.put.poznan.pl

2
2
Związki węgla z azotem i ich
pochodne
Cyjanowodór:
HCN silnie toksyczny (kwas pruski).
Dawka śmiertelna - 50 mg KCN (!)
HCN CN
-
+ H
+
bardzo słaby kwas: K
a
= 710
-10
HCN występuje w formie 2 odmian izomerycznych:
H - C N C N - H
cyjanowodór
izocyjanowodór
Sole cyjanki, np. KCN - cyjanek potasu z Fe
2+
i Fe
3+
tworzy
aniony
kompleksowe:
[Fe(CN)
6
]
4-
aniony heksacyjanożelazianowe(I I )
[Fe(CN)
6
]
3-
aniony heksacyjanożelazianowe(I I I )
Cyjanowodór:
HCN silnie toksyczny (kwas pruski).
Dawka śmiertelna - 50 mg KCN (!)
HCN CN
-
+ H
+
bardzo słaby kwas: K
a
= 710
-10
HCN występuje w formie 2 odmian izomerycznych:
H - C N C N - H
cyjanowodór
izocyjanowodór
Sole cyjanki, np. KCN - cyjanek potasu z Fe
2+
i Fe
3+
tworzy
aniony
kompleksowe:
[Fe(CN)
6
]
4-
aniony heksacyjanożelazianowe(I I )
[Fe(CN)
6
]
3-
aniony heksacyjanożelazianowe(I I I )

3
3
Właściwości chemiczne węglowców
- węgliki
• Węgliki, to związki węgla z pierwiastkami mniej od niego
elektroujemnymi. Nie należą do nich zatem połączenia
węgla z azotem, fosforem, tlenem, siarką i fluorowcami.
Wyróżniamy węgliki:
a)
jonowe (typu soli),
b)
międzywęzłowe,
c) kowalencyjne.
• ad a) Zawierają aniony C
4-
, C
22-
lub C
34-
Al
4
C
3
metanki
(C
4-
)
Na
2
C
2
, CaC
2
acetylenki (C
22-
)
Mg
2
C
3
allilki
(C
34-
)
Otrzymuje się je przez ogrzewanie metalu z węglem lub
węglowodorem. Krystalizują w sieciach jonowych (kationy
metali i aniony C
4-
, C
22-
lub C
34-
).

4
4
Właściwości chemiczne węglowców
- węgliki
• ad b) Sieć przestrzenna zbudowana z atomów metali
a w przestrzeniach międzywęzłowych znajdują się
atomy węgla
(r
at
> 130 pm, r
c
= 77 pm).
Powstają w bardzo wysokich temperaturach (2300 K)
wyniku działania węgla na metale należące do 4, 5 lub
6 grupy - są bardzo twarde, np.: TiC, V
2
C, WC, W
2
C
• ad c) SiC, B
4
C
SiO
2
+ 3C = SiC + 2CO
SiC karborund bardzo twardy elementy
grzejne
(sylity) i materiał szlifierski
Ich sieci są atomowe (atomy węgla i krzemu/boru)

5
5
Właściwości chemiczne węglowców
- węgliki
• Krzem jest jedynym węglowcem, który reaguje z węglem. W
wyniku ogrzewania krzemu z węglem powstaje kowalencyjny
węglik o wzorze SiC (budowa warstwowa, przy czym struktura
warstw podobna do blendy cynkowej lub wurcytu):
Si + C → SiC
• Jest to związek o zbliżonym charakterze do metanków, ale jest
bardzo bierny chemicznie (nierozpuszczalny w wodzie – nie
ulega hydrolizie). Ulega stapianiu na powietrzu z
wodorotlenkiem sodu:
SiC + 4NaOH + 2O
2
→ Na
2
CO
3
+ Na
2
SiO
3
+ 2H
2
O
SiC jest twardy i nietopliwy. Jako tzw. karborund stosowany jest
szeroko do produkcji materiałów ściernych.

6
6
Właściwości chemiczne węglowców
– związki pierwiastków z wodorem
• Wszystkie węglowce tworzą kowalencyjne wodorki, przy
czym różna jest łatwość ich tworzenia i ilość
otrzymywanych połączeń dla poszczególnych pierwiastków.
Najwięcej łańcuchowych i pierścieniowych połączeń, a przy
tym najtrwalszych, tworzy węgiel (np. alkany, alkeny,
związki alicykliczne – zajmuje się nimi chemia organiczna).
• Sporo związków o wzorze Si
n
H
2n+2
(n=1÷6) tworzy krzem
(silany).
• Najniższe węglowodory (metan – CH
4
, etan – C
2
H
6
, propan –
C
3
H
8
) występują w gazie ziemnym. Wszystkie wodorki
można też otrzymać z innych związków chemicznych
(najczęściej z halogenków) - obecnie powszechnie stosuje
się do tego celu ich redukcję za pomocą glinowodorku litu:
MeCl
4
+ Li[AlH
4
] → MeH
4
+ AlCl
3
+ LiCl (Me=C, Si, Ge, Sn, Pb)
• Uwaga! Żaden węglowiec nie reaguje bezpośrednio z
wodorem.

7
7
Właściwości chemiczne węglowców
– związki pierwiastków z wodorem
• Węglowodory nasycone są dość bierne chemicznie. Znacznie
reaktywniejsze są silany, które są silnymi reduktorami – w
roztworach alkalicznych reagują z wodą, z wydzieleniem
wodoru:
• Si
2
H
6
+ 2H
2
O + 4NaOH → 2Na
2
SiO
3
+ 7H
2
• Krzemowodory są bardziej od alkanów podatne na utlenianie i
reakcję z chlorem, a reaktywność następnych wodorków
węglowców w tych reakcjach maleje:
MeH
4
+2O
2
→ MeO
2
+ 2H
2
O (Me=C, Si, Ge, Sn, Pb)
• MeH
4
+4Cl
2
→ MeCl
4
+ 4HCl (Me=C, Si, Ge, Sn, Pb)
• Trwałość wodorków typu MeH
4
maleje w szeregu CH
4
→ PbH
4
.
• Znane są alkilowe i arylowe pochodne wszystkich wodorków
IV grupy głównej

8
8
Halogenki weglowców
• Znane sa wszystkie tetrahalogenki, poza PbI
4
. Wszystkie są
tetraedryczne i lotne (poza jonowymi SnF
4
i PbF
4
, które są trudno
topliwe). Mieszane chlorofluorowęglowodory (freony) stosowano
przed laty jako środki
chłodnicze i propelanty aerozoli.
• Wszystkie halogenki krzemu łatwo hydrolizują w wodzie, dając
kwas otrokrzemowy:
SiX
4
+ 4H
2
0 → Si(OH)
4
+ 4HX (X=F, Cl, Br, I)
tetrafluorek krzemu we wtórnej reakcji z powstającym HF tworzy
kompleks:
SiF
4
+ 2HF → [SiF
6
]
2-
• GeCl
4
i GeBr
4
hydrolizują trudniej, zaś SnCl
4
i PbCl
4
– tylko
w roztworach rozcieńczonych, ale hydroliza jest niepełna i
łatwa do odwrócenia.
• Węgiel tworzy wiele halogenków nienasyconych, np.
CF
2
=CF
2
(jego polimeryzacja pod ciśnieniem daje teflon):
nCF
2
=CF
2
→ (-CF
2
-CF
2
-)
n
, gdzie n=200÷700

9
9
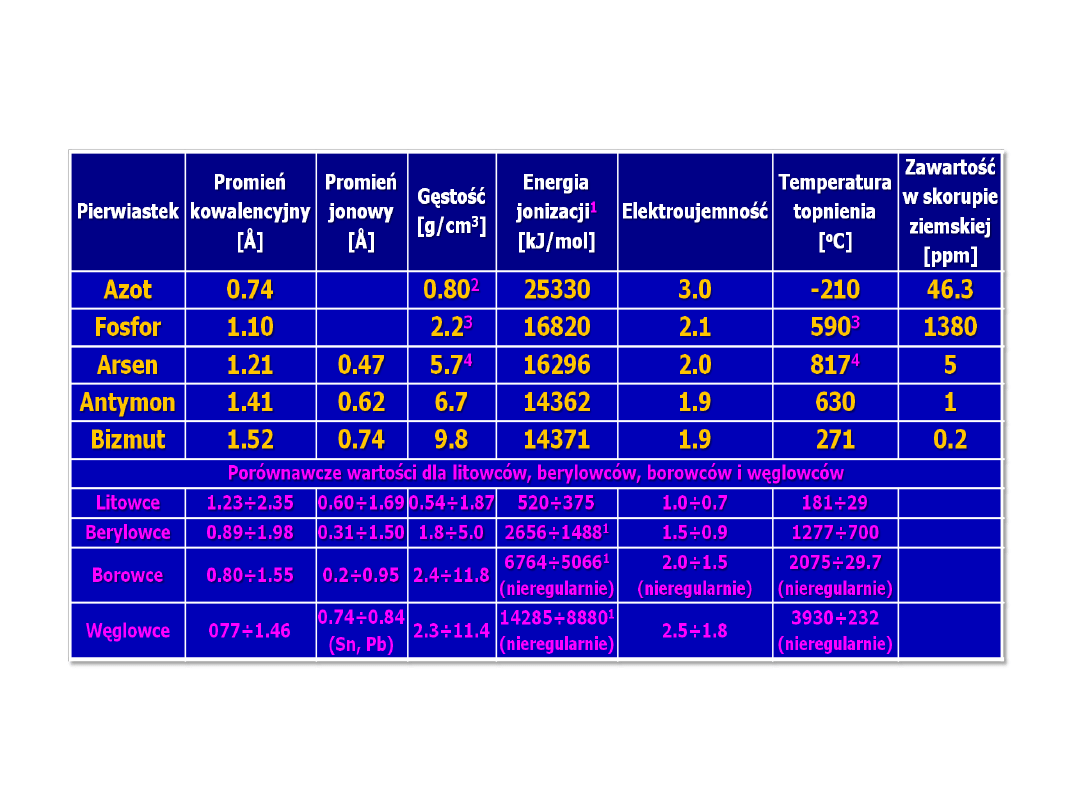
Właściwości fizykochemiczne
węglowców – rozpuszczalność
związków w wodzie
• Węglowiec w anionie kwasu tlenowego
- Dobrze rozpuszczalne w wodzie są węglany, szczawiany i
mrówczany metali alkalicznych.
- Poza nielicznymi wyjątkami, wszystkie octany są dobrze
rozpuszczalne.
- Z krzemianów rozpuszczalne są tylko sole sodowe i
potasowe.
• Związki z węglowcem w pozycji kationu
- Te związki węglowców, których energia hydratacji jest
większa od energii sieciowej, są dobrze rozpuszczalne w
wodzie (m.in. azotany - zarówno cyny, jak i ołowiu,
halogenki - poza związkami ołowiu(II)).
- Węgiel tworzy gazowe tlenki (CO i CO
2
) – CO
2
w większym
stopniu niż CO rozpuszcza się w wodzie. Wodorotlenki i
różne formy tlenków (w tym uwodnionych) pozostałych
węglowców,
są praktycznie nierozpuszczalne w wodzie, np.
• pIr(Sn(OH)
2
)=28.1, pIr(Sn(OH)
4
)=56.0
pIr(Pb(OH)
2
)=16.8, pIr(Pb(OH)
4
)=64.0

10
10
Właściwości fizykochemiczne
węglowców – rozpuszczalność
związków w wodzie
Spośród siarczków węglowców CS
2
, SiS
2
, GeS i GeS
2
wykazują zróżnicowaną rozpuszczalność w wodzie.
Siarczki cyny i ołowiu są nierozpuszczalne (jeszcze
mniejsze iloczyny rozpuszczalności od siarczków mają
seleniany i tellurany), np.
pIr(SnS)=25.0, pIr(PbS)=28.0
PbTe(pIr=48.0) < PbSe(pIr=38.0) < PbS(pIr=28.0)
Z halogenków węglowców trudno w wodzie rozpuszczają
się wszystkie związki ołowiu(II), a także niektóre związki
węgla.
Do trudno rozpuszczalnych związków cyny i ołowiu należą
ortofosforany (pIr(Pb
3
(PO4)
2
)=43.5)
i ortoarseniany (pIr(Pb
3
(AsO4)
2
)=35.4). Do trudno
rozpuszczalnych w wodzie związków ołowiu(II) należą też
siarczan i chromian.
Spośród siarczków węglowców CS
2
, SiS
2
, GeS i GeS
2
wykazują zróżnicowaną rozpuszczalność w wodzie.
Siarczki cyny i ołowiu są nierozpuszczalne (jeszcze
mniejsze iloczyny rozpuszczalności od siarczków mają
seleniany i tellurany), np.
pIr(SnS)=25.0, pIr(PbS)=28.0
PbTe(pIr=48.0) < PbSe(pIr=38.0) < PbS(pIr=28.0)
Z halogenków węglowców trudno w wodzie rozpuszczają
się wszystkie związki ołowiu(II), a także niektóre związki
węgla.
Do trudno rozpuszczalnych związków cyny i ołowiu należą
ortofosforany (pIr(Pb
3
(PO4)
2
)=43.5)
i ortoarseniany (pIr(Pb
3
(AsO4)
2
)=35.4). Do trudno
rozpuszczalnych w wodzie związków ołowiu(II) należą też
siarczan i chromian.
11
11
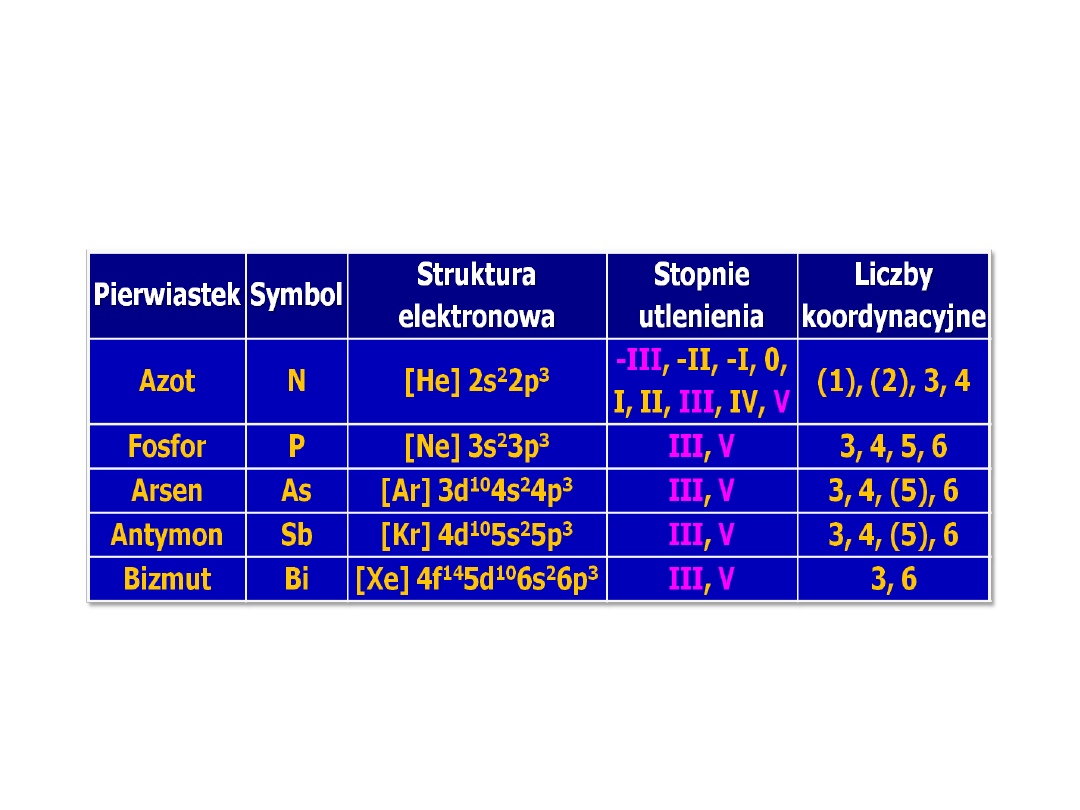
Struktura elektronowa
azotowców

12
12
Rozpowszechnienie
pierwiastków w skorupie
ziemskiej
Azot gazowy (N
2
) jest głównym składnikiem atmosfery
ziemskiej (78%, pozostałą część stanowi tlen – około
22%). Jego zawartość w skorupie ziemskiej jest niewielka
– głównie złoża naturalnych azotanów (saletra chilijska –
NaNO
3
, indyjska – KNO
3
).
Azot gazowy (N
2
) jest głównym składnikiem atmosfery
ziemskiej (78%, pozostałą część stanowi tlen – około
22%). Jego zawartość w skorupie ziemskiej jest niewielka
– głównie złoża naturalnych azotanów (saletra chilijska –
NaNO
3
, indyjska – KNO
3
).
N P As Sb
Bi
0,03 % 0,11 % 5 10
-4
%
2 10
-5
% 2 10
-5
%
20 13
13
13
Ogólna charakterystyka
azotowców
Stan skupienia
azot
fosfor
arsen
antymon
bizmut
g a z
c i a ł a s t a ł e
n i e m e t a l e
p ó ł m e t a l e
m e t a l
Elektroujemność
wg. Allreda-Rochowa
3,07
2,06
2,20
1,82
1,67
Konfiguracja
elektronów
walencyjnych
Stopnie utlenienia
s
2
p
3
od -3 do +5 st. utlenienia
Orbitale typu d
brak
są dostępne
maks. 4 wiązania
kowalencyjne, np.
4
NH
5 lub 6 wiązań kowalencyjnych,
np. PCl
5
,
6
PCl
Stan skupienia
azot
fosfor
arsen
antymon
bizmut
g a z
c i a ł a s t a ł e
n i e m e t a l e
p ó ł m e t a l e
m e t a l
Elektroujemność
wg. Allreda-Rochowa
3,07
2,06
2,20
1,82
1,67
Konfiguracja
elektronów
walencyjnych
Stopnie utlenienia
s
2
p
3
od -3 do +5 st. utlenienia
Orbitale typu d
brak
są dostępne
maks. 4 wiązania
kowalencyjne, np.
4
NH
5 lub 6 wiązań kowalencyjnych,
np. PCl
5
,
6
PCl
14
14
Właściwości fizykochemiczne
azotowców

15
15
Charakterystyka ogólna
azotowców
• Ze wzrostem liczby atomowej narastają cechy metaliczne
azotowców. Azot i fosfor to niemetale (azot - gazowy, fosfor
– stały), arsen i antymon – półmetale, bizmut – metal.
• Azot jest piątym pierwiastkiem pod względem
rozpowszechnienia we wszechświecie. Jest podstawowym
składnikiem atmosfery ziemskiej (78%), ale w skorupie
ziemskiej jego związki nie mają dużego udziału.
• Azot jest najbardziej elektroujemnym azotowcem (jego
elektroujemność w skali Paulinga wynosi 3.0), dlatego jako
jedyny tworzy cały szereg związków na stopniach utlenienia
od –III do +V. Wszystkie azotowce tworzą związki na +III
(podstawowy)
i +V stopniu utlenienia – to dwa najważniejsze stopnie
utlenienia dla azotowców.
• Związki azotowców mają głównie charakter kowalencyjny.
Fluor jest jedynym pierwiastkiem o wystarczająco dużej
elektroujemności, aby tworzyć z niektórymi azotowcami
związki o charakterze jonowym (np. SbF
3
, BiF
3
).
• Azot może tworzyć wiązania wielokrotne (między atomami
azotu, np. cząsteczka N
2
, jak i między azotem i węglem czy
tlenem, np. HCN, HNO
2
). Właśnie dlatego tlenki azotu N
2
O
3
i
N
2
O
5
są monomeryczne i gazowe, zaś tritlenki i pentatlenki
pozostałych azotowców są stałymi dimerami.
16
16
Charakterystyka ogólna
azotowców
• W poszczególnych okresach układu okresowego,
azotowce są bardziej elektroujemne niż odpowiednie
pierwiastki z grup głównych I÷IV (azot ma
elektroujemność w skali Paulinga 3.0 i jest jednym z
najbardziej elektroujemnych pierwiastków). W szeregu
od pierwiastków grupy I do IV maleje liczba związków
jonowych, ale dla azotowców zaczyna znowu wzrastać, w
stosunku do węglowców.
• Najczęściej związki azotowców mają budowę AB, AB
2
,
AB
3
, A
2
B
3
i A
2
B
5
. Te, które mają wystarczająco jonowy
charakter, tworzą sieci typu wurcytu (np. azotki: AlN,
GaN), lub typu blendy cynkowej (np. fosforki: AlP, GaP).
Niektóre związki
o charakterze jonowym, tworzą sieci zdeformowane, ze
względu na różnicę w stechiometrii cząsteczek (np. SbF
3
,
BiF
3
tworzą sieć typu fluorytu, w której zajętych jest
tylko 2/3 miejsc sieciowych przeznaczonych dla
kationów.
S
2-
S
2-
Zn
2
+
Zn
2
+
Ca
2
+
Ca
2
+
F
-
F
-

17
17
Stopnie utlenienia azotowców
Stopnie utlenienia:
Przykłady:
-3 st.utl.
NH
3
, PH
3
+1 st.utl.
N
2
O
+3 st.utl.
N
2
O
3
, HNO
2
, H
3
PO
3
, Bi
2
(SO
4
)
3
+5 st.utl.
N
2
O
5
, HNO
3
, H
3
PO
4
, H
3
AsO
4
Ponadto -2, -1, +2 i +4 st. utlenienia (np.: N
2
H
4
, NH
2
OH, NO, NO
2
)

18
18
Występowanie w przyrodzie i
otrzymywanie azotowców
•
azot – stanowi 78% atmosfery ziemskiej; praktycznie
wszystkie jego związki są rozpuszczalne w wodzie – mimo
tego występuje w postaci złóż soli (głównie azotanów:
saletry chilijskiej NaNO
3
i saletry indyjskiej KNO
3
)
fosfor – jest dziesiątym pierwiastkiem pod względem
rozpowszechnienia w skorupie ziemskiej; występuje w
postaci złóż magmowych (apatyty) lub osadowych
(fosforyty); istotnym składnikiem wszystkich tych złóż jest
chloro- i fluoroapatyt (Ca
3
(PO
4
)
2
▪(CaF
2
,CaCl
2
))
• Pozostałe azotowce należą do śladowych pierwiastków w
przyrodzie.
• arsen – występuje w popiele piecowym przy
otrzymywaniu żelaza i niklu
• antymon – najczęściej towarzyszy w przyrodzie rudom
cynku
• bizmut – jest składnikiem pyłu piecowego po prażeniu
PbS.

19
19
Występowanie w przyrodzie i
otrzymywanie azotowców
Azot najczęściej otrzymywany jest przez
skraplanie powietrza. Bardzo czysty azot (w
małych ilościach) można otrzymywać przez
ogrzewanie azydku sodowego – NaN
3
.
NaN
3
= 3/2N
2
+ Na
(bardzo czysty azot)
Ogrzewanie z azotynu amonu:
NH
4
NO
2
= N
2
+ 2H
2
O
• Fosfor, arsen, antymon i bizmut na skalę
przemysłową otrzymywane są przez redukcję
węglem ich odpowiednich tlenków:
• Ca
3
(PO
4
)
2
+ SiO
2
→ CaSiO
3
+ P
4
O
10
P
4
O
10
+ 10C → 4P + 10CO
Me
4
O
6
+ 6C → 4Me + 6CO (Me=As, Sb, Bi)
20
20
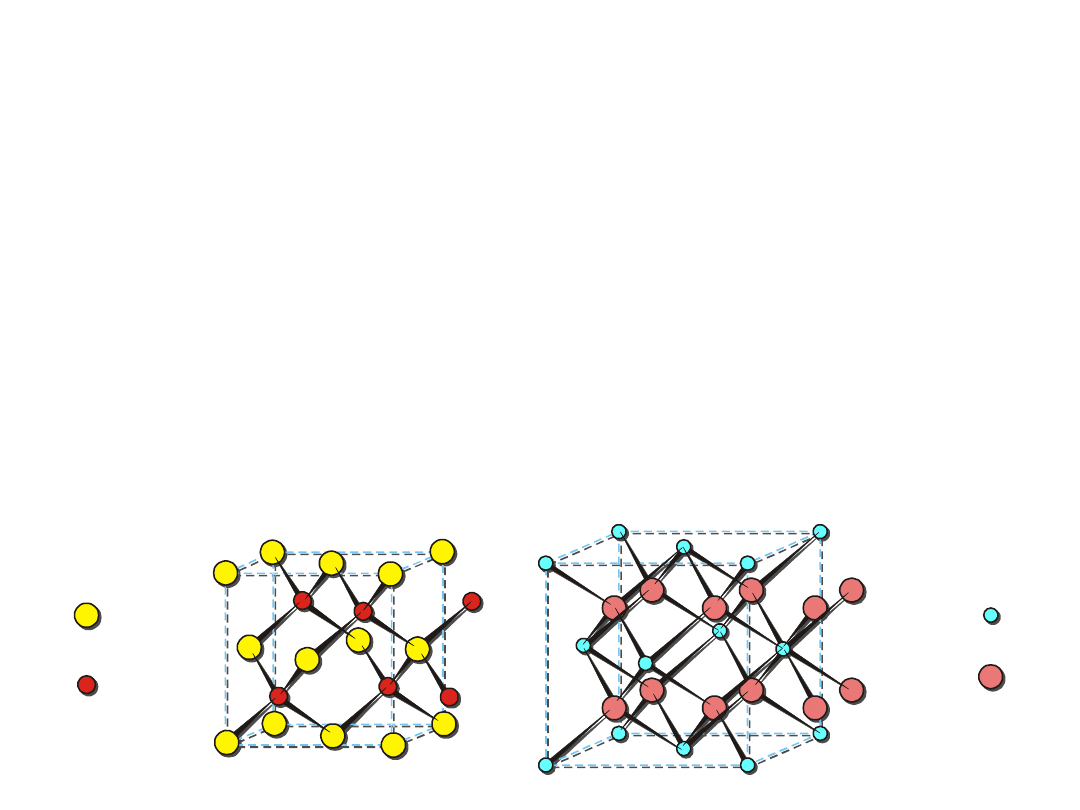
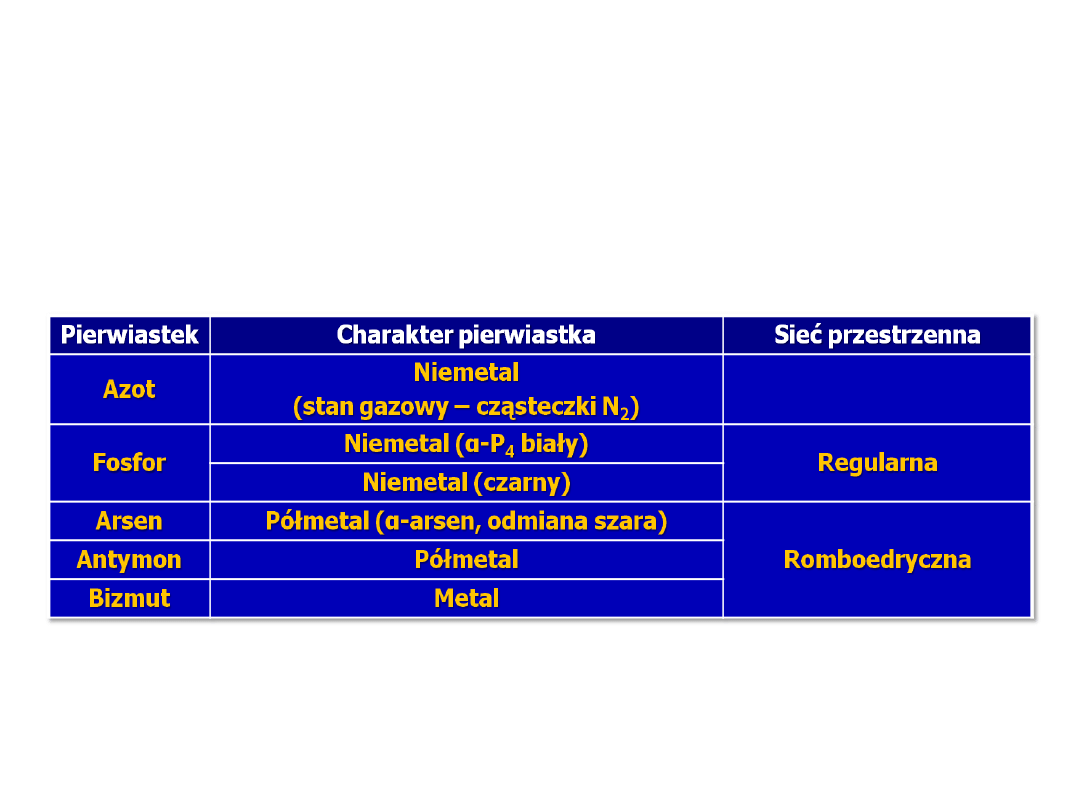
Sieci przestrzenne azotowców
Wśród azotowców są dwa pierwiastki
niemetaliczne – azot(gazowy) i fosfor (stały),
dwa półmetale (arsen i antymon) oraz jeden
metal (bizmut).
21
21
Alotropia azotowców
Odmiany niemetaliczne
Metaliczne
Azot
N
2
-
Fosfor
biały czerwony fioletowy
d = 1,89 g/ cm
3
(bezpostaciowy) d = 2,32 g/ cm
3
(toksyczny)
czarny
d = 2,70 g/ cm
3
- połysk
metaliczny
- przewodzi prąd
Arsen
żółty czarny
szary
Antymon
żółty czarny
srebrzystobiały
Bizmut
-
różowo-biały
Odmiany najtrwalsze podkreślono.
Odmiany najtrwalsze podkreślono.
22
22
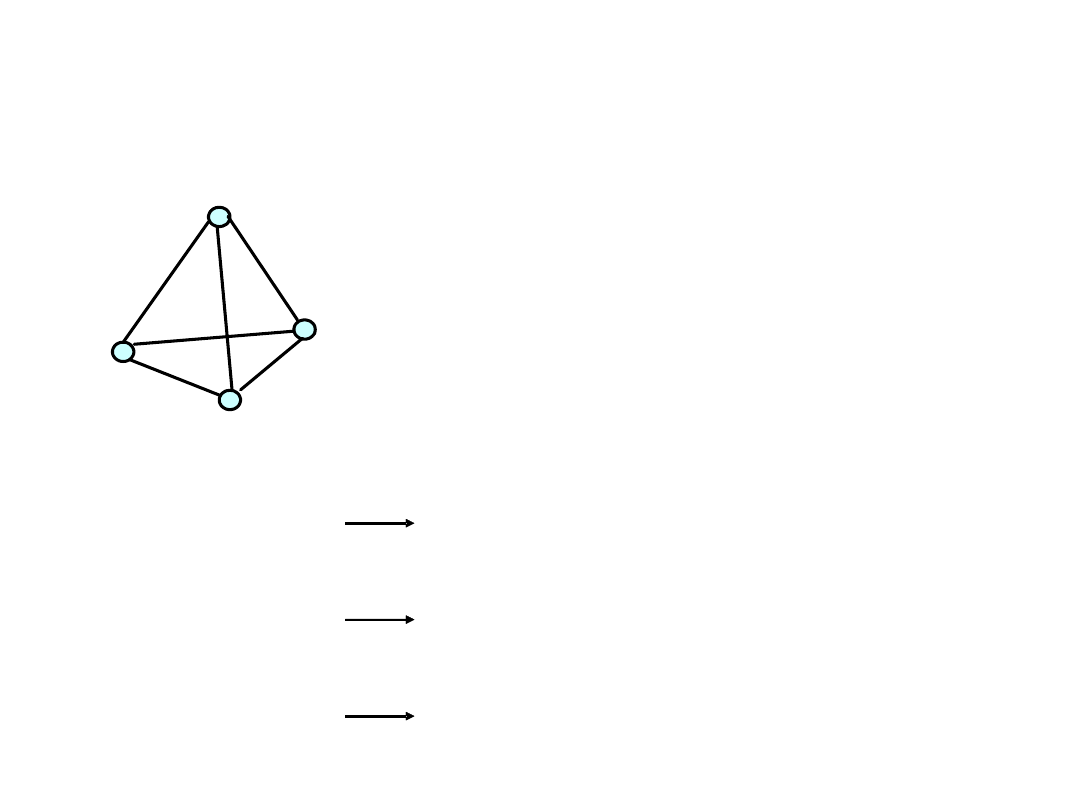
Alotropia azotowców
Fosfor biały występuje w postaci cząsteczek P
4
:
Pozostałe odmiany są
produktami polimeryzacji
cząsteczek P
4.
Przemiany alotropowe fosforu:
biały czerwony
biały fioletowy
biały czarny
450 K
(I
2
)
800 K
490 K
1,2 GPa
Fosfor biały zapala się już w
Fosfor biały zapala się już w
temperaturze 57
temperaturze 57
o
o
C:
C:
P
P
4
4
+ 5O
+ 5O
2
2
= P
= P
4
4
O
O
10
10
H
H
o
o
= -3096 kJ/mol
= -3096 kJ/mol
Silnie rozdrobniony fosfor
Silnie rozdrobniony fosfor
biały zapala się samorzutnie
biały zapala się samorzutnie
w atmosferze powietrza już w
w atmosferze powietrza już w
temperaturze pokojowej.
temperaturze pokojowej.
Fosfor biały zapala się już w
Fosfor biały zapala się już w
temperaturze 57
temperaturze 57
o
o
C:
C:
P
P
4
4
+ 5O
+ 5O
2
2
= P
= P
4
4
O
O
10
10
H
H
o
o
= -3096 kJ/mol
= -3096 kJ/mol
Silnie rozdrobniony fosfor
Silnie rozdrobniony fosfor
biały zapala się samorzutnie
biały zapala się samorzutnie
w atmosferze powietrza już w
w atmosferze powietrza już w
temperaturze pokojowej.
temperaturze pokojowej.
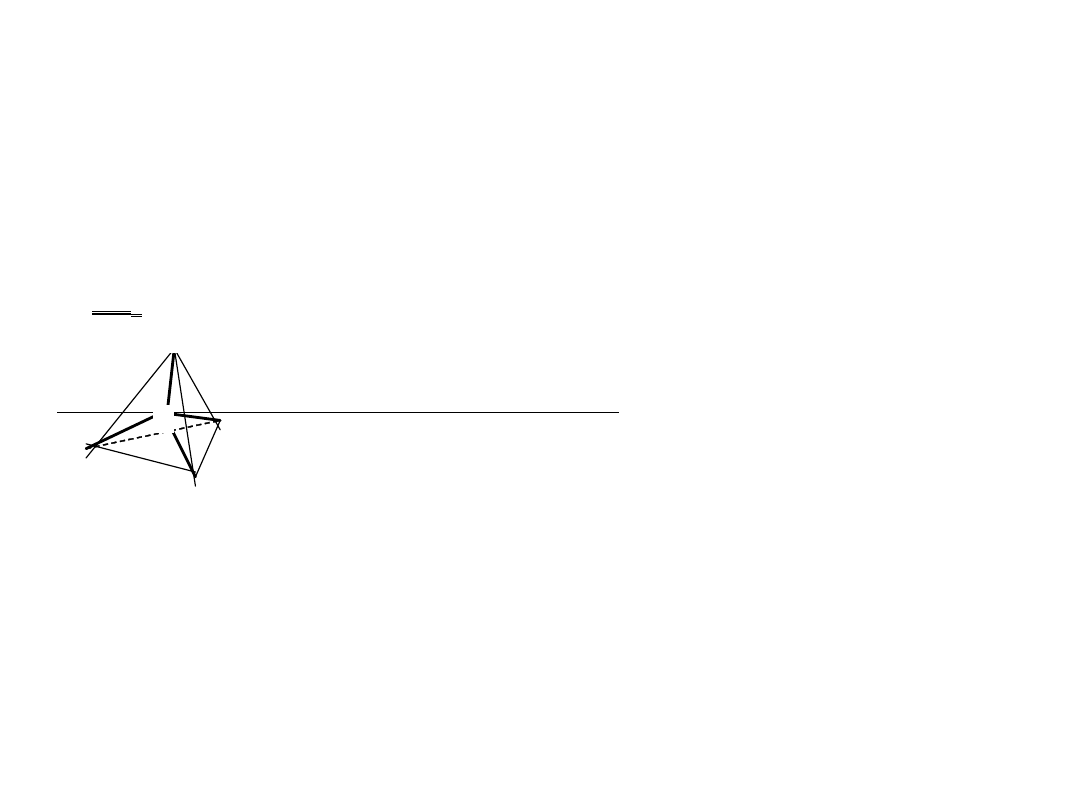
23
23
Połączenia z wodorem - wodorki
N
P As
Sb
Bi
XH
3
x
x
x
x
x
X
2
H
4
x x
HX
3
x
a) XH
3
NH
3
amoniak
PH
3
fosfan (fosforowodór)
AsH
3
arsan (arsenowodór)
SbH
3
styban (antymonowodór)
H
BiH
3
bizmutan (bizmutowodór)
H
H
X
..
Hybrydyzacja typu sp
3
cząsteczki w kształcie piramidy
kąty od 106
o
(dla NH
3
) do 91o (dla SbH
3
i BiH
3
).
NH
3
cząsteczka polarna = 1,48 D
wiązanie atomowe spolaryzowane asocjacja cząsteczek
NH
3
w stanie ciekłym:
N - H - - - N (wiązania wodorowe)
Pozostałe wodorki są niepolarne mała różnica
elektroujemności pomiędzy wodorem i azotowcem.
Hybrydyzacja typu sp
3
cząsteczki w kształcie piramidy
kąty od 106
o
(dla NH
3
) do 91o (dla SbH
3
i BiH
3
).
NH
3
cząsteczka polarna = 1,48 D
wiązanie atomowe spolaryzowane asocjacja cząsteczek
NH
3
w stanie ciekłym:
N - H - - - N (wiązania wodorowe)
Pozostałe wodorki są niepolarne mała różnica
elektroujemności pomiędzy wodorem i azotowcem.
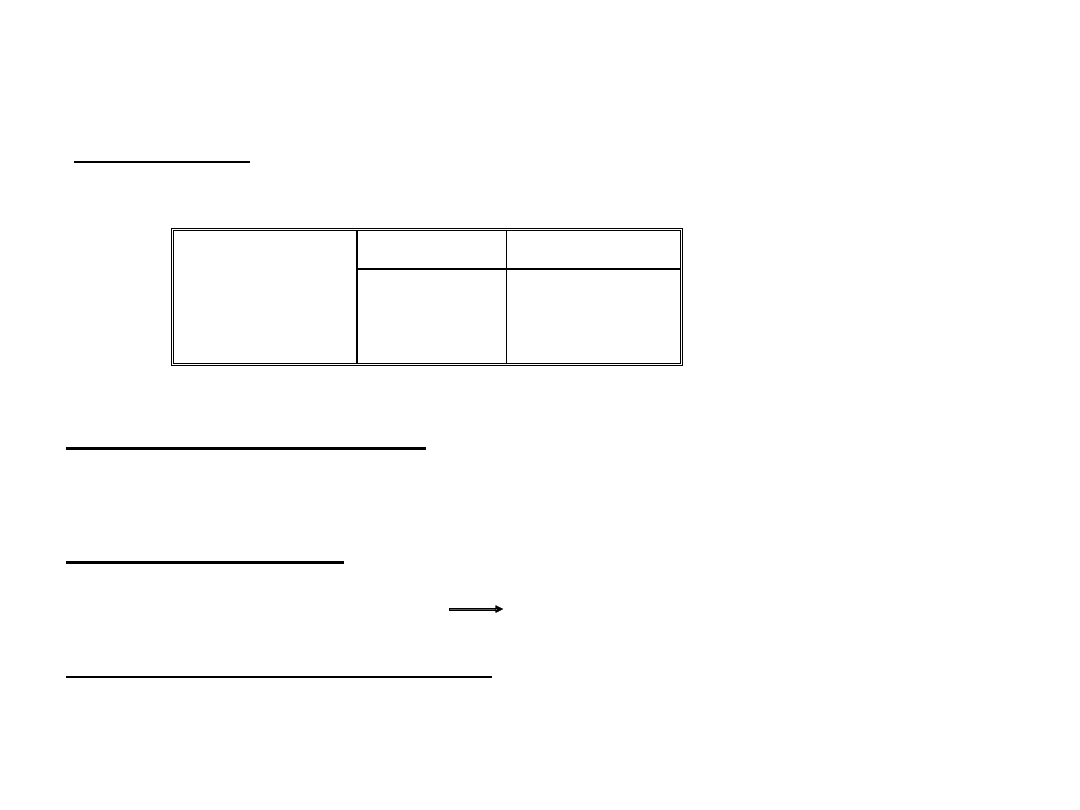
24
24
Połączenia z wodorem - wodorki
Amoniak
N
2
+ 3H
2
= 2NH
3
H
o
= - 92 kJ / mol
szybkość
wydajność
temperatura
ciśnienie
katalizator
+
+
+
-
+
0
Warunki optymalne syntezy:
30 - 35 MPa, 770 - 780 K,
katalizator – np. Fe
Metoda laboratoryjna: z soli amonowych
NH
4
+
+ OH
-
= NH
3
H
2
O NH
3
+ H
2
O
Amoniak rozpuszczony w wodzie
NH
3
jest dobrze rozpuszczalny w wodzie i tworzy słaby
wodorotlenek:
NH
3
+ H
2
O NH
3
H
2
O
ogrzewanie
25
25
Połączenia z wodorem - wodorki
Amoniak
NH
3
H
2
O NH
4
+
+ OH
-
K
b
= 1,8 10
-5
Sole amonowe:
NH
4
Cl, (NH
4
)
2
SO
4
, NH
4
HSO
4
.
Spalanie amoniaku w tlenie: 4NH
3
+ 3O
2
= 2N
2
+ 6H
2
O
W obecności katalizatora (Pt):
4NH
3
+ 5O
2
= 4NO + 6H
2
O metoda Ostwalda
Ciekły (bezwodny) NH
3
jest dobrym rozpuszczalnikiem dla
substancji polarnych. Ulega autodysocjacji:
2NH
3
= NH
4
+
+ NH
2
-
słaby kwas mocna zasada
Pochodne amoniaku:
Amidki
np. NaNH
2
, Ca(NH
2
)
2
I midki
np. Li
2
NH, MgNH
Azotki
np. Na
3
N, Mg
3
N
2
, AlN
Hydroksylamina NH
2
OH
26
26
Połączenia z wodorem - wodorki
Amoniak
Aminy
R
1
-R
1
, -R
2
, -R
3
lub -H
N R
2
R
3
Typy amin:
1) 1-szo rzędowa R
1
= R
2
= H, R
3
H,
np. (CH
3
)NH
2
2) 2-go rzędowa R
1
= H,
R
2
, R
3
H, np. (C
2
H
5
)
2
NH
3) 3-cio rzędowa R
1
, R
2
, R
3
H,
np. (C
8
H
17
)
3
N
4) czwartorzedowe sole amonowe
R
1
+
R
2
N R
4
X
-
X
-
to np.: Cl
-
, Br
-
R
3
I nne związki azotu z wodorem:
H
H
hybrydyzacja obu
Hydrazyna N
2
H
4
N N
atomów azotu
H
H
typu sp
2

27
27
Połączenia z wodorem - wodorki
I nne związki azotu z wodorem:
H
H
hybrydyzacja obu
Hydrazyna N
2
H
4
N N
atomów azotu
H
H
typu sp
2
W roztworze wodnym posiada właściwości słabo zasadowe:
N
2
H
4
H
2
O hydrat hydrazyny czyli (NH
2
NH
3
+
)OH
-
Hydrazyna i jej pochodne są silnymi środkami redukującymi -
wydzielają złoto, platynę i srebro z ich soli.
Stosowana jest paliwo rakietowe (+ substancje silnie
utleniające, np. ciekły tlen, H
2
O
2
, st. HNO
3
).

28
28
Połączenia z wodorem -
wodorki
Azydek wodoru HN
3
kwas azotowodorowy
umiarkowanie mocny kwas:
Sole kwasu azotowodorowego to azydki:
NaN
3
azydek sodu,
Ca(N
3
)
2
azydek wapnia
Azydek sodu jest używany w samochodowych poduszkach
powietrznych.
Wodorki pozostałych azotowców :
PH
3
- fosfan (fosforowodór)
toksyczne gazy
AsH
3
- arsan
nie posiadają wł.
SbH
3
- styban
zasadowych
BiH
3
- bizmutan
z wyj. PH
3
P
2
H
4
- dwufosfan
HN
3
= H
+
+ N
3
-
29
29
Tlenowe połączenia
azotowców
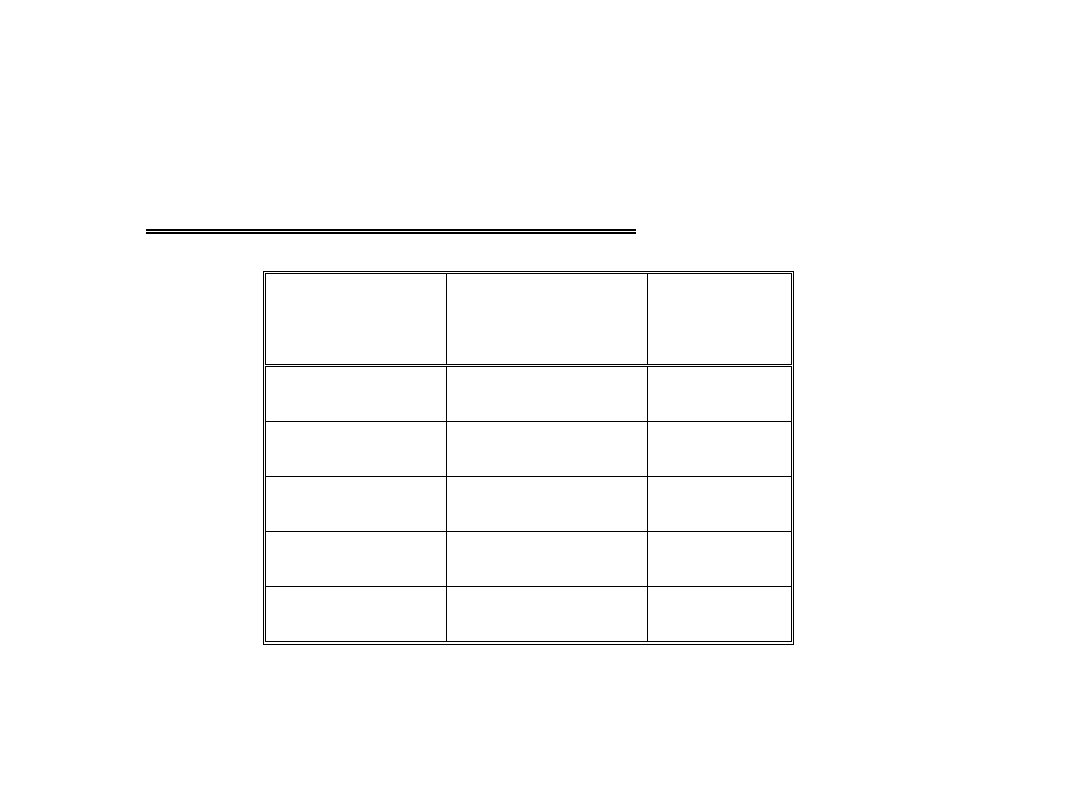
Tlenki i kwasy tlenowe azotu:
Stopień
utlenienia
Tlenki
Kwasy
+1
N
2
O
H
2
N
2
O
2
+2
NO
+3
N
2
O
3
HNO
2
+4
NO
2
, N
2
O
4
+5
N
2
O
5
HNO
3
30
30
Tlenowe połączenia
azotowców
Tlenek azotu (NO)
Otrzymywanie:
1
o
N
2
+ O
2
2NO
2
o
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
3
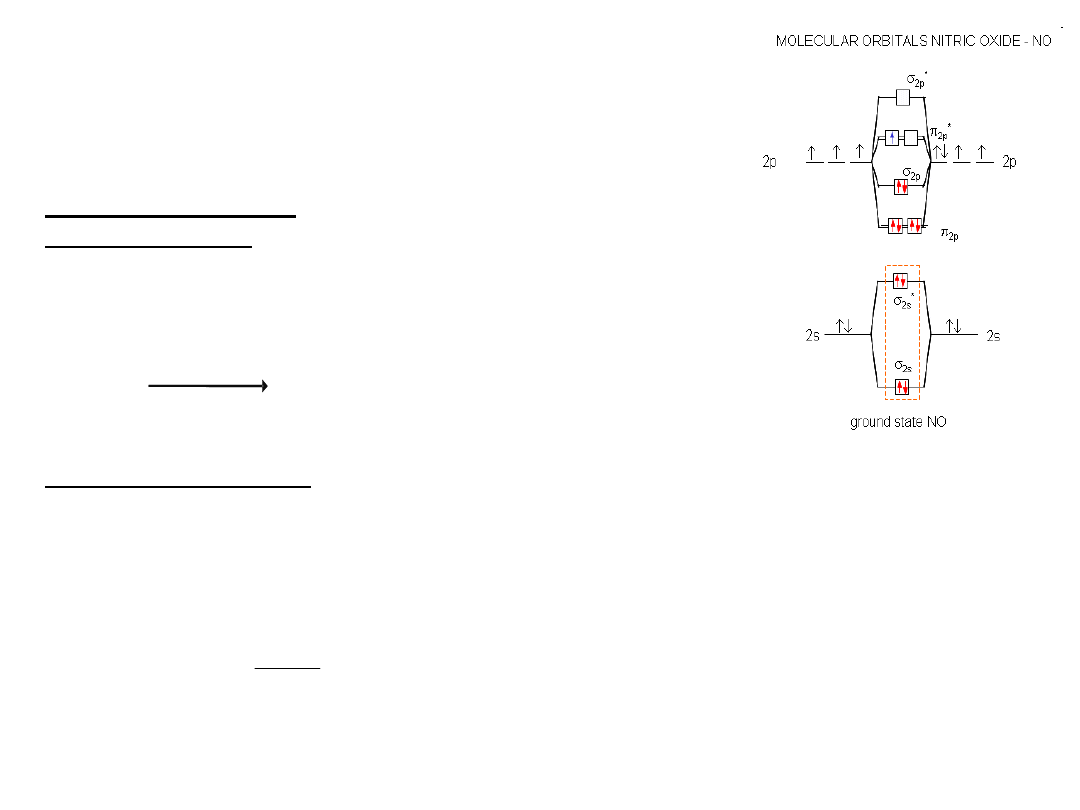
o
NH
3
NO
Budowa cząsteczki NO: 5 + 6 = 11
O
2
:
6 + 6 = 12
Budowa cząsteczki NO jest taka jak O
2
ale o 1 elektron mniej:
KK (2s)
2
(
*
2s)
2
(2p
x
)
2
(2p
y
)
2
(2p
z
)
2
(
*
2p
y
)
1
liczby elektronów
walencyjnych
walencyjnych
rząd
wiązania:
katalityczne
spalanie
2,5
=
2
3
-
8
31
31
Tlenowe połączenia
azotowców
Kwas azotowy(I I I ) = HNO
2
kwas azotowy(I I I ) kwas azotawy HNO
2
J est to kwas nietrwały. W stężonych roztworach ulega rozkładowi:
3HNO
2
= H
+
+ NO
3
-
+ 2NO + H
2
O
HNO
2
H
+
+ NO
2
-
K
a
= 510
-4
Sole kwasu azotawego: azotyny, np. NaNO
2
, NH
4
NO
2
, Ca(NO
2
)
2
Anion NO
2
-
: 5 + 2 x 6 + 1 = 18 el. walencyjnych
Cząsteczka O
3
: 6 x 3 = 18 el. walencyjnych
Anion NO
2
-
jest izoelektronowy z cząsteczką O
3
ta sama
struktura orbitali molekularnych (patrz cząsteczka O
3
wg. teorii
orbitali molekularnych).
J est kwasem słabym:
32
32
Tlenowe połączenia
azotowców
Dwutlenek azotu (NO
2
)
2NO + O
2
= 2NO
2
W temperaturze < 420 K NO
2
ulega dimeryzacji:
2NO
2
N
2
O
4
N
2
O
4
+ H
2
O = HNO
3
+ HNO
2
jonowo: N
2
O
4
+ H
2
O = H
+
+ NO
3
-
+ HNO
2
Cząsteczka NO
2
5 + 2 x 6 = 17 elektronów walencyjnych 1 niesparowany
elektron cząsteczka paramagnetyczna
Cząsteczka O
3
6 x 3 = 18 elektronów walencyjnych
Cząsteczka NO
2
ma budowę podobną do O
3
- ale posiada o 1
elektron mniej:
1
0
del
2
del
2
3
,
2
2
2
,
1
2
2
2
2
y
2
1
y
2
3
2
1
)
(
)
(
)
(
)
(
)
t
(
)
p
2
(
)
p
2
(
)
s
2
(
)
s
2
(
KKK
33
33
Tlenowe połączenia
azotowców
Cząsteczka N
2
O
4
2 x 5 + 4 x 6 = 34 elektrony walencyjne nie ma tutaj
niesparowanego elektronu cząsteczka diamagnetyczna
Wiązanie N - N w cząsteczce N
2
O
4
ma większą długość (164 pm) niż
pojedyńcze wiązanie N - N w cząsteczce hydrazyny (145 pm)
wiązanie słabsze od wiązania pojedynczego:
Kwas azotowy - HNO
3
J est to mocny kwas:
HNO
3
H
+
+ NO
3
-
J est kwasem utleniającym:
Cu + HNO
3
= ?
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
126
0
N
N
O
O
O
O
164 pm

34
34
Tlenowe połączenia
azotowców
Kwas azotowy - HNO
3
J est to mocny kwas:
HNO
3
H
+
+ NO
3
-
J est kwasem utleniającym:
Cu + HNO
3
= ?
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
Dobierz współczynniki do tej reakcji pisząc reakcje połówkowe
Cu + HCl reakcja nie zachodzi HCl nie jest kwasem
utleniającym.
W HNO
3
roztwarzają się wszystkie metale za wyjątkiem złota
i platynowców.
Woda królewska - mieszanina stężonych roztworów wodnych HNO
3
i HCl w stosunku objętościowym 1 : 3. Reakcja roztwarzania złota
w wodzie królewskiej:
Dobierz współczynniki do tej reakcji pisząc reakcje połówkowe.
O
H
2
NO
AuCl
H
4
NO
Cl
4
Au
2
4
3

35
35
Otrzymywanie kwasu azotowego –
etapy otrzymywania
1
o
N
2
+ 3H
2
= 2NH
3
2
o
4NH
3
+ 5O
2
= 4NO + 6H
2
O
3
o
NO +
1
/
2
O
2
= NO
2
4
o
2NO
2
N
2
O
4
5
o
N
2
O
4
+ H
2
O = HNO
3
+ HNO
2
6
o
3HNO
2
= HNO
3
+ 2NO + H
2
O
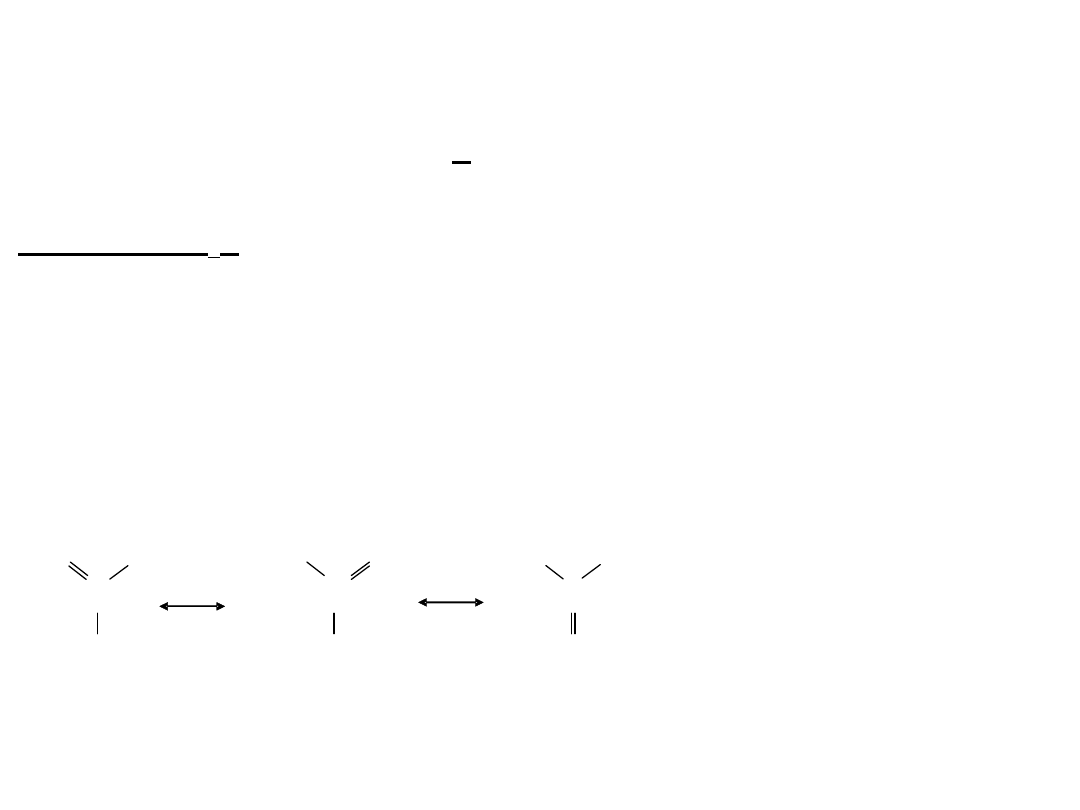
36
36
HNO
3
Stężony HNO
3
: 69% mas., d = 1,41 kg/ dm
3
Sole kwasu azotowego AZOTANY, np: NaNO
3
, Ca(NO
3
)
2
,
Al(NO
3
)
3
Kształt anionu
3
NO
jest płaski (hybrydyzacja sp
2
)
Strukturę elektronową (wzory Lewisa) anionu
3
NO
oddają
3 mezomeryczne wzory elektronowe:
:
O O
:
:
O
O
:
:
O O
:
N
N
N
:
O
:
:
O
:
:
O

37
37
Tlenki fosforu, arsenu, antymonu i
bizmutu
• Fosfor, arsen i antymon nie tworzą prostych tlenków
Me
2
O
3
i Me
2
O
5
, tylko odpowiednie dimery (odróżnia je
to od azotu, który ma zdolność do tworzenia wiązań
wielokrotnych). Bizmut tworzy tlenek (Bi
2
O
3
)n (o
budowie polimerycznej),
a pięciotlenku Bi
2
O
5
nie tworzy wcale:
4Me + 3O
2
→ Me
4
O
6
(Me=P, As, Sb)
4nBi + 3nO
2
→ 2(Bi
2
O
3
)n
• Zasadowość tritlenków rośnie w szeregu N
2
O
3
→
(Bi
2
O
3
)n. Tritlenki azotu, fosforu i arsenu są kwasowe,
antymonu – amfoteryczny a bizmutu – zasadowy.
• Trwałość pentatlenków maleje w szeregu N
2
O
5
→
Sb
4
O
10
.
38
38
Tlenki i kwasy tlenowe
fosforu
st. utl. tlenki
kwasy
+3 P
4
O
6
H
3
PO
3
ortofosforawy = fosforowy(I I I )
+5
P
4
O
10
H
3
PO
4
ortofosforowy = fosforowy(V)
P
4
O
6
+ 6H
2
O = 4H
3
PO
3
P
4
O
10
+ 6H
2
O = 4H
3
PO
4
H
3
PO
4
ma ścisłą nazwę kwas ortojednofosforowy, zwyczajowo
nazywamy go kwasem fosforowym
H
3
PO
4
- kwas o średniej mocy
(x)
:
H
3
PO
4
H
+
+ H
2
PO
4
-
K
a1
= 7 10
-3
H
2
PO
4
-
H
+
+ HPO
4
2-
K
a2
= 8 10
-8
HPO
4
2-
H
+
+ PO
4
3-
K
a3
= 4 10
-13
(x)
ze względu na 1-szy etap dysocjacji
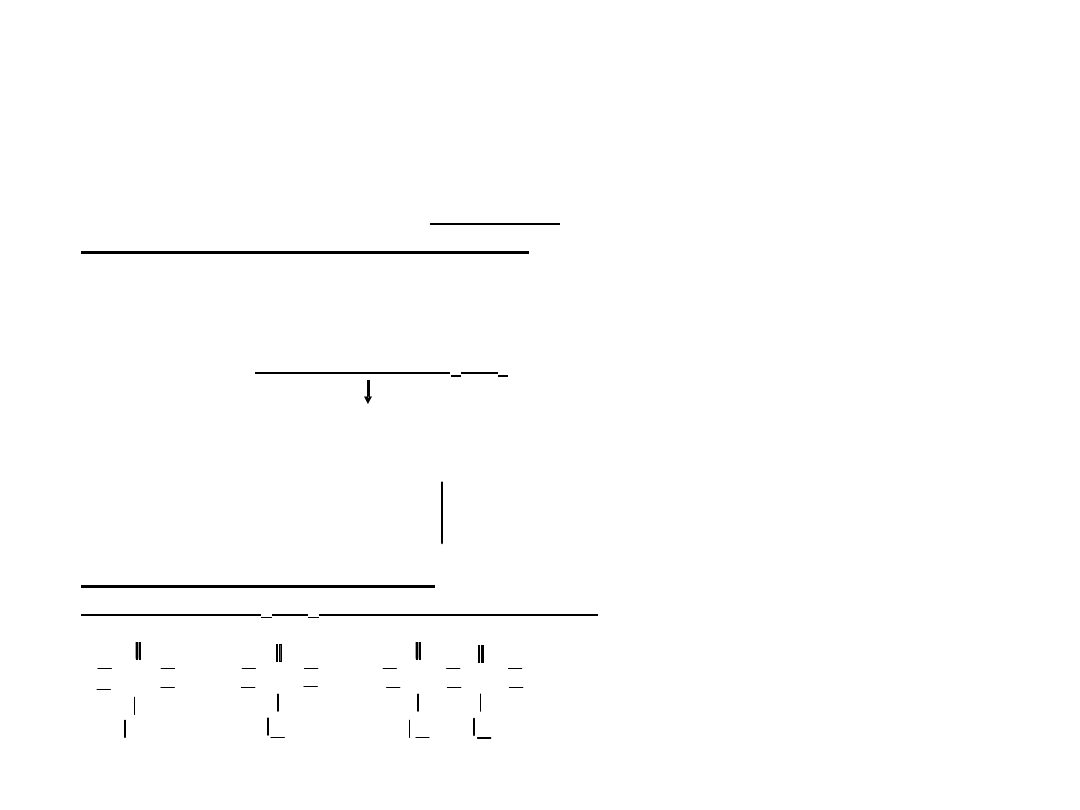
39
39
Tlenki i kwasy tlenowe
fosforu
Sole kwasu fosforowego to fosforany
Przykłady soli kwasu fosforowego:
NaH
2
PO
4
, Ca(H
2
PO
4
)
2
dwuwodorofosforan sodu i wapnia
K
2
HPO
4
, MgHPO
4
jednowodorofosforan potasu i magnezu
Ca
3
(PO
4
)
2
, AlPO
4
(obojętny) fosforan wapnia i glinu
Odwadnianie H
3
PO
4
kondensacja kwasu fosforowego polifosforany
Mamy dwa typy polifosforanów:
budowa łańcuchowa
budowa pierścieniowa
kwasy ortofosforowe
kwasy metafosforowe
1. Łańcuchy polifosforanów
Ogrzewanie H
3
PO
4
w temp. 470 - 570 K:
O
O
O O
HO - P - OH + HO - P - OH = HO - P - O - P - OH + H
2
O
OH OH
OH OH
kwas ortodwufosforowy
(H
4
P
2
O
7
)
walencyjnych
40
40
Połączenia pozostałych azotowców z
tlenem
+3
+5
As
Amfoteryczny
AsO
3
3-
(H
3
AsO
3
)
As
4
O
6
As
3+
(As
4
O
6
- arszenik - silna trucizna)
Kwasowy
As
4
O
10
AsO
4
3-
(H
3
AsO
4
)
Sb
Zasadowy
Sb
4
O
6
Sb
3+
Sb(OH)
3
– wodorotlenek antymonu(I I I )
Sb
2
(SO
4
)
3
- siarczan antymonu(I I I )
Hydroliza Sb
3+
:
Sb
3+
+ H
2
O = SbO
+
+ 2H
+
SbO
+
: kation antymonylowy
Kwasowy
Sb
2
O
5
[Sb(OH)
6
]
-
HSb(OH)
6
– kwas
heksahydroksoantymonowy(V)
41
41
Połączenia pozostałych azotowców z
tlenem
Bi
Zasadowy
Bi
2
O
3
Bi
3+
Bi(OH)
3
– wodorotlenek bizmutu(I I I )
Bi
2
(SO
4
)
3
- siarczan bizmutu(I I I )
Hydroliza Bi
3+
:
Bi
3+
+ H
2
O = BiO
+
+ 2H
+
BiO
+
: kation bizmutylowy
Kwasowy
Bi
2
O
5
BiO
3
-
(BiO
4
3-
)
Kwasy bizmutu(V) nie są znane
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
Wyszukiwarka
Podobne podstrony:
Leszek wyklad11 metale
Leszek wyklad4 elektrochemia
Leszek wyklad9 teoria pasmowa ciala stalego
Leszek wyklad8a chlorowce
Leszek wyklad2
Leszek wyklad3
Leszek wyklad4
Leszek wyklad3
Leszek wyklad2
Leszek wyklad5
Leszek wyklad1
Leszek wyklad8
Leszek wyklad10 zwiazki kompleksowe
Leszek wyklad6
Leszek wyklad12 grupy dlowne
Leszek wyklad1
Leszek wyklad11 metale
więcej podobnych podstron