
1
1
Materiały internetowe
•
http://www.angelo.edu/faculty/kboudrea/ind
ex/Notes_Chapter_08.pdf
•
http://cwx.prenhall.com/petrucci/medialib/po
wer_point/Ch24.ppt
•
http://web.mit.edu/2.813/www/Class
%20Slides/Lecture%207%20Mat.Prod.pdf
•
http://www.google.pl/search?
hl=pl&lr=&client=firefox-
a&channel=s&rls=org.mozilla:pl:official&q=
uklad+okresowy+pierwiastkow
%2BPower+Point&start=20&sa=N
•
http://www.its.caltech.edu/~chem1/Lecture
%20Notes%20pdfs/Series%204%20Periodic
%20Trends.pdf

2
2
Pierwiastki
Pierwiastki
88 występuje w przyrodzie w łatwo
wykrywalnych ilościach
kilka
otrzymano
za
pomocą
reakcji
jądrowych w analitycznie oznaczalnej ilości
zaś ostatnie otrzymano w najmniejszej nie
dającej się oznaczyć ilości
współcześnie
znanych jest
118 pierwiastków

3
3
Wszystkie pierwiastki pogrupowane
są w tablicy nazywanej
Układem okresowym pierwiastków.
Już na początku XIX wieku
podejmowano próby ułożenia w
logiczny sposób tablicy pierwiastków.
Próby takie podejmowali: Dobereiner,
Newlands i Meyer.
4
4
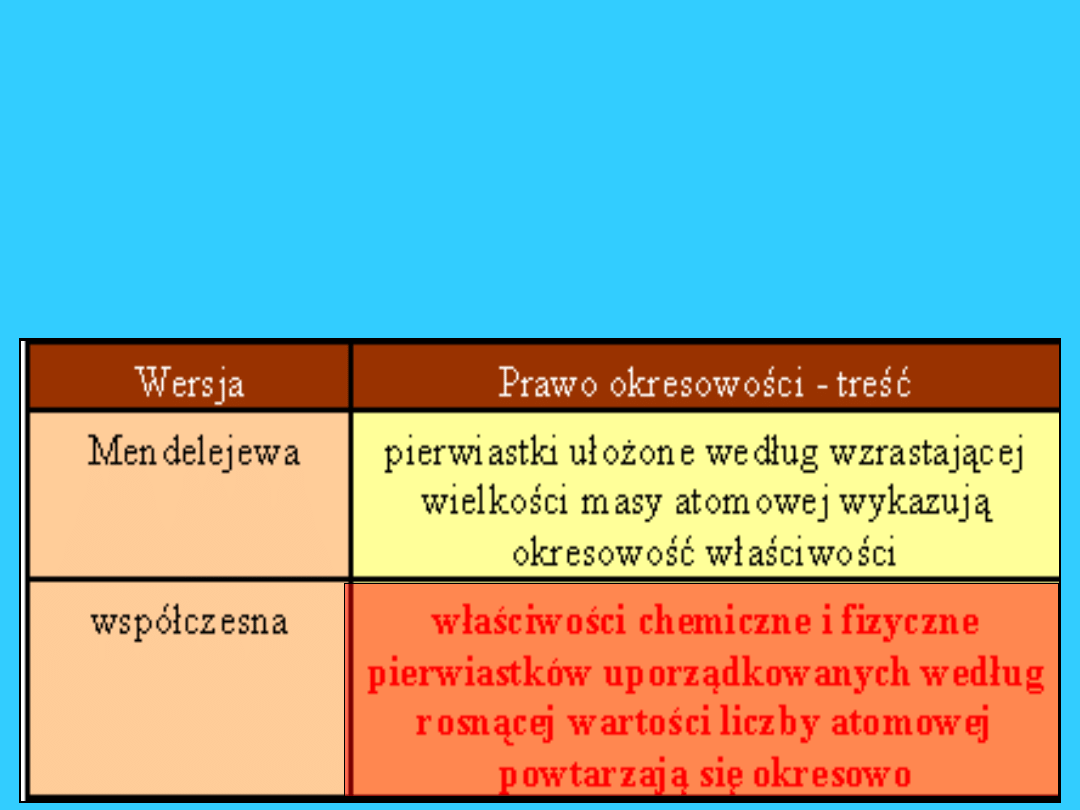
W 1870 Mendelejew opracował
prawo okresowości, którego
wyrazem jest układ okresowy.

5
5
Można zatem ułożyć tablicę
pierwiastków, kierując się
następującymi zasadami:
ustawia się pierwiastki w ciąg rosnących liczb
atomowych
ciąg ten „zawija” się tak, aby pierwiastki o
podobnych konfiguracjach elektronowych
powłoki walencyjnej znalazły się w tych
samych kolumnach
Uzyskuje się układ okresowy
:

6
6
O własnościach pierwiastka
decyduje ilość elektronów w
atomie a szczególnie ilość
elektronów na powłokach
zewnętrznych i ich kształt
.
Współczesna teoria budowy
atomu wyjaśniła PRAWO
OKRESOWOŚCI
UKŁAD OKRESOWY
PIERWIASTKÓW jest pochodną
konfiguracji elektronowej
atomów

7
7
Elektrony uczestniczące w tworzeniu
wiązań chemicznych to elektrony
najwyższego poziomu energetycznego
mogą to
być
elektrony
umieszczon
e w
różnych
powłokach,
jak i
podpowłok
ach
w znacznej mierze określają
one właściwości chemiczne
pierwiastków
8
8
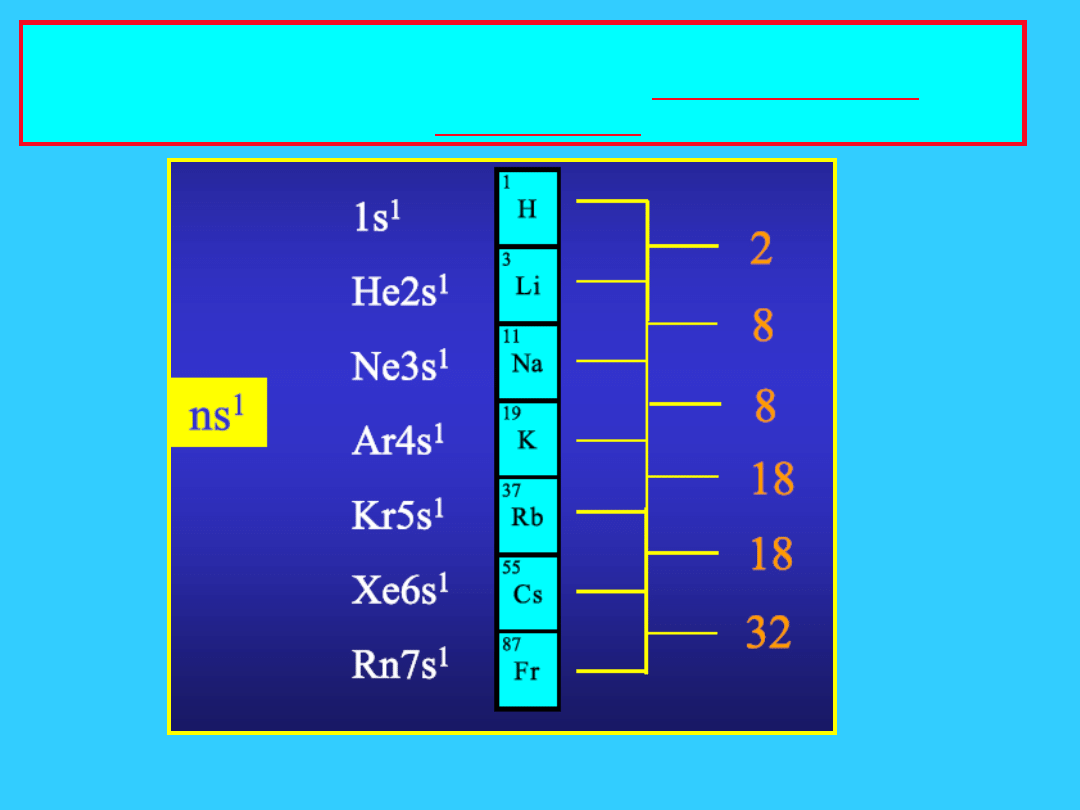
Konfiguracje elektronowe POWŁOK WALENCYJNYCH
atomów powtarzają się co 2, 8, 18 lub 32
pierwiastki
9
9
10
10
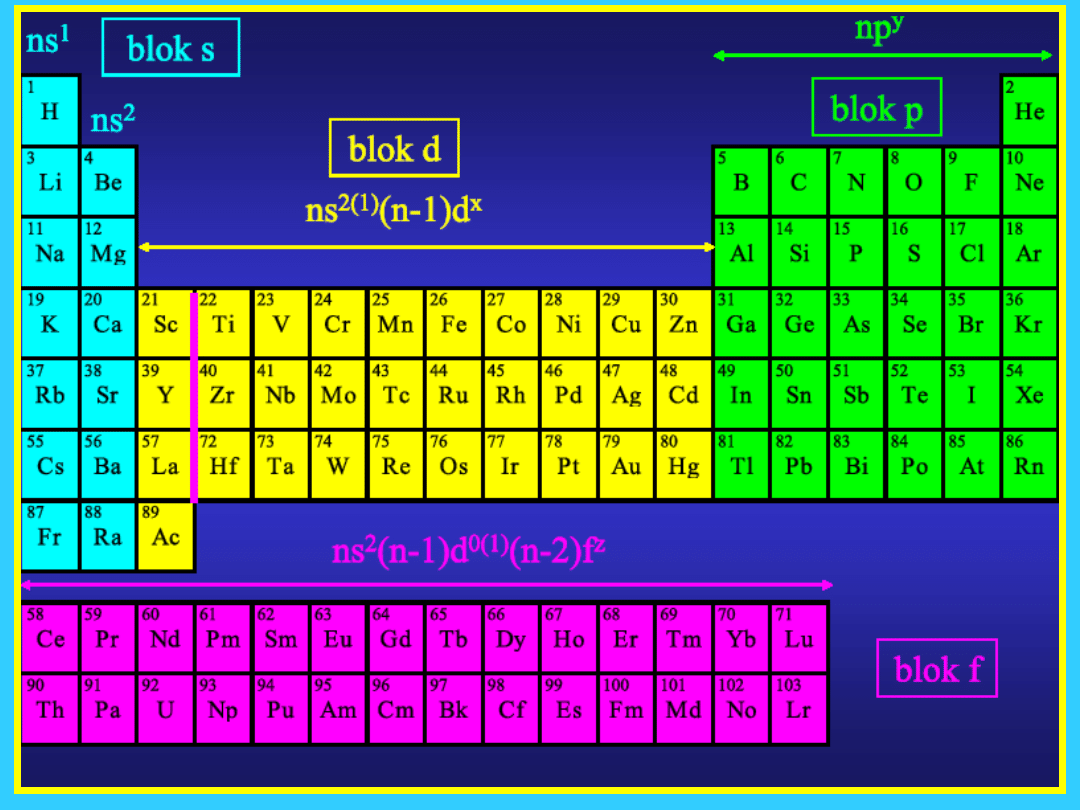
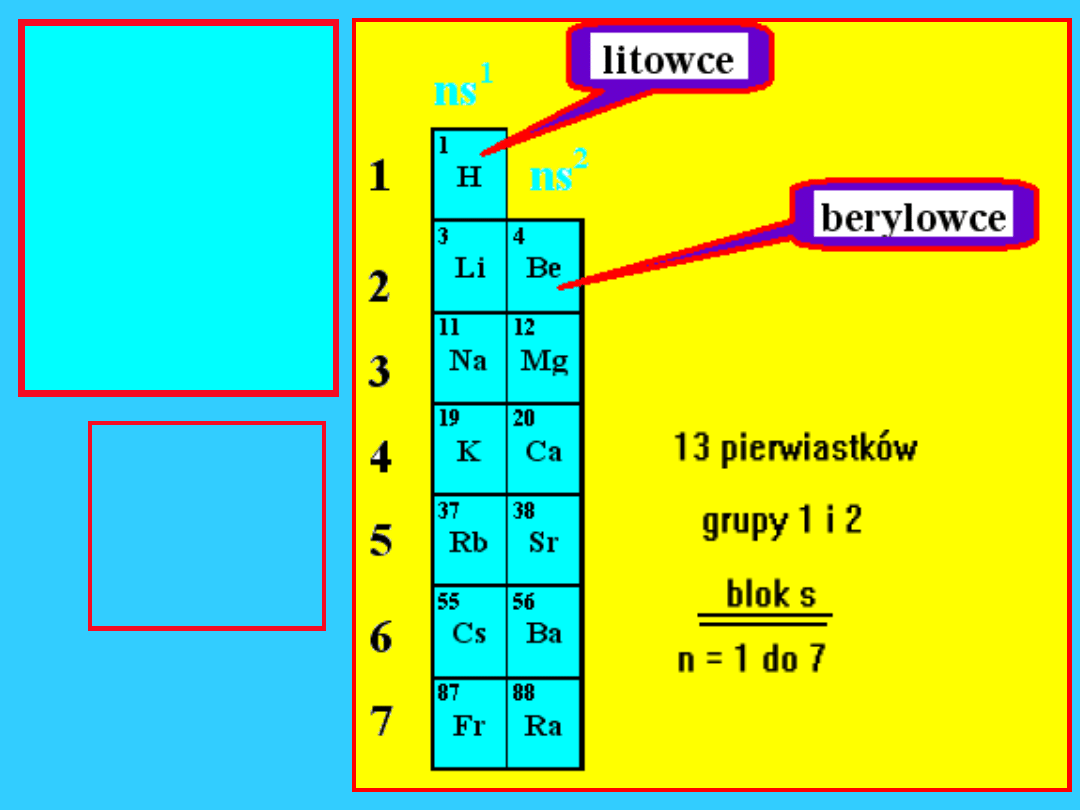
2
pierwsze
kolumny
układu
Układ
okresow
y składa
się z 18
kolumn
blok
s
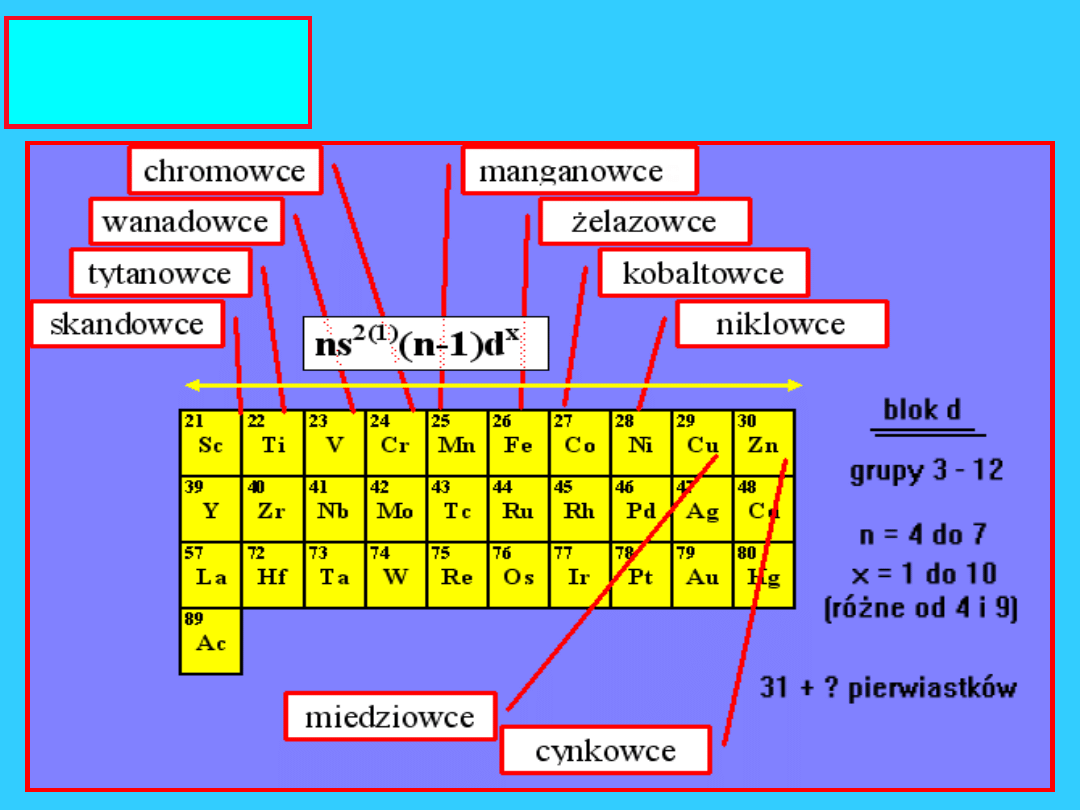
11
11
10 kolumn układu od 3
do 12
blok d

12
12
blok
f

13
13
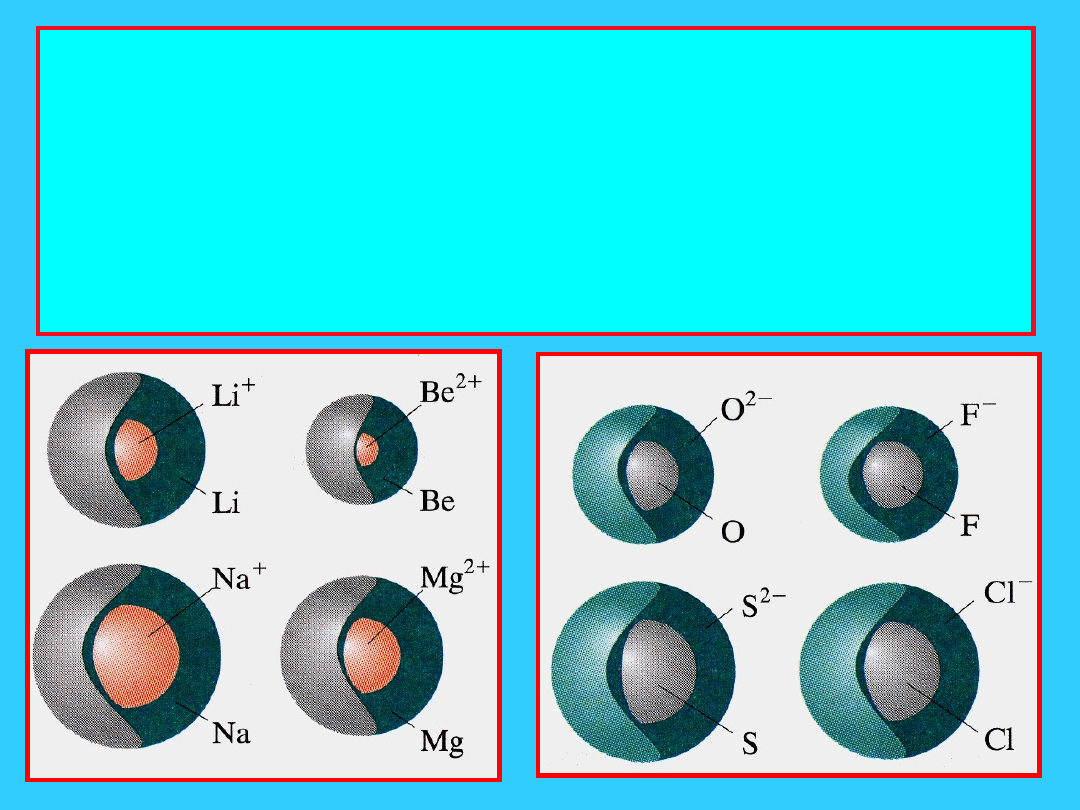
Rozmiary atomów
wielkosc atomu lub jonu okresla
promien najbardziej
zewnetrznej powłoki
elektronowej
Promień atomowy
połowa odległości między środkami
sąsiednich atomów mierzony w
pm (pikometry 1pm = 10
-12
m)
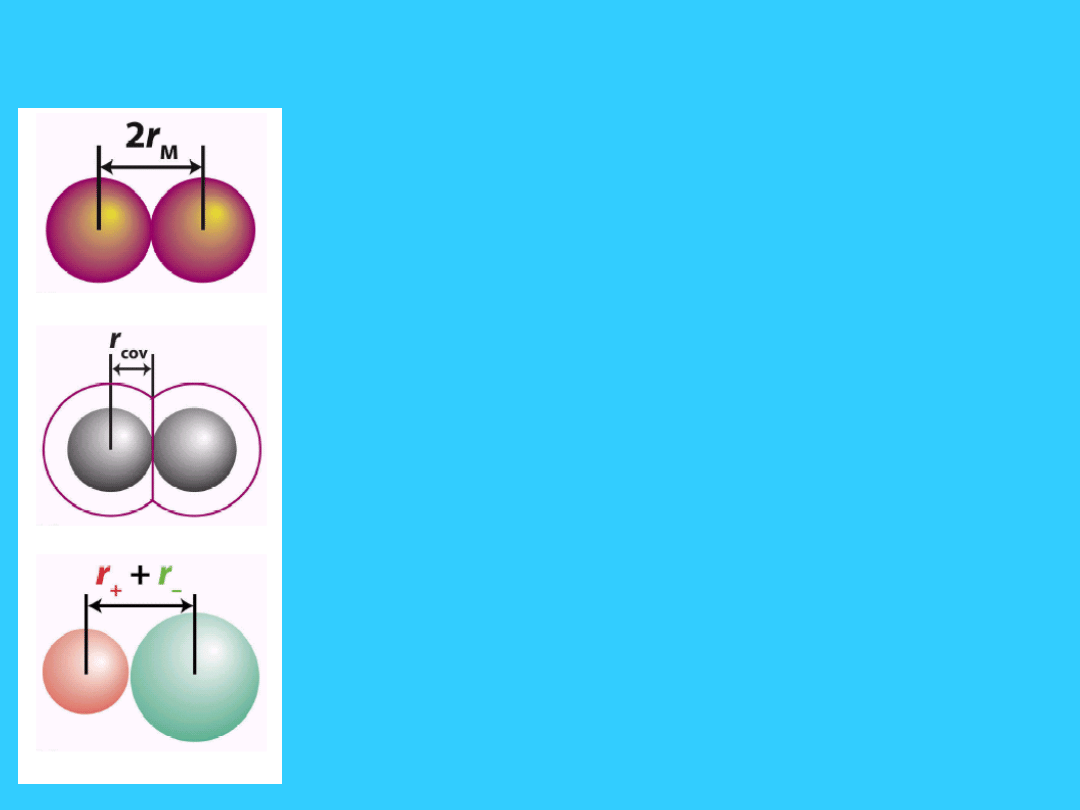
14
14
Rozmiary atomów i jonów
Promień atomowy - połowa eksperymentalnie
wyznaczonej odległości pomiędzy środkami
sąsiednich atomów w ciele stałym
Promień atomowy - połowa eksperymentalnie
wyznaczonej odległości pomiędzy środkami
sąsiednich atomów w ciele stałym
Promień kowalencyjny pierwiastków niemetalicznych
- połowa eksperymentalnie wyznaczonej odległości
pomędzy środkami sąsiednich atomów w ciele stałym
Promień kowalencyjny pierwiastków niemetalicznych
- połowa eksperymentalnie wyznaczonej odległości
pomędzy środkami sąsiednich atomów w ciele stałym
Promień jonowy - wielkość związana z odległością
pomiędzy środkami
sąsiadujących jonów
Promień jonowy - wielkość związana z odległością
pomiędzy środkami
sąsiadujących jonów
15
15
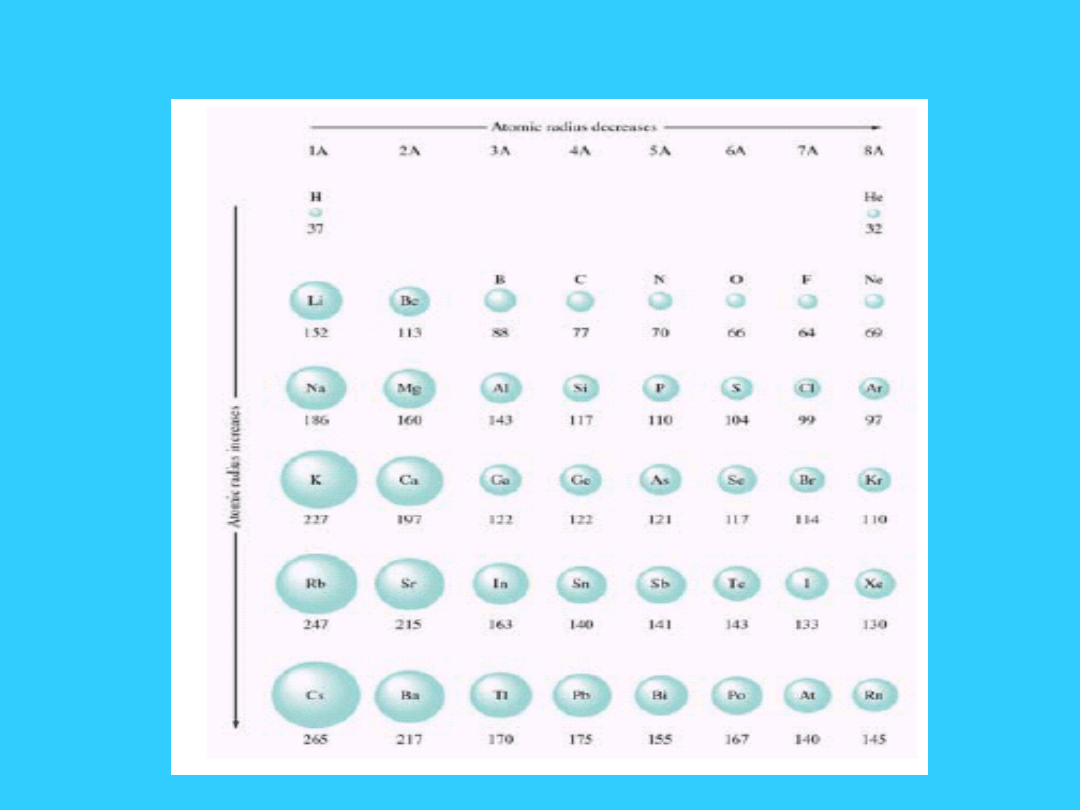
Zmiana promienia
atomowego

16
16
Ekranowanie
Energia elektronu jest funkcją Z
2
/n
2
.
Ładunek jądra (Z) wzrasta szybciej niż główna liczba
kwantowa (n).
Dlatego też ciągły wzrost energii jonizacji EI następuje ze
wzrostem liczby atomowej.
Ale:
EI dla H wynosi 1312 KJ mol
-1
a dla Li tylko 520 KJ mol
-1
Dlaczego?
Przyczyny:
Srednia odległość elektronów 2s od jądra jest większa niż
elektronów 1s.
Elektrony 2s są też odpychane przez elektrony 1s
2
,
dlatego też mogą być łatwiej usunięte – ekranowanie
jądra przez wewnętrzne elektrony. Elektrony walencyjne
„widzą” tylko część ładunku jądra
Efektywny Ładunek Jądra
Z* = Z – σ ( σ= Stała ekranowania)

17
17
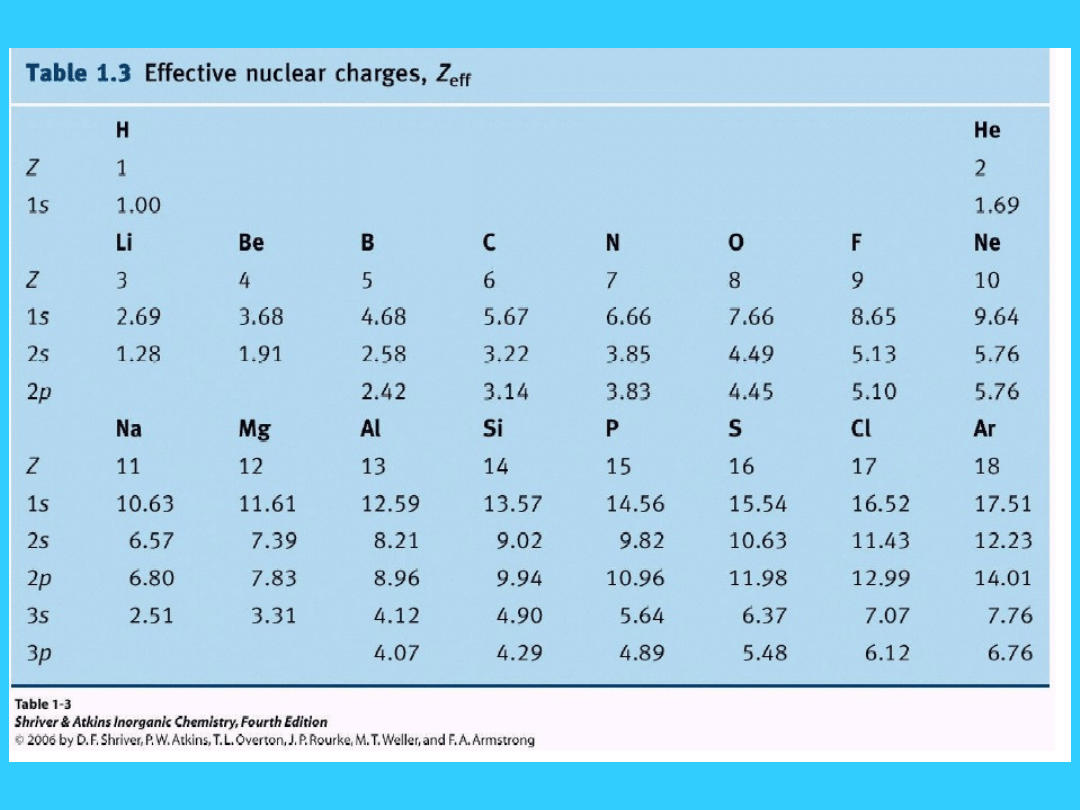
Jak wyznaczyć Z*?
Dla elektronów orbitali s lub p
1. Elektrony powłoki wyższej niż ta na której znajduje się
rozpatrywany elektron e, nie wnoszą wkładu do σ
2. Każdy elektron tej samej powłoki głównej wnosi 0.35
do σ
3. Każdy elektron powłoki (n-1) wnosi 0.85 do σ
4. Każdy elektron głębszej powłoki wnosi 1.00 do σ
Przykład: Obliczyć Z* dla elektronu 2p fluoru (Z = 9) 1s
2
2s
2
2p
5
Stała ekranowania dla elektronu (2p):
6 (sześć) (dwa elektrony 2s i cztery 2p) = 6 X 0.35 = 2.10
2 (dwa) elektrony 1s = 2 X 0.85 = 1.70
σ= 1.70+2.10 = 3.80
Z* = 9 - 3.80 = 5.20

18
18
Jak wyznaczyć Z*?
Dla elektronu na orbitalu
d
lub
f
• 1. Wszystkie elektrony na wyższych
powłokach wnoszą wkład 0
• 2. Każdy elektron tej samej powłoki
wnosi wkład 0.35
• 3. Każdy elektron powłoki (n-1) i
niższych wnosi wkład 1.00
19
19
Efektywny Ładunek Jądra
Z* dla elektronów walencyjnych wzrasta
nieznacznie wraz z przesuwaniem się w dół
grupy
…..ale wzrasta wyraźnie w okresie
…..ale wzrasta wyraźnie w okresie
Jednakowa konfiguracja elektronów
walencyjnych
Jednakowa konfiguracja elektronów
walencyjnych
20
20

21
21
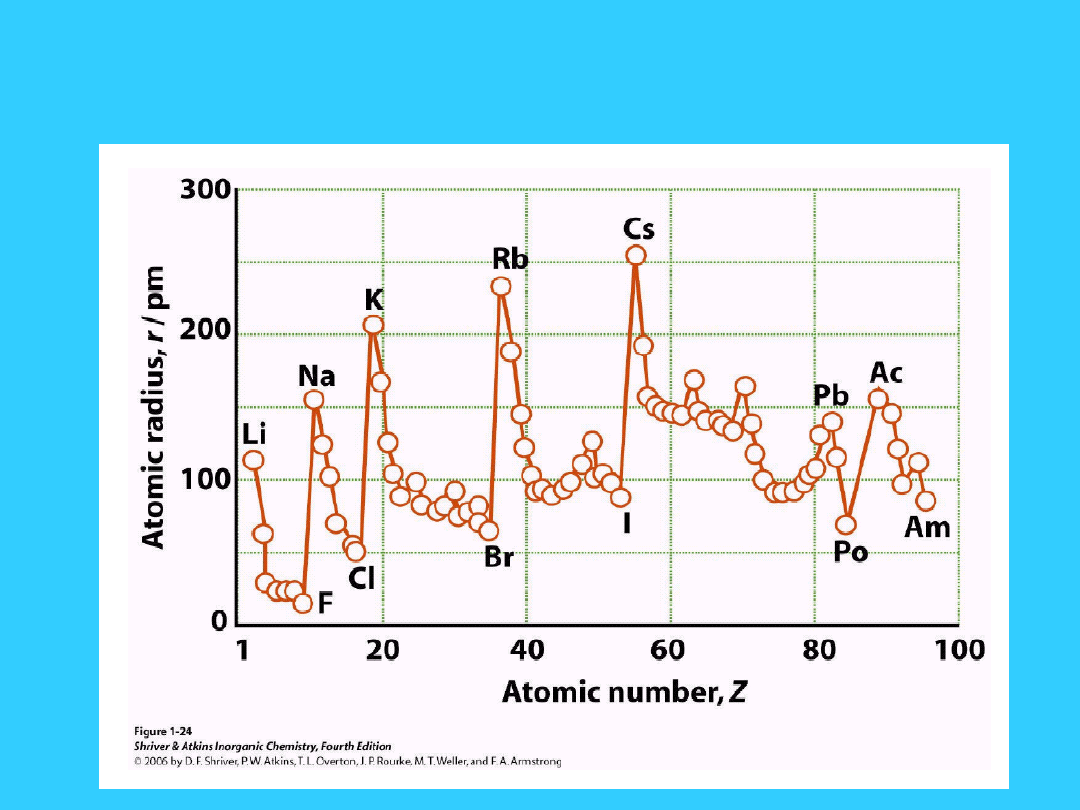
Promień atomowy
W okresie przesuwając się z lewa na prawo
1. n pozostaje stałe.
2. Z wzrasta (o jeden)
3. Z* wzrasta (o 0.65 )
Elektrony są przyciągane silniej z powodu
wzrastającego Z*
Promień atomowy maleje ze
wzrostem liczby atomowej
W grupie (przesuwając się ku dołowi)
1. n wzrasta
2. Z wzrasta
3. Brak wyraźnej zmiany Z* - praktycznie
pozostaje stała
Promień atomowy wyraźnie wzrasta
przy przesuwaniu się w dół grupy
W okresie przesuwając się z lewa na prawo
1. n pozostaje stałe.
2. Z wzrasta (o jeden)
3. Z* wzrasta (o 0.65 )
Elektrony są przyciągane silniej z powodu
wzrastającego Z*
Promień atomowy maleje ze
wzrostem liczby atomowej
W grupie (przesuwając się ku dołowi)
1. n wzrasta
2. Z wzrasta
3. Brak wyraźnej zmiany Z* - praktycznie
pozostaje stała
Promień atomowy wyraźnie wzrasta
przy przesuwaniu się w dół grupy
22
22
Promień atomowy
23
23
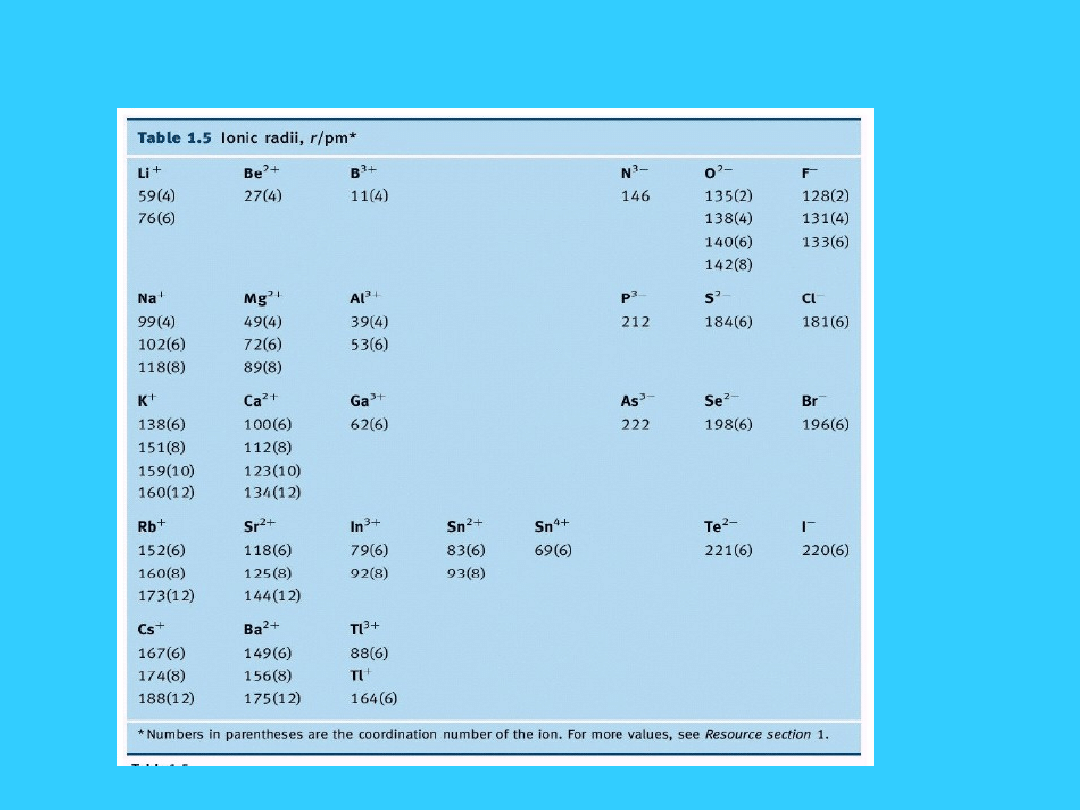
Rozmiary jonów
okresowym zmianom ulegają również jony
pierwiastków: objętość jonów ujemnych jest
większa od objętości atomów, dodatnich zaś
znacznie mniejsza
24
24
Promienie jonowe

25
25
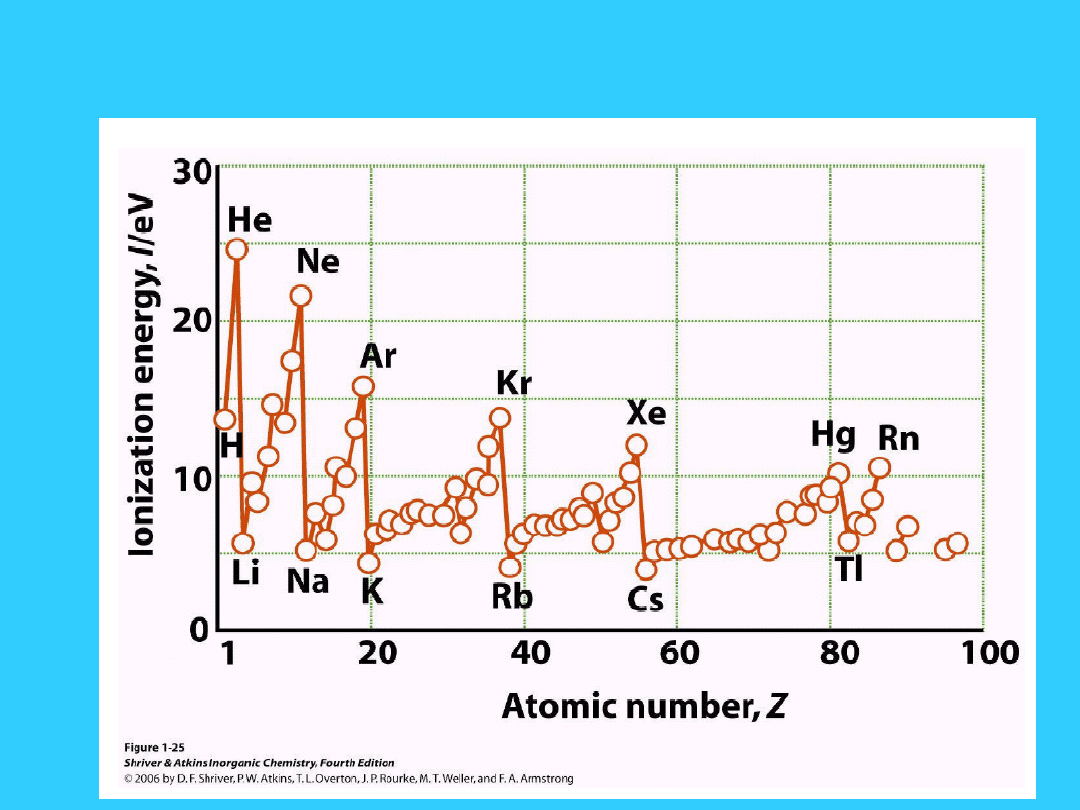
Energia jonizacji (EI)
minimalna energia potrzebna do usunięcia
elektronu z atomu w fazie gazowej
• Z
ależy od:
• (a) rozmiaru atomu -
EI maleje ze wzrostem promienia
atomowego
• (b) ładunku jądra -
EI wzrasta ze wzrostem ładunku jądra
• (c) rodzaju elektronu - efekt ekranowania
• I pot. Jonizacyjny -
H 1312 KJ mol
-1
, Li 520 KJ mol
-1
• Przyczyny
• 1. Srednia odległość elektronów 2s od jądra jest większa
niż elektronów 1s
• 2. Efekt ekranowania przez elektromy 1s

26
26
Energia jonizacji (EI)
• Przesuwając się w dół grupy
• 1. ładunek jądra wzrasta
• 2. Z* pozostaje praktycznie stałe (efekt
ekranowania)
• 3. Liczba powłok elektronowych wzrasta,
wzrasta promień atomowy.
• 4. Wzrasta ilość elektronów na wewnętrznych
powłokach, ekranujących elektrony walencyjne
• EI maleje w dół grup
• Przesuwając się od lewa do prawa w okresie
• 1. Promień atomowy maleje
• 2. Ładunek jądra i efektywny ładunek jądra
wzrastają
• EI wzrasta od lewej do prawej strony okresu
27
27
Energia jonizacji (EI)
28
28
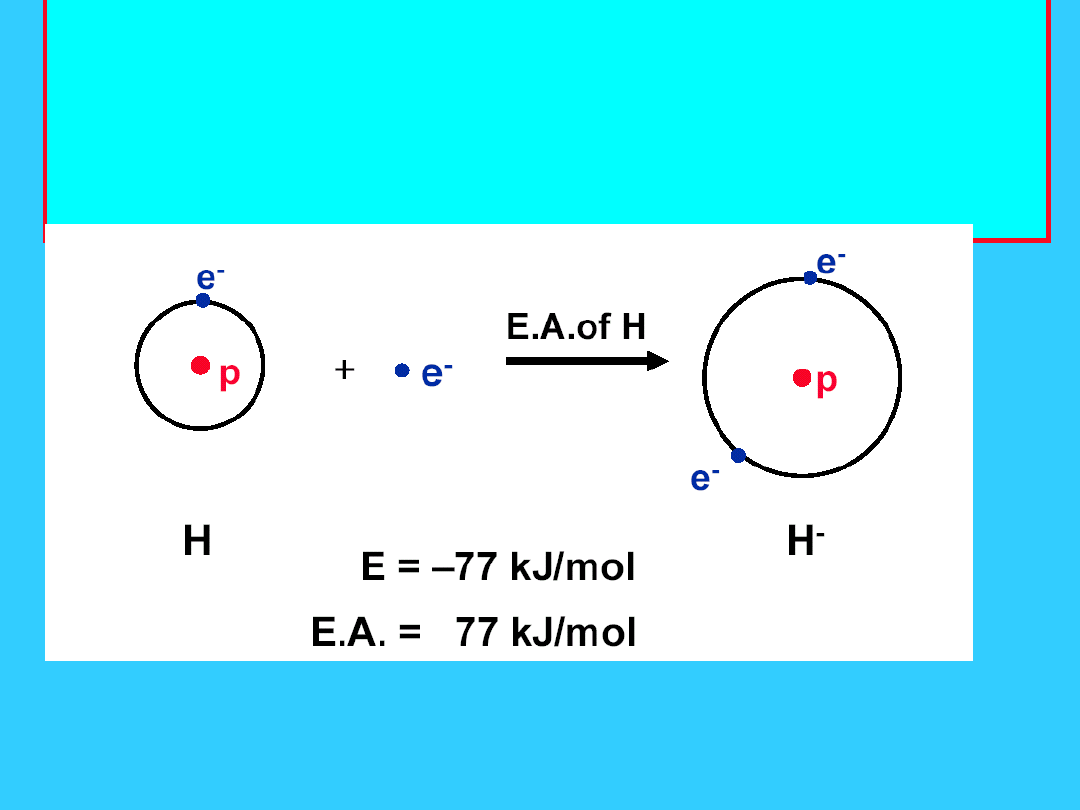
Powinowactwo elektronowe E
p
Energia wydzielona podczas przyłączenia
elektronu do atomu
Z definicji, E
p (
E.A) jest dodatnie gdy energia jest
wydzielana (Odwrotnie do definicji termodynamicznej)
Z definicji, E
p (
E.A) jest dodatnie gdy energia jest
wydzielana (Odwrotnie do definicji termodynamicznej)

29
29
Powinowactwo
elektronowe
Powinowactwo
elektronowe pierwiastka X
= Energii jonizacji anionu X
-
• Z lewa na prawo w okresie,
• promień atomowy maleje, więc siła przyciągania
elektronów przez jądro wzrasta. W konsekwencji atom
wykazuje większą tendencję do przyciągania
dodatkowego elektronu, czyli ma większe
powinowactwo elektronowe.
• wartości Ep metali są małe, niemetali duże.
• Fluorowce posiadają duże powinowactwo elektronowe.
Wynika to z ich tendencji do uzyskania konfiguracji
ns2np6.
• Przesuwając się w dół grupy,
• promień atomowy wzrasta i siła przyciągania elektronu maleje.
Powinowactwo elektronowe maleje.
30
30
największe
wartości
powinowactw
a
elektronowego
posiadają
pierwiastki
prawej górnej
części układu
okresowego
(chlorowce F,
Cl
)

31
31
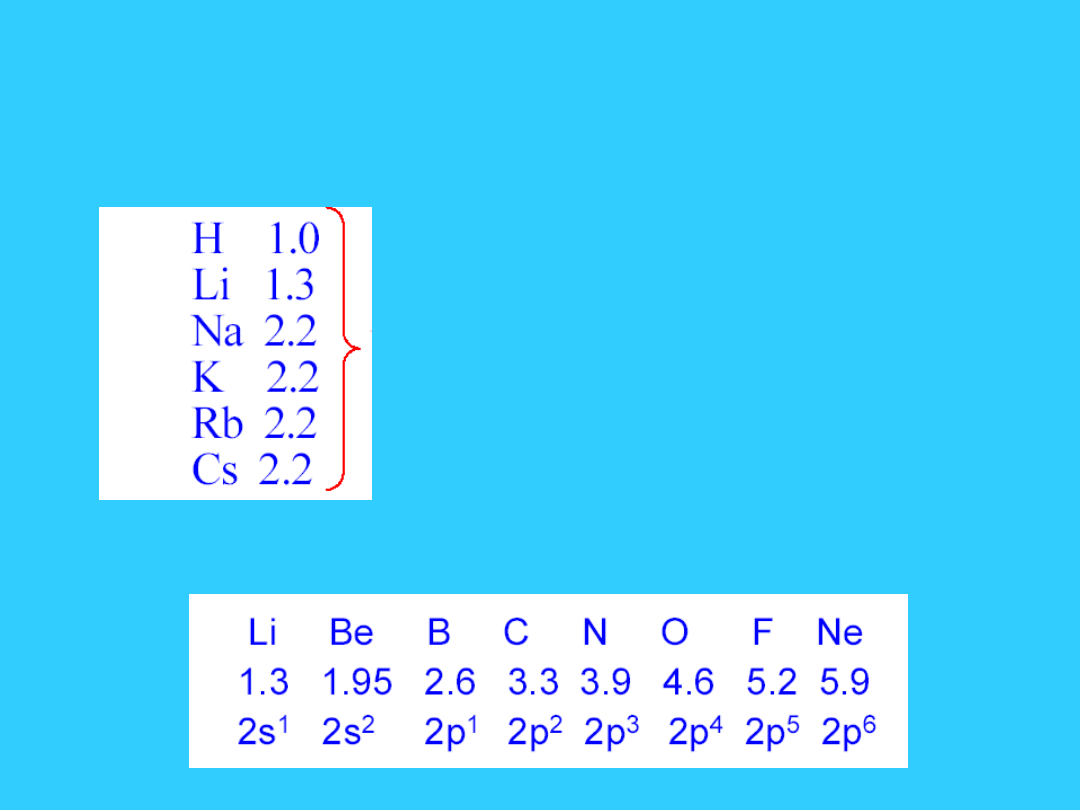
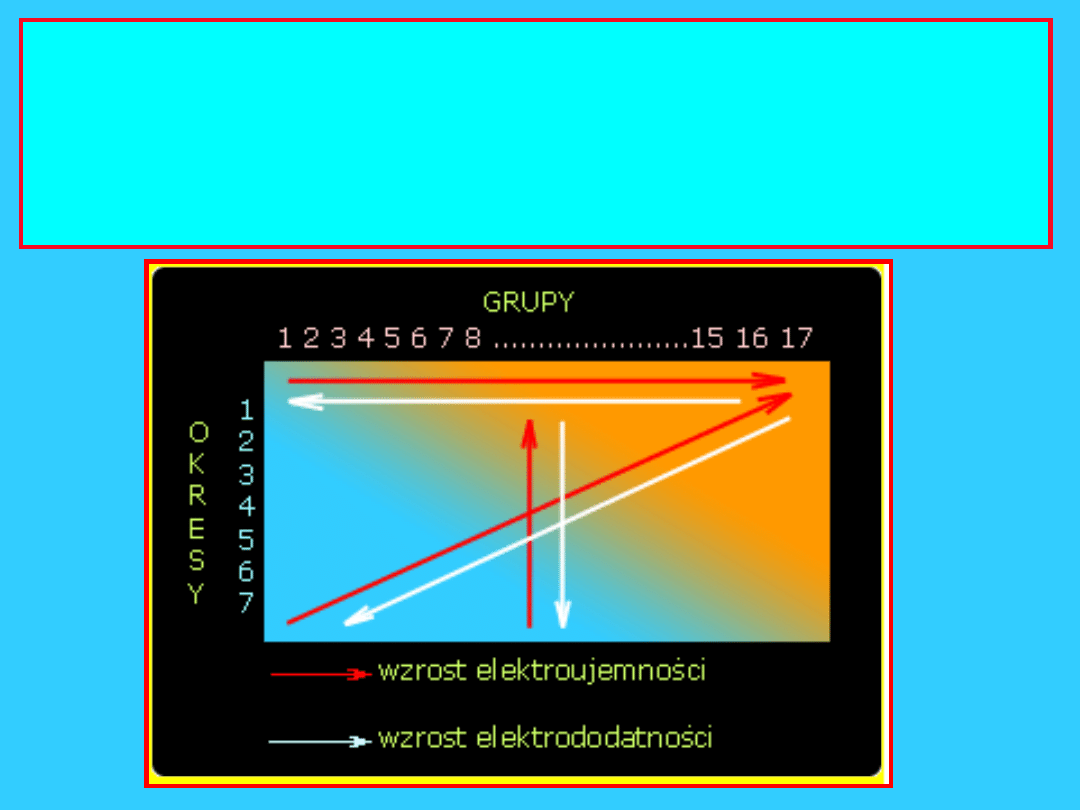
Elektroujemność
Miara tendencji pierwiastka do przyciągania elektronów
Przesuwając się w dół grupy
,
-
Z rośnie, ale Z* pozostaje praktycznie stałe
- liczba powłok elektronowych(n) wzrasta
- promień atomowy wzrasta
- siła przyciągania pomiędzy dodatkowym elektronem i
jądrem maleje
Elektroujemność maleje
Przesuwając się z lewa na prawo w okresie
-
Z i Z* rośnie
- liczba powłok elektronowych pozostaje stała
- promień atomowy maleje
- siła przyciągania dodatkowego elektronu przez jądro
wzrasta
Elektroujemność wzrasta

32
32
Elektroujemność
pierwiastki, których atomy w reakcjach
chemicznych
przyłączają elektrony
, przyjmując
w związkach
ujemne stopnie utlenienia
lub
tworzą jony ujemne nazywamy
elektroujemnymi
pierwiastki, których atomy w reakcjach
chemicznych
"tracą" elektrony
lub tworzą jony
dodatnie nazywamy
elektrododatnimi
33
33
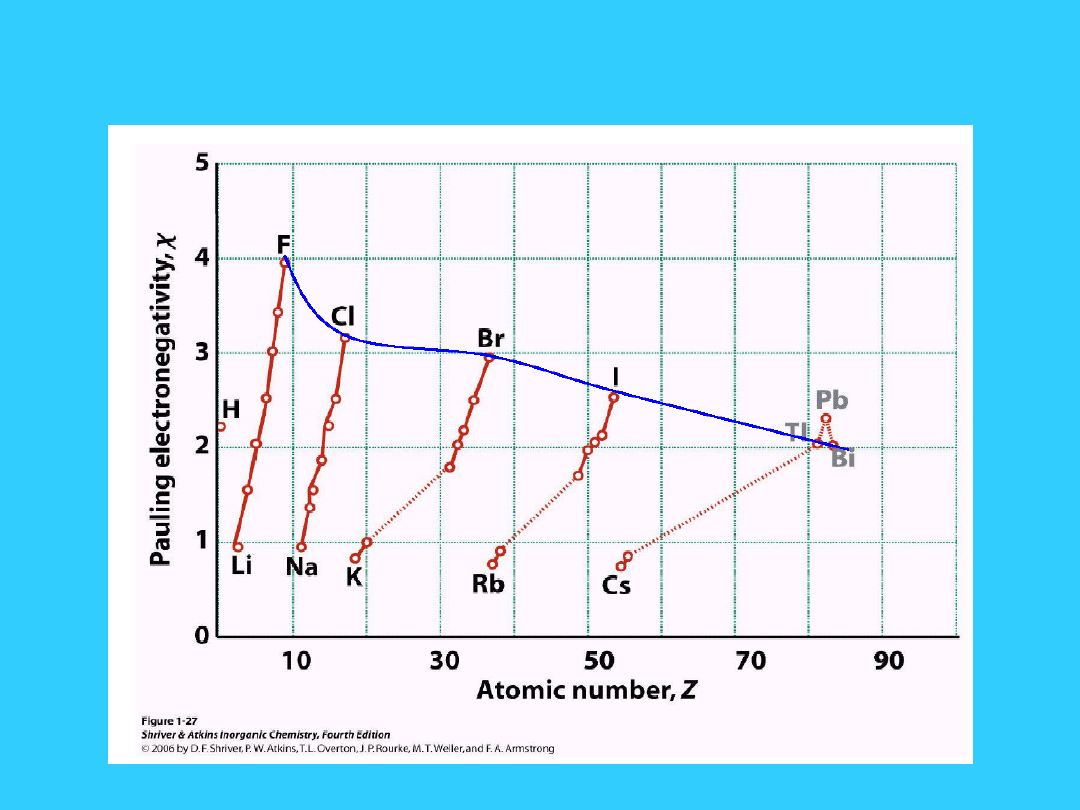
w kolejnych
pierwiastkach
grupy charakter
elektroujemny pierwiastków maleje
w miarę wzrostu liczb atomowych wzrasta
charakter elektroujemny pierwiastków
34
34
Elektroujemność

35
35
znane są trzy
skale
elektroujemności: Mullikena,
Paulinga, Allreda i Rochowa
(w zależności od sposobu
wyznaczania)
Pauling ułożył skalę
elektroujemności
pierwiastków
zawierającą się w
granicach
od 0,7 (cez)
do 4,0 (fluor)
skala
elektroujemności
pozwala na
przybliżone
szacowanie
trwałości
i mocy wiązania

36
36
Skala elektroujemności
Paulinga
Skala elektroujemności
Paulinga

37
37
Elektroujemność
• Pierwiastki różniące się znacznie elektroujemnością
wytwarzają pomiędzy sobą wiązania o dominującym
charakterze jonowym. Charakter ten najbardziej
zaznacza się w połączeniach fluoru, chloru i tlenu z
fransem, cezem, rubidem, radem i barem
• Wg Paulinga jednakowy udział wiązania jonowego i
kowalencyjnego pojawia się przy różnicy
elektroujemności ok. 1.7
• W miarę jak różnica elektroujemności maleje,
wzrasta tendencja do tworzenia się wiązań
kowalencyjnych lub wiązań metalicznych
• Wiązania kowalencyjne powstają gdy
elektroujemności pierwiastków przekraczają wartość
1.8-1.9. Poniżej tej wartości powstają wiązania
metaliczne.

38
38
Okresowość własności
chemicznych
• Okresowość własności pierwiastków
znajduje swoje odbicie we własnościach
związków chemicznych
Wiązanie jonowe
Na• + Cl• = [Na]
Na• + Cl• = [Na]
+
+
[ Cl]
[ Cl]
-
-
Na posiada małą EI., niskie Ep, niższą
Na posiada małą EI., niskie Ep, niższą
elektroujemność; oddaje elektrony
elektroujemność; oddaje elektrony
Cl - wysoka EI, wyższa elektroujemność;
Cl - wysoka EI, wyższa elektroujemność;
przyjmuje elektrony
przyjmuje elektrony
Li• + H• = [Li]
Li• + H• = [Li]
+
+
[ H]
[ H]
-
-
Li niska EI, niskie Ep, niższa
Li niska EI, niskie Ep, niższa
elektroujemność; oddaje elektrony
elektroujemność; oddaje elektrony
H wysoka EI, wysokie Ep, wyższa
H wysoka EI, wysokie Ep, wyższa
elektroujemność; przyjmuje elektrony
elektroujemność; przyjmuje elektrony
Wiązanie jonowe
Na• + Cl• = [Na]
Na• + Cl• = [Na]
+
+
[ Cl]
[ Cl]
-
-
Na posiada małą EI., niskie Ep, niższą
Na posiada małą EI., niskie Ep, niższą
elektroujemność; oddaje elektrony
elektroujemność; oddaje elektrony
Cl - wysoka EI, wyższa elektroujemność;
Cl - wysoka EI, wyższa elektroujemność;
przyjmuje elektrony
przyjmuje elektrony
Li• + H• = [Li]
Li• + H• = [Li]
+
+
[ H]
[ H]
-
-
Li niska EI, niskie Ep, niższa
Li niska EI, niskie Ep, niższa
elektroujemność; oddaje elektrony
elektroujemność; oddaje elektrony
H wysoka EI, wysokie Ep, wyższa
H wysoka EI, wysokie Ep, wyższa
elektroujemność; przyjmuje elektrony
elektroujemność; przyjmuje elektrony

39
39
Wodorki - X
m
H
n
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się
wiązań
kowalencyjnych lub
wiązań
metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają
wartość 1.8-1.9.
Poniżej tej wartości
powstają wiązania
metaliczne
.
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się
wiązań
kowalencyjnych lub
wiązań
metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają
wartość 1.8-1.9.
Poniżej tej wartości
powstają wiązania
metaliczne
.

40
40
Wodorki
W wodorkach stopień utlenienia wodoru
wynosi +1 lub -1. Stopień utlenienia w
niektórych wodorkach metali przejściowych nie
jest dobrze zdefiniowany.
Trzy typy wodorków:
- wodorki jonowe (typu soli) - związki wodoru z
pierwiastkami elektrododatnimi (st. utlenienia
wodoru
-1)
-wodorki kowalencyjne (związki wodoru z
niemetalami)
- wodorki metaliczne (związki wodoru z
metalami przejściowymi)
W wodorkach stopień utlenienia wodoru
wynosi +1 lub -1. Stopień utlenienia w
niektórych wodorkach metali przejściowych nie
jest dobrze zdefiniowany.
Trzy typy wodorków:
- wodorki jonowe (typu soli) - związki wodoru z
pierwiastkami elektrododatnimi (st. utlenienia
wodoru
-1)
-wodorki kowalencyjne (związki wodoru z
niemetalami)
- wodorki metaliczne (związki wodoru z
metalami przejściowymi)

41
41
Wodorki jonowe
Wodorki grupy 1A i 2A.
-stopione przewodzą prąd elektryczny
- w czasie elektrolizy litowiec (berylowiec)
wydziela się na katodzie a wodór na anodzie
- jon wodorowy H
-
ma własności zasadowe
(H
-
+ H
2
O = H
2
+ OH
-
wodorki sodu, litu, wapnia są silnymi
zasadami. LiH i CaH
2
są przenośnymi
źródłami wodoru. LiH reaguje z AlCl
3
dając
LiAlCl
4
będący użytecznym reduktorem w
chemii organicznej.
Wodorki grupy 1A i 2A.
-stopione przewodzą prąd elektryczny
- w czasie elektrolizy litowiec (berylowiec)
wydziela się na katodzie a wodór na anodzie
- jon wodorowy H
-
ma własności zasadowe
(H
-
+ H
2
O = H
2
+ OH
-
wodorki sodu, litu, wapnia są silnymi
zasadami. LiH i CaH
2
są przenośnymi
źródłami wodoru. LiH reaguje z AlCl
3
dając
LiAlCl
4
będący użytecznym reduktorem w
chemii organicznej.

42
42
Wodorki metaliczne
Wodorki metaliczne długo uważano za związki o
strukturze regularnej z atomami wodoru zajmującymi
pozycje międzywęzłowe.
Otrzymuje się je w reakcji pomiędzy metalami
przejściowymi, lantanowcami i aktynowcami i
gazowym wodorem. W podwyższonej temperaturze
reakcja jest odwracalna - prowadzi do otrzymania
gazowego wodoru i sproszkowanego metalu.
Wygląd metaliczny, dobre przewodnictwo elektryczne,
zmienny skład.
Często mają niestechiometryczny skład, np.: TiH
1.7
,
TiH
2
, PdH
0.65
, LaH
1.68
, UH
3
Jedno z ważniejszych zastosowań - magazynowanie
wodoru
Wodorki metaliczne długo uważano za związki o
strukturze regularnej z atomami wodoru zajmującymi
pozycje międzywęzłowe.
Otrzymuje się je w reakcji pomiędzy metalami
przejściowymi, lantanowcami i aktynowcami i
gazowym wodorem. W podwyższonej temperaturze
reakcja jest odwracalna - prowadzi do otrzymania
gazowego wodoru i sproszkowanego metalu.
Wygląd metaliczny, dobre przewodnictwo elektryczne,
zmienny skład.
Często mają niestechiometryczny skład, np.: TiH
1.7
,
TiH
2
, PdH
0.65
, LaH
1.68
, UH
3
Jedno z ważniejszych zastosowań - magazynowanie
wodoru

43
43
Wodorki kowalencyjne
Węgiel jest pierwszym pierwiastkiem w okresie 3
wykazującym elektroujemność większa od
wodoru. Różnica elektroujemności jest mała i
wiązanie ma charakter kowalencyjny. Przesuwając
się w prawo w okresie następuje wzrost
właściwości kwasowych wodorków
kowalencyjnych
Węgiel jest pierwszym pierwiastkiem w okresie 3
wykazującym elektroujemność większa od
wodoru. Różnica elektroujemności jest mała i
wiązanie ma charakter kowalencyjny. Przesuwając
się w prawo w okresie następuje wzrost
właściwości kwasowych wodorków
kowalencyjnych
44
44
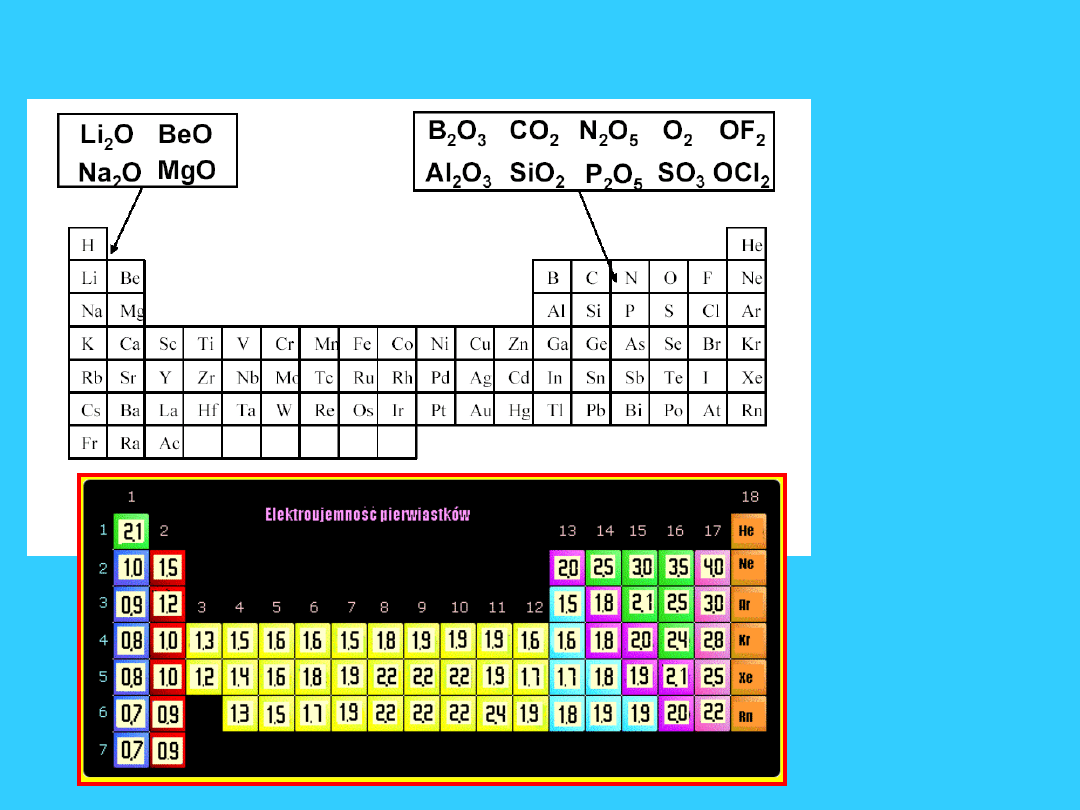
Tlenki - X
m
O
n
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się
wiązań
kowalencyjnych lub
wiązań
metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają
wartość 1.8-1.9.
Poniżej tej wartości
powstają wiązania
metaliczne
.
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się
wiązań
kowalencyjnych lub
wiązań
metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają
wartość 1.8-1.9.
Poniżej tej wartości
powstają wiązania
metaliczne
.

45
45
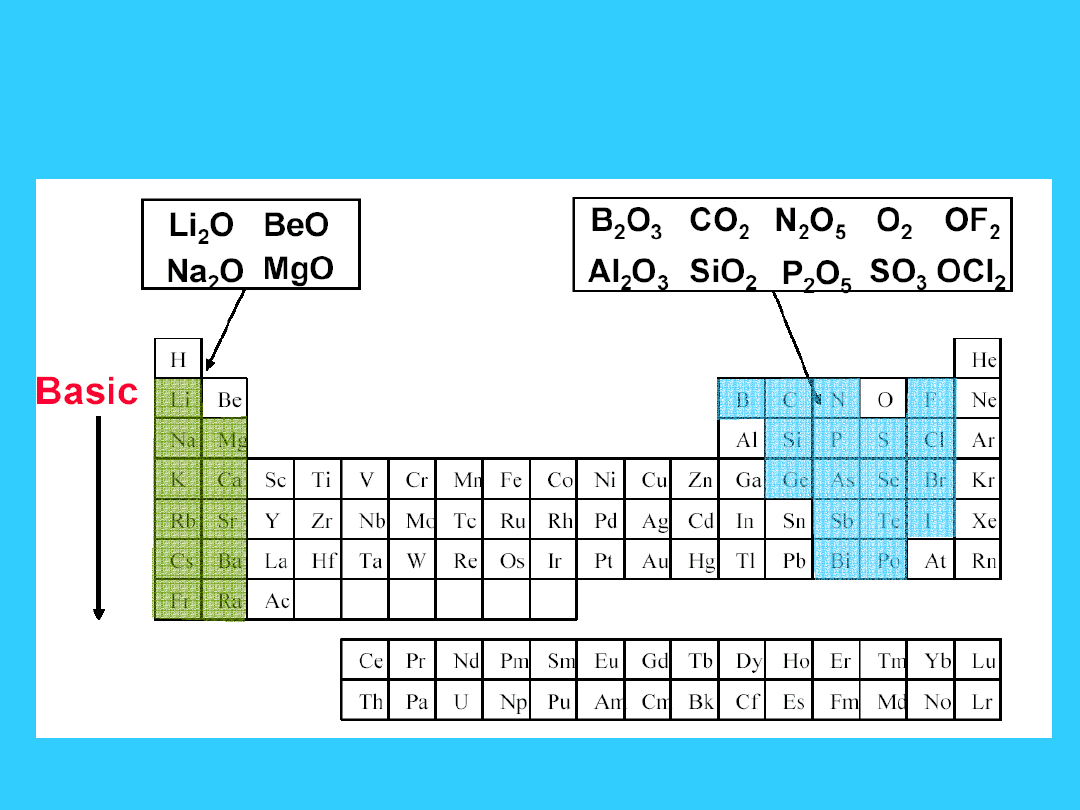
Tlenki - przykłady i nazwy

46
46
Tlenki
47
47
Kwasowo-zasadowe
własności tlenków
Kwasowość wzrasta w górę grupy i z lewa na prawo w okresie
Kwasowość wzrasta w górę grupy i z lewa na prawo w okresie
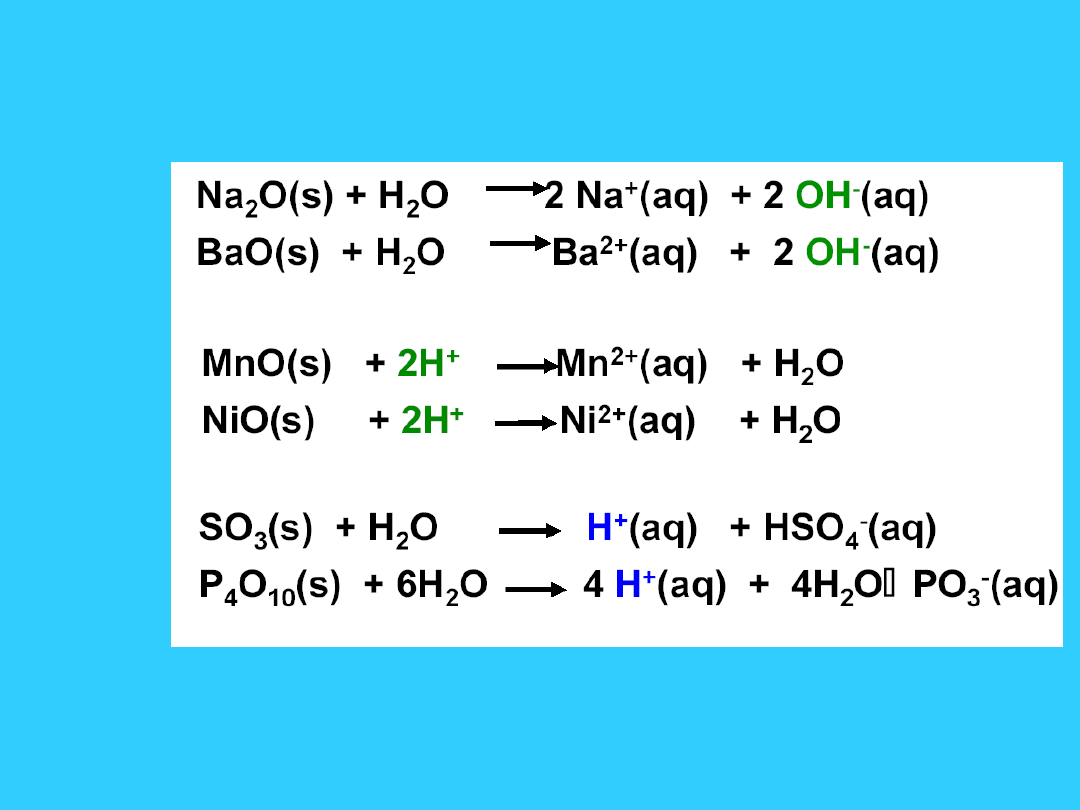
48
48
Kwasowo-zasadowe własności
tlenków
zasadowe
zasadowe
zasadowe
zasadowe
kwasowe
kwasowe
•
w tlenkach zasadowych gęstość elektronowa
przesunięta na O, który jest odszczepiany w reakcji z wodą
(uwalnianie OH
-
)
• tlenki kwasowe mają mniejszą gęstość elektronową i
przyłączają dodatkowy O z H
2
O (uwalniając H
+
)
•
w tlenkach zasadowych gęstość elektronowa
przesunięta na O, który jest odszczepiany w reakcji z wodą
(uwalnianie OH
-
)
• tlenki kwasowe mają mniejszą gęstość elektronową i
przyłączają dodatkowy O z H
2
O (uwalniając H
+
)

49
49
Tlenki

50
50
Kwasy
• Najprostsza definicja kwasu, wg teorii Arheniusa:
• - kwasem jest związek chemiczny, który w wyniku dysocjacji
elektrolitycznej odczepia kation wodorowy (H
+
).
• Wyróżniamy:
• kwasy beztlenowe
:
• kwas solny HCl
• kwas bromowodorowy HBr
• kwas siarkowodorowy H
2
S
• Kwasy tlenowe (oksokwasy):
• kwas azotowy HNO
3
• kwas siarkowy(VI) H
2
SO
4
• kwas siarkowy(IV) H
2
SO
3
• kwas węglowy H
2
CO
3
• kwas nadchlorowy HClO
4
• kwas chlorowy HClO
3
• kwas fosforowy(V) H
3
PO
4

51
51
Kwasy organiczne
• kwas mrówkowy HCOOH
• kwas octowy CH
3
COOH
• Ogólnie:
• C
n
H
2n+1
COOH
• gdzie: – C
n
H
2n+1
rodnik węglowodorowy
• Każdy kwas rozpuszczony w wodzie ma
swoją moc, której miarą jest stała
dysocjacji tego kwasu.
• Im kwas mocniejszy tym większa
wartość stałej dysocjacji (Ka), czyli
mniejsza wartość pKa
• pKa = - logKa (a = acid = kwas)

52
52
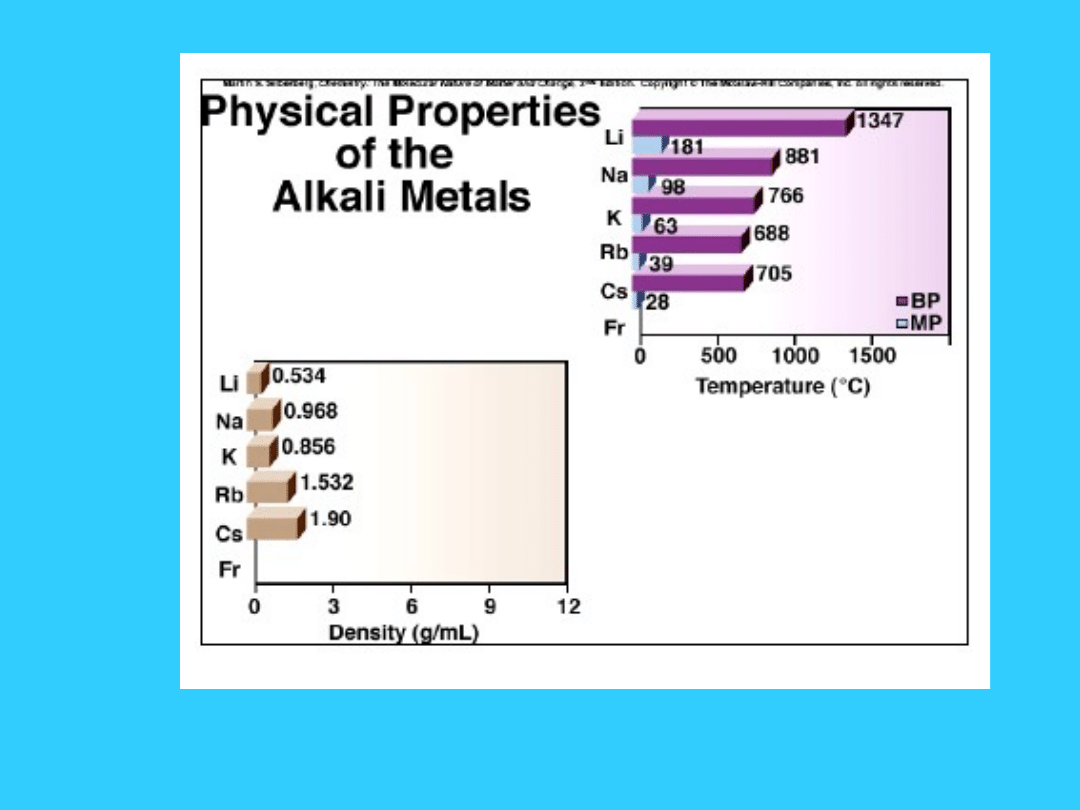
53
53

54
54

55
55

56
56

57
57

58
58

59
59

60
60

61
61

62
62

63
63

64
64

65
65
IUPAC Nomenclature of
elements with atomic number
above 100
• Digit Name
Abbreviation
• 0 nil n
• 1 un u
• 2 bi b
• 3 tri t
• 4 quad q
• 5 pent p
• 6 hex h
• 7 sept s
• 8 oct o
• 9 enn e
• E. g.,
• 114 Un-un-quad-ium
Uuq
• 118 Un-un-oct-ium
Uuo
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
Wyszukiwarka
Podobne podstrony:
Leszek wyklad11 metale
socjologia, WYKLAD 2 grupy spoleczne i procesy grupowe
Leszek wyklad4 elektrochemia
Leszek wyklad9 teoria pasmowa ciala stalego
Leszek wyklad8a chlorowce
Leszek wyklad2
higiena wykłady, grupy czynniów rakotwórczych
Leszek wyklad7
Leszek wyklad3
Leszek wyklad4
Leszek wyklad3
Leszek wyklad2
Leszek wyklad5
Leszek wyklad1
Leszek wyklad8
Leszek wyklad10 zwiazki kompleksowe
Leszek wyklad6
WYKŁAD X komunikacja, WYKŁAD X: GRUPY I KOMUNIKOWANIE SIĘ W ORGANIZACJI
więcej podobnych podstron